Resumo
Fundamento
O ácido úrico (AU), produto final do metabolismo dos nucleotídeos das purinas, participa dos processos de doenças metabólicas e cardiovasculares. Evidências experimentais sugerem que o ácido úrico é um mediador importante na resposta fisiológica ao aumento da pressão arterial.
Objetivo
Avaliar a associação entre os níveis séricos de AU e pré-hipertensão e hipertensão em uma população chinesa.
Métodos
Conduziu-se um estudo transversal entre março e setembro de 2017, e 1.138 participantes com idades entre 35 e 75 anos foram incluídos neste estudo, onde 223 normotensos, 316 pré-hipertensos e 599 hipertensos foram selecionados para avaliar a associação entre níveis séricos de AU e hipertensão. Considerou-se um valor de p<0,05 estatisticamente significativo.
Resultados
Os níveis séricos de AU foram significativamente maiores no grupo pré-hipertensão e hipertensão em comparação com o grupo controle em toda a população (p<0,05 para todos). A análise quantitativa das características indicou níveis séricos de AU (2,92±0,81, 3,06±0,85, 3,22±0,98 mg/d) linearmente aumentados em mulheres normotensas, pré-hipertensas e hipertensas, com um valor de p de 0,008. Os níveis séricos de AU nos quartis correlacionaram-se positivamente com a PAD (p<0,05), principalmente em mulheres. Após o ajuste para idade, sexo, índice de massa corporal (IMC), glicose (GLI), colesterol total (CT), triglicerídeos (TG), colesterol HDL (lipoproteína de alta densidade), as razões de chances ( odds ratios — ORs) e intervalos de confiança (IC) de 95% da pré-hipertensão, dos níveis séricos de AU mais baixos (referentes) aos mais altos foram 1,718 (1,028–2,872), 1,018 (0,627–1,654) e 1,738 (1,003–3,010). Além disso, o segundo quartil dos níveis séricos de AU esteve significativamente associado à hipertensão, com uma OR (IC 95%) de 2,036 (1,256–3,298).
Conclusões
O presente estudo sugere que níveis séricos mais elevados de AU estão positivamente associados à pré-hipertensão e hipertensão entre adultos chineses.
Keywords: Doenças Cardiovasculares/epidemiologia, Pressão Arterial, Hipertensão, Fatores de Risco, Ácido Úrico, Hiperuricemia
Introdução
A prevalência de doenças cardiovasculares (DCV) vem aumentando rapidamente nas comunidades mundiais. A taxa geral de prevalência padronizada por idade de doenças cardiovasculares aumentou significativamente de 1990 a 2016 — 14,7% — e o número anual de óbitos por DCV aumentou de 2,51 milhões para 3,97 milhões na China. 1 A hipertensão arterial representa uma grande carga para a saúde pública mundial devido à sua alta prevalência, sendo um importante fator de risco para uma série de DCVs, incluindo acidente vascular cerebral, infarto do miocárdio, insuficiência cardíaca e insuficiência renal. 2 De acordo com o documento “Summary of report on cardiovascular diseases in China (2018)”, o número de pacientes hipertensos na China é de cerca de 245 milhões, e a taxa de prevalência de homens é maior do que de mulheres. 3 A hipertensão, um distúrbio altamente heterogêneo, é influenciada pela interação entre diversos fatores, como ingestão de sódio, álcool, tabagismo, excesso de peso e fatores genéticos. 4 Nos últimos anos, muitos estudos mostraram que níveis elevados de ácido úrico (AU) sérico estão associados ao aumento da incidência de hipertensão. 5 , 6
O AU é o produto final do metabolismo do nucleotídeo da purina, e o distúrbio do metabolismo da purina ou a excreção anormal do AU pode levar ao aumento dos níveis séricos de AU. Além disso, o aumento da concentração sérica de AU no corpo resulta em hiperuricemia, levando à ocorrência de gota. 7 Um estudo de coorte mostrou que a hiperuricemia é preditor de hipertensão em homens e mulheres. 8 Pesquisas com animais revelaram que a hiperuricemia leve causa hipertensão e lesão renal em ratos por meio da estimulação do sistema renina-angiotensina e inibição da óxido nítrico-sintase neuronal (nNOS). 9 Como fator de relaxamento derivado do endotélio, o óxido nítrico é crucial para a manutenção da pressão arterial (PA). 10 Uma revisão sistemática e uma meta-análise verificaram que para um aumento de 60 umol/L nos níveis séricos de AU, o risco relativo de hipertensão aumentou em 13%, e esse risco parece mais pronunciado em indivíduos mais jovens e em mulheres. 11
A hiperuricemia está comumente associada à pré-hipertensão em adultos. 12 O AU sérico também se mostrou um fator de risco independente para um padrão circadiano de hipertensão non-dipper. 13 Quanto mais alto o nível de AU sérico, mais difícil é controlar a pressão arterial ambulatorial noturna, a pressão arterial diastólica noturna e o pico de pressão arterial matinal. 14 Em um estudo inicial, não se observou hiperuricemia em 25–40% dos hipertensos não tratados e 75% dos indivíduos com hipertensão maligna. 15 No entanto, não se encontrou nenhuma associação independente entre os níveis séricos de AU ou risco de hipertensão incidente entre homens mais velhos. 16
Quando a hipertensão se complica com hiperuricemia, ambas causam e afetam uma à outra, o que agrava o desenvolvimento da doença. Portanto, apesar da associação entre AU sérico e hipertensão, seu mecanismo permanece obscuro. Assim, em nosso estudo, exploramos a associação entre altos níveis séricos de AU e hipertensão entre adultos chineses na província de Anhui, no norte da China.
Métodos
Desenho do estudo
Este estudo foi realizado de março a setembro de 2017 no Centro de Exame Físico de um Hospital Popular na Província de Anhui, no norte da China. Um total de 1.191 participantes com idades entre 35 e 75 foram incluídos neste estudo, incluindo 643 casos de hipertensão e 548 indivíduos normotensos. Indivíduos sem valor sérico de AU (n=53) foram excluídos. Por fim, 1.138 adultos, incluindo 223 normotensos, 316 pré-hipertensos e 599 hipertensos, foram selecionados para avaliar a associação entre os níveis séricos de AU e hipertensão. O protocolo de estudo foi aprovado pelo Comitê de Ética da Wannan Medical College.
Coleta dos dados e medições
Cada participante passou por entrevista presencial e preencheu um questionário padrão incluindo características demográficas, histórico clínico e características de estilo de vida. Todas as informações foram coletadas por uma equipe de pesquisa treinada. No exame físico, todos os indivíduos tiveram sua altura, peso e pressão arterial (PA) medidos. O índice de massa corporal (IMC) foi calculado como o peso corporal (kg) dividido pela altura ao quadrado (m 2 ). Uma equipe de pesquisa bem treinada mediu a PA uma vez usando esfigmomanômetro eletrônico com o participante na posição sentada após pelo menos 5 minutos de repouso. Todos os indivíduos jejuaram durante a noite por pelo menos 10 horas antes da coleta de sangue. Amostras de sangue venoso de 5 ml foram coletadas para medir os níveis de colesterol total (CT), triglicerídeos (TG), colesterol HDL, colesterol LDL, glicose (GLI) e níveis séricos de AU. Os fumantes foram definidos como consumidores de cigarros que fumavam ao menos 20 cigarros por semana ou ao menos 3 meses por ano. Beber álcool no mínimo 2 vezes por semana ou no mínimo 6 meses por ano foi considerado consumo de álcool.
Definição
A hipertensão foi definida como PAS≥140 mmHg e/ou PAD≥90 mmHg, ou uso de anti-hipertensivos, e a pré-hipertensão foi considerada PAS de 120–139 mmHg e/ou PAD 80–89 mmHg. 17 A hiperuricemia foi definida como níveis séricos de AU >4,75 mg/dL em homens e >4,04 mg/dL em mulheres. 18 Os níveis séricos de AU foram categorizados por quartis como ≤2,65, 2,66–3,24, 3,25–3,98 e ≥3,99 mg/dL.
Análise de dados
A normalidade dos dados foi determinada pelo teste de Kolmogorov-Smirnov. Os dados quantitativos são resumidos como média e desvio padrão (média±DP) com distribuição normal; os dados qualitativos, como proporções. As diferenças de sexo nas características gerais foram analisadas usando o teste t pareado de Student para variáveis contínuas e o teste qui-quadrado (χ2) para variáveis categóricas. As diferenças para as variáveis entre os grupos foram determinadas por análise de variância (ANOVA) de um fator ou teste χ2, e as correções de Bonferroni foram usadas para comparações múltiplas. Além disso, aplicou-se a análise de regressão logística múltipla não condicional para estimar a relação entre AU e hipertensão. Realizou-se o teste do coeficiente de correlação de Pearson para avaliar as inter-relações entre as variáveis basais e os níveis séricos de AU. Utilizou-se o equipamento Epidata 3.1 (The Epidata Association, Odense, Dinamarca) para estabelecer bases de dados. Todas as análises estatísticas foram realizadas com o software SPSS 18.0 (SPSS Inc., Chicago, IL). Um p<0,05 bicaudal foi definido como estatisticamente significativo.
Resultados
Características dos participantes
Este estudo incluiu 1.138 indivíduos (223 controles, 316 pré-hipertensos e 599 hipertensos) com idades entre 35 e 75 anos. A Tabela 1 apresenta os dados demográficos e as características clínicas dos participantes. As características de colesterol LDL, creatinina, tabagismo e consumo de álcool não foram significativamente diferentes entre os grupos, enquanto idade, índice de massa corporal (IMC), glicose (GLI), colesterol total (CT), triglicerídeos (TG), colesterol HDL e AU apresentaram diferenças significativas. Os níveis séricos de AU (mg/dL) foram significativamente maiores no grupo pré-hipertensão (3,5±1,1) e hipertensão (3,4±1,1) em comparação com o grupo controle (3,2±1,0) em toda a população (p<0,05 para todos). Além disso, a prevalência de hiperuricemia foi de 10,3%, 17,1% e 17,0% em normotensos, pré-hipertensos e hipertensos, respectivamente.
Tabela 1. – Características demográficas de normotensão, pré-hipertensão e hipertensão.
| Característica | Normotensão (n=223) | Pré-hipertensão (n=316) | Hipertensão (n=599) | p |
|---|---|---|---|---|
| Idade (anos) | 56,1±11,3 | 58,2±11,2 | 61,2±9,8 #* | 0,000 |
| IMC (kg/m 2 ) | 22,3±2,8 | 23,3±2,9 # | 24,1±2,9 #* | 0,000 |
| PAS (mmHg) | 108,3±7,8 | 126,2±7,4 # | 148,2±19,2 #* | 0,000 |
| PAD (mmHg) | 69,7±5,9 | 79,5±6,5 # | 89,1±13,0 #* | 0,000 |
| GLI (mmol / L) | 5,6±1,6 | 5,6±1,6 | 6,0±2,2 #* | 0,002 |
| CT (mmol/L) | 4,4±0,9 | 4,5±0,9 | 4,7±1,1 # | 0,003 |
| TG (mmol/L) | 1,2±0,8 | 1,3±0,8 | 1,7±1,2 #* | 0,000 |
| Colesterol HDL (mmol/L) | 1,4±0,4 | 1,3±0,4 | 1,2±0,4 #* | 0,000 |
| Colesterol LDL (mmol/L) | 2,6±0,8 | 2,7±0,8 | 2,6±0,8 | 0,235 |
| Creatinina (umol/L) | 82,5±61,8 | 80,4±13,5 | 86,1±39,2 | 0,110 |
| AU (mg/dL) | 3,2±1,0 | 3,5±1,1 # | 3,4±1,1 # | 0,013 |
| Tabagismo atual (n=362) | 65 (29,1%) | 95 (30,1) | 202 (33,7%) | 0,336 |
| Etilismo atual (n=415) | 68 (30,5%) | 118 (37,3%) | 229 (38,2%) | 0,114 |
| Prevalência de hiperuricemia (n=179) | 23(10,3%) | 54(17,1%) | 102(17,0%) | 0,046 |
PAS: Pressão arterial sistólica; PAD: Pressão arterial diastólica; GLI: Glicose; CT: Colesterol total; TG: Triglicerídeos; HDL: Lipoproteína de alta densidade; LDL: Lipoproteína de baixa densidade; AU: Ácido úrico. p: Todos os participantes dos grupos de normotensão, pré-hipertensão e hipertensão tiveram as variáveis analisadas por ANOVA de um fator ou teste do qui-quadrado. #: p<0,05 vs. Normotensão. *: p<0,05 vs. Pré-hipertensão.
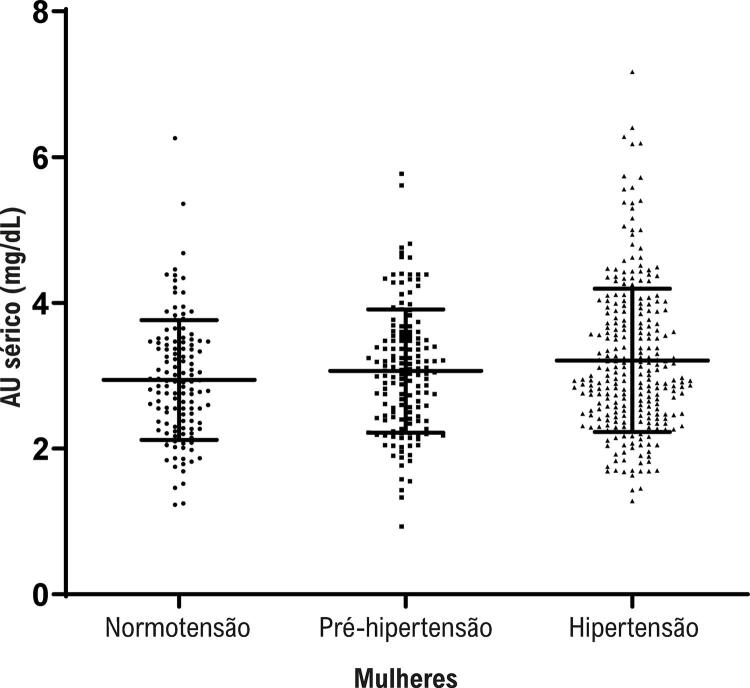
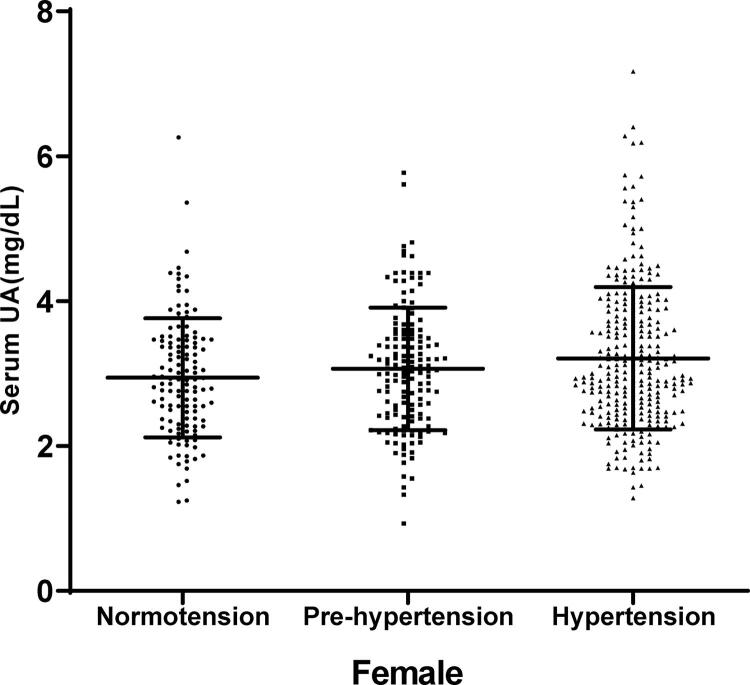
Por subgrupo dividido por sexo, dos 1,138 indivíduos, 568 eram do sexo masculino e 570 eram do sexo feminino. O nível médio de AU sérico foi de 3,67 mg/dL em homens e 3,11 mg/dL em mulheres (p<0,05). Os níveis séricos de AU não mostraram diferença entre os grupos no sexo masculino. Outras análises quantitativas de características do AU sérico (mg/dL) indicaram que os níveis séricos de AU (2,92±0,81, 3,06±0,85, 3,22±0,98) aumentaram linearmente em normotensão, pré-hipertensão e hipertensão em mulheres, com valor de p de 0,008 ( Figura 1 ).
Figura 1. – Comparação dos níveis séricos de AU em normotensão, pré-hipertensão e hipertensão no sexo feminino.
Níveis de variáveis demográficas e clínicas nos quartis de AU sérico
A Tabela 2 apresenta as informações basais dos indivíduos em cada quartil de AU sérico. Os níveis médios de IMC, PAD, TG, colesterol LDL e creatinina mostraram-se aumentados com níveis elevados de AU sérico nos quartis (p<0,01 para tendência).
Tabela 2. – Características basais dos participantes do estudo de acordo com os quartis de AU sérico.
| Característica | AU sérico (mg/dL) | valor de p para tendência | |||
|---|---|---|---|---|---|
|
| |||||
| Q1(≤ 2,65) | Q2(2.66-3.24) | Q3(3,25-3,98) | Q4(≥3,99) | ||
| Idade (anos) | 60,2±10,5 | 59,2±10,5 | 58,7±10,7 | 59,4±11,1 | 0,305 |
| IMC (kg/m 2 ) | 23,1±2,8 | 23,1±2,8 | 23,5±2,9 | 24,3±3,2 | 0,000 |
| PAS (mmHg) | 133,2±23,0 | 136,9±21,4 | 132,7±22,4 | 134,4±20,0 | 0,914 |
| PAD(mmHg) | 80,5±13,2 | 83,4±12,3 | 83,0±12,7 | 83,7±12,8 | 0,005 |
| GLI (mmol / L) | 6,0±2,4 | 5,8±2,2 | 5,6±1,5 | 5,8±1,5 | 0,120 |
| CT (mmol/L) | 4,5±1,0 | 4,5±1,0 | 4,5±0,9 | 4,7±1,00 | 0,098 |
| TG (mmol/L) | 1,2±0,7 | 1,3±0,9 | 1,5±1,1 | 1,8±1,3 | 0,000 |
| Colesterol HDL (mmol/L) | 1,3±0,4 | 1,3±0,5 | 1,2±0,4 | 1,2±0,4 | 0,266 |
| Colesterol LDL (mmol/L) | 2,5±0,8 | 2,6±0,8 | 2,7±0,9 | 2,9±0,8 | 0,000 |
| Creatinina (umol/L) | 73,7±14,3 | 81,9±53,5 | 83,1±14,1 | 96,6±54,4 | 0,000 |
PAS: Pressão arterial sistólica; PAD: Pressão arterial diastólica; GLI: Glicose; CT: Colesterol total; GT: Triglicerídeos; HDL: Lipoproteína de alta densidade; LDL: Lipoproteína de baixa densidade; AU: Ácido úrico. p: Todos os participantes dos grupos de normotensão, pré-hipertensão e hipertensão tiveram as variáveis analisadas por ANOVA de um fator para tendência linear.
Correlação dos níveis séricos de AU e características clínicas por sexo
Os níveis séricos de AU estiveram positivamente correlacionados com IMC, pressão arterial diastólica (PAD), CT, TG, colesterol LDL e creatinina em ambos os sexos. Os níveis séricos de AU estiveram negativamente correlacionados com a idade e positivamente correlacionados com IMC, CT, TG, colesterol LDL e creatinina em homens. No sexo feminino, os níveis séricos de AU estiveram positivamente associados com IMC, PAD, TG, colesterol LDL e creatinina ( Tabela 3 ).
Tabela 3. – Correlação dos níveis séricos de AU e características clínicas dos participantes do estudo por sexo.
| Características | Homens | Mulheres | Total | |||
|---|---|---|---|---|---|---|
|
| ||||||
| r | p | r | p | r | p | |
| Idade (anos) | -0,091 | 0,030 | -0,042 | 0,314 | -0,012 | 0,679 |
| IMC (kg/m 2 ) | 0,167 | <0,001 | 0,138 | 0,001 | 0,177 | <0,001 |
| PAS (mmHg) | -0,063 | 0,133 | 0.0.63 | 0,133 | 0,007 | 0,821 |
| PAD (mmHg) | 0,055 | 0,187 | 0,116 | 0,006 | 0,099 | 0,001 |
| GLI (mmol / L) | -0,069 | 0,101 | 0,022 | 0,593 | -0,017 | 0,570 |
| CT (mmol/L) | 0,152 | <0,001 | 0,065 | 0,123 | 0,080 | 0,007 |
| TG (mmol/L) | 0,230 | <0,001 | 0,205 | <0,001 | 0,22 | <0,001 |
| Colesterol HDL (mmol/L) | 0,011 | 0,786 | 0,001 | 0,998 | -0,041 | 0,163 |
| Colesterol LDL (mmol/L) | 0,250 | <0,001 | 0,148 | <0,001 | 0,187 | <0,001 |
| Creatinina | 0,143 | 0,001 | 0,443 | <0,001 | 0,230 | <0,001 |
PAS: Pressão arterial sistólica; PAD: Pressão arterial diastólica; GLI: Glicose; CT: Colesterol total; TG: Triglicerídeos; HDL: Lipoproteína de alta densidade; LDL: Lipoproteína de baixa densidade; AU: Ácido úrico.
Associação entre quartis de AU sérico e pré-hipertensão e hipertensão
Na análise de regressão logística, a Tabela 4 apresenta as razões de chances de pré-hipertensão e hipertensão pelo aumento dos quartis de AU sérico. Após o ajuste para idade e sexo na pré-hipertensão, as razões de chances (ORs) (IC 95%) foram 1,686 (1,024–2,775) e 2,064 (1,220–3,492), respectivamente, no 2º e 4º quartil em comparação com o 1º quartil. Após ajustar novamente o IMC, GLI, CT, TG, colesterol HDL, a associação ainda se apresentava estatisticamente significativa. O segundo quartil dos níveis séricos de AU esteve significativamente associado à hipertensão, com um OR (IC 95%) de 2,061 (1,313–3,235) e 2,036 (1,256–3,298), para os modelos 1 e 2, respectivamente.
Tabela 4. – Associação entre quartis de AU sérico e pré-hipertensão e hipertensão.
| AU sérico (mg/dL) | Pré-hipertensão | Hipertensão | ||
|---|---|---|---|---|
|
| ||||
| Idade ajustada para sexo | Multivariada | Idade ajustada para sexo | Multivariada | |
| Q1(≤ 2,65) | 1 | 1 | 1 | 1 |
| Q2(2,66–3,24) | 1,686 (1,024–2,775)* | 1,718 (1,028–2,872)* | 2,061 (1,313–3,235)* | 2,036 (1,256–3,298)* |
| Q3(3,25–3,98) | 1,091 (0,683–1,742) | 1,018 (0,627–1,654) | 1,105 (0,723–1,689) | 0,912 (0,576–1,444) |
| Q4(≥3,99) | 2,064 (1,220–3,492)* | 1,738 (1,003–3,010)* | 2,236 (1,387–3,606) | 1,613 (0,967–2,690) |
Multivariada ajustada para idade, sexo, IMC, GLI, CT, TG, Colesterol HDL; * Comparado com Q1, p<0,05.
Discussão
Alterações nos níveis de AU estão envolvidas na remodelação vascular e na disfunção endotelial, que pode ser a causa de distúrbios cardiovasculares. 19 , 20 O AU pode ser considerado um importante antioxidante, que não só estabiliza a atividade da óxido nítrico sintase endotelial (eNOS), mas também aumenta o armazenamento de gordura e triglicerídeos. 21 Estudos epidemiológicos têm demonstrado forte associação entre o AU e a doença arterial coronariana, aterosclerose e hipertensão. 22 Em nosso estudo, relatamos que níveis séricos de AU mais elevados estiveram positivamente associados com pré-hipertensão e hipertensão na população de meia-idade e idosos, e níveis elevados de AU sérico podem indicar um aumento correspondente na PAD. O risco geral de pré-hipertensão aumentou 73,8% para o quartil mais elevado vs. mais baixo dos níveis séricos de AU, mesmo após o ajuste para possíveis variáveis de confusão. Além disso, verificamos que uma associação mais robusta nas mulheres participantes.
Estudos anteriores examinaram a associação entre os níveis séricos de AU e hipertensão, e os resultados estavam de acordo com nossos achados. Sundstrom et al., 23 revelaram que o aumento dos níveis séricos de AU foi preditor independente de desenvolvimento de hipertensão após um seguimento de curto prazo. Níveis elevados de colesterol LDL e AU sérico são fatores de risco para disfunção endotelial e envelhecimento vascular. A presença concomitante de valores subótimos de colesterol LDL e AU sérico está associada a risco aumentado de hipertensão em uma amostra populacional saudável. 24 Um estudo de coorte retrospectivo de 5 anos descobriu que o aumento de AU é um forte marcador de risco para hipertensão desenvolvida a partir da pré-hipertensão em adultos japoneses. 25 Além disso, estudos clínicos piloto sugerem que a redução dos níveis séricos de AU pode reduzir a pressão arterial em adolescentes pré-hipertensos. 26 Atualmente, a pré-hipertensão é comum na China. Aproximadamente 20–50% dos adultos são acometidos por pré-hipertensão em todo o mundo, e isso aumenta o risco de hipertensão incidente. 27 A prevalência de pré-hipertensão está aumentando rapidamente na China, mas suas causas e fatores associados não foram bem estudados.
Observamos que os níveis séricos de AU aumentaram linearmente na normotensão, pré-hipertensão e hipertensão em mulheres, e essa associação entre AU sérico e pressão arterial se mostrou mais forte entre as mulheres do que entre os homens. Além disso, os níveis séricos de AU estiveram associados positivamente à PAD, principalmente em mulheres. Alguns estudos anteriores demonstraram uma associação entre níveis séricos de AU e a hipertensão mais pronunciada em mulheres. Peng et al., 28 também verificaram que a hiperuricemia estava associada à pré-hipertensão entre 1.773 mulheres chinesas com idade ≥30. Resultados semelhantes foram apresentados em um estudo de seguimento, no qual Strasak et al., 29 demonstraram que o AU sérico é um preditor independente de todas as principais formas de morte cardiovascular em mulheres idosas. A variação dos níveis de AU sérico em mulheres na menopausa sugere uma interação com os hormônios sexuais. 30 Pesquisas mostram que a diferença de sexo na pressão arterial começa a aparecer na adolescência e o surto de crescimento puberal ocorre mais cedo nas meninas do que nos meninos. 31 Há aumento mais significativo da PAS em meninos do que em meninas, enquanto há maior aumento da PAD em meninas do que em meninos. 32 Outras alterações fisiológicas e hormonais complexas podem contribuir para a hipertensão.
Diversas limitações devem ser consideradas. Em primeiro lugar, o desenho transversal usado para avaliar a relação entre AU sérico e pré-hipertensão e hipertensão limita nossa capacidade de estabelecer uma relação causal. Este problema pode ser resolvido por estudos longitudinais no futuro. Em segundo lugar, o mecanismo de interação entre hipertensão e aumento de ácido úrico não foi explorado. Mais estudos ainda são necessários para examinar a possível diferença de sexo na associação entre os níveis séricos de AU e hipertensão em diferentes populações.
Conclusões
Nossos achados sugerem que o AU sérico está significativamente associado à pré-hipertensão e hipertensão, e a associação se mostrou mais robusta nas participantes do sexo feminino. Portanto, o manejo precoce adequado dos níveis de AU em adultos pode ser importante para prevenir o desenvolvimento de hipertensão.
Funding Statement
Fontes de financiamento: O presente estudo foi financiado por the National Natural Science Foundation of China (No. 81874280 e No. 81673266); Anhui Provincial Natural Science Foundation (No. 1808085QH283 e No. 1808085MH297); Key Projects of Anhui Provincial Department of Education (No. KJ2019A0405); Key Program in the Youth Elite Support Plan in Universities of Anhui Province (No. gxyqZD2017066).
Vinculação acadêmica
Não há vinculação deste estudo a programas de pós-graduação.
Fontes de financiamento : O presente estudo foi financiado por the National Natural Science Foundation of China (No. 81874280 e No. 81673266); Anhui Provincial Natural Science Foundation (No. 1808085QH283 e No. 1808085MH297); Key Projects of Anhui Provincial Department of Education (No. KJ2019A0405); Key Program in the Youth Elite Support Plan in Universities of Anhui Province (No. gxyqZD2017066).
Referências
- 1.1. Liu S, Li Y, Zeng X, Wang H, Yin P, Wang L, et al. Burden of cardiovascular diseases in china, 1990-2016: Findings from the 2016 global burden of disease study. JAMA Cardiol. 2019 Apr 1;4(4):342-52. [DOI] [PMC free article] [PubMed]
- 2.2. Messerli FH, Williams B, Ritz E. Essential hypertension. Lancet . 2007;370(9587):591-603. [DOI] [PubMed]
- 3.3. Hu ST, Gao RL, Liu LS, Zhu ML, Wang W, Wang YJ, et al. Summary of report on cardiovascular diseases in China (2018). Chin Circ J 2019;03:209-20.
- 4.4. Forman JP, Stampfer MJ, Curhan GC. Diet and lifestyle risk factors associated with incident hypertension in women. Jama . 2009;302(4):401-11. [DOI] [PMC free article] [PubMed]
- 5.5. Liu L, Gu Y, Li C, Zhang Q, Meng G, Wu H, et al. Serum uric acid is an independent predictor for developing prehypertension: A population-based prospective cohort study. J hum hypertens . 2017;31(2):116-20. [DOI] [PubMed]
- 6.6. Cao Z, Cheng Y, Li S, Yang H, Sun L, Gao Y, et al. Mediation of the effect of serum uric acid on the risk of developing hypertension: A population-based cohort study. J Transl Med . 2019;17(1):202. [DOI] [PMC free article] [PubMed]
- 7.7. Maiuolo J, Oppedisano F, Gratteri S, Muscoli C, Mollace V. Regulation of uric acid metabolism and excretion. Int J Cardiol . 2016;213:8-14. [DOI] [PubMed]
- 8.8. Nagahama K, Inoue T, Iseki K, Touma T, Kinjo K, Ohya Y, et al. Hyperuricemia as a predictor of hypertension in a screened cohort in okinawa, japan. Hypertens res . 2004;27(11):835-41. [DOI] [PubMed]
- 9.9. Mazzali M, Hughes J, Kim YG, Jefferson JA, Kang DH, Gordon KL, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism. Hypertension . 2001;38(5):1101-6. [DOI] [PubMed]
- 10.10. Wang L, Shen C, Yang S, Chen Y, Guo D, Jin Y, et al. Association study of nos3 gene polymorphisms and hypertension in the han chinese population. Nitric oxide . 2015;51:1-6. [DOI] [PubMed]
- 11.11. Grayson PC, Kim SY, LaValley M, Choi HK. Hyperuricemia and incident hypertension: A systematic review and meta-analysis. Arthritis Care Res (Hoboken) . 2011;63(1):102-10. [DOI] [PMC free article] [PubMed]
- 12.12. Syamala S, Li J, Shankar A. Association between serum uric acid and prehypertension among us adults. J Hypertens . 2007;25(8):1583-9. [DOI] [PubMed]
- 13.13. Turak O, Ozcan F, Tok D, Isleyen A, Sokmen E, Tasoglu I, et al. Serum uric acid, inflammation, and nondipping circadian pattern in essential hypertension. J Clin Hypertens . 2013;15(1):7-13. [DOI] [PMC free article] [PubMed]
- 14.14. Turak O, Afsar B, Ozcan F, Canpolat U, Grbovic E, Mendi MA, et al. Relationship between elevated morning blood pressure surge, uric acid, and cardiovascular outcomes in hypertensive patients. J Clin Hypertens. 2014;16(7):530-5. [DOI] [PMC free article] [PubMed]
- 15.15. Cannon PJ, Stason WB, Demartini FE, Sommers SC, Laragh JH. Hyperuricemia in primary and renal hypertension. N Engl J Med . 1966;275(9):457-64. [DOI] [PubMed]
- 16.16. Forman JP, Choi H, Curhan GC. Plasma uric acid level and risk for incident hypertension among men. J Am Soc Nephrol. . 2007;18(1):287-92. [DOI] [PubMed]
- 17.17. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr., et al. Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension . 2003;42(6):1206-52. [DOI] [PubMed]
- 18.18. You L, Liu A, Wuyun G, Wu H, Wang P. Prevalence of hyperuricemia and the relationship between serum uric acid and metabolic syndrome in the asian mongolian area. J Atheroscler Thromb. 2014;21(4):355-65. [DOI] [PubMed]
- 19.19. Taher R, Sara JD, Prasad M, Kolluri N, Toya T, Lerman LO, et al. Elevated serum uric acid is associated with peripheral endothelial dysfunction in women. Atherosclerosis . 2019;290:37-43. [DOI] [PubMed]
- 20.20. Gaubert M, Marlinge M, Alessandrini M, Laine M, Bonello L, Fromonot J, et al. Uric acid levels are associated with endothelial dysfunction and severity of coronary atherosclerosis during a first episode of acute coronary syndrome. Purinergic signal . 2018;14(2):191-9. [DOI] [PMC free article] [PubMed]
- 21.21. Li P, Zhang L, Zhang M, Zhou C, Lin N. Uric acid enhances pkc-dependent enos phosphorylation and mediates cellular er stress: A mechanism for uric acid-induced endothelial dysfunction. Int J Mol Med . 2016;37(4):989-97. [DOI] [PMC free article] [PubMed]
- 22.22. Ndrepepa G. Uric acid and cardiovascular disease. Clin Chim Acta. . 2018;484:150-63. [DOI] [PubMed]
- 23.23. Sundstrom J, Sullivan L, D’Agostino RB, Levy D, Kannel WB, Vasan RS. Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension . 2005;45(1):28-33. [DOI] [PubMed]
- 24.24. Cicero AF, Fogacci F, Giovannini M, Grandi E, D’Addato S, Borghi C, et al. Interaction between low-density lipoprotein-cholesterolaemia, serum uric level and incident hypertension: Data from the brisighella heart study. Journal of hypertension . 2019;37(4):728-31. [DOI] [PubMed]
- 25.25. Kuwabara M, Hisatome I, Niwa K, Hara S, Roncal-Jimenez CA, Bjornstad P, et al. Uric acid is a strong risk marker for developing hypertension from prehypertension: A 5-year japanese cohort study. Hypertension . 2018;71(1):78-86. [DOI] [PMC free article] [PubMed]
- 26.26. Soletsky B, Feig DI. Uric acid reduction rectifies prehypertension in obese adolescents. Hypertension . 2012;60(5):1148-56. [DOI] [PubMed]
- 27.27. Egan BM, Stevens-Fabry S. Prehypertension--prevalence, health risks, and management strategies. Nat Rev Cardiol. 2015;12(5):289-300. [DOI] [PubMed]
- 28.28. Peng H, Ding J, Peng Y, Zhang Q, Xu Y, Chao X, et al. Hyperuricemia and microalbuminuria are separately and independently associated with prehypertension among chinese han women. Metab Syndr Relat Disord. . 2012;10(3):202-8. [DOI] [PubMed]
- 29.29. Strasak AM, Kelleher CC, Brant LJ, Rapp K, Ruttmann E, Concin H, et al. Serum uric acid is an independent predictor for all major forms of cardiovascular death in 28,613 elderly women: A prospective 21-year follow-up study. Int J Cardiol. 2008;125(2):232-9. [DOI] [PubMed]
- 30.30. Levine W, Dyer AR, Shekelle RB, Schoenberger JA, Stamler J. Serum uric acid and 11.5-year mortality of middle-aged women: Findings of the chicago heart association detection project in industry. J Clin Epidemiol. 1989;42(3):257-67. [DOI] [PubMed]
- 31.31. Ewald DR, Haldeman PhD. Risk factors in adolescent hypertension. Glob Pediatr Health. 2016;3:2333794X15625159 [DOI] [PMC free article] [PubMed]
- 32.32. Tu W, Eckert GJ, Saha C, Pratt JH. Synchronization of adolescent blood pressure and pubertal somatic growth. J Clin Endocrinol Metab. 2009;94(12):5019-22 [DOI] [PMC free article] [PubMed]