Abstract
目的
观察中药复方保肝宁对肝纤维化模型小鼠的保护作用并探讨其作用机制。
方法
本研究分为两部分,第1部分:按0.6 mL/(kg·d)予以腹腔注射25% CCl4(CCl4∶橄榄油=1∶3)的方式诱导野生型小鼠建立肝纤维化病理模型,随机分为对照组、模型组、阳性对照组及保肝宁低、中、高浓度组,10只/组。造模给药8周后处死小鼠,取小鼠血清检测AST、ALT水平。另取肝组织做HE、天狼星红染色及α-平滑肌肌动蛋白(α-SMA)免疫组化染色并检测吲哚胺2, 3-双加氧酶1(IDO1)的表达水平。流式细胞仪检测小鼠肝脏树突状细胞(DCs)及T细胞的数量和表型变化。第2部分:按3×1011 v.g/只尾静脉注射IDO1过表达腺相关病毒,取正常野生型小鼠随机分为腺相关病毒阴性对照(AAV9-NC)干预组、IDO1过表达腺相关病毒(AAV9-IDO1)干预组及高浓度保肝宁+IDO1过表达腺相关病毒联合干预组,6只/组。干预4周后,取肝组织做IDO1免疫组化染色并检测小鼠肝脏树突状细胞(DCs)及T细胞的表型变化。
结果
与模型组比较,保肝宁高浓度组能有效降低肝纤维化小鼠血清中AST、ALT水平(P < 0.01);改善肝组织病理损伤,减少肝纤维组织的形成及α-SMA和IDO1的沉淀(P < 0.05)。保肝宁高浓度治疗组肝纤维化小鼠肝脏中CD11C+DCs、CD11C+CD80+DCs、CD11C+CD86+DCs、CD11C+CD40+ DCs、CD11C+MHCII+ DCs细胞和CD3+T、CD3+CD4+T细胞比例与模型组相比均呈不同程度的升高(P < 0.05)。高浓度保肝宁干预后可显著降低IDO1过表达腺相关病毒干预小鼠肝脏中IDO1的表达水平及上调CD11C+CD40+ DCs、CD11C+MHCII+ DCs和CD3+CD4+T细胞比例(P < 0.05)。
结论
保肝宁对CCl4所致小鼠肝纤维化具有一定的治疗作用,其机制可能与降低肝组织中IDO1的表达水平继而促进肝脏中DCs表型成熟使DCs刺激T细胞增殖能力增强有关。
Keywords: 保肝宁; 肝纤维化; 吲哚胺2, 3-双加氧酶1; 树突状细胞; T细胞
Abstract
Objective
To investigate the protective effect of Bao Gan Ning (BGN), a traditional Chinese medicinal formula, against CCl4-induced liver fibrosis in mice and explore the mechanism.
Methods
C57BL/6 mice were randomly divided into control group, liver fibrosis model group, positive control group and the low-, middle-, and high-dose BGN groups (n=10). In all but the control group, the mice were subjected to daily intraperitoneal injection of 25% CCl4 (in olive oil) to induce liver fibrosis and intragastric gavage of corresponding drugs. After 8 weeks, serum levels of ALT and AST were detected. Pathological examination of the liver was performed using HE and Sirius Red staining and α-SMA immunohistochemistry. The expression level of indoleamine 2, 3-dioxygenase 1 (IDO1) and phenotypic changes of hepatic DCs in the liver were measured. Another 18 mice were randomly divided into AAV9-NC, AAV9-IDO1 and high-dose BGN + AAV-IDO1 groups (n=6) for corresponding treatment, and 4 weeks later the deposit of hepatic IDO1 and phenotypic changes of the hepatic DCs were analyzed.
Results
Compared with those in the model group, serum AST and ALT levels decreased significantly in BGN group (P < 0.01). Obvious liver fibrosis was observed in the model group, while the mice treated with BGN showed obviously reduced cell necrosis and collagen proliferation in the liver with significantly lowered the expression levels of hepatic α-SMA and IDO1 (P < 0.05). The percentages of CD11C + DCs, CD11C +CD80 + DCs, CD11C +CD86 + DCs, CD11C +CD40 + DCs, CD11C +MHCII + DCs, CD3 + T cells, and CD3 +CD4 + T cells all increased significantly in BGN group as compared with the model group (P < 0.05). In mice with adenovirus-mediated IDO1 overexpression in the liver, BGN treatment significantly lowered the expression level of IDO1 (P=0.000) and increased the percentages of hepatic CD11C +CD40 + DCs, CD11C +MHCII + DCs and CD3 +CD4 + T cells (P < 0.05).
Conclusion
BGN can effectively inhibit liver fibrosis in mice possibly by lowering the expression level of IDO1 in the liver, thus improving the function of hepatic DCs and subsequently promoting proliferation of T cells.
Keywords: Bao Gan Ning; liver fibrosis; indoleamine 2, 3-dioxygenase 1; dendritic cells; T cells
现代医家多认为肝纤维化属于中医“症瘕、黄疸、胁痛”等病症范畴[1]。吕志平教授根据多年临床经验提出其病因病机多为“湿热余毒未尽,肝郁气滞,淤热互结阻络”,其中湿热疫毒与脾虚血瘀是关键[2, 3],并设计出新方保肝宁用于治疗以此类病机为主的肝纤维化患者,疗效显著[4, 5]。该方主要由白背叶根、丹参、莪术、黄芪、三七等组成,诸药合用共奏清热祛湿解毒、活血化瘀软坚、益气疏肝健脾之效[6]。保肝宁复方对肝炎后肝纤维化患者的临床症状、体征、主要理化指标有明显的改善作用,临床使用安全,无明显副作用,值得临床大力推广应用[7]。为了推广其临床应用及增加国际化应用的可能性,使更多的临床患者收益,亟需对保肝宁治疗肝纤维化作用的分子机制展开深入研究。
研究表明免疫应答紊乱是肝纤维化发生、发展的重要因素。树突状细胞作为抗原递呈细胞,在肝脏免疫微环境中尤为重要[7-9]。有学者指出慢性乙型病毒性肝炎患者体内的树突状细胞存在功能减弱,数量减少的病理变化[10, 11]。作为一种关键的免疫微环境调控因子,吲哚胺2, 3-双加氧酶1(IDO1)与免疫系统的调控密切相关。抑制IDO1的活性可显著降低免疫性肝炎小鼠肝组织中F4/80+巨噬细胞、LY6G+中性粒细胞、CD11b+单核细胞及CD3+T细胞的浸润[12]。IDO1的基因缺失可使肝纤维化小鼠肝组织中IL-17a、IL-6、TNF-α和TGF-β炎症因子水平及Th17细胞浸润减少[13]。我们前期的研究结果表明IDO1在肝纤维化小鼠肝组织中显著上调且IDO1可与Nrf2相互拮抗调节肝纤维化小鼠树突状细胞的成熟[8]。然而,关于保肝宁复方是否也可以通过调控IDO1的表达继而影响树突状细胞的成熟发挥抗肝纤维化作用仍然未知。因此,本研究拟构建四氯化碳(CCL4)所致的小鼠化学性肝纤维化,观察保肝宁复方对实验性肝纤维化的影响,并试图探索IDO1的表达及树突状细胞的功能状态在保肝宁复方抗肝纤维化过程中发挥的作用。
1. 材料和方法
1.1. 材料
1.1.1. 动物
雄性C57BL/6小鼠60只,体质量18~22 g,SPF级,由广州中医药大学实验动物中心提供,许可证号:SYXK(粤)2013-0034。
1.1.2. 药物
中药复方保肝宁各组成成份购于广州康美药业,经南方医科大学中药鉴定与药用植物教研室专家鉴定、水煎后,75 ℃水浴浓缩,制成高、中、低浓度组(含生药量分别为3.51、1.76、0.88 g/mL,其中低剂量组相当于成人等效剂量)。秋水仙碱(阳性对照药),购自西双版纳版纳药业有限责任公司(国药准字号:H53021369),使用前12 h研碎制成0.01 mg/mL悬浊液。
1.1.3. 主要试剂
四氯化碳溶液(SIGMA),EGTA(APExBIO),Ⅳ型胶原酶(Gibco),DNA酶(SIGMA),CD16/CD32(BD),CD11c-PE-CY7(BD),CD80-BV421(BD),CD86-BV605(BD),CD40-PE(BD),MHCIIAF488(BD),7-AAD(BD)。AST、ALT检测试剂盒均购自南京建成生物工程技术研究所。天狼星红苦味酸染色液(phygene)。IDO1过表达腺相关病毒(AAV9-IDO1)购自上海吉凯基因科技有限公司。免疫组化染色试剂盒(上海基因科技有限公司)。
1.2. 方法
1.2.1. 实验分组、造模及给药
小鼠适应性喂养7 d后,根据小鼠随机分为6组,每组10只,分别为对照组、模型组、秋水仙碱组和保肝宁低、中、高浓度组。参照参考文献[8],除对照组予以腹腔注射微量纯橄榄油溶液0.6 mL/(kg·d)外,其余各组予以等体积CCl4橄榄油溶液(CCl4∶橄榄油=1∶3)注射,3次/周,持续8周。各组按照0.2 mL/10 g的灌胃体积予以相应的受试药物灌胃。对照组与模型组给予生理盐水灌胃,阳性对照组予以2 mg/kg秋水仙碱灌胃,保肝宁低、中、高浓度组分别予以0.88、1.76、3.51 g/mL保肝宁灌胃,持续8周。另取正常野生型小鼠分为腺相关病毒阴性对照干预组、IDO1过表达腺相关病毒干预组及高浓度保肝宁+IDO1过表达腺相关病毒联合干预组。将IDO1过表达腺相关病毒干预组及高浓度保肝宁+IDO1过表达腺相关病毒联合干预组小鼠置于固定器内,露出尾巴,选取尾部一条侧静脉,掐住尾巴根部,使静脉充血膨胀,用75%酒精浸泡过的棉球反复擦拭尾部,在消毒的基础上使静脉进一步膨胀。向上斜插针头进入静脉,回抽有血,证明针头进入静脉,缓慢将IDO1过表达腺相关病毒注射入小鼠体内(3×1011 v.g/只)。注射完毕后按压3 min止血,观察小鼠情况。另腺相关病毒阴性对照干预组注射等量空载病毒。高浓度保肝宁+IDO1过表达腺相关病毒联合干预组小鼠同时给予3.51 g/mL保肝宁灌胃,其余各组给予等体积生理盐水灌胃,4周后处死小鼠。所有动物处理和程序均经广州中医药大学动物保护和使用委员会批准(S2017040,S2017043)。
1.3. 指标检测方法
1.3.1. 血清指标AST、ALT的检测
分离小鼠血清,严格按照试剂说明书进行检测。
1.3.2. 肝组织病理学检测
取小鼠肝左叶用4%多聚甲醛固定后,常规石蜡包埋、切片,分别做HE、天狼星红染色,在光学显微镜下观察肝组织病理变化情况。
1.3.3. 免疫组化法检测小鼠肝组织α-SMA及IDO1的表达
肝脏石蜡切片常规烤片、封闭、阻断内源性过氧化物酶后分别滴加α-SMA及IDO1一抗(稀释浓度1∶250),4 ℃过夜孵育,后续步骤按照免疫显色试剂盒进行,中性树胶封片后在光学显微镜下观察蛋白表达情况。
1.3.4. Western blot检测肝脏IDO1蛋白表达水平
将肝脏组织加入裂解液制成肝匀浆,离心取上清液。测定上清蛋白浓度,加入上样缓冲液,10% SDS-PAGE电泳,转膜,BSA室温封闭2 h,一抗(IDO1)4 ℃孵育过夜,TBST洗涤3次,二抗室温孵育2 h,TBST洗涤3次。ECL化学发光试剂盒显色曝光,分析。
1.3.5. 肝脏非实质细胞的分离
根据参照文献[6, 14]分离肝脏非实质细胞:小鼠麻醉后,取腹正中切口,逐层剪开,开腹暴露下腔静脉及门静脉,静脉留置针在下腔静脉穿刺,快速注入EGTA(190 mg/L)冲洗肝脏以避免红细胞污染及肝脏血管凝血,再以1 mL/min注入约50 mL浓度为0.5 mg /mL的Ⅳ型胶原酶(含1% 2 mg/mL DNA酶)消化。取出肝脏,撕开肝脏表面包膜,捣碎肝组织,再以0.5 mg/mL的Ⅳ型胶原酶(含1% 2 mg/mL DNA酶)体外继续消化20 min。消化后细胞混悬液经70 μmol/L细胞滤网过滤。滤液以50 g离心3 min,收集上清备用。
1.3.6. 肝脏DCs表型变化及T细胞增殖情况的检测
将上述获得的肝脏非实质细胞悬液调整至细胞密度为1×106/mL;取100 μL细胞悬液先加入0.5 μL CD16/32冰上孵育5 min阻断非特异性染色,350 g,5 min,弃上清。随后,各管按照检测类型加入相应的抗体染色液,检测肝脏DCs表型变化的抗体染色液配置:CD11C-PECY7,CD80-BV421,CD86-BV605,CD40-PE,MHCIIAF488各1 μL;检测T细胞亚群的抗体染色液配置:CD-APC-CY7,CD4-PE,CD8a-FITC各1 μL。常温孵育30 min后加入1 mL含2%FBS的PBS洗1次,1000 r/min,5 min,弃上清。再加入5 μL 7-AAD孵育10 min标记死细胞,随后加入1 mL含2%FBS的PBS洗1次,1000 r/min,5 min,弃上清。加500 μL含2%FBS的PBS重悬,上机待测。
1.4. 统计方法
采用SPSS 22.0软件分析数据、Graph Pad Prism7.0作图,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,若方差齐性,组间两两比较采用Tukey检验;若方差不齐,组间比较采用Dunnett's T3法检验,以P < 0.05为差异有统计学意义。
2. 结果
2.1. 保肝宁对CCl4所诱导的肝纤维化小鼠的影响
对照组小鼠肝组织仅在汇管区见极少量红色纤维增生,肝小叶结构清晰,无假小叶形成(图 1A、B)。模型组小鼠肝组织汇管区及小叶间见大量红色胶原纤维并形成纤维间隔,可见假小叶结构,天狼星红阳性染色面积较对照组明显增多(P=0.003)。与模型组比较,保肝宁低浓度组小鼠肝组织胶原纤维明显减少,假小叶结构减少,肝小叶破坏程度减轻,但其差异不具有统计学意义(P=0.223);其中保肝宁中、高浓度组小鼠肝组织仅在汇管区见少量胶原纤维形成,未见明显假小叶结构形成,肝小叶结构较完整(P=0.001;P=0.028)。
1.
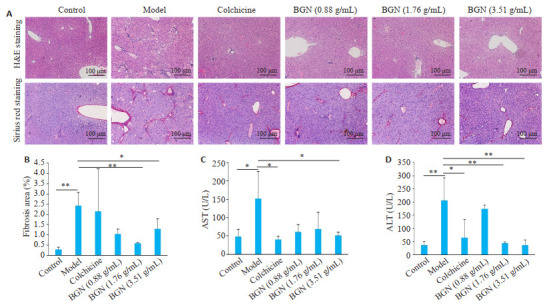
保肝宁对CCL4所诱导的肝纤维化小鼠的影响
Effects of BGN on CCl4-induced liver fibrosis in mice. A: Histopathological changes in the liver shown by HE staining and Sirius Red staining (Original magnification: ×100). B: Positive staining area for Sirius red measured using image J software and quantified in a bar graph. C, D: Serum concentrations ofAST andALT, respectively. Data are presented as Mean±SD. *P < 0.05, **P < 0.01, ***P < 0.001.
与对照组比较,模型组小鼠血清AST(P=0.02)、ALT(P=0.001)水平均显著升高(图 1C、D)。与模型组比较,秋水仙碱干预后可使肝纤维化小鼠血清AST、ALT水平明显下降(P=0.011;P=0.012)。保肝宁低、中浓度组小鼠血清AST平均水平较模型组降低,但其差异不具有统计学意义(P=0.074;P=0.128),保肝宁高浓度组可显著降低肝纤维化小鼠血清AST水平(P=0.041)。保肝宁中、高浓度组小鼠血清ALT水平均较模型组显著降低(P=0.003;P=0.001)。
2.2. 保肝宁对CCl4所诱导的肝纤维化小鼠肝脏中α-SMA、IDO1表达水平及肝脏DCs数量的影响
与对照组比较,模型组小鼠肝组织中α-SMA的表达明显上升(P=0.002),表达的阳性物质呈黄色,主要分布在汇管区、肝窦Disse间隙及纤维间隔等纤维区。与模型组相比,秋水仙碱组α-SMA表达明显降低(P=0.001),仅在肝窦Disse间隙见极少量表达;保肝宁低、中、高浓度组治疗后,α-SMA的表达水平均较模型组显著下降(P=0.004;P=0.003;P=0.002),在汇管区、肝窦间隙及纤维组织等见少量α-SMA表达(图 2A、B)。
2.
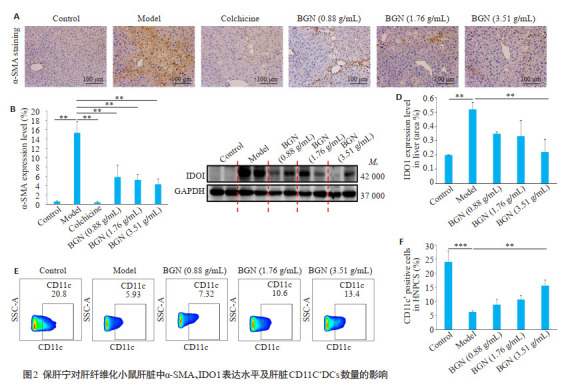
保肝宁对肝纤维化小鼠肝脏中α-SMA、IDO1表达水平及肝脏CD11C+DCs数量的影响
Effects of BGN on expression levels of α-SMA, IDO1 and frequencies of hepatic CD11c+DCs in the liver of the mice with liver fibrosis. A, B: Immunohistochemistry for hepatic α-SMA expression (×200) and positive staining area measured using image J software and quantified in a bar graph. C, D: Western blotting for hepatic IDO1 expression and semi-quantitative analysis of the results (GAPDH as the loading control). E, F: Flow cytometry and summary data showing the percentage of hepatic CD11C+ DC cells in hepatic NPCs. Data are presented as Mean±SD. *P < 0.05, **P < 0.01, ***P < 0.001.
Western blot结果显示:与对照组比较,模型组小鼠肝组织中IDO1的蛋白表达水平明显增多(P=0.024)。与模型组比较,保肝宁低、中浓度组小鼠肝组织IDO1平均表达水平均较模型组降低,但其差异不具有统计学意义(P=0.204;P=0.15,图 2C、D),保肝宁高浓度组可显著降低肝纤维化小鼠肝脏中IDO1蛋白水平(P=0.031,图 2C、D)。
本研究以CD11C+DCs标记树突状细胞。模型组小鼠肝脏中CD11C+DCs细胞较对照组显著下降(P=0.000,图 2E、F)。保肝宁低、中浓度组小鼠肝脏中CD11C+DCs细胞比例的平均水平均较模型组升高,但其差异不具有统计学意义(P=0.627;P=0.188),保肝宁高浓度组可显著上调肝纤维化小鼠肝脏中CD11C+DCs细胞比例(P=0.003)。
2.3. 保肝宁对CCL4所诱导的肝纤维化小鼠肝脏中DCs表型的影响
与对照组比较,模型组小鼠肝脏CD11C+CD80+ DCs、CD11C+CD86+ DCs细胞比例显著降低(P=0.000;P=0.007)。保肝宁低、中浓度干预组小鼠肝脏中CD11C+CD80+DCs(P=0.153;P=0.69)、CD11C+CD86+ DCs(P=0.254;P=0756)细胞比例的平均水平均较模型组小鼠升高,但其差异不具有统计学意义。与模型组比较,保肝宁高浓度干预组小鼠肝脏CD11C+CD80+DCs、CD11C+ CD86+ DCs细胞比例显著升高(P=0.01;P=0.008,图 3A、B、E、F)。
3.
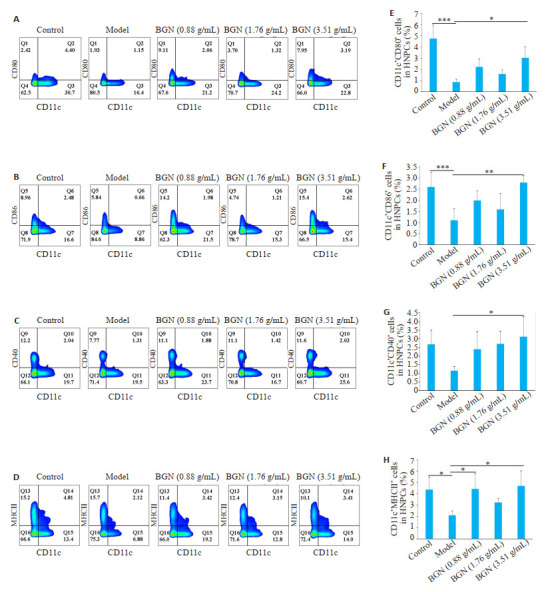
保肝宁对肝纤维化小鼠肝脏中DCs表型的影响
Effects of BGN on the phenotype of hepatic DCs in mice with liver fibrosis. A-D: Flow cytometry of hepatic CD11C + CD80 + DCs, CD11C + CD86 + DCs, CD11C + CD40 + DCs and CD11C + MHCII + DCs in hepatic NPCs, respectively. E-H: The corresponding summary data of cell percentages. Data are presented as Mean±SD. *P < 0.05, **P < 0.01, ***P < 0.001.
与对照组比较,模型组小鼠肝脏中CD11C+CD40+ DCs细胞比例平均水平呈下降趋势,但其差异不具有统计学意义(P=0.14)。保肝宁低、中浓度干预组小鼠肝脏中CD11C+CD40+ DCs细胞比例的平均水平均较模型组小鼠升高,但其差异不具有统计学意义(P=0.354;P=0.182)。保肝宁高浓度干预组小鼠肝脏中CD11C+ CD40+ DCs细胞比例较模型组小鼠显著升高(P=0.04,图 3C、G)。
与对照组比较,模型组小鼠肝脏CD11C+MHCII+ DCs细胞比例平均水平明显下降(P=0.019)。保肝宁低、高浓度干预组小鼠肝脏CD11C+MHCII+ DCs细胞比例均较模型组小鼠显著升高(P=0.039;P=0.019,图 3D、H)。
2.4. 保肝宁对CCL4所诱导的肝纤维化小鼠肝脏中T细胞亚群的影响
模型组小鼠肝脏CD3+T细胞比例较对照组小鼠显著降低(P=0.002);保肝宁低、中浓度干预组小鼠肝脏CD3+T细胞比例平均水平均较模型组小鼠升高,但其差异不具有统计学意义(P=1.00;P=0.053);保肝宁高浓度干预组小鼠肝脏CD3+T细胞比例较模型组小鼠显著升高(P=0.002,图 4A、B)。
4.
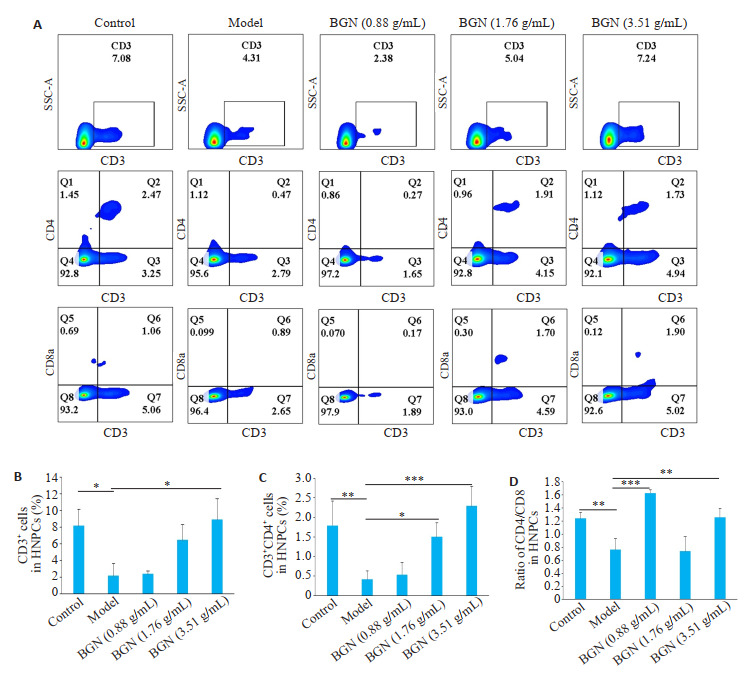
保肝宁对肝纤维化小鼠肝脏中T细胞亚群的影响
Effects of BGN on hepatic T cell subsets in mice with liver fibrosis. A: Frequencies of CD3+, CD3+CD4+, and CD3+ CD8+ T cells in hepatic NPCs analyzed by flow cytometry and the summary data (B-D). Data are presented as Mean±SD. *P < 0.05, **P < 0.01, ***P < 0.001.
与对照组相比,模型组小鼠肝脏CD3+CD4+T细胞比例显著降低(P=0.02);保肝宁低浓度组小鼠肝脏CD3+CD4+T细胞比例平均水平较模型组小鼠升高,但其差异不具有统计学意义(P=0.996);保肝宁中(P=0.033)、高浓度(P=0.001)干预组小鼠肝脏CD3+CD4+T细胞比例均较模型组小鼠显著升高(图 4A、C)。
模型组小鼠肝脏中CD4+/CD8a+比值较对照组明显降低(P=0.006);保肝宁低(P=0.001)、高浓度(P=0.005)干预组小鼠肝脏CD4+/CD8a+比值较模型组小鼠显著升高(图 4A、D)。
2.5. 保肝宁对肝脏特异性过表达IDO1小鼠的肝组织中IDO1表达水平及DCs数量和表型的影响
免疫组化染色结果示:尾静脉注射IDO1过表达腺相关病毒4周后,小鼠肝组织IDO1蛋白表达水平较注射空载病毒组显著增多(P=0.000,图 5A、B)。高浓度保肝宁干预后可显著降低IDO1过表达腺相关病毒干预小鼠肝脏中IDO1的表达水平(P=0.001,图 5A、B)。
5.
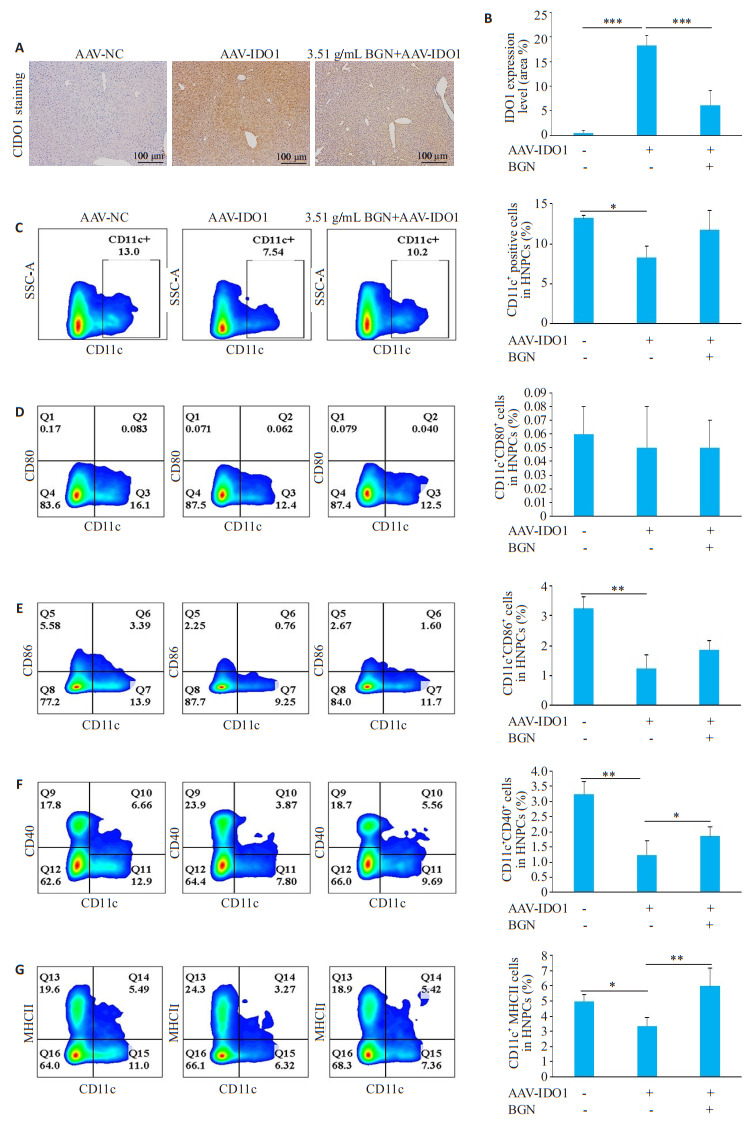
保肝宁对肝脏特异性过表达IDO1小鼠的肝组织中IDO1表达水平及DCs数量和表型的影响
Effects of BGN on the expression level of hepatic IDO1 and the number and phenotype of hepatic DCs in AAV-IDO1 infected mice. A, B: Immunohistochemistry for detecting hepatic IDO1 (×100) and bar graph of the positive staining area. C-G: FACS plots (left) and summary data (right) showing the percentage of hepatic CD11C + DCs, CD11C + CD80 + DCs, CD11C + CD86 + DCs, CD11C + CD40 + DCs, and CD11C + MHCII+ DCs in hepatic NPCs. Data are presented as Mean±SD. *P < 0.05, **P < 0.01, ***P < 0.001.
IDO1过表达腺相关病毒干预组小鼠肝脏中CD11C+DCs数量(P=0.026)及CD11C+CD86+ DCs(P=0.002)、CD11C+CD40+ DCs(P=0.001)、CD11C+MHCII+ DCs(P=0.05,图 5C、G)细胞比例较腺相关病毒阴性对照干预组明显降低,高浓度保肝宁干预后可明显上调IDO1过表达腺相关病毒干预小鼠肝脏中CD11C+ CD40+ DCs(P=0.017)、CD11C+MHCII+ DCs(P=0.008)细胞比例。
2.6. 保肝宁对肝脏特异性过表达IDO1小鼠的肝组织中T细胞亚群的影响
IDO1过表达腺相关病毒干预组小鼠肝脏中CD3+ CD4+T细胞比例较腺相关病毒阴性对照干预组显著降低(P=0.006,图 6),高浓度保肝宁干预后可明显上调IDO1过表达腺相关病毒干预小鼠肝脏中CD3+CD4+T细胞比例(P=0.03)。IDO1过表达腺相关病毒干预组小鼠肝脏中CD3+T(P=0.373)细胞比例、CD4+/CD8+(P=0.135)比值均较腺相关病毒阴性对照干预组降低,高浓度保肝宁干预后可上调IDO1过表达腺相关病毒干预小鼠肝脏中CD3+ T细胞比例(P=0.516)、CD4+/CD8+(P=0.828)比值,但其差异均不具有统计学意义。
6.
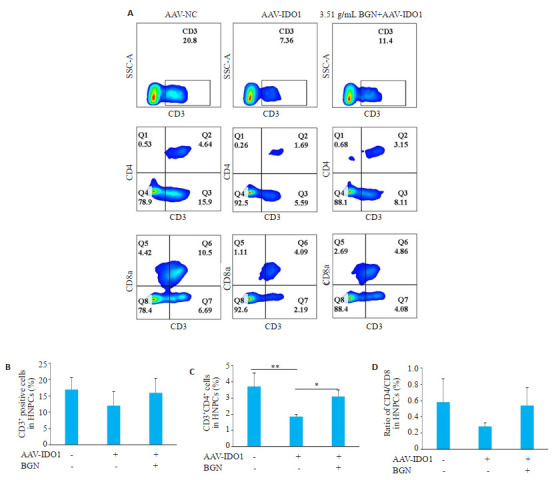
保肝宁对肝脏特异性过表达IDO1小鼠的肝组织中T细胞亚群的影响
Effects of BGN on hepatic T cell subsets in AAV-IDO1-infected mice. A: Frequencies of CD3+, CD3+CD4 +, and CD3 + CD8+ T cells in hepatic NPCs analyzed by flow cytometry and the summary data (B-D). Data are presented as Mean±SD. *P < 0.05, **P < 0.01, ***P < 0.001.
3. 讨论
本研究采用给小鼠腹腔注射具有肝毒性的化学物质CCl4以诱导复制肝纤维化模型,是最早也是目前国内外使用最广泛的一种实验性肝纤维化模型[15]。CCl4进入体内可破坏线粒体、内质网和质膜的渗透性,引起肝细胞的损伤与坏死[16]。我们采用单因素腹腔注射CCL4的造模方法,排除了其他复合因素的干扰,更有利于分析保肝宁的药效作用。当肝细胞受损时,转氨酶会释放入血液,故血清中转氨酶会升高。本研究结果示,保肝宁可显著降低CCL4所致的肝纤维化小鼠血清中ALT、AST水平,表明保肝宁具有护肝、抑制肝细胞损伤的作用。肝纤维化的主要病理特征是活化的肝星状细胞(HSC)产生大量的胶原纤维和细胞外基质(ECM)的过度沉积[17]。α-SMA的表达是HSC早期被激活的标记。目前,以抑制肝星状细胞活化为靶点的治疗方法已成为肝纤维化的研究热点[18]。本研究病理切片示模型组小鼠肝组织中见大量纤维结缔组织,并形成纤维间隔把肝小叶分割成假小叶,说明本研究肝纤维化模型复制成功。保肝宁可以减少肝纤维化小鼠肝组织中胶原纤维的形成,改善肝组织病理结构。表明保肝宁具有抑制胶原蛋白的沉积,减轻肝纤维化程度的作用。此外,模型组小鼠肝组织见大量α-SMA表达,表明HSC活化水平增多,予以保肝宁治疗后可显著降低肝组织中α-SMA的表达水平,即抑制了HSC的活化,提示保肝宁可能通过抑制HSC的活化继而延缓肝纤维化的病理进程。
肝纤维化是组织细胞损伤和修复的免疫应答过程[19]。IDO1是肝脏外唯一可以催化色氨酸分解代谢的限速酶,是一种抑制性免疫调节酶[13]。多项研究表明IDO1可在单核-巨噬细胞、DCs等免疫细胞中表达,负责各种免疫调节功能[20-22]。DCs是目前已发现的功能最强的专职抗原呈递细胞,成熟DCs是体内免疫反应的重要媒介,进一步激活T细胞并参与免疫应答过程或通过免疫耐受来维持机体的免疫平衡状态[23, 24]。成熟DCs的表面高表达CD80、CD86、CD40和MHCII等黏附分子,对抗原加工提呈能力很强,而对抗原的摄取能力减弱[25-27]。因此,肝纤维化过程中可能伴随着IDO1表达水平的变化及DCs表型和其下游T细胞的改变。已有临床研究表明肝纤维化分级越高,慢性乙型肝炎患者外周血DCs的数量越低。DCs数目下降和功能减弱是慢性乙型肝炎患者重要的病理特征[10, 11]。与临床研究结果一致,本研究发现肝纤维化小鼠肝脏中IDO1表达水平显著升高的同时CD11C+DCs、CD11C+CD80+DCs、CD11C+CD86+DCs、CD11C+MHCII+DCs细胞比例较对照组显著降低。更重要的是,保肝宁干预后可显著降低肝纤维化小鼠肝组织中IDO1表达水平,上调CD11C+DCs、CD11C+CD80+DCs、CD11C+CD86+DCs、CD11C+CD40+DCs、CD11C+MHCII+DCs细胞比例,说明保肝宁能有效的下调肝纤维化小鼠肝脏中IDO1表达、增加DCs数量和其表面成熟分子的表达。同时,模型组小鼠肝脏CD3+T、CD3+CD4+T细胞比例与对照组比较均呈低水平,予以保肝宁治疗后可使肝纤维化小鼠肝脏中CD3+T、CD3+CD4+T细胞比例显著上调。说明保肝宁可降低肝纤维化小鼠肝脏中IDO1表达水平,同时改变DCs的成熟表型,促进DCs功能的恢复。研究表明,调节树突状细胞的功能、抑制IDO1的表达均可抑制肝纤维化的进展[28, 29]。为了进一步验证保肝宁的分子机制,本课题组利用保肝宁干预肝脏中特异性过表达IDO1的小鼠,结果发现保肝宁可有效降低IDO1过表达腺相关病毒干预组小鼠肝脏中IDO1的表达水平、CD11C+CD40+ DCs、CD11C+MHCII+ DCs细胞比例和CD3+CD4+T细胞比例。因此,本实验不仅揭示了保肝宁能够通过抑制IDO1的表达进而发挥促进DCs成熟和刺激T细胞增殖的免疫调节作用,还证实了保肝宁具有治疗抗肝纤维化的潜能。
保肝宁是以“活血化瘀”为基本治则,兼以“清热解毒、软坚、益气健脾、疏肝理气”等多途径发挥抗肝纤维化的药效。本实验研究证实保肝宁能有效防治实验性小鼠肝纤维化的形成,其作用机制可能与保护肝细胞损伤、抑制胶原蛋白的形成、改善肝脏免疫应答等相关,有助于诠释保肝宁多途径、多层次抗肝纤维化的科学内涵,为保肝宁更好地应用于临床提供了实验依据。
Biography
莫婵,在读博士研究生,E-mail: channiem@foxmail.com
Funding Statement
国家自然科学基金(81673774);吕志平全国名中医传承工作室建设项目
Supported by National Natural Science Foundation of China (81673774)
Contributor Information
莫 婵 (Chan MO), Email: channiem@foxmail.com.
吕 志平 (Zhiping LÜ), Email: lzp_smu@126.com.
References
- 1.杨 广栋, 高 志远, 李 卫民, et al. 中医对肝纤维化的认识及论治方法研究现状. 国际中医中药杂志. 2018;40(1):87–91. doi: 10.3760/cma.j.issn.1673-4246.2018.01.024. [杨广栋, 高志远, 李卫民, 等. 中医对肝纤维化的认识及论治方法研究现状[J]. 国际中医中药杂志, 2018, 40(1): 87-91.] [DOI] [Google Scholar]
- 2.吕 志平, 贺 松其, 张 绪富, et al. 保肝宁抗肝纤维化的治疗作用探析. 上海中医药杂志. 2005;39(5):6–8. doi: 10.3969/j.issn.1007-1334.2005.05.002. [吕志平, 贺松其, 张绪富, 等. 保肝宁抗肝纤维化的治疗作用探析[J]. 上海中医药杂志, 2005, 39(5): 6-8.] [DOI] [Google Scholar]
- 3.贺 松其, 张 绪富, 蔡 红兵. 吕志平教授辨治慢性肝炎肝纤维化经验介绍. 新中医. 2005;37(3):16–7. doi: 10.3969/j.issn.0256-7415.2005.03.006. [贺松其, 张绪富, 蔡红兵. 吕志平教授辨治慢性肝炎肝纤维化经验介绍[J]. 新中医, 2005, 37(3): 16-7.] [DOI] [Google Scholar]
- 4.贺 松其, 吕 志平, 张 绪富. 保肝宁治疗慢性乙型肝炎肝纤维化128例疗效观察. 新中医. 2008;40(4):24–5. doi: 10.3969/j.issn.0256-7415.2008.04.015. [贺松其, 吕志平, 张绪富. 保肝宁治疗慢性乙型肝炎肝纤维化128例疗效观察[J]. 新中医, 2008, 40(4): 24-5.] [DOI] [Google Scholar]
- 5.贺 松其, 张 绪富, 吕 志平, et al. 保肝宁治疗慢性乙型肝炎肝纤维化的临床研究. https://www.cnki.com.cn/Article/CJFDTOTAL-BXYY200905015.htm. 中华中医药杂志. 2009;24(5):590–2. [贺松其, 张绪富, 吕志平, 等. 保肝宁治疗慢性乙型肝炎肝纤维化的临床研究[J]. 中华中医药杂志, 2009, 24(5): 590-2.] [Google Scholar]
- 6.吕 小燕, 苏 娟萍, 刘 强, et al. 保肝宁抗酒精性肝纤维化大鼠的实验研究. https://www.cnki.com.cn/Article/CJFDTOTAL-SZGY201704015.htm. 时珍国医国药. 2017;28(4):809–11. [吕小燕, 苏娟萍, 刘强, 等. 保肝宁抗酒精性肝纤维化大鼠的实验研究[J]. 时珍国医国药, 2017, 28(4): 809-11.] [Google Scholar]
- 7.Lurje I, Hammerich L, Tacke F. Dendritic cell and T cell crosstalk in liver fibrogenesis and hepatocarcinogenesis: Implications for prevention and therapy of liver cancer. http://www.researchgate.net/publication/344628599_Molecular_Sciences_Dendritic_Cell_and_T_Cell_Crosstalk_in_Liver_Fibrogenesis_and_Hepatocarcinogenesis_Implications_for_Prevention_and_Therapy_of_Liver_Cancer. Int J Mol Sci. 2020;21(19) doi: 10.3390/ijms21197378. [Lurje I, Hammerich L, Tacke F. Dendritic cell and T cell crosstalk in liver fibrogenesis and hepatocarcinogenesis: Implications for prevention and therapy of liver cancer [J]. Int J Mol Sci, 2020, 21(19).] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mo C, Xie S, Zhong W, et al. Mutual antagonism between indoleamine 2, 3-dioxygenase 1 and nuclear factor E2-related factor 2 regulates the maturation status of DCs in liver fibrosis. Free Radic Biol Med. 2020;160:178–90. doi: 10.1016/j.freeradbiomed.2020.07.038. [Mo C, Xie S, Zhong W, et al. Mutual antagonism between indoleamine 2, 3-dioxygenase 1 and nuclear factor E2-related factor 2 regulates the maturation status of DCs in liver fibrosis[J]. Free Radic Biol Med, 2020, 160: 178-90.] [DOI] [PubMed] [Google Scholar]
- 9.Chen Y, Yang JE, Tang JM, et al. Predictive value of plasmacytoid dendritic cells and Toll-like receptor-9 regarding the treatment efficacy of interferon-α in HBeAg-positive chronic hepatitis B patients. http://www.ingentaconnect.com/content/sp/etm/2019/00000018/00000006/art00043. Exp Ther Med. 2019;18(6):4541–6. doi: 10.3892/etm.2019.8161. [Chen Y, Yang JE, Tang JM, et al. Predictive value of plasmacytoid dendritic cells and Toll-like receptor-9 regarding the treatment efficacy of interferon-α in HBeAg-positive chronic hepatitis B patients [J]. Exp Ther Med, 2019, 18(6): 4541-6.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.冯 晓霞, 梁 海林, 聂 苑霞. 不同核苷类似物对慢性乙肝患者肝纤维化及外周血树突状细胞功能的影响. https://www.cnki.com.cn/Article/CJFDTOTAL-HNYY201723009.htm. 海南医学院学报. 2017;23(23):3219–22. [冯晓霞, 梁海林, 聂苑霞. 不同核苷类似物对慢性乙肝患者肝纤维化及外周血树突状细胞功能的影响[J]. 海南医学院学报, 2017, 23(23): 3219-22.] [Google Scholar]
- 11.马 春明, 张 锁才, 史 罗明, et al. 慢性乙型肝炎外周血浆样树突状细胞与免疫应答的关系及干预分析. https://www.cnki.com.cn/Article/CJFDTOTAL-ZUAN202001013.htm. 肝脏. 2020;25(1):34–6. [马春明, 张锁才, 史罗明, 等. 慢性乙型肝炎外周血浆样树突状细胞与免疫应答的关系及干预分析[J]. 肝脏, 2020, 25(1): 34-6.] [Google Scholar]
- 12.Zeng T, Deng G, Zhong W, et al. Indoleamine 2, 3-dioxygenase 1enhanceshepatocytes ferroptosis in acute immune hepatitis associated with excess nitrative stress. Free Radic Biol Med. 2020;152:668–79. doi: 10.1016/j.freeradbiomed.2020.01.009. [Zeng T, Deng G, Zhong W, et al. Indoleamine 2, 3-dioxygenase 1enhanceshepatocytes ferroptosis in acute immune hepatitis associated with excess nitrative stress [J]. Free Radic Biol Med, 2020, 152: 668-79.] [DOI] [PubMed] [Google Scholar]
- 13.Zhong W, Gao L, Zhou Z, et al. Indoleamine 2, 3-dioxygenase 1 deficiency attenuates CCl4-induced fibrosis through Th17 cells down-regulation and tryptophan 2, 3-dioxygenase compensation. Oncotarget. 2017;8(25):40486–500. doi: 10.18632/oncotarget.17119. [Zhong W, Gao L, Zhou Z, et al. Indoleamine 2, 3-dioxygenase 1 deficiency attenuates CCl4-induced fibrosis through Th17 cells down-regulation and tryptophan 2, 3-dioxygenase compensation[J]. Oncotarget, 2017, 8(25): 40486-500.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mederacke I, Dapito DH, Affò S, et al. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nat Protoc. 2015;10(2):305–15. doi: 10.1038/nprot.2015.017. [Mederacke I, Dapito DH, Affò S, et al. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers [J]. Nat Protoc, 2015, 10(2): 305-15.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.闫 冰川, 丁 常清, 江 伟炽, et al. 长期腹腔注射四氯化碳诱导小鼠肝纤维化模型的建立. 中华实验外科杂志. 2015;32(6):1464–5. doi: 10.3760/cma.j.issn.1001-9030.2015.06.092. [闫冰川, 丁常清, 江伟炽, 等. 长期腹腔注射四氯化碳诱导小鼠肝纤维化模型的建立[J]. 中华实验外科杂志, 2015, 32(6): 1464-5.] [DOI] [Google Scholar]
- 16.陈 文龙, 戴 富臻, 邵 正勇, et al. 槲皮素对四氯化碳诱导的大鼠肝纤维化抑制作用和肝保护作用. 中国免疫学杂志. 2021;37(1):46–50. doi: 10.3969/j.issn.1000-484X.2021.01.008. [陈文龙, 戴富臻, 邵正勇, 等. 槲皮素对四氯化碳诱导的大鼠肝纤维化抑制作用和肝保护作用[J]. 中国免疫学杂志, 2021, 37(1): 46-50.] [DOI] [Google Scholar]
- 17.Park YJ, An HT, Park JS, et al. Tyrosine kinase inhibitor neratinib attenuates liver fibrosis by targeting activated hepatic stellate cells. Sci Rep. 2020;10(1):14756. doi: 10.1038/s41598-020-71688-2. [Park YJ, An HT, Park JS, et al. Tyrosine kinase inhibitor neratinib attenuates liver fibrosis by targeting activated hepatic stellate cells [J]. Sci Rep, 2020, 10(1): 14756.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.高 宏, 文 楠, 徐 雪松, et al. 内质网应激介导的Kupffer细胞源性TNF-α经TNFR/caspase 8途径诱导肝星状细胞凋亡. http://www.j-smu.com/CN/10.12122/j.issn.1673-4254.2020.05.04. 南方医科大学学报. 2020;40(5):632–9. doi: 10.12122/j.issn.1673-4254.2020.05.04. [高宏, 文楠, 徐雪松, 等. 内质网应激介导的Kupffer细胞源性TNF-α经TNFR/caspase 8途径诱导肝星状细胞凋亡[J]. 南方医科大学学报, 2020, 40(5): 632-9.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Tang R, Lei ZG, Wang XP, et al. Hepatitis B envelope antigen increases Tregs by converting CD4+CD25-T cells into CD4+CD25+ Foxp3+ Tregs. http://www.ingentaconnect.com/content/sp/etm/2020/00000020/00000004/art00095. Exp Ther Med. 2020;20(4):3679–86. doi: 10.3892/etm.2020.9107. [Tang R, Lei ZG, Wang XP, et al. Hepatitis B envelope antigen increases Tregs by converting CD4+CD25-T cells into CD4+CD25+ Foxp3+ Tregs [J]. Exp Ther Med, 2020, 20(4): 3679-86.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Bo L, Guojun T, Li G. An expanded neuroimmunomodulation axis: sCD83-indoleamine 2, 3-dioxygenase-kynurenine pathway and updates of kynurenine pathway in neurologic diseases. Front Immunol. 2018;9:1363. doi: 10.3389/fimmu.2018.01363. [Bo L, Guojun T, Li G. An expanded neuroimmunomodulation axis: sCD83-indoleamine 2, 3-dioxygenase-kynurenine pathway and updates of kynurenine pathway in neurologic diseases[J]. Front Immunol, 2018, 9: 1363.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.马 丽, 申 慧琴. 吲哚胺2, 3-双加氧酶1对幽门螺旋杆菌免疫调节的研究进展. 胃肠病学和肝病学杂志. 2020;29(9):1057–60. doi: 10.3969/j.issn.1006-5709.2020.09.020. [马丽, 申慧琴. 吲哚胺2, 3-双加氧酶1对幽门螺旋杆菌免疫调节的研究进展[J]. 胃肠病学和肝病学杂志, 2020, 29(9): 1057-60.] [DOI] [Google Scholar]
- 22.张黎明. 吲哚胺2, 3-双加氧酶1在Vogt-小柳原田综合征发病中的作用研究[D]. 重庆医科大学, 2020.
- 23.Kimura TFE, Romera LMD, de Almeida SR. Fonsecaea pedrosoi conidia induces activation of dendritic cells and increases CD11c + cells in regional lymph nodes during experimental chromoblastomycosis. Mycopathologia. 2020;185(2):245–56. doi: 10.1007/s11046-020-00429-w. [Kimura TFE, Romera LMD, de Almeida SR. Fonsecaea pedrosoi conidia induces activation of dendritic cells and increases CD11c + cells in regional lymph nodes during experimental chromoblastomycosis [J]. Mycopathologia, 2020, 185(2): 245-56.] [DOI] [PubMed] [Google Scholar]
- 24.Zhuang Q, Cai H, Cao Q, et al. Tolerogenic dendritic cells: the pearl of immunotherapy in organ transplantation. http://www.researchgate.net/publication/346110254_Tolerogenic_Dendritic_Cells_The_Pearl_of_Immunotherapy_in_Organ_Transplantation. Front Immunol. 2020;11:552988. doi: 10.3389/fimmu.2020.552988. [Zhuang Q, Cai H, Cao Q, et al. Tolerogenic dendritic cells: the pearl of immunotherapy in organ transplantation[J]. Front Immunol, 2020, 11: 552988.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Huang H, Fang J, Fan X, et al. Advances in molecular mechanisms for traditional Chinese medicine actions in regulating tumor immune responses. http://www.researchgate.net/publication/342778282_Advances_in_Molecular_Mechanisms_for_Traditional_Chinese_Medicine_Actions_in_Regulating_Tumor_Immune_Responses. Front Pharmacol. 2020;11:1009. doi: 10.3389/fphar.2020.01009. [Huang H, Fang J, Fan X, et al. Advances in molecular mechanisms for traditional Chinese medicine actions in regulating tumor immune responses [J]. Front Pharmacol, 2020, 11: 1009.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.郭 旭雪, 聂 汉祥, 陈 千慧, et al. iNKT细胞联合卵清蛋白对髓源性树突状细胞表型和功能的影响. 中国病理生理杂志. 2019;35(8):1483–8. doi: 10.3969/j.issn.1000-4718.2019.08.021. [郭旭雪, 聂汉祥, 陈千慧, 等. iNKT细胞联合卵清蛋白对髓源性树突状细胞表型和功能的影响[J]. 中国病理生理杂志, 2019, 35(8): 1483-8.] [DOI] [Google Scholar]
- 27.王 树琪, 李 华, 唐 中生, et al. 甘草多糖诱导的树突状细胞生物学特性研究. https://www.cnki.com.cn/Article/CJFDTOTAL-YZYY202002022.htm. 云南中医中药杂志. 2020;41(2):72–8. [王树琪, 李华, 唐中生, 等. 甘草多糖诱导的树突状细胞生物学特性研究[J]. 云南中医中药杂志, 2020, 41(2): 72-8.] [Google Scholar]
- 28.徐 叶进, 唐 新月, 杨 敏, et al. 白细胞介素10基因修饰的树突状细胞对肝纤维化小鼠的治疗作用及其机制. 中华内科杂志. 2018;8(11):835–40. doi: 10.3760/cma.j.issn.0578-1426.2018.11.008. [徐叶进, 唐新月, 杨敏, 等. 白细胞介素10基因修饰的树突状细胞对肝纤维化小鼠的治疗作用及其机制[J]. 中华内科杂志, 2018, 8(11): 835-40.] [DOI] [Google Scholar]
- 29.Cao G, Zhu R, Jiang T, et al. Danshensu, a novel indoleamine 2, 3-dioxygenase1 inhibitor, exerts anti-hepatic fibrosis effects via inhibition of JAK2-STAT3 signaling. Phytomedicine. 2019;63:153055. doi: 10.1016/j.phymed.2019.153055. [Cao G, Zhu R, Jiang T, et al. Danshensu, a novel indoleamine 2, 3-dioxygenase1 inhibitor, exerts anti-hepatic fibrosis effects via inhibition of JAK2-STAT3 signaling[J]. Phytomedicine, 2019, 63: 153055.] [DOI] [PubMed] [Google Scholar]


