Abstract
目的
利用简易Z-Score成像系统(eZIS)对脑血流灌注SPECT图像进行分析,探讨其在早期阿尔茨海默病(AD)诊断中的价值。
方法
回顾性分析2018年9月~2020年9月至南方医院核医学科行脑血流灌注SPECT检查的71例受检者的临床资料,根据2011版NIA-AA标准诊断为阿尔茨海默病源性轻度认知障碍(MCI)12例,阿尔茨海默病痴呆阶段(AD)11例,无认知障碍的的健康中老年人(NC)8例。所有受检者均已行脑血流灌注SPECT显像,并应用eZIS辅助分析,获得指标值——严重程度、范围和比率。应用SPSS23.0软件比较3组间严重程度、范围、比率的差异,并分析3个指标值单项及联合分析在早期AD中诊断效能。
结果
(1)3组受检者间性别(P=0.58)、年龄(P=0.21)、受教育程度(P=0.88)的差异无统计学意义;AD组(P=0.00)、MCI组(P=0.04)简易精神状态检查量表(MMSE)分数低于NC组,AD组(P=0.02)MMSE分数明显低于MCI组,差异均有统计学意义;(2)AD组的严重程度(P=0.00)、范围(P=0.00)高于MCI组,AD组、MCI组的严重程度(P=0.00、0.00)、范围(P=0.00、0.00)、比率(P=0.00、0.00)均高于NC组,且差异均有统计学意义,AD组、MCI组的比率(P=0.09)差异无统计学意义;(3)单项分析时严重程度的诊断性能(AUC=0.911)和灵敏度(87.0%)最高,联合分析时诊断性能及灵敏度均高于单项分析,其中范围、比率联合分析的诊断性能(AUC=0.948)和灵敏度(87.0%)较高。
结论
eZIS辅助脑血流灌注SPECT分析在早期阿尔茨海默病诊断中有较高的应用价值。
Keywords: 阿尔茨海默病, 脑血流灌注SPECT显像, Z-Score成像系统, 轻度认知障碍
Abstract
Objective
To analyze single-photon emission tomography (SPECT) images of cerebral blood flow perfusion using an easy Z-score imaging system (eZIS) and explore the value of SPECT and eZIS in early diagnosis of Alzheimer's disease (AD).
Methods
We retrospectively analyzed the clinical data of 71 subjects undergoing brain perfusion SPECT examination in our department from September, 2018 to September, 2020 and identified 31 eligible subjects for this study. Among these subjects, according to the NIA-AA criteria (2011 edition), 12 were diagnosed with mild cognitive impairment due to AD (MCI) and 11 with AD dementia stage (AD); 8 elderly subjects were healthy without cognitive impairment (NC). All these subjects underwent brain perfusion SPECT, and eZIS-assisted analysis was used to obtain the index values (severity, range and ratio). The differences in the severity, extent and ratio among the 3 groups were compared, and the diagnostic efficacy of single and joint analysis of the 3 indexes for early AD was analyzed.
Results
There was no significant difference in gender, age and education level among the 3 groups (P>0.05). Compared with those in NC group, the Mini Mental State Examination Scale (MMSE) scores were significantly lowered in AD group and MCI group; the MMSE score was significantly lower in AD group than in MCI group (P < 0.05). The patients with AD had significantly greater disease severity and extent than those with MCI group; the severity, range and ratio in both AD group and MCI group were significantly higher than those of NC group, but the ratio did not differ significantly between AD group and MCI group (P>0.05). In single index analysis, severity had the highest diagnostic performance (AUC=0.911) and sensitivity (87.0%); the diagnostic performance and sensitivity of joint analysis were better than those of single analysis, and joint analysis of range and ratio showed high diagnostic performance (AUC=0.948) and sensitivity (87.0%).
Conclusion
The analysis of brain perfusion SPECT using an eZIS program can be useful for early diagnosis of AD.
Keywords: Alzheimer's disease, Brain perfusion SPECT, Easy Z-score imaging system, Mild cognitive impairment
痴呆已经成为老年人群致死和致残的主要疾病之一,全世界大约有5000万人患有痴呆症,预计到2050年,将增加到1.52亿[1],其中阿尔茨海默病(AD)是痴呆的首要病因。AD又称原发性老年痴呆症,是一种进行性神经系统退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间能力损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今尚未明确,亦缺乏治愈方法,目前主要治疗为延缓病情进展,临床实践诊断主要依据典型临床表现、神经心理学量表、结构影像学等,但当诊断明确时,患者已处于AD中晚期,从而延误了疾病治疗,因此发现早期诊断方法并及时干预对于AD的防治具有重要意义。
一些早期诊断方法,如生物学标志物检查,包括脑脊液中总tau蛋白(t-tau)、磷酸化tau蛋白(p-tau)、和Aβ 42等,虽然敏感度高,但脑脊液采集存在一定风险,外周血检测尚不成熟以及检测技术等原因,临床上较难大规模应用[2]。18F-FDG PET、Aβ-PET等功能影像学能在CT、MRI等结构影像学检出脑组织形态改变之前发现AD的病理改变,但由于所使用的放射性核素生产成本高,操作复杂,不利于在临床上广泛应用[3]。
单光子发射计算机断层扫描脑血流灌注显像(SPECT)是一种相对安全、廉价的功能显像方法,通过静脉注入一种单光子核素显像剂,可观察其在脑内的分布,了解脑组织的血流、代谢情况从而辅助神经系统疾病的诊断[3]。但传统的SPECT图像目测分析法易受图像质量、诊断医师经验等主观因素及正常年龄老化、视觉分辨力有限等生理因素影响[4],可重复性差,容易导致偏倚,所得的结果判断可信度较低。针对这些不足,日本学者Matsuda等[5]开发了简易Z-Score成像系统,它是一种基于SPM和3D-SSP的脑血流灌注SPECT显像自动化诊断的统计分析方法,同时eZIS会将早期AD患者局部脑血流量(rCBF)降低区域设置为感兴趣区,并自动生成能反应感兴趣区中rCBF降低情况的3个指标值,即严重程度、范围和比率,用于客观地区分早期AD患者和性别、年龄匹配的正常人[6]。
Matsuda等[7]在关于早期AD诊断的多中心研究中发现,当eZIS中的严重程度、范围和比率的截值分别为1.19、14.2%和2.22倍时,其诊断效能最佳,区分早期AD患者和健康人的准确率最高,分别为85%、86%和80%,3个指标的灵敏度和特异度分别为100%和45%、100% 和100%、42%和100%。但Ishii等[8]探索eZIS-SPECT在AD患者和健康人中的鉴别能力时发现,当严重程度、比率截值分别调整为1.4、1.5倍时,其诊断早期AD的灵敏度(100%、92%)和特异度(88%、88%)优于Matsuda等[7]的研究结果,他们考虑这可能是在共享正常数据库时,与不同机构准直器的SPECT图像转换和重建不足够精准等因素有关。本研究基于Matsuda[7]等提出的3个指标值截值,通过eZIS-SPECT对早期AD患者和健康人的脑血流量差异进行分析,旨在探讨eZIS在本机构中诊断早期AD的临床应用价值。
1. 资料和方法
1.1. 一般资料
1.1.1. 研究对象
选取2018年9月~2020年9月至南方医科大学南方医院就诊的11例AD痴呆阶段患者(AD组),12例AD源性轻度认知障碍患者(MCI组)以及同期至我院检查的8例无认知障碍的健康中老年人作为对照组(NC组)。
1.1.2. 纳入标准
(1) AD入组标准:①符合2018年中国痴呆与认知障碍诊治指南推荐的由阿尔茨海默病及相关疾病协会修订的2011版NIA-AA诊断标准中的AD所致痴呆的核心临床标准[9, 10];②简易精神状态检查量表(MMSE):受教育程度为文盲≤17分,小学≤20分,中学(包括中专)≤22,大学(包括大专)≤23分。
(1) AD入组标准:①符合2018年中国痴呆与认知障碍诊治指南推荐的由阿尔茨海默病及相关疾病协会修订的2011版NIA-AA诊断标准中的AD所致痴呆的核心临床标准[9, 10];②简易精神状态检查量表(MMSE):受教育程度为文盲≤17分,小学≤20分,中学(包括中专)≤22,大学(包括大专)≤23分。
每位受检者在脑血流灌注SPECT检查前,均进行详细病史询问、全面体格检查、神经心理量表评估和相应实验室检查。所有受检者均为右利手。受试者或其授权委托人签署知情同意书。
(3) 排除标准:其他导致痴呆的神经系统疾病,包括血管性痴呆、路易体痴呆、额颞叶变性、帕金森病、颅内肿瘤、颅内感染、癫痫等;合并脑外伤引起的认知障碍;合并甲减、叶酸、维生素B12缺乏、严重肾脏、肝脏疾病等影响认知的疾病;特定药物影响、酗酒、情绪问题如抑郁、焦虑、精神分裂等。
1.2. 研究方法
使用带有16排诊断CT的双探头SPECT/CT断层显像仪系Simmens的Symbia intevo 16。受检者用眼罩蒙住双眼,耳塞堵住双耳,在昏暗、安静的房间内仰卧休息15~20 min后,静脉注射适量的显像剂锝-双半胱乙酯(99mTc-ECD)(约20 mCi),并继续封闭视听,仰卧休息45~60 min后开展局部的脑血流灌注断层显像。指导患者采仰卧位,将头部固定,设置矩阵64×64,以最小旋转半径,用连续旋转断层采集模式,每旋转一周时间为2 min,采集8周完毕,数据自动存盘[11]。1.2.2用eZIS进行SPECT图像分析首先SPM2将重建后的SPECT图像进行校准,利用12个最佳参数仿射转换和非线性估计将所有图像转换为99mTc-ECD的标准脑模板,将转换后的图像进行平滑化处理[12, 13]。再用上述方法处理从婴幼儿到高龄者不同性别的健康人的脑血流SPECT图像,获得正常数据库,并纳入eZIS中。利用将特定灰质区域中超过全脑像素平均值1/8的部分遮罩后计算得到的全脑平均值,或者较高一侧小脑半球的平均值将所有体素进行归一化,生成标准差影像[13]。应用同样的方法处理本研究中受检者的影像数据,并与正常对照数据库中性别、年龄匹配的SPECT图像比较,逐个体素进行Z分数分析:Z分数=(对照平均值)−(个体值)/对照标准差,获得每幅SPECT图像的Z分数图。后将Z分数图叠加显示在经解剖标准化的MRI横断面、矢状面、冠状面及三维脑表面图像上,获得eZIS图像[7, 14, 15] (图 1)。
1.
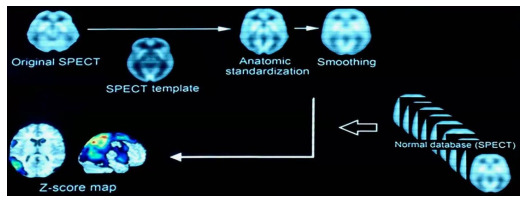
eZIS通过应用SPM2和3D-SSP分析SPECT图像,并与正常数据库对比获得Z分数的的过程
Process of SPECT image analysis by eZIS utilizing SPM2 and 3D-SSP and comparison with normal databases to obtain the Z-score map.
根据由横断面影像所形成的Z分数分布图,沿着脑表面计算至14 mm深度,求出的数值表示为脑表面值。考虑统计学显著性,Z分数的下限值多采用标准值2,范围是2-6[13]。Z分数的正值表示与对照数据库比较rCBF降低,并在图像中用彩色标识出来,从冷色系至暖色系代表血流降低程度逐渐加重。在eZIS中,早期AD特异性感兴趣区体积(VOI)就设置在双侧扣带回后部、楔前叶和顶叶联合皮质处,采用白线勾画出来,并自动计算出可评估VOI局部脑血流量的3个指标值——严重程度、范围、比率。严重程度是指VOI中rCBF降低的严重程度,由平均正Z分数表示;范围是指VOI中rCBF降低的范围,由VOI中Z值超过阈值2的百分率表示;比率是VOI中rCBF降低的区域与全脑rCBF降低区域的比值,即Z值超过阈值2的百分率[7, 15],它表明了与全脑相比,VOI中rCBF降低的特异性。
1.3. 判断标准
采用Matsuda等[7]报道的可区分早期AD和无认知障碍的健康人的指标临界值:严重程度、范围和比率分别为1.19、14.2%和2.22倍。单项分析时,严重程度、范围、比率单项指标值超过临界值即判断为单项分析阳性,联合分析时,只要其中一项指标值超过临界值即判断为联合分析阳性。
1.4. 统计学方法
本研究假说为严重程度、范围、比率能有效地区分早期AD患者和健康人,研究假说为严重程度、范围、比率的ROC曲线下面积均大于0.5。参考文献[7]获知严重程度、范围、比率的ROC曲线下面积分别为0.924、0.934、0.862,在α=0.05(单侧),β=0.2,组间比例1∶1.5,采用PASS11估算样本量。结果发现,至少需要纳入早期AD患者10人,健康人7人。考虑10%的失访率,研究纳入早期AD患者12人,健康人8人。
采用SPSS23.0统计学软件对数据进行处理及分析。计量资料以均数±标准差表示;所有资料进行Shapiro-Wilk正态性检验、方差齐性检验;年龄资料多组间比较采用单因素方差分析,组间两两比较采用LSD检验;性别、文化程度、MMSE分数多组间比较采用Kruskal-Wallis H检验,组间两两比较采用Bonferroni校正法;严重程度、范围、比率值多组间比较采用Welch's单因素方差分析,组间两两比较采用Gamse Howell检验。应用二元logistic回归计算出3个指标不同组合的联合分析的预测概率值,应用ROC曲线分析严重程度、范围和比率在早期AD中的诊断效能。以P < 0.05为差异有统计学意义。
2. 结果
2.1. 3组一般资料比较
3组受检者的性别(P=0.58)、年龄(P=0.21)、受教育程度(P=0.88)比较,差异无统计学意义;AD组(P= 0.00)、MCI组(P=0.04)的MMSE分数低于NC组,AD组的MMSE分数明显低于MCI组,差异均有统计学意义(P=0.02,表 1)。
1.
3组性别、年龄、文化程度、MMSE分数比较
Comparison of gender, age, education level and MMSE scores among the 3 groups
| Group | n | Gender (M: F) | Age (Mean±SD, years) | Education (Mean±SD, years) | MMSE (Mean±SD, scores) |
| aP < 0.05 vs NC group; bP < 0.05 vs MCI group. NC: Middle-aged and elderly subjects with normal cognitive function matched for sex, age and education level. MCI: Patients with mild cognitive impairment caused by Alzheimer's disease. AD: Patients in dementia stage of Alzheimer's disease. | |||||
| NC | 8 | 4/4 | 59.38±8.85 | 10.25±3.77 | 28.13±1.55 |
| MCI | 12 | 7/5 | 67.00±8.89 | 9.92±5.63 | 22.67±3.47a |
| AD | 11 | 4/7 | 65.00±9.98 | 10.64±5.03 | 11.45±6.56ab |
| F | 1.08 | 1.66 | 0.25 | 23.83 | |
| P | 0.58 | 0.21 | 0.88 | 0.00 | |
2.2. 3组严重程度、范围和比率的比较
AD组的严重程度(P=0.00)、范围(P=0.00)高于MCI组,AD组、MCI组的严重程度(P=0.00)、范围(P= 0.00)、比率(P=0.00)均高于NC组,且差异均有统计学意义,AD组、MCI组的比率差异无统计学意义(P=0.09,表 2)。
2.
3组严重程度、范围、比率3个指标值的比较
Comparison of the severity, extent, and ratio among the 3 groups
| Group | n | Severity | Extent (%) | Ratio (times) |
| aP < 0.05 vs NC group; bP < 0.05 vs MCI group. | ||||
| NC | 8 | 0.98±0.30 | 5.64±8.83 | 1.09±1.84 |
| MCI | 12 | 1.50±0.28a | 17.94±9.49a | 2.11±0.96a |
| AD | 11 | 2.74±0.68ab | 52.23±20.39ab | 3.54±1.88a |
| F | 28.59 | 46.90 | 12.04 | |
| P | 0.00 | 0.00 | 0.00 | |
2.3. 严重程度、范围和比率单项及联合分析在MCI和AD诊断的价值比较
MCI组和AD组作为金标准阳性组,严重程度、范围、比率分别单独分析、3个指标值联合分析、严重程度和范围联合分析、严重程度和比率联合分析、范围和比率联合分析的阳性例数分别为20例、19例、13例、21例、20例、21例、20例;NC组作为金标准阴性组,所有单项及联合分析的阳性例数均为1例,计算出严重程度、范围、比率单项及不同组合联合分析的灵敏度、特异度、阳性预测值、阴性预测值和诊断符合率。在单项分析中,严重程度的灵敏度及诊断准确率最高,比率的灵敏度及诊断准确率最低,与单项分析相比,联合分析的灵敏度及诊断准确率增高,特异度不变(表 3)。
3.
严重程度、范围、比率单项及联合分析的诊断价值
Diagnostic value of single and joint analysis of the severity, range, and ratio forAD (%)
| Indicators | Sensitivity (%) | Specificity (%) | Positive predictive value (%) | Negative predictive value (%) | Accuracy (%) |
| A: Severity; B: Extent; C: Ratio. | |||||
| A | 87.0 | 87.5 | 95.2 | 70.0 | 87.1 |
| B | 82.6 | 87.5 | 95.0 | 63.6 | 83.9 |
| C | 56.5 | 87.5 | 92.9 | 41.2 | 64.5 |
| A+B+C | 91.3 | 87.5 | 95.5 | 77.8 | 90.3 |
| A+B | 87.0 | 87.5 | 95.2 | 70.0 | 87.1 |
| A+C | 91.3 | 87.5 | 95.5 | 77.8 | 90.3 |
| B+C | 87.0 | 87.5 | 95.2 | 70.0 | 87.1 |
2.4. 严重程度、范围和比率单项及联合分析对轻度认知障碍诊断的ROC曲线分析
用严重程度、范围、比率3个指标值作ROC曲线,评价单项及联合分析的诊断价值(表 4,图 2)。对轻度认知障碍诊断的ROC曲线分析显示,单项分析时严重程度的诊断性能最好(AUC=0.911),比率的诊断性能最差(AUC=0.833)。联合分析的诊断性能均优于单项分析,其中范围、比率联合分析的诊断性能(AUC=0.948) 最高。AD源性轻度认知障碍(MCI)及AD痴呆患者的典型图像(图 3、4)。
4.
严重程度、范围、比率单项及联合分析对轻度认知障碍诊断的ROC曲线参数
ROC curve parameters of single and joint analysis of the severity, range, and ratio for diagnosis of mild cognitive impairment
| Indicators | AUC | 95% CI | Standard error | P |
| A: Severity; B: Extent; C: Ratio. | ||||
| A | 0.911 | 0.759-1.000 | 0.078 | 0.00 |
| B | 0.854 | 0.650-1.000 | 0.104 | 0.01 |
| C | 0.833 | 0.598-1.000 | 0.120 | 0.01 |
| A+B+C | 0.938 | 0.828-1.000 | 0.560 | 0.00 |
| A+B | 0.911 | 0.759-1.000 | 0.078 | 0.00 |
| A+C | 0.938 | 0.828-1.000 | 0.056 | 0.00 |
| B+C | 0.948 | 0.857-1.000 | 0.046 | 0.00 |
2.
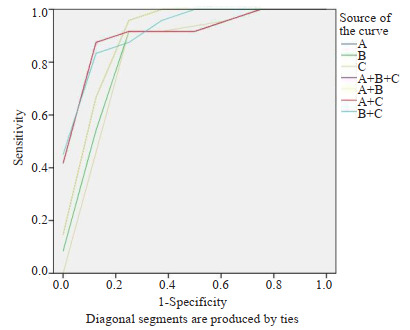
严重程度、范围、比率单项及联合分析对轻度认知障碍诊断的ROC曲线
ROC curve of single and joint analysis of the severity, range, and ratio for diagnosis of mild cognitive impairment.
3.
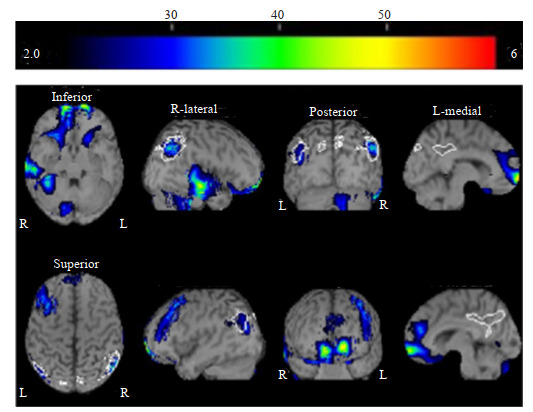
一例49岁男性患者,临床诊断AD源性轻度认知障碍
An eZIS image of a 49-year-old man with mild cognitive impairment caused by Alzheimer's disease. His total Mini Mental State Examination (MMSE) score was 25 (high school education level). The values for severity, range, and ratio were 1.74, 25.83%, and 3.25 times, respectively. Decreased rCBF was identified in the bilateral parietal association cortices, bilateral prefrontal lobe and part of the right temporal lobe.
4.
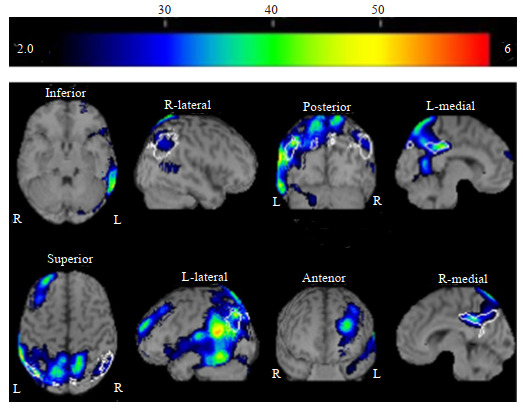
一例55岁女性患者,临床诊断AD痴呆阶段
An eZIS image of a 55-year-old woman with Alzheimer's disease. Her total Mini Mental State Examination (MMSE) score was 8 (primary school education). The values for severity, range, and ratio were 2.52, 61.88%, and 5.03 times, respectively. A significant rCBF decrease was found in an area extending from the posterior cingulate cortex to the precuneus, the bilateral parietal association cortices and the left temporal lobe.
3. 讨论
随着我国人口老龄化的加剧,阿尔茨海默病的发病率逐渐升高,在我国进行的一项城乡人群调查中显示,65岁以上的人群痴呆患病率可达5.14%,而AD的患病率占痴呆总数的62%[16]。轻度认知障碍(MCI)是老年人出现轻度记忆或认知障碍,介于正常老化和早期痴呆之间,但未达到痴呆的诊断标准[17]。2011版NIA-AA诊断标准将AD视为包括MCI在内的连续的疾病过程[10],有流行病学调查显示,每年有10%~15%MCI人群进展为AD[18, 19]。因此,早期识别AD源性的MCI对疾病的早期诊断和干预有着重要意义。
典型早期AD脑血流灌注SPECT会出现双侧楔前叶、后扣带回及顶叶联合区rCBF的降低,可呈不对称性。有研究发现,由于在平静状态下的正常人中,后扣带回的代谢活动与初级视觉皮层的代谢活动一样高,因此很难通过视觉来区分早期AD患者这一区域的改变[20]。简易Z-Score成像系统(eZIS)作为一种影像分析方法,可根据Z分数检定进行统计处理,在临床上的实用度较高。即使不同个体间的脑血流会存在一些生理学变化,而可能使统计的敏感度降低,但在分析时会使特异度增高[13]。通过将早期AD rCBF降低的特定区域合并到eZIS中,并作为感兴趣体积(VOI)获得指标值,并根据指标截值客观地进行早期AD诊断。虽然缺乏最后的病理来证实eZIS的诊断结果,但已有学者应用一种Aβ-PET显像即11C-PiB PET对eZIS-SPECT显像的结果进行了验证,他们在eZIS指标值异常的患者中发现了中度到最高程度的淀粉样蛋白沉积,这也间接地证明了eZIS诊断的准确性[21]。至今,SPECT影像的eZIS分析因其优于视觉分析[20-23],已被作为AD的早期诊断方法应用于临床。
此外,eZIS在AD以外的神经系统疾病方面也具有一定的应用价值,Waragai等[20]应用eZIS-SPECT对路易体痴呆、额颞叶痴呆、特发性帕金森病、血管性帕金森综合征、小脑型多系统性萎缩、皮质小脑萎缩和肌萎缩侧索硬化症的图像进行研究,他们发现了每种疾病的特异性rCBF降低模式,虽然所研究病例数量较少,但也为复杂的神经系统疾病诊断提供了影像学参考。eZIS的另一大优势就是可实现数据共享。该程序利用Hoffman三维脑模来获得校正因子,进而调整SPECT扫描仪之间的系统差异,目前从同一脑模SPECT图像获得的转换图的使用可提供非常相似的SPECT数据[24]。在不同扫描仪间对这些SPECT图像进行比较分析时,SPM证明了这种转换的适当的有效性[22]。但也有学者[13]认为尽管eZIS在实现正常数据库共享方面是有实用价值的,但考虑不同机构的SPECT扫描仪参数、准直器、散射和衰减校正算法之间存在较大差异,eZIS进行仪器间校正可能不够精准,未来可能需进一步改良。
MMSE量表因其敏感性强、易操作等特点,是国内外最常用的痴呆筛查量表[25],主要用于AD初步筛查和判断痴呆严重程度[26]。从本研究也可以看出,随着认知障碍的加重,MMSE分数也随之下降。有研究证实,18FFDG PET和SPECT血流灌注显像于AD早期发现后扣带回皮质和楔前叶的低代谢和低灌注,随着疾病的进展,后出现双侧、多不对称的后颞顶联合区的低代谢和低灌注,病程晚期额叶也会受到影响[27]。本次研究发现,早期AD患者的eZIS指标值较正常人增高,说明eZIS可对VOI区域的血流灌注降低情况进行数值化显示。
当本研究应用Matsuda等[7]提出的严重程度、范围、比率的指标截值对早期AD患者与正常老年人进行区分时,ROC分析显示Az值分别为0.911、0.854和0.833,这与Matsuda等[7]的研究结果——0.924、0.934和0.862相似。同时,我们发现AD患者的严重程度和范围这两个数值较MCI患者增加,这在一定程度上说明eZIS的这2个指标值可反映AD病情的进展,较多纵向研究发现,在转化为AD的MCI患者中,顶颞叶、后扣带区、楔前叶的18F-FDG摄取或脑血流灌注低于未转化的MCI患者[28-30],这些变化对AD具有较高的预测价值。考虑到本研究病例数较少,因此未对MCI和AD的指标截值进行分析,未来可纳入更多的病例对MCI转换进行预测研究。在MCI和AD患者中,比率数值未见明显差异,我们考虑这是因为比率反映的是VOI中rCBF降低相对于全脑rCBF降低的特异性,可能有助于AD与其他神经系统疾病的鉴别[14],已有研究人员发现可应用比率对AD和血管性痴呆进行区分[8]。
此外,我们发现比率的早期AD诊断能力较差,这与其他学者的研究结果相一致[7, 8, 31],但我们的研究结果表明严重程度的诊断能力略强于范围,这与以前提出范围的鉴别力略高于严重程度[31]不一致。我们考虑这可能与本研究样本量较少、研究人群以及诊断方法不同有关,之前的研究学者采用的是NINCDS-ADRDA诊断标准。Ishii等[8]提出,在缺血性疾病中,rCBF降低区域的扩大会导致局部血流显著降低,而在功能性疾病中严重程度的增加很少见,这可能是解释在评估功能性疾病时,rCBF降低区域的范围比严重程度鉴别能力更高的原因。
本次我们开展了先前未进行过的研究,即探讨3个指标值联合分析的诊断价值。我们的结果首次表明,在区别MCI、AD患者与健康人的能力方面,不同组合的联合分析均强于单项分析,其中范围、比率联合分析的鉴别能力较强。目前我们建议,临床应用时可进行联合分析诊断,尤其是范围、比率联合分析。但考虑到本研究样本量较少,且未有其他学者开展相关研究,因此结果尚需经大量的临床实践进一步验证。
Ishii等[8]发现了不同的情况,但他们使用Matsuda等[7]提出的指标截值时,计算出的灵敏度和特异度均较低,而适当的降低或增高数值,会获得更高的灵敏度和特异度。他们提出了一些造成这些现象的原因:可能涉及检查机构之间的差异,虽然eZIS具有能在不同准直器之间转换SPECT图像,并共享正常数据库的能力,但他们认为这仍不足够,当他们使用这个转换方案和正常数据库时,发现在脑内某些区域会有提高Z分值的趋势;脑模图像和患者脑灌注SPECT图像之间的数据处理不同,以及由于Talairach脑模与eZIS对照数据库中的日本人的脑形态不同,对脑形态的标准化不够。因此他们提出,每个机构都需要设置自己的截值,减少eZIS中的假阳性,补偿机构之间的差异,并改进脑形态学的标准化。由于本研究所得初步结果与Matsuda等[7]相近,并且病例数较少,所以并未开展设置新截值的研究,这也是未来研究方向之一。
本研究存在以下不足:(1)纳入病例数较少,统计结果可能存在一定偏倚,需要进一步扩大样本量证实本研究的初步结论,同时,eZIS在正常数据库的通用化方面,设置了不同SPECT仪器间的影响转换程序[32],因此将来可通过共享eZIS中的正常数据库,开展不同机器及不同机构间的多中心合作研究[20, 33];(2)本文为横断面研究,并未追踪MCI患者的临床转归,因为MCI具有临床异质性,一项Meta分析显示[34],有20~40%的MCI患者最终未转换为AD,他们可能进展为其他类型的痴呆,或者保持MCI状态稳定,部分甚至恢复正常;(3)本研究未将路易体痴呆(DLB)完全排除,DLB是仅次于AD的老年人较常见痴呆类型[35],DLB与AD都可出现认知障碍,当DLB患者枕叶rCBF下降不明显时,两者鉴别诊断并非易事[20],因为有报道称在DLB患者的后扣带回、楔前叶可观察到rCBF的下降[36, 37],因此不能完全排除DLB病例可能;(4)MMSE量表因简单易行,是临床上应用最多的量表,但同时存在一定的缺点,如受教育程度、语言等干扰因素的影响,有假阳性、假阴性的可能[38],有荟萃分析发现其鉴别正常老人和MCI的敏感度和特异度并不高,分别仅为63.4%和65.4%[39],因此未来需要更精确的临床量表进行评估。
综上所述,应用eZIS中的严重程度、范围、比率3个指标值对早期阿尔茨海默病患者和健康人进行脑血流灌注SPECT自动化分析,结果显示eZIS在阿尔茨海默病的早期诊断方面具有较高的临床应用价值。
致谢
作者感谢洪光威教授对本研究提供的eZIS技术建议和支持!
Biography
王思飞,在读硕士研究生,E-mail: 2940069544@qq.com
Funding Statement
南方医科大学南方医院院长基金(2017C052和2019Z027)
Contributor Information
王 思飞 (Sifei WANG), Email: 2940069544@qq.com.
李 贵平 (Guiping LI), Email: Ligp62@126.com.
References
- 1.Patterson C. World Alzheimer Report 2018: The state of the art of dementia research: New frontiers[C]. Alzheimer's Disease International (ADI): London, UK, 2018.
- 2.孙 梦莎, 顾 鸣敏. 阿尔茨海默病早期诊断研究进展. 中国现代神经疾病杂志. 2018;18(3):213–21. doi: 10.3969/j.issn.1672-6731.2018.03.011. [孙梦莎, 顾鸣敏. 阿尔茨海默病早期诊断研究进展[J]. 中国现代神经疾病杂志, 2018, 18(3): 213-21.] [DOI] [Google Scholar]
- 3.郭 佳, 尹 雅芙, 李 亚明. SPECT脑血流灌注显像在脑功能研究中的应用进展. 中国临床医学影像杂志. 2010;21(8):563–6. doi: 10.3969/j.issn.1008-1062.2010.08.010. [郭佳, 尹雅芙, 李亚明. SPECT脑血流灌注显像在脑功能研究中的应用进展[J]. 中国临床医学影像杂志, 2010, 21(8): 563-6.] [DOI] [Google Scholar]
- 4.杨 淑贞, 朱 传明, 刘 婷婷, et al. SPECT/CT脑血流灌注显像两种半定量分析法诊断缺血性脑病价值比较. https://www.cnki.com.cn/Article/CJFDTOTAL-RMJZ201503045.htm. 人民军医. 2015;58(3):303–4, 313. [杨淑贞, 朱传明, 刘婷婷, 等. SPECT/CT脑血流灌注显像两种半定量分析法诊断缺血性脑病价值比较[J]. 人民军医, 2015, 58(3): 303-4, 313.] [Google Scholar]
- 5.Kanetaka H, Matsuda H, Asada T, et al. Effects of partial volume correction on discrimination between very early Alzheimer's dementia and controls using brain perfusion SPECT. http://europepmc.org/abstract/MED/14991240. Eur J Nucl Med Mol Imaging. 2004;31(7):975–80. doi: 10.1007/s00259-004-1491-3. [Kanetaka H, Matsuda H, Asada T, et al. Effects of partial volume correction on discrimination between very early Alzheimer's dementia and controls using brain perfusion SPECT[J]. Eur J Nucl Med Mol Imaging, 2004, 31(7): 975-80.] [DOI] [PubMed] [Google Scholar]
- 6.Matsuda H, Mizumura S, Nagao T, et al. An easy Z-score imaging system for discrimination between very early Alzheimer's disease and controls using brain perfusion SPECT in a multicentre study. Nucl Med Commun. 2007;28(3):199–205. doi: 10.1097/MNM.0b013e328013eb8b. [Matsuda H, Mizumura S, Nagao T, et al. An easy Z-score imaging system for discrimination between very early Alzheimer's disease and controls using brain perfusion SPECT in a multicentre study[J]. Nucl Med Commun, 2007, 28(3): 199-205.] [DOI] [PubMed] [Google Scholar]
- 7.Matsuda H, Mizumura S, Nagao T, et al. Automated discrimination between very early Alzheimer disease and controls using an easy Zscore imaging system for multicenter brain perfusion single-photon emission tomography. http://www.ncbi.nlm.nih.gov/pubmed/17416830. AJNR Am J Neuroradiol. 2007;28(4):731–6. [Matsuda H, Mizumura S, Nagao T, et al. Automated discrimination between very early Alzheimer disease and controls using an easy Zscore imaging system for multicenter brain perfusion single-photon emission tomography[J]. AJNR Am J Neuroradiol, 2007, 28(4): 731-6.] [PMC free article] [PubMed] [Google Scholar]
- 8.Ishii S, Shishido F, Miyajima M, et al. Comparison of Alzheimer's disease with vascular dementia and non-dementia using specific voxel-based Z score maps. Ann Nucl Med. 2009;23(1):25–31. doi: 10.1007/s12149-008-0210-8. [Ishii S, Shishido F, Miyajima M, et al. Comparison of Alzheimer's disease with vascular dementia and non-dementia using specific voxel-based Z score maps[J]. Ann Nucl Med, 2009, 23(1): 25-31.] [DOI] [PubMed] [Google Scholar]
- 9.中国痴呆与认知障碍写作组, 中国医师协会神经内科医师分会认知 障碍疾病专业委员会. 2018中国痴呆与认知障碍诊治指南(二): 阿尔茨海默病诊治指南. 中华医学杂志. 2018;98(13):971–7. doi: 10.3760/cma.j.issn.0376-2491.2018.13.004. [中国痴呆与认知障碍写作组, 中国医师协会神经内科医师分会认知障碍疾病专业委员会. 2018中国痴呆与认知障碍诊治指南(二): 阿尔茨海默病诊治指南[J]. 中华医学杂志, 2018, 98(13): 971-7.] [DOI] [Google Scholar]
- 10.McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer's disease: recommendations from the national institute on aging-Alzheimer's association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011;7(3):263–9. doi: 10.1016/j.jalz.2011.03.005. [McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer's disease: recommendations from the national institute on aging-Alzheimer's association workgroups on diagnostic guidelines for Alzheimer's disease[J]. Alzheimers Dement, 2011, 7(3): 263-9.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.苏 梅蕾, 洪 军, 池 晓华, et al. 孤独症患儿SPECT脑血流灌注显像的研究. 新医学. 2012;43(12):850–4. doi: 10.3969/g.issn.0253-9802.2012.12.007. [苏梅蕾, 洪军, 池晓华, 等. 孤独症患儿SPECT脑血流灌注显像的研究[J]. 新医学, 2012, 43(12): 850-4.] [DOI] [Google Scholar]
- 12.张 海敏, 陈 盛祖. 一种新的脑功能显像分析法: 统计参数图(SPM) 中国医学影像技术. 2002;18(7):711–3. doi: 10.3321/j.issn:1003-3289.2002.07.038. [张海敏, 陈盛祖. 一种新的脑功能显像分析法: 统计参数图(SPM)[J]. 中国医学影像技术, 2002, 18(7): 711-3.] [DOI] [Google Scholar]
- 13.西村 恒彦, 畑 泽顺, 松田 博史. 脑SPECT/PET的临床探索. 中国台湾: 枫书坊文化出版社; 2016. pp. 38–9. [西村恒彦, 畑泽顺, 松田博史. 脑SPECT/PET的临床探索[M]. 中国台湾. 枫书坊文化出版社, 2016, 38-9.] [Google Scholar]
- 14.Takemaru M, Kimura N, Abe Y, et al. The evaluation of brain perfusion SPECT using an easy Z-score imaging system in the mild cognitive impairment subjects with brain amyloid-β deposition. Clin Neurol Neurosurg. 2017;160:111–5. doi: 10.1016/j.clineuro.2017.06.018. [Takemaru M, Kimura N, Abe Y, et al. The evaluation of brain perfusion SPECT using an easy Z-score imaging system in the mild cognitive impairment subjects with brain amyloid-β deposition[J]. Clin Neurol Neurosurg, 2017, 160: 111-5.] [DOI] [PubMed] [Google Scholar]
- 15.Mizumura S, Kumita S. Stereotactic statistical imaging analysis of the brain using the easy Z-score imaging system for sharing a normal database. Radiat Med. 2006;24(7):545–52. doi: 10.1007/s11604-006-0056-8. [Mizumura S, Kumita S. Stereotactic statistical imaging analysis of the brain using the easy Z-score imaging system for sharing a normal database[J]. Radiat Med, 2006, 24(7): 545-52.] [DOI] [PubMed] [Google Scholar]
- 16.Jia J, Wang F, Wei C, et al. The prevalence of dementia in urban and rural areas of China. Alzheimers Dement. 2014;10(1):1–9. doi: 10.1016/j.jalz.2013.01.012. [Jia J, Wang F, Wei C, et al. The prevalence of dementia in urban and rural areas of China[J]. Alzheimers Dement, 2014, 10(1): 1-9.] [DOI] [PubMed] [Google Scholar]
- 17.黄 蕊, 华 学思, 张 兰. 影像学技术应用于阿尔茨海默病早期诊断的研究进展. 中国康复理论与实践. 2017;23(5):534–8. doi: 10.3969/j.issn.1006-9771.2017.05.009. [黄蕊, 华学思, 张兰. 影像学技术应用于阿尔茨海默病早期诊断的研究进展[J]. 中国康复理论与实践, 2017, 23(5): 534-8.] [DOI] [Google Scholar]
- 18.Ganguli M, Dodge HH, Shen C, et al. Mild cognitive impairment, amnestic type: an epidemiologic study. Neurology. 2004;63(1):115–21. doi: 10.1212/01.WNL.0000132523.27540.81. [Ganguli M, Dodge HH, Shen C, et al. Mild cognitive impairment, amnestic type: an epidemiologic study[J]. Neurology, 2004, 63(1): 115-21.] [DOI] [PubMed] [Google Scholar]
- 19.Ward A, Tardiff S, Dye C, et al. Rate of conversion from prodromal Alzheimer's disease to Alzheimer's dementia: a systematic review of the literature. Dement Geriatr Cogn Dis Extra. 2013;3(1):320–32. doi: 10.1159/000354370. [Ward A, Tardiff S, Dye C, et al. Rate of conversion from prodromal Alzheimer's disease to Alzheimer's dementia: a systematic review of the literature[J]. Dement Geriatr Cogn Dis Extra, 2013, 3(1): 320-32.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Waragai M, Yamada T, Matsuda H. Evaluation of brain perfusion SPECT using an easy Z-score imaging system (eZIS) as an adjunct to early-diagnosis of neurodegenerative diseases. J Neurol Sci. 2007;260(1-2):57–64. doi: 10.1016/j.jns.2007.03.027. [Waragai M, Yamada T, Matsuda H. Evaluation of brain perfusion SPECT using an easy Z-score imaging system (eZIS) as an adjunct to early-diagnosis of neurodegenerative diseases[J]. J Neurol Sci, 2007, 260(1-2): 57-64.] [DOI] [PubMed] [Google Scholar]
- 21.Yokoyama S, Kajiya Y, Yoshinaga T, et al. Imaging discrepancies between magnetic resonance imaging and brain perfusion singlephoton emission computed tomography in the diagnosis of Alzheimer's disease, and verification with amyloid positron emission tomography. Psychogeriatrics. 2014;14(2):110–7. doi: 10.1111/psyg.12047. [Yokoyama S, Kajiya Y, Yoshinaga T, et al. Imaging discrepancies between magnetic resonance imaging and brain perfusion singlephoton emission computed tomography in the diagnosis of Alzheimer's disease, and verification with amyloid positron emission tomography[J]. Psychogeriatrics, 2014, 14(2): 110-7.] [DOI] [PubMed] [Google Scholar]
- 22.Matsuda H, Mizumura S, Soma T, et al. Conversion of brain SPECT images between different collimators and reconstruction processes for analysis using statistical parametric mapping. Nucl Med Commun. 2004;25:67–74. doi: 10.1097/00006231-200401000-00010. [Matsuda H, Mizumura S, Soma T, et al. Conversion of brain SPECT images between different collimators and reconstruction processes for analysis using statistical parametric mapping[J]. Nucl Med Commun, 2004, 25: 67-74.] [DOI] [PubMed] [Google Scholar]
- 23.Imabayashi E, Matsuda H, Asada T, et al. Superiority of 3-dimensional stereotactic surface projection analysis over visual inspection in discrimination of patients with very early Alzheimer's disease from controls using brain perfusion SPECT. http://www.ncbi.nlm.nih.gov/pubmed/15347711. J Nucl Med. 2004;45(9):1450–7. [Imabayashi E, Matsuda H, Asada T, et al. Superiority of 3-dimensional stereotactic surface projection analysis over visual inspection in discrimination of patients with very early Alzheimer's disease from controls using brain perfusion SPECT[J]. J Nucl Med, 2004, 45(9): 1450-7.] [PubMed] [Google Scholar]
- 24.Matsuda H. The role of neuroimaging in mild cognitive impairment. Neuropathology. 2007;27(6):570–7. doi: 10.1111/j.1440-1789.2007.00794.x. [Matsuda H. The role of neuroimaging in mild cognitive impairment [J]. Neuropathology, 2007, 27(6): 570-7.] [DOI] [PubMed] [Google Scholar]
- 25.闵 宝权, 贾 建平. 认知功能检查量表在老年期痴呆诊断中的应用. https://www.cnki.com.cn/Article/CJFDTOTAL-XDKF200410081.htm. 中国临床康复. 2004;10:1938–40. [闵宝权, 贾建平. 认知功能检查量表在老年期痴呆诊断中的应用[J]. 中国临床康复, 2004, 10: 1938-40.] [Google Scholar]
- 26.段 晓宇, 江 新梅. HDS、MMSE、BBS在痴呆筛查中的应用. 中风与神经疾病杂志. 2002;19(3):167–8. doi: 10.3969/j.issn.1003-2754.2002.03.015. [段晓宇, 江新梅. HDS、MMSE、BBS在痴呆筛查中的应用[J]. 中风与神经疾病杂志, 2002, 19(3): 167-8.] [DOI] [Google Scholar]
- 27.Valotassiou V, Malamitsi J, Papatriantafyllou J, et al. SPECT and PET imaging in Alzheimer's disease. Ann Nucl Med. 2018;32(9):583–93. doi: 10.1007/s12149-018-1292-6. [Valotassiou V, Malamitsi J, Papatriantafyllou J, et al. SPECT and PET imaging in Alzheimer's disease[J]. Ann Nucl Med, 2018, 32(9): 583-93.] [DOI] [PubMed] [Google Scholar]
- 28.Pagani M, Nobili F, Morbelli S, et al. Early identification of MCI converting to AD: a FDG PET study. Eur J Nucl Med Mol Imaging. 2017;44(12):2042–52. doi: 10.1007/s00259-017-3761-x. [Pagani M, Nobili F, Morbelli S, et al. Early identification of MCI converting to AD: a FDG PET study[J]. Eur J Nucl Med Mol Imaging, 2017, 44(12): 2042-52.] [DOI] [PubMed] [Google Scholar]
- 29.Hanyu H, Sato T, Hirao, K, et al. The progression of cognitive deterioration and regional cerebral blood flow patterns in Alzheimer's disease: A longitudinal SPECT study. J Neurol Sci. 2010;290(1-2):96–101. doi: 10.1016/j.jns.2009.10.022. [Hanyu H, Sato T, Hirao, K, et al. The progression of cognitive deterioration and regional cerebral blood flow patterns in Alzheimer's disease: A longitudinal SPECT study[J]. J Neurol Sci, 2010, 290(1-2): 96-101.] [DOI] [PubMed] [Google Scholar]
- 30.Hirao K, Ohnishi T, Hirata Y, et al. The prediction of rapid conversion to Alzheimer's disease in mild cognitive impairment using regional cerebral blood flow SPECT. Neuroimage. 2005;28(4):1014–21. doi: 10.1016/j.neuroimage.2005.06.066. [Hirao K, Ohnishi T, Hirata Y, et al. The prediction of rapid conversion to Alzheimer's disease in mild cognitive impairment using regional cerebral blood flow SPECT[J]. Neuroimage, 2005, 28 (4): 1014-21.] [DOI] [PubMed] [Google Scholar]
- 31.Mizumura S, Kumita S, Cho K, et al. Development of quantitative analysis method for stereotactic brain image: assessment of reduced accumulation in extent and severity using anatomical segmentation. Ann Nucl Med. 2003;17(4):289–95. doi: 10.1007/BF02988523. [Mizumura S, Kumita S, Cho K, et al. Development of quantitative analysis method for stereotactic brain image: assessment of reduced accumulation in extent and severity using anatomical segmentation [J]. Ann Nucl Med, 2003, 17(4): 289-95.] [DOI] [PubMed] [Google Scholar]
- 32.Yokogami K, Kawano H, Moriyama T, et al. Application of SPET using technetium-99m sestamibi in brain tumours and comparison with expression of the MDR-1 gene: is it possible to predict the response to chemotherapy in patients with gliomas by means of 99mTcsestamibi SPET? Eur J Nucl Med. 1998;25(4):401–9. doi: 10.1007/s002590050238. [Yokogami K, Kawano H, Moriyama T, et al. Application of SPET using technetium-99m sestamibi in brain tumours and comparison with expression of the MDR-1 gene: is it possible to predict the response to chemotherapy in patients with gliomas by means of 99mTcsestamibi SPET[J]? Eur J Nucl Med, 1998, 25(4): 401-9.] [DOI] [PubMed] [Google Scholar]
- 33.Kanetaka H, Matsuda H, Asada T, et al. Effects of partial volume correction on discrimination between very early Alzheimer's dementia and controls using brain perfusion SPECT. http://europepmc.org/abstract/MED/14991240. Eur J Nucl Med Mol Imaging. 2004;31(7):975–80. doi: 10.1007/s00259-004-1491-3. [Kanetaka H, Matsuda H, Asada T, et al. Effects of partial volume correction on discrimination between very early Alzheimer's dementia and controls using brain perfusion SPECT[J]. Eur J Nucl Med Mol Imaging, 2004, 31(7): 975-80.] [DOI] [PubMed] [Google Scholar]
- 34.Mitchell AJ, Shiri-Feshki M. Rate of progression of mild cognitive impairment to dementia: meta-analysis of 41 robust inception cohort studies. Acta Psychiatr Scand. 2009;119(4):252–65. doi: 10.1111/j.1600-0447.2008.01326.x. [Mitchell AJ, Shiri-Feshki M. Rate of progression of mild cognitive impairment to dementia: meta-analysis of 41 robust inception cohort studies[J]. Acta Psychiatr Scand, 2009, 119(4): 252-65.] [DOI] [PubMed] [Google Scholar]
- 35.李 延峰, 纪 勇, 李 晓光, et al. 路易体痴呆诊治中国专家共识. 中华老年医学杂志. 2015;34(4):339–44. doi: 10.3760/cma.j.issn.0254-9026.2015.04.001. [李延峰, 纪勇, 李晓光, 等. 路易体痴呆诊治中国专家共识[J]. 中华老年医学杂志, 2015, 34(4): 339-44.] [DOI] [Google Scholar]
- 36.Minoshima S, Foster NL, Sima AA, et al. Alzheimer's disease versus dementia with Lewy bodies: cerebral metabolic distinction with autopsy confirmation. Ann Neurol. 2001;50:358–65. doi: 10.1002/ana.1133. [Minoshima S, Foster NL, Sima AA, et al. Alzheimer's disease versus dementia with Lewy bodies: cerebral metabolic distinction with autopsy confirmation[J]. Ann Neurol, 2001, 50: 358-65.] [DOI] [PubMed] [Google Scholar]
- 37.Shimizu S, Hanyu H, Kanetaka H, et al. Differentiation of dementia with Lewy bodies from Alzheimer's disease using brain SPECT. Dement Geriatr Cogn Disord. 2005;20(1):25–30. doi: 10.1159/000085070. [Shimizu S, Hanyu H, Kanetaka H, et al. Differentiation of dementia with Lewy bodies from Alzheimer's disease using brain SPECT[J]. Dement Geriatr Cogn Disord, 2005, 20(1): 25-30.] [DOI] [PubMed] [Google Scholar]
- 38.Roselli F, Tartaglione B, Federico F, et al. Rate of MMSE score change in Alzheimer's disease: influence of education and vascular risk factors. Clin Neurol Neurosurg. 2009;111(4):327–30. doi: 10.1016/j.clineuro.2008.10.006. [Roselli F, Tartaglione B, Federico F, et al. Rate of MMSE score change in Alzheimer's disease: influence of education and vascular risk factors[J]. Clin Neurol Neurosurg, 2009, 111(4): 327-30.] [DOI] [PubMed] [Google Scholar]
- 39.Mitchell A. A meta-analysis of the accuracy of the mini-mental state examination in the detection of dementia and mild cognitive impairment. Psychiatr Res. 2009;43(4):411–31. doi: 10.1016/j.jpsychires.2008.04.014. [Mitchell A. A meta-analysis of the accuracy of the mini-mental state examination in the detection of dementia and mild cognitive impairment[J]. Psychiatr Res, 2009, 43(4): 411-31.] [DOI] [PubMed] [Google Scholar]


