Abstract
目的
采用交联技术制备鱼鳔膜材料,检测其理化性能及细胞毒性。
方法
取鱼鳔经脱细胞处理后随机分为两组,交联组采用碳二亚胺[1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC]/N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)法交联处理后,行表面制孔及冻干处理;未交联组仅行表面制孔及冻干处理。观测两组材料理化性能,包括扫描电镜观察微观结构,电子万能材料试验机测试力学性能(拉伸强度及断裂伸长率),接触角测量仪检测材料亲水性,乙醇浸润法测定材料孔隙率,体外降解性能及热稳定性检测,以及红外光谱分析支架成分。取小鼠成纤维细胞 L929 与两组材料浸提液培养,细胞检测试剂盒 8(cell counting kit 8,CCK-8)测定细胞毒性。
结果
扫描电镜观测两组支架均具有多孔结构,且表面粗糙。与未交联组相比,交联组材料拉伸强度明显增高、断裂伸长率降低、孔隙率增大,差异有统计学意义(P<0.05);接触角差异无统计学意义(P>0.05)。两组材料降解趋势一致,最初 7 d 内降解较快,之后趋于平缓;各时间点交联组降解率低于未交联组,差异均有统计学意义(P<0.05)。差示扫描量热法检测显示,交联组材料变性温度为(75.2±1.3)℃,高于未交联组的(68.5±0.4)℃,差异有统计学意义(t=4.586,P=0.002)。红外光谱分析,与未交联组相比,交联组生成了酰胺键中新的 C=O 键和 N-H 键,并且未引入其他新的基团。CCK-8 法检测示,交联组及未交联组 A 值与阳性对照组比较,差异均无统计学意义(P>0.05)。
结论
经 EDC/NHS 法交联处理获得的鱼鳔膜材料具有优良的理化性能,无细胞毒性,有望作为硬膜修复材料。
Keywords: 鱼鳔膜, 交联, 理化性能, 硬膜修复
Abstract
Objective
To manufacture fish swim bladder membrane material by crosslinking techniques, and to explore its physical and chemical properties and cytotoxicity.
Methods
After decellularization, the swim bladders were randomly divided into two groups. The swim bladders were treated with 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC)/N-hydroxysuccinimide (NHS) crosslinking method, surface hole making, and freeze-drying in crosslinking group, and only surface hole making and freeze-drying in non-crosslinking group. The physical and chemical properties of the materials were observed, including microstructure by scanning electron microscopy (SEM), mechanical properties (tensile strength and breaking elongation) by universal tensile machine, hydrophilicity by contact angle measuring instrument, porosity by ethanol infiltration method, degradation performance in vitro and thermal stability test, and the components of materials by infrared spectrum analysis. Mouse fibroblasts (L929) were cultured with the extracts of two groups of materials in order to determine the cytotoxicity of materials by using cell counting kit 8 (CCK-8) method.
Results
The porous structure and rough surface of materials were observed by SEM. Compared with the non-crosslinking group, the tensile stress of the crosslinking group was higher, the breaking elongation was lower, and the porosity increased, showing significant differences (P<0.05). There was no significant difference in contact angle between the two groups (P>0.05). The degradation was faster within the first 7 days and then tended to be smooth in the two groups. But the degradation rates of crosslinking group were significantly lower than those of non-crosslinking group (P<0.05). Differential scanning calorimeter showed that the denaturation temperature of the crosslinking group was (75.2±1.3)℃, which was significantly higher than that of the non-crosslinking group [(68.5±0.4)℃] (t=4.586, P=0.002). Compared with the non-crosslinking group, the crosslinking group produced new C=O bond and N-H bond, and no other new groups were introduced into the cross-linking group. CCK-8 method showed that the absorbance values of the crosslinking group and the non-crosslinking group were not significant when compared with the positive control group (P>0.05).
Conclusion
The fish swim bladder membrane obtained by crosslinking treatment with EDC/NHS method has good physical and chemical properties, no cytotoxicity, and is expected to be used as a dura mater repair material.
Keywords: Fish swim bladder membrane, crosslinking, physical and chemical properties, dura mater repair
硬膜破损是脊柱外科及神经外科手术常见并发症,发生率为 4%~17.4%[1]。如处理不当会导致脑脊液漏、脑膜炎、椎管或颅内感染,甚至死亡等严重并发症[2]。因此,术中及时发现并修复硬膜缺损十分重要。既往认为硬膜破损后不具备再生性[3],但近年研究发现硬膜破损后可以修复,主要修复机制为缺损边缘的成纤维细胞迁徙以及增殖分泌Ⅰ型胶原,但该修复过程缓慢[4]。体外实验证实,当有支架覆盖于缺损硬膜边缘时,成纤维细胞可生长、迁徙至支架材料中完成硬膜修复[5]。目前用于硬膜修复的材料大致分为自体组织、同种异体组织、合成材料、生物膜材料 4 种,这些材料存在生物相容性差、增加感染风险、机械性能不佳、改良工艺复杂等不足,限制了进一步应用研究[6]。
目前市售的硬膜修复材料天义福生物膜(天新福医疗器械有限公司)是牛或猪跟腱酶解后的Ⅰ型胶原提纯物。因酶解提纯破坏了Ⅰ型胶原结构,导致该修复材料力学性能差,抗缝合能力弱[7-8]。而且取材于哺乳动物(如猪、牛、羊)的材料,有潜在传播疾病风险[9]。鱼鳔主要成分为Ⅰ型胶原,与哺乳动物来源Ⅰ型胶原相比,鱼鳔具有变性温度高、密封性能好、生物相容性良好的优点[10-12]。而且鱼鳔来源于水生生物,相较于陆地生物污染小、安全性更高,迄今尚无鱼类病毒与人畜共患传播的报道。此外还可有效规避伊斯兰等地区使用猪相关产品的宗教壁垒问题[13]。而且鱼鳔获取方便、来源广泛,将其作为硬膜修复材料具有潜在应用前景。本研究我们拟利用交联方法改善鱼鳔性能,同时进行表面制孔,以期获得既能满足硬膜修复材料所需要的理化性质和生物相容性,又价格低廉、来源广泛的修复材料。
1. 材料与方法
1.1. 主要试剂及仪器
NaH2PO4、Na2HPO4、NaOH(成都市科龙化工试剂厂);Triton X-100、碳二亚胺[1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、2-(N-吗啡啉)乙磺酸[2-(N-morpholino)ethanesulfonic acid,MES](北京百灵威科技有限公司);上述试剂均为国产分析纯。细胞计数试剂盒 8(cell counting kit 8,CCK-8)试剂盒(同仁研究所,日本)。
FD-1A-80 冷冻干燥机 (北京博医康实验仪器有限公司);JSM-7500 扫描电镜(JEOL 公司,日本);电子游标卡尺(上海量具刃具厂);电子万能材料试验机(Instron 公司,美国);光学接触角测定仪(Dataphysics 公司,德国);Nicolet iS50 傅立叶变换红外光谱仪(Thermo Fisher 公司,美国);自动酶标检测仪(Sunrise 公司,澳大利亚)。
1.2. 实验方法
1.2.1. 鱼鳔脱细胞处理
本实验采用花鲢鱼鳔(花鲢鱼产自简阳三岔湖水库,体质量约 2.5 kg)。用 NaCl、NaH2PO4、Na2HPO4、NaOH 配制的 PBS 缓冲液(pH7.4)清洗鱼鳔表面纤维及血液、脂肪等组织,置于 1%Triton X-100 溶液中,常温避光放置 24 h 进行脱细胞处理。
1.2.2. 实验分组及方法
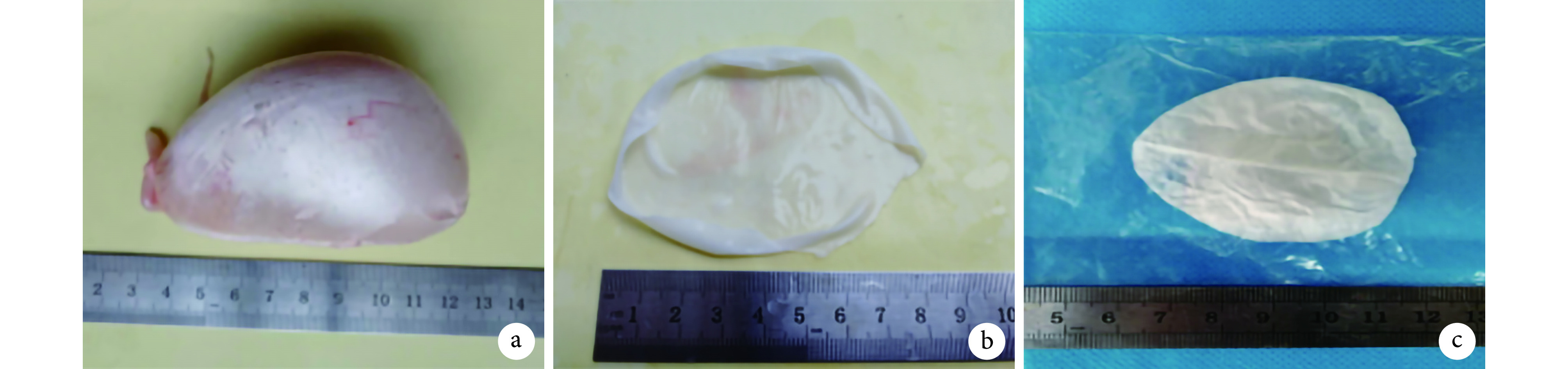
将脱细胞处理后的鱼鳔随机分为未交联组及交联组。交联组:首先采用 EDC/NHS 法进行交联处理。用 MES 缓冲液配制 EDC 与 NHS 摩尔比为 4∶1 的交联溶液,放入脱细胞鱼鳔,于常温避光放置 12 h 后取出;置于 PBS 溶液中,超声条件下反复清洗 3 次。然后进行表面制孔,将鱼鳔平铺于聚苯乙烯泡沫盒中,加入去离子水,用保鲜膜封住开口处,置于–20℃ 冰箱 1 d,取出室温下解冻。最后,置于冷冻干燥机冻干处理 3 d,取出后以环氧乙烷灭菌处理,常温下储存备用。见图 1。
图 1.
General observation on the preparation of the fish swim bladder membrane in crosslinking group
交联组鱼鳔膜制备大体观察
a. 新鲜鱼鳔;b. 交联后鱼鳔;c. 冻干后鱼鳔
a. Fresh swim bladder; b. After crosslinked; c. After freeze-dried
非交联组:除不作交联处理外,同交联组方法对鱼鳔进行表面制孔及冻干处理。
1.3. 观测指标
1.3.1. 理化性能检测
① 扫描电镜观察:将两组材料喷金后,置于扫描电镜下观察材料表面及断面的微观结构。同时,取未作表面制孔处理的交联鱼鳔观察,作为对照。
② 力学性能检测:用裁刀将两组材料裁成哑铃形,电子游标卡尺测量其中间部分宽度和厚度。然后,将哑铃形样品固定于电子万能材料试验机夹具上,以拉伸速率 100 mm/min 进行拉伸测试,直至断裂。记录拉伸强度和断裂伸长率。每组测试 5 个样品。
③ 亲水性及孔隙率测试:将两组材料制备成 1 cm×2 cm 大小后,将 1 μL 去离子水滴至样品上,采用光学接触角测定仪测量接触角。每组测试 5 个样品。
采用乙醇浸润法测定材料孔隙率。将两组材料制备成 1 cm×2 cm 大小,电子游标卡尺测量厚度。首先测定材料质量(W0),然后置于乙醇浸泡 10 min 后测量质量(W1)。按以下公式计算孔隙率:(W1-W0)/ρV,其中 V 为材料体积,ρ 为乙醇密度。每组测量 5 个样品。
④ 体外降解性能检测:称取两组材料质量(M0),然后置于 PBS 溶液(pH7.4)中,置于恒温水浴震荡箱中浸泡,分别于第 7、14、21、28 天取出材料(每个时间点每组各取 5 个样本),冻干后称取质量(M1)。按以下公式计算降解率:(M0-M1)/M0×100%。
⑤ 热稳定性检测:称取两组质量 3~5 mg 材料,采用差示扫描量热法测试材料热稳定性,检测材料变性温度。测试起始温度为 0℃,结束温度为 100℃,升温速率为 10 K/min。每组测量 5 个样品。
⑥ 红外光谱分析:为判断鱼鳔内部分子是否交联,以全反射模式进行红外光谱分析,观察其基团情况。为排除因鱼鳔厚度对结果的影响,实验均取来自同一个鱼鳔的两组样品(大小均为 10 mm×10 mm)夹在样品台上。
1.3.2. 细胞毒性检测
按照 4 cm2∶1 mL 比例,将两组材料分别加入含 10%FBS 的 H-DMEM 培养液,于 37℃、5%CO2 培养箱浸泡 24 h,取浸提液备用。取小鼠成纤维细胞 L929(四川大学华西医院移植免疫实验室提供),按 1×104个/孔密度接种至 96 孔板。于 37℃、5%CO2 培养箱培养,待细胞贴壁后分别加入交联组及非交联组材料浸提液,每孔 100 μL。另外,以单纯含 10%FBS 的 H-DMEM 培养液作为阳性对照,含 0.5% 苯酚的培养基作为阴性对照。于培养 24、48、72 h,各组取 5 孔,加入 10 μL CCK-8 溶液,继续孵育 4 h。于自动酶标检测仪测定 450 nm 处吸光度(A)值。
1.4. 统计学方法
采用 SPSS19.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. 扫描电镜观察
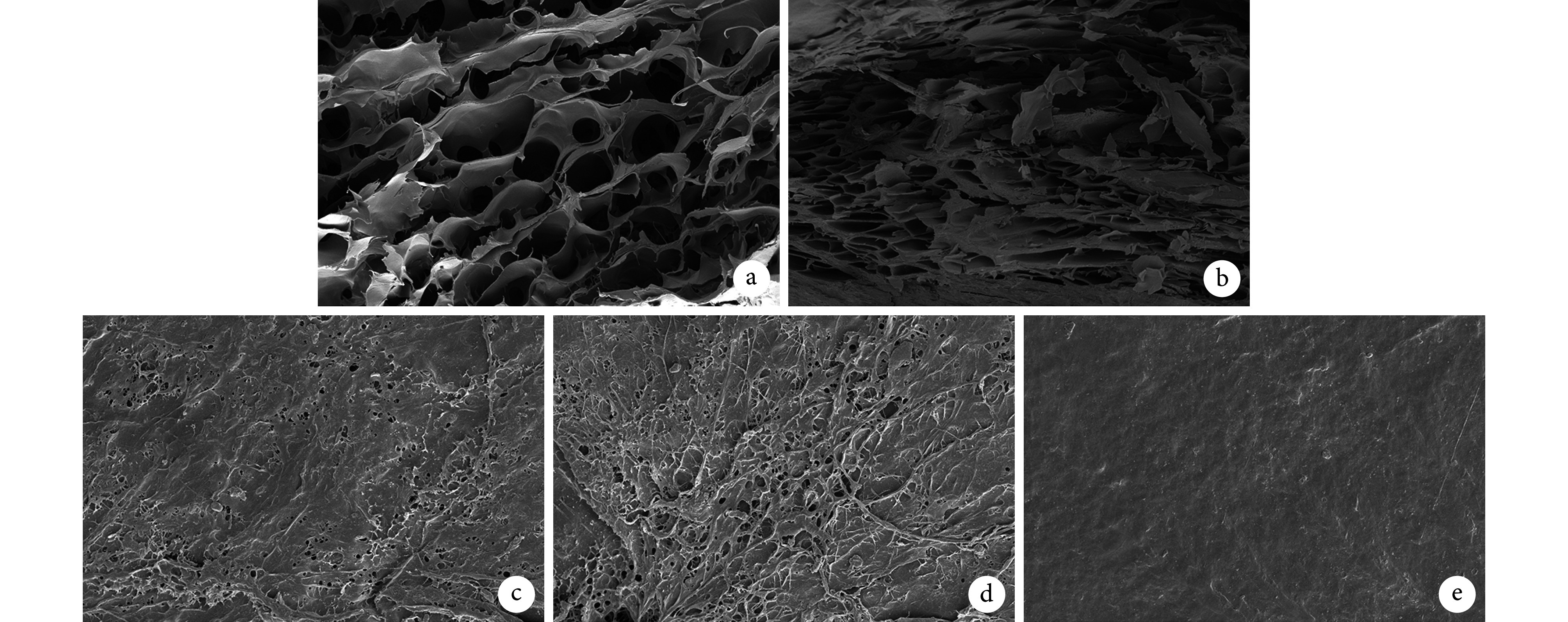
交联组和未交联组材料均可见断面疏松多孔结构;与未行表面制孔处理的交联组材料相比,其表面有凹凸不平的粗糙多孔结构,有利于成纤维细胞黏附生长。其中,交联组材料断面相对未交联组塌陷,但孔隙数量增加。见图 2。
图 2.
Scanning electron microscopy observation of each group
各组材料扫描电镜观察
a. 未交联组材料断面(×1 000);b. 交联组材料断面(×1 000);c. 未交联组材料表面(×3 000);d. 交联组材料表面(×3 000);e. 未行表面制孔的交联组材料表面(×3 000)
a. Cross section of material in non-crosslinking group (×1 000); b. Cross section of material in crosslinking group (×1 000); c. Surface of material in non-crosslinking group (×3 000); d. Surface of material in crosslinking group (×3 000); e. Surface of non-porous material in crosslinking group (×3 000)
2.2. 力学性能检测
交联组及未交联组拉伸强度分别为(15.91±1.52)、(12.25±1.59)MPa,断裂伸长率分别为 38.42%±2.89%、58.70%±2.10%。与未交联组相比,交联组拉伸强度明显增高,断裂伸长率明显降低,差异有统计学意义(t=3.389,P=0.028;t=9.280,P=0.001)。
2.3. 亲水性及孔隙率测试
交联组及未交联组接触角分别为(80.1±0.9)、(78.3±1.8)°,孔隙率分别 73.6%±2.8%、69.3%±1.2%。交联组接触角及孔隙率均大于未交联组,其中接触角组间差异无统计学意义(t=2.370,P=0.077),孔隙率差异有统计学意义(t=4.447,P=0.011)。
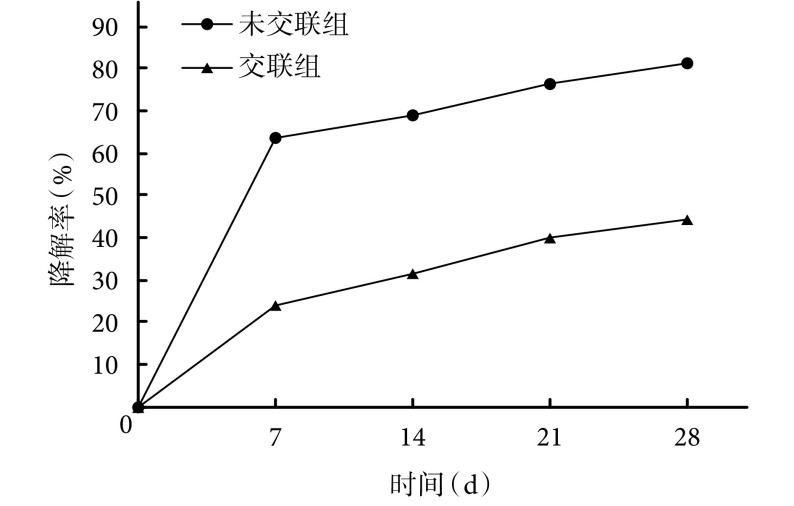
2.4. 体外降解性能及热稳定性检测
两组材料降解趋势一致,最初 7 d 内降解较快,之后趋于平缓。未交联组各时间点降解率均显著高于交联组,差异均有统计学意义(t=27.310,P=0.000;t=26.160,P=0.000;t=19.150,P=0.000;t=18.490,P=0.000)。见图 3。
图 3.
Comparison of degradation rates in vitrobetween the two groups
两组体外降解率比较
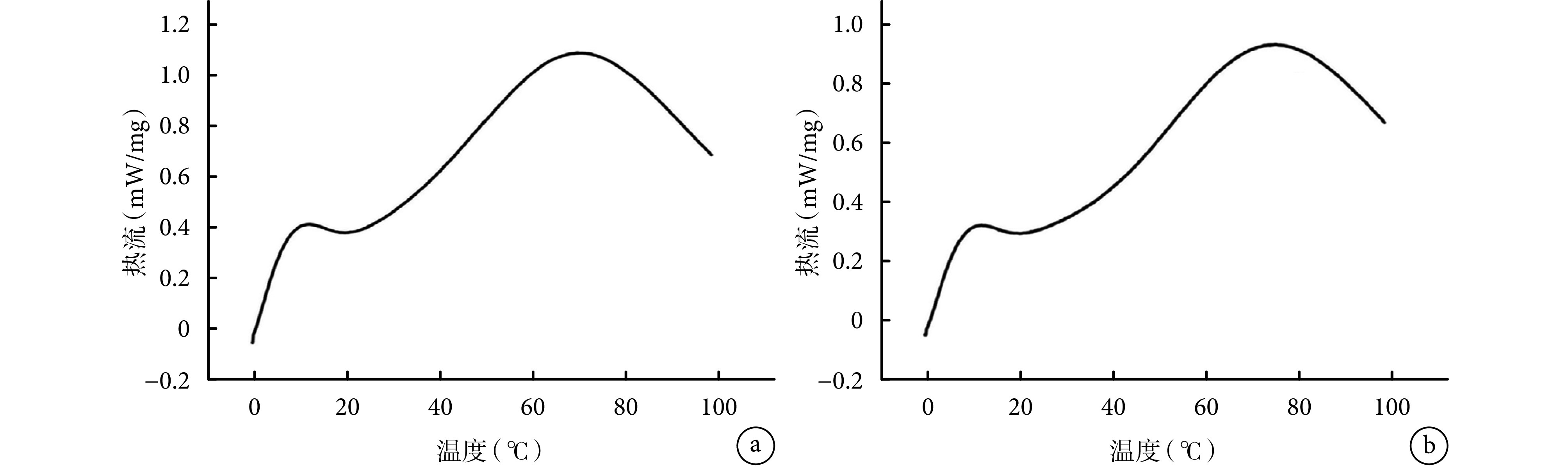
差示扫描量热法检测显示,交联组材料变性温度为(75.2±1.3)℃,高于未交联组的(68.5±0.4)℃,差异有统计学意义(t=4.586,P=0.002)。见图 4。
图 4.
Differential scanning calorimeter of two groups
两组差示扫描量热图
a. 未交联组;b. 交联组
a. Non-crosslinking group; b. Crosslinking group
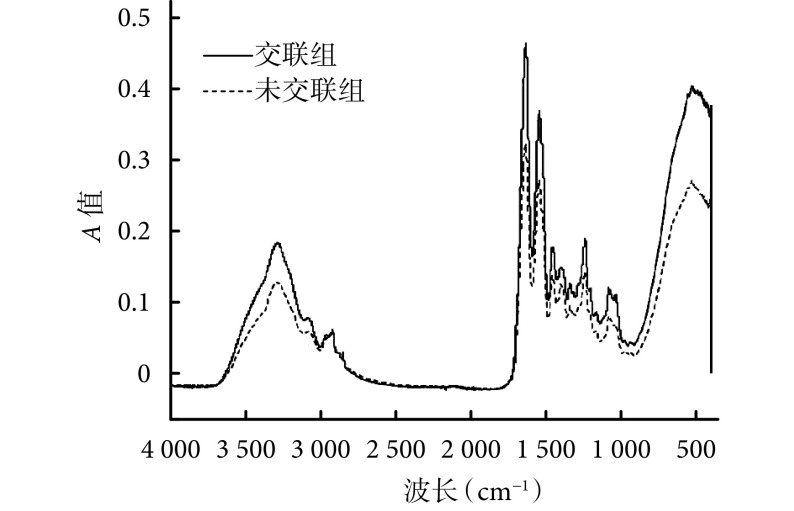
2.5. 红外光谱分析
与未交联组相比,交联组材料可见 1 635 cm–1处 C=O 伸缩振动峰,3 280 cm–1处 N-H 键伸缩振动峰吸收明显增加,表明生成了酰胺键中新的 C=O 键和 N-H 键,并且未引入其他新的基团。见图 5。
图 5.
Fourier transform infrared spectroscopy of two groups
两组傅里叶红外光谱图
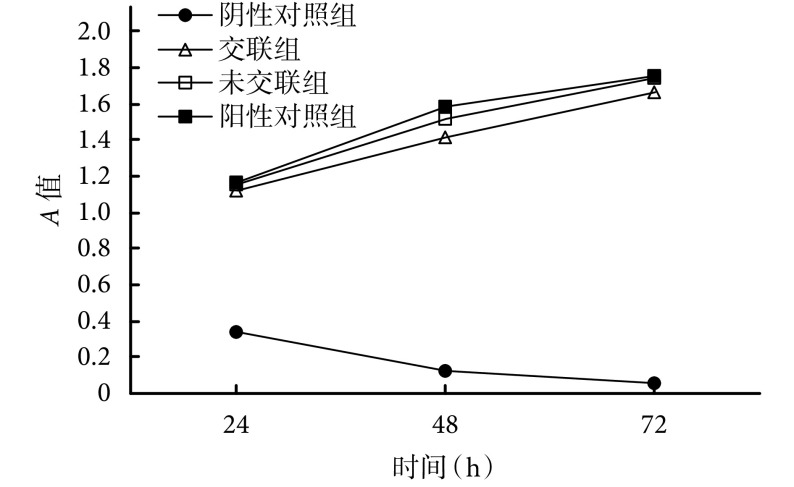
2.6. 细胞毒性检测
培养后各时间点,交联组及未交联组 A 值与阳性对照组比较,差异均无统计学意义(P>0.05)。见图 6。
图 6.
The cell proliferations in each group
两组细胞增殖检测
3. 讨论
目前,关于鱼鳔脱细胞材料的研究较少,EDC/NHS 交联制备鱼鳔膜尚无报道。我们前期预实验中选择了草鱼及花鲢的鱼鳔进行比较,结果发现花鲢鱼鳔孔隙大小及密度均优于草鱼,故本研究选择花鲢鱼鳔进行实验。交联是通过物理或化学方法使胶原蛋白基团发生反应,封闭其裸露在外的活性基团以维持其在植入期间的稳定性,降低免疫原性,增加抗降解性能,提升力学性能[14]。物理方法主要通过紫外光、高热等处理,使胶原蛋白分子间发生交联反应。但该方法交联不彻底,常作为化学交联的辅助方法。化学方法是利用各种化学试剂,如醛类、EDC、环氧化物等,对胶原进行交联[15]。国内学者张更申等[16]利用戊二醛对鲤鱼鱼鳔进行处理后,成功修复兔缺损脑膜,但戊二醛交联存在醛基残留等问题。Kumar 等[10]报道用 1,4-丁二醇二缩水甘油醚对鱼鳔进行交联处理并修复皮肤,也存在交联剂残留毒性的问题。本研究选择 EDC 进行交联处理,与其他化学交联试剂不同,在交联过程中 EDC 的作用类似于一种催化剂,催化胶原分子间进行反应,胶原反应后不会引入其他新的基团,而且交联处理后经 PBS 洗涤,材料无交联剂残留。
本研究显示,鱼鳔经交联后具有疏松多孔结构,有利于细胞迁移生长。与对照组相比,交联组鱼鳔膜拉伸性能得到一定提高,断裂伸长率降低,提示交联处理提高了材料的韧性。人体硬膜力学拉伸最大应力为 3~9 MPa,而交联组材料拉伸强度达(15.91±1.52)MPa,超过人体最大应力范围。目前市售的天义福生物膜力学性能很弱,有报道甚至未检测出相关力学指标[17-18]。我们认为该生物膜虽主要成分为Ⅰ型胶原,但其为水解后提纯的胶原纤维,水解过程中破坏了原胶原排列结构,导致力学性能差。近年来,随着电纺技术的发展,有研究联合Ⅰ型胶原复合高分子聚合物(如聚乳酸-羟基乙酸共聚物、聚羟基乙酸)制备生物膜,结合了胶原良好的生物相容性和聚合物良好的力学性能[18],早期动物实验结果良好,但未见长期体内转归实验报道。此外,电纺技术操作复杂,成本较高,也会影响相关生物膜的广泛应用。
体外降解研究结果显示,交联处理显著提高了鱼鳔膜的抗降解性能。既往研究报道鱼皮胶原材料的变性温度约为 30℃,即使通过交联等方式也难以提升其变性温度[19]。本研究结果显示,交联处理后的鱼鳔膜其热变性温度为(75.2±1.3)℃,显著高于人体正常体温,提示材料热稳定性也符合人体硬膜修复材料的要求。此外,由于交联原理是使分子间基团发生反应,因此红外光谱分析结果显示新形成的 N-H 键、C=O 键特征性吸收峰明显增强,表明交联起到了催化胶原蛋白裸露的基团发生反应,生成新的酰胺键作用。交联后鱼鳔膜接触角稍增大,我们认为可能是交联使亲水基团发生反应减少所致,但总体未显著降低胶原亲水性[20]。
综上述,通过脱细胞、EDC/NHS 法处理获得的鱼鳔膜材料具有良好的理化性能,无细胞毒性,有望作为硬膜修复材料。下一步我们将检测鱼鳔膜材料外源性细胞/DNA 的残留及其生物相容性,为其作为硬膜缺损修复材料提供更多实验依据。
Funding Statement
四川省科技支撑计划资助项目(2016FZ0097);国家老年疾病临床医学研究中心(四川大学华西医院)立项资助(Z2018B07)
Sichuan Science and Technology Support Program (2016FZ0097); Supported by National Clinical Research Center for Geriatrics West China Hospital of Sichuan University (Z2018B07)
References
- 1.Sairyo K, Matsuura T, Higashino K, et al Surgery related complications in percutaneous endoscopic lumbar discectomy under local anesthesia. J Med Invest. 2014;61(3-4):264–269. doi: 10.2152/jmi.61.264. [DOI] [PubMed] [Google Scholar]
- 2.Li H, Dai LY A systematic review of complications in cervical spine surgery for ossification of the posterior longitudinal ligament. Spine J. 2011;11(11):1049–1057. doi: 10.1016/j.spinee.2011.09.008. [DOI] [PubMed] [Google Scholar]
- 3.Boon ME, Ruijgrok JM, Vardaxis MJ Collagen implants remain supple not allowing fibroblast ingrowth. Biomaterials. 1995;16(14):1089–1093. doi: 10.1016/0142-9612(95)98905-T. [DOI] [PubMed] [Google Scholar]
- 4.Berthod F, Hayek D, Damour O, et al Collagen synthesis by fibroblasts cultured within a collagen sponge. Biomaterials. 1993;14(10):749–754. doi: 10.1016/0142-9612(93)90039-5. [DOI] [PubMed] [Google Scholar]
- 5.Schick B, Wolf G, Romeike BF, et al Dural cell culture. A new approach to study duraplasty. Cells Tissues Organs. 2003;173(3):129–137. doi: 10.1159/000069469. [DOI] [PubMed] [Google Scholar]
- 6.Meng F, Modo M, Badylak SF Biologic scaffold for CNS repair. Regen Med. 2014;9(3):367–383. doi: 10.2217/rme.14.9. [DOI] [PubMed] [Google Scholar]
- 7.Sandoval-Sánchez JH, Ramos-Zúñiga R, de Anda SL, et al A new bilayer chitosan scaffolding as a dural substitute: experimental evaluation. World Neurosurgery. 2012;77(3-4):577–582. doi: 10.1016/j.wneu.2011.07.007. [DOI] [PubMed] [Google Scholar]
- 8.Narotam PK, José S, Nathoo N, et al Collagen matrix (DuraGen) in dural repair: analysis of a new modified technique. Spine (Phila Pa 1976) 2004;29(24):2861–2869. doi: 10.1097/01.brs.0000148049.69541.ad. [DOI] [PubMed] [Google Scholar]
- 9.Yamada S, Aiba T, Endo Y, et al Creutzfeldt-Jakob disease transmitted by a cadaveric dura mater graft. Neurosurgery. 1994;34(4):740–744. doi: 10.1227/00006123-199404000-00027. [DOI] [PubMed] [Google Scholar]
- 10.Kumar V, Kumar N, Gangwar AK, et al Comparative histologic and immunologic evaluation of 1,4-butanediol diglycidyl ether crosslinked versus noncrosslinked acellular swim bladder matrix for healing of full-thickness skin wounds in rabbits. J Surg Res. 2015;197(2):436–446. doi: 10.1016/j.jss.2015.04.080. [DOI] [PubMed] [Google Scholar]
- 11.Matsumoto R, Uemura T, Xu Z, et al Rapid oriented fibril formation of fish scale collagen facilitates early osteoblastic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 2015;103(8):2531–2539. doi: 10.1002/jbm.a.v103.8. [DOI] [PubMed] [Google Scholar]
- 12.Mahesh R, Sreenu M, Kishore PVS, et al Acellular matrix of swim bladder for cervical oesophagoplasty in rabbits. Trends in Biomaterials and Artificial Organs. 2013;27(4):146. [Google Scholar]
- 13.陈泓弛, 位晓娟, 张长青, 等 鱼胶原蛋白作为新型生物医用材料的研究进展. 中国修复重建外科杂志. 2018;32(9):1227–1230. doi: 10.7507/1002-1892.201802025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Pawelec K, Best SM, Cameron RE Collagen: a network for regenerative medicine. J Mater Chem B Mater Biol Med. 2016;4(40):6484–6496. doi: 10.1039/C6TB00807K. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Dufrane D, Cornu O, Delloye C, et al Physical and chemical processing for a human dura mater substitute. Biomaterials. 2002;23(14):2979–2988. doi: 10.1016/S0142-9612(02)00027-3. [DOI] [PubMed] [Google Scholar]
- 16.张更申, 张庆俊, 孙国柱, 等 应用鲤鱼鳔进行家兔硬脑膜修补术实验研究. 河北医科大学学报. 2000;21(6):337–340. doi: 10.3969/j.issn.1007-3205.2000.06.006. [DOI] [Google Scholar]
- 17.Zerris VA, James KS, Roberts JB, et al Repair of the dura mater with processed collagen devices. J Biomed Mater Res Part B Appl Biomater. 2007;83(2):580–588. doi: 10.1002/jbm.b.30831. [DOI] [PubMed] [Google Scholar]
- 18.Sacks MS, Jimenez H, Otaño-Lata SE, et al Local mechanical anisotropy in human cranial dura mater allografts. J Biomech Eng. 1998;120(4):541–544. doi: 10.1115/1.2798027. [DOI] [PubMed] [Google Scholar]
- 19.Li Q, Mu L, Zhang F, et al A novel fish collagen scaffold as dural substitute. Mater Sci Eng C Mater Biol Appl. 2017;80:346–351. doi: 10.1016/j.msec.2017.05.102. [DOI] [PubMed] [Google Scholar]
- 20.Chen G, Sato T, Ohgushi H, et al Culturing of skin fibroblasts in a thin PLGA-collagen hybrid mesh. Biomaterials. 2005;26(15):2559–2566. doi: 10.1016/j.biomaterials.2004.07.034. [DOI] [PubMed] [Google Scholar]