Abstract
目的
了解绵羊颈、胸、腰段硬脊膜的结构和生物力学特点,为人工硬脊膜的研发提供理论参考。
方法
取 5 只成年雄性白绵羊,处死后取 C5、T10 和 L3 平面的硬脊膜分别行组织学 HE 染色观察内部结构并测量硬脊膜厚度,扫描电镜观察硬脊膜内外表面形态,透射电镜观察硬脊膜内部结构并测量各部位硬脊膜胶原纤维直径。取 C6、C7、T11、T12、L4、L5 平面的硬脊膜行单轴生物力学测试,测量样本的断裂强度、弹性模量和断裂伸长率。
结果
HE 染色示颈、胸、腰段硬脊膜厚度逐渐递减,分别为(268.19±15.91)、(198.16±27.25)、(103.74±21.54)μm,比较差异均有统计学意义(P<0.05)。扫描电镜观察示,硬脊膜内表面胶原纤维较多,细胞较少;外表面则细胞分布较多,且细胞均沿纵轴方向拉伸。透射电镜观察示,硬脊膜内部胶原纤维板层状交织排列,板层内胶原纤维同向排列,板层间胶原纤维相互垂直。颈、胸、腰段硬脊膜胶原纤维直径分别为(68.04±21.00)、(64.54±20.64)、(60.36±19.65)nm,比较差异无统计学意义(P>0.05)。单轴生物力学测试显示,颈段硬脊膜轴向和横向的弹性模量、断裂强度、断裂伸长率比较差异均无统计学意义(P>0.05);胸段和腰段轴向各指标均显著大于横向(P<0.05)。组间比较:颈、胸、腰段硬脊膜的轴向和横向弹性模量、断裂强度、断裂伸长率,两两比较差异均有统计学意义(P<0.05),呈颈、胸、腰段逐渐减小趋势。颈、胸段硬脊膜轴向弹性模量与横向弹性模量比值显著小于腰段(P<0.05);颈、胸段间比较差异无统计学意义(P>0.05)。
结论
绵羊硬脊膜从头侧向尾侧厚度依次减小;硬脊膜内表面胶原纤维分布较多、细胞较少,而外表面被细胞覆盖;硬脊膜内部胶原纤维板层交替排列,具有明显的各向异性生物力学特点,且从头侧向尾侧各向异性生物力学特点越明显。
Keywords: 硬脊膜, 结构, 力学特征, 绵羊
Abstract
Objective
To clarify the structure and biomechanical characteristics of the dura mater of the cervical, thoracic, and lumbar segments of sheep, in order to provide a theoretical reference for the study of artificial dura mater.
Methods
Five adult male white sheep were sacrificed. The dura mater of C5, T10, and L3 planes were obtained. The histological HE staining was used to observe the internal structure and the thickness of dura mater; the inner and outer surfaces morphology of the dura was observed by scanning electron microscopy (SEM); transmission electron microscopy (TEM) was used to observe the internal structure of dura mater and to measure the diameter of collagen fibers in each part of dura mater. The dura mater of C6, C7, T11, T12, L4, and L5 planes were taken for uniaxial biomechanical test, and modulus of elasticity, tensile strength, and elongation at break were measured.
Results
HE staining showed that the thickness of the cervical, thoracic, and lumbar dura mater gradually decreased, and the thickness of the dura mater was (268.19±15.91), (198.16±27.25), (103.74±21.54) μm, respectively, and the differences were significant (P<0.05). SEM observation showed that there were more collagen fibers and fewer cells on the inner surface of the dura mater, while more cells were distributed on the outer surface, and the cells on the inner and outer surface were stretched along the longitudinal axis. TEM observation showed that the collagen fibers in the dura mater were interlaced and arranged in layers. The collagen fibers in the lamina were arranged in the same direction, and the collagen fibers between the lamina were arranged vertically. The diameters of collagen fibers in the cervical, thoracic, and lumbar dura mater were (68.04±21.00), (64.54±20.64), (60.36±19.65) nm, respectively, and the differences were not significant (P>0.05). Uniaxial biomechanical tests results showed that there was no significant difference in modulus of elasticity, tensile strength, and elongation at break between the axial and transverse dura mater of the cervical dura mater (P>0.05); the axial data of thoracic and lumbar segments were significantly larger than the transverse data (P<0.05). The axial modulus of elasticity, tensile strength, and elongation at break of the dura mater of the cervical, thoracic, and lumbar dura mater were significantly different (P<0.05) from the transverse ones, and showing a decreasing trend. Among them, the ratio of axial and transverse modulus of elasticity of cervical and thoracic dura were significantly smaller than that of lumbar segment (P<0.05), and there was no significant difference between cervical segments and thoracic segments (P>0.05).
Conclusion
The thickness of dura mater in sheep decreased gradually from head to tail. There are more collagen fibers and fewer cells on the inner surface of dura mater, while the outer surface of dura mater is covered by cells. The collagen fiberboard layers in the dura mater are arranged alternately, and have obvious anisotropic biomechanical characteristics, and the anisotropic biomechanical characteristics get more significant from the head to the tail.
Keywords: Dura mater, structure, mechanical characteristics, sheep
硬脊膜起源于中胚层,由原始脑膜发育而来,是一种富含胶原的致密结缔组织膜,包绕整个脊髓,作为脊髓被膜中最坚韧的结构,硬脊膜维持着脑脊液的流动和压力并减少外界应力对脊髓的影响[1-3]。严重外伤或手术操作都可能造成硬脊膜损伤,如果不能进行有效修复,则可能导致脑脊液漏、中枢神经系统感染、癫痫等严重并发症[4-6]。对硬脊膜进行有效修补或者开发人工硬脊膜修复材料,都需要对硬脊膜的结构和力学特性进行深入研究。
目前已有许多研究对硬脊膜的结构进行了仔细观察,并对其生物力学特征进行了测定[7-15]。通过对人和牛的硬脊膜标本进行单轴拉伸力学测试发现,硬脊膜在纵轴方向的强度明显大于横轴[7-9]。大鼠脊髓标本也得到相似结论[10]。以上研究通过组织学观察发现胶原纤维的结构特征与各向异性的力学特点相吻合。但最近有关硬脊膜弹性和黏弹性行为的研究却发现,硬脊膜横轴的拉伸力学强度大于纵轴[11-13]。此外,一些组织学研究也指出,硬脊膜的胶原纤维并不是完全沿纵轴方向排列,也有相当数量的胶原纤维沿横轴排列[14-15]。因此,目前对于硬脊膜的生物力学特性和超微结构的关系还存在广泛争议,对人工硬脊膜的研发造成了巨大阻碍。
我们对以上存在争议的研究仔细分析后发现,标本差异可能是造成结果争议的主要原因。选取颈段硬脊膜标本进行分析的研究发现横轴拉伸力学强度大于纵轴,而选取腰段硬脊膜标本进行分析的研究却得到相反结果。本研究选取绵羊颈、胸、腰段硬脊膜标本进行组织学观察和生物力学测试,旨在明确不同节段硬脊膜的组织结构和力学特征,为人工硬脊膜的研发提供理论依据。报告如下。
1. 材料与方法
1.1. 实验动物及主要仪器
成年 1 岁龄雄性白绵羊 5 只,体质量 23~25 kg,由解放军联勤保障部队第 940 医院动物实验中心提供。所有动物实验均经解放军联勤保障部队第 940 医院实验动物伦理委员会批准,实验动物使用许可证号:SYXK(甘)2015-0001。
动物手术台(上海医疗器械厂);骨科手术器械(江苏创生医疗器械有限公司);冷冻切片机(北京盛科信德科技有限公司);光学显微镜(Olympus 公司,日本);SIGMA 500/VP 扫面电镜、LIBRA 120 透射电镜、KS400 图像分析软件(Carl Zeiss 公司,德国);AG-IS/10KN 力学试验机(Shimadzu 公司,日本)。
1.2. 标本制备
取 5 只成年雄性白绵羊,臀部肌肉注射过量盐酸塞拉嗪注射液(0.015 mL/kg)处死后固定于动物手术台,剔除颈胸腰背部羊毛。分别选取 C5~7、T10~12 及 L3~5 椎体平面,纵行切开皮肤及皮下组织,剔除棘突及椎板表面附着的肌肉,切除同平面棘突及椎板暴露椎管。清除椎管内脂肪,暴露硬脊膜背侧。切断神经根,将脊髓及其被膜整段剪下,分离硬脊膜制备测试标本。其中 C5、T10 和 L3 平面的硬脊膜剪成 15 mm×15 mm 正方形标本,而后剪成对称的 2 份,分别行组织学和电镜观察。C6、C7、T11、T12、L4、L5 平面的硬脊膜沿着纵轴方向和横轴方向分别制备长 20 mm、宽 5 mm 的矩形标本,进行单轴生物力学测试。
1.3. 观测指标
1.3.1. 组织学观察
将硬脊膜标本经 4% 多聚甲醛固定,石蜡包埋并切片(片厚 3~5 μm),70℃ 下烤片 30 min;再用甲苯脱蜡 2 次,每次 5 min;然后用 100%、95%、85%、70% 乙醇梯度脱水,各 2 min;蒸馏水冲洗 1 min,然后苏木精染色 10 min;蒸馏水冲洗 3 min,75% 盐酸乙醇分色 2 s 后,蒸馏水冲洗 10 min 返蓝,酸化伊红染液染色 12 s;蒸馏水冲洗 1 min,70%、85%、95%、100% 乙醇梯度脱水,各 2 min;二甲苯透明 3 次,每次 2 min,中性树胶封片;光镜下观察硬脊膜横断面并对其厚度进行测量:分别在显微镜目镜和载物台上安置目镜测微尺(5 mm/50 格)和物镜测微尺(1 mm/100 格),在低倍镜下确认目镜测微尺的每一格长度[目尺每格长度(mm)=物尺的格数/目尺的格数×10 μm],拿开物镜测微尺,放上组织标本片,测量标本厚度。每个部位硬脊膜平行测量 5 个标本。
1.3.2. 硬脊膜内、外表面形态扫描电镜观察
将硬脊膜标本经 4% 多聚甲醛 4℃ 固定过夜,然后使用 PBS 液洗涤 3 次,1% 锇酸溶液避光固定 1 h,PBS 液洗涤 3 次;用 25%、50%、75%、85%、95%、100% 乙醇梯度脱水,各 15 min,使用乙腈置换法干燥处理后,固定于电镜专用托上,喷金处理后扫描电镜观察硬脊膜的内表面和外表面,加速电压 20 kV。
1.3.3. 硬脊膜内部结构透射电镜观察
将硬脊膜标本脱水干燥后,包埋于环氧树脂中,冷却后使用超薄切片机对硬脊膜进行切片,获得硬脊膜横断面超薄切片,片厚约 80 nm,透射电镜观察,工作电压为 80 kV。通过 KS400 图像分析软件测量各部位硬脊膜胶原纤维直径。
1.3.4. 单轴生物力学测试
将制备的硬脊膜矩形标本放入生理盐水中,并在取材后立刻进行生物力学测试,该测试在恒温(25℃)、恒湿(85%)环境中进行。将剪裁好的样品固定于 AG-IS/10KN 力学试验机上,根据郭兴锋等[16]描述的单轴拉伸力学测试方法进行测试,拉伸速度 0.016 mm/s,当硬脊膜标本断裂时即表示测试结束。绘制硬脊膜标本的拉力-应变曲线,计算测试标本的断裂强度、弹性模量和断裂伸长率。颈、胸、腰每个平面各取 1 个硬脊膜标本,为避免个体间差异,对同一个体相邻平面硬脊膜进行随机轴向-横向比较。颈、胸、腰段硬脊膜分别取 5 组标本进行力学测试。为比较硬脊膜在颈、胸、腰段的各向异性特点,采用轴向弹性模量与横向弹性模量比值进行描述。该比值越趋近于 1,则说明标本的力学特性更趋近于各向同性;该比值越大,则说明标本的各向异性生物力学特点越明显。
1.4. 统计学方法
采用 SPSS22.0 统计软件进行分析。数据以均值±标准差表示,组间比较采用单因素方差分析,两两比较采用 SNK 检验;检验水准 α=0.05。
2. 结果
2.1. 组织学观察
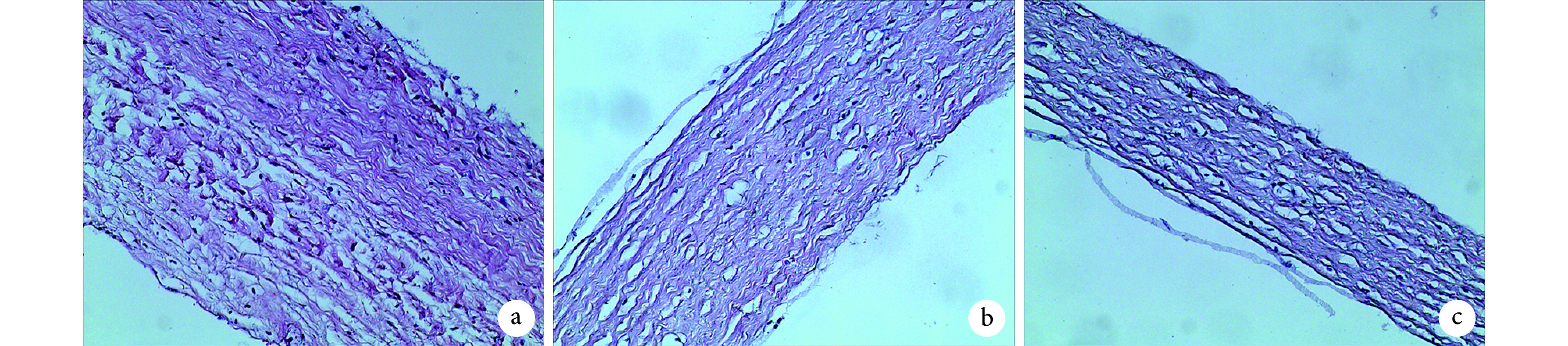
HE 染色示,硬脊膜主要由板层状交织排列的胶原纤维、弹性纤维以及散在分布的成纤维细胞构成;胶原纤维及弹性纤维并非完全拉伸,而是略有皱褶,呈波浪状;细胞分布于胶原纤维之间。硬脊膜结构并非均质,而是中间纤维排列略疏松,而内外侧纤维排列更致密。这种结构上的非均质性在颈段硬脊膜表现更明显,胸段和腰段硬脊膜内部结构差异不明显。见图 1。颈、胸、腰段硬脊膜厚度分别为(268.19±15.91)、(198.16±27.25)、(103.74±21.54)μm,差异具有统计学意义(P<0.05)。
图 1.
HE staining of cervical, thoracic, and lumbar dura mater (×200)
颈、胸、腰段硬脊膜 HE 染色观察(×200)
a. 颈段;b. 胸段;c. 腰段
a. Cervical segment; b. Thoracic segment; c. Lumbar segment
2.2. 扫描电镜观察
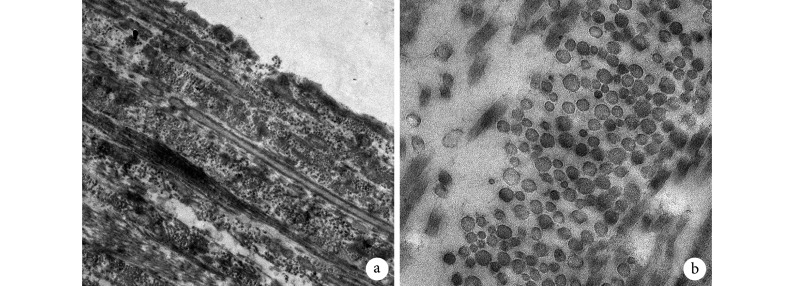
扫描电镜观察示,硬脊膜内外表面均可见规律分布有序排列的条状隆起,且走向几乎一致,均沿脊髓纵轴方向排列。这些条状隆起均为硬脊膜表面覆盖的成纤维细胞,细胞呈拉伸状态,拉伸方向与纵轴方向一致。同时硬脊膜内外表面并不完全一样,与脑脊液接触的硬脊膜内表面细胞覆盖较少,也更为平坦,可以看见散杂裸露的胶原纤维;而硬脊膜外表面则由大量成纤维细胞严密覆盖,形成了沿脊髓纵轴排列的沟壑状隆起,未见裸露的胶原纤维。硬脊膜内、外表面特点在颈、胸、腰段均表现类似,没有明显差异。见图 2。
图 2.
Scanning electron microscopy observation of the inner and outer surface of dura mater
硬脊膜内、外表面扫描电镜观察
从左至右分别为放大 400、3 000 倍 a. 内表面;b. 外表面
From left to right for the magnification of 400 and 3 000 times respectively a. Inner surface; b. Outer surface

2.3. 透射电镜观察
透射电镜观察示,硬脊膜内部是由不同方向的胶原纤维以层状排列;同一层内,胶原纤维走向几乎一致,规律分布,具有明显的取向性;其中纵向排列的胶原纤维板层厚度明显大于横向板层,说明纵向排列的胶原纤维占优,胶原纤维层与层之间并非完全独立,分界并不明显,横向排列的胶原纤维板层插入纵向板层之中,见图 3。这种层状结构在颈、胸、腰段硬脊膜中均可见,无明显差异。测量显示,颈、胸、腰段硬脊膜胶原纤维直径分别为(68.04±21.00)、(64.54±20.64)、(60.36±19.65)nm,差异无统计学意义(P>0.05)。
图 3.
The transverse section of dura mater observed by transmission electron microscopy
硬脊膜横截面透射电镜观察
圆形或椭圆形点状表示轴向排列胶原纤维,长条形表示横向排列胶原纤维 a. ×5 000;b. ×50 k
The round and oval dots were aligned collagen fibers along the axial direction, the long bars were collagen fibers along the transverse direction a. ×5 000; b. ×50 k
2.4. 单轴生物力学测试
组内比较:颈段硬脊膜轴向和横向的弹性模量、断裂强度、断裂伸长率比较差异均无统计学意义(P>0.05);胸段和腰段轴向各指标均显著大于横向,差异有统计学意义(P<0.05)。组间比较:颈、胸、腰段硬脊膜的轴向和横向弹性模量、断裂强度、断裂伸长率,两两比较差异均有统计学意义(P<0.05),呈颈、胸、腰段逐渐减小趋势。轴向弹性模量/横向弹性模量比值显示,腰段比值最大,胸段次之,颈段比值最趋近于 1;颈、胸段比值显著小于腰段,差异有统计学意义(P<0.05);颈、胸段间比较差异无统计学意义(P>0.05)。见图 4、表 1。
图 4.
Tension-strain curves of cervical, thoracic, and lumbar dura mater
颈、胸、腰段硬脊膜拉力-应变曲线
a. 颈段;b. 胸段;c. 腰段
a. Cervical segment; b. Thoracic segment; c. Lumbar segment
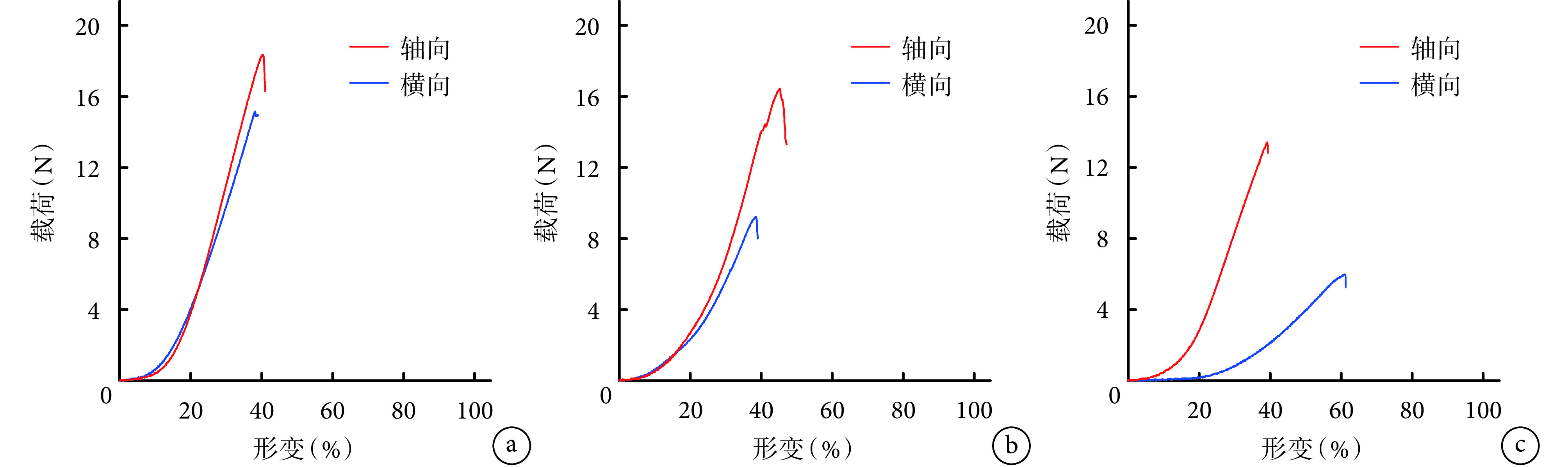
表 1.
Mechanical properties along the axial and transverse direction of cervical,thoracic, and lumbar spinal dura mater (n=5,
 )
)
颈、胸、腰段硬脊膜轴向及横向力学性能比较(n=5,
 )
)
| 部位
Position |
弹性模量(MPa)
Modulus of elasticity (MPa) |
断裂强度(MPa)
Tensile strength (MPa) |
断裂伸长率(%)
Elongation at break (%) |
|||||||||
| 轴向
Longitudinal direction |
横向
Transverse direction |
统计值
Statistic |
轴向/横向
Longitudinal/ transverse |
轴向
Longitudinal direction |
横向
Transverse direction |
统计值
Statistic |
轴向
Longitudinal direction |
横向
Transverse direction |
统计值
Statistic |
|||
|
*与颈段比较P<0.05,#与腰段比较P<0.05
*Compared with cervical segment, P<0.05;#compared with lumbar segment, P<0.05 | ||||||||||||
| 颈段
Cervical segment |
15.97±2.52# | 14.38±2.68# |
t=1.15
P=0.32 |
1.14±0.24# | 5.13±0.97# | 4.83±1.04# |
t=0.54
P=0.62 |
34.60±7.91# | 32.14±10.63# |
t=1.10
P=0.33 |
||
| 胸段
Thoracic segment |
12.39±1.88*# | 8.78±1.01*# |
t=5.55
P=0.01 |
1.41±0.17# | 3.51±0.67*# | 2.45±0.57*# |
t=4.50
P=0.01 |
28.62±5.24*# | 20.08± 2.83*# |
t=7.60
P=0.00 |
||
| 腰段
Lumbar segment |
8.33±3.10* | 3.46±1.24* |
t=5.33
P=0.01 |
2.40±0.42* | 2.41±0.61* | 1.16±0.35* |
t=8.49
P=0.00 |
25.77±2.46* | 17.28± 2.64* |
t=6.90
P=0.00 |
||
| 统计值
Statistic |
F=11.26
P= 0.00 |
F=45.95
P= 0.00 |
F=25.05
P= 0.00 |
F=15.91
P= 0.00 |
F=34.08
P= 0.00 |
F=3.17
P=0.08 |
F=7.31
P=0.01 |
|||||
3. 讨论
硬脊膜损伤是脊柱手术或脊柱骨折的严重并发症,若不及时有效处理,将极大影响患者康复。因此,越来越多学者在寻找良好的硬脊膜替代物方面作了大量研究[16-22]。生物性硬脊膜替代物由于存在免疫排斥、伦理及传播疾病等问题,且物理特性及强度无法达到天然硬脊膜的要求,重建后易形成瘢痕造成椎管狭窄或压迫神经,临床应用受限[23-28]。人工硬脊膜多由人工材料合成,无传播疾病风险及伦理问题,通过寻找低抗原性的材料,避免了免疫排斥反应,且成本低、易获得,是近年研究热点。但目前对天然硬脊膜的超微结构和力学特性尚不明确,现有文献报道甚至存在相互矛盾[7-9, 11-13],故明确硬脊膜的结构和力学特点对于人工硬脊膜的研发具有重要意义。
目前已有不少学者对硬脊膜的结构进行了研究[7-15, 29]。虽然有的研究采用人体标本[14-15, 29],有的研究采用牛、猪、绵羊等[11-13]作为研究对象,但观察到的硬脊膜结构相似。本研究以绵羊硬脊膜作为研究对象,通过 HE 染色发现硬脊膜主要由板层状交织排列的胶原纤维、弹性纤维以及散在分布的成纤维细胞构成,纤维并非完全拉伸,而是呈波浪状。胶原纤维主要为硬脊膜提供力学强度,而弹性纤维主要提供弹性和柔韧性。这与 Fink 等[14]以及 Vandenabeele 等[29]对人硬脊膜研究结果一致。此外,扫描电镜观察示成纤维细胞覆盖于胶原纤维表面,形成了沿脊髓纵轴方向规律排列的沟壑状隆起。与脑脊液接触的腹侧沟壑浅且平坦,可见散在分布的胶原纤维和弹性纤维;而背侧细胞大量聚集,有明显的沟壑,细胞沿轴向拉伸并有序排列。这一特点在颈、胸、腰段表现相似。细胞在胶原纤维表面的黏附生长、形态变化,与胶原纤维的排列密切相关。已有研究证实,在无规则的纳米纤维表面,细胞随机伸展,无明显极性;而在取向纳米纤维表面,细胞沿着纤维排列的方向拉伸并有序排列,具有明显极性[30]。从硬脊膜内外侧细胞排列的情况可以判断,硬脊膜表面大部分胶原纤维沿纵轴方向有序排列。透射电镜观察发现,硬脊膜内部是由不同方向的胶原纤维板层状排列而成,层内胶原纤维走向高度一致,具有明显的取向性。与 Reina 等[15]以及 Vandenabeele 等[29]研究结果相吻合。
Wilcox 等[11]、Mazgajczyk 等[12]、Snehal 等[13]研究发现,硬脊膜横向力学强度大于轴向。这些研究都选用颈段硬脊膜作为研究对象,而且越靠近上颈段,横向拉伸力学强度越大;越靠近胸段,则轴向拉伸力学强度越大[12-13]。这表明不同节段硬脊膜的拉伸力学行为存在很大差异,不能通过某一局部的硬脊膜拉伸力学行为推测整个硬脊膜。本研究通过对绵羊 C6、C7 节段硬脊膜进行拉伸力学测试后发现,其轴向与横向的力学强度差异无统计学意义。另有研究发现,硬脊膜轴向力学强度明显大于横向,硬脊膜内部胶原纤维以轴向为主[7-10]。分析相关文献后我们发现,这些研究均是以腰段硬脊膜作为研究对象,再次印证了不同节段硬脊膜的结构和力学特点存在差异。本研究通过对绵羊 T11、T12、L4、L5 节段硬脊膜进行拉伸力学测试,同样发现硬脊膜轴向力学强度明显大于横向,与上述研究结果相似。虽然不同节段硬脊膜拉伸力学特点有差异,但是却有明显的规律性:从头侧到尾侧,硬脊膜轴向弹性模量/横向弹性模量比值逐渐增加,说明越靠近尾侧硬脊膜各向异性特点更为明显。由于生物材料拉伸力学行为主要是由其内部结构决定,而胶原纤维是硬脊膜内最主要的力学强度提供因素,因此可以推断,越靠近尾侧,硬脊膜内轴向排列的胶原纤维比例越高,而越靠近头侧,横向排列的胶原纤维比例越高。同时,从颈段到腰段,硬脊膜的力学强度逐渐减小。由于不同节段硬脊膜厚度也存在差异,颈段最厚,胸段次之,腰段最薄,可以部分解释力学强度的差异。由于同一个体硬脊膜内胶原纤维粗细相似,因此可以推测颈段硬脊膜内胶原纤维排列可能更为紧密,而腰段硬脊膜内的胶原纤维排列可能更为疏松。但由于颈段硬脊膜断裂强度和弹性模量不超过腰段的 2 倍,故不同节段胶原纤维排列的疏密程度差异可能并不会很大。
近年来,关于人硬脊膜结构和功能研究已有较多报道[7, 9, 14-15]。本实验选择绵羊作为动物模型,是因为绵羊脊柱和人体脊柱相似性较高,绵羊易获得且性格温和,是人体脊柱研究的良好动物模型[31-32]。但绵羊硬脊膜与人硬脊膜又存在差异,因此本文的研究数据尚不能直接用于指导人工硬脊膜的制备,但可以作为参考。
综上述,本研究对绵羊不同节段硬脊膜的超微结构进行观察并经生物力学测试,发现不同节段硬脊膜结构特征存在差异,且从颈段到腰段有一定的变化趋势;在制备人工硬脊膜的过程中,不能用单一节段的结构和力学特征数据来模拟整个硬脊膜。本研究从整体上对硬脊膜的结构和生物力学特性进行了描述,为以后设计制备更加仿生的人工硬脊膜提供了参考。
Funding Statement
国家自然科学基金资助项目(81601905);中国博士后科学基金资助项目(2017M623433);全军医学科技青年培育项目(15QNP012)
National Natural Science Foundation of China (81601905); China Postdoctoral Science Foundation (2017M623433); Military Science and Technology Youth Cultivation Project (15QNP012)
References
- 1.Bokka S, Trivedi A Histopathological study of the outer membrane of the dura mater in chronic sub dural hematoma: Its clinical and radiological correlation. Asian J Neurosurg. 2016;11(1):34–38. doi: 10.4103/1793-5482.154979. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kurpinski K, Patel S Dura mater regeneration with a novel synthetic, bilayered nanofibrous dural substitute: an experimental study. Nanomedicine (Lond) 2011;6(2):325–337. doi: 10.2217/nnm.10.132. [DOI] [PubMed] [Google Scholar]
- 3.O’Rahilly R, Müller F The meninges in human development. J Neuropathol Exp Neurol. 1986;45(5):588–608. doi: 10.1097/00005072-198609000-00008. [DOI] [PubMed] [Google Scholar]
- 4.Bhimani AD, Denyer S, Esfahani DR, et al Surgical complications in intradural extramedullary spinal cord tumors-an ACS-NSQIP analysis of spinal cord level and malignancy. World Neurosurg. 2018;117:e290–e299. doi: 10.1016/j.wneu.2018.06.014. [DOI] [PubMed] [Google Scholar]
- 5.Scantland JT, Gondim MJ, Koivuniemi AS, et al Primary spinal intradural extraosseous Ewing sarcoma in a pediatric patient: case report and review of the literature. Pediatr Neurosurg. 2018;53(4):222–228. doi: 10.1159/000488767. [DOI] [PubMed] [Google Scholar]
- 6.Mortazavi MM, Verma K, Harmon OA, et al The microanatomy of spinal cord injury: a review. Clin Anat. 2015;28(1):27–36. doi: 10.1002/ca.22432. [DOI] [PubMed] [Google Scholar]
- 7.Runza M, Pietrabissa R, Mantero S, et al Lumbar dura mater biomechanics: experimental characterization and scanning electron microscopy observations. Anesth Analg. 1999;88(6):1317–1321. doi: 10.1213/00000539-199906000-00022. [DOI] [PubMed] [Google Scholar]
- 8.Persson C, Evans S, Marsh R, et al Poisson’s ratio and strain rate dependency of the constitutive behavior of spinal dura mater. Ann Biomed Eng. 2010;38(3):975–983. doi: 10.1007/s10439-010-9924-6. [DOI] [PubMed] [Google Scholar]
- 9.Patin DJ, Eckstein EC, Harum K, et al Anatomic and biomechanical properties of human lumbar dura mater. Anesth Analg. 1993;76(3):535–540. doi: 10.1213/00000539-199303000-00014. [DOI] [PubMed] [Google Scholar]
- 10.Maikos JT, Elias RA, Shreiber DI Mechanical properties of dura mater from the rat brain and spinal cord. J Neurotrauma. 2008;25(1):38–51. doi: 10.1089/neu.2007.0348. [DOI] [PubMed] [Google Scholar]
- 11.Wilcox RK, Bilston LE, Barton DC, et al Mathematical model for the viscoelastic properties of dura mater. J Orthop Sci. 2003;8(3):432–434. doi: 10.1007/s10776-003-0644-9. [DOI] [PubMed] [Google Scholar]
- 12.Mazgajczyk E, Ścigała K, Czyż M, et al Mechanical properties of cervical dura mater. Acta Bio Biomech. 2012;14(1):51–58. [PubMed] [Google Scholar]
- 13.Shetye SS, Deault MM, Puttlitz CM Biaxial response of ovine spinal cord dura mater. J Mech Behav Biomed Mater. 2014;34(6):146–153. doi: 10.1016/j.jmbbm.2014.02.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Fink BR, Walker S Orientation of fibers in human dorsal lumbar dura mater in relation to lumbar puncture. Anesth Analg. 1989;69(6):768–772. [PubMed] [Google Scholar]
- 15.Reina MA, Dittmann M, López GA, et al New perspectives in the microscopic structure of human dura mater in the dorsolumbar region. Reg Anesth. 1997;22(2):161–166. doi: 10.1016/S1098-7339(06)80036-2. [DOI] [PubMed] [Google Scholar]
- 16.郭兴锋, 侯春林, 窦源东, 等 几丁糖电纺膜预防脑脊液漏远期效果的实验研究. 中国修复重建外科杂志. 2014;28(8):993–997. [Google Scholar]
- 17.Centonze R, Agostini E, Massaccesi S, et al A novel equine-derived pericardium membrane for dural repair: a preliminary, short-term investigation. Asian J Neurosurg. 2016;11(3):201–205. doi: 10.4103/1793-5482.179645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Arnautovic KI, Kovacevic M CSF-related complications after intradural spinal tumor surgery: utility of an autologous fat graft. Med Arch. 2016;70(6):460–465. doi: 10.5455/medarh.. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Ma J, Meng J, Simonet M, et al Biodegradable fibre scaffolds incorporating water-soluble drugs and proteins. J Mater Sci Mater Med. 2015;26(7):205. doi: 10.1007/s10856-015-5537-9. [DOI] [PubMed] [Google Scholar]
- 20.Sae-Jung S, Apiwatanakul P Chitosan pad, cellulose membrane, or gelatin sponge for peridural bleeding: an efficacy study on a lumbar laminectomized rat model. Asian Spine J. 2018;12(2):195–201. doi: 10.4184/asj.2018.12.2.195. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Sun H, Wang H, Diao Y, et al Large retrospective study of artificial dura substitute in patients with traumatic brain injury undergo decompressive craniectomy. Brain Behav. 2018;8(5):e00907. doi: 10.1002/brb3.2018.8.issue-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Marton E, Giordan E, Gioffrè G, et al Homologous cryopreserved amniotic membrane in the repair of myelomeningocele: preliminary experience. Acta Neurochir (Wien) 2018;160(8):1625–1631. doi: 10.1007/s00701-018-3577-x. [DOI] [PubMed] [Google Scholar]
- 23.Dafford EE, Anderson PA Comparison of dural repair techniques. Spine J. 2015;15(5):1099–1105. doi: 10.1016/j.spinee.2013.06.044. [DOI] [PubMed] [Google Scholar]
- 24.胡家正, 席孝庄, 陈鲁芹, 等 颞筋膜修补硬脑膜缺损 48 例. 中国修复重建外科杂志. 1997;11(1):45. doi: 10.3321/j.issn:1002-1892.1997.01.016. [DOI] [Google Scholar]
- 25.LeHuec JC, Sadikki R, Cogniet A, et al Role of a collagen membrane in adhesion prevention strategy for complex spinal surgeries. Int Orthop. 2015;39(7):1383–1390. doi: 10.1007/s00264-015-2767-x. [DOI] [PubMed] [Google Scholar]
- 26.张念武, 郭常芬, 牟善宇, 等 颈侧皮下蒂皮瓣修补多发性脑脊液耳漏一例. 中国修复重建外科杂志. 1998;12(4):235. doi: 10.3321/j.issn:1002-1892.1998.04.024. [DOI] [Google Scholar]
- 27.Gürer B, Kertmen H, Akturk UD, et al Use of the bovine pericardial patch and fibrin sealant in meningomyelocele closure. Acta Neurochir (Wien) 2014;156(7):1345–1350. doi: 10.1007/s00701-014-2099-4. [DOI] [PubMed] [Google Scholar]
- 28.Nakano T, Yoshikawa K, Kunieda T, et al Treatment for infection of artificial dura mater using free fascia lata. J Craniofac Surg. 2014;25(4):1252–1255. doi: 10.1097/SCS.0000000000000929. [DOI] [PubMed] [Google Scholar]
- 29.Vandenabeele F, Creemers J, Lambrichts I Ultrastructure of the human spinal arachnoid mater and dura mater. J Anat. 1996;189(Pt 2):471–430. [PMC free article] [PubMed] [Google Scholar]
- 30.杨成伟, 邓国英, 杨洋, 等 单层组织工程纤维环取向纳米纤维支架的构建和初步验证. 脊柱外科杂志. 2014;12(2):87–91. doi: 10.3969/j.issn.1672-2957.2014.02.006. [DOI] [Google Scholar]
- 31.Hasler C, Sprecher CM, Milz S Comparison of the immature sheep spine and the growing human spine: a spondylometric database for growth modulating research. Spine (Phila Pa 1976) 2010;35(23):E1262–1272. doi: 10.1097/BRS.0b013e3181e24196. [DOI] [PubMed] [Google Scholar]
- 32.Sheng SR, Wang XY, Xu HZ, et al Anatomy of large animal spines and its comparison to the human spine: a systematic review. Eur Spine J. 2010;19(1):46–56. doi: 10.1007/s00586-009-1192-5. [DOI] [PMC free article] [PubMed] [Google Scholar]