Abstract
目的
探讨将联合培养血管内皮细胞(vascular endothelial cells,VECs)和脂肪干细胞(adipose-derived stem cells,ADSCs)的培养体系作为种子细胞的组织工程骨异位成骨能力。
方法
采用纤维粘连蛋白复合部分脱蛋白骨(partially deproteinised bone,PDPB)制备部分脱蛋白生物骨(partially deproteinised biologic bone,PDPBB);分离培养 18 周龄 SD 大鼠 ADSCs 及足月妊娠 SD 大鼠脐血 VECs。体外构建 3 种组织工程骨:PDPBB+VECs(A 组)、PDPBB+ADSCs(B 组)、PDPBB+联合培养细胞(VECs∶ADSCs 为 1∶1,C 组),以单纯 PDPBB 为对照组(D 组)。细胞移植后 10 d 行扫描电镜观察细胞在各组支架上的黏附情况。取 18 周龄 SD 大鼠 48 只,随机分为 A、B、C、D 4 组,每组 12 只。分别将 A、B、C、D 4 种支架材料植入相应组别的大鼠股部肌袋,术后 2、4、8、12 周处死动物行大体观察及 HE 染色和 Masson 染色组织学观察,并取 Masson 染色切片行骨胶原量定量检测。
结果
扫描电镜观察示,PDPB 材料孔隙内部相互连通;纤维粘连蛋白修饰的 PDPBB 表面大量片状蛋白结晶松散附着于支架表面;复合细胞联合培养 10 d 后,C 组大量细胞与 PDPBB 附着,细胞相互堆积形成细胞团,多角形细胞和梭形细胞混合分布,细胞沿骨小梁生长,形成细胞层。大体观察示术后 2 周各组肉芽组织开始长入材料孔隙。C 组自 4 周后材料表面逐渐产生大量白色软骨样物质,表面高低不平。至 12 周时,A 组材料表面血管量增多,材料呈实变;B 组材料表面出现少许白色软骨样物质,但材料孔隙未见明显减小;D 组材料孔隙大小未见明显减小。组织学观察可见术后 2 周,各组间骨胶原量比较差异无统计学意义(F=2.551,P=0.088);术后 4、8、12 周,C 组骨胶原量显著高于其余 3 组,B 组高于 D 组,差异均有统计学意义(P<0.05);A 组与 B、D 组比较差异均无统计学意义(P>0.05)。
结论
联合培养 VECs 与 ADSCs 作为种子细胞构建组织工程骨的异位成骨能力最强。
Keywords: 脂肪干细胞, 血管内皮细胞, 联合培养, 组织工程骨, 异位成骨
Abstract
Objective
To investigate the heterotopic osteogenesis of tissue engineered bone using the co-culture system of vascular endothelial cells (VECs) and adipose-derived stem cells (ADSCs) as seed cells.
Methods
The partially deproteinized biological bone (PDPBB) was prepared by fibronectin combined with partially deproteinized bone (PDPB). The ADSCs of 18-week-old Sprague Dawley (SD) rats and VECs of cord blood of full-term pregnant SD rats were isolated and cultured. Three kinds of tissue engineered bone were constructed in vitro: PDPBB+VECs (group A), PDPBB+ADSCs (group B), PDPBB+co-cultured cells (VECs∶ADSCs was 1∶1, group C), and PDPBB was used as control group (group D). Scanning electron microscopy was performed at 10 days after cell transplantation to observe cell adhesion on scaffolds. Forty-eight 18-week-old SD rats were randomly divided into groups A, B, C, and D, with 12 rats in each group. Four kinds of scaffolds, A, B, C, and D, were implanted into the femoral muscle bags of rats in corresponding groups. The animals were killed at 2, 4, 8, and 12 weeks after operation for gross observation, HE staining and Masson staining histological observation, and the amount of bone collagen was measured quantitatively by Masson staining section.
Results
Scanning electron microscopy showed that the pores were interconnected in PDPB materials, and a large number of lamellar protein crystals on the surface of PDPBB modified by fibronection were loosely attached to the surface of the scaffold. After 10 days of co-culture PDPBB and cells, a large number of cells attached to PDPBB and piled up with each other to form cell clusters in group C. Polygonal cells and spindle cells were mixed and distributed, and some cells grew along bone trabeculae to form cell layers. Gross observation showed that the granulation tissue began to grow into the material pore at 2 weeks after operation. In group C, a large number of white cartilage-like substances were gradually produced on the surface of the material after 4 weeks, and the surface of the material was uneven. At 12 weeks, the amount of blood vessels on the surface of group A increased, and the material showed consolidation; there was a little white cartilage-like material on the surface of group B, but the pore size of the material did not decrease significantly; in group D, the pore size of the material did not decrease significantly. Histological observation showed that there was no significant difference in the amount of bone collagen between groups at 2 weeks after operation (F=2.551, P=0.088); at 4, 8, and 12 weeks after operation, the amount of bone collagen in group C was significantly higher than that in other 3 groups, and that in group B was higher than that in group D (P<0.05); there was no significant difference between group A and groups B, D (P>0.05).
Conclusion
The ability of heterotopic osteogenesis of tissue engineered bone constructed by co-culture VECs and ADSCs was the strongest.
Keywords: Adipose-derived stem cells, vascular endothelial cells, co-culture, tissue engineered bone, heterotopic osteogenesis
组织工程骨的成骨活性除了依靠支架材料的骨诱导作用、骨传导作用,和种子细胞的成骨诱导作用、分泌作用外,还有各种生长因子的成骨和成血管作用,它们可以刺激成骨细胞的作用,调节局部成骨,如 BMP、bFGF、TGF-β、PDGF、IGF-Ⅰ、IGF-Ⅱ等。当形成骨缺损时,损伤刺激周围组织和血液细胞分泌各种成骨因子,促进周围成骨细胞和骨髓、血液的 MSCs 增生,以达到成骨作用。但使用组织工程骨原位修复骨缺损时,会受到这些干细胞和组织生长因子的影响,不能完全体现植入的组织工程骨真正的成骨能力。异位成骨时,因为去除了局部的成骨因素,可以完全体现组织工程骨的成骨能力,所以异位成骨的能力可作为验证组织工程骨成骨能力的主要指标[1]。詹健峰等[2]也通过把组织工程骨植入 SD 大鼠竖脊肌肌袋,来验证载 BMP-2 多肽 P24 的巯基化壳聚糖水凝胶的异位成骨能力。
本研究组前期研究表明,联合培养血管内皮细胞(vascular endothelial cells,VECs)能促进脂肪干细胞(adipose-derived stem cells,ADSCs)增殖[3],而且能促进 ADSCs 成骨分化[4]。骨组织工程支架材料中部分脱蛋白骨(partially deproteinised bone,PDPB)具有正常骨的三维立体结构,孔隙率、钙磷比和正常骨相似,组织相容性好、无致瘤性,是一种较为理想的骨移植材料[5-6]。本实验拟将联合培养的 ADSCs 和 VECs 与部分脱蛋白生物骨(partially deproteinised biologic bone,PDPBB)体外构建组织工程骨异位肌袋移植,排除原位骨床干扰,旨在确定将联合培养细胞作为种子细胞的生物工程骨成骨作用的有效性和异位建造骨组织的可能性。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
18 周龄 SD 大鼠 50 只,雌雄不限,体质量(200±10)g;足月妊娠 SD 大鼠 2 只,体质量约 400 g;均由昆明医学院动物科提供。
低糖 DMEM 培养基、新生牛血清(GIBCO 公司,美国);胰蛋白酶、EDTA、DAPI(Sigma 公司,美国);FBS(JRS 公司,美国;HyClone 公司,美国);纤维粘连蛋白(fibronectin,FN;R&D 公司,美国);BrdU(Upstate 公司,美国);BrdU 小鼠单克隆抗体(Thermo Scientific 公司,美国);FITC 标记的山羊抗小鼠 IgG(KPL 公司,美国)。超净工作台、恒温 CO2 培养箱(Thermo Scientific 公司,美国);低温自动平衡离心机(北京医用离心机厂);倒置相差显微镜、PM-20 型荧光显微镜(Olympus 公司,日本);酶标板自动读数仪(Bio-Rad 公司,美国);SP2500 型硬组织切片机(Leica 公司,德国);XL 型流式细胞仪(Beckman Coulter 公司,美国)。
1.2. 体外组织工程骨构建及相关观测
1.2.1. PDPBB 的制备
取新鲜市售猪腰椎骨制成横截面积为 0.5 cm2 的骨条,蒸馏水反复冲洗干净,按文献[7]方法处理制得 PDPB;用蒸馏水充分浸洗 PDPB,并将浸泡液 pH 值调至 7.0~7.2,于干燥箱风干;将制得的 PDPB 分别磨制成大小为 0.5 cm×0.4 cm×0.3 cm 的骨块和 0.5 cm×0.5 cm×0.1 cm 的骨片,于 150 μg/mL FN 浸泡 12 h,制成 PDPBB[8],生理盐水超声漂洗,干燥箱风干,60Co 放射灭菌备用。
1.2.2. VECs 诱导分化培养及鉴定
取足月妊娠 SD 大鼠 2 只,3% 戊巴比妥钠(1 mL/kg)腹腔注射麻醉后,于 75% 乙醇中浸泡 10 min,按文献[9]方法分离脐血单个核细胞。加入 5 mL VECs 诱导培养液(含 10%FBS、1% 青霉素、1% 链霉素、20 μg/L VEGF、2 μg/L IGF-1、2 μg/L bFGF、20 μg/L EGF 的 L-DMEM 培养基),诱导培养 6 周[10],倒置相差显微镜下观察细胞形态变化。
鉴定:将诱导培养 6 周的 VECs 接种于 24 孔板上,分别行 CD34、CD133、血管内皮生长因子受体 1(fetal liver kinase 1,Flk-1)免疫荧光染色(每个指标各检测 3 孔),另分别取 1 孔为阴性对照。具体方法:贴壁细胞 PBS 冲洗 2 遍,4% 多聚甲醛固定 30 min,干燥 10 min,3% 牛血清白蛋白孵育标本 20 min;分别加入相应一抗室温孵育 60 min(阴性对照不加一抗),PBS 洗 3 次,每次 5 min;分别滴加适量山羊抗兔或抗小鼠 Cy3 荧光素标记二抗,置 37℃、5%CO2、饱和湿度培养箱中孵育 30 min,PBS 洗 3 次,每次 5 min;DAPI 浸染 1 min,50% 缓冲甘油封片,荧光显微镜下观察。
1.2.3. ADSCs 分离培养及鉴定
取 18 周龄 SD 大鼠 2 只,3% 戊巴比妥钠(1 mL/kg)腹腔注射麻醉后脱颈处死,按照文献[8]方法分离大鼠 ADSCs,以含 10% 新生牛血清的 DMEM 培养基[11],于 37℃、5%CO2、饱和湿度培养箱培养细胞,并传至第 3 代。倒置相差显微镜下观察细胞形态。
鉴定:取第 3 代 ADSCs 按 5×104 个/mL 密度接种至 6 孔板,加入成骨诱导培养基(含 1×10−8 mol/L 地塞米松、10 mol/L β-甘油磷酸、50 mg/L 维生素 C 的低糖 DMEM 培养基),14 d 时各取 1 孔进行下列染色:① 茜素红染色:细胞染色前用 PBS 冲洗 2 次,滤纸吸去多余水分,95% 乙醇固定 30 min,2% 茜素红染色 5 min,流水冲洗,倒置相差显微镜下观察;②ALP 染色:细胞染色前用 PBS 冲洗 2 次,滤纸吸去多余水分,4% 多聚甲醛固定 30 min,NBT/BCIP 避光染色 1 h,流水冲洗,倒置相差显微镜下观察。
1.2.4. 体外构建组织工程骨
取 0.5 cm×0.4 cm×0.3 cm 的 PDPBB 材料 144 块,L-DMEM 预湿,随机分为 4 组,A 组为 PDPBB+VECs,B 组为 PDPBB+ADSCs,C 组为 PDPBB+联合培养细胞(VECs∶ADSCs 为 1∶1)[3-4],D 组为单纯 PDPBB,每组 36 块,置入 2 块 6 孔板中,每组 2 孔。取第 4 代 ADSCs 和诱导 6 周后的 VECs,以 5.0×106 个/mL 浓度[12]按上述分组接种于预湿后的 PDPBB,100 μL/孔,置 37℃、5%CO2、饱和湿度培养箱培养 4 h 后,加入 4 mL 含 15% 新生牛血清、100 U/mL 青霉素、100 μg/mL 链霉素、0.01 mol/L HEPES 缓冲液的 L-DMEM 培养基,隔日换液。
1.2.5. 扫描电镜观察
细胞移植后 10 d[13]每组各取 2 块材料,3.5% 戊二醛固定 6 h,二蒸水清洗 3 次、每次 15 min;4% 单宁酸+3.5% 戊二醛导电染色 48 h,二蒸水清洗 3 次、每次 30 min;1% 锇酸固定 4 h,二蒸水清洗 4 次、每次 20 min;30%~100% 乙醇梯度脱水,叔丁醇置换,冰冻干燥,喷镀铂钯合金,扫描电镜观察细胞在支架材料上附着情况。同时采用扫描电镜观察单纯 PDPB 形貌。
1.3. 组织工程骨移植及异位成骨检测
1.3.1. 实验分组及方法
取 18 周龄 SD 大鼠 48 只,随机分为 A、B、C、D 4 组,每组 12 只。3% 戊巴比妥钠(1 mL/kg)肌肉注射麻醉后脱毛,0.5% 聚维酮碘溶液消毒手术区域,分层切开双侧股部皮肤、皮下,钝性分离肌肉,造成肌袋。分别将 1.2.4 中制备的 3 种组织工程骨或单纯 PDPBB 置于 A、B、C、D 组 SD 大鼠两侧股部肌袋处。术毕肌肉注射青霉素 0.5 万U预防切口感染。术后各组动物于相同条件下分笼饲养。
1.3.2. 一般观察
术后观察各组动物的活动、进食、伤口愈合情况。
1.3.3. 异位成骨标本大体观察
术后 2、4、8、12 周每组分别脱颈处死 3 只大鼠,大体观察植入材料的外观形态变化。
1.3.4. 组织学观测
术后各时间点取各组植入材料,10% 甲醛固定,树脂包埋,硬组织切片机连续切片,片厚 5 μm,常规行 HE、Masson 染色,倒置相差显微镜下观察。每组于 Masson 染色放大 100 倍镜下选取 6 张切片,使用 Adobe Photoshop 7.0 软件的魔棒工具和直方图(histogram)功能,进行胶原组织形态计量分析,以像素值代表骨面积计算骨胶原量。
1.4. 统计学方法
采用 SPSS11.5 统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用 LSD 检验;检验水准 α=0.05。
2. 结果
2.1. 组织工程骨相关观测
2.1.1. VECs 形态学观察及鉴定
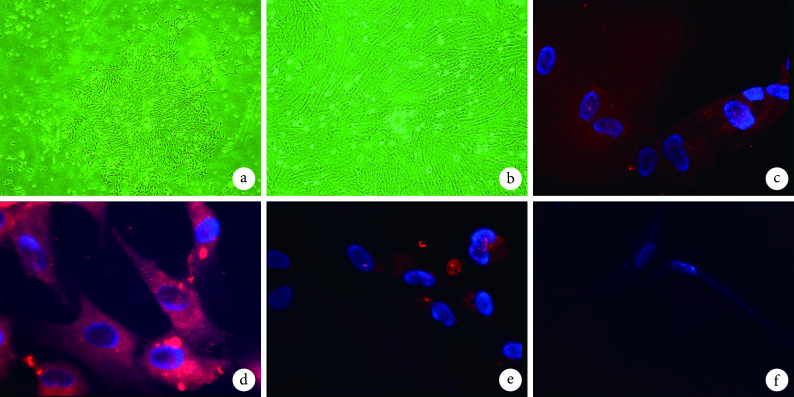
倒置相差显微镜观察示,脐血单个核细胞原代培养 7 d,贴壁单个核细胞形态单一,呈梭形集落样生长,无重叠现象;诱导后 6 周细胞形态呈多样化,有梭形和多角形混合生长。免疫荧光染色示,诱导后 6 周细胞 CD34、CD133、Flk-1 染色均为阳性,细胞核被 DAPI 染为蓝色,细胞质内存在大量红色颗粒;阴性对照未发现阳性细胞。见图 1。
图 1.
Morphological observation of VECs and identification by immunofluorescence staining at 6 weeks after induction
VECs 形态学观察及诱导后 6 周免疫荧光染色鉴定
a. 脐血单个核细胞原代培养 7 d 形态(倒置相差显微镜×40);b. 脐血单个核细胞诱导后 6 周形态(倒置相差显微镜×100);c. CD34 染色(荧光显微镜×630);d. Flk-1 染色(荧光显微镜×630);e. CD133 染色(荧光显微镜×630);f. 阴性对照(荧光显微镜×630)
a. Primary culture of cord blood mononuclear cells for 7 days (Inverted phase contrast microscope×40); b. At 6 weeks after induction of cord blood mononuclear cells (Inverted phase contrast microscope×100); c. CD34 staining (Fluorescence microscope×630); d. Flk-1 staining (Fluorescence microscope×630); e. CD133 staining (Fluorescence microscope×630); f. Negative control (Fluorescence microscope×630)
2.1.2. ADSCs 形态学观察及鉴定
倒置相差显微镜观察示,第 3 代 ADSCs 贴壁单个核细胞形态单一,呈梭形生长,无重叠现象。成骨诱导 14 d 时,ALP 染色示细胞多数呈阳性,细胞失去漩涡状生长方式,融合成团,ALP 阳性的蓝黑色颗粒状影像相互融合成网状;茜素红染色示细胞均可见大量红色钙结节影,部分互相融合,形成片状钙化影。见图 2。
图 2.
Morphological observation and osteogenesis identification of ADSCs
ADSCs 形态学观察及成骨诱导鉴定
a. 第 3 代 ADSCs 形态(倒置相差显微镜×40);b. ALP 染色(倒置相差显微镜×200);c. 茜素红染色(倒置相差显微镜×200)
a. Morphology of the 3rd generation ADSCs (Inverted phase contrast microscope×40); b. ALP staining (Inverted phase contrast microscope×200); c. Alizarin red staining (Inverted phase contrast microscope×200)
2.1.3. 支架材料大体观察
PDPB 呈白色,正常骨质的血管、细胞、蛋白质等完全去除,表面有大量孔隙相互连通呈蜂窝状,较正常骨质柔软,容易切割成形,不易碎;骨小梁分布均匀,表面光滑。见图 3。
图 3.
Appearance of PDPB
PDPB 外观
2.1.4. 扫描电镜观察
PDPB 孔隙内部相互连通,正常骨组织上的血管、细胞等结构消失;骨小梁光滑,无附着物,表面可见大量微孔结构。单纯 PDPBB(D 组)可见大量片状蛋白结晶松散附着于支架表面。与细胞复合培养后 10 d,A 组仅有少量 VECs 附着于支架上,形状呈多角形;B 组 ADSCs 黏附于 PDPBB 支架表面,细胞呈梭形,伸出足突连接于 PDPBB 表面的微孔中;C 组大量细胞与 PDPBB 附着,呈巢状分布,细胞相互堆积形成细胞团,细胞形态多样,多角形细胞和梭形细胞混合分布,部分细胞团细胞之间分界不清,有大量大小不等颗粒状物质;细胞沿骨小梁生长,形成细胞层。见图 4。
图 4.
Scanning electron microscope observation
扫描电镜观察
a. PDPB(×35);b. PDPBB(D 组)(×120);c. A 组(×600);d. B 组(×800);e. C 组(×500)
a. PDPB (×35); b. PDPBB (group D) (×120); c. Group A (×600); d. Group B (×800); e. Group C (×500)

2.2. 组织工程骨移植及异位成骨检测
2.2.1. 一般观察
术后各组均无动物死亡,术后第 1 天动物开始进食,饮食、活动正常。第 1 周内切口肿胀,2 周后完全愈合。
2.2.2. 异位成骨标本大体观察
A 组:术后 2 周,材料表面形成薄层结缔组织包膜,包膜内形成新生血管网,肉芽组织开始长入材料孔隙,孔隙清晰可见。术后 4、8、12 周,包膜内纤维组织填塞孔隙,取出较难,孔隙逐渐缩小;12 周时材料表面血管量增多,材料呈实变,孔隙很难看见。术后 4、8、12 周组织工程骨外周呈现白色软骨样组织。B 组:术后 2、4 周,肉芽组织开始长入材料孔隙,材料很少吸收,棱角分明;术后 8、12 周,材料棱角变钝,表面出现少许白色软骨样物质,血管量较 A 组减少,材料孔隙未见明显减小。C 组:术后 2 周,材料表面形成薄层结缔组织包膜,材料表面平整;术后 4、8、12 周,材料表面逐渐产生大量白色软骨样物质,表面高低不平,较 A、B 组明显增多。D 组:术后 2、4、8 周,材料表面平整,棱角未见变钝,表面未见白色软骨样物质;8 周时大量纤维组织长入材料孔隙内,孔隙大小未见明显减小;术后 12 周,材料表面出现少许白色软骨样物质,较 A、C 组明显减少。见图 5。
图 5.
Gross observation of ectopic osteogenesis specimens at different time points after operation
术后各时间点各组异位成骨标本大体观察
从左至右依次为术后 2、4、8、12 周 a. A 组;b. B 组;c. C 组;d. D 组
From left to right for postoperative at 2, 4, 8, and 12 weeks a. Group A; b. Group B; c. Group C; d. Group D

2.2.3. HE 染色
术后 2 周,A、B、C 组可见大量纤维组织长入组织工程骨孔隙内,D 组间隙内有少量纤维组织长入,但仍可见大量孔隙,各组未见明显淋巴细胞浸润。术后 4 周,各组骨支架开始降解,大量多核巨大破骨细胞位于支架材料周围长入材料内部,破坏、吸收支架材料。A、B 组大量细胞长入孔隙组织,未见类骨物质出现;C 组支架材料边缘开始出现均质、无细胞的类骨物质,孔隙内大量滋养血管形成;D 组部分支架材料老化深染、断裂。术后 8 周,A、B、D 组部分支架材料已被破坏、碎裂;C 组大量骨支架降解,周围分布大量多核破骨细胞。术后 12 周,各组支架材料部分吸收,边缘模糊,易碎裂;各组边缘均可见均质的类骨物质出现,D 组较少,C 组最多。见图 6。
图 6.
HE staining observation in each group at different time points after operation (Inverted phase contrast microscope×200)
术后各时间点各组 HE 染色观察(倒置相差显微镜×200)
从左至右依次为术后 2、4、8、12 周 a. A 组;b. B 组;c. C 组;d. D 组
From left to right for postoperative at 2, 4, 8, and 12 weeks a. Group A; b. Group B; c. Group C; d. Group D
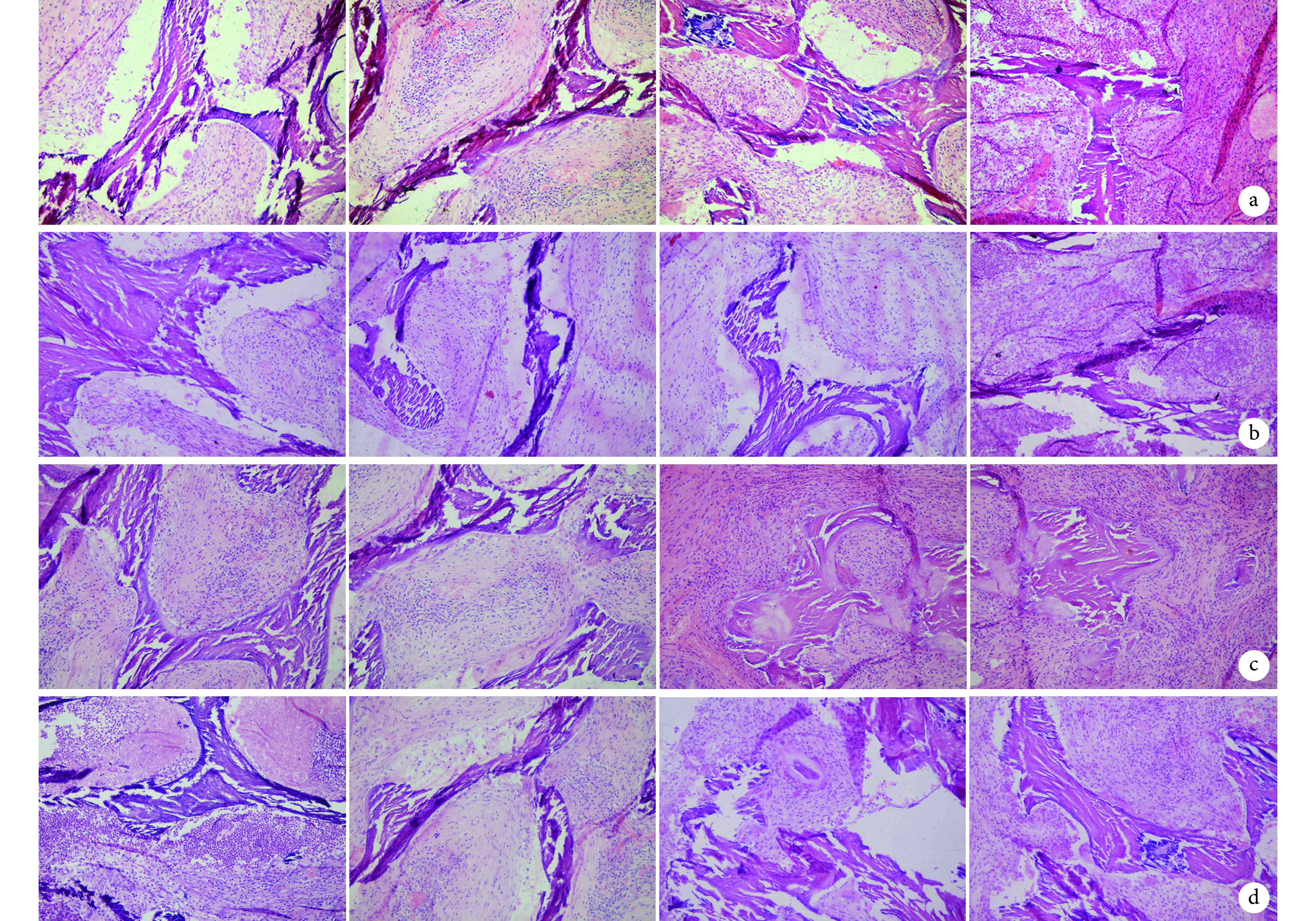
2.2.4. Masson 染色
术后 2 周,A、B、C、D 组支架材料孔隙内出现少量胶原组织,D 组较少。术后 4 周,A、B 组骨支架孔隙内部出现胶原组织,排列整齐;C 组支架孔隙产生大量骨胶原;D 组软组织内部分泌少量胶原,部分支架材料老化深染、断裂。术后 8 周,A、B、D 组破骨细胞侵入支架材料内部,降解、破坏支架材料,周围有胶原形成;C 组外围平行排列大量梭形成纤维细胞,分泌大量胶原编织在一起形成新的骨小梁雏形。术后 12 周,各组支架材料均有骨胶原生成,D 组较少。C 组支架材料部分降解完毕,取代为新的成骨中心,周围存在大量巨噬细胞和新生血管网材料;支架材料周围胶原组织堆积形成新的骨小梁结构,骨细胞包埋进胶原内部,大量骨支架被降解取代。见图 7。
图 7.
Masson staining observation in each group at different time points after operation (Inverted phase contrast microscope×200)
术后各时间点各组 Masson 染色观察(倒置相差显微镜×200)
从左至右依次为术后 2、4、8、12 周 a. A 组;b. B 组;c. C 组;d. D 组
From left to right for postoperative at 2, 4, 8, and 12 weeks a. Group A; b. Group B; c. Group C; d. Group D

定量检测示,术后随时间延长各组骨胶原量均呈逐渐上升趋势,其中 C 组呈直线上升,B 组曲线呈 S 形;A、D 组第 4 周骨胶原量较 2 周时略有下降,8、12 周逐渐上升。术后 2 周,各组间骨胶原量比较差异无统计学意义(F=2.551,P=0.088);术后 4、8、12 周,C 组骨胶原量显著高于其余 3 组,B 组高于 D 组,差异均有统计学意义(P<0.05);A 组与 B、D 组比较差异均无统计学意义(P>0.05)。见图 8。
图 8.
Comparison of the amount of collagen in each group at different time points after operation
术后各时间点各组骨胶原量比较
3. 讨论
3.1. FN 对 PDPB 的表面修饰作用
理想的骨修复支架材料应具有以下特点:可塑性、良好的生物相容性、适当的降解速率、一定力学强度、合适的孔隙率、促成骨性等。单一材料很难满足上述要求。寻找新的材料用于组织工程骨,是目前研究的热点和急需解决的关键科学问题[14]。
PDPB 是应用仿生原理设计研制的支架材料,是天然骨经物理化学方法处理后制得的天然生物衍生骨支架材料,它保持原骨组织的天然网状孔隙结构,去除了骨组织上细胞和大部分蛋白质,蛋白质含量 22.4%±0.83%,钙磷比为 1.74,其主要成分为羟基磷灰石,具有良好的组织相容性和成骨效果,植入机体内未引起严重免疫排斥反应,是一种良好的骨支架材料[5-7]。但 PDPB 制作过程中不仅去除了可以引起免疫排斥反应的细胞和细胞外基质,而且也除去了细胞在支架材料黏附生长所必需的环境。本课题组之前研究中也发现,PDPB 与细胞体外复合后超过 20 d,细胞活性会逐渐降低,老化脱落,可见 PDPB 的细胞和组织相容性还需要进一步改善[8]。FN 存在于正常骨基质中,由成骨细胞分泌,是骨细胞存活、增殖、成骨发生过程中不可缺少的蛋白。很多学者对 FN 的作用进行了广泛研究,有报道认为 FN 不仅能够促进伤口愈合,而且在 FGF 的协同作用下,还能够提高成骨细胞在生物衍生骨支架上的黏附[15]。在细胞黏附过程中,细胞通过表面蛋白与周围基质蛋白的特异性结合,一方面介导细胞黏附,另一方面产生细胞信号传导,引起一系列相应细胞生物学活动[16]。本研究通过扫描电镜发现采用 FN 修饰制备的 PDPBB,可以明显促进细胞在 PDPB 支架材料上的黏附、增殖。
3.2. 评价组织工程骨成骨的实验方法
肌袋包埋实验是评价骨诱导活性的常用方法,骨骼肌中富含具有成骨细胞转化潜能的 MSCs,在一定的诱导条件下可分化为成骨细胞,进而形成一定数量的骨组织[17]。因此,在骨骼肌中形成骨组织不仅是检测一些促进骨形成的生长因子活性的方法,也为获取新的供骨来源提供了新的研究方向[18]。本研究观察显示,PDPBB 及其复合种子细胞的组织工程骨在大鼠股部肌袋中具有成骨活性,主要为膜内成骨。早期主要为类骨质形成,随着骨髓腔的形成及基质分泌的增加,类骨质逐渐钙化为成熟骨组织。其机制可能是 PDPBB 上含有的羟基磷灰石能大量吸附创区渗血渗液中的原始造血细胞、血浆蛋白、纤维结合素、血小板以及其他骨诱导物质,如骨骼生长因子、骨衍生性生长因子、TGF-β 等;再加上植入的 ADSCs 在羟基磷灰石或 VECs 的影响下向成骨方向诱导,为异位新生骨形成提供了细胞保障。
本研究中联合培养细胞组的组织工程骨成骨效能最佳,说明联合培养系统中的 VECs 能促进 ADSCs 向成骨方向诱导,增加成骨效能。在未复合细胞的 PDPBB 材料上也可见新骨形成,说明 PDPBB 不仅只有骨传导作用,还有部分骨诱导作用,其机制还有待进一步研究。
3.3. 联合培养 VECs 对 MSCs 的影响
正常骨组织中存在成骨细胞、破骨细胞、VECs、成纤维细胞和 BMSCs。骨组织的功能是由多种细胞、细胞外基质以及各种细胞因子共同作用完成,只采用一种干细胞显然无法完成构建复杂骨组织的重任。近年学者们越来越认识到联合培养细胞体系的优越性[19],国内外研究重点逐渐由单一细胞培养转向多种细胞共同培养,来完成组织工程骨的构建。
在细胞联合培养方面,越来越多学者认为 VECs 对 MSCs 的成骨分化具有促进作用。Wang 等[20]发现将人成骨细胞和几乎不表达 ALP 活性的人脐静脉内皮细胞共培养时,其 ALP 活性升高并伴随细胞数量增多,而这种作用是内皮细胞通过分泌具有促成骨作用的因子如 IGF-Ⅰ和内皮素 1 来实现的,而成骨细胞可以通过 VEGF 来增强这一作用。Inglis 等[21]在研究共同培养 VECs 和胎儿股骨来源 MSCs 体系中发现,VECs 能提高 MSCs 的 ALP 和Ⅰ型胶原表达,同时得出在成骨与血管生成过程中,VECs 和 MSCs 之间存在重要的、错综复杂的协同作用。Kusumbe 等[22]认为在骨折修复过程中成骨细胞及其前体细胞与 VECs 之间存在相互作用,在骨缺损局部,血管发生和骨形成具有某种偶联关系。该研究证明两种细胞之间关系密切,但未对体外联合培养下两种细胞的增殖和分化影响进行系统研究。Liang 等[23]将内皮祖细胞和 BMSCs 复合于磷酸三钙支架上进行联合培养,结果显示联合培养能够促进组织工程骨的血管化和新骨形成。Verseijden 等[24]分别将 BMSCs 和 ADSCs 与人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)混合培养,结果显示两种来源细胞均能促进 HUVECs 增殖形成血管样结构,其机制可能与细胞之间的接触和信号传递有关。这些研究表明 VECs 能促进 MSCs 的成骨分化和骨组织的血管化。国内学者孙源等[25]也认为联合培养 VECs 对自体 BMSCs 具有促进成骨的作用。
本课题组前期研究中,用大鼠脐血来源的 VECs 和 ADSCs 建立联合培养体系,发现 VECs 不仅能促进 ADSCs 的增殖[4],也可促进 ADSCs 成骨分化[3,26];同时,在没有成骨诱导液作用下,也可使 ADSCs 的 ALP 活性提高和骨钙素分泌增加,表明联合培养体系中 VECs 既能促进 MSCs 的增殖,又能促进 MSCs 的成骨分化,这两种联合细胞在 PDPBB 上的增殖能力明显优于单种细胞[13]。董苑等[27]研究发现联合培养 VECs 和 BMSCs 体系中,VECs 分泌的 BMP-2 对 BMSCs 增殖和成骨诱导分化起着重要作用。杨瑞年等[28-29]研究证实,VECs 可以通过影响 BMSCs 的 Bmi-1 基因促进 BMSCs 增殖,通过促进 Runx-2 基因的表达来影响 BMSCs 的成骨分化。这就可以解释本研究发现的 PDPBB 及其复合 VECs 和 ADSCs 种子细胞的组织工程骨,在大鼠股部肌袋中具有一定成骨活性的结论。
综上述,本研究表明联合培养 VECs 与 ADSCs 作为种子细胞构建的组织工程骨异位成骨能力最强。但 VECs 与 ADSCs 之间的相互作用机制还不太明确,下一步需要进行两种细胞相互影响的基因因素的研究。
作者贡献:王福科负责研究设计、实施及文章撰写;张红负责研究实施及数据收集整理;李彦林、刘流负责研究设计;何川负责数据的统计分析;蔡国锋、宋恩负责研究实施。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。课题经费支持并没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经昆明医科大学第一附属医院医学伦理委员会批准。实验过程中对动物的处置符合2006年科技部《关于善待实验动物的指导性意见》的规定,实验动物生产许可证号:SCXK(滇)2005-0008,实验动物使用许可证号:SYXK(滇)K2015-0002。
Funding Statement
云南省卫生和计划生育委员会医学学科带头人培养计划(D201639);云南省科技厅-昆明医科大学应用基础研究联合专项资金项目(201701UH00095)
The Medical Discipline Leader Training Program of Yunnan Provincial Health and Family Planning Commission (D201639); the Special Fund Project of Applied Basic Research of Yunnan Provincial Science and Technology Department Joint Kunming Medical University (201701UH00095)
References
- 1.Florczyk SJ, Leung M, Li Z, et al Evaluation of three-dimensional porous chitosan-alginate scaffolds in rat calvarial defects for bone regeneration applications. J Biomed Mater Res A. 2013;101(10):2974–2983. doi: 10.1002/jbm.a.v101.10. [DOI] [PubMed] [Google Scholar]
- 2.詹健峰, 刘徐妹, 于博 载 BMP-2 多肽 P24 的巯基化壳聚糖水凝胶诱导异位成骨的实验研究. 中国修复重建外科杂志. 2018;32(9):1144–1149. doi: 10.7507/1002-1892.201806086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.王福科, 刘流, 赵德萍, 等 体外血管内皮细胞和脂肪干细胞联合培养对脂肪干细胞成骨分化的影响. 中国修复重建外科杂志. 2010;24(4):399–405. [Google Scholar]
- 4.王福科, 刘流, 何晓光, 等 血管内皮细胞和脂肪干细胞体外联合培养细胞的增殖. 中国组织工程研究与临床康复. 2010;14(32):6001–6005. doi: 10.3969/j.issn.1673-8225.2010.32.024. [DOI] [Google Scholar]
- 5.李彦林, 杨志明, 解慧琪, 等 生物衍生骨支架材料的体外细胞相容性实验研究. 中国修复重建外科杂志. 2001;15(4):227–231. doi: 10.3321/j.issn:1002-1892.2001.04.013. [DOI] [Google Scholar]
- 6.杨浩, 李彦林, 韩睿, 等 异种骨衍生材料修复节段性骨缺损的实验研究. 昆明医学院学报. 2004;25(1):14–18. doi: 10.3969/j.issn.1003-4706.2004.01.003. [DOI] [Google Scholar]
- 7.李彦林, 杨志明, 解慧琪, 等 生物衍生组织工程骨支架材料的制备及理化特性. 生物医学工程学杂志. 2002;19(1):10–12. doi: 10.3321/j.issn:1001-5515.2002.01.003. [DOI] [Google Scholar]
- 8.王福科, 刘流, 代晓明, 等 纤维粘连蛋白对部分脱蛋白骨细胞相容性影响研究. 昆明医学院学报. 2010;31(1):9–14. doi: 10.3969/j.issn.1003-4706.2010.01.003. [DOI] [Google Scholar]
- 9.裴雪涛 干细胞实验指南. 北京: 科学出版社. 2006:83–100. [Google Scholar]
- 10.王福科, 刘流, 赵德萍, 等 大鼠脐血来源单个核细胞诱导为内皮祖细胞的免疫荧光检测. 中国生物美容. 2009;1(4):10–15. [Google Scholar]
- 11.王福科, 赵德萍, 代晓明, 等 不同类型血清对大鼠脂肪干细胞分离培养的影响. 昆明医学院学报. 2010;31(3):4–10. doi: 10.3969/j.issn.1003-4706.2010.03.002. [DOI] [Google Scholar]
- 12.Han X, Liu L, Wang F, et al Reconstruction of tissue-engineered bone with bone marrow mesenchymal stem cells and partially deproteinized bone in vitro . Cell Biol Int. 2012;36(11):1049–1053. doi: 10.1042/CBI20110501. [DOI] [PubMed] [Google Scholar]
- 13.刘流, 王福科, 赵德萍, 等 联合培养 VECs 与 ADSCs 与部分脱蛋白生物骨体外构建组织工程骨的实验研究. 中国生物美容. 2010;1(1):1–9. [Google Scholar]
- 14.宁钰, 秦文, 任亚辉, 等 载淫羊藿苷/凹凸棒石/Ⅰ型胶原/聚己内酯复合支架修复兔胫骨缺损的实验研究. 中国修复重建外科杂志. 2019;33(9):1–13. [Google Scholar]
- 15.冯立, 曹晓建, 任永信 纤维粘连蛋白与碱性成纤维细胞生长因子对成骨细胞黏附的协同刺激作用. 中国修复重建外科杂志. 2007;21(4):390–395. doi: 10.3321/j.issn:1002-1892.2007.04.019. [DOI] [PubMed] [Google Scholar]
- 16.García AJ, Reyes CD Bio-adhesive surfaces to promote osteoblast differentiation and bone formation. J Dent Res. 2005;84(5):407–413. doi: 10.1177/154405910508400502. [DOI] [PubMed] [Google Scholar]
- 17.Williams JT, Southerland SS, Souza J, et al Cells isolated from adult human skeletal muscle capable of differentiating into multiple mesodermal phenotypes. Am Surg. 1999;65(1):22–26. [PubMed] [Google Scholar]
- 18.Nakagawa T, Tagawa T Ultrastructural study of direct bone formation induced by BMPs-collagen complex implanted into an ectopic site. Oral Dis. 2000;6(3):172–179. doi: 10.1111/j.1601-0825.2000.tb00329.x. [DOI] [PubMed] [Google Scholar]
- 19.Li H, Daculsi R, Grellier M, et al The role of vascular actors in two dimensional dialogue of human bone marrow stromal cell and endothelial cell for inducing self-assembled network. PLoS One. 2011;6(2):e16767. doi: 10.1371/journal.pone.0016767. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Wang DS, Miura M, Demura H, et al Anabolic effects of 1,25-dihydroxyvitamin D3 on osteoblasts are enhanced by vascular endothelial growth factor produced by osteoblasts and by growth factors produced by endothelial cells. Endocrinology. 1997;138(7):2953–2962. doi: 10.1210/endo.138.7.5275. [DOI] [PubMed] [Google Scholar]
- 21.Inglis S, Christensen D, Wilson DI, et al Human endothelial and foetal femur-derived stem cell co-cultures modulate osteogenesis and angiogenesis. Stem Cell Res Ther. 2016;7:13. doi: 10.1186/s13287-015-0270-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kusumbe AP, Ramasamy SK, Adams RH Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 2014;507(7492):323–328. doi: 10.1038/nature13145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Liang Y, Wen L, Shang F, et al Endothelial progenitors enhanced the osteogenic capacities of mesenchymal stem cells in vitro and in a rat alveolar bone defect model . Arch Oral Biol. 2016;68:123–130. doi: 10.1016/j.archoralbio.2016.04.007. [DOI] [PubMed] [Google Scholar]
- 24.Verseijden F, Posthumus-van Sluijs SJ, Pavljasevic P, et al Adult human bone marrow- and adipose tissue-derived stromal cells support the formation of prevascular-like structures from endothelial cells in vitro. Tissue Eng Part A. 2010;16(1):101–114. doi: 10.1089/ten.tea.2009.0106. [DOI] [PubMed] [Google Scholar]
- 25.孙源, 林红, 吴子征, 等 联合培养时诱导的内皮细胞对自体骨髓基质干细胞成骨作用的影响. 中华创伤骨科杂志. 2006;8(10):919–923. doi: 10.3760/cma.j.issn.1671-7600.2006.10.006. [DOI] [Google Scholar]
- 26.Zhao X, Liu L, Wang FK, et al Coculture of vascular endothelial cells and adipose-derived stem cells as a source for bone engineering. Ann Plast Surg. 2012;69(1):91–98. doi: 10.1097/SAP.0b013e3182583eb9. [DOI] [PubMed] [Google Scholar]
- 27.董苑, 杨瑞年, 王福科, 等 BMP2 的表达对联合培养体系中骨髓间充质干细胞增殖和成骨分化的影响. 中华显微外科杂志. 2013;36(4):352–355. doi: 10.3760/cma.j.issn.1001-2036.2013.04.010. [DOI] [Google Scholar]
- 28.杨瑞年, 刘流, 王福科, 等 联合培养体系中对骨髓间充质干细胞 Bmi-1 表达的影响. 中国组织工程研究. 2012;16(14):2524–2529. doi: 10.3969/j.issn.1673-8225.2012.14.011. [DOI] [Google Scholar]
- 29.杨瑞年, 刘流, 王福科, 等 血管内皮细胞对联合培养体系中骨髓间充质干细胞侏儒症相关转录因子表达及成骨分化的影响. 中国组织工程研究. 2012;16(19):3447–3449. doi: 10.3969/j.issn.1673-8225.2012.19.006. [DOI] [Google Scholar]