Abstract
目的
采用低温沉积 3D 打印技术制备聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]支架,复合脱细胞软骨细胞外基质(decellularized articular cartilage extracellular matrix,DACECM)制备 PLGA/DACECM 组织工程软骨支架,探讨其理化特性。
方法
利用低温沉积 3D 打印技术制备 PLGA 支架。采用改良式物理、化学脱细胞方法制备 DACECM 混悬液。利用冷冻干燥和物理化学法交联技术制备 DACECM 取向支架,同法将 DACECM 混悬液与 PLGA 支架复合制备 PLGA/DACECM 取向支架。通过大体观察、扫描电镜观察 3 种支架宏观、微观结构,组织学及免疫组织化学染色定性分析 DACECM 取向支架成分,生物力学试验检测 3 种支架压缩模量。于 SD 大鼠皮下包埋 3 种支架,HE 染色观察免疫排斥反应。分离培养新西兰大白兔软骨细胞,制备 3 种细胞-支架复合物,扫描电镜观察细胞在支架上的生长黏附情况。取鼠 L-929 成纤维细胞分别于 3 种支架浸提液进行培养,以 DMEM 培养液培养细胞作为对照,细胞计数试剂盒 8(cell counting kit 8,CCK-8)法检测细胞增殖情况。
结果
大体观察和扫描电镜观察示,PLGA 支架表面较光滑,可见大孔;DACECM 取向支架表面粗糙,为疏松多孔相互连通的三维立体结构;PLGA/DACECM 取向支架表面粗糙,大孔与小孔相互连通,具有垂直三维立体结构。组织学及免疫组织化学定性分析显示,DACECM 脱细胞完全,保留了软骨基质的糖胺聚糖和Ⅱ型胶原蛋白成分。生物力学检测示,DACECM 取向支架压缩模量显著低于其余 2 种支架(P<0.05),PLGA 支架和 PLGA/DACECM 取向支架间差异无统计学意义(P>0.05)。SD 大鼠皮下包埋实验示,DACECM 取向支架和 PLGA/DACECM 取向支架的免疫排斥反应明显低于 PLGA 支架。细胞-支架复合物扫描电镜观察示,软骨细胞在 PLGA 支架上未见明显黏附,大量软骨细胞在 PLGA/DACECM 取向支架和 DACECM 取向支架表面黏附、生长。CCK-8 检测示,随培养时间延长,各组细胞数量均呈递增趋势,各时间点组间吸光度(A)值比较差异均无统计学意义(P>0.05)。
结论
PLGA/DACECM 取向支架具有无细胞毒性、优良的理化性能,有望成为一种组织工程软骨支架材料。
Keywords: 软骨组织工程, 支架材料, 3D 打印技术, 聚乳酸-羟基乙酸共聚物, 脱细胞软骨细胞外基质, 理化特性
Abstract
Objective
To manufacture a poly (lactic-co-glycolic acid) (PLGA) scaffold by low temperature deposition three-dimensional (3D) printing technology, prepare a PLGA/decellularized articular cartilage extracellular matrix (DACECM) cartilage tissue engineered scaffold by combining DACECM, and further investigate its physicochemical properties.
Methods
PLGA scaffolds were prepared by low temperature deposition 3D printing technology, and DACECM suspensions was prepared by modified physical and chemical decellularization methods. DACECM oriented scaffolds were prepared by using freeze-drying and physicochemical cross-linking techniques. PLGA/DACECM oriented scaffolds were prepared by combining DACECM slurry with PLGA scaffolds. The macroscopic and microscopic structures of the three kinds of scaffolds were observed by general observation and scanning electron microscope. The chemical composition of DACECM oriented scaffold was analyzed by histological and immunohistochemical stainings. The compression modulus of the three kinds of scaffolds were measured by biomechanical test. Three kinds of scaffolds were embedded subcutaneously in Sprague Dawley rats, and HE staining was used to observe immune response. The chondrocytes of New Zealand white rabbits were isolated and cultured, and the three kinds of cell-scaffold complexes were prepared. The growth adhesion of the cells on the scaffolds was observed by scanning electron microscope. Three kinds of scaffold extracts were cultured with L-929 cells, the cells were cultured in DMEM culture medium as control group, and cell counting kit 8 (CCK-8) was used to detect cell proliferation.
Results
General observation and scanning electron microscope showed that the PLGA scaffold had a smooth surface and large pores; the surface of the DACECM oriented scaffold was rough, which was a 3D structure with loose pores and interconnected; and the PLGA/DACECM oriented scaffold had a rough surface, and the large hole and the small hole were connected to each other to construct a vertical 3D structure. Histological and immunohistochemical qualitative analysis demonstrated that DACECM was completely decellularized, retaining the glycosaminoglycans and collagen typeⅡ. Biomechanical examination showed that the compression modulus of DACECM oriented scaffold was significantly lower than those of the other two scaffolds (P<0.05). There was no significant difference between PLGA scaffold and PLGA/DACECM oriented scaffold (P>0.05). Subcutaneously embedded HE staining of the three scaffolds showed that the immunological rejections of DACECM and PLGA/DACECM oriented scaffolds were significantly weaker than that of the PLGA scaffold. Scanning electron microscope observation of the cell-scaffold complex showed that chondrocytes did not obviously adhere to PLGA scaffold, and a large number of chondrocytes adhered and grew on PLGA/DACECM oriented scaffold and DACECM oriented scaffold. CCK-8 assay showed that with the extension of culture time, the number of cells cultured in the three kinds of scaffold extracts and the control group increased. There was no significant difference in the absorbance (A) value between the groups at each time point (P>0.05).
Conclusion
The PLGA/DACECM oriented scaffolds have no cytotoxicity, have excellent physicochemical properties, and may become a promising scaffold material of tissue engineered cartilage.
Keywords: Cartilage tissue engineering, scaffold material, three-dimensional printing technology, poly (lactic-co-glycolic acid), decellularized articular cartilage extracellular matrix, physicochemical property
关节软骨由于无血液供应、神经支配和淋巴循环的特殊结构,导致其损伤后难以自我修复[1]。关节软骨损伤随着时间发展逐渐累及软骨下骨,最终导致骨关节炎的发生[2]。临床治疗关节软骨缺损的方法包括微骨折术、自体移植或同种异体移植等,但均不能完全满足临床以及患者预后的运动要求[3-6]。与传统治疗方法相比,组织工程再生医学为软骨损伤提供了一种非常有前景的替代治疗方法[7]。支架、细胞因子和种子细胞是组织工程再生医学 3 个关键要素[8]。恰当合理地选择支架材料,对软骨组织工程尤为重要。大量研究表明,脱细胞软骨细胞外基质(decellularized articular cartilage extracellular matrix,DACECM)是用于软骨再生的优良生物材料之一[9-11],然而 DACECM 作为支架缺乏足够的力学性能。人工合成聚合物聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]具有良好的生物力学性能和可控的生物降解速率[12-13],但疏水性和内在生物活性的缺乏限制了其应用。
软骨组织工程支架传统的制备工艺普遍存在支架形状局限、孔径大小难以控制、力学强度不足等缺点。3D 打印技术可以克服传统支架制造方法在形态和工艺一致性方面的限制,实现高精密度支架的制备[14-16]。此外,低温沉积 3D 打印技术可在不破坏 PLGA 材料微观结构的条件下,实现 PLGA 溶液的快速成型[17-18]。
本研究采用低温沉积 3D 打印技术制备 PLGA 支架,进而将 DACECM 灌注于 3D 打印 PLGA 支架中,通过冷冻干燥、物理化学交联制备具有软骨仿生性结构的 PLGA/DACECM 取向支架,以期获得既具有良好力学性能,又有利于软骨细胞黏附、增殖及细胞表型维持的组织工程软骨支架材料。同时,对支架理化特性进行检测,为下一步动物体内实验奠定研究基础。
1. 材料与方法
1.1. 主要材料、试剂及仪器
市售健康新鲜家猪膝关节。健康 1 月龄 SD 大鼠 12 只,体质量约 200 g;健康 1 月龄新西兰大白兔 3 只,体质量 0.5~0.6 kg;均购自解放军总医院实验动物中心。鼠 L-929 成纤维细胞(上海斯信生科科技有限公司)。
PLGA(聚乳酸∶聚羟基乙酸=75∶25,相对分子质量 10.2 万;山东济南岱罡生物科技有限公司);1,4-二氧六环(上海阿拉丁生化科技股份有限公司);胶原酶、胰蛋白酶粉剂、DNase 粉剂、RNase 粉剂(Sigma 公司,美国);FBS(HyClone 公司,美国);DMEM 培养基(Corning 公司,美国);细胞计数试剂盒 8(cell counting kit 8,CCK-8;同仁公司,日本);Triton X-100(J.T.Baker 公司,美国)。
3D 生物打印机、3D-Bioplotter 软件(青岛尤尼科技有限公司);计算机辅助设计软件 UG(Siemens 公司,德国);九阳家用粉碎机(山东九阳股份有限公司);Beckman J-25 低温高速离心机(Beckman 公司,美国);FD-1 冷冻干燥机(北京博医康实验仪器有限公司);Bio-link 紫外交联仪(北京博威兴业科技发展有限公司);BOSE 5100 生物力学试验机(BOSE 公司,美国);CO2 培养箱(Heraeus 公司,德国);BCPCAS-4800 扫描电镜(Hitachi 公司,日本);BH-2 生物显微镜(Olympus 公司,日本)。
1.2. 各支架制备方法
1.2.1. PLGA 支架
根据预实验结果,准确称取 PLGA 4.0 g,加入 10 mL 1,4-二氧六环溶液中,磁力搅拌至 PLGA 完全溶解,制备 40%PLGA 溶液。通过体外组织学、生物力学等多角度综合分析研究软骨不同层次参数,将所得参数通过计算机辅助设计软件设计所需要形状,利用 3D-Bioplotter 软件调用上述数据文件,设定支架层-层之间的排列角度和孔径大小,打印出仿生软骨微结构的 PLGA 软骨组织工程仿生支架。
3D 打印参数:平台成型温度−20℃,打印层厚 0.1 mm,打印速度 10 mm/s。具体步骤:① 使用 3D 打印机将 PLGA 溶液按照设定的打印参数进行打印,−20℃ 预冻 2 h,置于冷冻干燥机中干燥升华 24 h 得到 PLGA 支架初步成型结构。② 将 PLGA 支架经 10%NaOH 溶液浸泡 2 h,PBS 反复清洗至 pH7.0,−20℃ 预冻 2 h,置于冷冻干燥机中干燥升华 24 h。③ 将支架置于紫外交联仪中,调节波长至 258 nm 交联 4 h。用 50 mmol/L EDAC 与 20 mmol/L NHS 无水乙醇溶液 4℃ 下交联 24 h 后,无菌 PBS、三蒸水反复漂洗。④ 支架再次冷冻干燥后密封,60Co消毒,4℃ 下保存备用。
1.2.2. DACECM 取向支架
采用改良式物理、化学脱细胞方法制备 DACECM 浆料[19-20]。具体操作如下:常规消毒猪膝关节,在无菌条件下打开膝关节,切取透明软骨组织,并将其剪成 1 mm×1 mm×1 mm 的薄片,置入无菌容器内,加入过氧化氢漂洗 3 次(5 min/次),然后用无菌 PBS 溶液反复漂洗 3 次(5 min/次)。在无菌搅拌机中加入适量无菌去离子水,置入漂洗后的软骨薄片反复进行湿法粉碎,最终形成软骨匀浆。使用无菌去离子水充分稀释软骨匀浆后进行差速离心(离心半径 13 cm):低转速 1 500 r/min 离心 5 min,分离沉淀,保留上清液;取上清液分别以 2 000 r/min 离心 15 min,6 000 r/min 离心 20 min,取上清液,保留沉淀;取上清液以 10 000 r/min 离心 30 min,收集沉淀。在最终所得沉淀中先后加入 3%Triton X-100 和 0.25% 胰蛋白酶,充分搅拌,4℃ 条件下进行脱细胞处理各 12 h,然后用无菌 PBS 反复清洗;再于 37℃ 条件下分别加入 1 U/mL RNase 与 50 U/mL DNase,搅拌均匀以去除核物质;处理完成后再次用无菌去离子水与 PBS 液反复清洗,最后以离心半径 13 cm、10 000 r/min 离心 30 min,所得沉淀即为 DACECM。使用无菌去离子水将 DACECM 配制为 3%(M/V)混悬液,于 4℃ 无菌条件下保存备用。
将 DACECM 混悬液置入特定模具中,−20℃ 预冻 2 h,置于冷冻干燥机中干燥升华 24 h。将支架置于紫外交联仪中,调节波长至 258 nm 交联 4 h。用 50 mmol/L EDAC 与 20 mmol/L NHS 无水乙醇溶液 4℃ 下交联 24 h 后,无菌 PBS、三蒸水反复漂洗。支架再次冷冻干燥后密封,60Co消毒,4℃ 下保存备用。
1.2.3. PLGA/DACECM 取向支架
将 3D 打印 PLGA 支架经 10%NaOH 溶液浸泡 2 h,PBS 反复清洗至 pH7.0;将 3%DACECM 混悬液均匀灌注于 3D 打印的 PLGA 支架内,4℃ 下过夜,−20℃ 预冻 2 h,转移至冷冻干燥机中升华干燥 24 h。取出支架在距离光源 5 cm、波长 258 nm 处紫外线交联 4 h。用 50 mmol/L EDAC 与 14 mmol/L NHS 水溶液 4℃ 下交联 24 h 后,无菌 PBS、三蒸水反复漂洗。支架再次冷冻干燥后密封,60Co消毒,4℃ 下保存备用。
1.3. 观测指标
1.3.1. 支架大体及微观结构观察
取 3 种支架观察大体结构;清洗、固定、梯度乙醇脱水等处理后,室温干燥,样品喷金后扫描电镜观察微观结构。
1.3.2. DACECM 取向支架的组织学及免疫组织化学定性分析
取 DACECM 取向支架,包埋后行冰冻切片(8 μm 厚),无水乙醇室温下固定 30 min,室温干燥后的切片分别行 HE 染色、甲苯胺蓝染色、番红 O 染色及Ⅱ型胶原免疫组织化学染色。
1.3.3. 支架生物力学检测
将冻干后的 3 种支架样本裁剪为 5 mm×10 mm×10 mm 大小,室温下浸泡于 PBS 缓冲液中至完全浸润后取出,使用 BOSE 5100 生物力学试验机进行力学检测。预压缩 5%,以恒定的压缩速率(5 mm/min)进行压缩,当应变达到 20% 时停止检测,获得应力-应变曲线,计算压缩模量。
1.3.4. 支架的免疫排斥分析
取 SD 大鼠 12 只,随机分为 3 组,每组 4 只,分别为 PLGA 组、DACECM 组和 PLGA/DACECM 组。大鼠以腹腔注射 0.3% 戊巴比妥钠(1 mL/100 g)麻醉后,常规背部备皮。于背部取长约 0.5 cm 切口,切开皮肤,游离皮下组织,将制备的统一规格(5 mm×5 mm×1 mm)无菌 PLGA 支架、DACECM 取向支架和 PLGA/DACECM 取向支架,分别按照组别植入大鼠皮下。术后 2、4、8 周过量麻醉处死大鼠取材,常规行 HE 染色,观察炎性细胞浸润情况。
1.3.5. 支架细胞毒性的体外评估
① 兔软骨细胞的分离和培养:取 1 月龄新西兰大白兔,氯胺酮与速眠新Ⅱ号按照 1∶1(V/V)比例混合后,肌肉注射(0.5 mL/kg)麻醉。无菌条件下,分离培养软骨细胞并传代培养[21]。取冻干后 3 种支架,裁剪为 3.5 mm×3.5 mm×1.5 mm 大小,60Co消毒后转移至无菌 24 孔板中备用。取第 2 代兔软骨细胞制备浓度为 1×106个/mL 的细胞悬液,吸取 100 μL 细胞悬液分别接种于 3 种支架上。置入 37℃、5%CO2 培养箱中孵育 4 h,加入 DMEM 培养液,培养 3 d 后取出细胞-支架复合物,以 2.5% 戊二醛 4℃ 恒温下固定 24 h。支架经清洗、固定、梯度乙醇脱水等处理后,室温干燥,样品喷金,扫描电镜观察细胞-支架复合物中细胞黏附及生长情况。
② 支架 CCK-8 细胞毒性检测:按照 ISO 10993-12(2009)标准,将冻干后的 3 种支架按照 3 cm2/mL 加入 DMEM 培养液中,37℃ 下温育 3 d。收集浸提液,于浸提液中加入 FBS 至浓度为 10%(V/V)、双抗(青霉素-链霉素)至浓度为 1%(V/V),得到 3 种支架的浸提液培养基。在 96 孔板中每孔接种 3×103个鼠 L-929 成纤维细胞,每组设置 3 孔样本,分别加入 3 种支架的浸提液培养基各 100 μL;对照组用正常 DMEM 培养基培养细胞。于 37℃、5%CO2 培养箱内培养 1、3、5 d 后,分别加入 10 μL CCK-8 试剂,孵育 2 h 后用酶标仪测量 450 nm 波长处的吸光度(A)值。
1.4. 统计学方法
采用 SPSS19.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用 SNK 检验;检验水准 α=0.05。
2. 结果
2.1. 支架形态及微观结构观察
大体观察示,3 种支架均呈圆形结构,DACECM 均匀附着于 PLGA 支架孔隙中。见图 1。扫描电镜观察示,PLGA 支架表面较光滑,可见大孔;DACECM 取向支架表面粗糙,为疏松多孔相互连通的三维立体结构;PLGA/DACECM 取向支架表面粗糙,大孔与小孔相互连通,具有垂直三维立体结构。见图 2。
图 1.
General observation of three scaffolds
3 种支架大体观察
1:PLGA 支架 2:PLGA/DACECM 取向支架 3:DACECM 取向支架
1: PLGA scaffold; 2: PLGA/DACECM oriented scaffold; 3: DACECM oriented scaffold
图 2.
Scanning electron microscope observation of three scaffolds (×50)
3 种支架扫描电镜观察(×50)
a. PLGA 支架;b. DACECM 取向支架;c. PLGA/DACECM 取向支架
a. PLGA scaffold; b. DACECM oriented scaffold; c. PLGA/DACECM oriented scaffold

2.2. DACECM 取向支架的组织学及免疫组织化学定性分析
HE 染色未见细胞核物质;甲苯胺蓝和番红 O 染色阳性,提示 DACECM 中含有糖胺聚糖(glycosaminoglycans,GAGs)成分;免疫组织化学染色示 DACECM 中有Ⅱ型胶原蛋白。见图 3。
图 3.
Histological and immunohistochemical staining observations of DACECM oriented scaffold (×200)
DACECM 取向支架的组织学及免疫组织化学染色观察(×200)
a. HE 染色;b. 甲苯胺蓝染色;c. 番红 O 染色;d. Ⅱ型胶原免疫组织化学染色
a. HE staining; b. Toluidine blue staining; c. Safranin O staining; d. Immunohistochemical staining of collagen type Ⅱ
2.3. 支架生物力学检测
PLGA 支架、DACECM 取向支架和 PLGA/DACECM 取向支架的压缩模量分别为(4.34±0.82)、(0.11±0.04)和(3.39±0.85)MPa,DACECM 取向支架压缩模量显著低于其余 2 种支架,差异有统计学意义(P<0.05);PLGA 支架和 PLGA/DACECM 取向支架间比较差异无统计学意义(P>0.05)。
2.4. 支架的免疫排斥分析
HE 染色示,术后 2、4 周 3 组支架炎性细胞浸润情况均较严重,浸润程度由轻到重依次为 DACECM 组、PLGA/DACECM 组、PLGA 组。随着时间延长,各组炎性细胞浸润情况均明显减轻,8 周时 3 组支架周围均未见明显炎性反应。见图 4。
图 4.
HE staining at different time points of subcutaneous embedding in three groups of rats (×200)
3 组支架大鼠皮下包埋各时间点 HE 染色观察(×200)
从左至右依次为 PLGA 组、DACECM 组和 PLGA/DACECM 组 a.2 周;b. 4 周;c. 8 周
From left to right for PLGA group, DACECM group, and PLGA/DACECM group, respectively a. Two weeks; b. Four weeks; c. Eight weeks

2.5. 支架细胞毒性的体外评估
细胞-支架复合物扫描电镜观察示,软骨细胞在 PLGA 支架上未见明显黏附;大量软骨细胞在 PLGA/DACECM 取向支架和 DACECM 取向支架表面黏附、生长,两种支架软骨细胞的黏附、生长无明显区别。见图 5。
图 5.
Scanning electron microscope observation of three cell-scaffold complexes
3 种细胞-支架复合物扫描电镜观察
从左至右依次为 PLGA 支架-细胞复合物、DACECM 取向支架-细胞复合物、PLGA/DACECM 取向支架-细胞复合物 a. ×150;b. ×300
From left to right for PLGA scaffold-cell complex, DACECM scaffold-cell complex, and PLGA/DACECM scaffold-cell complex a. ×150; b. ×300

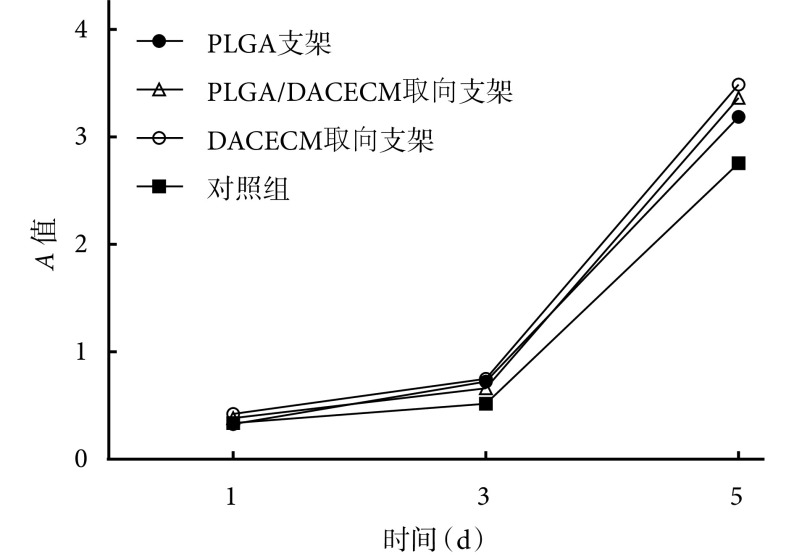
CCK-8 检测示,3 种支架浸提液培养的细胞以及对照组细胞随培养时间延长,细胞数量呈递增趋势。各时间点各组间 A 值比较差异均无统计学意义(P>0.05)。见图 6。
图 6.
Detection of cytotoxicity in each group by CCK-8 method
CCK-8 法检测各组细胞毒性
3. 讨论
组织工程软骨支架不仅必须为组织再生提供合适的微环境,还必须具有生物力学性能以抵抗正常的应力。支架的细胞亲和性对于组织再生很重要,本研究扫描电镜观察和 CCK-8 检测结果表明,DACECM 取向支架和 PLGA/DACECM 取向支架比 PLGA 支架更有利于细胞黏附和增殖。这可能与 PLGA 的疏水性能有关,DACECM 与 PLGA 结合后,复合支架亲水性明显增加。此外,复合支架多孔隙且表面粗糙的结构可显著促进细胞的增殖、分化、黏附[22-23]。支架的免疫排斥实验说明 3 种支架均具有较低的免疫原性。研究表明力学强度差的支架材料很难承载软骨活动的压缩应力,高力学强度的支架不仅起到暂时力学支撑替代作用,而且适当的应力刺激还能促进细胞的增殖、分化以及与周围正常软骨区域的整合[24-28]。本研究生物力学检测示,PLGA 支架压缩模量与 PLGA/DACECM 取向支架比较差异无统计学意义,均显著高于 DACECM 取向支架。
本研究显示,DACECM 保留了关节软骨细胞外基质中的主要成分 GAGs 和Ⅱ型胶原。其良好的生物学特性可有效地诱导与维持关节腔内 MSCs 成软骨分化[10, 29-33]。PLGA/DACECM 取向支架一方面可以利用 PLGA 提供力学支撑,而且其降解缓慢,可长期存在于膝关节内,为新生组织的成熟提供一个时间窗口[12];另一方面,DACECM 具有良好的生物相容性,可以使支架具有更好的软骨诱导性特点;此外,仿生的软骨环境条件及垂直取向结构又可以进一步诱导软骨功能蛋白的累积和天然结构的再生,使其发挥正常的软骨功能[21]。PLGA/DACECM 取向支架可以充分利用两种材料的优势,达到优势互补。所以我们认为,PLGA/DACECM 取向支架比单纯 PLGA 支架和 DACECM 取向支架更适合软骨的再生修复。
综上述,本研究采用低温沉积 3D 打印技术和改良式物理、化学脱细胞法、冷冻干燥、物理化学法交联技术等,立足于满足软骨再生修复不同阶段(诱导分化阶段、成熟阶段)的关键要素,成功构建了新型组织工程软骨仿生支架。在诱导分化阶段利用软骨细胞外基质诱导干细胞向软骨方向分化;成熟阶段利用 3D 打印 PLGA 取向支架,为新生软骨成熟提供良好的力学条件及仿生微结构。PLGA/DACECM 取向支架具有良好的生物学与力学特性,有作为软骨缺损修复替代材料的潜力。但 PLGA/DACECM 取向支架在募集内源性干细胞功能方面有所欠缺。针对组织工程软骨支架研究现状,通过整合传统与新型组织工程支架制备工艺,构建既能募集内源性干细胞,又能仿生软骨天然微环境及微结构,且有利于新生组织成熟的组织工程软骨支架,转变传统的首先经过体外构建细胞支架复合体、再植入体内进行软骨修复的模式,将是组织工程软骨修复研究新方向。
作者贡献:张彬参与实验设计,数据收集、整理、分析,撰写文章;沈师、鲜海参与实验设计,动物实验,收集实验原始数据;代永静、刘舒云、鲁晓波参与指导实验设计,文章撰写及修改;郭维民参与指导实验设计,统计分析,文章撰写及修改;李旭参与实验设计,动物实验,英文翻译;张学亮、王振勇、李浩江参与实验设计,原材料的收集及制备;彭礼庆、罗旭江参与实验设计,原材料的收集及制备,实验细胞的培养;郭全义指导实验设计、统筹实验进度、文章撰写及修改。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。基金项目经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经中国人民解放军总医院医学/动物实验伦理委员会批准。实验动物使用许可证批准号:SYXK(军)2015-0003。
Biography
郭全义:中华医学会组织工程与再生医学分会副主任委员、中国医药生物技术协会骨组织库分会副主任委员
Funding Statement
国家重点研发计划资助项目(2018YFC1105902);国家自然科学基金面上项目(81772319)
National Key Research and Development Plan of China (2018YFC1105902); National Natural Science Foundation of China (81772319)
Contributor Information
晓波 鲁 (Xiaobo LU), Email: luxiaobo1963@126.com.
全义 郭 (Quanyi GUO), Email: doctorguo_301@163.com.
References
- 1.Li X, Ding J, Wang J, et al Biomimetic biphasic scaffolds for osteochondral defect repair. Regen Biomater. 2015;2(3):221–228. doi: 10.1093/rb/rbv015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Correa D, Lietman SA Articular cartilage repair: Current needs, methods and research directions. Semin Cell Dev Biol. 2017;62:67–77. doi: 10.1016/j.semcdb.2016.07.013. [DOI] [PubMed] [Google Scholar]
- 3.DiBartola AC, Wright BM, Magnussen RA, et al Clinical outcomes after autologous chondrocyte implantation in adolescents’ knees: a systematic review. Arthroscopy. 2016;32(9):1905–1916. doi: 10.1016/j.arthro.2016.03.007. [DOI] [PubMed] [Google Scholar]
- 4.Boushell MK, Hung CT, Hunziker EB, et al Current strategies for integrative cartilage repair. Connect Tissue Res. 2017;58(5):393–406. doi: 10.1080/03008207.2016.1231180. [DOI] [PubMed] [Google Scholar]
- 5.Mithoefer K, McAdams T, Williams RJ, et al Clinical efficacy of the microfracture technique for articular cartilage repair in the knee: an evidence-based systematic analysis. Am J Sports Med. 2009;37(10):2053–2063. doi: 10.1177/0363546508328414. [DOI] [PubMed] [Google Scholar]
- 6.Hangody L, Vásárhelyi G, Hangody LR, et al Autologous osteochondral grafting—technique and long-term results. Injury. 2008;39(Suppl 1):S32–S39. doi: 10.1016/j.injury.2008.01.041. [DOI] [PubMed] [Google Scholar]
- 7.Johnstone B, Alini M, Cucchiarini M, et al Tissue engineering for articular cartilage repair—the state of the art. Eur Cell Mater. 2013;25:248–267. doi: 10.22203/ecm.v025a18. [DOI] [PubMed] [Google Scholar]
- 8.Pereira H, Frias AM, Oliveira JM, et al Tissue engineering and regenerative medicine strategies in meniscus lesions. Arthroscopy. 2011;27(12):1706–1719. doi: 10.1016/j.arthro.2011.08.283. [DOI] [PubMed] [Google Scholar]
- 9.Oh HJ, Kim SH, Cho JH, et al Mechanically reinforced extracellular matrix scaffold for application of cartilage tissue engineering. Tissue Eng Regen Med. 2018;15(3):287–299. doi: 10.1007/s13770-018-0114-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kang H, Peng J, Lu S, et al In vivo cartilage repair using adipose-derived stem cell-loaded decellularized cartilage ECM scaffolds . J Tissue Eng Regen Med. 2014;8(6):442–453. doi: 10.1002/term.v8.6. [DOI] [PubMed] [Google Scholar]
- 11.Benders KE, van Weeren PR, Badylak SF, et al Extracellular matrix scaffolds for cartilage and bone regeneration. Trends Biotechnol. 2013;31(3):169–176. doi: 10.1016/j.tibtech.2012.12.004. [DOI] [PubMed] [Google Scholar]
- 12.Yan B, Zhang Z, Wang X, et al PLGA-PTMC-cultured bone mesenchymal stem cell scaffold enhances cartilage regeneration in tissue-engineered tracheal transplantation. Artif Organs. 2017;41(5):461–469. doi: 10.1111/aor.2017.41.issue-5. [DOI] [PubMed] [Google Scholar]
- 13.Ngiam M, Liao S, Patil AJ, et al The fabrication of nano-hydroxyapatite on PLGA and PLGA/collagen nanofibrous composite scaffolds and their effects in osteoblastic behavior for bone tissue engineering. Bone. 2009;45(1):4–16. doi: 10.1016/j.bone.2009.03.674. [DOI] [PubMed] [Google Scholar]
- 14.Gauvin R, Chen YC, Lee JW, et al Microfabrication of complex porous tissue engineering scaffolds using 3D projection stereolithography. Biomaterials. 2012;33(15):3824–3834. doi: 10.1016/j.biomaterials.2012.01.048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.信更新, 刘毅 组织工程多孔支架的构建方法. 中国美容整形外科杂志. 2018;29(8):500–503. doi: 10.3969/j.issn.1673-7040.2018.08.016. [DOI] [Google Scholar]
- 16.Dutta RC, Dey M, Dutta AK, et al Competent processing techniques for scaffolds in tissue engineering. Biotechnol Adv. 2017;35(2):240–250. doi: 10.1016/j.biotechadv.2017.01.001. [DOI] [PubMed] [Google Scholar]
- 17.Yen HJ, Hsu SH, Tseng CS, et al Fabrication of precision scaffolds using liquid-frozen deposition manufacturing for cartilage tissue engineering. Tissue Eng Part A. 2009;15(5):965–975. doi: 10.1089/ten.tea.2008.0090. [DOI] [PubMed] [Google Scholar]
- 18.Hung KC, Tseng CS, Dai LG, et al Water-based polyurethane 3D printed scaffolds with controlled release function for customized cartilage tissue engineering. Biomaterials. 2016;83:156–168. doi: 10.1016/j.biomaterials.2016.01.019. [DOI] [PubMed] [Google Scholar]
- 19.Gilbert TW, Sellaro TL, Badylak SF Decellularization of tissues and organs. Biomaterials. 2006;27(19):3675–3683. doi: 10.1016/j.biomaterials.2006.02.014. [DOI] [PubMed] [Google Scholar]
- 20.郭维民, 刘舒云, 高钺, 等 新型脱细胞半月板细胞外基质的制备及其生物相容性的研究. 中国医药生物技术. 2015;10(1):5–10. [Google Scholar]
- 21.鹿亮, 刘彬, 尚希福, 等 脱细胞软骨细胞外基质取向支架复合软骨细胞构建组织工程软骨的实验研究. 中国修复重建外科杂志. 2018;32(3):291–297. doi: 10.7507/1002-1892.201710095. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Sun F, Zhou H, Lee J Various preparation methods of highly porous hydroxyapatite/polymer nanoscale biocomposites for bone regeneration. Acta Biomater. 2011;7(11):3813–3828. doi: 10.1016/j.actbio.2011.07.002. [DOI] [PubMed] [Google Scholar]
- 23.Zhao C, Tan A, Pastorin G, et al Nanomaterial scaffolds for stem cell proliferation and differentiation in tissue engineering. Biotechnol Adv. 2013;31(5):654–668. doi: 10.1016/j.biotechadv.2012.08.001. [DOI] [PubMed] [Google Scholar]
- 24.Ingber DE The mechanochemical basis of cell and tissue regulation. Mech Chem Biosyst. 2004;1(1):53–68. [PubMed] [Google Scholar]
- 25.Wang JH, Thampatty BP Mechanobiology of adult and stem cells. Int Rev Cell Mol Biol. 2008;271:301–346. doi: 10.1016/S1937-6448(08)01207-0. [DOI] [PubMed] [Google Scholar]
- 26.Waldman SD, Spiteri CG, Grynpas MD, et al Long-term intermittent shear deformation improves the quality of cartilaginous tissue formed in vitro . J Orthop Res. 2003;21(4):590–596. doi: 10.1016/S0736-0266(03)00009-3. [DOI] [PubMed] [Google Scholar]
- 27.Nugent GE, Aneloski NM, Schmidt TA, et al Dynamic shear stimulation of bovine cartilage biosynthesis of proteoglycan 4. Arthritis Rheum. 2006;54(6):1888–1896. doi: 10.1002/(ISSN)1529-0131. [DOI] [PubMed] [Google Scholar]
- 28.Zhang Y, Chen S, Pei M Biomechanical signals guiding stem cell cartilage engineering: from molecular adaption to tissue functionality. Eur Cell Mater. 2016;31:59–78. doi: 10.22203/ecm.v031a05. [DOI] [PubMed] [Google Scholar]
- 29.Yang Q, Peng J, Guo Q, et al A cartilage ECM-derived 3-D porous acellular matrix scaffold for in vivo cartilage tissue engineering with PKH26-labeled chondrogenic bone marrow-derived mesenchymal stem cells . Biomaterials. 2008;29(15):2378–2387. doi: 10.1016/j.biomaterials.2008.01.037. [DOI] [PubMed] [Google Scholar]
- 30.Yin H, Wang Y, Sun Z, et al Induction of mesenchymal stem cell chondrogenic differentiation and functional cartilage microtissue formation for in vivo cartilage regeneration by cartilage extracellular matrix-derived particles . Acta Biomater. 2016;33:96–109. doi: 10.1016/j.actbio.2016.01.024. [DOI] [PubMed] [Google Scholar]
- 31.Guo W, Zheng X, Zhang W, et al Mesenchymal stem cells in oriented PLGA/ACECM composite scaffolds enhance structure-specific regeneration of hyaline cartilage in a rabbit Model. Stem Cells Int. 2018;2018:6542198. doi: 10.1155/2018/6542198. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Zheng X, Yang F, Wang S, et al Fabrication and cell affinity of biomimetic structured PLGA/articular cartilage ECM composite scaffold. J Mater Sci Mater Med. 2011;22(3):693–704. doi: 10.1007/s10856-011-4248-0. [DOI] [PubMed] [Google Scholar]
- 33.付晶, 张伟, 张爱武, 等 鹿茸软骨组织脱细胞基质材料的制备及生物相容性研究. 中国修复重建外科杂志. 2017;31(6):723–729. doi: 10.7507/1002-1892.201612072. [DOI] [PMC free article] [PubMed] [Google Scholar]