Abstract
目的
探讨经转子间弧形内翻截骨术治疗成人股骨头缺血性坏死(avascular necrosis of the femoral head,ANFH)时,采用虚拟现实(virtual reality,VR)技术进行术前规划的应用价值。
方法
以 2018 年 6 月—11 月拟行经转子间弧形内翻截骨术的 7 例(11 髋)ANFH 患者作为研究对象。其中,男 4 例(7 髋),女 3 例(4 髋)。年龄 14~46 岁,平均 31.9 岁。单髋 3 例,双髋 4 例。创伤性 1 例(1 髋),酒精性 2 例(4 髋),激素性 2 例(3 髋),特发性 2 例(3 髋)。ANFH 根据国际骨循环学会(ARCO)分期均为Ⅲ期;日本骨坏死研究会(JIC)分型:C1 型 5 髋、C2 型 6 髋;中日友好医院(CJFH)分型:L1 型 5 髋、L2 型 1 髋、L3 型 5 髋。病程 5~12 个月,平均 8 个月。术前 Harris 评分为(53.91±7.66)分。颈干角为 128~143°,平均 133.9°。术前采用 VR 技术进行方案设计,将 CT 数据导入软件构建坏死区域形态,模拟转子间内翻截骨,根据负重区股骨头完整率设计内翻角度。VR 术前规划内翻角度为 6~16°,平均 9.7°。术中按照术前规划进行内翻截骨,C 臂 X 线机透视确认内翻角度和负重区情况。如出现计划内翻角度偏小情况,则在透视下继续增加至获得满意位置。术后 2 d 摄 X 线片测量颈干角,计算手术前后差值,并与术前规划内翻角度比较(误差值)。随访时采用 Harris 评分评估髋关节功能。
结果
术后切口均Ⅰ期愈合。患者均获随访,随访时间 6~11 个月,平均 8 个月。术后 2 d 复查 X 线片,颈干角为 112~135°,平均 123.4°;手术前后差值为 6~16°,平均 11.0°;其中,5 髋颈干角手术前后差值与 VR 术前规划内翻角度一致,其余 6 髋误差值为 1~4°。术后 1 例(1 髋)出现截骨处骨不连、1 例(1 髋)发生股骨近端骨折,其余 5 例(9 髋)截骨处愈合良好。末次随访时,Harris 评分为(82.18±16.35)分,与术前比较差异有统计学意义(t=−5.195,P=0.000)。
结论
VR 技术为经转子间弧形内翻截骨术治疗 ANFH 提供了一种新的术前规划方法。
Keywords: 虚拟现实技术, 股骨头缺血性坏死, 截骨术, 术前规划
Abstract
Objective
To research the value of virtual reality (VR) technology in the preoperative planning of transtrochanteric curved varus osteotomy for avascular necrosis of the femoral head (ANFH) in adults.
Methods
Between June 2018 and November 2018, 7 patients (11 hips) with ANFH, who were treated with transtrochanteric curved varus osteotomy, were enrolled in the study. There were 4 males (7 hips) and 3 females (4 hips) with an average age of 31.9 years (range, 14-46 years). Among them, 3 patients were unilateral ANFH and 4 patients were bilateral ANFH. There was 1 patient (1 hip) of traumatic ANFH, 2 patients (4 hips) of alcohol-induced ANFH, 2 patients (3 hips) of hormonal ANFH, and 2 patients (3 hips) of idiopathic ANFH. All hips were Association Research Circulation Osseous (ARCO) stage Ⅲ. There were 5 hips for Japanese Investigation Committee (JIC) type C1 and 6 hips for type C2. There were 5 hips for China-Japan Friendship Hospital (CJFH) type L1,1 for type L2, and 5 for type L3. The disease duration ranged from 5 to 12 months (mean, 8 months). Preoperative Harris score was 53.91±7.66. The neck-shaft angle ranged from 128 to 143° (mean, 133.9°). VR technology was adopted for the preoperative planning. CT data were imported into the software to construct the morphology of necrotic area, and the transrtrochanteric varus osteotomy was simulated. The varus angle was designed according to the integrity rate of femoral head. The planned varus angle was 6 to 16° (mean, 9.7°). The transtrochanteric curved varus osteotomy was performed according to the preoperative planning, and the varus angle and loading area were confirmed under fluoroscopy. If the planned varus angle was too small, it would continue to increase under the fluoroscopy until a satisfactory varus angle. Postoperative changes of the neck-shaft angle were calculated and compared with the preoperative planned varus angle (error). The hip function was assessed by using the Harris score.
Results
All incisions healed by first intention. All patients were followed up 6-11 months with an average of 8 months. The X-ray film at 2 days after operation showed that the neck-shaft angle was 112-135° (mean, 123.4°). The difference of the neck-shaft angle between pre- and post-operation was 6-16° (mean, 11.0°). Among them, the difference of the neck-shaft angle was consistent with planned varus angle in 5 hips, while the error of the remaining 6 hips was 1-4°. There was 1 patient (1 hip) of osteotomy nonunion at 4 months after operation, 1 patient (1 hip) of proximal femur fracture at 2 months after operation. The rest 5 patients (9 hips) obtained union at the osteotomy. At last follow-up, the Harris score was 82.18±16.35, showing significant difference when compared with preoperative score (t=–5.195, P=0.000).
Conclusion
VR technology is a brand-new preoperative planning method for transtrochanteric curved varus osteotomy in treating ANFH.
Keywords: Virtual reality technology, avascular necrosis of the femoral head, osteotomy, preoperative planning
股骨头缺血性坏死(avascular necrosis of the femoral head,ANFH)好发于青壮年,可引起髋关节疼痛、活动受限,严重降低患者日常生活质量。尽管人工髋关节置换术治疗 ANFH 已在临床广泛使用,但对于年轻患者而言,过早关节置换存在许多问题,因此保髋治疗具有重要意义。由于股骨头坏死范围、分型和分期存在个体差异,所以保髋治疗强调阶梯化和精准性。经转子间弧形内翻截骨术是经典保髋术式,其原理是通过改变股骨颈的角度和股骨头的力线分布,将骨坏死病损区从负重区转变为非负重区,截骨后股骨头负重区被正常的骨和关节软骨所替代,达到缓解疼痛、延缓股骨头塌陷的目的[1-4]。国际骨循环协会(ARCO) Ⅲ期 ANFH 患者经转子间弧形内翻截骨术治疗后可获得较好疗效,但由于患者个体差异较大,术前规划困难、计划术中内翻角度以及手术难度高,是目前骨科难题之一[5]。
虚拟现实(virtual reality,VR)技术是一种可以创建和体验虚拟世界的计算机仿生系统,现已用于创伤、脊柱和关节等骨科领域。在术前规划方面,通过 VR 技术可三维展示病变部位和周围结构,进行三维立体测量、预测术后形态改变等[6],达到真正诊治个体化和精准化。而且通过术前 VR 展示,有助于患者理解手术方案,减轻压力并缓解紧张感[7]。2018 年 6 月—11 月,我们收治 7 例(11 髋)拟行经转子间弧形内翻截骨术治疗的 ANFH 患者,采用 VR 技术进行术前规划,设计内翻角度。现总结临床疗效及治疗体会,探讨 VR 技术术前规划的应用价值。报告如下。
1. 临床资料
1.1. 一般资料
本组男 4 例(7 髋),女 3 例(4 髋)。年龄 14~46 岁,平均 31.9 岁。单髋 3 例,双髋 4 例。ANFH 类型:创伤性 1 例(1 髋),酒精性 2 例(4 髋),激素性 2 例(3 髋),特发性 2 例(3 髋)。ANFH 根据 ARCO 分期:ⅢA 期 3 髋,ⅢB 期 3 髋,ⅢC 期 5 髋;日本骨坏死研究会(JIC)分型:C1 型 5 髋、C2 型 6 髋;中日友好医院(CJFH)分型:L1 型 5 髋、L2 型 1 髋、L3 型 5 髋。病程 5~12 个月,平均 8 个月。术前 Harris 评分(53.91±7.66)分。颈干角为 128~143°,平均 133.9°。
1.2. 术前规划
1.2.1. VR工程制作
术前摄标准骨盆正位 X 线片及髋关节 256 排 CT 平扫,CT 扫描层厚 1 mm。将 CT 扫描数据以 DCM 格式输入 VR 软件(MVR 手术规划系统)[妙智科技(深圳)有限公司]。软件自动分割髂骨和左、右股骨,同时除噪点和碎片,构建髋关节三维图像,保存为原始 VR 工程;然后在图像中于冠状面逐层标记坏死区域(图 1a),最后系统自动生成股骨头坏死区域的三维图像,经边界平滑处理,生成最终髋关节 VR 工程(图 1b、c)。
图 1.
Process of preoperative planning via VR technology
VR术前规划步骤
a. MVR 手术规划系统中逐层标记坏死区域;b、c. 标记完整坏死区域并生成最终髋关节 VR 工程;d、e. 于髋关节 VR 工程确定截骨界面及内翻角度
a. Necrotic areas were labeled layer by layer in the MVR surgical planning system;b, c. Complete necrotic areas were marked and the final hip VR project was generated; d, e. The osteotomy interface and varus angle were determined in hip VR project
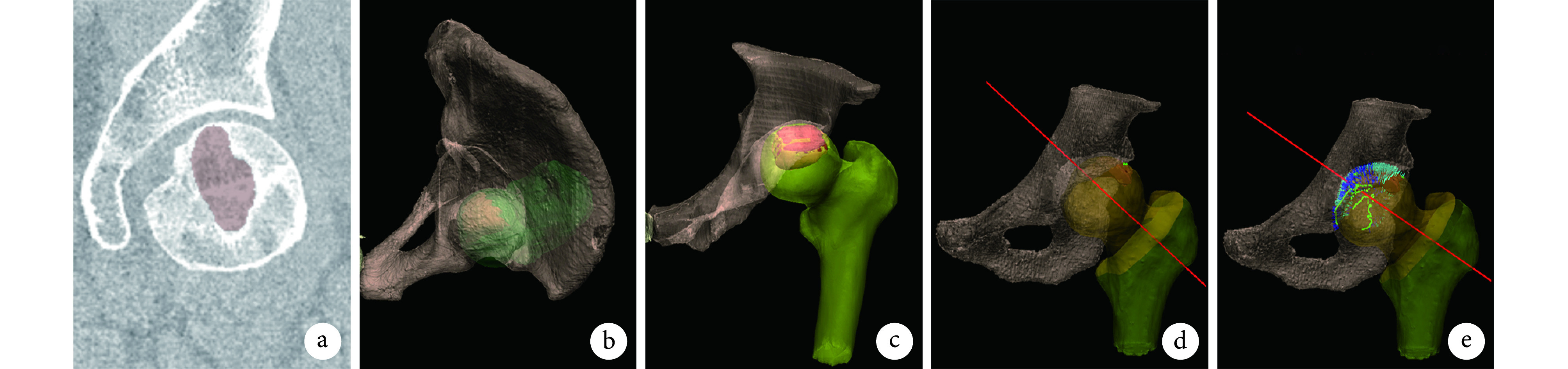
1.2.2. VR图像处理与术前规划
根据股骨头坏死区域的形态与面积,初步确定手术方案为内翻截骨。术者于 VR 工程上确定截骨界面并进行模拟手术(图 1d、e),期间通过软件处理多次计算股骨头负重区域完整率,并采用不同颜色线条标示不同内翻角度下股骨头颈交界与髋臼间的相对距离,以确认术后无继发头臼撞击风险。在确保无撞击情况下,取股骨头负重区完整率最高时内翻角度;本组 VR 术前规划内翻角度为 6~16°,平均 9.7°。如术前规划最高完整率<33.6%[8],则认为患者不适合该术式。对符合手术适应证的所有患者,确认截骨界面位于小转子的起点和大转子上的终点,并通过软件测量得出起点与小转子顶点的距离以及终点与大转子顶点的距离,完成术前规划。
1.3. 手术方法
本组双髋患者均为同期手术。全麻下患者取健侧卧位,采用外侧入路,切开皮肤、皮下组织及阔筋膜张肌筋膜,暴露大粗隆、股骨颈基底部及小粗隆。沿大粗隆、小粗隆内侧弧线、关节囊外侧,根据术前规划确定小转子截骨起点和大转子截骨终点,分别植入 1 枚克氏针;随后沿转子间线植入 5~7 枚克氏针。C 臂 X 线机透视下,确定克氏针位置满意后,沿克氏针外侧用骨凿弧形凿开骨皮质(距克氏针约 2 mm)并截断,牵引下肢同时撬拨克氏针,将股骨颈及股骨头内翻。内翻至术前规划角度后,透视下确认股骨头坏死区是否转移出外侧柱;如内翻后坏死区仍未移出外侧柱,则继续增大内翻角度,直至获得满意位置。最后,将截骨块用 3 枚克氏针与股骨固定,髋关节正位及蛙式位透视确认位置满意后取 3 枚空心加压螺钉固定。生理盐水反复冲洗切口后逐层缝合,不留置引流管。
1.4. 术后处理及疗效评价指标
术后给予抗感染、镇痛,辅以化痰、抑酸护胃等对症治疗,嘱患者抬高患肢,术侧避免负重 6 周。术后 2 d 摄骨盆正位 X 线片,由同一研究人员测量颈干角,计算颈干角手术前后差值,并与术前规划内翻角度进行比较(误差值)。术后每 2 个月随访 1 次,摄骨盆正位 X 线片,采用 Harris 评分评价髋关节功能。
1.5. 统计学方法
采用 SPSS17.0 统计软件进行分析。数据以均数±标准差表示,手术前后比较采用配对 t 检验;检验水准 α=0.05。
2. 结果
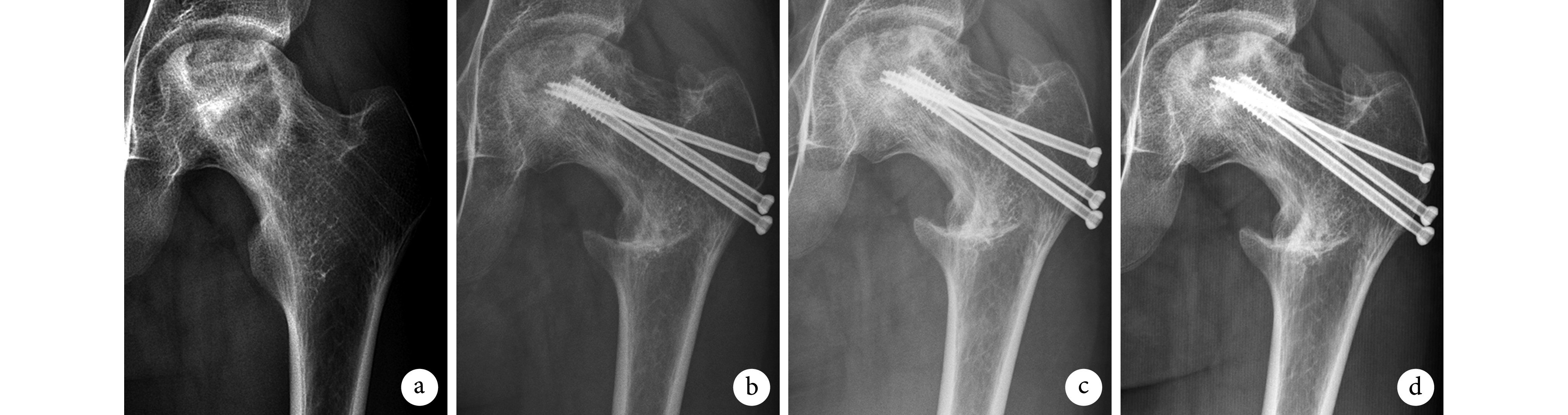
术后切口均Ⅰ期愈合。患者均获随访,随访时间 6~11 个月,平均 8 个月。术后 2 d 复查骨盆正位 X 线片,颈干角为 112~135°,平均 123.4°;手术前后差值为 6~16°,平均 11.0°;其中,5 髋颈干角手术前后差值与 VR 术前规划内翻角度一致,2 髋误差值为 1°、1 髋 2°、2 髋 3°、1 髋 4°。本组 5 例(9 髋)截骨处愈合良好;1 例(1 髋)术后 4 个月出现截骨处骨不连,局部注射富血小板血浆后愈合;1 例(1 髋)术后 2 个月发生股骨近端骨折,予钢板内固定、局部注射富血小板血浆,6 个月后复查时骨折端已愈合。见图 2。
图 2.
X-ray films of a 14-year-old boy with traumatic ANFH (ARCO stage ⅢB) of left hip
患儿,男,14岁,左髋创伤型 ANFH(ARCO ⅢB期)X 线片
a. 术前;b. 术后 2 d;c. 术后 5 个月;d. 术后 10 个月
a. Before operation; b. At 2 days after operation; c. At 5 months after operation; d. At 10 months after operation
除术后发生股骨近端骨折患者外,其余患者髋关节疼痛均明显缓解,关节功能较术前改善。末次随访时,Harris 评分为(82.18±16.35)分,与术前比较差异有统计学意义(t=–5.195,P=0.000)。髋关节功能获优 8 髋,良 2 髋,差 1 髋。本组患者详细临床资料见表 1。
表 1.
Clinical data of patients
患者临床资料
| 病例
Case |
年龄
Age (years) |
侧别
Side |
病程(月)
Disease duration (months) |
ANFH 分期与分型
Stage and type of ANFH |
随访时
间(月) Follow- up time (months) |
颈干角(°)
Neck-shaft angle (°) |
Harris 评分
Harris score |
||||||||
| ARCO | CJFH | JIC | 术前
Preoperative |
术后 2 d
Two days after operation |
手术前
后差值 Difference between pre- and post- operation |
术前规划
内翻角度 Planned varus angle |
误差值
Error |
术前
Preoperative |
末次随访
Last follow-up |
||||||
| 1 | 14 | 左 | 6 | ⅢB | L1 | C1 | 10 | 130 | 116 | 14 | 11 | 3 | 65 | 95 | |
| 2 | 24 | 左 | 9 | ⅢA | L1 | C1 | 11 | 130 | 117 | 13 | 9 | 4 | 53 | 70 | |
| 右 | 9 | ⅢA | L3 | C2 | 11 | 133 | 119 | 14 | 12 | 2 | 53 | 84 | |||
| 3 | 34 | 左 | 12 | ⅢC | L3 | C2 | 10 | 128 | 112 | 16 | 16 | 0 | 63 | 40 | |
| 右 | 12 | ⅢB | L1 | C1 | 10 | 133 | 119 | 14 | 14 | 0 | 65 | 80 | |||
| 4 | 39 | 左 | 10 | ⅢA | L3 | C2 | 8 | 143 | 132 | 11 | 10 | 1 | 54 | 78 | |
| 右 | 10 | ⅢC | L1 | C1 | 8 | 141 | 135 | 6 | 6 | 0 | 52 | 91 | |||
| 5 | 32 | 左 | 9 | ⅢC | L3 | C2 | 7 | 135 | 126 | 9 | 9 | 0 | 47 | 95 | |
| 右 | 9 | ⅢC | L2 | C2 | 7 | 135 | 127 | 8 | 7 | 1 | 41 | 98 | |||
| 6 | 46 | 左 | 5 | ⅢC | L1 | C1 | 8 | 132 | 122 | 10 | 7 | 3 | 52 | 90 | |
| 7 | 34 | 左 | 8 | ⅢB | L3 | C2 | 6 | 133 | 127 | 6 | 6 | 0 | 48 | 83 | |
3. 讨论
通过本组 7 例临床应用,我们认为 VR 技术用于经转子间弧形内翻截骨术术前规划具有三方面优势。第一,VR 技术具有准确、直观、便捷的特点。传统术前规划是在可以使用截骨内翻导引装置情况下,计算股骨近段移动距离,测算内翻角度[8]。在不能使用截骨内翻导引装置情况下,无法准确测算内翻角度。然而,VR 技术仅需在截骨界面选定起、始点,软件可直接测算内翻角度,不仅有较高准确性,也避免了反复作图的繁琐过程。同时,通过 VR 工程可以在三维空间中模拟手术,术后负重区情况和完整率均由软件运算获得,准确便捷。经 VR 技术术前规划后,术者术中无需使用截骨内翻导引装置,简化了手术流程,缩短了手术时间。
第二,与传统术前规划方法相比,VR 软件计算负重区完整率的速度和准确性均大大提高。负重区完整率是决定手术成功与否的关键。Hamanishi 等[9]对 53 例采用内翻截骨术治疗的特发型 ANFH 患者进行研究,结果表明术前负重区完整率达 40% 及以上时,手术成功率较高。一项纳入 93 例(102 髋)且平均随访时间达 10.1 年的临床研究发现,术后负重区骨质完整率<33.3% 和 CE 角<25° 均为手术失败的独立危险因素[10]。
第三,通过 VR 软件进行规划时,可以筛选出一些满足手术条件的 C2 型患者,同时也可以预见术后继发的头臼撞击。VR 术前规划以 CT 数据作基础,沿冠状面逐张绘制坏死范围,最后由软件生成三维坏死区域,并计算术前负重区完整率。以往根据 X 线片图像进行术前设计时,仅能测量坏死区面积,不能提供坏死区域的形态,因此只能在冠状面确定内翻角度。对于坏死区累及和超过外侧柱的 C1、C2 型患者,单纯冠状面内翻无法为负重区提供足够骨量。而 VR 设计时,除了在冠状面确定内翻角度外,当单纯冠状面内翻无法满足骨量需要时,还可以将截骨块进行有限地旋后或旋前,然后再计算负重区完整率,直至满足手术要求。本次研究中有 5 例(6 髋)为 C2 型,术中均按照术前规划对截骨块进行±5° 的旋转,从而达到了预期手术效果。在模拟截骨完成、确定内翻角度过程中,软件会以不同颜色线段自动标明股骨头与髋臼相对距离,有效提示了可能出现的继发头臼撞击,避免由于撞击导致的内翻角度改变,降低手术失败风险。此外,将股骨头以及坏死区形态、体积纳入考虑范围,反复进行模拟手术,为患者制定个体化保髋方案,能更准确地预估手术疗效。
但是,VR 技术用于经转子间弧形内翻截骨术还存在以下问题。第一,坏死区域重建仍需人工完成,精确度有待提高。本次研究所用软件可以基于 MRI 以及 256 排 CT 数据进行髋关节初步重建,在其基础上进行人工绘图后模拟坏死区域形态,截骨平面的选定和内翻角度的规划也由人工完成,不能避免误差。不过随着人工智能的不断发展,有望实现软件自动识别坏死区域的能力,提高 VR 工程精确度。
第二,对于术后可能出现的部分并发症,如股骨近端应力过度集中,目前软件仍不能实现预警。由于术者缺乏经验、截骨工具开发不足等原因,可能会出现新的并发症或后遗症。本组 1 例术后 2 个月发生股骨近端骨折,分析可能是由于弧形截骨界面过度偏向外侧,造成股骨外侧骨量偏少,股骨近端应力过度集中状况下导致骨折。由于 VR 技术用于保髋治疗处于起步阶段,对于如何预防此类并发症,医生需要与软件工程师进行充分交流,针对具体问题提出诉求,不断改进。
第三,由于缺乏合适工具,VR 术前规划确定的截骨平面尚不能在术中精确重现。目前,国内临床术中仍依赖于术者经验以及手工测量以实现术前规划。一项基于 CT 数据的内翻截骨术前规划方法研究显示,内翻截骨 CT 规划与实际结果误差在 5° 以内[11]。目前,有研究将 VR 技术应用于计算机辅助外科手术导航系统中,通过一系列仿真技术,使得原来必须用实际手术作为对象的研究活动,可以一定程度地转移至计算机中虚拟进行。国内外研究机构已在 VR 技术与计算机辅助外科手术系统结合方面进行了大量研究[12-17]。无论是截骨导引装置还是计算机导航,在术中精确重现规划的截骨平面和内翻角度仍是本手术的关键,仍需要医生与软件设计人员不断合作开发。
综上述,VR 技术为经转子间弧形内翻截骨术治疗 ANFH 提供了一种新的术前规划方式,其具有较高精准度,能有效指导手术操作。但本研究仅临床应用 7 例,患者随访时间较短,且无对照研究,该技术的临床应用价值有待进一步研究明确。
作者贡献:施乐负责科研设计、方案实施、数据收集整理、文章撰写,张超负责方案实施、数据收集整理,樊燕鑫负责资料统计分析,沈计荣负责方案实施、科研设计。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。
机构伦理问题:研究方案经南京中医药大学附属医院医学伦理委员会批准(2017NL-069-03)。患者均知情同意。
References
- 1.赵德伟, 谢辉 成人股骨头坏死保髋手术治疗的策略及探讨. 中国修复重建外科杂志. 2018;32(7):792–797. doi: 10.7507/1002-1892.201806029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ito H, Kaneda K, Matsuno T Osteonecrosis of the femoral head. Simple varus intertrochanteric osteotomy. J Bone Joint Surg (Br) 1999;81(6):969–974. doi: 10.1302/0301-620X.81B6.10037. [DOI] [PubMed] [Google Scholar]
- 3.Mont MA, Fairbank AC, Krackow KA, et al Corrective osteotomy for osteonecrosis of the femoral head. J Bone Joint Surg (Am) 1996;78(7):1032–1038. doi: 10.2106/00004623-199607000-00007. [DOI] [PubMed] [Google Scholar]
- 4.Pavlovcic V, Dolinar D Intertrochanteric osteotomy for osteonecrosis of the femoral head. Int Orthop. 2002;26(4):238–242. doi: 10.1007/s00264-002-0343-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.夏天卫, 魏伟, 刘金柱, 等 经外科脱位入路打压植骨术与旋转截骨术治疗 ARCO Ⅲ期股骨头缺血性坏死疗效比较. 中国修复重建外科杂志. 2019;33(4):445–450. [Google Scholar]
- 6.郑潮顺, 李春海 虚拟现实技术在骨科术前规划中的应用. 中国骨科临床与基础研究杂志. 2017;9(5):310–315. doi: 10.3969/j.issn.1674-666X.2017.05.009. [DOI] [Google Scholar]
- 7.Bekelis K, Calnan D, Simmons N, et al Effect of an immersive preoperative virtual reality experience on patient reported outcomes: A randomized controlled trial. Ann Surg. 2017;265(6):1068–1073. doi: 10.1097/SLA.0000000000002094. [DOI] [PubMed] [Google Scholar]
- 8.Koo KH, Mont MA, Jones LC. 骨坏死. 李子荣, 孙伟, 主译. 北京: 人民军医出版社, 2015: 295-299
- 9.Hamanishi M, Yasunaga Y, Yamasaki T, et al The clinical and radiographic results of intertrochanteric curved varus osteotomy for idiopathic osteonecrosis of the femoral head. Arch Orthop Trauma Surg. 2014;134(3):305–310. doi: 10.1007/s00402-013-1919-y. [DOI] [PubMed] [Google Scholar]
- 10.Okura T, Hasegawa Y, Morita D, et al What factors predict the failure of curved intertrochanteric varus osteotomy for the osteonecrosis of the femoral head? Arch Orthop Trauma Surg. 2016;136(12):1647–1655. doi: 10.1007/s00402-016-2563-0. [DOI] [PubMed] [Google Scholar]
- 11.Takao M, Sakai T, Hamada H, et al Error range in proximal femoral osteotomy using computer tomography-based navigation. Int J Comput Assist Radiol Surg. 2017;12(12):2087–2096. doi: 10.1007/s11548-017-1577-6. [DOI] [PubMed] [Google Scholar]
- 12.孟颖, 洪如 虚拟现实技术在骨科手术导航系统中的应用. 装备制造技术. 2010;(5):104–105. doi: 10.3969/j.issn.1672-545X.2010.05.045. [DOI] [Google Scholar]
- 13.Lee SC, Fuerst B, Tateno K, et al Multi-modal imaging, model-based tracking, and mixed reality visualisation for orthopaedic surgery. Healthc Technol Lett. 2017;4(5):168–173. doi: 10.1049/htl.2017.0066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mavrogenis AF, Savvidou OD, Mimidis G, et al Computer-assisted navigation in orthopedic surgery. Orthopedics. 2013;36(8):631–642. doi: 10.3928/01477447-20130724-10. [DOI] [PubMed] [Google Scholar]
- 15.Fritz J, U-Thainual P, Ungi T, et al Augmented reality visualization with use of image overlay technology for MR imaging-guided interventions: assessment of performance in cadaveric shoulder and hip arthrography at 1. 5 T. Radiology. 2012;265(1):254–259. doi: 10.1148/radiol.12112640. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Elmi-Terander A, Skulason H, Söderman M, et al Surgical navigation technology based on augmented reality and integrated 3D intraoperative imaging: A spine cadaveric feasibility and accuracy study. Spine. 2016;41(21):E1303–E1311. doi: 10.1097/BRS.0000000000001830. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Abe Y, Sato S, Kato K, et al A novel 3D guidance system using augmented reality for percutaneous vertebroplasty: technical note. J Neurosurg Spine. 2013;19(4):492–501. doi: 10.3171/2013.7.SPINE12917. [DOI] [PubMed] [Google Scholar]


