Abstract
目的
探讨纳米羟基磷灰石/聚酰胺 66 椎间融合器(nano-hydroxyapatite/polyamide-66 Cage,n-HA/PA66 Cage)用于腰椎退变性侧凸椎间融合的疗效。
方法
回顾性分析 2013 年 1 月—2016 年 6 月,采用 n-HA/PA66 Cage 行后路侧凸矫形、椎间植骨融合内固定术治疗并获完整随访的 43 例腰椎退变性侧凸患者临床资料,其中单节段融合 18 例(单节段组)和双节段融合 25 例(双节段组)。两组患者性别、年龄、体质量指数、侧凸方向、顶椎旋转度、融合节段、骨质疏松例数以及术前融合节段椎间隙高度、冠状面 Cobb 角、腰腿痛疼痛视觉模拟评分(VAS)以及改良 Oswestry 功能障碍指数(ODI)等一般资料比较,差异均无统计学意义(P>0.05)。记录患者手术时间、术中出血量、术后引流量、住院时间以及术后并发症发生情况;采用改良 ODI、VAS 评分、MacNab 标准进行临床疗效评价;影像学检测融合节段椎间隙高度、冠状面 Cobb 角、Cage 植入深度、植骨融合情况等。
结果
两组手术时间、术中出血量、术后引流量及住院时间比较,差异无统计学意义(P>0.05)。所有患者均获随访,随访时间 18~62 个月,平均 30.9 个月。术后 4 例发生切口相关并发症(单节段组 2 例、双节段组 2 例),单节段组 1 例出现谵妄, 双节段组 1 例发生 Cage 移位。两组术后融合节段椎间隙高度均较术前明显改善(P<0.05),末次随访时双节段组椎间隙高度高于单节段组(P<0.05)。两组术后冠状面 Cobb 角均较术前明显矫正(P<0.05),术后各时间点两组间比较差异均无统计学意义(P>0.05)。两组术后 3 d、6 个月及末次随访时 Cage 植入深度比较,差异均无统计学意义(P>0.05);各时间点组间比较差异亦无统计学意义(P>0.05)。末次随访时,两组患者均达骨性融合。两组术后 VAS 评分、改良 ODI 均较术前改善(P<0.05);末次随访时双节段组 VAS 评分高于单节段组,差异有统计学意义(P<0.05);其余各时间点 VAS 评分、改良 ODI 组间比较差异无统计学意义(P>0.05)。末次随访时,按照腰椎功能 MacNab 标准,单节段组优良率为 94.4%、双节段组为 84.0%,差异无统计学意义(P>0.05)。
结论
采用 n-HA/PA66 椎间融合器可有效恢复、维持腰椎退变性侧凸患者的融合节段椎间隙高度、重建脊柱稳定性,获得较好疗效。其中,双节段患者椎间隙高度维持优于单节段患者。
Keywords: 腰椎退变性侧凸, 椎间融合, 纳米羟基磷灰石, 聚酰胺 66, 椎间融合器
Abstract
Objective
To explore the effectiveness of nano-hydroxyapatite/polyamide-66 (n-HA/PA66) Cage in interbody fusion for degenerative lumbar scoliosis.
Methods
A retrospective analysis was designed and conducted for 43 patients, who underwent posterior decompression and n-HA/PA66 Cage interbody fusion with correction of deformity between January 2013 and June 2016. Eighteen cases were single-level fusion (single-level group) and 25 cases were double-level fusion (double-level group). There was no significant difference in gender, age, body mass index, direction of convex, degree of apical rotation, fusion level, the number of osteoporotic patients, pre-operative intervertebral height of fusion segments, coronal Cobb angle, visual analogue score (VAS), and modified Oswestry Disability Index (ODI) between 2 groups (P>0.05). The operation time, intraoperative blood loss, postoperative drainage, hospital stay, and complications of the operation were recorded. Modified ODI, VAS score, and MacNab criteria were adopted to assess clinical outcomes. Radiographic indexes, including intervertebral height of fusion segments, coronal Cobb angle, disc insertion depth, and the bone graft fusion rate, were also evaluated.
Results
There was no significant difference in operation time, intraoperative blood loss, postoperative drainage, and hospital stay between 2 groups (P>0.05). All patients were followed up 18-62 months (mean, 30.9 months). Wound complications, postoperative delirium, and Cage retropulsion occurred in 4 cases (2 cases in single-level group, 2 cases in double-level group), 1 case of single-level group, and 1 case of double-level group, respectively. The intervertebral height of fusion segments after operation significantly improved compared with preoperative ones in both groups (P<0.05). At last follow-up, the intervertebral height in double-level group was superior to which in single-level group (P<0.05). The coronal Cobb angles after operation significantly improved compared with preoperative ones (P<0.05), and no significant difference was found between 2 groups at each time point (P>0.05). The disc insertion depth showed no significant difference between different time points after operation in 2 groups (P>0.05) and between 2 groups at each time point after operation (P>0.05). Bony fusion was obtained in all patients at last follow-up. The VAS score and modified ODI after operation in both groups were superior to those before operation (P<0.05). The VAS score in double-level group was higher than that in single-level group (P<0.05) at last follow-up, and no significant difference was found in VAS score and modified ODI between 2 groups at other time points (P>0.05). According to the MacNab criteria, the excellent and good rates at last follow-up were 94.4% and 84.0% in single-level group and double-level group, respectively.
Conclusion
The n-HA/PA66 Cage can effectively restore and maintain the disc height of fusion segment, normal sequence, and biomechanical stability of the spine, and gain favorable effectivenss for degenerative lumbar scoliosis. And double-level fusion is superior to single-level fusion in maintaining disc height of fusion segment.
Keywords: Degenerative lumbar scoliosis, interbody fusion, nano-hydroxyapatite, polyamide-66, Cage
腰椎退变性侧凸是指无脊柱侧凸病史,由于椎间盘退行性改变和小关节突非对称性退变导致的原发性脊柱侧凸,冠状面 Cobb 角>10°,同时可能伴有脊柱旋转、后凸、前凸畸形[1]。随着人口老龄化、预期寿命增加以及对该病认识的不断加深,腰椎退变性侧凸发病率逐年上升,据统计达 8.3%~68.0%[2-3]。患者通常表现为腰痛、下肢放射痛和间歇性跛行症状。对于终末期患者,手术矫形植骨融合内固定是主要治疗方法,其中椎间融合是维持长期疗效的关键。
纳米羟基磷灰石/聚酰胺 66 椎间融合器(nano-hydroxyapatite/polyamide-66 Cage,n-HA/PA66 Cage)是一种新型支撑复合骨充填材料,具有良好生物相容性、高机械强度、透射线性等特点。我们通过检索国内外文献,尚未见 n-HA/PA66 Cage 用于腰椎退变性侧凸手术治疗的相关报道。2013 年 1 月—2016 年 6 月,我们对 43 例腰椎退变性侧凸患者行后路侧凸矫形、椎间植骨融合内固定术,术中均采用 n-HA/PA66 Cage(四川国纳科技有限公司)。现回顾患者临床资料,探讨 n-HA/PA66 Cage 用于腰椎退变性侧凸椎间融合术的安全性及临床疗效,为临床推广应用提供数据支撑。报告如下。
1. 临床资料
1.1. 患者选择标准
纳入标准:① 年龄 55~80 岁,临床表现为不同程度下腰痛,伴单侧或双侧下肢放射性疼痛、麻木,伴或不伴神经源性间歇性跛行症状;脊柱全长 X 线片提示脊柱侧弯,冠状面 Cobb 角>10°,确诊为腰椎退变性侧凸患者。② 经严格卧床休息、消炎镇痛药物、理疗等规范保守治疗半年后,临床症状改善不明显,有强烈手术意愿者。③ 接受后路侧凸矫形,单节段或双节段椎间植骨融合内固定术。排除标准:① 合并腰椎结核、肿瘤等骨质破坏病变;② 合并 3 个及以上节段的椎间盘突出或椎管狭窄;③ 特发性脊柱侧凸成年后进展者、医源性脊柱侧凸;④ 有脊柱手术史者;⑤ 一般状况较差无法耐受手术者;⑥ 随访资料不齐全者。
2013 年 1 月—2016 年 6 月,共 43 例患者符合选择标准纳入研究。根据椎间融合节段数,分为单节段组(18 例)和双节段组(25 例)。本研究通过重庆医科大学附属第一医院医学伦理委员会批准,所有患者术前均签署知情同意书。
1.2. 一般资料
单节段组:男 7 例,女 11 例;年龄 61~78 岁,平均 67.2 岁。体质量指数(24.42±5.20)kg/m2。左、右侧凸各 9 例。顶椎旋转度:1 度 1 例,2 度 9 例,3 度 7 例,4 度 1 例。融合节段:L3、4 4 例,L4、5 13 例,L5、S1 1 例。骨质疏松(T 值<–2.5)6 例。
双节段组:男 10 例,女 15 例;年龄 56~79 岁,平均 64.9 岁。体质量指数(22.28±3.84)kg/m2。左侧凸 11 例,右侧凸 14 例。顶椎旋转度:1 度 1 例,2 度 14 例,3 度 8 例,4 度 2 例。融合节段:L2、3 及 L3、4 1 例,L3、4 及 L4、5 10 例,L4、5 及 L5、S1 14 例。骨质疏松 6 例。
两组患者性别、年龄、体质量指数、侧凸方向、顶椎旋转度、融合节段、骨质疏松例数以及术前融合节段椎间隙高度、冠状面 Cobb 角、疼痛视觉模拟评分(VAS)以及改良 Oswestry 功能障碍指数(ODI)等一般资料比较,差异均无统计学意义(P>0.05)。
1.3. 手术方法
两组手术均由同一组术者完成。全麻下,患者取俯卧位,胸腹部垫软垫,悬空腹部;术前以 C 臂 X 线机定位手术节段。作后正中切口,暴露侧凸节段棘突、椎板、关节突关节,定位双侧椎弓根,按照标准椎弓根螺钉植入流程进行植钉。根据固定节段长度,选取适宜长度钛棒,折弯呈生理曲度,置于双侧椎弓根钉 U 形槽内,根据侧凸程度,对相应节段行关节突截骨或全椎板切除减压,切除相应的黄韧带,通过转棒技术、体内折弯等恢复腰椎前凸和胸椎后凸,并矫正患者冠状位、矢状位畸形,临时固定。切除的骨组织剪成颗粒骨,备用。结合患者术前临床症状及侧凸节段内椎体间稳定程度、椎间盘退变及突出情况,对责任节段行椎间盘切除、椎间融合。探查狭窄的神经根管或侧隐窝,彻底松解受压神经根,切除间盘组织,刮除软骨板至椎体终板,冲洗后撑开椎间隙,向椎间隙逐级击入 n-HA/PA66 Cage 试模,确定合适的 Cage 规格。将制备的自体颗粒骨填充至 n-HA/PA66 Cage 后,斜行植入椎间隙,适当加压融合间隙。透视确定 Cage 位置良好,检查神经根移动度良好,锁紧钉棒并安装横连。剩余的自体颗粒骨行后外侧植骨。43 例患者共融合 68 个椎间隙。冲洗视野,仔细止血,放置引流管引流,逐层关闭切口,敷料包扎。
1.4. 术后处理
两组患者术后均常规镇痛,静脉滴注抗生素 1~3 d 预防感染,予以甘露醇、小剂量激素等对症治疗。如未出现切口相关并发症且切口 24 h 引流量小于 50 mL 后拔出引流管。术后 3~5 d 患者可佩戴外固定支具下床活动,支具保护 3 个月,3 个月内可行低强度日常活动,避免弯腰负重,3 个月后恢复正常活动。
1.5. 观测指标
1.5.1. 一般情况
记录两组手术时间、术中出血量、术后引流量、住院时间及手术相关并发症发生情况。
1.5.2. 影像学观测
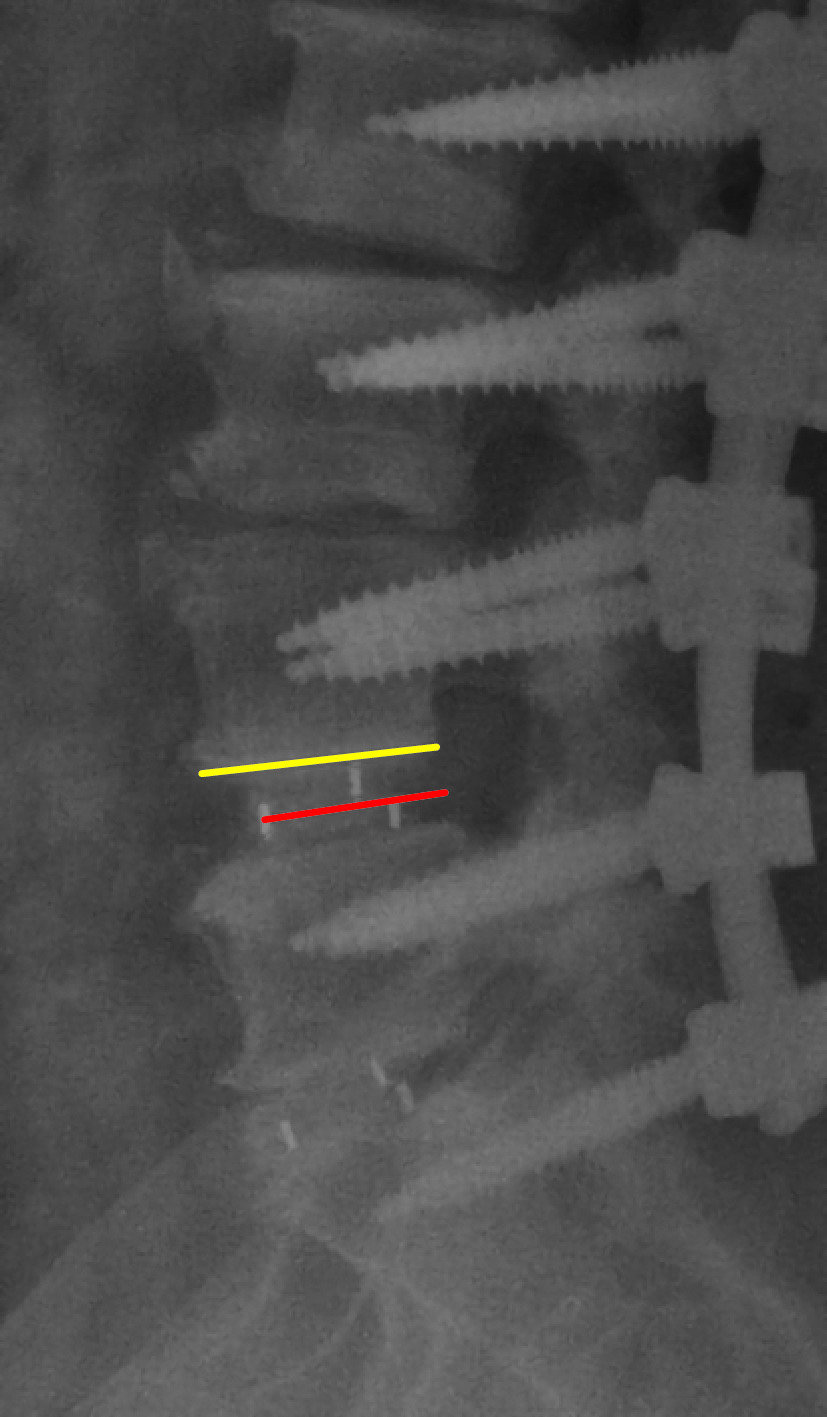
手术前后摄脊柱全长正侧位 X 线片及 CT,采用影像学资料处理系统 Carestream software 10.0(Eastman Kodak 公司,美国)测量相关影像学参数。① 术前及术后 3 d、6 个月及末次随访时测量融合节段椎间隙高度,融合节段椎间隙高度=(椎体前缘上下终板高度+椎体后缘上下终板高度)/2;测量冠状面 Cobb 角,计算术后 3 d Cobb 角矫正率, Cobb 角矫正率=(术前 Cobb 角–术后 Cobb 角)/术前 Cobb 角×100%。② 术后 3 d、6 个月及末次随访时评估 Cage 植入深度,公式为:Cage 植入深度比×100%,其中 Cage 植入深度比=Cage 前缘显影带中点至椎间隙后缘距离/椎间隙上位椎体下终板前缘至脊柱后缘的距离(图 1),随访期间 Cage 植入深度差异超过 10% 定义为 Cage 移位。③ 术后 6 个月及末次随访时,依据 Brantigan 植骨融合分级标准[4]评价植骨融合情况,共分为 A、B、C、D、E 级,其中 D、E 级视为融合,A、B、C 级视为未融合。
图 1.
Illustration of the measurement of disc insertion depth ratio
Cage 植入深度比测量示意图
红线示 Cage 前缘显影带中点至椎间隙后缘距离 黄线示椎间隙上位椎体下终板前缘至脊柱后缘的距离
Red line indicated the distance between midpoint of anterior Cage and posterior intervertebral line Yellow line indicated the distance between anterior intervertebral line and posterior intervertebral line
1.5.3. 临床疗效观察
术前、术后 3 d 及末次随访时,采用 VAS 评分评估腰腿痛程度,改良 ODI 评估功能障碍情况。末次随访时,按照腰椎功能 MacNab 标准评估并计算治疗优良率,公式为:(优+良)/总例数×100%。
1.6. 统计学方法
采用 SPSS 22.4 统计软件进行分析。计量资料以均数±标准差表示,组间比较采用独立样本 t 检验;组内手术前后比较采用重复测量方差分析,两两比较采用配对 t 检验。计数资料组间比较采用 χ2 检验及秩和检验。检验水准 α=0.05。
2. 结果
2.1. 一般情况
两组均顺利完成手术,术中无神经损伤及脑脊液漏发生。两组手术时间、术中出血量、术后引流量及住院时间比较,差异均无统计学意义(P>0.05)。所有患者均获随访,随访时间 18~62 个月,平均 30.9 个月;两组随访时间比较差异无统计学意义(P>0.05)。见表 1。
表 1.
Comparison of operation time, intraoperative blood loss, postoperative drainage, hospital stay, and follow-up time between 2 groups (
 )
)
两组手术时间、术中出血量、术后引流量、住院时间及随访时间比较(
 )
)
| 组别
Group |
例数
n |
手术时间(min)
Operation time (minutes) |
术中出血量(mL)
Intraoperative blood loss (mL) |
术后引流量(mL)
Postoperative drainage (mL) |
住院时间(d)
Hospital stay (days) |
随访时间(月)
Follow-up time (months) |
| 单节段组
Single-level group |
18 | 206.72±64.78 | 383.33±244.95 | 479.17±308.75 | 15.94±6.87 | 31.11±9.85 |
| 双节段组
Double-level group |
25 | 204.24±61.26 | 481.20±293.11 | 634.48±452.54 | 14.20±4.16 | 30.68±7.38 |
| 统计值
Statistic |
t=0.128
P=0.899 |
t=–1.155
P= 0.255 |
t=–1.258
P= 0.215 |
t=1.035
P=0.307 |
t=0.164
P=0.870 |
术后 6 例发生并发症,单节段组 3 例(16.7%)、双节段组 3 例(12.0%),并发症发生率组间比较差异无统计学意义(P=0.683)。其中,4 例发生切口相关并发症,单节段组 1 例、双节段组 2 例出现切口渗液,单节段组 1 例出现切口积脓,经延长抗生素使用时间、对症治疗后切口均愈合良好。单节段组 1 例出现谵妄,未作特殊处理,3 d 后谵妄状态消失。双节段组 1 例发生 Cage 移位,患者术后 1 个月出现间歇性跛行症状并逐渐加重,3 个月时复查腰椎 X 线片发现 L4、5 Cage 向后移位,其术后 3 d Cage 植入深度为 71.3%,术后 3 个月时为 52.5%,差异超过 10%,行翻修手术后好转,末次随访时 Cage 位置及椎间融合良好。
2.2. 影像学观测
2.2.1. 椎间隙高度
两组术后各时间点融合节段椎间隙高度均较术前明显改善,差异有统计学意义(P<0.05);末次随访时椎间隙高度均较术后 3 d 有所丢失,但组内术后各时间点间差异均无统计学意义(P>0.05)。术后 3 d 及 6 个月两组间比较差异均无统计学意义(P>0.05),但末次随访时双节段组椎间隙高度高于单节段组,差异有统计学意义(P<0.05)。见表 2。
表 2.
Comparison of intervertebral height of fusion segments between 2 groups (mm,
 )
)
两组各时间点融合节段椎间隙高度比较(mm,
 )
)
| 组别
Group |
节段
n |
术前
Preoperative |
术后 3 d
Three days after operation |
术后 6 个月
Six months after operation |
末次随访
Last follow-up |
统计值
Statistic |
|
*与术前比较 P<0.05,#与术后 3 d 比较 P<0.05,△与术后 6 个月比较P<0.05
*Compared with preoperative value, P<0.05;#compared with the value at 3 days after operation, P<0.05;△compared with the value at 6 months after operation, P<0.05 | ||||||
| 单节段组
Single-level group |
18 | 9.01±2.60#△ | 11.47±1.83* | 11.26±1.59* | 11.05±1.40* |
F= 8.333
P= 0.004 |
| 双节段组
Double-level group |
50 | 8.58±2.14#△ | 12.91±2.60* | 12.52±2.05* | 12.37±1.52* |
F=54.886
P= 0.000 |
| 统计值
Statistic |
t=0.572
P=0.570 |
t=–1.818
P= 0.076 |
t=–1.977
P= 0.054 |
t=–2.698
P= 0.010 |
||
2.2.2. 冠状面 Cobb 角
两组术后 3 d、6 个月及末次随访时冠状面 Cobb 角均较术前明显矫正,差异有统计学意义(P<0.05);术后各时间点间比较差异无统计学意义(P>0.05)。术后 3 d 单节段组 Cobb 角矫正率为 46.1%±19.4%,双节段组为 49.3%±17.3%,组间比较差异无统计学意义(t=–0.441,P=0.663)。术后各时间点两组间比较,差异均无统计学意义(P>0.05)。见表 3。
表 3.
Comparison of coronal Cobb angles between 2 groups (°,
 )
)
两组各时间点冠状面 Cobb 角比较(°,
 )
)
| 组别
Group |
节段
n |
术前
Preoperative |
术后 3 d
Three days after operation |
术后 6 个月
Six months after operation |
末次随访
Last follow-up |
统计值
Statistic |
|
*与术前比较P<0.05,#与术后 3 d 比较P<0.05,△与术后 6 个月比较P<0.05
*Compared with preoperative value, P<0.05;#compared with the value at 3 days after operation, P<0.05;△compared with the value at 6 months after operation, P<0.05 | ||||||
| 单节段组
Single-level group |
18 | 24.16±12.43#△ | 13.16±8.51* | 12.31±8.32* | 14.30±9.63* |
F=12.361
P= 0.001 |
| 双节段组
Double-level group |
50 | 20.72±5.79#△ | 10.23±3.94* | 10.99±4.12* | 10.73±4.48* |
F= 8.654
P= 0.002 |
| 统计值
Statistic |
t=0.920
P=0.371 |
t=1.147
P=0.268 |
t=0.555
P=0.584 |
t=1.233
P=0.235 |
||
2.2.3. Cage 植入深度
两组组内术后 3 d、6 个月及末次随访时 Cage 植入深度比较,差异均无统计学意义(P>0.05);各时间点组间比较差异亦无统计学意义(P>0.05)。见表 4。
表 4.
Comparison of disc insertion depth between 2 groups (%,
 )
)
两组各时间点 Cage 植入深度比较(%,
 )
)
| 组别
Group |
节段
n |
术后 3 d
Three days after operation |
术后 6 个月
Six months after operation |
末次随访
Last follow-up |
统计值
Statistic |
| 单节段组
Single-level group |
18 | 72.99±8.86 | 71.81±9.39 | 71.91±6.66 |
F=0.080
P=0.924 |
| 双节段组
Double-level group |
50 | 70.15±6.71 | 70.06±4.72 | 69.28±3.86 |
F=0.431
P=0.654 |
| 统计值
Statistic |
t=1.171
P=0.248 |
t=0.638
P=0.534 |
t=1.666
P=0.103 |
2.2.4. 植骨融合
术后 6 个月时,单节段植骨融合 17 例,其中 D 级 10 例、E 级 7 例;未融合 1 例(C 级);植骨融合率为 94.4%。双节段植骨融合 22 例,其中 D 级 14 例、E 级 8 例;未融合 3 例(C 级),植骨融合率为 88.0%;两组比较差异无统计学意义(P=0.628)。末次随访时,两组患者均达骨性融合。
2.3. 临床疗效观察
两组患者术后 3 d 及末次随访时 VAS 评分、改良 ODI 均较术前改善,差异有统计学意义(P<0.05);术后 3 d 与末次随访时比较,差异有统计学意义(P<0.05)。末次随访时双节段组 VAS 评分高于单节段组,差异有统计学意义(P<0.05);其余各时间点 VAS 评分、改良 ODI 组间比较差异无统计学意义(P>0.05)。见表 5。末次随访时,按照腰椎功能 MacNab 标准,单节段组获优 13 例、良 4 例、可 1 例,优良率为 94.4%;双节段组获优 15 例、良 6 例、可 3 例、差 1 例,优良率为 84.0%;两组比较差异无统计学意义(P=0.380)。见图 2。
表 5.
Comparison of VAS score and modified ODI between 2 groups (
 )
)
两组手术前后 VAS 评分及改良 ODI 比较(
 )
)
| 组别
Group |
例数
n |
VAS 评分
VAS score |
改良 ODI(%)
Modified ODI(%) |
|||||||
| 术前
Preoperative |
术后 3 d
Three days after operation |
末次随访
Last follow-up |
统计值
Statistic |
术前
Preoperative |
术后 3 d
Three days after operation |
末次随访
Last follow-up |
统计值
Statistic |
|||
|
*与术前比较P<0.05,#与术后 3 d 比较P<0.05
*Compared with preoperative value, P<0.05;#compared with the value at 3 days after operation, P<0.05 | ||||||||||
| 单节段组
Single-level group |
18 | 6.94±1.06# | 3.56±0.92* | 1.11±0.90*# |
F=167.016
P= 0.000 |
60.61±7.70# | 44.83±9.07* | 29.06±5.46*# |
F=78.431
P= 0.000 |
|
| 双节段组
Double-level group |
25 | 6.44±1.23# | 3.32±0.85* | 1.92±1.08*# |
F=118.338
P= 0.000 |
62.00±9.30# | 47.56±8.96* | 28.08±7.65*# |
F=96.443
P= 0.000 |
|
| 统计值
Statistic |
t=1.408
P=0.167 |
t=0.864
P=0.393 |
t=–2.597
P= 0.013 |
t=–0.518
P= 0.607 |
t=–0.980
P= 0.333 |
t=0.462
P=0.646 |
||||
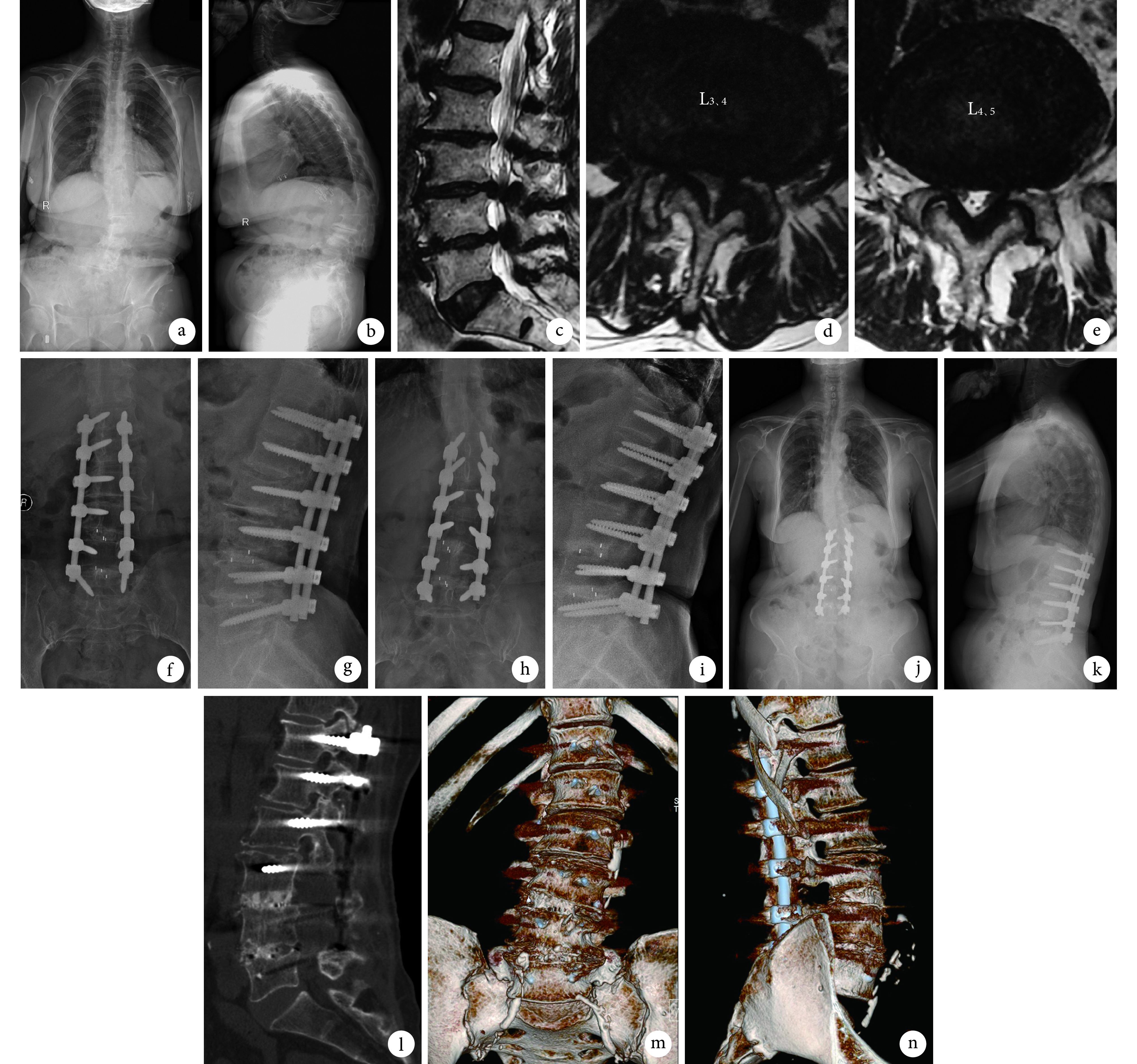
图 2.
A 71-year-old female patient with degenerative lumbar scoliosis (L3, 4 and L4, 5) in double-level group
双节段组患者,女,71 岁,L3、4 及 L4、5 退变性侧凸
a、b. 术前脊柱全长正侧位 X 线片;c~e. 术前 MRI;f、g. 术后 3 d 腰椎正侧位 X 线片;h、i. 术后 6 个月腰椎正侧位 X 线片;j、k. 术后 24 个月脊柱全长正侧位 X 线片;l~n. 术后 24 个月腰椎 CT 及三维重建
a, b. Preoperative anteroposterior and lateral X-ray films of full spine; c-e. Preoperative MRI; f, g. Anteroposterior and lateral X-ray films of lumbar spine at 3 days after operation; h, i. Anteroposterior and lateral X-ray films of lumbar spine at 6 months after operation; j, k. Anteroposterior and lateral X-ray films of full spine at 24 month after operation; l-n. CT scanning and three-dimensional reconstruction at 24 months after operation
3. 讨论
腰椎退变性侧凸常于中老年发病,继发于椎间盘退变的椎间隙高度丢失使得双侧关节突与椎间盘的非对称性应力增加,最终出现椎体旋转性半脱位或侧方滑移,导致脊柱失平衡;同时椎间盘退变突出,关节突形态及位置改变,造成神经根牵拉卡压、椎管狭窄,引起神经根性症状及神经源性间歇性跛行[5]。腰椎退变性侧凸手术治疗原则为对狭窄椎管及受压神经进行减压,并通过脊柱融合内固定术纠正脊柱失衡,防止畸形进一步加重[6-7]。
3.1. n-HA/PA66 Cage 特点
1988 年 Kuslich 等首次将 Cage 应用于脊柱融合,不同的椎间融合 Cage 材料会直接影响椎间隙高度、曲度的恢复和维持以及植骨融合率,进而影响术后疗效[8-9]。目前临床上常用的椎间融合 Cage 材料包括钛合金、可吸收聚合物材料、聚醚醚酮、同种异体骨等,均存在不同程度的缺陷[10-12]。本研究采用的 n-HA/PA66 Cage 是将纳米级 HA 晶体颗粒均匀分散在 PA66 中复合而成。HA 是一种活性生物陶瓷,是人及动物骨骼、牙齿的主要无机成分,对骨代谢过程中钙盐沉积起到支架作用,同时能诱导新骨形成[13];PA66 是一种有机高分子材料,具有与骨胶原相似的结构,易加工,可塑性强;复合制成的 n-HA/PA66 Cage 弹性模量(3~30 GPa)与人皮质骨相近,具有良好的骨传导生物活性及坚强的力学性能[14]。前期动物及体内研究表明,n-HA/PA66 复合生物材料具有良好的生物相容性和生物安全性[15-17]。
3.2. n-HA/PA66 Cage 用于腰椎退变性侧凸椎间融合的疗效分析
3.2.1. 影像学及临床疗效评价
腰椎退变性侧凸患者常存在椎间隙高度降低,Cinotti 等[18]通过在干燥和新鲜的腰椎标本上研究椎间孔的形态与椎间盘之间的关系,发现椎间孔狭窄与椎间盘高度丢失相关。因此,恢复椎间隙高度是确保手术疗效的重要环节,椎间隙高度的恢复亦可增加椎间孔径,间接减压神经根[19-20]。针对腰椎退变性侧凸,因侧凸节段椎体终板常不与矢状面垂直,侧位 X 线片上呈现“椭圆形”表现,故本研究采用椎体前后缘上、下终板高度的均值来表示椎间隙高度,减少测量误差。两组术后各时间点融合节段椎间隙高度均较术前明显改善,差异有统计学意义(P<0.05),术后各时间点间差异无统计学意义(P>0.05),提示术后融合节段椎间隙高度获得满意恢复,且在随访期间内维持良好,表明 n-HA/PA66 Cage 用于腰椎退变性侧凸椎间融合能有效恢复并维持腰椎间正常解剖关系。杨曦等[15]总结了 20 例使用 n-HA/PA66 Cage 行椎间融合术治疗下腰椎退变性疾病的短期疗效,平均随访时间 7 个月,结果提示末次随访时椎间隙高度为(10.0±1.0)mm,较术前显著改善,本研究结果与该研究相似。
因腰椎退变性侧凸冠状面椎间隙左、右侧高度存在差异,植入 Cage 后其上、下表面与椎体终板贴合不佳,Cage 承重面积减小及受力不均,可能影响骨性融合及自身稳定性[21-22]。Aoki 等[23]发现侧凸角度>10° 是出现 Cage 移位的独立危险因素,因此良好的 Cobb 角矫正是确保腰椎退变性侧凸患者椎间融合及临床疗效的重要因素。Khajavi 等[24]回顾性分析了聚醚醚酮 Cage 用于腰椎退变性侧凸椎间融合的临床疗效,患者冠状面 Cobb 角从 27.7° 矫正至 16.6°。本研究中,单节段组术后 3 d Cobb 角矫正率为 46.1%±19.4%,双节段组为 49.3%±17.3%,两组术后 3 d、6 个月及末次随访时冠状面 Cobb 角均较术前明显矫正(P<0.05),取得了较好影像学结果。
成功椎间融合是维持长期疗效的关键,n-HA/PA66 Cage 相对较大的中空体积提高了 Cage 内植骨填充的容量。孟纯阳等[25]进行了兔体内 n-HA/PA66 植入实验,结果表明 n-HA/PA66 植入兔体内后能在表面形成片状和针状的磷灰石晶体层,该新生晶体层能桥联受体骨和植入材料间的界面,提高植骨融合率。Deng 等[17]比较了 n-HA/PA66 Cage 与聚醚醚酮 Cage 用于退行性腰椎疾病椎间融合的临床疗效,末次随访时融合率分别为 92.5% 和 91.6%,表明 n-HA/PA66 Cage 能明显加快植骨融合速度,提高植骨融合率。本研究中,术后 6 个月时单节段植骨融合率为 94.4%、双节段为 88.0%,末次随访时所有患者均达骨性融合。
本研究中,两组患者 VAS 评分、改良 ODI 均呈整体下降趋势,末次随访时单节段组 MacNab 优良率为 94.4%、双节段组为 84.0%,表明 n-HA/PA66 Cage 用于成人腰椎退变性侧凸椎间融合可明显缓解患者临床症状、改善生活质量。
3.2.2. Cage 移位并发症分析
Cage 移位是一种椎间融合术中较严重的术后并发症,可以导致神经受压而引起腰痛或下肢神经源性疼痛,严重时出现不可逆性神经损伤,同时易导致植骨不融合。Pan 等[26]认为 Cage 类型、固定因素、融合节段、终板形状、椎间隙高度及骨密度等都可能影响 Cage 移位。Aoki 等[23]报道了 125 例行经椎间孔腰椎椎间融合术的患者,术后 Cage 移位发生率为 3.2%。子弹型 n-HA/PA66 Cage 上下边缘锯齿状结构一定程度上可增加 Cage 自稳性,并且与正常终板凹状面达良好匹配,增大了 Cage 与终板的接触面积,理论上可以减少 Cage 移位的发生[27]。本研究中双节段组 1 例患者术后出现 Cage 移位,并伴有神经症状,经翻修手术处理后 Cage 位置及椎间融合良好。
Abbushi 等[28]以 Cage 位置向后移动≥3 mm 判定为 Cage 后移,通过对椎体终板进行生物力学研究,认为当 Cage 在椎间隙后缘靠中央时其移位率最低,但该判定方法易受投照因素影响,且椎体大小及椎间隙前后缘距离存在个体差异。本研究采用 Cage 植入深度这一客观评价指标来评估 Cage 位置,结果显示组内术后各时间点单、双节段 Cage 植入深度比较,差异均无统计学意义(P>0.05),提示 Cage 前缘植入椎间隙中前份时可以获得较好的临床结果,但术者仍需对术前影像学资料进行充分测量、仔细评估,并选择合适型号 Cage。
3.3. 单、双节段椎间融合疗效比较
本研究结果显示,术后 3 d 及 6 个月单、双节段组椎间隙高度差异无统计学意义(P>0.05),但末次随访时双节段组椎间隙高度高于单节段组(P<0.05)。我们认为可能与双节段 Cage 提供的前柱支撑较单节段稳定,后柱弯曲应力及内固定的疲劳性损害较单节段小,椎体终板发生骨吸收亦较少等因素相关[29],但仍需进一步研究提供证据支持。同时,末次随访时双节段组 VAS 评分高于单节段组(P<0.05),可能与双节段病变患者腰椎整体退变更严重有关。尽管如此,两组患者围术期、其他影像学及临床疗效等检测指标均无明显差异,提示单节段和双节段 n-HA/PA66 Cage 椎间融合均能提供良好的即时稳定性和临床疗效。
值得注意的是,椎间植骨时骨量越多,植骨融合概率就越大,更有利于患者远期疗效的维持,所以要重视椎间骨粒的打压植骨[30]。结合我们的手术经验,双节段椎间融合单纯行关节突截骨时,自体骨量一般无法满足椎间植骨需求,必要时需改为全椎板切除减压或加用同种异体骨,以确保椎间植骨量。而是否行单节段或多节段椎间融合,主要与患者神经受压责任节段相关,术前应准确评估患者神经症状及影像学表现,合理选择神经减压及椎间植骨方法。
综上述,n-HA/PA66 Cage 用于腰椎退变性侧凸椎间融合可有效恢复、维持融合节段椎间隙高度,重建脊柱稳定性,是一种理想的椎间植骨融合替代材料。单、双节段患者均获得较好临床疗效,但双节段患者中期椎间隙高度维持优于单节段患者。由于本研究是基于单中心、回顾性研究,样本量较小,上述结论还需进行大样本、长时间随访进一步验证。
Funding Statement
国家自然科学基金面上项目(81572634)
National Natural Science Foundation of China (81572634)
References
- 1.York PJ, Kim HJ Degenerative scoliosis. Curr Rev Musculoskelet Med. 2017;10(4):547–558. doi: 10.1007/s12178-017-9445-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Tsutsui S, Yoshimura N, Watanuki A, et al Risk factors and natural history of de novo degenerative lumbar scoliosis in a community-based cohort: the miyama study. Spine Deform. 2013;1(4):287–292. doi: 10.1016/j.jspd.2013.05.005. [DOI] [PubMed] [Google Scholar]
- 3.Swamy G, Lopatina E, Thomas KC, et al The cost effectiveness of minimally invasive spine surgery in the treatment of adult degenerative scoliosis: A comparison of transpsoas and open techniques. Spine J. 2019;19(2):339–348. doi: 10.1016/j.spinee.2018.05.040. [DOI] [PubMed] [Google Scholar]
- 4.Brantigan JW, Steffee AD A carbon fiber implant to aid interbody lumbar fusion. Two-year clinical results in the first 26 patients. Spine (Phila Pa 1976) 1993;18(14):2106–2107. doi: 10.1097/00007632-199310001-00030. [DOI] [PubMed] [Google Scholar]
- 5.Ailon T, Smith JS, Shaffrey CI, et al Degenerative spinal deformity. Neurosurgery. 2015;77(Suppl 4):S75–S91. doi: 10.1227/NEU.0000000000000938. [DOI] [PubMed] [Google Scholar]
- 6.Cho KJ, Kim YT, Shin SH, et al Surgical treatment of adult degenerative scoliosis. Asian Spine J. 2014;8(3):371–381. doi: 10.4184/asj.2014.8.3.371. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.张志成, 任大江, 孙天胜, 等 退变性腰椎侧凸合并椎管狭窄的阶梯性治疗策略. 中国修复重建外科杂志. 2011;25(8):951–955. [PubMed] [Google Scholar]
- 8.Kuslich SD, Bagby G. The BAK interbody fusion system: early clinical results of treatment for chronic low back pain. The 8th Annual Meeting of the North American Spine Society. San Diego: [s.n], 1993.
- 9.王松, 杨函, 杨剑, 等 多孔磷酸钙/骨基质明胶复合骨水泥修复兔腰椎骨缺损的实验研究. 中国修复重建外科杂志. 2017;31(12):1462–1467. doi: 10.7507/1002-1892.201707097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Seaman S, Kerezoudis P, Bydon M, et al Titanium vs. polyetheretherketone (PEEK) interbody fusion: Meta-analysis and review of the literature . J Clin Neurosci. 2017;44:23–29. doi: 10.1016/j.jocn.2017.06.062. [DOI] [PubMed] [Google Scholar]
- 11.郜德龙, 方忠, 孙允龙, 等 同种异体骨 Cage 在经椎间孔腰椎椎间融合手术中的应用. 中国修复重建外科杂志. 2018;32(7):927–932. doi: 10.7507/1002-1892.201801125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.赵勃然, 郑修军, 马金荣 椎间融合器及其材料的研究与进展. 中国组织工程研究. 2017;21(2):315–321. [Google Scholar]
- 13.Xiong Y, Ren C, Zhang B, et al Analyzing the behavior of a porous nano-hydroxyapatite/polyamide 66 (n-HA/PA66) composite for healing of bone defects. Int J Nanomedicine. 2014;9:485–494. doi: 10.2147/IJN.S52990. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.温从游, 孟纯阳, 蒋电明 纳米羟基磷灰石/聚酰胺 66 复合材料的研究及应用. 中国组织工程研究. 2014;18(3):464–469. [Google Scholar]
- 15.杨曦, 宋跃明, 孔清泉, 等 纳米羟基磷灰石/聚酰胺 66 椎间融合器植骨融合治疗下腰椎退变性疾病的近期疗效. 中国修复重建外科杂志. 2012;26(12):1425–1429. [PubMed] [Google Scholar]
- 16.邓乾兴, 欧云生, 蒋电明, 等 n-HA/PA66 椎间融合器在颈椎病前路椎间盘切除减压融合术的中期临床疗效. 重庆医科大学学报. 2016;41(5):489–494. [Google Scholar]
- 17.Deng QX, Ou YS, Zhu Y, et al Clinical outcomes of two types of cages used in transforaminal lumbar interbody fusion for the treatment of degenerative lumbar diseases: n-HA/PA66 cages versus PEEK cages. J Mater Sci Mater Med. 2016;27(6):102. doi: 10.1007/s10856-016-5712-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Cinotti G, De Santis P, Nofroni I, et al Stenosis of lumbar intervertebral foramen: anatomic study on predisposing factors. Spine (Phila Pa 1976) 2002;27(3):223–229. doi: 10.1097/00007632-200202010-00002. [DOI] [PubMed] [Google Scholar]
- 19.Hueng DY, Chung TT, Chuang WH, et al Biomechanical effects of cage positions and facet fixation on initial stability of the anterior lumbar interbody fusion motion segment. Spine (Phila Pa 1976) 2014;39(13):E770–E776. doi: 10.1097/BRS.0000000000000336. [DOI] [PubMed] [Google Scholar]
- 20.Kurra S, Lavelle WF, Silverstein MP, et al Long-term outcomes of transforaminal lumbar interbody fusion in patients with spinal stenosis and degenerative scoliosis. Spine J. 2018;18(6):1014–1021. doi: 10.1016/j.spinee.2017.10.063. [DOI] [PubMed] [Google Scholar]
- 21.Landham PR, Don AS, Robertson PA. Do position and size matter? An analysis of cage and placement variables for optimum lordosis in PLIF reconstruction. Eur Spine J, 2017, 26(11): 2843-2850.
- 22.邓乾兴, 欧云生, 朱勇, 等 经椎间孔单节段腰椎椎间融合术后融合器下沉的危险因素分析. 中华骨科杂志. 2018;38(3):156–163. doi: 10.3760/cma.j.issn.0253-2352.2018.03.005. [DOI] [Google Scholar]
- 23.Aoki Y, Yamagata M, Nakajima F, et al Examining risk factors for posterior migration of fusion cages following transforaminal lumbar interbody fusion: a possible limitation of unilateral pedicle screw fixation. J Neurosurg Spine. 2010;13(3):381–387. doi: 10.3171/2010.3.SPINE09590. [DOI] [PubMed] [Google Scholar]
- 24.Khajavi K, Shen AY Two-year radiographic and clinical outcomes of a minimally invasive, lateral, transpsoas approach for anterior lumbar interbody fusion in the treatment of adult degenerative scoliosis. Eur Spine J. 2014;23(6):1215–1223. doi: 10.1007/s00586-014-3246-6. [DOI] [PubMed] [Google Scholar]
- 25.孟纯阳, 安洪, 蒋电明 新型纳米骨关节修复重建材料的生物活性及近期对机体钙磷代谢的影响. 中国骨与关节损伤杂志. 2005;20(10):682–684. doi: 10.3969/j.issn.1672-9935.2005.10.015. [DOI] [Google Scholar]
- 26.Pan FM, Wang SJ, Yong ZY, et al Risk factors for cage retropulsion after lumbar interbody fusion surgery: Series of cases and literature review. Int J Surg. 2016;30:56–62. doi: 10.1016/j.ijsu.2016.04.025. [DOI] [PubMed] [Google Scholar]
- 27.马龙冰, 贾云兵, 宋跃明, 等 聚氨基酸/纳米羟基磷灰石/硫酸钙椎间融合器在腰椎融合术中的初步应用. 中国修复重建外科杂志. 2016;30(3):328–335. [Google Scholar]
- 28.Abbushi A, Cabraja M, Thomale UW, et al The influence of cage positioning and cage type on cage migration and fusion rates in patients with monosegmental posterior lumbar interbody fusion and posterior fixation. Eur Spine J. 2009;18(11):1621–1628. doi: 10.1007/s00586-009-1036-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wang L, Zhang B, Chen S, et al A validated finite element analysis of facet joint stress in degenerative lumbar scoliosis. World Neurosurg. 2016;95:126–133. doi: 10.1016/j.wneu.2016.07.106. [DOI] [PubMed] [Google Scholar]
- 30.Zhang XN, Sun XY, Meng XL, et al Risk factors for medical complications after long-level internal fixation in the treatment of adult degenerative scoliosis. Int Orthop. 2018;42(11):2603–2612. doi: 10.1007/s00264-018-3927-6. [DOI] [PubMed] [Google Scholar]


