Abstract
Hintergrund: Mit den neu zugelassenen Impfungen gegen COVID-19 kam es zu ersten Berichten über allergische beziehungsweise Unverträglichkeitsreaktionen. In der Folge stellte sich die Frage, ob von diesen Impfstoffen eine erhöhte Gefahr für Unverträglichkeitsreaktionen ausgeht und ob Allergiker gegebenenfalls hierfür ein höheres Risiko aufweisen.
Ergebnisse: Allergische Reaktionen nach COVID-19-Impfungen wurden berichtet, jedoch meist von mildem Ausprägungsgrad und in bei Impfstoffen normaler (Moderna®) oder nur gering erhöhter Frequenz (BioNTech/Pfizer®). Das Risiko einer allergischen Reaktion auf die neu zugelassenen Vektorimpfstoffe (AstraZeneca®, Johnson & Johnson®) kann noch nicht abschließend beurteilt werden, scheint jedoch ebenfalls gering. Es gibt aktuell keinen Hinweis, dass Patienten mit Allergien häufiger oder schwerer reagieren. Man geht momentan davon aus, dass Unverträglichkeitsreaktionen vom Soforttyp einerseits Typ-I-allergisch (IgE-vermittelt) oder über Komplement-Aktivierung (CARPA, "complement activation-related pseudoallergy") stattfinden. Als Auslöser hierfür werden Polyethylenglycol (PEG) oder Polysorbat, die als Stabilisatoren in den Impfstoffen vorhanden sind, vermutet.
Diskussion: Die bisher verfügbaren Daten zeigen kein wesentlich erhöhtes Risiko hinsichtlich allergischer Reaktionen vom Soforttyp bei Allergikern. Allergiker können zumeist problemlos geimpft werden. Standardisierte Testungen zur Nachverfolgung möglicher Allergien oder CARPA-vermittelten Reaktionen sind derzeit nur begrenzt verfügbar.
Zitierweise: Altrichter S, Wöhrl S, Horak F, Idzko M, Jordakieva G, Untersmayr E, Szepfalusi Z, Zieglmayer P, Jensen-Jarolim E, Wiedermann U, Rosenkranz A, Hötzenecker W. Answers to burning questions for clinical allergologists related to the new COVID-19 vaccines. Allergo J Int 2021; 30:169-75
https://doi.org/10.1007/s40629-021-00177-3
Schlüsselwörter: COVID-19, Allergie, Anaphylaxie, Impfung
Impfungen gegen COVID-19 aus Sicht des Allergologen
Nach Angaben der WHO (World Health Organization) befinden sich derzeit 63 Impfpräparate in der klinischen Erprobung [1]. Stand März 2021 sind in der Europäischen Union (EU) vier Impfstoffe zugelassen und drei werden bereits geimpft: Zunächst wurde Comirnaty® der Firma Pfizer/BioNTech [2] sowie mRNA-1273 der Firma Moderna® zugelassen. Beide Präparate sind neuartige mRNA-basierte (mRNA, "messenger-RNA") Impfstoffe, bei denen Virus-mRNA in Lipidnanopartikel eingeschlossen wird [3]. Zudem enthalten beide Impfungen Hilfsstoffe (siehe Tab. 1). Ein Hilfsstoff (ALC-0159) enthält ein Polyethylenglykol(PEG)-Polymer mit einem Molekulargewicht von etwa 2.000 g/mol (PEG 2000), was einer mittleren Größe entspricht (im Vergleich zu den PEG-Längen, die in einer Vielzahl von Kosmetika und Medikamenten als Zusatzstoff oder zur PEGylierung von Arzneistoffen eingesetzt werden [von 300 bis etwa 40.000 g/mol]). Adjuvanzien sind in diesen Impfstoffen nicht enthalten, ebenso wenig Konservierungsstoffe oder Hühnereiweiß.
| Impfstoff, Hersteller | Inhaltsstoffe | Status |
|---|---|---|
| BNT162b2 (Comirnaty®), Pfizer/BioNTech |
mRNA ALC-0315 ((4-hydroxybutyl)azanediyl)bis (hexane-6,1-diyl)bis(2-hexyldecanoate) ALC-0159 (2-[(polyethylene glycol)-2000]- N,N-ditetradecylacetamide 1,2-Distearoyl-sn-glycero-3-phophocholine Cholesterol Kaliumchlorid, Kaliumdihydrogenphosphat, Natriumchlorid, Dinatriumhydrogenphosphat-dihydrat, Saccharose Durchstechflasche: Naturlatex-Stopfen |
Post-EUA |
| mRNA-1273 (Moderna®), Moderna Biotech | mRNA SM (sphyngomyelin)-102 Polyethylenglycol [PEG] 2000 dimyristoyl glycerol [DMG] 1,2-distearoyl-sn-glycero-3-phosphocholine [DPSC] Cholesterol Tromethamin-Hydrochlorid, Essigsäure, Natriumacetat, Saccharose | Post-EUA |
| AZD1222 (Vaxzevria®/ AstraZeneca), AstraZeneca | modifizierter Virus (ChAdOx1 nCoV-19) Polysorbat 80 = Polyoxyethylen-20-sorbitanmonooleat Histine, Saccharose, Natriumchlorid, Magnesiumchlorid NatriumEDTA, Ethanol | Post-EU |
| Ad26.COV2.S (Janssen), Johnson & Johnson |
Adenivirus26 vectored vaccine Natriumchlorid, Zitronensäure-monohydrat Polysorbat 80 = Polyoxyethylen-20-sorbitanmonooleat 2 hydroxylpropyl-B-cyclodextrin (HBCD) Ethanol, Natriumhydroxid |
Post-EU |
| NVX-CoV2373, Novavax | Rec. SARS-CoV-2 glycoprotein nanoparticle mit MatrixM adjuvant Polysorbat 80 = Polyoxyethylen-20-sorbitanmonooleat Matrix M1 adjuvant | Phase III |
| EU, Europäische Union; EUA, emergency use authorization; mRNA, messenger-RNA | ||
Die weiteren zugelassenen Impfstoffe sind vektorbasierte Impfstoffe der Firmen AstraZeneca und Johnson & Johnson. In diesen Impfstoffen ist PEG 2000 nicht enthalten, jedoch ein strukturverwandtes Molekül (Polysorbat 80 = Polyoxyethylen-20-sorbitanmonooleat). Aktuell befinden sich weitere Prüfpräparate in Phase-III-Studien, welche ebenfalls Polysorbat 80 enthalten (siehe Tab. 1).
Typ-I-allergische, IgE-vermittelte Reaktionen wurden in Einzelfallberichten auf (zumeist langkettige) PEG unterschiedlicher Größe berichtet [4, 5]. Allergien vom Soforttyp gegen PEG wurden in Einzelfällen zum Beispiel nach Darmreinigung in Vorbereitung einer Darmspiegelung beschrieben, bei der die Patienten eine große Menge PEG verabreicht bekommen haben. Da PEG als Hilfsstoff in einer Vielzahl von Produkten (Abführmittel, intravenöse Medikamente wie z. B. Kortison) enthalten ist, wird es auch als "verstecktes" Allergen vermutet [6, 7, 8]. Eine mögliche Typ-IV-Sensibilisierung auf (vorwiegend kurzkettige) PEGs (z. B. PEG 400) durch vorherige Anwendung von Kosmetika oder "dermal fillers" [9] ist ebenfalls möglich. PEG sind ebenfalls im zahnmedizinischen Umfeld im Einsatz (Bleachings, Zahnpasten). Abgesehen davon wurden auch pseudoallergische (nicht IgE-vermittelte) Reaktionen (sogenannte CARPA, "complement activation-related pseudoallergy") im Zusammenhang mit Liposomen beschrieben [3, 10, 11]. Diese Reaktionen werden zum Teil auf die Bindung von präexistierenden Anti-PEG-IgM an die Liposomen mit nachfolgender Komplementaktivierung zurückgeführt. Als klinische Symptome dieser nicht IgE-mediierten Hypersensitivität wurden Dyspnoe, Tachypnoe, Hypo- und Hypertension kurz nach der intravenösen Verabreichung anderer liposomenhaltiger Medikamente beschrieben. Unabhängig von der PEGylierung haben Liposomen das Potenzial, auch unspezifisch Komplement zu aktivieren (in Abhängigkeit ihrer verschiedenen Oberflächenstrukturen und Ladung) [3].
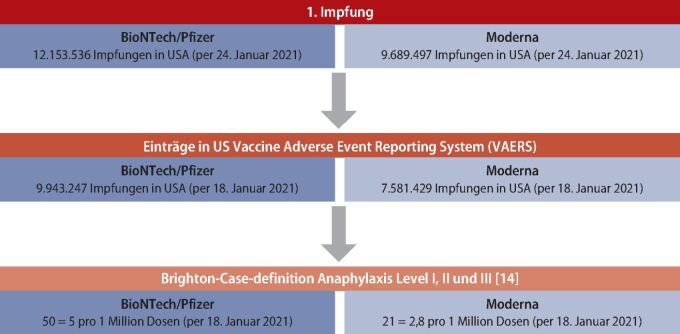
Bisher erfasste Nebenwirkungen nach einer COVID-19-mRNA-Impfung sind Lokalreaktionen, Fieber, Serum-Krankheit oder andere Nebenwirkungen (Exantheme, Schmerzen und Rötungen an der Impfstelle, Myalgie, Temperaturerhöhung etc.). Diese sind häufige auch nach anderen Impfungen beobachtete Reaktionen und nicht als Allergie oder Pseudoallergie gegen die Impfung zu werten. Bisher berichtete Fälle anaphylaktischer Reaktionen nach COVID-19-mRNA-Impfungen (Abb. 1) waren insgesamt selten und lagen beim mRNA1273-Impfstoff (Moderna®) bei 2,5 Vorfällen pro einer Million verabreichte Erstdosen. Geringfügig höhere Raten sind beim Impfstoff Comirnaty® (Pfizer/BioNTech) aufgefallen (5 pro 1 Million Erstimpfungen) [12, 13]. Sämtliche bisher berichtete allergische Reaktionen mit einem Brighton-Sicherheitsgrad I oder II (sehr hohe oder hohe diagnostische Sicherheit einer allergischen/anaphylaktischen Reaktion; [14]) hatten milde Reaktionen wie Hautsymptome (wie z. B. Rötung, Juckreiz, Quaddeln) oder Hautreaktionen und pulmonale Symptome (wie Kurzatmigkeit, Husten, Asthma, Stridor, Hypoxie). Keiner der Impflinge hat nach einer Notfallbehandlung einer stationären Behandlung bedurft. Interessanterweise waren 90 % der Patienten mit den vorher beschriebenen Reaktionen Frauen. Die Reaktionen traten zumeist innerhalb von 15 Minuten auf, jedoch bei einzelnen Patienten auch bis zu 2,5 Stunden nach der Impfung. Ob diese beobachteten Reaktionen auf IgE-vermittelte oder auf IgE-unabhängige pseudoallergische (gegebenenfalls CARPA) Reaktionen zurückzuführen sind, ist bisher unbekannt. Ebenso ist unklar, ob diese Reaktionen durch den Impfstoff an sich oder durch die Hilfsstoffe, wie zum Beispiel das PEG 2000, ausgelöst wurden.
Die berichteten aufgetretenen Todesfälle nach COVID-19-Impfung sind höchstwahrscheinlich nicht auf allergische Reaktionen gegenüber dem Impfstoff zurückzuführen, sondern zum Teil durch das hohe Lebensalter der ersten Impfzielgruppe in Pflegeheimen (seniles Alter, multiple Grunderkrankungen etc.) oder gegebenenfalls durch impfstoffspezifische Nebenwirkungen erklärbar [13].
Zu den Impfstoffen von AstraZeneca und Johnson & Johnson gibt es aktuell keine im Peer-Review-Verfahren bewertete und publizierte wissenschaftliche Analysen zu allergischen Reaktionen auf die Impfungen. Über Anaphylaxien nach Impfung mit AstraZeneca-Impfstoff wurde berichtet. Die European Medicines Agency (EMA) hat 535 Fälle bezogen auf 22 Millionen verimpfte AstraZeneca-Dosen erfasst, die jedoch sowohl von medizinischen als auch nicht medizinischem Personal gemeldet wurden und die bisher nicht allergologisch aufgearbeitet wurden. Die sich daraus theoretisch errechnende Zahl von 22 Fällen pro einer Million Dosen beinhaltet dementsprechend mit hoher Wahrscheinlichkeit eine hohe Anzahl an Impfnebenwirkungen, die die Kriterien für eine Anaphylaxie nicht erfüllen [15]. Beim Johnson-&-Johnson-Impfstoff wurden bisher über zwei anaphylaktische Reaktionen in den Medien berichtet [16]. Offizielle schriftliche Meldungen oder Stellungnahmen zu diesen Ereignissen gibt es bislang nicht (Stand: 17.3.2021). In den publizierten Zulassungsstudien mit dem Johnson-&-Johnson-Impfstoff an 40.000 Probanden kam es zu keiner anaphylaktischen Reaktion [17].
COVID-19-Impfungen bei Patienten mit allergologischen Erkrankungen
Aus den bisherigen Studiendaten lässt sich ableiten, dass für Patienten mit allergischen Erkrankungen (z. B. Rhinokonjunktivitis allergica, Asthma bronchiale, Nahrungsmittelallergien, Insektengiftallergien, Medikamentenallergien etc.) keine erhöhte Wahrscheinlichkeit für eine anaphylaktische Reaktion nach einer COVID-19-Impfung besteht [18]. Ein Drittel der bisher beobachten Fälle mit allergischen Reaktionen hatte keine bekannte allergische Vorerkrankung [12]. In der Mehrzahl der Fälle, in denen Reaktionen innerhalb von wenigen Minuten nach der Impfung auftraten, wurden nichtimmunologische Reaktionen (wie z. B. vasovagale Synkopen) diagnostiziert. Um bei vermeintlichen anaphylaktischen Reaktionen Klarheit über den Pathomechanismus zu erhalten, kann mittels Blutabnahme die Bestimmung der Mastzelltryptase aus dem Serum und des Komplementspiegels (C3/C4/CH 50) unmittelbar nach erfolgter Notfallbehandlung und Patientenstabilisierung erfolgen. [19]. Bekannte Allergien, außer eine Soforttypallergie gegen einen Bestandteil des Impfstoffs, stellen daher nach derzeitiger Datenlage kein Problem für die COVID-19-Impfung dar.
Patienten mit früheren Anaphylaxien auf Impfungen, bekannter idiopathischer Anaphylaxie, bekannter systemischer Mastozytose oder bei gesicherten Allergien gegen verschiedenste Medikamentengruppen können eine Prämedikation (Antihistaminika) vor der Impfung einnehmen (Tab. 2). Zudem kann eine längere Nachbeobachtung von 30 Minuten erwogen werden. Die Impfzentren sollten generell mit medizinischem Personal ausgestattet sein, von welchem eine Notfallbehandlung bei schweren Reaktionen durchgeführt werden kann. Notfallmedikamente inklusive Adrenalin-Pen, Infusions- und Intubationsbesteck sind bereit zu halten und das Personal muss hinsichtlich Reanimationen geschult sein.
| Impfung unbedenklich | Impfung in erhöhter Risikobereitschaft | keine Impfung aus allergologischer Sicht |
|
— positive Familienanamnese auf Allergien — inhalative Allergien — allergenspezifische Immuntherapie — bei Patienten mit stabilem Asthma oder Biologikatherapie — Unverträglichkeit von NSAR — Allergie gegen Insektengifte, Nahrungsmittel oder eindeutig definierte Medikamente oder Medikamentengruppe — Lokalreaktion (nicht systemisch) auf Impfungen |
— frühere Anaphylaxie gegen Impfungen — bekannte idiopathische Anaphylaxie — bekannte systemische Mastozytose — allergologisch abgeklärte und gesicherte Soforttypallergie gegen mehrere verschiedene Medikamentengruppenb |
— schwere Anaphylaxie auf die erste Teilimpfung — anamnestische schwere Anaphylaxie auf eine andere mRNA- oder Vektor-basierte COVID-19-Vakzine — anamnestische Soforttypreaktion auf PEG (PEG/Makrogol > 400, z. B. Washout-Lösungen bei Koloskopie, Laxanzien) — bekannte, gesicherte Soforttypallergie gegen PEG/Makrogol oder Polysorbat |
| Handlungsempfehlung | Handlungsempfehlung | Handlungsempfehlung |
|
— normale Durchführung der Impfung wie vorgesehen — Nachbeobachtung für 15 Minuten |
— bei Impfung: Nachbeobachtung für 30 Minuten — evtl. Prämedikation mit Antihistaminika — bevtl. Evaluierung des Risikos einer PEG-Allergie |
— nicht mit allergieauslösender Vakzine impfen — andere COVID-19-Vakzine wählen, falls verfügbar — Überweisung an ein allergologisches Zentrum für weitere Austestungen |
|
a© AG Allergologie der ÖGDV; Stand 12. Februar 2021 mRNA, messenger-RNA; NSAR, nicht steroidales Antirheumatikum; PEG, Polyethylenglykol | ||
Interaktionen zwischen COVID-19-Impfungen und vorhandenen Therapien bei Patienten
Patienten, die eine spezifische Immuntherapie (subkutane oder sublinguale Allergen-Immuntherapie [AIT]) durchführen, antiallergische Medikamente einnehmen (Antihistaminika, Leukotrienantagonisten, topische und systemische Glukokortikoide) oder eine Therapie mit Biologika gegen ihre allergische Erkrankung erhalten (z. B. Omalizumab, Dupilumab, Benralizumab, Mepolizumab, Reslizumab) können die Impfung erhalten [20]. Es wird allgemein empfohlen, diese Therapien (AIT, Biologika) jeweils im Intervall von ein bis zwei Wochen vor oder nach der COVID-19-Impfung vorzunehmen [21]. Eine sublinguale Immuntherapie (SLIT) kann wie gewohnt weiter eingenommen werden. Eine Pause am Tag der COVID-19-Impfung und eventuell noch ein bis zwei Tage danach kann empfohlen werden, um mögliche Impfreaktionen von Reaktionen auf die SLIT unterscheiden zu können.
Auch bei immunsuppressiven Systemtherapien (hochdosierte Glukokortikoide, Cyclosporin A, Methotrexat) kann die Impfung erfolgen. Es gibt bisher keine Daten, die eine schlechtere Verträglichkeit der Impfung unter diesen Therapien gezeigt haben, jedoch ist wie bei anderen Impfstoffen/Totimpfstoffen anzunehmen, dass nur ein reduzierter oder unzureichender Impfschutz unter Immunsuppression aufgebaut wird.
Möglichkeiten und Abwägung einer allergologischen Abklärung
Aus derzeitiger Sicht empfiehlt es sich, Personen, die auf die erste Impfung mit einer schweren fraglich allergischen Reaktion oder einem fraglich anaphylaktischen Schock reagiert haben, vor einer zweiten COVID-19-Impfung einer allergologischen Begutachtung und Abklärung zuzuführen. Aktuell stehen die verwendeten Zusatzstoffe der Impfungen für eine Allergietestung oftmals nicht zur Verfügung. Zudem fehlen Daten über die Sensitivität und Spezifität dieser Testsubstanzen in Hauttestungen (z. B. Haut-Pricktest oder Intrakutantest) oder zellulären Testansätzen (z. B. Basophilen-Aktivierungstest [BAT], zellulärer Stimulationstest [CAST]). PEG mit verschiedenen Molekulargewichten können als Reinsubstanz bezogen werden und wie auch Polysorbat 80 gegebenenfalls in "in house"-Pricktestungen eingesetzt werden, analog wie in den bisher berichteten Einzelfällen zur Abklärung einer IgE-vermittelten Allergie vom Soforttyp auf PEG oder Polysorbat. Generell dürfte die Kreuzreaktivität zwischen PEG und Polysorbaten unterschätzt sein, mit der Größe des PEG direkt proportional ansteigen [6] und IgE-mediiert sein [5]. Ob diese Testungen jedoch eine Abschätzung des allergologischen Risikos im Rahmen einer COVID-19-Impfung erlauben, ist ebenso nicht bekannt. Eine direkte Austestung mit dem Impfstoff ist derzeit nicht möglich, da einerseits die Impfstoffknappheit diese Testungen aus ethischer Sicht nicht erlauben würde und andererseits weder Art der Testung noch Testkonzentrationen oder Testreagibilität mit dem Impfstoff bekannt oder etabliert sind. Kontaktallergien auf PEG sind beschrieben und werden auch regelmäßig im Epikutantest erfasst (PEG400). In den wenigen bekannten Fällen, bei denen verschiedene PEG getestet wurden, zeigte sich meist nur geringe Kreuzreaktivität zwischen niedermolekularen PEG und hochmolekularen PEG (PEG4000 oder PEG3350) [22]. Bisher gibt es noch keinen berichteten Fall einer allergischen Reaktion nach der COVID-19-Impfung bei Patienten mit bekannter Typ-4-Sensibilisierung auf PEG.
Diskussion
Nach aktuellem Wissensstand sind allergische beziehungsweise anaphylaktische Reaktionen auf die neuartigen COVID-19-Impfstoffe sehr selten, aber bis zu circa zehnmal häufiger als auf konventionelle Impfstoffe. Patienten mit Erkrankungen aus dem atopisch-allergischen Formenkreis haben insgesamt kein erhöhtes Risiko für eine allergische Reaktion auf die Impfung. Als auslösende Agenzien für Hypersensitivitätsreaktionen kommen die im Impfstoff enthaltenen Lipidnanopartikel, und besonders das darin enthaltene PEG, in Betracht. Bei den Vektorimpfstoffen der Firma AstraZeneca und Johnson & Johnson ist Polysorbat 80 ein mögliches allergieauslösendes Agens. Prädiktive Testverfahren, die das Eintreten einer (pseudo)allergischen Unverträglichkeitsreaktion bei einer COVID-19-Impfung wahrscheinlich machen oder ausschließen könnten, stehen nur sehr begrenzt zur Verfügung. Allergische und Unverträglichkeitsreaktionen können mit einer klinisch schweren (anaphylaktoiden) Symptomatik manifest werden und treten in der Regel innerhalb von 15-30 Minuten nach der Verabreichung auf. Personelle, räumliche und technische Ausstattung zur Notfallbehandlung in Impfzentren ist daher notwendig. Es besteht keine Kontraindikation für Allergiker*innen beziehungsweise Menschen mit Anaphylaxien in der Vorgeschichte. Eine vorbekannte Allergie auf im Impfstoff enthaltene Inhaltsstoffe (z. B. PEG) stellt jedoch derzeit eine Kontraindikation für die entsprechende Impfung dar, wie auch eine anaphylaktische Reaktion auf die erste Dosis des COVID-19-Impfstoffs, die eine Kontraindikation für die Verabreichung der zweiten Dosis mit demselben Präparat darstellt. In Übereinstimmung mit dem Center for Disease Control [23], empfehlen die Autoren, unabhängig vom Vakzine-induzierten Antikörper-Titer vorerst auf die zweite Impfung zu verzichten, bis valide Daten vorliegen, welche die zweite Impfung mit einem Alternativpräparat unterstützen.
Abgesehen von den Anaphylaxien bei Erstinjektion, die eine präexistente Sensibilisierung voraussetzen [24], kann derzeit keine Aussage getroffen werden, ob die erste Teilimpfung per se zu einer spezifischen Sensibilisierung führen kann. Es wurden insgesamt erst vier Fälle von anaphylaktischen Reaktion nach der zweiten Gabe dokumentiert [13].
Gemäß europäischer Produktinformation soll eine mindestens 15- bis 30-minütige Nachbeobachtung bei allen geimpften Personen nach der Impfung erfolgen. Für den Fall einer schweren allergischen Unverträglichkeitsreaktion nach der Verabreichung des Impfstoffs sollte immer eine angemessene medizinische Behandlung und Überwachung bereitstehen.
PD Dr. Sabine Altrichter.
Universitätsklinik für Dermatologie und Venerologie
Comprehensive Allergy Center
Kepler Universitätsklinikum
Krankenhausstraße 9
4020 Linz, Österreich
E-Mail: sabine.altrichter@kepleruniversitätsklinikum.at
Anmerkungen.
Aufgrund des aktuell rasanten Wissenszuwachses reflektiert dieses Manuskript den Kenntnisstand vom 17. März 2021 und es ist möglich, dass die angeführten Überlegungen in naher Zukunft veraltet sein könnten.
Bei der Erstellung dieses Manuskripts wurden keine finanziellen Mittel zur Unterstützung erhalten.
Abkürzungen .
AIT Allergen-Immuntherapie
BAT Basophilen-Aktivierungstest
CARPA Complement activation-related pseudoallergy
CAST Zellulärer Stimulationstest
COVID Corona Virus Disease
mRNA Messenger-RNA
PEG Polyethylenglycol
SLIT Sublinguale Immuntherapie
Interessenkonflikt
Die Autoren geben an, keine Interessenkonflikte zu haben, die für den Inhalt dieses Artikels relevant sind.
Außerhalb der vorliegenden Arbeit: S. Altrichter hat Studien durchgeführt/war Beraterin für/war Sprecherin für Allakos, AstraZeneca, CSL Behring, Moxie und Novartis.
S. Wöhrl war Berater und/oder Sprecher für AbbVie, ALK, Allergopharma, Bencard, DrFalk, HAL, MEDA, Novartis, Lilly, Pelpharma, Sanofi-Aventis, Siemens Healthineers, Stallergenes und ThermoFisher Scientific.
F. Horak war Berater für LETI, hat Studien mit ALK und Bencard Allergy durchgeführt und war Sprecher für HAL und Allergopharma.
M. Idzko war Berater und/oder Sprecher für AstraZeneca, Bayer, Berlin-Chemie, Boehringer-Ingelheim, Chiesi, CSL-Behring, GSK, Menarini, MSD, Novartis, Roche, Sanofi und Thermofischer. G. Jordakieva war Berater für die Bencard Allergie GmbH.
Z. Szepfalusi war Sprecher oder war in Beiräten tätig für Milupa/Nutricia, Novartis und Medis.
P. Zieglmayer hat Vortragsgebühren erhalten von Alk Abello, Allergopharma, Allergy Therapeutics, HAL, Leti, Meda, Merck, Novartis, Stallergenes und Thermo Fisher Scientific sowie wissenschaftliche Stipendien und Lehrstipendien von Alk-Abelló, Allergopharma, Allergy Therapeutics, Biomay, Calistoga, GSK, HAL, Marinomed, MSD, Ono, Oxagen, RespiVert, Stallergenes und VentirX. Sie ist Beiratsmitglied bei Alk Abello, Bencard, Meda, Merck, Novartis, Sigmapharm und Stallergenes.
E. Jensen-Jarolim ist Anteilseigner von Biomedical Int. R+D GmbH und hat Studien mit Bencard Allergie, Deutschland sowie Allergy Therapeutics Ltd, UK, durchgeführt. Sie hat gelehrt für Bencard, ATL, Meda, Novartis, Sanofi, Santen, Allergopharma und Roxall.
U. Wiedermann ist PI bei klinischen Versuchen an der Medizinischen Universität, gesponsert von Novartis, GSK und Pfizer. Keine der Studien bezieht sich auf COVID-19-Impfstoffe. Er erhält kein persönliches Honorar und ist Mitglied der National Immunization Advisory Group (NIG).
W Hötzenecker hat Studien durchgeführt/war Berater/Sprecher für Novartis, Eli Lilly, Bencard, ALK, Leo Pharma, Kyowa Kirin, Takeda, Sanofi-Aventis und AbbVie.
Contributor Information
Sabine Altrichter, Email: sabine.altrichter@kepleruniversitätsklinikum.at.
Stefan Wöhrl, Email: stefan.woehrl@faz.at.
Petra Zieglmayer, Email: petra@zieglmayer.at.
Wolfram Hötzenecker, Email: wolfram.hoetzenecker@kepleruniklinikum.at.
Literatur
- 1.WHO. Landscapes of COVID-19 candiate vaccines. 2021, www.who.int/publications/m/item/draft-landscape- of-covid-19-candidate-vaccines (Accessed: 29.1.2021)
- 2.MHRA. MHRA Public Assessment Report - Authorisation for Temporary Supply COVID-19 mRNA Vaccine BNT162b2 (BNT162b2 RNA) concentrate for solution for injection. 11.12.2020, https://www.gov.uk/government/publications/regulatory-approval-of-pfizer-biontech-vaccine-for-covid-19 (Accessed: 17.12.2020)
- 3.Inglut CT, Sorrin AJ, Kuruppu T, Vig S, Cicalo J, Ahmad H et al. Immunological and Toxicological Considerations for the Design of Liposomes. Nanomaterials (Basel) 2020;10:190 [DOI] [PMC free article] [PubMed]
- 4.Calogiuri G, Foti C, Nettis E, Di Leo E, Macchia L, Vacca A. Polyethylene glycols and polysorbates: Two still neglected ingredients causing true IgE-mediated reactions. J Allergy Clin Immunol Pract 2019;7:2509-10 [DOI] [PubMed]
- 5.Giavina-Bianchi P, Kalil J. Polyethylene Glycol Is a Cause of IgE-Mediated Anaphylaxis. J Allergy Clin Immunol Pract 2019;7:1874-5 [DOI] [PubMed]
- 6.Stone CA, Jr., Liu Y, Relling MV, Krantz MS, Pratt AL, Abreo A et al. Immediate Hypersensitivity to Polyethylene Glycols and Polysorbates: More Common Than We Have Recognized. J Allergy Clin Immunol Pract 2019;7:1533-40 e8 [DOI] [PMC free article] [PubMed]
- 7.Wenande E, Garvey LH. Immediate-type hypersensitivity to polyethylene glycols: a review. Clin Exp Allergy 2016;46:907-22 [DOI] [PubMed]
- 8.Wylon K, Dolle S, Worm M. Polyethylene glycol as a cause of anaphylaxis. Allergy Asthma Clin Immunol 2016;12:67 [DOI] [PMC free article] [PubMed]
- 9.American Society for Dermatologic Surgery. Guidance Regarding SARS-CoV-2 mRNA Vaccine Side Effects in Dermal Filler Patients - Based on information available as of 28 December 2020. 2020, www.asds.net/Portals/0/PDF/secure/ASDS-SARS-CoV-2-Vaccine-Guidance.pdf (Accessed: 12.2.2021)
- 10.Szebeni J, Muggia F, Gabizon A, Barenholz Y. Activation of complement by therapeutic liposomes and other lipid excipient-based therapeutic products: prediction and prevention. Adv Drug Deliv Rev 2011;63:1020-30 [DOI] [PubMed]
- 11.Mohamed M, Abu Lila AS, Shimizu T, Alaaeldin E, Hussein A, Sarhan HA et al. PEGylated liposomes: immunological responses. Sci Technol Adv Mater 2019;20:710-24 [DOI] [PMC free article] [PubMed]
- 12.CDC COVID-19 Response Team, Food and Drug Administration. Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine - United States, December 14-23, 2020. MMWR Morb Mortal Wkly Rep 2021;70:46-51 [DOI] [PMC free article] [PubMed]
- 13.Shimabukuro T. COVID-19 vaccine safety update - January 27, 2021. National Center for Immunization and Respiratory diseases - Advisory Comittee on Immunozation Pracitices (ACIP). 2021, www.cdc.gov/ vaccines/acip/meetings/downloads/slides-2021-01/06-COVID-Shimabukuro.pdf (Accessed: 12.2.2021)
- 14.Ruggeberg JU, Gold MS, Bayas JM, Blum MD, Bonhoeffer J, Friedlander S et al. Anaphylaxis: case definition and guidelines for data collection, analysis, and presentation of immunization safety data. Vaccine 2007;25:5675-84 [DOI] [PubMed]
- 15.European Medicines Agency. EudraVigilance - European database of suspected adverse drug reactions. 2021, https://www.adrreports.eu/de/search_subst.html# (Accessed: 15.4.2021)
- 16.Berkeley LJ. J&J says two trial participants had severe allergic reactions after getting Covid vaccine. CNBC. 2021, www.cnbc.com/2021/02/26/jj-says-two-people-had- severe-allergic-reactions-after-getting-covid-vaccine.html (Accessed: 17.3.2021)
- 17.CDC. Local Reactions, Systemic Reactions, Adverse Events, and Serious Adverse Events: Janssen COVID-19 Vaccine. 2021, www.cdc.gov/vaccines/covid-19/info-by-product/janssen/reactogenicity.html (Accessed: 17.3.2021)
- 18.Li X, Xu S, Yu M, Wang K, Tao Y, Zhou Y et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. J Allergy Clin Immunol 2020;146:110-8 [DOI] [PMC free article] [PubMed]
- 19.Doessegger L, Banholzer ML. Clinical development methodology for infusion-related reactions with monoclonal antibodies. Clin Transl Immunology 2015;4:e39 [DOI] [PMC free article] [PubMed]
- 20. Klimek L, Pfaar O, Worm M, Eiwegger T, Hagemann J, Ollert M, et al. Anwendung von Biologika bei allergischen und Typ-2-entzündlichen Erkrankungen in der aktuellen Covid-19-Pandemie: Positionspapier des Ärzteverbands Deutscher Allergologen (AeDA)A, der Deutschen Gesellschaft für Allergologie und klinische Immunologie (DGAKI)B, der Gesellschaft für Pädiatrische Allergologie und Umweltmedizin (GPA)C, der Österreichischen Gesellschaft für Allergologie und Immunologie (ÖGAI)D, der Luxemburgischen Gesellschaft für Allergologie und Immunologie (LGAI)E, der Österreichischen Gesellschaft für Pneumologie (OGP)F in Kooperation mit der deutschen, österreichischen und schweizerischen ARIA-GruppeG und der Europäischen Akademie für Allergologie und Klinische Immunologie (EAACI)H. Allergo J 2020;29(4):14-27 [DOI] [PMC free article] [PubMed]
- 21.Klimek L, Pfaar O, Worm M, Bergmann KC, Bieber T, Buhl R, et al. Allergen-Immuntherapie in der aktuellen Covid-19-Pandemie: Positionspapier der deutschen ARIA-GruppeA in Kooperation mit der österreichischen ARIA-GruppeB, der schweizerischen ARIA-GruppeC, dem Ärzteverband Deutscher Allergologen (AeDA)D, der Deutschen Gesellschaft für Allergologie und klinische Immunologie (DGAKI)E und der Gesellschaft für Pädiatrische Allergologie und Umweltmedizin (GPA)F in Kooperation mit der AG Klinische Immunologie, Allergologie und Umweltmedizin der DGHNO-KHCG und der Europäischen Akademie für Allergologie und klinische Immunologie (EAACI)H. Allergo J 2020;29(3):17-25 [DOI] [PMC free article] [PubMed]
- 22.Sellaturay P, Nasser S, Ewan P. Polyethylene Glycol-Induced Systemic Allergic Reactions (Anaphylaxis). J Allergy Clin Immunol Pract 2021;9:670-5 [DOI] [PubMed]
- 23.CDC. Interim considerations: preparing for the potential management of anaphylaxis after COVID-19 vaccination (February 10, 2021). www.cdc.gov/vaccines/covid-19/clinical-considerations/managing-anaphylaxis.html (Accessed: 12.2.2021)
- 24.Sokolowska M, Eiwegger T, Ollert M, Torres MJ, Barber D, Del Giacco S et al. EAACI statement on the diagnosis, management and prevention of severe allergic reactions to COVID-19 vaccines. Allergy 2021; https://doi.org/10.1111/all.14739 [DOI] [PMC free article] [PubMed]
- 25.Castells MC, Phillips EJ. Maintaining Safety with SARS-CoV-2 Vaccines. N Engl J Med 2020; https://doi.org/10.1056/NEJMra2035343 [DOI] [PMC free article] [PubMed]