Abstract
目的
探讨脂肪干细胞来源外泌体(adipose-derived stem cell derived exosomes,ADSC-Exos)对大鼠皮瓣移植后血管新生的影响。
方法
取抽脂术患者自愿捐赠脂肪组织,采用酶消化法分离培养 ADSCs;取第 3 代细胞光镜观察形态,流式细胞术鉴定细胞表面标志物,成脂诱导培养 14 d 后油红 O 染色观察。细胞鉴定为 ADSCs 后,采用密度梯度离心法提取 ADSC-Exos;透射电镜观察形态,Western blot 检测膜表面标志蛋白(CD63、TSG101),纳米颗粒跟踪分析仪测量其粒径分布。取 20 只雄性 SD 大鼠,体质量 250~300 g,随机分为 ADSC-Exos 组和 PBS 组,每组 10 只。两组大鼠背部沿长轴方向制作面积为 9 cm×3 cm 随意皮瓣后,分别于近端、中间和远端区域注射 ADSC-Exos(ADSC-Exos 组)或 PBS(PBS 组)。术后大体观察皮瓣成活情况,第 7 天测算皮瓣成活率后切取皮瓣组织,HE 染色观察组织形态,CD31 免疫组织化学染色测定皮瓣微血管密度(mean blood vessel density,MVD)。
结果
光镜、流式细胞术及成脂诱导培养鉴定培养细胞为 ADSCs。ADSC-Exos 为边缘清晰、大小形态均匀的圆形或椭圆形膜性囊泡,高表达标志蛋白 CD63 和 TSG101,粒径分布在 30~200 nm,符合外泌体粒径范围。术后两组皮瓣远端均出现不同程度坏死表现,但 ADSC-Exos 组程度较 PBS 组轻;第 7 天 ADSC-Exos 组皮瓣成活率为 64.2%±11.5%,显著大于 PBS 组的 31.0%±6.6%(t=7.945,P=0.000);中间区域皮肤附属器官更完整,近端区域组织水肿程度轻、血管扩张更多。ADSC-Exos 组 MVD 为(103.3±27.0)个/视野,显著多于 PBS 组(45.3±16.2)个/视野(t=3.190,P=0.011)。
结论
ADSC-Exos 可通过促进皮瓣移植后新生血管的形成,改善皮瓣血供,进而提高大鼠皮瓣成活率。
Keywords: 脂肪干细胞, 外泌体, 皮瓣移植, 血管新生, 大鼠
Abstract
Objective
To investigate the effect of adipose-derived stem cell derived exosomes (ADSC-Exos) on angiogenesis after skin flap transplantation in rats.
Methods
ADSCs were isolated and cultured by enzymatic digestion from voluntary donated adipose tissue of patients undergoing liposuction. The 3rd generation cells were observed under microscopy and identified by flow cytometry and oil red O staining at 14 days after induction of adipogenesis. After cells were identified as ADSCs, ADSC-Exos was extracted by density gradient centrifugation. And the morphology was observed by transmission electron microscopy, the surface marker proteins (CD63, TSG101) were detected by Western blot, and particle size distribution was measured by nanoparticle size tracking analyzer. Twenty male Sprague Dawley rats, weighing 250-300 g, were randomly divided into ADSC-Exos group and PBS group with 10 rats in each group. ADSC-Exos (ADSC-Exos group) and PBS (PBS group) were injected into the proximal, middle, and distal regions of the dorsal free flaps with an area of 9 cm×3 cm along the long axis in the two groups. The survival rate of the flap was measured on the 7th day, and then the flap tissue was harvested. The tissue morphology was observed by HE staining, and mean blood vessel density (MVD) was measured by CD31 immunohistochemical staining.
Results
ADSCs were identified by microscopy, flow cytometry, and adipogenic induction culture. ADSC-Exos was a round or elliptical membrane vesicle with clear edge and uniform size. It has high expression of CD63 and TSG101, and its size distribution was 30-200 nm, which was in accordance with the size range of Exos. The distal necrosis of the flaps in the ADSC-Exos group was milder than that in the PBS group. On the 7th day, the survival rate of the flaps in the ADSC-Exos group was 64.2%±11.5%, which was significantly higher than that in the PBS group (31.0%±6.6%; t=7.945, P=0.000); the skin appendages in the middle region of the flap in the ADSC-Exos group were more complete, the edema in the proximal region was lighter and the vasodilation was more extensive. MVD of the ADSC-Exos group was (103.3±27.0) /field, which was significantly higher than that of the PBS group [(45.3±16.2)/field; t=3.190, P=0.011].
Conclusion
ADSC-Exos can improve the blood supply of skin flaps by promoting the formation of neovascularization after skin flap transplantation, thereby improve the survival rate of skin flaps in rats.
Keywords: Adipose-derived stem cells, exosomes, flap transplantation, angiogenesis, rat
皮瓣移植是临床修复创伤、肿瘤切除、先天畸形等原因导致的组织缺损最经典且最重要的方法[1]。皮瓣远端缺血性坏死是移植术后最常见并发症,尤其是皮瓣长宽比较大时 [2]。发生缺血性坏死的主要原因是缺乏新生血管,因此需要寻找一种促进皮瓣移植后血管新生的方法,以提高皮瓣成活率。
脂肪干细胞(adipose-derived stem cells,ADSCs)是人体储量丰富的 MSCs,因具有较强的增殖分化能力、免疫调节作用以及获取便利、对受区损伤小等优势,常用于组织再生与修复[3]。研究证明,ADSCs 在创面愈合过程中血管形成方面发挥了重要作用[4]。外泌体(exosomes,Exos)是 MSCs 和靶细胞之间重要的旁分泌介质[5-6],MSCs 分泌的 Exos 可以有效减少心肌缺血-再灌注损伤[7-8]以及保护肾脏免受缺血-再灌注损伤[9],提示 Exos 对缺血性疾病的治疗具有积极作用。本课题组前期研究发现 ADSC-Exos 能促进人脐静脉血管内皮细胞增殖、迁移及管样分化,提示其可能促进血管新生[10]。为此,我们进行了本次研究,旨在通过建立大鼠随意皮瓣模型,评估 ADSC-Exos 对皮瓣移植后成活的影响及能否促进血管新生。报告如下。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
2~3 月龄雄性 SPF 级 SD 大鼠 20 只,体质量 250~300 g,由南昌大学动物实验中心提供,实验前适应性喂养 1 周。实验用脂肪组织由在南昌大学第二附属医院整形美容科接受腰腹部超声吸脂术的健康女性自愿捐赠,年龄 25~40 岁。
L-DMEM 培养基、FBS、Ⅰ型胶原酶(GIBCO 公司,美国);鼠抗人 CD90、CD105、CD49d、CD45、CD106、CD34 多克隆抗体(BD 公司,美国);BCA 蛋白质定量试剂盒[天根生化科技(北京)有限公司];CD63、TSG101、β-actin 多克隆抗体(Abcam 公司,美国);HE 染液、兔抗鼠 CD31 多克隆抗体(武汉赛维尔生物科技有限公司)。
CO2 培养箱(Thermo 公司,美国);流式细胞仪(BD 公司,美国);低温超高速离心机(Beckman 公司,美国);纳米颗粒跟踪分析仪 NanoSight(Malvern 公司,英国);透射电镜(ZEISS 公司,德国)。
1.2. ADSCs分离培养及鉴定
取 10 mL 无菌脂肪组织置于 50 mL 离心管中,PBS 冲洗后加入 10 mL 0.2% Ⅰ型胶原酶,置于 37 ℃ 恒温水浴箱消化;加入等体积完全培养基终止消化,以 258×g 离心 5 min;弃上清,完全培养基重悬细胞沉淀后接种至培养瓶,于 37 ℃、5%CO2 培养箱中培养,待细胞融合至 80% 以上后传代。
取第 3 代 ADSCs,光镜下观察细胞形态;流式细胞术鉴定细胞表面标志物 CD90、CD105、CD49d、CD45、CD106、CD34 表达;成脂诱导培养 14 d 后,油红 O 染色观察。
1.3. ADSC-Exos分离纯化及鉴定
1.3.1. ADSC-Exos分离纯化
4 ℃ 条件下,将 FBS 以 100 000×g 离心 8 h,取上清制备无 Exos 的完全培养基。取第 3 代 ADSCs,加入无 Exos 完全培养基温育 48 h 后,收集上清,采用密度梯度离心法提取 ADSC-Exos。具体步骤:4 ℃、以 300×g 离心 10 min,取上清;以 3 000×g 离心 20 min,取上清;以 10 000×g 离心 30 min,取上清;以 100 000×g 离心 70 min,取沉淀,1 mL PBS 重悬;以 100 000×g 离心 70 min,取沉淀,100 μL PBS 重悬,0.22 μm 滤器过滤。将提取的 ADSC-Exos 悬浊液储存于−80 ℃ 备用。
1.3.2. ADSC-Exos鉴定
① 透射电镜下观察 ADSC-Exos 形态:取 10 μL ADSC-Exos 悬浊液于 300 目载样铜网上,1% 磷钨酸溶液负染 5 min,晾干后于透射电镜下观察。②Western blot 检测 ADSC-Exos 膜表面标志蛋白:取 ADSC-Exos 以 100 000×g 离心 70 min,弃上清,加入 RIPA 裂解液 80 μL,在冰上裂解充分后,于 4 ℃ 以 10 000×g 离心 30 min,取上清并转移至新的 1.5 mL EP 管中,−80 ℃ 冻存。BCA 法测定 ADSC-Exos 蛋白浓度,加入 6×Loading Buffer,95 ℃ 变性 10 min。10%SDS-PAGE 胶每孔上样量为 50 μg,80 V 电泳 30 min,100 V 电泳 1 h,200 mA 转膜 80 min,5% 脱脂牛奶室温封闭 1 h,加入 CD63、TSG101、β-actin 一抗 4 ℃ 孵育过夜。用 TBST 将 PVDF 膜漂洗 3 次,每次 10 min,再加入二抗室温孵育 1 h,最后显影曝光。以 ADSCs 作为对照,检测方法步骤同上。③ 纳米颗粒跟踪分析仪测量 ADSC-Exos 粒径分布:用 1.5 mL PBS 将 100 μL 浓度为 100 μg/mL 的 ADSC-Exos 重悬后,使用纳米颗粒跟踪分析仪进行检测。
1.4. 动物模型制备及分组
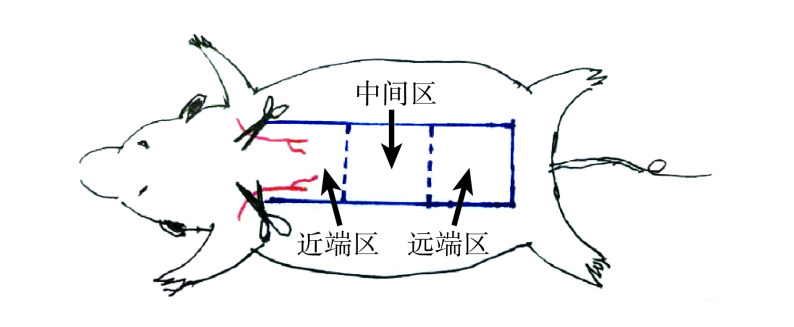
将 20 只大鼠随机分为 ADSC-Exos 组和 PBS 组,每组 10 只。参考改良 McFarlanc 皮瓣模型制备方法[11-12],于大鼠背部制备随意皮瓣模型。两组大鼠腹腔注射 2% 戊巴比妥钠(50 mg/kg)麻醉后固定于操作台,背部剃毛、消毒后,沿长轴方向设计制备 1 个面积为 9 cm×3 cm 的随意皮瓣,深达筋膜层。根据血供及与蒂部距离,将皮瓣等分为 3 个区域,分别为近蒂部以成活为主的近端区域、可能存在坏死与成活并存的中间区域和以坏死为主的远端区域,每个区域面积为 3 cm×3 cm。见图1。皮瓣原位缝合后,ADSC-Exos 组在皮瓣近端、中间、远端区域,分别选取左、右对称 2 处,注射 100 μL 含 ADSC-Exos(100 μg/mL)的 PBS 混悬液,确保注射的 ADSC-Exos 在皮瓣各区分布均匀;对照组同部位注射等量 PBS。用敷料将两组大鼠背部包裹后分笼饲养。
图 1.
Schematic design of dorsal skin flaps in rats
大鼠背部皮瓣设计示意图
蓝色线条示切口切缘,红色线条示蒂部知名血管
The blue line for the incision margin, and the red line for the well-known blood vessels of the pedicle
1.5. 观测指标
1.5.1. 大体观察
术后观察大鼠成活及皮瓣愈合情况。术后第 7 天两组大鼠同上法麻醉后,用透明纸描绘背部皮瓣成活区域[13],拍照并标记标尺后导入计算机,使用 Image Pro Plus6.0 软件(Media Cybernetics 公司,美国)测量面积,计算皮瓣成活率(成活皮瓣面积/皮瓣总面积×100%)。
1.5.2. 组织学观察
大体观察后,两组分别切取皮瓣 3 个区域中间部位皮肤组织,经固定、脱水、包埋后切片,片厚 3 μm。取部分切片常规 HE 染色,观察皮肤各层次组织形态。
1.5.3. 免疫组织化学染色观察
取两组部分切片,常规二甲苯脱蜡,经各级浓度乙醇水化,柠檬酸盐缓冲液行抗原修复,3%H2O2 封闭后,滴加一抗 CD31(1∶100),4 ℃ 条件下过夜;滴加辣根过氧化物酶标记的二抗,4 ℃ 孵育 30 min。每张切片滴加 DAB 液显色 20 min,各级浓度乙醇快速脱水,二甲苯透明,中性树脂封片。晾干后镜下观察管样形状,以棕色为阳性染色。每组取 10 张切片,100 倍镜下每张切片随机挑选 5 个视野,计数 CD31 阳性血管,取均值,作为皮瓣微血管密度(mean blood vessel density,MVD)。
1.6. 统计学方法
采用 SPSS17.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. ADSCs细胞形态及鉴定
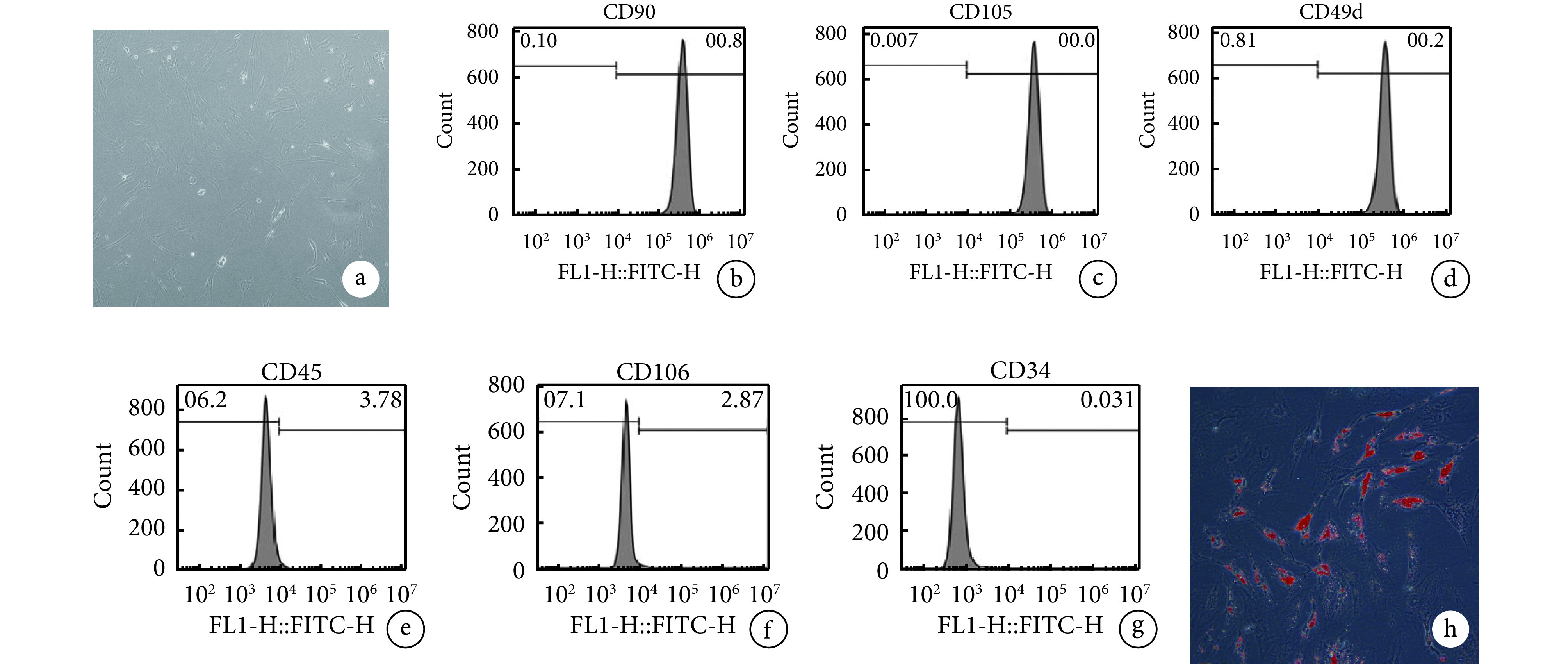
第 3 代 ADSCs 呈长梭形贴壁生长,生长密集后表现为旋涡状分布。流式细胞术鉴定显示 CD90、CD105、CD49d 表达为阳性,CD45、CD106、CD34 表达为阴性。成脂诱导培养 3 d 后光镜下可见胞质中有透明脂滴形成;14 d ADSCs 胞质内脂滴融合增大,形态更饱满,油红 O 染色呈阳性。上述检测结果提示培养细胞为 ADSCs。见图2。
图 2.
Morphology and identify of ADSCs
ADSCs形态观察及鉴定
a. 第 3 代 ADSCs 形态(×200);b~g. 流式细胞术鉴定;h. 成脂诱导 14 d 油红 O 染色观察(×200)
a. Morphology of the 3rd generation ADSCs (×200); b-g. Flow cytometry identification; h. Oil red O staining at 14 days after induction of adipogenesis (×200)
2.2. ADSC-Exos鉴定
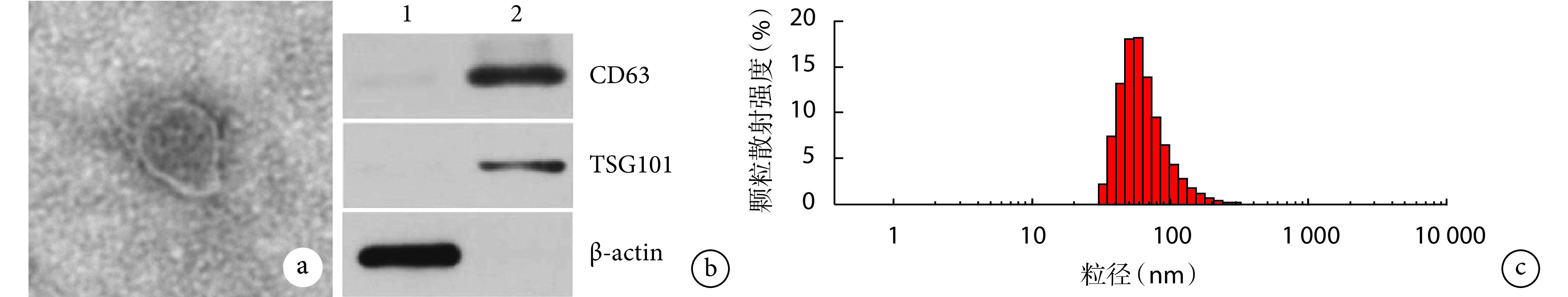
透射电镜下见 ADSC-Exos 为边缘清晰、大小形态均匀的圆形或椭圆形膜性囊泡。Western blot 检测示,ADSC-Exos 高表达标志蛋白 CD63 和 TSG101,未检测到干细胞中表达的 β-actin,提示分离出的 ADSC-Exos 纯度较高。纳米颗粒跟踪分析仪显示 ADSC-Exos 粒径分布在 30~200 nm,符合外泌体粒径范围。见图3。
图 3.
Identification of ADSC-Exos
ADSC-Exos鉴定
a. 透射电镜观察(×49k);b. Western blot 检测 1: ADSCs 2: ADSC-Exos;c. 纳米颗粒跟踪分析仪检测ADSC-Exos粒径分布
a. Transmission electron microscopic observation (×49k); b. Western blot 1: ADSCs 2: ADSC-Exos;c. ADSC-Exos particle size distribution detected by nanoparticle tracking analyzer
2.3. 动物实验结果
2.3.1. 大体观察
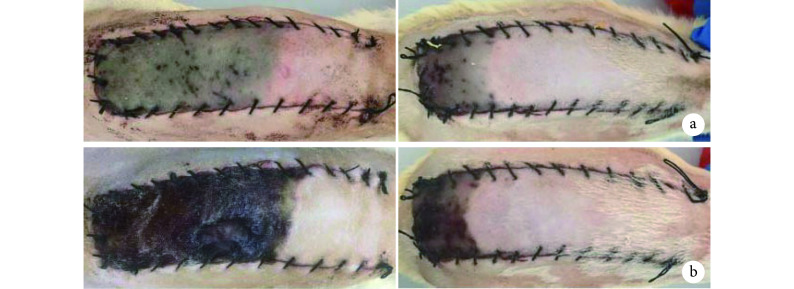
术后第 3 天两组皮瓣远端均出现不同程度皮肤紫绀,靠近近端区域的皮肤成活,且 ADSC-Exos 组成活范围明显大于 PBS 组。第 7 天两组皮瓣远端均出现不同程度坏死表现,有黑痂形成;ADSC-Exos 组皮瓣成活率为 64.2%±11.5%,显著大于 PBS 组的 31.0%±6.6%,差异有统计学意义(t=7.945,P=0.000)。见图4。
图 4.
Gross observation of two groups after operation
术后两组皮瓣大体观察
左侧为 PBS 组,右侧为 ADSC-Exos 组 a. 术后第 3 天;b. 术后第 7 天
Left for the PBS group and right for the ADSC-Exos group a. On the 3rd day after operation; b. On the 7th day after operation
2.3.2. 组织学观察
术后第 7 天两组皮瓣远端区域组织形态相似,皮肤结构表现出不同程度坏死现象,但 ADSC-Exos 组略好于 PBS 组;中间区域 ADSC-Exos 组皮肤附属器官较 PBS 组更完整;近端区域两组均可见少量炎性细胞浸润,但 ADSC-Exos 组与 PBS 组相比,组织水肿程度轻、血管扩张更多。见图5a。
图 5.
Histological and CD31 immunohistochemical staining observations of two groups on the 7th day
术后第7天两组皮瓣组织学及CD31免疫组织化学染色观察
左侧为 PBS 组,右侧为 ADSC-Exos 组 a. HE 染色(×200);b. CD31 免疫组织化学染色(×100)
Left for the PBS group and right for the ADSC-Exos group a. HE staining (×200); b. CD31 immunohistochemical staining (×100)
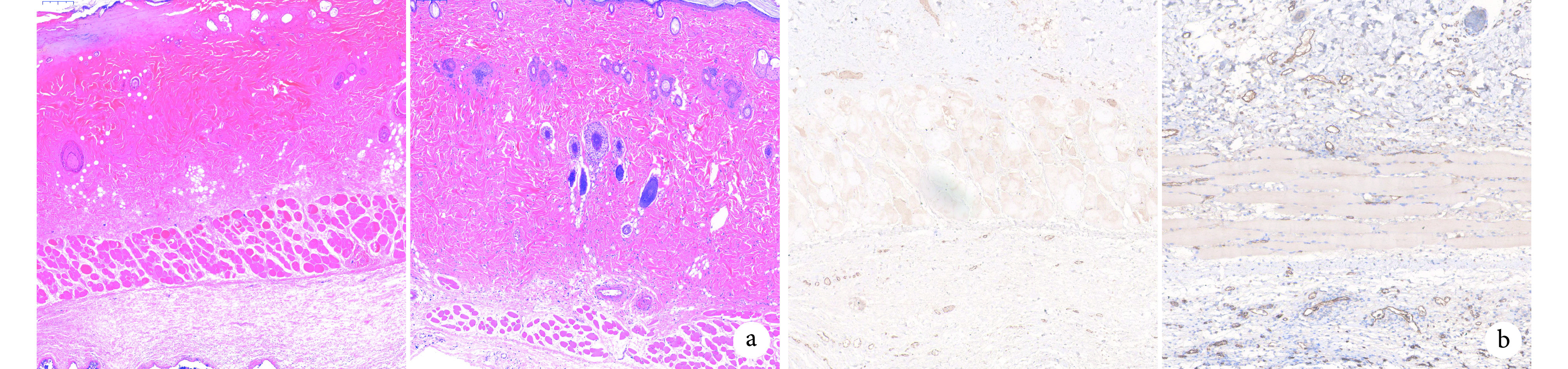
2.3.3. 免疫组织化学染色观察
镜下见 ADSC-Exos 组皮瓣中间部位组织中出现大量成熟新生血管,伴有新生血管侧支形成,新生血管基本扩张;PBS 组新生血管形成较少或处于内皮细胞萌发阶段,血管扩张不明显。ADSC-Exos 组 MVD 为(103.3±27.0)个/视野,显著多于 PBS 组(45.3±16.2)个/视野,差异有统计学意义(t=3.190,P=0.011)。见图5b。
3. 讨论
皮瓣移植是临床上修复创伤、重建功能、恢复外观的常用治疗方法,但由于皮瓣长宽比过大等因素,容易发生微循环和血运障碍等不良后果[14]。皮瓣移植后及早建立与周围组织的血管联系是减少早期坏死的关键。血管生成是一个复杂的调控过程,包括内皮细胞增殖和活化、内皮细胞迁移和侵袭、内皮细胞萌发、基底膜形成和新生血管成熟等多个步骤[15]。多项实验表明干细胞疗法在缺血组织新生血管形成中发挥重要作用[16-17]。但相比 MSCs,使用 MSCs-Exos 可以降低免疫排斥反应、异位组织形成等潜在风险[18]。并且纳米级 Exos 易透过血脑屏障,到达干细胞无法到达的微环境,而且易保存,−20 ℃ 条件下 6 个月内不会丧失生物学活性[19-20]。这些特征均显示 Exos 治疗优于干细胞疗法,为无细胞治疗的开发提供了思路 [21]。
本课题组前期将 ADSC-Exos 与人脐静脉血管内皮细胞复合培养,经 CCK-8 实验、Transwell 迁移实验、Matrigel 基质胶成血管实验检测,发现 ADSC-Exos 能促进人脐静脉血管内皮细胞增殖、迁移以及管样分化,而血管内皮细胞参与血管内壁形成,因此我们分析 ADSC-Exos 可能具有促进血管形成作用[10]。为进一步验证该结论,探讨其用于治疗皮瓣移植的可行性,我们进行了本次动物实验。
因随意皮瓣切取应用方便、灵活,在组织缺损修复重建领域应用广泛,所以本研究选择制备该皮瓣模型。为了方便实验观察,保证注射均匀性,我们将皮瓣分为 3 个区左、右侧分别注射,参考既往相关研究[22-23]确定 Exos 浓度及注射量。皮肤组织、血管及其他附属结构一般在皮瓣移植术后 7 d 基本形成,因此我们选择在该时间点进行观察。本次研究发现,术后第 7 天两组大鼠皮瓣远端均出现不同程度坏死,但 ADSC-Exos 组皮瓣坏死面积明显小于 PBS 组。HE 染色显示,ADSC-Exos 组皮肤附属器官比 PBS 组更完整,皮肤组织愈合更佳,这可能与 ADSC-Exos 作用于皮肤各层,进而减轻氧化应激有关[24]。CD31 免疫组织化学染色显示 ADSC-Exos 组皮瓣中间部位出现大量成熟新生血管,并伴有血管侧支形成,MVD 明显高于 PBS 组。上述研究结果提示,ADSC-Exos 组各区域皮瓣愈合程度均优于 PBS 组,结合文献报道的增加移植皮瓣早期新生血管可以有效促进缺血皮瓣成活[12, 25-26],我们认为皮瓣移植术后注射的 ADSC-Exos 可以通过增加新生血管,进而减少皮瓣坏死情况的发生。
但本研究也存在一定局限性,ADSCs-Exos 对皮瓣移植后血管新生具体作用机制尚未涉及。文献报道,Exos 在细胞间信息交流中扮演着重要角色,通过将 DNA、microRNA、蛋白质和脂质等传递至受体细胞,进而调控受体细胞的生物发生过程[27]。Kang 等[28]研究发现,ADSC-Exos 通过其携带的 miRNA-31 诱导血管新生。并且,Todorova 等[29]总结了细胞外囊泡中刺激血管生成的主要 micro-RNA 有 miR-126、miR-214、miR-296、miR-125a、miR-31、miR-150。因此,后续我们将探索 Exos 中包含的 microRNA 和蛋白等,进而深入研究 ADSC-Exos 促进皮瓣愈合的具体机制。另外,ADSC-Exos 用于临床皮瓣移植的剂量、给药途径及时间等也需要进一步研究。
作者贡献:胡玄负责动物实验和文章撰写,朱元正、张静负责数据收集整理及统计分析,王朝慧负责细胞实验,王江文、聂佳莹负责动物饲养,吴舒负责临床标本收集,易阳艳负责科研设计。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经南昌大学第二附属医院医学/动物实验伦理委员会批准,批号:研临审[2018]第(024)号;动物使用许可证号:SYXK(赣)2015-0001。
Funding Statement
国家自然科学基金资助项目(81660326);江西省自然科学基金资助项目(20171ACB20037);南昌大学研究生创新基金资助项目(CX2018206)
National Natural Science Foundation of China (81660326); Jiangxi Natural Science Foundation (20171ACB20037); Nanchang University Graduate Innovation Fund Project (CX2018206)
References
- 1.Lin B, Lin Y, Lin D, et al Effects of Bezafibrate on the survival of random skin flaps in rats. J Reconstr Microsurg. 2016;32(5):395–401. doi: 10.1055/s-0036-1571348. [DOI] [PubMed] [Google Scholar]
- 2.Yang M, Sheng L, Li H, et al Improvement of the skin flap survival with the bone marrow-derived mononuclear cells transplantation in a rat model. Microsurgery. 2010;30(4):275–281. doi: 10.1002/micr.20779. [DOI] [PubMed] [Google Scholar]
- 3.Rao RR, Stegemann JP Cell-based approaches to the engineering of vascularized bone tissue. Cytotherapy. 2013;15(11):1309–1322. doi: 10.1016/j.jcyt.2013.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Choudhery MS, Khan M, Mahmood R, et al Bone marrow derived mesenchymal stem cells from aged mice have reduced wound healing, angiogenesis, proliferation and anti-apoptosis capabilities. Cell Biol Int. 2012;36(8):747–753. doi: 10.1042/CBI20110183. [DOI] [PubMed] [Google Scholar]
- 5.Zhongrun Q, Qi S, Xi Y, et al The role of extracellular vesicles: an epigenetic view of the cancer microenvironment. Biomed Res Int. 2015;2015:649161. doi: 10.1155/2015/649161. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhang Y, Hu YW, Zheng L, et al Characteristics and roles of exosomes in cardiovascular disease. DNA Cell Biol. 2017;36(3):202–211. doi: 10.1089/dna.2016.3496. [DOI] [PubMed] [Google Scholar]
- 7.Sahoo S, Losordo DW Exosomes and cardiac repair after myocardial infarction. Circ Res. 2014;114(2):333–344. doi: 10.1161/CIRCRESAHA.114.300639. [DOI] [PubMed] [Google Scholar]
- 8.Zhang H, Xiang M, Meng D, et al Inhibition of myocardial ischemia/reperfusion injury by exosomes secreted from mesenchymal stem cells. Stem Cells Int. 2016;2016:4328362. doi: 10.1155/2016/4328362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Farzamfar S, Hasanpour A, Nazeri N, et al Extracellular micro/nanovesicles rescue kidney from ischemia-reperfusion injury. J Cell Physiol. 2019;234(8):12290–12300. doi: 10.1002/jcp.27998. [DOI] [PubMed] [Google Scholar]
- 10.张静, 易阳艳, 阳水发, 等 脂肪干细胞来源外泌体对人脐静脉血管内皮细胞增殖、迁移及管样分化的影响. 中国修复重建外科杂志. 2018;32(10):1351–1357. doi: 10.7507/1002-1892.201804016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mcfarlane RM, Deyoung G, Henry RA, et al The design of a pedicle flap in the rat to study necrosis and its prevention. Plast Reconstr Surg. 1965;35(2):177–182. doi: 10.1097/00006534-196502000-00007. [DOI] [PubMed] [Google Scholar]
- 12.Zhou KL, Zhang YH, Lin DS, et al Effects of calcitriol on random skin flap survival in rats. Sci Rep. 2016;6:18945. doi: 10.1038/srep18945. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Cai L, Cao B, Lin D Effects of traditional Chinese medicine huangqi injection (radix astragali) on random skin flap survival in rats. J Reconstr Microsurg. 2015;31(8):565–570. doi: 10.1055/s-0035-1555142. [DOI] [PubMed] [Google Scholar]
- 14.Bai Y, Han YD, Yan XL, et al Adipose mesenchymal stem cell-derived exosomes stimulated by hydrogen peroxide enhanced skin flap recovery in ischemia-reperfusion injury. Biochem Biophys Res Commun. 2018;500(2):310–317. doi: 10.1016/j.bbrc.2018.04.065. [DOI] [PubMed] [Google Scholar]
- 15.Annex, Brian H Therapeutic angiogenesis for critical limb ischaemia. Nature Reviews Cardiology. 2013;10(7):387–396. doi: 10.1038/nrcardio.2013.70. [DOI] [PubMed] [Google Scholar]
- 16.Pu CM, Liu CW, Liang CJ, et al Adipose-derived stem cells protect skin flaps against ischemia/reperfusion injury via IL-6 expression. J Invest Dermatol. 2017;137(6):1353–1362. doi: 10.1016/j.jid.2016.12.030. [DOI] [PubMed] [Google Scholar]
- 17.Du W, Zhang K, Zhang S, et al Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer. Biomaterials. 2017;133:70–81. doi: 10.1016/j.biomaterials.2017.04.030. [DOI] [PubMed] [Google Scholar]
- 18.Merino-González C, Zuñiga FA, Carlos E, et al Mesenchymal stem cell-derived extracellular vesicles promote angiogenesis: potencial clinical application. Front Physiol. 2016;7:24. doi: 10.3389/fphys.2016.00024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hessvik NP, Llorente A Current knowledge on exosome biogenesis and release. Cell Mol Life Sci. 2018;75(2):193–208. doi: 10.1007/s00018-017-2595-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Webber J, Clayton A. How pure are your vesicles? J Extracell Vesicles, 2013, 2(1): 19861.
- 21.Kishore R, Khan M More than tiny sacks: stem cell exosomes as cell-free modality for cardiac repair. Circ Res. 2016;118(2):330–343. doi: 10.1161/CIRCRESAHA.115.307654. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Zhang J, Guan J, Niu X, et al Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis. J Transl Med. 2015;13:49. doi: 10.1186/s12967-015-0417-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Han YD, Bai Y, Yan XL, et al Co-transplantation of exosomes derived from hypoxia-preconditioned adipose mesenchymal stem cells promotes neovascularization and graft survival in fat grafting. Biochem Biophys Res Commun. 2018;497(1):305–312. doi: 10.1016/j.bbrc.2018.02.076. [DOI] [PubMed] [Google Scholar]
- 24.Arslan F, Lai RC, Smeets MB, et al Mesenchymal stem cell-derived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury. Stem Cell Res. 2013;10(3):301–312. doi: 10.1016/j.scr.2013.01.002. [DOI] [PubMed] [Google Scholar]
- 25.Schlaudraff KU, Bezzola T, Montandon D, et al. Mixed arterio-venous insufficiency in random skin flaps in the rat: Is the application of medicinal leeches beneficial? J Surg Res, 2008, 150(1): 85-91.
- 26.李俊杰, 高自勉, 高伟阳, 等 皮瓣延迟术对大鼠三血管体穿支皮瓣成活的影响及其机制. 中华烧伤杂志. 2014;30(4):337–343. doi: 10.3760/cma.j.issn.1009-2587.2014.04.013. [DOI] [Google Scholar]
- 27.Guo YX, Ji X, Liu JB, et al Effects of exosomes on pre-metastatic niche formation in tumors. Mol Cancer. 2019;18:39. doi: 10.1186/s12943-019-0995-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kang T, Jones T M, Naddell C, et al Adipose-Derived Stem Cells Induce Angiogenesis via Microvesicle Transport of miRNA-31. Stem Cells Translational Medicine. 2016;5(4):440–450. doi: 10.5966/sctm.2015-0177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Todorova D, Simoncini S, Lacroix R, et al Extracellular vesicles in angiogenesis. Circ Res. 2017;120(10):1658–1673. doi: 10.1161/CIRCRESAHA.117.309681. [DOI] [PMC free article] [PubMed] [Google Scholar]