Abstract
目的
探讨 2, 3, 7, 8-四氯二苯二 英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)致胎鼠腭裂模型中 miR-381-3p 下调与胎鼠腭间充质(mouse embryonic palatal mesenchymal,MEPM)细胞成骨分化抑制的相关性。
英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)致胎鼠腭裂模型中 miR-381-3p 下调与胎鼠腭间充质(mouse embryonic palatal mesenchymal,MEPM)细胞成骨分化抑制的相关性。
方法
32 只 6~8 周龄 SPF 级建康 C57BL/6J 孕鼠随机分为 TCDD 组与对照组,每组 16 只。于胚胎日第 10.5 天(embryonic day 10.5,E10.5)时,TCDD 组一次性灌胃 TCDD(28 μg/kg)、对照组给予等量玉米油。于 E13.5 和 E14.5 取出两组胎鼠大体观察腭突组织后,取 E13.5 和 E14.5 腭突组织行实时荧光定量 PCR 检测 miR-381-3p 表达;E14.5 腭突组织 Western blot 检测成骨特异性转录因子 RUNX2 和骨桥蛋白(osteopontin,OPN)的表达。取对照组 E14.5 胎鼠腭突分离培养 MEPM 细胞,取第 3 代细胞以含 10 nmol/L TCDD 的完全培养基培养,于 0、0.5、1、2、3 d 检测 miR-381-3p 表达,0、1、2、3 d 检测 RUNX2 和 OPN 蛋白表达。另取第 3 代 MEPM 细胞随机分为 4 组,沉默表达组及对照组分别转染 miR-381-3p 抑制物及抑制物对照,过表达组及对照组分别转染 miR-381-3p 模拟物及模拟物对照。转染 48 h 后,检测各组 miR-381-3p 及 RUNX2 和 OPN 蛋白表达。
结果
E13.5 和 E14.5 时对照组获得活胎鼠 96 只、TCDD 组 92 只;其中,E14.5 对照组活胎鼠可见双侧腭突接触,TCDD 组双侧腭突中间有间隙。TCDD 组胎鼠腭突组织 miR-381-3p 以及 RUNX2、OPN 蛋白相对表达量均明显低于对照组(P<0.05)。TCDD 处理 MEPM 细胞 0.5 和 1 d 后 miR-381-3p 相对表达量较 0 d 时明显下降(P<0.05),2、3 d 时表达量明显上升,与 0 d 时比较差异无统计学意义(P>0.05);1、2、3 d 时 RUNX2 及 OPN 蛋白相对表达量均较 0 d 时显著降低(P<0.05)。MEPM 细胞转染 48 h 后,沉默表达组 miR-381-3p 及 RUNX2、OPN 蛋白相对表达量均较其对照组下降,过表达组均较其对照组升高,差异有统计学意义(P<0.05)。
结论
在 TCDD 致胎鼠腭裂模型中,miR-381-3p 表达下调可能抑制胎鼠 MEPM 细胞成骨分化。
Keywords: miR-381-3p, 胎鼠腭间充质细胞, 成骨分化, 2,3,7,8-四氯二苯二(口恶)英, 腭裂
Abstract
Objective
To investigate the correlation between down-regulation of miR-381-3p and inhibition of osteogenic differentiation of mouse embryonic palatal mesenchymal (MEPM) cells in 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD)-induced cleft palate of fetal mice.
Methods
Thirty-two pregnant mice were randomly divided into TCDD group and control group, 16 in each group. On embryonic day 10.5 (E10.5), the pregnant mice in TCDD group were orally administrated with TCDD at dosage of 28 μg/kg, while the pregnant mice in control group received equivalent corn oil. The pregnant mice in each group were sacrificed on E13.5 and E14.5, fetal palates were collected for analysis. The expression of miR-381-3p was detected by real-time fluorescent quantitative PCR and the protein expressions of runt- related transcription factor 2 (RUNX2) and osteopontin (OPN) were detected by Western blot. MEPM cells were extracted from fetal palates on E14.5 in control group and passaged. The 3rd passage cells were cultured with TCDD at dosage of 10 nmol/L for 0, 0.5, 1, 2, and 3 days. The expression of miR-381-3p was detected after 0, 0.5, 1, 2, and 3 days and the protein expressions of RUNX2 and OPN were detected after 0, 1, 2, and 3 days. Then, the 3rd passage cells were divided into 4 groups. The MEPM cells were transfected with miR-381-3p inhibitor (inhibitor group), NC inhibitor (NC inhibitor group) and miR-381-3p mimics (mimics group), NC mimics (NC mimics group) for 48 hours, respectively. And the expressions of miR-381-3p and the protein expressions of RUNX2 and OPN were detected.
Results
On E13.5 and E14.5, 96 fetal mice in control group and 92 in TCDD group were obtained. The bilateral palates contacted in control group on E14.5, and a gap between the bilateral palates existed in TCDD group. On E13.5 and E14.5, the relative expressions of miR-381-3p and RUNX2 and OPN proteins were significant lower in TCDD group than in control group (P<0.05). The relative expression of miR-381-3p at 0.5 and 1 day after TCDD treatment of MEPM cells were significantly lower than that at 0 day (P<0.05); then, the relative expressions at 2 and 3 days significantly increased, showing no significant difference when compared with that at 0 day (P>0.05). The relative expressions of RUNX2 and OPN proteins at 1, 2, and 3 days were significantly lower than that at 0 day (P<0.05). The relative expressions of miR-381-3p and RUNX2 and OPN proteins significantly lower in inhibitor group than in NC inhibitor group (P<0.05) and higher in mimics group than in NC mimics group (P<0.05).
Conclusion
Down-regulation of miR-381-3p expression may be associated with inhibition of osteogenic differentiation of MEPM cells in TCDD-induced cleft palate of fetal mice.
Keywords: miR-381-3p; mouse embryonic palatal mesenchymal cells; osteogenic differentiation; 2, 3, 7, 8- tetrachlorodibenzo-p-dioxin; cleft palate
腭裂是最常见的出生缺陷之一[1]。继发腭的形成需要经过两侧腭突的生长、抬高、接触黏附和融合,其中任一过程中断均会导致腭裂发生[2]。因小鼠继发腭发育与人类相似,腭部发育研究常选择其作为动物模型[3]。在小鼠腭发育中,胚胎日第 13.5 天(embryonic day 13.5,E13.5)时两侧腭突垂直于舌体两侧生长,E14.5 时两侧腭突迅速抬高至舌体上方的水平方向并向对侧生长,于中部与对侧接触黏附形成腭中缝,随后腭中缝降解,两侧腭间充质(mouse embryonic palatal mesenchymal,MEPM)汇合,其连续性得以建立;与此同时,胎鼠 MEPM 开始分化成骨和肌肉,分别形成硬腭和软腭[4]。2,3,7,8-四氯二苯二 英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)是环境污染物,在动物和人类中都具有发育毒性,在发育的小鼠胚胎中会导致腭裂发生率增高,抑制腭部成骨分化和肌肉生长,导致双侧腭突融合后复裂[5]。
英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)是环境污染物,在动物和人类中都具有发育毒性,在发育的小鼠胚胎中会导致腭裂发生率增高,抑制腭部成骨分化和肌肉生长,导致双侧腭突融合后复裂[5]。
研究表明,环境因素介导基因转录后水平的调节是通过非编码 RNAs(如 miRNAs)来完成的[6]。miRNAs 调节基因的表达在多种疾病的发生发展中发挥着重要作用,例如与小鼠、斑马鱼甚至人类的腭裂发生相关[7]。生物信息学分析发现,miR-381-3p 调节多个已知与腭裂相关的基因,如 TGF-β3、Smo、Msx2 和 Bmp1r 等[8],而且可上调成骨细胞特异性转录因子 RUNX2 的表达,促进软骨细胞的生长[9]。MEPM 细胞来源于神经嵴细胞,随着双侧腭突开始融合,MEPM 细胞通过膜内成骨分化形成腭骨[10]。本研究旨在观察 TCDD 作用于 MEPM 细胞后,miR-381-3p 及成骨分化标志物 RUNX2、骨桥蛋白(osteopontin,OPN)的表达变化,以及 miR-381-3p 对 MEPM 细胞成骨分化的影响。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
6~8 周龄 SPF 级建康 C57BL/6J 小鼠 52 只,雌性 40 只、雄性 12 只,体质量 18~20 g;购自重庆医科大学实验动物中心,生产许可证号:SCXK(渝)20050002;饲养于 SPF 级动物实验室,温度 22~24℃,湿度 55%±5%,循环光照明暗各 12 h,普通实验室饲料、水源,自由饮水、摄食。
TCDD(Sigma-Aldrich 公司,美国);DMEM/F12、0.25% 胰蛋白酶-0.02%EDTA(GIBCO 公司,美国);青霉素+链霉素双抗(上海碧云天生物技术有限公司);PBS 磷酸盐缓冲粉剂(北京鼎国昌盛生物技术有限责任公司);FBS(杭州四季青生物工程有限公司);Dispase Ⅱ酶(上海翊盛生物科技有限公司);DMSO(Sigma 公司,美国);miR-381-3p 抑制物及对照物、miR-381-3p 模拟物及对照物(上海吉荧生物技术有限公司);All-in-oneTMqPCR Mix、EndoFectinTM-MAX 转染试剂(GeneCopoeia 公司,美国);Biospin miRNA 提取试剂盒(杭州博日科技有限公司);miRNA 第 1 链 cDNA 合成(茎环法)试剂盒(上海生工生物工程有限公司);细胞组织全蛋白提取试剂盒(新赛美生物科技有限公司);BCA 蛋白浓度定量试剂盒、SDS-PAGE 凝胶快速制备试剂盒、抗 β-actin 多克隆抗体、抗 RUNX2 多克隆抗体、超敏 ECL 化学发光试剂盒(沈阳万类生物科技有限公司);抗 OPN 多克隆抗体(Proteintech 公司,美国);二抗(北京中杉金桥生物技术有限公司)。
体式显微镜 DXM1200F、倒置光学/荧光多功能显微镜(Nikon 公司,日本);细胞培养瓶、培养皿(Corning 公司,美国);NanoDrop 2000 分光光度计、移液器、细胞培养箱、普通 PCR 仪和生物安全柜、Biofuge Primo 台式离心机(Thermo 公司,美国);CFX96 实时荧光定量 PCR 仪(Bio-Rad,美国); ECL 显影仪 Gene Gnome 5(Gene 公司,美国)。
1.2. TCDD 对胎鼠腭部发育影响观察
1.2.1. 实验分组及方法
52 只 C57BL/6J 小鼠适应新环境 2 周后,于黄昏按雌雄比例 2∶1 或 3∶1 合笼交配,次日晨雌雄分笼,检查雌鼠阴栓,称重标记;记录当天为 E0.5,观察体质量至 E10.5;体质量增长小于 2 g 者视为未孕,重新合笼。最后获取 32 只符合要求的孕鼠用于实验。
将 32 只孕鼠随机分为 TCDD 组与对照组,每组 16 只。E10.5 时,TCDD 组孕鼠按 28 μg/kg(以玉米油配制成 5 μg /mL)一次性灌胃 TCDD;对照组一次性灌胃等体积玉米油。各组孕鼠分别在 E13.5 和 E14.5 时取 8 只 CO2 麻醉处死。无菌条件下,配合体式显微镜从孕鼠子宫取出胎鼠,剪取胎鼠头部,大体观察腭突生长情况。
1.2.2. 实时荧光定量 PCR 检测 miR-381-3p
取两组 E13.5 和 E14.5 腭突组织,采用 Biospin miRNA 提取试剂盒提取 miRNAs。使用 miRNA 第 1 链 cDNA 合成(茎环法)试剂盒进行逆转录,体系为 20 μL,包括:2×miRNA L-RT Solution mix 10 μL,miRNA L-RT Enzyme mix 1.5 μL,miRNA 2 μg,茎环引物(10 μmol/L)1 μL,U6 下游引物(10 μmol/L)1 μL,去酶水定容 20 μL;反应条件:16℃ 30 min,37℃ 30 min,85℃ 5min。逆转录反应液被稀释 2 倍并作 3 个复孔,每孔反应体系共 10 μL,包括:2×All-in-oneTMqPCR Mix 5 μL,上、下引物各 1 μL(2 μmol/L),cDNA 1 μL,去酶水 2 μL;反应条件:95℃ 预变性 10 min,40 个循环(95℃ 变性 10 s,57℃ 退火 20 s,延伸 72℃ 15 s)。以 U6 为内参基因,使用 2−ΔΔCt方法计算 miR-381-3p 相对表达量。miR-381-3p 和 U6 逆转录引物及 PCR 引物设计和合成均由上海生工生物工程技术有限公司完成,根据 NCBI Nucleotide 数据库,比对引物特异性,引物序列见表 1。实验重复 3 次。
表 1.
Reverse transcription primers, upstream and downstream primers of real-time fluorescent quantitative PCR, inhibitor and mimics sequences for miR-381-3p
miR-381-3p 和 U6 的逆转录引物、实时荧光定量 PCR 上下游引物及 miR-381-3p 抑制物和模拟物序列
| 基因
Gene |
引物序列(5′→3′)
Primer sequence (5′→3′) |
| miR-381-3p | |
| 逆转录引物
Reverse transcription primer |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAGAG |
| 上游
Upstream |
CGCGTATACAAGGGCAAGCT |
| 下游
Downstream |
AGTGCAGGGTCCGAGGTATT |
| 抑制物
Inhibitor |
ACAGAGAGCUUGCCCUUGUAUA |
| 模拟物
Mimics |
UAUACAAGGGCAAGCUCUCUGU |
| 抑制物对照
NC inhibitor |
UCUACUCUUUCUAGGAGGUUGUGA |
| 模拟物对照
NC mimics |
UCACAACCUCCUAGAAAGAGUAGA |
| U6 | |
| 上游
Upstream |
CTCGCTTCGGCAGCACATA |
| 下游
Downstream |
ATTTGCGTGTCATCCTTGCG |
1.2.3. Western blot 检测 RUNX2 和 OPN 蛋白
取两组 E14.5 腭突组织,采用细胞组织全蛋白提取试剂盒提取总蛋白。使用 BCA 蛋白浓度定量试剂盒测定每个样品中总蛋白质的浓度。使用 SDS-PAGE 凝胶快速制备试剂盒制备 8%SDS-PAGE 凝胶,电泳分离蛋白质并转移到 PVDF 膜。将膜浸入含 5% 脱脂奶粉的 TBST 溶液,在室温下摇床封闭 2~3 h;将膜分别与抗 RUNX2 蛋白多克隆抗体(1∶300)、抗 OPN 多克隆抗体(1∶500)、抗 β-actin 多克隆抗体(1∶1 000)4℃ 孵育过夜。次日用辣根过氧化物酶标记的二抗(1∶2 000)室温孵育 2 h,以超敏 ECL 试剂显影拍照,Image J 分析灰度值。与 β-actin 条带灰度值的比值来表示目的蛋白相对表达量。实验重复 3 次。
1.3. MEPM 细胞分离培养及观测
1.3.1. MEPM 细胞分离及传代
无菌条件下,参考 Feng 等[11]的方法提取原代细胞。具体步骤:取 1.2 中获得的对照组 E14.5 胎鼠腭突,置于 0.5% Dispase Ⅱ酶(DMEM/F12 稀释)4℃ 过夜,期间摇匀 1~2 次。次日见上皮与 MEPM 明显分离后,显微外科器械剥离上皮,余下的 MEPM 用 0.25% 胰蛋白酶-0.02%EDTA 消化吹打;待其分离为絮状物时,用完全培养基终止消化,继续吹打至单细胞悬液,以离心半径 14 cm,1 200 r/min 离心 5 min;细胞重悬,接种于 75 cm2培养瓶,加入完全培养基(含 90%DMEM/F12 培养基、10%FBS、100 U/mL 青霉素和 100 μg/mL 链霉素),置于 37℃、5%CO2 及 95% 饱和湿度恒温培养箱培养 30 min;弃去培养液(差速贴壁法去除残留上皮细胞),加入新的完全培养液继续培养;重复 1 次。每 2~3 天换液 1 次进行传代。取第 3 代细胞进行观测。
1.3.2. TCDD 体外处理 MEPM 细胞及观测
TCDD 溶于 DMSO 并加入完全培养基,TCDD 终浓度为 10 nmol/L,DMSO 终浓度小于 0.05%。取第 3 代 MEPM 细胞以 50% 左右密度接种于直径 6 cm 培养皿中,次日更换含 10 nmol/L TCDD 的完全培养基。TCDD 处理后 0(对照)、0.5、1、2、3 d,取细胞参照 1.2.2 实时荧光定量 PCR 检测 miR-381-3p 表达;0、1、2、3 d 时参照 1.2.3 Western blot 检测 RUNX2 和 OPN 蛋白表达。实验重复 3 次。
1.4. MEPM 细胞转染及观测
取第 3 代 MEPM 细胞,根据转染内容不同分为 4 组。沉默表达组及对照组分别转染 miR-381-3p 抑制物及对照物,过表达组及对照组分别转染 miR-381-3p 模拟物及对照物。转染物设计与合成均由上海吉荧生物技术有限公司完成,各转染物序列见表 1。按照 EndoFectinTM-MAX 转染试剂使用说明书转染,过表达组及对照组转染浓度为 75 nmol/L,沉默表达组及对照组转染浓度为 100 nmol/L。
转染 48 h 后取各组细胞采用实时荧光定量 PCR 检测 miR-381-3p 表达,验证 MEPM 细胞转染 miR-381-3p 抑制物和模拟物效率;采用 Western blot 检测 RUNX2 和 OPN 蛋白表达,分析沉默和过表达 miR-381-3p 对 MEPM 细胞成骨分化的影响,以及 MEPM 细胞转染 miR-381-3p 模拟物后 miR-381-3p 过表达情况。实验重复 3 次。
1.5. 统计学方法
采用 SPSS 24.0 统计软件进行分析。数据以均数±标准差表示,两组间比较采用独立样本 t 检验;多组间比较采用单因素方差分析,两两比较采用 Tukey 检验;检验水准 α=0.05。
2. 结果
2.1. 胎鼠腭部发育形态学观察
2.1.1. 大体观察
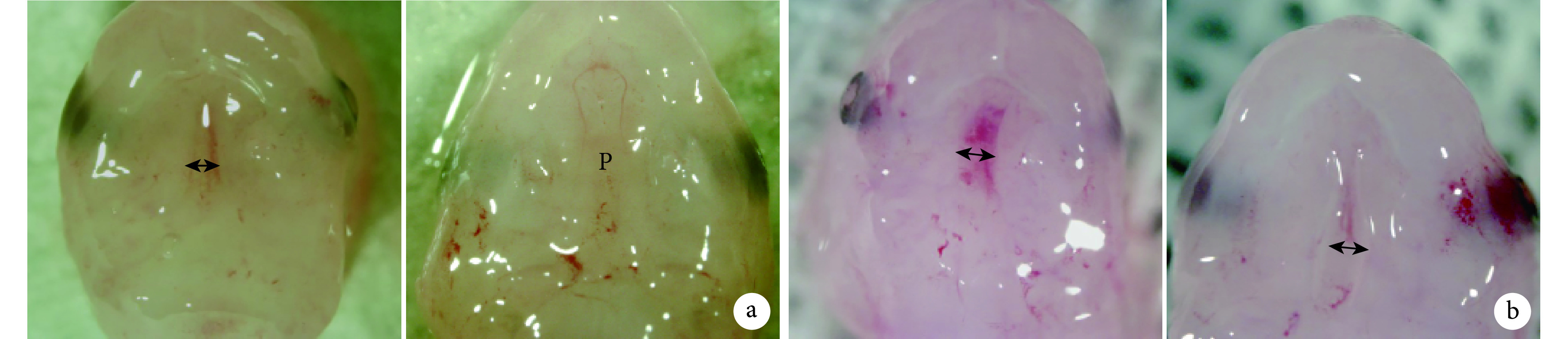
E13.5 和 E14.5 时,对照组从孕鼠获得活胎鼠共计 96 只,死胎和吸收胎共 2 只;TCDD 组获得活胎鼠共 92 只,死胎和吸收胎 3 只。E13.5 两组活胎鼠可见双侧腭突生长,均未接触,中间有较大间隙;E14.5 对照组活胎鼠可见双侧腭突接触,TCDD 组活胎鼠可见双侧腭突未能接触,中间有间隙。见图 1。
图 1.
Morphological changes of the palate in the control and TCDD groups on E13.5 and E14.5 (×20)
胎鼠腭部形态学观察(×20)
左侧为 E13.5,右侧为 E14.5;P 表示完整腭部,↔表示两侧腭突裂隙 a. 对照组;b. TCDD 组
Left for E13.5 and right for E14.5; P indicated the complete fusion palate and ↔ indicated the gap between bilateral palates a. Control group; b. TCDD group
2.1.2. 实时荧光定量 PCR 检测
TCDD 组 E13.5 和 E14.5 胎鼠腭突组织 miR-381-3p 相对表达量分别为 0.51±0.09、1.49±0.10,对照组为 1.25±0.15、2.05±0.09,TCDD 组明显低于对照组,差异有统计学意义(t=4.039,P=0.015;t=4.043,P=0.015)。
2.1.3. Western blot 检测
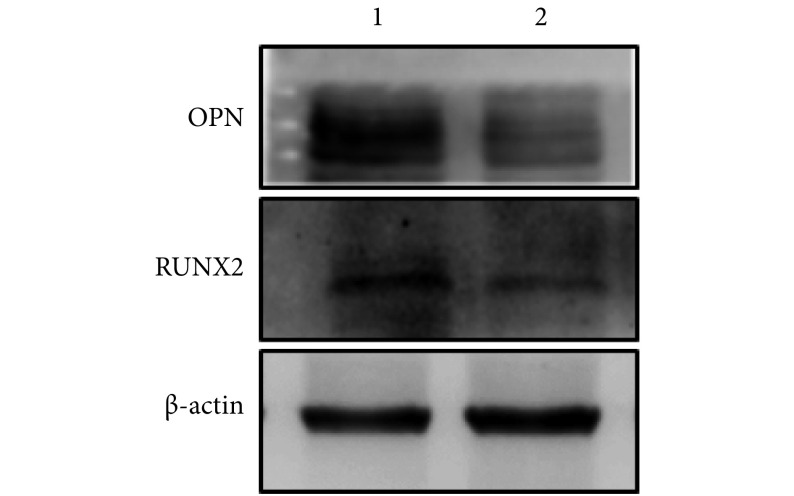
TCDD 组 E14.5 胎鼠腭突组织 RUNX2 及 OPN 蛋白相对表达量分别为 0.69±0.06、0.56±0.03,均较对照组 1.00±0.05、1.00±0.03 降低,差异有统计学意义(t=3.529,P=0.024;t=8.288,P=0.001)。见图 2。
图 2.
The expressions of RUNX2 and OPN proteins in TCDD and control groups on E14.5
Western blot 检测 E14.5 胎鼠腭突组织 RUNX2 及 OPN 蛋白表达
1:对照组 2:TCDD 组
1: Control group 2: TCDD group
2.2. TCDD 处理 MEPM 细胞后观测
2.2.1. 实时荧光定量 PCR 检测
TCDD 处理 MEPM 细胞 0、0.5、1、2、3 d 后,miR-381-3p 相对表达量分别为 1.00±0.12、0.43±0.09、0.61±0.09、1.00±0.08、1.18±0.05。其中,0.5 和 1 d 时 miR-381-3p 相对表达量较 0 d 时明显下降,差异均有统计学意义(P<0.05);2、3 d 时表达量明显上升,与 0 d 时比较差异无统计学意义(P>0.05)。
2.2.2. Western blot 检测
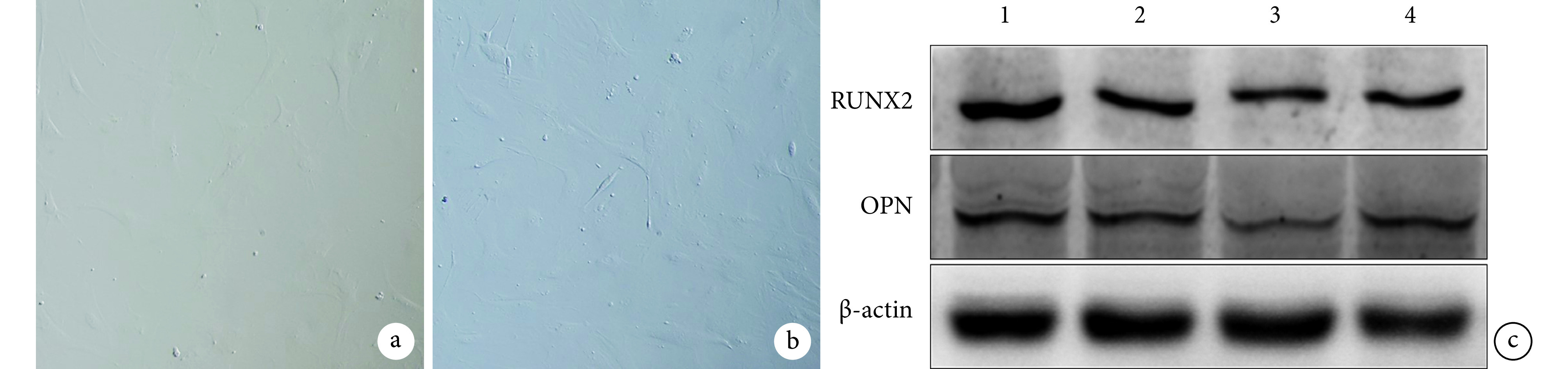
TCDD 处理 MEPM 细胞 0、1、2、3 d 后,RUNX2 蛋白相对表达量分别为 1.00±0.11、0.57±0.10、0.50±0.01、0.47±0.10;OPN 蛋白相对表达量分别为 1.00±0.02、0.75±0.12、0.59±0.02、0.67±0.04。1、2、3 d 时 RUNX2 及 OPN 蛋白相对表达量均较 0 d 时显著降低,差异有统计学意义(P<0.05);1、2、3 d 间差异无统计学意义(P>0.05)。见图 3。
图 3.
Morphological observation of MEPM cells and Western blot detection
MEPM 细胞形态观察及 Western blot 检测
a. TCDD 处理前第 3 代 MEPM 细胞(倒置相差显微镜×200);b. TCDD 处理后第3 代 MEPM 细胞(倒置相差显微镜×200);c. Western blot 检测 TCDD 处理后 MEPM 细胞 RUNX2 和 OPN 蛋白表达 1~4:处理后 0、1、2、3 d
a. The 3rd passage MEPM cells before TCDD treatment (Inverted phase contrast microscope×200); b. The 3rd passage MEPM cells after TCDD treatment (Inverted phase contrast microscope×200); c. The expressions of RUNX2 and OPN proteins detected by Western blot in MEPM cells after TCDD treatment 1-4: 0, 1, 2, 3 days after treatment, respectively
2.3. MEPM 细胞转染及观测
2.3.1. 实时荧光定量 PCR 检测
转染 48 h 后,沉默表达组及其对照组 miR-381-3p 相对表达量分别为 0.26±0.08、1.03±0.33,差异有统计学意义(t=3.873,P=0.018),沉默效率为 74.75%。过表达组及其对照组 miR-381-3p 相对表达量分别为 553.20±49.76、1.01±0.20,过表达组 miR-381-3p 表达量显著上调,差异有统计学意义(t=19.220,P=0.000)。
2.3.2. Western blot 检测
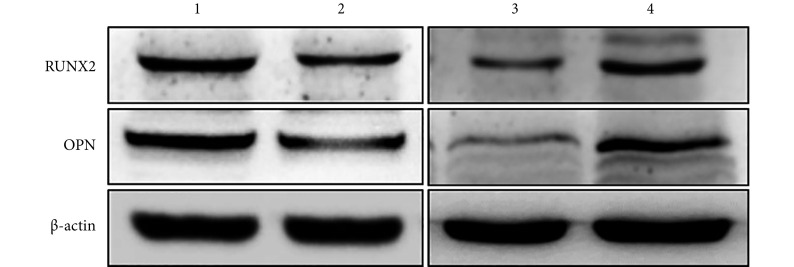
沉默表达组 RUNX2 及 OPN 蛋白相对表达量分别为 0.59±0.02、0.65±0.02,较对照组 1.00±0.02、1.00±0.02 明显下降,差异有统计学意义(t=11.830,P=0.000;t=9.589,P=0.000)。见图 4。
图 4.
Western blot analysis of OPN and RUNX2 protein expressions in MEPM cells at 48 hours after transfection
Western blot 检测转染 48 h 后 MEPM 细胞 OPN 和 RUNX2 蛋白表达
1:沉默表达对照组 2:沉默表达组 3:过表达对照组4:过表达组
1: NC inhibitor group 2: Inhibitor group 3: NC mimics group 4: Mimics group
过表达组 RUNX2 及 OPN 蛋白相对表达量分别为 1.54±0.11、1.59±0.11,较对照组 1.00±0.05、1.00±0.10 升高,差异均有统计学意义(t=4.327,P=0.012;t=3.729,P=0.020)。见图 4。
3. 讨论
腭部发育需要基因精确的时空表达,这受大量转录因子及对应的 DNA 基序位点形成的复杂网络调控,对网络的细微干扰均会导致腭裂发生[12]。miRNAs 是一类有调节功能的小非编码 RNA,广泛参与胚胎发育的调控。miRNAs 主要是通过转录后调控来抑制基因表达发挥功能 [13]。而 miRNAs 在转录后水平抑制基因表达,主要通过降解靶基因的 mRNA 或者抑制靶基因翻译完成。许多 miRNAs 已被证实在多种先天疾病发挥作用。目前斑马鱼和小鼠模型相关研究发现,miRNAs 在正常腭部发育和腭裂形成中均是关键调节因子。条件性敲除 Dicer 会引起小鼠颅面部严重畸形,而 Dicer 是一种加工成熟 miRNAs 所必须的功能蛋白[14]。在腭部发育过程中,适量 miR-140 表达是神经嵴细胞迁移所必需的条件[15]。miR-17-92 簇参与了腭突生长的调节[16]。miR-200b 过表达会造成腭中缝持续存在导致腭融合失败[17]。可见 miRNAs 在两侧腭突的生长、抬高和融合中发挥重要作用。
研究发现,miRNAs 对成骨分化具有调控作用[18]。本研究发现,在 TCDD 致胎鼠腭裂模型中,E13.5 和 E14.5 胎鼠腭突组织 miR-381-3p 相对表达量较对照组降低。腭发育的重要信号通路,如 TGF-β 超家族(包括 BMP)、Wnt/β-Catenin 和 Hedgehog 信号通路中的关键分子,均是 miR-381-3p 靶基因[8],而这些通路与成骨分化也密切相关[19-20]。腭骨形成缺陷与腭融合失败互为因果:双侧腭突接触融合开始时,启动 MEPM 细胞的成骨分化;若腭的成骨分化受到干扰,双侧腭突即使已经融合亦会复裂;延迟的成骨分化又促成了腭裂的发生[21]。多项研究发现 TCDD 抑制成骨分化[22-23]。RUNX2 和 OPN 蛋白是成骨分化的标志物,是成骨分化所必需的转录因子。本研究亦发现,TCDD 组 E14.5 腭突组织 RUNX2 和 OPN 蛋白表达较对照组低,与 Yamada 等[5]的发现类似,表明 TCDD 可能抑制腭的成骨分化。体外 TCDD 处理 MEPM 细胞后 0.5、1 d,miR- 381-3p 表达较 0 d 明显降低,随后又逐渐回升至 0 d 水平;与此同时,RUNX2 和 OPN 蛋白相对表达量亦明显下降。体内、外实验结果一致,均提示 TCDD 同时抑制 MEPM 细胞成骨分化和 miR-381-3p 的表达。
为进一步探索在 TCDD 干扰下,腭发育早期 miR-381-3p 表达下调与腭成骨分化抑制是否存在关联,本研究在体外应用 miR-381-3p 模拟物和抑制物分别转染胎鼠 MEPM 细胞,制备 miR-381-3p 功能获得性和功能缺失性细胞模型,并分别采用实时荧光定量 PCR 和 Western blot 检测各自转染效率和成骨分化标志物的表达变化,发现在 miR-381-3p 下调的 MEPM 细胞中 RUNX2 和 OPN 蛋白表达较对照组降低,而 miR-381-3p 过表达的 MEPM 细胞 RUNX2 和 OPN 蛋白表达明显上调。该结果提示 miR-381-3p 正向调控 RUNX2 和 OPN 蛋白表达,可能促进 MEPM 细胞成骨分化。但如前述,miRNAs 主要通过抑制基因表达发挥调控作用。有学者发现,在软骨细胞中正向操作 miR-381-3p 会抑制去乙酰化酶 4 的表达,RUNX2 蛋白表达上调;而沉默去乙酰化酶 4 亦会引起 RUNX2 蛋白表达升高[9]。结合本研究结果,我们认为 miR-381-3p 并非直接作用于 RUNX2 和 OPN mRNA 的 3p 非翻译区,而是通过某个负性中间分子介导来发挥作用的。
综上述,TCDD 致胎鼠腭裂模型中,TCDD 抑制继发腭成骨分化和 miR-381-3p 表达,miR-381-3p 可能间接调控 MEPM 细胞的成骨分化;miR-381-3p 表达下调可能是继发腭成骨分化受到抑制的原因之一。但对于 miR-381-3p 调控腭成骨分化的直接作用机制尚不清楚,仍需要深入研究。
作者贡献:蒋亨负责科研具体设计、实施、数据收集整理及统计分析、文章撰写;袁心刚负责科研设计、实施过程中的指导;傅跃先负责科研课题方向性框架的提出,数据及统计的审查,文章审查和修改。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。基金项目经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经重庆医科大学医学研究伦理委员会批准(2017012002)。动物使用许可证号:SYXK(渝)2017-0012。所有动物实验均符合实验室动物伦理标准,所有动物残余组织均由动物实验中心给予生物无害化处理。
Funding Statement
国家临床重点专科建设项目 [国卫办医函(2013)544];重庆市渝中区科技计划项目(20150112)
National Key Speciality Construction of Clinical Projects [(2013)544]; Science and Technology Plan Projects of Yuzhong District of Chongqing (20150112)
References
- 1.Gatti GL, Freda N, Giacomina A, et al Cleft lip and palate repair. J Craniofac Surg. 2017;28(8):1918–1924. doi: 10.1097/SCS.0000000000003820. [DOI] [PubMed] [Google Scholar]
- 2.Li C, Lan Y, Jiang R Molecular and cellular mechanisms of palate development. J Dent Res. 2017;96(11):1184–1191. doi: 10.1177/0022034517703580. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bush JO, Jiang R Palatogenesis: morphogenetic and molecular mechanisms of secondary palate development. Development. 2012;139(2):231–243. doi: 10.1242/dev.067082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Hammond NL, Brookes KJ, Dixon MJ Ectopic hedgehog signaling causes cleft palate and defective osteogenesis. J Dent Res. 2018;97(13):1485–1493. doi: 10.1177/0022034518785336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yamada T, Hirata A, Sasabe E, et al TCDD disrupts posterior palatogenesis and causes cleft palate. J Craniomaxillofac Surg. 2014;42(1):1–6. doi: 10.1016/j.jcms.2013.01.024. [DOI] [PubMed] [Google Scholar]
- 6.王飞龙, 李多多, 黄鑫, 等 高脂环境下微 RNA-29c-3p 靶向调节蓬乱蛋白 2 对大鼠骨髓间充质干细胞成骨分化的影响. 中华口腔医学杂志. 2018;53(10):694–700. doi: 10.3760/cma.j.issn.1002-0098.2018.10.009. [DOI] [Google Scholar]
- 7.Schoen C, Aschrafi A, Thonissen M, et al MicroRNAs in palatogenesis and cleft palate. Front Physiol. 2017;8:165. doi: 10.3389/fphys.2017.00165. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Suzuki A, Abdallah N, Gajera M, et al Genes and microRNAs associated with mouse cleft palate: A systematic review and bioinformatics analysis. Mech Dev. 2018;150:21–27. doi: 10.1016/j.mod.2018.02.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chen W, Sheng P, Huang Z, et al MicroRNA-381 regulates chondrocyte hypertrophy by inhibiting histone deacetylase 4 expression. Int J Mol Sci. 2016;17(9):1377. doi: 10.3390/ijms17091377. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kawai M, Herrmann D, Fuchs A, et al. Fgfr1 conditional-knockout in neural crest cells induces heterotopic chondrogenesis and osteogenesis in mouse frontal bones. Med Mol Morphol, 2018. DOI: 10.1007/s00795-018-0213-z.
- 11.Feng C, Xu Z, Li Z, et al Down-regulation of Wnt10a by RNA interference inhibits proliferation and promotes apoptosis in mouse embryonic palatal mesenchymal cells through Wnt/beta-catenin signaling pathway. J Physiol Biochem. 2013;69(4):855–863. doi: 10.1007/s13105-013-0262-7. [DOI] [PubMed] [Google Scholar]
- 12.Voigt A, Radlanski RJ, Sarioglu N, et al Cleft lip and palate. Pathologe. 2017;38(4):241–247. doi: 10.1007/s00292-017-0313-x. [DOI] [PubMed] [Google Scholar]
- 13.Shen J, Hung MC Signaling-mediated regulation of MicroRNA processing. Cancer Res. 2015;75(5):783–791. doi: 10.1158/0008-5472.CAN-14-2568. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ratnadiwakara M, Mohenska M, Änkö ML, et al Splicing factors as regulators of miRNA biogenesis-links to human disease. Semin Cell Dev Biol. 2018;79:113–122. doi: 10.1016/j.semcdb.2017.10.008. [DOI] [PubMed] [Google Scholar]
- 15.Weiner AMJ MicroRNAs and the neural crest: From induction to differentiation. Mech Dev. 2018;154:98–106. doi: 10.1016/j.mod.2018.05.009. [DOI] [PubMed] [Google Scholar]
- 16.Ries RJ, Yu W, Holton N, et al Inhibition of the miR-17-92 cluster separates stages of palatogenesis. J Dent Res. 2017;96(11):1257–1264. doi: 10.1177/0022034517716915. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Warner D, Ding J, Mukhopadhyay P, et al Temporal expression of miRNAs in laser capture microdissected palate medial edge epithelium from Tgfbeta3(–/–) mouse fetuses. Microrna. 2015;4(1):64–71. doi: 10.2174/2211536604666150710125743. [DOI] [PubMed] [Google Scholar]
- 18.彭建强, 黄年盛, 黄胜, 等 H2O2 下调 miR-21 对 MC3T3-E1 细胞成骨分化影响的研究 . 中国修复重建外科杂志. 2018;32(3):276–284. doi: 10.7507/1002-1892.201707030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hill CR, Jacobs BH, Brown CB, et al Type Ⅲ transforming growth factor beta receptor regulates vascular and osteoblast development during palatogenesis. Dev Dyn. 2015;244(2):122–133. doi: 10.1002/dvdy.v244.2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Lei Z, Wang MH Research progress of osteogenesis-related signaling pathways. Advances in Clinical Medicine. 2017;7(4):235–241. doi: 10.12677/ACM.2017.74039. [DOI] [Google Scholar]
- 21.Zhang S, Wang C, Xie C, et al Disruption of hedgehog signaling by vismodegib leads to cleft palate and delayed osteogenesis in experimental design. J Craniofac Surg. 2017;28(6):1607–1614. doi: 10.1097/SCS.0000000000003790. [DOI] [PubMed] [Google Scholar]
- 22.Watson AT, Planchart A, Mattingly CJ, et al From the cover: embryonic exposure to TCDD impacts osteogenesis of the axial skeleton in Japanese Medaka, Oryzias latipes. Toxicol Sci. 2017;155(2):485–496. doi: 10.1093/toxsci/kfw229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Burns FR, Peterson RE, Heideman W Dioxin disrupts cranial cartilage and dermal bone development in zebrafish larvae. Aquat Toxicol. 2015;164:52–60. doi: 10.1016/j.aquatox.2015.04.005. [DOI] [PMC free article] [PubMed] [Google Scholar]