Abstract
Hintergrund: Zwischen Darm und Lunge besteht eine bidirektionale Interaktion, die sogenannte Lungen-Darm-Achse.
Methode: In der Übersichtsarbeit wird über Studien berichtet, die sich mit einem möglichen Einfluss der intestinalen Mikrobiota auf die Immunantwort auf eine SARS-CoV-2-Infektion befassen.
Ergebnisse und Schlussfolgerungen: Untersuchungen haben gezeigt, dass COVID-19 von einer Dysbiose begleitet wird, die auch nach erfolgreicher Viruskonversion (negativer PCR) persistiert. Eine Studie fand heraus, dass der Schweregrad von COVID-19 mit der intestinalen Mikrobiota assoziiert ist. Eine Dysbiose könnte somit den sogenannten Zytokinsturm begünstigen. Es gibt Hinweise, dass Pre- und Probiotika die Immunantwort sowohl im Darm als auch in der Lunge verstärken könnten.
Schlüsselwörter: Lungen-Darm-Achse, intestinale Mikrobiota, COVID-19, Zytokinsturm, Probiotika
Eingereicht am 19.5.2021 - Revision akzeptiert am 28.6.2021
Supplementary Information
Zusatzmaterial online: Zu diesem Beitrag sind unter 10.1007/s15006-021-0200-5 für autorisierte Leser zusätzliche Dateien abrufbar.
Abstract:
Background: There is a bidirectional interaction between the intestines and lungs, the so-called lung-intestinal axis.
Method: The review article reports on studies that deal with a possible influence of the intestinal microbiota on the immune response to a SARS-CoV-2 infection.
Results and Conclusions: Studies have shown that COVID-19 is accompanied by dysbiosis that persists even after successful virus conversion (negative PCR). One study found that the severity of COVID-19 is associated with the intestinal microbiota. A dysbiosis could thus favor the so-called cytokine storm. There is indication that pre- and probiotics could boost the immune response in both the guts and lungs.
Keywords: Lung-intestinal axis, intestinal microbiota, COVID-19, cytokine storm, probiotics
Als intestinale Mikrobiota wird die Gesamtheit der Mikroorganismen bezeichnet, die den Darm des Menschen besiedeln. Die größte Ansammlung von Mikroben findet sich im Darm, die zweitgrößte in der Mundhöhle. Außerdem wurden Mikroben auf der Haut, in den Atemwegen oder bei Frauen in der Vagina festgestellt [1].
Bei der intestinalen Mikrobiota handelt es sich in erster Linie um Bakterien, aber auch um Viren, Urbakterien und Pilze [2]. Mit Hilfe des sogenannten Next-Generation-Sequencing ist es gelungen, die Darmbakterien und deren Gene zu charakterisieren. Mit Hilfe sogenannter Metabolomics werden verschiedene Stoffwechselprodukte der Bakterien analysiert [3].
Physiologische Rolle
Eine gesunde intestinale Mikrobiota stellt einen wichtigen Grundbaustein unserer Gesundheit dar. In den letzten Jahren konnte gezeigt werden, dass die Zusammensetzung der Darmmikrobiota von vielen Faktoren, wie Stress, Genetik, Ernährung, Antibiotika, Protonenpumpenhemmern, einem negativen frühkindlichen Umfeld oder Darminfektionen abhängt [4]. Die Wirkung der intestinalen Mikrobiota umfasst u.a. Konkurrenz um Nährstoffe, Biokonversion, Produktion von Vitaminen, antibakterielle Wirkung, Verbesserung der Darmbarriere, Wettbewerb um die sogenannten Bindungsstellen, Modulation der Inflammation und Immunmodulation [5].
In den letzten 10 Jahren konnte die Interaktion zwischen Darmmikrobiota und verschiedenen extraintestinalen Organen aufgezeichnet werden. Dazu gehören u.a. die Hirn-Darm-Achse, die Leber-Darm-Achse, die Lungen-Darm-Achse oder die Haut-Darm-Achse. Die Störung einer oder mehrerer dieser Achsen kann Konsequenzen im Sinne von neuen Erkrankungen außerhalb des Darmes haben [7].
Die intestinale Mikrobiota beeinflusst außerdem die Durchlässigkeit der Darmbarriere. Bei einem gesunden Darmmikrobiom können verschiedene schädliche Substanzen oder gefährliche Bakterien und Viren nicht vom Darm ins Blut gelangen [8].
Dysbiose
Die Dysbiose, d. h. kompositionelle Störung der Darmmikrobiota (Missverhältnis zwischen Symbionten und Pathobionten) ist mit verschiedenen Erkrankungen im Darm (z. B. chronisch-entzündliche Darmerkrankung) und außerhalb des Darmes (z. B. Autoimmunerkrankung, maligne Erkrankung, Allergien, metabolisches Syndrom oder neurologische bzw. psychiatrische Erkrankung) verbunden [1]. In den letzten Jahren konnten verschiedene Faktoren charakterisiert werden, die die Zusammensetzung des Darmmikrobioms beeinflussen. Neben der Ernährung, die einen sehr wichtigen Einfluss auf die Qualität und Quantität der intestinalen Mikrobiota ausübt [6], gehören hierzu auch Bewegung, die geografische Lokalisation, die Einnahme von Medikamenten, Komorbiditäten und vor allem der Alterungsprozess [9]. Mit zunehmendem Alter kommt es zu ungünstigen Verschiebungen zwischen negativen und positiven Bakterien. Der erhöhte Dysbiose-Index begünstigt somit kognitive Störungen, Immundefekte und metabolische Erkrankungen [10].
Die intestinale Mikrobiota stellt auch eine wichtige Quelle für verschiedene Metabolite dar, die die physiologische Funktion verschiedener Organe beeinflussen. Dazu gehören u. a. kurzkettige Fettsäuren, Vitamine, Gallensäuren, Phenolen oder Methylamine [11].
Darmmikrobiom und COVID-19
Die SARS-CoV-2-Pandemie stellte die Medizin auf der ganzen Welt vor große Herausforderungen. Mittlerweile sind weltweit an dieser Erkrankung ca. 3,4 Millionen (Stand 18.5.2021) Menschen gestorben [12]. Durch intensive Forschung wurde die Übertragung dieser Infektion besser charakterisiert. Die SARS-CoV-2-Viren vermehren sich nicht nur in der Lunge, sondern auch im Gastrointestinaltrakt [13].
Bereits bei anderen viralen Infektionen konnte eine Lungen-Darm-Achse beschrieben werden. So konnte gezeigt werden, dass die Störung der Darmmikrobiota mit einer verstärkten Entzündung in der Lunge einhergeht. Auf der anderen Seite kann eine bakterielle Superinfektion in der Lunge die Dysbiose im Darm verstärken [14]. Eine Vielzahl von Studien konnte zeigen, dass die COVID-19-Infektion außerhalb der Lunge und vor allem im Gastrointestinaltrakt, in der Leber bzw. der Bauchspeicheldrüse zu verschiedenen Komplikationen führt [15]. Besorgniserregend ist auch Long-COVID, d. h. Komplikationen, die nach einer durchgemachten Coronavirusinfektion persistieren. Dazu gehören u. a. Schlafstörungen, Abgeschlagenheit, Dyspnoe, persistierender Husten, psychische Probleme (Angststörung, Depressionen), Komplikationen im Bereich des muskuloskelettalen Systems (Myalgie, Arthritiden), kardiovaskuläre und neurologische Komplikationen [16].
Bei Patienten, die an COVID-19 erkrankten, konnten in den Studien zwischen 8,8% und 79% gastrointestinale Manifestationen festgestellt werden. Bei etwa 30-40% der Betroffenen kommt es im Rahmen der COVID-Infektion zu einer verlängerten Ausscheidung von Coronaviren über den Darm im Stuhl [15].
Mikrobiomforschung
Die COVID-19-Infektion hat einen enormen Einfluss auf die Mikrobiomforschung. Zum einen konnte gezeigt werden, dass die Viren durch die Aktivierung der Lungen-Darm-Achse negative Effekte auf die Zusammensetzung der Darmmikrobiota haben. Darüber hinaus führten die COVID-19-Infektionen zu bisher nicht bekannten Einschränkungen in unserem Leben (Lockdown), die ebenfalls negative Auswirkungen auf die Zusammensetzung der Darmmikrobiota haben (einseitige Ernährung, Snacking, vermehrtes Rauchen und Alkoholkonsum, weniger Bewegung, Übergewicht) [17].
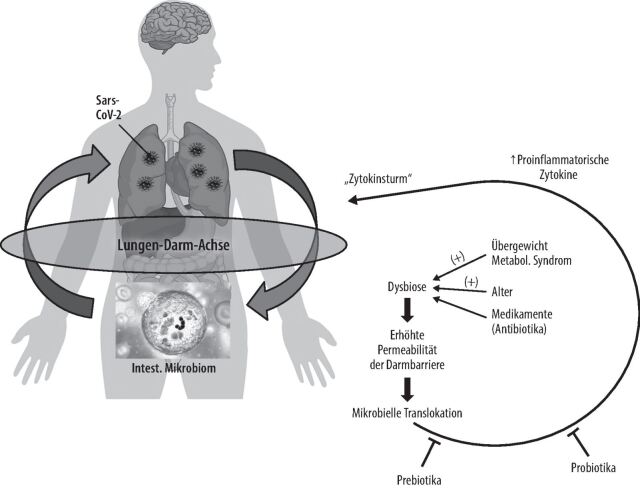
COVID-19 war auch Anlass zur Durchführung von verschiedenen lokalen, kleinen und großen Populationsstudien zur Rolle des Mikrobioms beim Verlauf dieser Erkrankung. Die Studien haben gezeigt, dass bei Eubiose im Darm (gesundes Mikrobiom) die Reaktion des Immunsystems der Lunge auf die virale Infektion (Interferon-Produktion, Aktivierung von T-Zellen) wesentlich besser und kontrollierter abläuft als bei Patienten mit Dysbiose. Beim dysbiotischen Darm sehen wir eine defekte Immunantwort der Lunge mit unkontrollierter Vermehrung der Viren und unkontrollierter Aktivierung des Immunsystems, einen sogenannten Zytokinsturm [18].
Die Studien konnten demonstrieren, dass bei einem gesunden Darmmikrobiom die Bindung der Viren an entsprechende Rezeptoren im Gastrointestinaltrakt vermindert ist. Darüber hinaus produzieren gute Bakterien (Symbionten) antimikrobielle und antivirale Substanzen. Schließlich werden bei Eubiose das angeborene und das erworbene Immunsystem effektiver aktiviert [19].
Die erste Studie zur Rolle der intestinalen Dysbiose bei COVID-Patienten kommt aus China. Die Wissenschaftler zeigten einen dramatischen Rückgang nützlicher Symbionten, vor allem Faecalobacterium (F.) prausnitzii, Roseburia und Lachnospiraceae, und gleichzeitig einen signifikanten Anstieg entzündungsfördernder Bakterien, wie Clostridium hathewayi, Actinomyces viscosus oder Bacteroides nordii [20]. Die gleiche Wissenschaftlergruppe zeigte außerdem, dass es im Rahmen der COVID-19-Infektion zu einem deutlichen Anstieg von verschiedenen Pilzvertretern kommt, vor allem Candida albicans, aber auch Candida auris, Aspergillus flavus oder Aspergillus niger [21].
Eine aktuelle Studie einer Arbeitsgruppe aus Hongkong zeigt gravierende Veränderungen der Darmmikrobiota bei Patienten mit einer COVID-19-Infektion, die nach Ausheilung der Infektion (negativer PCR) weiterhin persistierten. Patienten mit einer COVID-19-Infektion wiesen einen höheren Anteil an Ruminococcus gnavus, Ruminococcus torques und Bacteroides dorei und einen dramatischen Rückgang von F. prausnitzii, Bifidobakterien und Eubacterium rectale auf [22]. F. prausnitzii macht im gesunden Darm ca. 5-15% des Darmmikrobioms aus und ist dafür bekannt, ein wichtiger Produzent von Butyrat (ein wichtiges antientzündliches Molekül) zu sein. Butyrat ist in der Lage, z. B. den NF-kappa-B-Signalweg in den Zellen, einen wichtigen entzündungsfördernden Signalweg, zu blockieren [23].
Die Hongkonger Arbeitsgruppe untersuchte außerdem einen Zusammenhang zwischen Schweregrad der COVID-19-Infektion und intestinaler Mikrobiota. Einer mikrobiellen Analyse zufolge war die durch SARS-CoV-2 induzierte Dysbiose mit erhöhten Konzentrationen an proinflammatroischen Zytokinen und entzündlichen Markern assoziiert. Die Studie zeigte, dass der schwere COVID-19-Infektionsverlauf mit einem höheren Dysbiose-Index assoziiert ist. Somit könnte die intestinale Dysbiose den sogenannten Zytokinsturm begünstigen [22].
Basierend auf den Ergebnissen verschiedener Studien konnte außerdem gezeigt werden, dass die SARS-CoV-2-Infektion zur Dysregulation verschiedener Mikrobiota-Achsen führt, dazu gehört auch die Hirn-Darm-Achse. Das könnte möglicherweise erklären, warum Patienten mit einer SARS-CoV-2-Infektion neurologische und psychiatrische Symptome entwickeln. Viele der Betroffenen klagen auch in der Rekonvaleszenzphase über mehrere Monate über eine ausgeprägte Abgeschlagenheit (Fatigue) und kognitive Störungen ("brain fog") [24].
Mikrobiota-basierte Therapie
Auf Grund der Tatsache, dass eine COVID-19-Infektion zu einer Darmdysbiose führt, untersuchten viele Forscher weltweit den Einfluss von Prebiotika, Probiotika oder einer Diät auf den Verlauf der Infektion und auf die Regeneration der Darmmikrobiota nach durchgemachter Infektion. Die industrialisierten Länder (USA, Länder Westeuropas), in denen eine "westliche" fettreiche und mikrobiomstörende Ernährungsweise dominiert, wurden besonders stark von der Pandemie betroffen.
Eine Modifikation der prebiotischen Ernährung könnte eine präventive Bedeutung haben. Zu wichtigen diätetischen Empfehlungen gehören u a. der Verzehr von Obst und Gemüse, vor allem Brokkoli, Granatapfel, Kiwi und grüner Salat, darüber hinaus brauner Reis, Vollkornprodukte, Gerste, Bohnen, Linsen, Nüsse, Tofu und Kichererbse, außerdem Joghurt, Kefir, Buttermilch und Käse. Nahrungsmittel, wie z. B. Hamburger, Donuts, Süßigkeiten, verarbeitetes Fleisch, zuckerhaltige Nahrungsmittel, sollen auf alle Fälle gemieden werden [25].
Der Einsatz von Probiotika bei COVID-19 wird gerade in verschiedenen Studien untersucht. Es gibt zunehmende Hinweise dafür, dass Probiotika die Barrierefunktion stärken. Außerdem zeigen probiotische Stämme antientzündliche und immunmodulierende Effekte. Interessant sind die verschiedenen antiviralen Effekte von Probiotika. Dazu gehören u. a. die direkte Interaktion mit Coronaviren, die Blockade der viralen ACE-Rezeptoren, Stimulation der sogenannten antimikrobiellen Peptide, Stimmulation von IgA-Antikörpern und eine Reihe stimulierender Effekte auf das angeborene und erworbene Immunsystem. Die Studien konnten außerdem zeigen, dass Probiotika hemmende Effekte auf die Produktion von proentzündlichen Zytokinen und Stimulation von antiviralen Antikörpern ausüben [26].
In einer kürzlich publizierten Studie konnte demonstriert werden, dass Probiotika die Symptome bei Infektionen des oberen Respirationstraktes signifikant reduzierten. Diese Effekte waren bei Patienten älter als 45 Jahre oder mit Übergewicht (BMI > 30 kg/m2) noch stärker ausgeprägt [26]. Basierend auf diesen Ergebnissen wurde postuliert, dass Probiotika durch entzündungshemmende Reaktionen bei Viruserkrankungen eine wichtige Rolle in der Prävention des Zytokinsturms im Rahmen eine COVID-19-Infektion spielen könnten (Abb. 1) [27]. Die entsprechenden prospektiven Studien stehen allerdings noch aus.
Neben Probiotika spielen auch Prebiotika eine wichtige Rolle für die Darmgesundheit. Dabei handelt es sich um nicht verdaubare Lebensmittelbestandteile, die ihren Wirt günstig beeinflussen, indem sie das Wachstum und/oder die Aktivität einer oder mehrerer Bakterienarten im Dickdarm gezielt anregen und somit die Gesundheit des Wirtes verbessern. Zu den wichtigen Prebiotika gehören Chicorée, Topinambur, Artischocken, Pastinaken, Löwenzahnwurzel, Porree, Zwiebel oder Schwarzwurzel [28].
Zusammenfassend gibt es zunehmende Eckdaten dafür, dass die Mikrobiota-basierte Therapie die negativen Folgen der Dysbiose im Rahmen einer COVID-19-Infektion reduzieren könnte (s. Zusatzmaterial online: Abb. 2).
Fazit
Die intestinale Mikrobiota stellt einen wichtigen Baustein der Gesundheit dar.
Zwischen dem Darm, Darmmikrobiom und der Lunge besteht eine bidirektionale Interaktion, die sogenannte Lungen- Darm-Achse.
Die COVID-19-Infektion wird von einer ausgeprägten Dysbiose begleitet, die nach erfolgreicher Viruskonversion (negativer PCR) persistiert.
Die Zusammensetzung der intestinalen Mikrobiota könnte einen Einfluss auf die Immunantwort auf eine SARS-CoV-2-Infektion haben.
Die Darmdysbiose, vor allem im Kontext von fortgeschrittenem Alter und Komorbiditäten (Adipositas, Diabetes mellitus, metabolisches Syndrom) erhöht das Risiko für einen schweren COVID-19-Verlauf mit sogenanntem Zytokinsturm.
Es gibt zunehmend Hinweise dafür, dass Prebiotika und Probiotika die antivirale Immunantwort sowohl im Gastrointestinaltrakt, als auch in der Lunge verstärken können.
Autor:
Prof. Dr. med. habil. Peter C. Konturek
Klinik für Innere Medizin II Thüringen-Kliniken "Georgius Agricola" GmbH, Standort Saalfeld Rainweg 68, D-07318 Saalfeld E-Mail: pkonturek@web.de
Prof. Dr. med. habil. Peter C. Konturek: Thüringen-Kliniken GmbH Saalfeld, Klinik für Innere Medizin II, Akademisches Lehrkrankenhaus des Universitätsklinikums Jena
This article is part of a supplement not sponsored by the industry.
Supplementary Information
Interessenkonflikt
Prof. Peter Konturek erklärt, dass kein Interessenkonflikt vorliegt.
Literatur:
- 1.Konturek P et al. MMW Fortschr Med 2020; 162 (Suppl 4): 9-14 [DOI] [PubMed]
- 2.Ottman N et al. Front Cell Infect Microbiol 2012; 2: 104 [DOI] [PMC free article] [PubMed]
- 3.Laudadio I et al. OMICS 2019; 23(7): 327-33 [DOI] [PubMed]
- 4.Bhattarai Y et al. Am J Physiol Gastrointest Liver Physiol 2017; 312(1): G52-G62 [DOI] [PMC free article] [PubMed]
- 5.Stadlbauer V. Gastroenterologe 2019; 14: 196-200
- 6.Kolodziejczyk AA et al. Nat Rev Microbiol 2019; 17(12): 742-53 [DOI] [PubMed]
- 7.Kåhrström CT et al. Nature 2016; 535(7610): 47 [DOI] [PubMed]
- 8.Takiishi T et al. Tissue Barriers 2017; 5(4):e1373208 [DOI] [PMC free article] [PubMed]
- 9.Quigley EMM. Nat Rev Gastroenterol Hepatol 2017; 14(5): 315-20 [DOI] [PubMed]
- 10.Haran JP et al. Gastroenterology 2021; 160(2): 507-23 [DOI] [PMC free article] [PubMed]
- 11.Mayneris-Perxachs J et al. FEBS J 2020; 287(5): 856-65 [DOI] [PubMed]
- 12.COVID-19: Fallzahlen in Deutschland und weltweit. https://www.rki.de
- 13.Dhar J et al. Indian J Gastroenterol 2020; 39(3): 220-31 [DOI] [PMC free article] [PubMed]
- 14.Li-Hong He et al. Front Microbiol 2020; 11: 1388 [DOI] [PMC free article] [PubMed]
- 15.Konturek PC et al. J Physiol Pharmacol 2020; 71(2) [DOI] [PubMed]
- 16.Iyengar KP et al. Adv Respir Med 2021; 89(2): 234-236 [DOI] [PubMed]
- 17.Burchill E et al. Front Med (Lausanne) 2021; 8: 652464 [DOI] [PMC free article] [PubMed]
- 18.Sencio V et al. Mucosal Immunology 2021; 14: 296-304 [DOI] [PMC free article] [PubMed]
- 19.Harper A et al. Front Cell Infect Microbiol 2021; 10: 596166 [DOI] [PMC free article] [PubMed]
- 20.Zuo T et al. Gastroenterology 2020; 159(3): 944-55 [DOI] [PMC free article] [PubMed]
- 21.Zuo T et al. Gastroenterology 2020; 159(4): 1302-1310.e5 [DOI] [PMC free article] [PubMed]
- 22.Yeoh YK et al. Gut 2021; 70(4): 698-706 [DOI] [PMC free article] [PubMed]
- 23.Leylabadlo HE et al. Microb Pathog 2020; 149: 104344 [DOI] [PubMed]
- 24.Shi Y et al. Brain Behav Immun 2021; 94: 476-7 [DOI] [PMC free article] [PubMed]
- 25.James PT et al. J Nutr 2021; 151(7): 1854-78 [DOI] [PMC free article] [PubMed]
- 26.Singh K et al. Nutr Res 2021; 87: 1-12 [DOI] [PMC free article] [PubMed]
- 27.Vignesh R et al. Front Cell Infect Microbiol 2021; 11: 667733 [DOI] [PMC free article] [PubMed]
- 28.Gasmi A et al. Clin Immunol 2021; 226: 108725 [DOI] [PMC free article] [PubMed]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.