Abstract
目的
研究飞秒激光表面处理后获得的微沟槽结构对氧化锆表面显微形貌、晶相组成及弯曲强度的影响,为氧化锆种植体表面微观结构优化提供参考。
方法
根据不同表面处理方法,将57个计算机辅助设计/计算机辅助制造(computer aided design/computer aided manufacture, CAD/CAM)的长方体氧化锆标准试件(20.0 mm×4.0 mm×1.4 mm)分为3组(每组19个):(1)终烧结组,终烧结后无处理,作为对照; (2)喷砂组,终烧结后用110 μm氧化铝(Al2O3)喷砂; (3)微沟槽组,用飞秒激光加工宽50 μm、深30 μm、间距100 μm的微沟槽。通过扫描电镜和3D激光形貌测量显微镜观察表面显微形貌,计算各组表面粗糙度和微沟槽组的沟槽尺寸,采用X射线衍射仪进行晶相分析,进行三点弯曲试验,通过Weibull分布分析其强度特征。
结果
扫描电镜显示终烧结组表面较为平整,晶粒结构清晰,喷砂组表面凹凸不平,出现边缘锐利的凹坑,形状不规则,微沟槽组表面微沟槽排列规则,未见明显缺陷,沟槽内壁形成纳米级颗粒状显微结构。微沟槽组粗糙度Ra值(9.42±0.28) μm显著高于喷砂组(1.04±0.03) μm和终烧结组(0.60±0.04) μm,喷砂组与终烧结组之间差异亦有统计学意义(P < 0.001)。飞秒激光加工的微沟槽尺寸精确,宽度(49.75±1.24) μm,深度(30.85±1.02) μm,间距(100.58±1.94) μm; 晶相分析结果显示,喷砂组的单斜相体积百分数(18.17%)较终烧结组(1.55%)明显增加,微沟槽组(2.21%)与终烧结组相近; 喷砂组的弯曲强度(986.22±163.25) MPa与终烧结组(946.46±134.15) MPa相比差异无统计学意义(P=0.847),而微沟槽组弯曲强度(547.92±30.89) MPa较其余两组显著下降(P < 0.001);终烧结组、喷砂组、微沟槽组的Weibull模数m分别为7.89、6.98、23.46。
结论
飞秒激光处理可在氧化锆表面形成具有微纳结构的微沟槽,会显著降低氧化锆的弯曲强度。
Keywords: 氧化锆, 飞秒激光, 微沟槽
Abstract
Objective
To evaluate the effects of femtosecond laser treated microgrooved surface on microscopic topography, phase transformation, and three-points flexural strength of zirconia, and to provide reference for surface microstructure optimization of zirconia implant.
Methods
According to different surface treatment methods, 57 computer aided design/computer aided manufacture (CAD/CAM) zirconia bars (20.0 mm×4.0 mm×1.4 mm) were evenly divided into three groups: sintered group, no treatment after sintering, taken as control; sandblasted group, sandblasted with 110 μm aluminium oxide (Al2O3) after sintering; microgrooved group, femtosecond laser fabricated microgrooves with 50 μm width, 30 μm depth, and 100 μm pitch. Surface microscopic topography was observed with scanning electron microscope (SEM) and 3D laser microscope. Further, surface roughness in each group and microgroove size were measured. Crystal phase was analyzed with X-ray diffraction. Specimens were subjected to three- points flexural strength test, and Weibull distribution was used to analyze their strength characteristics.
Results
SEM showed that sintered surface was flat with clear grain structure; sandblasted surface exihibited bumps and holes with sharp margins and irregular shape; microgrooves were regularly aligned without evident defect, and nano-scale particles were observed on the surface inside of the microgrooves. Ra value of microgrooved group [(9.42±0.28)] μm was significantly higher than that of sandblasted group [(1.04±0.03) μm] and sintered group [(0.60±0.04) μm], and there was statistical difference between sandblasted group and sintered group (P < 0.001). The microgroove size was precise with (49.75±1.24) μm width, (30.85±1.02) μm depth, and (100.58±1.94) μm pitch. Crystal phase analysis showed that monoclinic volume fraction of sandblasted group (18.17%) was much higher than that of sintered group (1.55%), while microgrooved group (2.21%) was similar with sintered group. The flexural strength of sandblasted group (986.22±163.25) MPa had no statistical difference with that of sintered group (946.46±134.15) MPa (P=0.847), but the strength in microgrooved group (547.92±30.89) MPa dropped significantly compared with the other two groups (P < 0.001). Weibull modulus of sintered, sandblasted, microgrooved groups were 7.89, 6.98, and 23.46, respectively.
Conclusion
Femtosecond laser was able to form micro/nanostructured microgrooves on zirconia surface, which deleteriously affected the flexural strength of zirconia.
Keywords: Zirconia, Femtosecond laser, Microgroove
氧化锆(ZrO2)材料在口腔医学领域内的应用日渐广泛,因其良好的生物相容性、机械性能、不易堆积菌斑的特性和与天然牙相近的美学效果,有望成为钛种植体的理想替代材料[1-4]。种植体的表面显微形貌和粗糙度是影响种植体骨结合的关键因素,常见的氧化锆种植体表面处理方法有喷砂、酸蚀、涂层等[5-6],这些处理方法可能对种植体表面造成污染,且难以实现表面微观形貌的精确调控。
近年来激光作为一种精确、高效、清洁的技术开始应用于氧化锆种植体的表面处理。既往研究表明,飞秒激光在氧化锆种植体表面形成的微沟槽同时具有微米级别和纳米级别形貌,而且可以通过接触诱导作用促进成骨细胞增殖,引导胶原纤维垂直于种植体表面排列,其骨结合效果优于喷砂表面种植体[7-9]。然而,微沟槽结构可能作为宏观缺陷导致应力集中[10],进而降低氧化锆的弯曲强度,而已有的研究多集中于微沟槽结构的生物学效应,目前国内外尚未见飞秒激光表面处理对氧化锆机械强度影响的相关研究。
本研究通过飞秒激光在氧化锆表面加工出特定尺寸的微沟槽,明确飞秒激光表面处理对氧化锆表面特征和弯曲强度的影响,为氧化锆种植体微沟槽表面显微结构优化设计提供参考。
1. 资料与方法
1.1. 氧化锆试件
氧化锆材料(Y-TZP, 威兰德公司,德国)组成成分如下:氧化锆(ZrO2 + HfO2 + Y2O3)≥99%,其中氧化钇(Y2O3) 占4.5%~6%,氧化铪(HfO2)≤5.0%,氧化铝(Al2O3) 及其他氧化物≤1.0%。
通过Geomagic Studio 12.0(Geomagic公司,美国)软件设计试件三维模型,导入至CAM软件(WIELAND CAM 2.2,威兰德公司,德国),添加支撑结构,自动生成切削工艺, 导入切削软件(ZENOTEC MINI,威兰德公司,德国),切削出长方体试件,使用氧化锆烧结炉(Ceramill Therm 3,Amann Girrbach公司,奥地利) 终烧结后获得计算机辅助设计/计算机辅助制造(computer aided design/computer aided manufacture, CAD/CAM)氧化锆试件(图 1)60个,尺寸为20.0 mm×4.0 mm×1.4 mm,倒角,用3D激光形貌测量显微镜(VKX100,Keyence公司,日本)观察试件表面,排除表面有明显缺陷的试件2个,共制备合格试件58个,其中57个用于三点弯曲试验,1个用于微沟槽横断面观察。
图 1.

CAD/CAM氧化锆长方体试件
CAD/CAM zirconia bar
1.2. 氧化锆试件表面处理方法
根据表面处理方式分为以下3组,每组19个试件:(1)终烧结组:终烧结后不进行表面处理; (2)喷砂组:终烧结后采用直径110 μm的Al2O3颗粒对试件进行喷砂(Ovaljet HiBlaster,松风公司,日本),距离10~20 mm,压力0.4~0.5 MPa,角度90°,时间2 min; (3)微沟槽组:使用光纤飞秒激光(Tangerine,Amplitude Systems公司, 法国,图 2)在试件表面加工出方向与试件长轴垂直的微沟槽,微沟槽宽度50 μm,深度30 μm,间距100 μm,如图 3所示。飞秒激光器参数设置:波长1 030 nm,功率8 W,焦距175 mm,光斑直径80 μm,扫描速度1 900 mm/s,扫描次数30次,脉宽400 fs, 重复频率200 kHz,能量密度0.8 J/cm2,激光扫描时试件不移动,通过振镜调整激光路径,每次扫描路径相同。
图 2.
飞秒激光器
Image of femtosecond laser set-up
图 3.
微沟槽尺寸示意图
Diagram of microgroove size
1.3. 试件表面特征观察及粗糙度测量
每组选取2个试件,在扫描电镜(Merlin, Zeiss公司,德国)下观察表面显微形貌。通过VK analyzer软件(Keyence公司,日本)测量所有试件表面粗糙度参数,每个试件选取10个无明显表面缺陷且不重复的区域(50 μm×50 μm)进行测量,取平均值作为该组表面粗糙度参数值。粗糙度参数包括:Ra(轮廓算数平均偏差)、Rq(轮廓各点高度均方根)、Rz(轮廓微观不平度的10个区域高度)。微沟槽组每个试件选取10个区域进行沟槽尺寸测量,计算均数±标准差。另制备一个微沟槽试件,用扫描电镜观察沟槽横断面形态。
1.4. X射线衍射分析
每组选取2个试件,通过X射线衍射仪(D/max 2500,Rigaku公司, 日本)进行晶相分析,参数为铜靶,步长0.02°,速度1 s/步,衍射角(2θ)扫描范围25°~35°,根据公式(1)[11]、(2)[12]计算单斜相(m相)氧化锆的体积百分数:
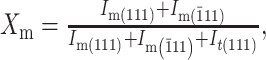 |
1 |
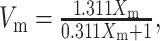 |
2 |
Xm为单斜相峰值强度比,Im(111)、Im(111)、It(111)分别表示衍射角在31°、28°、30°附近的峰值强度,Vm为单斜相氧化锆的体积百分数。
1.5. 三点弯曲强度试验
每组15个试件,通过力学性能试验机(AGS-X, SHIMADZU公司, 日本)进行三点弯曲试验,试验方法参考《牙科学陶瓷材料》(ISO 6872:2015)标准[13],跨距16 mm, 加载速度1 mm/min,记录试件断裂时的载荷,即三点弯曲强度。
1.6. 统计学分析
各组粗糙度参数和弯曲强度采用SPSS 24.0统计软件进行单因素方差分析,并通过Dunnett‘s T3方法进行组间两两比较,检验标准为α=0.05。使用MATLAB R2014a统计软件进行Weibull分析[14],计算特征断裂强度σ0(断裂概率为63.21%时的断裂强度)和Weibull模数m。
2. 结果
2.1. 表面显微形貌观察与测量
扫描电镜观察结果如图 4所示,终烧结表面较为平整,晶粒结构清晰; 喷砂表面凹凸不平,出现边缘锐利的凹坑,形状不规则; 微沟槽组沟槽排列规则,边缘清晰,沟槽内部未见明显缺陷,沟槽内壁可见纳米级颗粒状显微结构。微沟槽横断面扫描电镜(图 5)显示微沟槽底部为V形,形态较尖锐。
图 4.
氧化锆表面形貌扫描电镜照片
Scanning electron microscope images of zirconia surface topographies
图 5.
微沟槽横断面扫描电镜照片(×200)
SEM image of microgrooved zirconia cross section(×200)
各组氧化锆试件表面粗糙度(表 1)由大到小依次为微沟槽组、喷砂组、终烧结组,组间两两比较差异均有统计学意义(P < 0.001)。微沟槽尺寸精确稳定,其宽度、深度、间距分别为(49.75±1.24) μm、(30.85±1.02) μm、(100.58±1.94) μm。
表 1.
氧化锆试件表面粗糙度
Surface roughness of zirconia bar
| Groups | Ra/μm | Rq/μm | Rz/μm |
| Ra, Rq, Rz values in 3 groups were significantly different (P < 0.001). For Ra, FGroup=13 806.99, P < 0.001; For Rq, FGroup=14 161.55, P < 0.001; For Rz, FGroup=7 902.459, P < 0.001. | |||
| Sintered | 0.60±0.04 | 0.77±0.05 | 5.94±0.40 |
| Sandblasted | 1.04±0.03 | 1.31±0.04 | 10.14±0.58 |
| Microgrooved | 9.42±0.28 | 10.60±0.31 | 37.83±1.10 |
2.2. 表面晶相分析
各组X射线衍射图谱见图 6,微沟槽组的图谱与终烧结组基本一致,在衍射角为30.2°时出现四方相波峰,无单斜相波峰,而喷砂组在衍射角为28.2°时出现清晰的单斜相波峰。喷砂组的单斜相百分数(18.17%)较终烧结组(1.55%)明显升高,微沟槽组单斜相百分数(2.21%)与终烧结组相近。
图 6.
X射线衍射图谱,m为单斜相氧化锆波峰,t为四方相氧化锆波峰
X-ray diffraction spectra showing monoclinic phase peak(m) and tetragonal phase peak(t)
2.3. 三点弯曲强度及Weibull分析
表 2显示各组试件平均弯曲强度σc、特征断裂强度σ0和Weibull模数m,终烧结组与喷砂组的弯曲强度差异无统计学意义(P=0.847),微沟槽组的弯曲强度较其余两组显著降低(P < 0.001)。
表 2.
三点弯曲试验结果
Three-points flexural strength test results
| Groups | Flexural strength (σc) /MPa | Characteristic strength (σ0)/MPa | 95%CI | Weibull modulus (m) | 95%CI |
| *P < 0.001, compared with sintered group and sandblasted group. For flexural strength, FGroup=57.98, P < 0.001. | |||||
| Sintered | 946.46±134.15 | 1 003.92 | 937.96-1 074.52 | 7.89 | 5.37-11.58 |
| Sandblasted | 986.22±163.25 | 1 054.25 | 976.41-1 138.29 | 6.98 | 4.71-10.36 |
| Microgrooved | 547.92±30.89* | 561.45 | 548.86-574.34 | 23.46 | 15.41-35.73 |
3. 讨论
本研究结果表明,飞秒激光可在氧化锆表面形成具有良好尺寸稳定性的微沟槽结构,沟槽内壁形成了纳米级颗粒状显微结构,且未造成晶相转变,实现了对氧化锆表面显微形貌的精确处理。另外,微沟槽结构造成了氧化锆试件弯曲强度的显著降低,其对氧化锆种植体强度的影响有待进一步研究。
3.1. 飞秒激光表面处理技术
传统的纳秒(10-9 s)、皮秒(10-12 s)激光加工原理为热熔融,物质依次经历固态、液态、气态、重新冷凝为固态的变化过程[15],易对材料造成损伤, 而在飞秒激光的作用下,材料吸收大量光子能量使电子发生跃迁,出现雪崩电离(avalanche ionization)现象,形成的等离子体进入周围空气,同时材料被去除[16],是物质从固态到等离子态的过程,对材料损伤小。Roitero等[17]使用纳秒激光处理氧化锆后发现材料表面存在纳米级颗粒状结构,但沟槽形态不规则,出现大量晶粒间裂纹、孔洞等热损伤表现。Delgado-Ruíz等[7]用飞秒激光在氧化锆种植体表面加工出宽30 μm、深50 μm的均匀分布的微沟槽,沟槽形态规则,扫描电镜下未见明显微裂纹,沟槽内壁可见纳米级颗粒状显微结构,与本研究相似。
3.2. 氧化锆表面处理的生物学作用
既往研究证实,种植体表面的微纳结构可促进骨结合。微米尺度形貌具有稳定细胞外基质支架、增加种植体与骨的接触面积和机械锁结力的作用[18-19],纳米尺度形貌则可促进蛋白吸附、促进成骨细胞迁移,从而加速骨结合[20]。目前,在氧化锆表面形成微纳结构的方法有喷砂加酸蚀、表面涂层、激光处理等[7, 21-22]。
20世纪40年代,Weiss提出“接触诱导”现象,神经细胞、间充质细胞等多种细胞可受微纳米级别沟槽图案的影响,排列和迁移方向与沟槽方向趋于一致[23]。近年来,研究发现微沟槽表面可促进细胞成骨向分化,并且增加成骨细胞密度。Lee等[24]采用光刻法在钛试件表面加工出的微沟槽可促进血清蛋白吸附和成骨细胞成熟。Carvalho等[25]在氧化铝增强的氧化锆试件表面加工出的微沟槽,能促进人骨髓间充质干细胞成骨向分化。Delgado-Ruíz等[8]用飞秒激光在氧化锆试件表面加工出30 μm宽、50 μm深的微沟槽,其表面人胚成骨细胞的密度和碱性磷酸酶表达均较喷砂组显著增加。动物实验结果表明,在具有微沟槽表面的氧化锆种植体周围,垂直于种植体表面排列的胶原纤维增多,且有成骨细胞和血管长入微沟槽内[9]。目前,最适合成骨细胞生长的微沟槽尺寸尚无定论,多数研究表明,沟槽宽度10~80 μm、深度3~50 μm时有利于成骨细胞的生长[8, 24-26],为增加成骨细胞与微沟槽内壁的接触面积,并降低应力集中,本研究选择了50 μm宽、30 μm深的沟槽尺寸,且飞秒激光处理形成的微沟槽表面形貌具有微纳结构,有望通过接触诱导作用促进骨结合。
3.3. 表面处理对氧化锆晶相组成及弯曲强度的影响
氧化锆是一种脆性材料,对表面缺陷的尺寸和分布敏感[13],一方面,CAD/CAM切削、喷砂、打磨等可引入表面缺陷,从而对氧化锆强度产生不利影响[27-29],另一方面,上述表面加工及处理方式可造成四方相氧化锆(t相)向单斜相(m相)转变,该过程伴随3%~4%的体积膨胀,在裂纹尖端形成压应力,阻止微裂纹扩展,出现相变增韧效应,有助于提高氧化锆强度[30-31],实际强度取决于何种作用占优势[32]。
本研究通过X射线衍射证实,飞秒激光表面处理未造成氧化锆相变,这与既往研究结果相同。Aivazi等[33]对氧化锆进行了飞秒激光微沟槽表面处理后,X射线衍射结果显示氧化锆无明显相变。Delgado-Ruíz等[7]采用拉曼(Raman)光谱仪测得同样的结果。另外,本研究中飞秒激光处理形成的微沟槽导致了较明显的表面缺陷,且沟底形态尖锐,易产生应力集中,故本研究中微沟槽组的三点弯曲强度显著下降。
关于喷砂对氧化锆强度的影响,Aboushelib等[29]的研究显示,50 μm氧化铝颗粒喷砂后的试件弯曲强度(1 166.4 MPa)与抛光组(1 074.6 MPa)相比略有提高,而120 μm氧化铝喷砂后的强度(727.5 MPa)则较抛光组显著下降。Chintapalli等[34]分别用110 μm和250 μm氧化铝颗粒对氧化锆进行喷砂,通过拉曼光谱仪测得二者相变深度无明显差异,约为12~13 μm,110 μm氧化铝喷砂后,缺陷仅延伸至试件表层下8 μm,其深度局限于相变层内,而250 μm氧化铝喷砂产生的缺陷超过20 μm,深度超出相变层,从而推测当缺陷深度超出相变层深度时可能降低氧化锆的强度。本研究中,喷砂组弯曲强度与终烧结组相比差异无统计学意义,可能是缺陷和相变增韧效应对氧化锆强度产生的综合影响。
Weibull模数m代表材料均一性和可靠性,m值越大,材料均一性越好。多数陶瓷的Weibull模数m值为5~15[35],本研究中喷砂组的m值较终烧结组略有下降,而微沟槽组m值明显升高,即试件弯曲强度的均一性提高。可能的原因如下:尽管微沟槽结构导致应力集中,容易形成裂纹源,造成试件强度下降,但是飞秒激光处理形成的微沟槽形态规则且分布均匀,使试件原有不规则分布的缺陷对弯曲强度的影响明显变弱,即微沟槽组中试件的整体缺陷虽然提高,但试件之间缺陷的离散性下降,这一结果与弯曲强度的标准差可以互相印证。
本研究的不足之处是微沟槽仅设计了一种尺寸,若能调整激光器参数,使沟槽宽而浅,或将沟槽底部形态从V形变为U形[36],则有望减少微沟槽结构对氧化锆强度的不利影响,将多种不同尺寸和形状的沟槽进行强度对比,可为微沟槽结构的优化设计提供更多参考。
飞秒激光能够精确、高效地处理氧化锆表面,形成具有微纳结构的微沟槽,未造成表面相变,但会引起氧化锆弯曲强度的下降,其对氧化锆种植体强度的影响有待进一步研究。今后尚需改进飞秒激光表面处理方法,以减小对氧化锆弯曲强度的影响,探索既能促进组织结合,又能保证种植体强度的微沟槽形态及尺寸。
Funding Statement
国家自然科学基金(81671026)、北京市自然科学基金(7192233)
Supported by the National Natural Science Foundation of China (81671026) and the Beijing Natural Science Foundation (7192233)
References
- 1.Scarano A, di Carlo F, Quaranta M, et al. Bone response to zirconia ceramic implants: an experimental study in rabbits. J Oral Implantol. 2003;29(1):8–12. doi: 10.1563/1548-1336(2003)029<0008:BRTZCI>2.3.CO;2. [DOI] [PubMed] [Google Scholar]
- 2.Spies BC, Nold J, Vach K, et al. Two-piece zirconia oral implants withstand masticatory loads: An investigation in the artificial mouth. J Mech Behav Biomed Mater. 2016;53:1–10. doi: 10.1016/j.jmbbm.2015.07.005. [DOI] [PubMed] [Google Scholar]
- 3.Scarano A, Piattelli M, Caputi S, et al. Bacterial adhesion on commercially pure titanium and zirconium oxide disks: an in vivo human study. J Periodontol. 2004;75(2):292–296. doi: 10.1902/jop.2004.75.2.292. [DOI] [PubMed] [Google Scholar]
- 4.Borgonovo AE, Censi R, Vavassori V, et al. Zirconia implants in esthetic areas: 4-year follow-up evaluation study. Int J Dent. 2015;2015:415029. doi: 10.1155/2015/415029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Fischer J, Schott A, Martin S. Surface micro-structuring of zirconia dental implants. Clin Oral Implants Res. 2016;27(2):162–166. doi: 10.1111/clr.12553. [DOI] [PubMed] [Google Scholar]
- 6.Pardun K, Treccani L, Volkmann E, et al. Magnesium-containing mixed coatings on zirconia for dental implants: mechanical characterization and in vitro behavior. J Biomater Appl. 2015;30(1):104–118. doi: 10.1177/0885328215572428. [DOI] [PubMed] [Google Scholar]
- 7.Delgado-Ruíz RA, Calvo-Guirado JL, Moreno P, et al. Femto-second laser microstructuring of zirconia dental implants. J Biomed Mater Res B. 2011;96(1):91–100. doi: 10.1002/jbm.b.31743. [DOI] [PubMed] [Google Scholar]
- 8.Delgado-Ruíz RA, Gomez MG, Aguilar-Salvatierra A, et al. Human fetal osteoblast behavior on zirconia dental implants and zirconia disks with microstructured surfaces. An experimental in vitro study. Clin Oral Implants Res. 2016;27(11):e144–e153. doi: 10.1111/clr.12585. [DOI] [PubMed] [Google Scholar]
- 9.Delgado-Ruiz RA, Abboud M, Romanos G, et al. Peri-implant bone organization surrounding zirconia-microgrooved surfaces circularly polarized light and confocal laser scanning microscopy study. Clin Oral Implants Res. 2015;26(11):1328–1337. doi: 10.1111/clr.12461. [DOI] [PubMed] [Google Scholar]
- 10.Pilkey WD, Pilkey DF. Peterson's stress concentration factors. New Jersey: John Wiley & Sons; 2008. pp. 3–9. [Google Scholar]
- 11.Garvie RC, Nicholson PS. Phase analysis in zirconia systems. J Am Ceram Soc. 1972;55(6):303–305. doi: 10.1111/j.1151-2916.1972.tb11290.x. [DOI] [Google Scholar]
- 12.Toraya H, Yoshimura M, Somiya S. Calibration curve for quantitative analysis of the monoclinic-tetragonal ZrO2 system by X-ray diffraction. J Am Ceram Soc. 1984;67(6):119–121. [Google Scholar]
- 13.British Standards Institution. ISO 6872: 2015, Dentistry-ceramic materials[S]. London: BSI Standards Publication, 2015.
- 14.Quinn JB, Quinn GD. A practical and systematic review of Weibull statistics for reporting strengths of dental materials. Dent Mater. 2009;26(2):135–147. doi: 10.1016/j.dental.2009.09.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kurella A, Dahotre NB. Review paper: surface modification for bioimplants: the role of laser surface engineering. J Biomater Appl. 2005;20(1):5–50. doi: 10.1177/0885328205052974. [DOI] [PubMed] [Google Scholar]
- 16.孙 玉春, Vorobyev A, 刘 晶, et al. 飞秒激光切削牙齿硬组织表面粗糙度和显微形貌观察. 中华口腔医学杂志. 2012;47(8):486–489. doi: 10.3760/cma.j.issn.1002-0098.2012.08.009. [DOI] [PubMed] [Google Scholar]
- 17.Roitero E, Lasserre F, Anglada M, et al. A parametric study of laser interference surface patterning of dental zirconia: Effects of laser parameters on topography and surface quality. Dent Mater. 2016;33(1):e28–e38. doi: 10.1016/j.dental.2016.09.040. [DOI] [PubMed] [Google Scholar]
- 18.Ricci JL, Grew JC, Alexander H. Connective-tissue responses to defined biomaterial surfaces. Ⅰ. Growth of rat fibroblast and bone marrow cell colonies on microgrooved substrates. J Biomed Mater Res A. 2008;85A(2):313–325. doi: 10.1002/jbm.a.31379. [DOI] [PubMed] [Google Scholar]
- 19.Khandaker M, Riahinezhad S, Williams WR, et al. Microgroove and collagen-poly(ε-caprolactone) nanofiber mesh coating improves the mechanical stability and osseointegration of titanium implants. Nanomaterials. 2017;7(6):145. doi: 10.3390/nano7060145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Souza JCM, Sordi MB, Kanazawa M, et al. Nano-scale modification of titanium implant surfaces to enhance osseointegration. Acta Biomater. 2019;94:112–131. doi: 10.1016/j.actbio.2019.05.045. [DOI] [PubMed] [Google Scholar]
- 21.Ding Q, Zhang L, Bao R, et al. Effects of different surface treatments on the cyclic fatigue strength of one-piece CAD/CAM zirconia implants. J Mech Behav Biomed Mater. 2018;84:249–257. doi: 10.1016/j.jmbbm.2018.05.002. [DOI] [PubMed] [Google Scholar]
- 22.Frandsen CJ, Noh K, Brammer KS, et al. Hybrid micro/nano-topography of a TiO2 nanotube-coated commercial zirconia femoral knee implant promotes bone cell adhesion in vitro. Mater Sci Eng C. 2013;33(5):2752–2756. doi: 10.1016/j.msec.2013.02.045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Weiss P, Garber B. Shape and movement of mesenchyme cells as functions of the physical structure of the medium. Contributions to a quantitative morphology. PNAS. 1952;38(3):264–280. doi: 10.1073/pnas.38.3.264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Lee M, Oh N, Lee S, et al. Factors influencing osteoblast maturation on microgrooved titanium substrata. Biomaterials. 2010;31(14):3804–3815. doi: 10.1016/j.biomaterials.2010.01.117. [DOI] [PubMed] [Google Scholar]
- 25.Carvalho A, Cangueiro L, Oliveira V, et al. Femtosecond laser microstructured Alumina toughened Zirconia: A new strategy to improve osteogenic differentiation of hMSCs. Appl Surf Sci. 2018;435:1237–1245. doi: 10.1016/j.apsusc.2017.11.206. [DOI] [Google Scholar]
- 26.de Luca AC, Zink M, Weidt A, et al. Effect of microgrooved surface topography on osteoblast maturation and protein adsorption. J Biomed Mater Res A. 2015;103(8):2689–2700. doi: 10.1002/jbm.a.35407. [DOI] [PubMed] [Google Scholar]
- 27.Guilardi LF, Soares P, Werner A, et al. Fatigue performance of distinct CAD/CAM dental ceramics. J Mech Behav Biomed Mater. 2019;103:103540. doi: 10.1016/j.jmbbm.2019.103540. [DOI] [PubMed] [Google Scholar]
- 28.Iseri U, Ozkurt Z, Yalniz A, et al. Comparison of different grinding procedures on the flexural strength of zirconia. J Prosthet Dent. 2012;107(5):309–315. doi: 10.1016/S0022-3913(12)60081-X. [DOI] [PubMed] [Google Scholar]
- 29.Aboushelib MN, Wang H, Kleverlaan CJ, et al. Fatigue behavior of zirconia under different loading conditions. Dent Mater. 2016;32(7):915–920. doi: 10.1016/j.dental.2016.03.012. [DOI] [PubMed] [Google Scholar]
- 30.Piconi C, Maccauro G. Zirconia as a ceramic biomaterial. Biomaterials. 1999;20(1):1–25. doi: 10.1016/S0142-9612(98)00010-6. [DOI] [PubMed] [Google Scholar]
- 31.龚 旭, 赵 信义, 张 春宝, et al. 喷砂对口腔氧化锆陶瓷抗弯强度和亚临界裂纹扩展的影响. 中华口腔医学杂志. 2017;52(7):439–442. doi: 10.3760/cma.j.issn.1002-0098.2017.07.009. [DOI] [PubMed] [Google Scholar]
- 32.Kosmac T, Oblak C, Jevnikar P, et al. The effect of surface grinding and sandblasting on flexural strength and reliability of Y-TZP zirconia ceramic. Dent Mater. 1999;15(6):426–433. doi: 10.1016/S0109-5641(99)00070-6. [DOI] [PubMed] [Google Scholar]
- 33.Aivazi M, Hossein FM, Nejatidanesh F, et al. The evaluation of prepared microgroove pattern by femtosecond laser on alumina-zirconia nano-composite for endosseous dental implant application. Lasers Med Sci. 2016;31(9):1837–1843. doi: 10.1007/s10103-016-2059-8. [DOI] [PubMed] [Google Scholar]
- 34.Chintapalli RK, Marro FG, Jimenez-Pique E, et al. Phase transformation and subsurface damage in 3Y-TZP after sandblasting. Dent Mater. 2013;29(5):566–572. doi: 10.1016/j.dental.2013.03.005. [DOI] [PubMed] [Google Scholar]
- 35.Karakoca S, Yilmaz H. Influence of surface treatments on surface roughness, phase transformation, and biaxial flexural strength of Y-TZP ceramics. J Biomed Mater Res B. 2009;91(2):930–937. doi: 10.1002/jbm.b.31477. [DOI] [PubMed] [Google Scholar]
- 36.Taylor D. The theory of critical distances: a new perspective in fracture mechanics. London: Elsevier; 2007. pp. 8–10. [Google Scholar]







