Abstract
目的
探讨延胡索酸水合酶缺陷型肾细胞癌(fumarate hydratase-deficient renal cell carcinoma,FH-RCC)的临床病理特征及预后。
方法
应用免疫组织化学染色的方法检测北京大学第一医院泌尿外科2013年1月至2019年12月收治的109例60岁及以下不同类型肾细胞癌患者肿瘤组织中延胡索酸水合酶(fumarate hydratase,FH)的表达情况,分析FH-RCC的临床病理特征及预后。
结果
筛选出11例FH-RCC患者,其中男性7例,女性4例,发病年龄16~53岁(平均36.7岁)。4名女性患者均有子宫肌瘤病史,仅1例患者的一级亲属有肾癌家族史,所有患者均无皮肤平滑肌肿瘤的病史及家族史。肾细胞癌的肿瘤直径2.1~12.0 cm(平均8.83 cm),9例患者有肾窦或肾周脂肪侵犯,6例有肾静脉或下腔静脉内瘤栓形成,7例有淋巴结转移,4例侵犯肾上腺,1例侵犯脾脏被膜。11例患者中7例(7/49例,14.3%)原诊断为Ⅱ型乳头状肾细胞癌,2例(2/9例,22.2%)原诊断为集合管癌,2例(2/51例,3.9%)原诊断为未分类型肾细胞癌。肿瘤组织病理学大多表现为乳头状、管囊状、实性片状等不同结构的混合,最常见的组织结构为乳头状(9/11例,81.8%)及管状(8/11例,72.7%)结构,3例伴有肉瘤样分化。肿瘤细胞均可见灶状分布大而明显的嗜酸性核仁(WHO/国际泌尿病理协会Ⅲ~Ⅳ级)及核周空晕。免疫组织化学检测显示,癌组织CA9、CD10、CK7染色大多阴性,2例TFE3阳性表达的病例经荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测,结果显示TFE3基因均未发生易位或扩增。11例患者均获得随访资料,随访时间11~82个月,确诊后患者平均生存期为24个月,其中5例于术后9~31个月(平均19个月)因肿瘤远处转移而死亡,6例存活患者中已有5例发生了远处转移。
结论
FH-RCC在组织形态学上与多种肾细胞癌有重叠,乳头状及管囊状排列方式的混合存在是FH-RCC最常见的生长方式,癌细胞中灶状出现大而明显的嗜酸性核仁是该类型肾细胞癌的重要组织学特征,FH免疫组织化学染色有助于明确诊断。对于患有平滑肌瘤的年轻女性肾细胞癌患者,需警惕FH-RCC的可能。部分FH-RCC的诊断缺少临床证据,应根据组织病理学特征进一步行基因检测以确诊。
Keywords: 肾细胞癌, 延胡索酸水合酶, 免疫组织化学, 预后
Abstract
Objective
To investigate the clinicopathological features and prognosis of fumarate hydratase deficient renal cell carcinoma (FH-RCC).
Methods
Immunohistochemical (IHC) staining was used to detect the expression of fumarate hydratase (FH) in tumor tissues of 109 different types of renal cell carcinoma (RCC) patients aged 60 years and younger from the Department of Urology of Peking University First Hospital from January 2013 to December 2019. The clinicopathological data and prognosis of FH-RCC were collected and analyzed.
Results
There were eleven patients with FH-negative expression. Seven were males and four females. The age of onset ranged 16-53 years (mean age: 36.7 years), and four female patients all had a history of uterine leiomyoma. Only one first-degree relative of one patient had renal cancer, and none of the patients had a history or family history of cutaneous leiomyomas. The diameter of the tumor was 2.1-12.0 cm (mean: 8.83 cm). Renal sinus or perirenal fat invasion was seen in nine cases, tumor thrombus in renal vein or inferior vena cava in six cases, lymph node metastasis in seven cases, adrenal gland invasion in four cases and splenic capsule invasion in one case. The cases were initially diagnosed as type Ⅱ papillary RCC (7/49, 14.3%), collecting duct carcinoma (2/9, 22.2%) and unclassified RCC (2/51, 3.9%). Tumor histopathology mostly showed a mixture of different structures, such as papillary, tubular cystic, solid, and so on. The most common histological structures were papillary (9/11, 81.8%) and tubular (8/11, 72.7%). Three cases had sarcomatoid areas. At least focal eosinophilic nucleolus (WHO/grades Ⅲ-Ⅳ) and perinuclear halo could be seen in all cases. Immunohistochemical (IHC) stains of most tumors were negative for CA9, CD10 and CK7. The results of fluorescence in situ hybridization (FISH) showed that there was no translocation or amplification of TFE3 gene in two cases with TFE3 IHC expression. All the patients were followed up for 11-82 months. Mean survival was 24 months. Five cases died of distant metastasis 9-31 months after operation (mean: 19 months), and five of the six patients alive had became metastatic.
Conclusion
Morphologically, FH-RCC overlaps with many types cell RCC. A mixture of papillary and tubular cystic arrangement is the most common growth pattern of FH-RCC. At least focally large and obvious eosinophilic nucleoli are an important histological feature of this tumor. The negative expression of FH can help to confirm the diagnosis. Young female RCC patients with uterine leiomyomas should be suspected of FH-RCC. Some FH-RCC cases lack clinical evidence. The suspicion raised by pathologists based on histological characteristics is often the key step to further genetic testing and the final diagnosis of the tumor.
Keywords: Renal cell carcinoma, Fumarate hydratase, Immunohistochemistry, Prognosis
延胡索酸水合酶缺陷型肾细胞癌(fumarate hydratase-deficient renal cell carcinoma,FH-RCC)是一种罕见的肾细胞癌,与延胡索酸水合酶(fumarate hydratase,FH)基因和遗传性平滑肌瘤及肾细胞癌(hereditary leiomyomatosis and renal cell carcinoma,HLRCC)综合征有关[1-2]。HLRCC综合征是由FH基因发生胚系突变引起的一种罕见常染色体显性遗传病[3],临床主要表现为皮肤平滑肌瘤、子宫肌瘤和肾细胞癌发病风险增加[4]。目前,HLRCC的确切发病率尚不清楚,以往文献报道了约300个HLRCC家庭[5]。HLRCC相关肾细胞癌不同于普通家族性肾细胞癌,其具有高度侵袭性,易局部进展及转移,患者预后不良[6]。基因检测到FH的胚系致病性突变是诊断HLRCC相关肾细胞癌的金标准,FH免疫组织化学染色是一种有效的辅助诊断方法[6]。近年来,FH-RCC组织学图谱的不断扩展增加了该病的诊断难度。因对FH-RCC的组织病理特征认识不充分,且缺乏大样本研究,使得诊断和管理HLRCC相关肾细胞癌有很大的挑战性。本研究对北京大学第一医院泌尿外科收治的109例乳头状肾细胞癌、集合管癌及未分类型肾细胞癌进行FH染色,筛选出11例FH-RCC,结合以往文献报道探讨FH-RCC的临床病理特点及预后。
1. 资料与方法
1.1. 患者资料
纳入北京大学第一医院泌尿外科2013年1月至2019年12月收治的病理诊断为Ⅱ型乳头状肾细胞癌、未分类型肾细胞癌及集合管癌患者,选取其中年龄≤60岁、经手术治疗且临床病理资料完整的患者共109例。收集患者的临床及病理资料,临床资料包括发病年龄、性别、个人史、家族史、临床表现等,病理资料包括肿瘤大小、组织学类型、肿瘤分级、病理分期、组织学生长方式及细胞学特点、区域淋巴结情况、免疫组织化学检查结果等。本研究获得北京大学第一医院生物医学研究伦理委员会批准。
1.2. 免疫组织化学检测方法
手术标本均经10%(体积分数)中性缓冲甲醛溶液固定,常规脱水、石蜡包埋,4 μm切片,常规苏木精-伊红(hematoxylin-eosin,HE)染色法染色。每例标本选取代表性蜡块,全组织切片,采用EnVision法进行FH(1 ∶500,J-13,Santa Cruz)免疫组织化学染色。其他一抗包括波形蛋白(vimentin,Vim)、细胞角蛋白7(cytokeratin 7, CK7)、碳酸酐酶Ⅸ(CA9)、CD10、CD117及TFE3,除FH外其他的一抗及工作液均购自北京中杉金桥生物技术有限公司。
1.3. FH免疫组织化学染色结果判定
以正常肾组织、血管、炎症细胞或其他基质细胞作为阳性内对照,若内对照阳性,而肿瘤细胞质中FH染色完全缺失,则被判定为真正的FH阴性,将此类肾细胞癌归类为FH-RCC,其他所有染色模式的细胞质着色都被认为是阳性。
1.4. 随访
电话随访FH-RCC患者的生存资料及其家族史。
2. 结果
2.1. 临床资料
本组FH染色后共筛选出11例FH阴性表达的患者,其中男性7例,女性4例,发病年龄16~53岁(平均年龄36.7岁),均为单发病例,6例位于左侧肾脏,5例位于右侧肾脏,肿瘤直径2.1~12.0 cm(平均8.83 cm)。患者中4例因腰痛就诊,2例因血尿就诊,5例于体检中发现肾占位就诊。10例患者行肾根治性切除术,1例患者行肾及输尿管全长切除术。4例女性患者均患有子宫肌瘤病史,2例男性患者有多年肾结石病史,1例男性患者有囊性肾瘤病史。1例女性患者的父亲因肾癌去世,所有患者均无皮肤平滑肌肿瘤的病史及家族史(表 1)。
表 1.
延胡索酸水合酶缺陷型肾细胞癌的临床特征
Clinical features of FH-RCC
| Patient No. | Gender | Age/ years | Presentation | Personal history | Family history | Tumor location | Distant metastasis | OS/month |
| FH-RCC, fumarate hydratase-deficient renal cell carcinoma; RCC, renal cell carcinoma; F, female; M, male; OS, overall survival; DOD, dead of disease. | ||||||||
| 1 | M | 39 | Flank pain | - | Uterine leiomyomas | Right | Liver, thoracic vertebrae | 11.3 |
| 2 | F | 35 | Physical examination | Uterine leiomyomas, adrenal cortical hyperplasia | Uterine leiomyomas | Left | Omentum | 12.5 |
| 3 | F | 26 | Flank pain | Uterine leiomyomas | RCC | Right | Bone | 13.2 |
| 4 | M | 34 | Physical examination | - | - | Left | Bone, diaphragm | 20.0 |
| 5 | M | 16 | Flank pain | - | Uterine leiomyomas | Left | - | 9.2 (DOD) |
| 6 | M | 53 | Physical examination | - | - | Right | Bone | 16.6 (DOD) |
| 7 | M | 37 | Physical examination | - | Uterine leiomyomas | Left | Rectum | 32.8 |
| 8 | F | 40 | Physical examination | Multiple uterine leiomyomas | Uterine leiomyomas | Left | - | 17.2 (DOD) |
| 9 | M | 48 | Hematuria | - | - | Left | Unkown | 17.2 (DOD) |
| 10 | F | 28 | Flank pain | Uterine leiomyomas | Uterine leiomyomas, colorectal carcinoma | Right | - | 31.5 (DOD) |
| 11 | M | 48 | Hematuria | Cystic nephroma | - | Right | - | 82.7 |
2.2. 病理学观察
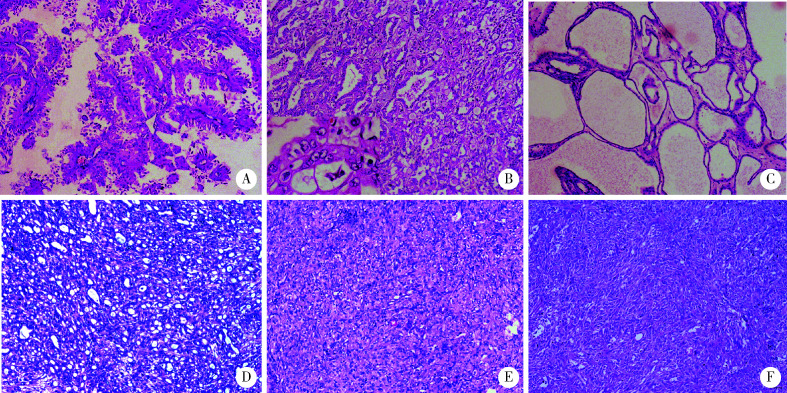
肿瘤肉眼切面大多为实性,灰白或多彩状,境界不清,侵袭性生长明显,部分病例可见明显囊状结构,组织形态学观察仅2例表现为单一的生长方式,其余9例均表现为乳头状、管囊状、实性片状等不同结构的混合性生长(表 2、图 1A~E),最常见为乳头状(9/11例,81.8%)及管状(8/11例,72.7%)结构,3例伴有肉瘤样分化(图 1F)。高倍显微镜观察,每例均可见灶状分布大而明显的嗜酸性核仁(WHO/国际泌尿病理协会Ⅲ~Ⅳ级)及核周空晕(图 1B)。9例FH-RCC可见肾窦或肾周脂肪侵犯,6例见肾静脉或下腔静脉内瘤栓形成,7例可见淋巴结转移,4例侵犯肾上腺,1例侵犯脾脏。
表 2.
延胡索酸水合酶缺陷型肾细胞癌的病理特征
Pathologic features of FH-RCC
| Patient No. | Size/cm | Initial histological type | Fuhrman grade | pTNM stage | Histological structures | |||
| Solid | Papillary | Tubulocystic | Cribriform | |||||
| FH-RCC, fumarate hydratase-deficient renal cell carcinoma; PRCC, papillary renal cell carcinoma; CDC, collecting duct carcinoma; U-RCC, unclassified renal cell carcinoma. | ||||||||
| 1 | 12.0 | PRCC Ⅱ | G3 | pT3aN1 | - | Yes | Yes | Yes |
| 2 | 6.5 | PRCC Ⅱ | G3 | pT3aN1 | - | Yes | Yes | - |
| 3 | 11.0 | PRCC Ⅱ | G3 | pT2b | - | Yes | Yes | - |
| 4 | 6.5 | PRCC Ⅱ | G3 | pT4N1 | Yes | Yes | - | - |
| 5 | 8.5 | PRCC Ⅱ | G3 | pT4N1 | - | Yes | - | - |
| 6 | 10.5 | CDC | G3 | pT4N1 | Yes | Yes | Yes | - |
| 7 | 12.0 | U-RCC | G4 | pT4N1 | Yes | Yes | Yes | Yes |
| 8 | 9.0 | U-RCC | G3 | pT3aN1 | - | Yes | Yes | Yes |
| 9 | 8.0 | PRCC Ⅱ | G3 | pT3bN2 | Yes | Yes | Yes | - |
| 10 | 11.0 | PRCC Ⅱ | G3 | T3a | - | Yes | Yes | - |
| 11 | 2.1 | CDC | G3 | pT1a | - | - | Yes | - |
图 1.
延胡索酸水合酶缺陷型肾细胞癌的组织病理学特点(HE ×40)
The histological features of fumarate hydratase-deficient renal cell carcinoma (HE ×40)
A, papillary structure, resembling type Ⅱ papillary renal cell carcinoma; B, tubular structure, resembling collecting duct carcinoma and high magnification shows eosinophilic (viral inclusion-like) macronucleoli with perinucleolar clearing (lower left, HE ×200); C, cystic structure; D, cribriform and tubular structure; E, solid structure; F, sarcomatoid area.
2.3. 免疫组织化学染色
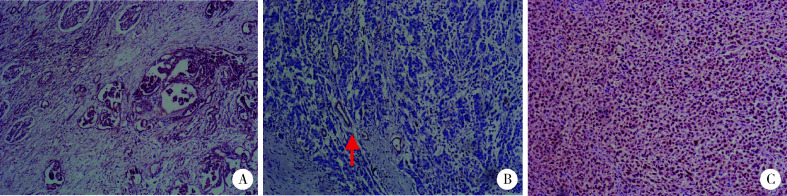
肿瘤组织大多CD10、CK7、CA9、TFE3阴性染色,个别病例癌细胞局灶阳性表达CD10(1例,9.1%)、CK7(2例,18.2%)、CA9(3例,27.3%)和TFE3(2例,18.2%),见图 2。2例TFE3蛋白阳性表达的病例经荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测,结果显示均未发生TFE3基因易位或扩增。
图 2.
免疫组织化学染色(×40)
Immunohistochemical staining (×40)
A, positive FH staining of non-FH-RCC (lower right) and normal kidney tissue (upper left); B, negative FH staining of FH-RCC and positive FH staining of residual normal renal tubules (arrow); C, diffuse strong positive staining of TFE3. FH, fumarate hydratase; FH-RCC, fumarate hydratase-deficient renal cell carcinoma.
2.4. 随访
11例患者均获得随访,随访时间11~82个月(平均随访时间35个月),总生存期9~82个月,平均生存期24个月,其中5例于术后9~31个月(平均19个月)因远处转移而死亡,6例存活患者中5例发生了远处转移,其中3例(3/5例)发生了骨转移,所有远处转移部位中,以骨转移最为常见(表 1)。
3. 讨论
HLRCC综合征是由FH基因发生胚系致病性突变而引起的常染色体显性遗传病[4]。HLRCC综合征患者的临床表现多样,主要表现有多发性皮肤平滑肌瘤,女性早发、多发性子宫肌瘤以及肾细胞癌发病风险增加[7]。FH基因突变携带者中,约75%发生皮肤平滑肌瘤,79%~100%的女性患有子宫肌瘤[8-9],约20%患有肾细胞癌[10]。
FH基因编码的延胡索酸水合酶是一种高度保守的蛋白质,在线粒体中参与三羧酸循环,催化延胡索酸与苹果酸之间的可逆反应。以往大多研究认为,HLRCC的发病机制与FH表达缺失引发的细胞内一系列的生化反应有关[11]。FH基因的双等位基因失活是HLRCC肿瘤细胞的遗传学特征[11],基因检测到肿瘤细胞存在FH致病性胚系突变是诊断HLRCC相关肾细胞癌的金标准。FH基因功能丧失性突变存在多种突变类型,其中错义突变最为常见,无义突变、插入或缺失、移码突变、剪接位点突变也都有报道,其4~7号外显子为突变热点区[12-13]。临床上,76%~100%的HLRCC综合征家庭检测到了FH基因的致病性突变[12-13],检测阴性的患者可能存在大片段的缺失或扩增[8]。对于基因检测阴性的患者,可以采用定量聚合酶链反应(quantitative polymerase chain reaction,Q-PCR)、多重连接探针扩增(multiplex ligation-dependent probe amplification,MLPA)等技术来揭示FH基因的拷贝数改变[14-15]。FH基因缺失引起延胡索酸水合酶表达下降,三羧酸循环受阻,底物延胡索酸表达上调。延胡索酸作为一种硫醇反应化合物,能够与半胱氨酸残基的巯基部分发生反应,在生理条件下产生2-琥珀酸-半胱氨酸(S-2-succino-cysteine,2SC),该反应被称为蛋白质的琥珀酸化[16]。肿瘤组织中,FH和2SC的免疫组织化学染色结果对诊断FH-RCC有临床价值[17-18],细胞质中FH缺乏和2SC高表达支持FH-RCC的诊断[6, 10]。
FH-RCC是因肿瘤细胞存在FH基因胚系或体系突变而导致FH蛋白表达缺失的一类特殊类型的肾细胞癌,两种原因引起的肾细胞癌在组织学形态上难以区分,用免疫组织化学染色的方式检测FH和2SC的表达来筛选FH-RCC有较高的特异性和敏感性,有文献报道,FH抗体的特异性高达100%,敏感性为87.5%,2SC的特异性和敏感性均为91.7%[19]。由于2SC的商用抗体尚未上市,本研究仅应用FH免疫组织化学检测筛选FH-RCC,因其特异性较高,筛选FH-RCC较为可靠,但因无法判断FH基因的突变类型,故而不能完全代替分子检测,只有分子检测能最终确诊HLRCC相关肾细胞癌。
HLRCC相关肾细胞癌为早发性肾细胞癌,中位发病年龄为40岁左右[15, 20-21],Hol等[22]报道了14例年龄在20岁以下的HLRCC相关肾细胞癌,约7%的病例在20岁之前得到确诊[10]。本研究选取60岁以内的肾细胞癌患者作为研究对象,FH-RCC患者的发病年龄为16~53岁,平均36.7岁,发病年龄低于无FH缺陷的肾细胞癌患者。HLRCC相关肾细胞癌患者的临床症状可与普通肾细胞癌相同,包括血尿、腰痛、腰腹痛、可扪及肿块等,但大多数患者诊断时无明显症状,并且不同于其他遗传性肾癌的是,HLRCC肾癌往往表现为孤立性单侧的肿块[23]。本组所有患者均表现为单侧孤立性肿块,所有女性患者均有子宫肌瘤病史,仅1例患者的一级亲属有肾细胞癌家族史,所有患者均无皮肤平滑肌肿瘤的病史及家族史。因此,对于患有平滑肌瘤的年轻女性肾细胞癌患者,临床应警惕遗传性肾细胞癌的可能。部分FH-RCC的诊断缺少临床证据,一方面可能是因为患有皮肤平滑肌瘤的部分HLRCC患者仅有微小的皮肤表现[8],容易被忽视; 另一方面可能是因为我国现阶段35岁以下的患者很少有兄弟姐妹,导致很难观察到患者一级亲属中的相关临床表现。因此,根据组织病理学特征,给予患者进一步的基因检测是最终确诊的关键步骤。
HLRCC相关肾细胞癌被2016版《WHO泌尿系统和男性生殖器官肿瘤分类》[24]新增为一类独立病种,该分类认为,HLRCC相关肾细胞癌与具有乳头状结构的肾细胞癌有关,肿瘤细胞内嗜酸性的大核仁及核仁外周空区是其较特异性的细胞学特征。但是,目前文献报道的FH-RCC的组织学图谱非常广泛,与Ⅱ型乳头状肾细胞癌、集合管癌[25]和差分化的管状囊性肾细胞癌[26]等都有重叠,透明细胞癌[27]、形态类似于琥珀酸脱氢酶缺乏性肾细胞癌的低级别嗜酸性肿瘤[28]也有部分病例被报道为FH-RCC,因此,诊断时需与上述肿瘤相鉴别,免疫组织化学检测对鉴别诊断有一定帮助,但目前关于FH-RCC的免疫表型结果报道较少,肿瘤细胞一般为CK7、TFE3阴性,PAX8、琥珀酸脱氢酶B(succinate dehydrogenase B, SDHB)阳性[14, 17]。本组病例中,CA9、CK7、TFE3大多阴性,个别病例局灶少许肿瘤细胞阳性表达CA9、CK7、TFE3。尽管有两例TFE3局灶阳性表达,但经FISH检测未发现TFE3基因易位或扩增,可能是由于表观遗传学或其他分子遗传学机制影响了TFE3蛋白表达,可排除Xp11.2易位/TFE3基因融合相关性肾细胞癌。
Patel等[7]总结并提出了HLRCC的临床诊断标准,可以将组织学证实的多发性皮肤平滑肌瘤作为主要标准,将孤立性平滑肌瘤、40岁前出现的Ⅱ型乳头状肾细胞癌以及女性40岁前临床表现严重的子宫肌瘤等作为次要标准,患者符合主要标准或符合不少于2条次要标准时,应怀疑其为HLRCC。Lehtonen等[13]还建议将集合管癌纳入HLRCC的诊断标准。本组将60岁以内的Ⅱ型乳头状肾癌及集合管癌患者纳入了研究,有14.3%(7/49例)的Ⅱ型乳头状肾癌、22.2%(2/9例)的集合管癌被诊断为FH-RCC。Ohe等[25]对51例先前诊断为集合管癌的病例进行了再次评估和诊断,其中13例(13/51例,25%)被重新诊断为FH-RCC,本研究与其报道的数据基本相符。FH-RCC多表现出两种或两种以上的生长模式[25],乳头型是最常见的结构,其他常见类型包括实性、管囊状、筛状型等,个别病例还可以观察到明显的肉瘤样及横纹肌样分化[18]。本组肿瘤中90.9%(10/11例)表现为乳头状、管囊状、实性片状等不同结构的混合性生长,乳头状和管囊状结构混合性生长方式是FH-RCC最常见的生长方式,对于此类患者应加强重视,警惕FH-RCC的可能。
FH-RCC具有高度的侵袭性,容易发生局部进展及远处转移[29],约一半的患者诊断时已发生转移[15],最常见的转移部位是腹部或胸部的淋巴结、骨和肝脏[30],多数患者在确诊后5年内死于转移性疾病[31]。Forde等[27]报道了23例HLRCC相关肾细胞癌,患者的平均生存期仅38个月。本组患者中多数(7/11例)于诊断时已发生淋巴结转移,随访时间11~82个月(平均随访时间35个月),平均生存期仅24个月,随访终止时,6例存活患者中的5例发生了远处转移和/或淋巴结转移,其中3例(3/5例)发生了骨转移,骨转移是最常见的远处转移部位,与既往文献报道结果大致相符。
FH-RCC的临床管理非常有挑战性。希佩尔-林道(von Hipple-Lindau, VHL)综合征等遗传性肾细胞癌的肿瘤生长相对缓慢,且易患双侧和多灶性肿瘤,因同步或异时性肾细胞癌可能需要多次治疗,保护肾功能是这类肿瘤患者的基本考虑因素,因此对于小于3 cm的小肾癌多采取保留肾单位的部分肾脏切除术[32]。HLRCC相关肾细胞癌通常是单侧孤立性肿瘤,即使是小的原发肿瘤,也可能发生早期转移,及时进行手术干预具有重要的预后意义,推荐宽切缘手术切除,并考虑进行腹膜后淋巴结清扫[10]。
目前,FH-RCC的系统药物治疗数据大多限于病例报道。一项评估贝伐珠(bevacizumab)单抗联合厄洛替尼(erlotinib)(AVATAR试验,NCT01130519)在治疗HLRCC相关肾细胞癌中的疗效和安全性的Ⅱ期临床试验正在进行,中期分析显示,其客观缓解率为65%,中位无进展生存期为24.2个月。基于这一试验结果,2018年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布了指南[33],推荐将贝伐珠单抗联合厄洛替尼用于治疗复发性或晚期HLRCC患者。近来,Choi等[30]报道了10例接受贝伐珠单抗及厄洛替尼联合治疗的进展期HLRCC相关肾细胞癌患者,客观缓解率为50%,中位无进展生存期和总生存期分别为13.3个月和14.1个月,因此推荐将该联合用药作为治疗HLRCC相关肾细胞癌的一线用药。本组患者全部进行了根治性肾切除术,1例患者进行了肾及输尿管全长切除术。两例患者在术后复发后,均采用了帕博丽珠(pembrolizuma)单抗及阿西替尼(axitinib)联合治疗,目前病情得到了控制。
FH突变携带者终生患肾细胞癌的风险为15%~20%[11],20岁之前患肾细胞癌的风险为1%~2%[10]。对患有HLRCC综合征患者的家庭成员应进行基因检测,存在FH突变的携带者应终身监测肾肿瘤。Patel等[7]建议FH突变携带者应从10岁左右开始,每年定期进行肾MRI监测,以便及时发现和治疗肾肿瘤。
综上,FH-RCC可能是HLRCC综合征的表现形式之一,也可能是FH基因发生体细胞突变引起的,该肿瘤虽具有一定的特征性形态学改变,但与多种肾细胞癌的组织学形态有重叠,应注意鉴别诊断。FH免疫组织化学染色有助于诊断FH-RCC,但确诊HLRCC综合征相关肾细胞癌仍需进行分子检测并对其家系进行系统调查。FH-RCC侵袭性强、易转移、预后差,针对HLRCC相关肾细胞癌的发病机制探索新的治疗方法,可能会为HLRCC患者带来曙光。
Funding Statement
北京大学第一医院科研种子基金(2020SF36)
Supported by the Scientific Research Seed Fund of Peking University First Hospital (2020SF36)
Contributor Information
何 群 (Qun HE), Email: bdyyqhe@sina.com.
李 学松 (Xue-song LI), Email: pineneedle@sina.com.
References
- 1.Pivovarcikova K, Martinek P, Grossmann P, et al. Fumarate hydratase deficient renal cell carcinoma: Chromosomal numerical aberration analysis of 12 cases. Ann Diagn Pathol. 2019;39:63–68. doi: 10.1016/j.anndiagpath.2019.02.008. [DOI] [PubMed] [Google Scholar]
- 2.周 婷婷, 邢 金春. FH基因在遗传性平滑肌瘤病及肾癌综合征中的研究进展. 医学综述. 2014;20(5):881–884. doi: 10.3969/j.issn.1006-2084.2014.05.037. [DOI] [Google Scholar]
- 3.Alam NA, Bevan S, Churchman M, et al. Localization of a gene (MCUL1) for multiple cutaneous leiomyomata and uterine fibroids to chromosome 1q42.3-q43. Am J Hum Genet. 2021;68(5):1264–1269. doi: 10.1086/320124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Tomlinson IP, Alam NA, Rowan AJ, et al. Germline mutations in FH predispose to dominantly inherited uterine fibroids, skin leiomyomata and papillary renal cell cancer. Nat Genet. 2002;30(4):406–410. doi: 10.1038/ng849. [DOI] [PubMed] [Google Scholar]
- 5.Hansen AW, Chayed Z, Pallesen K, et al. Hereditary leiomyomatosis and renal cell cancer. Acta Derm Venereol. 2020;100(1):adv00012. doi: 10.2340/00015555-3366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chen YB, Brannon AR, Toubaji A, et al. Hereditary leiomyomatosis and renal cell carcinoma syndrome-associated renal cancer: Recognition of the syndrome by pathologic features and the utility of detecting aberrant succination by immunohistochemistry. Am J Surg Pathol. 2014;38(5):627–637. doi: 10.1097/PAS.0000000000000163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Patel VM, Handler MZ, Schwartz RA, et al. Hereditary leiomyomatosis and renal cell cancer syndrome: An update and review. J Am Acad Dermatol. 2017;77(1):149–158. doi: 10.1016/j.jaad.2017.01.023. [DOI] [PubMed] [Google Scholar]
- 8.Alam NA, Barclay E, Rowan AJ, et al. Clinical features of multiple cutaneous and uterine leiomyomatosis: An underdiagnosed tumor syndrome. Arch Dermatol. 2005;141(2):199–206. doi: 10.1001/archderm.141.2.199. [DOI] [PubMed] [Google Scholar]
- 9.Wei MH, Toure O, Glenn GM, et al. Novel mutations in FH and expansion of the spectrum of phenotypes expressed in families with hereditary leiomyomatosis and renal cell cancer. J Med Genet. 2006;43(1):18–27. doi: 10.1136/jmg.2005.033506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Menko FH, Maher ER, Schmidt LS, et al. Hereditary leiomyomatosis and renal cell cancer (HLRCC): Renal cancer risk, surveillance and treatment. Fam Cancer. 2014;13(4):637–644. doi: 10.1007/s10689-014-9735-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Ooi A. Advances in hereditary leiomyomatosis and renal cell carcinoma (HLRCC) research. Semin Cancer Biol. 2020;61:158–166. doi: 10.1016/j.semcancer.2019.10.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Alam NA, Rowan AJ, Wortham NC, et al. Genetic and functional analyses of FH mutations in multiple cutaneous and uterine leiomyomatosis, hereditary leiomyomatosis and renal cancer, and fumarate hydratase deficiency. Hum Mol Genet. 2003;12(11):1241–1252. doi: 10.1093/hmg/ddg148. [DOI] [PubMed] [Google Scholar]
- 13.Lehtonen HJ. Hereditary leiomyomatosis and renal cell cancer: update on clinical and molecular characteristics. Fam Cancer. 2011;10(2):397–411. doi: 10.1007/s10689-011-9428-z. [DOI] [PubMed] [Google Scholar]
- 14.Lau HD, Chan E, Fan AC, et al. A clinicopathologic and mole-cular analysis of fumarate hydratase-deficient renal cell carcinoma in 32 patients. Am J Surg Pathol. 2020;44(1):98–110. doi: 10.1097/PAS.0000000000001372. [DOI] [PubMed] [Google Scholar]
- 15.Muller M, Ferlicot S, Guillaud-Bataille M, et al. Reassessing the clinical spectrum associated with hereditary leiomyomatosis and renal cell carcinoma syndrome in French FH mutation carriers. Clin Genet. 2017;92(6):606–615. doi: 10.1111/cge.13014. [DOI] [PubMed] [Google Scholar]
- 16.Alderson NL, Wang Y, Blatnik M, et al. S-(2-succinyl)cys-teine: A novel chemical modification of tissue proteins by a Krebs cycle intermediate. Arch Biochem Biophys. 2006;450(1):1–8. doi: 10.1016/j.abb.2006.03.005. [DOI] [PubMed] [Google Scholar]
- 17.Gupta S, Swanson AA, Chen Y, et al. Incidence of succinate dehydrogenase and fumarate hydratase-deficient renal cell carcinoma based on immunohistochemical screening with SDHA/SDHB and FH/2SC. Hum Pathol. 2019;91:114–122. doi: 10.1016/j.humpath.2019.07.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Trpkov K, Hes O, Agaimy A, et al. Fumarate hydratase-deficient renal cell carcinoma is strongly correlated with fumarate hydratase mutation and hereditary leiomyomatosis and renal cell carcinoma syndrome. Am J Surg Pathol. 2016;40(7):865–875. doi: 10.1097/PAS.0000000000000617. [DOI] [PubMed] [Google Scholar]
- 19.Muller M, Guillaud-Bataille M, Salleron J, et al. Pattern multiplicity and fumarate hydratase (FH)/S-(2-succino)-cysteine (2SC) staining but not eosinophilic nucleoli with perinucleolar halos differentiate hereditary leiomyomatosis and renal cell carcinoma-associated renal cell carcinomas from kidney tumors without FH gene alteration. Mod Pathol. 2018;31(6):974–983. doi: 10.1038/s41379-018-0017-7. [DOI] [PubMed] [Google Scholar]
- 20.Wong MH, Tan CS, Lee SC, et al. Potential genetic anticipation in hereditary leiomyomatosis-renal cell cancer (HLRCC) Fam Cancer. 2014;13(2):281–289. doi: 10.1007/s10689-014-9703-x. [DOI] [PubMed] [Google Scholar]
- 21.Toro JR, Nickerson ML, Wei MH, et al. Mutations in the fuma-rate hydratase gene cause hereditary leiomyomatosis and renal cell cancer in families in North America. Am J Hum Genet. 2003;73(1):95–106. doi: 10.1086/376435. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Hol JA, Jongmans MCJ, Littooij AS, et al. Renal cell carcinoma in young FH mutation carriers: case series and review of the literature. Fam Cancer. 2020;19(1):55–63. doi: 10.1007/s10689-019-00155-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Merino MJ, Torres-Cabala C, Pinto P, et al. The morphologic spectrum of kidney tumors in hereditary leiomyomatosis and renal cell carcinoma (HLRCC) syndrome. Am J Surg Pathol. 2007;31(10):1578–1585. doi: 10.1097/PAS.0b013e31804375b8. [DOI] [PubMed] [Google Scholar]
- 24.Moch H, Cubilla AL, Humphrey PA, et al. The 2016 WHO classification of tumours of the urinary system and male genital organs: part A: renal, penile, and testicular tumours. Eur Urol. 2016;70(1):93–105. doi: 10.1016/j.eururo.2016.02.029. [DOI] [PubMed] [Google Scholar]
- 25.Ohe C, Smith SC, Sirohi D, et al. Reappraisal of morphologic differences between renal medullary carcinoma, collecting duct carcinoma, and fumarate hydratase-deficient renal cell carcinoma. Am J Surg Pathol. 2018;42(3):279–292. doi: 10.1097/PAS.0000000000001000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Smith SC, Trpkov K, Chen YB, et al. Tubulocystic carcinoma of the kidney with poorly differentiated foci: A frequent morphologic pattern of fumarate hydratase-deficient renal cell carcinoma. Am J Surg Pathol. 2016;40(11):1457–1472. doi: 10.1097/PAS.0000000000000719. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Forde C, Lim D, Alwan Y, et al. Hereditary leiomyomatosis and renal cell cancer: Clinical, molecular, and screening features in a cohort of 185 affected individuals. Eur Urol Oncol. 2020;3(6):764–772. doi: 10.1016/j.euo.2019.11.002. [DOI] [PubMed] [Google Scholar]
- 28.Smith SC, Sirohi D, Ohe C, et al. A distinctive, low-grade oncocytic fumarate hydratase-deficient renal cell carcinoma, morpholo-gically reminiscent of succinate dehydrogenase-deficient renal cell carcinoma. Histopathology. 2017;71(1):42–52. doi: 10.1111/his.13183. [DOI] [PubMed] [Google Scholar]
- 29.Launonen V, Vierimaa O, Kiuru M, et al. Inherited susceptibility to uterine leiomyomas and renal cell cancer. Proc Natl Acad Sci USA. 2001;98(6):3387–3392. doi: 10.1073/pnas.051633798. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Choi Y, Keam B, Kim M, et al. Bevacizumab plus erlotinib combination therapy for advanced hereditary leiomyomatosis and renal cell carcinoma-associated renal cell carcinoma: A multicenter retrospective analysis in Korean patients. Cancer Res Treat. 2019;51(4):1549–1556. doi: 10.4143/crt.2019.086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Verine J, Pluvinage A, Bousquet G, et al. Hereditary renal cancer syndromes: An update of a systematic review. Eur Urol. 2010;58(5):701–710. doi: 10.1016/j.eururo.2010.08.031. [DOI] [PubMed] [Google Scholar]
- 32.Joly D, Mejean A, Correas JM, et al. Progress in nephron sparing therapy for renal cell carcinoma and von Hippel-Lindau disease. J Urol. 2011;185(6):2056–2060. doi: 10.1016/j.juro.2011.02.007. [DOI] [PubMed] [Google Scholar]
- 33.Benson AB, Venook AP, Al-Hawary MM, et al. Rectal cancer, version 2. 2018, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2018;16(7):874–901. doi: 10.6004/jnccn.2018.0061. [DOI] [PMC free article] [PubMed] [Google Scholar]