Abstract
目的
LAPTM4B-35是北京大学基础医学院发现和鉴定的一个肿瘤驱动基因LAPTM4B所编码的蛋白质同型分子(isoform)之一,其在多种恶性肿瘤中[如肝癌、肺癌(包括非小细胞肺癌和小细胞肺癌)、胃癌、结直肠癌、胰腺癌、胆囊癌、胆管癌、乳腺癌、前列腺癌、宫颈癌、子宫内膜癌等]均超高表达。实验室和临床资料均证明,LAPTM4B-35蛋白的过表达促进肿瘤生长、转移和多药耐药,LAPTM4B-35的蛋白表达水平与肝癌的复发相关。本文的目的在于鉴定患者体内的肝癌细胞和体外培养的肝癌细胞系是否释放出LAPTM4B-35蛋白到血液和细胞培养液中,以及其可能的存在形式,为建立肝细胞癌等肿瘤的血清学诊断新方法奠定基础。
方法
采用免疫印迹分析(Western blot)、酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)鉴定LAPTM4B-35蛋白,应用超滤和超离心方法从肝癌细胞培养上清液中分离、纯化外排体(exosome)。
结果
特异性抗体的ELISA结果表明,肝细胞癌患者的血液中存在LAPTM4B-35蛋白,体外培养的肝癌细胞以外排体形式释放LAPTM4B-35蛋白到培养基的上清液中。ELISA夹心法检测表明,肝细胞癌患者(n=43)血淸中LAPTM4B-35蛋白的平均水平和中位值均显著高于正常人(n=33)。
结论
肝癌细胞以外排体形式释放到其外环境中的LAPTM4B-35蛋白有望成为肝细胞癌血清学诊断的新标志物。
Keywords: 肝细胞癌; 外排体; LAPTM4B-35; 生物标记, 肿瘤
Abstract
Objective
LAPTM4B-35 protein is one of the isoforms that are encoded by a cancer driver gene, LAPTM4B. This gene was primarily found and identified in our lab of Peking University School of Basic Medical Sciences. The LAPTM4B-35 protein and its encoded mRNA are significantly over-expressed in a variety of cancers, such as hepatocellular carcinoma (HCC), lung cancers (including non small-cell lung cancer and small-cell lung cancer), stomach cancer, colorectal carcinoma, pancreatic cancer, gallbladder cancer, cholangiocarcinoma, breast cancer, prostate cancer, ovarian cancer, cervical cancer, endometrial cancer, and so on. It has firmly demonstrated through lab experiments either in vivo or in vitro, as well as clinical studies that the over-expression of LAPTM4B-35 can promote cancer growth, metastasis, and multidrug resistance. Specially, the expressive level of LAPTM4B-35 is associa-ted with recurrence of HCC. The aim of this study is to identify the release of LAPTM4B-35 protein from hepatocellular carcinoma into blood of HCC patients and into the medium of cultured HCC cells, and to identify its possible form of LAPTM4B-35 protein existed in blood and cell culture medium, as well as to explore the possibility of LAPTM4B-35 protein as a novel HCC biomarker for diagnosis of HCC and prognosis of HCC patients.
Methods
Immunobloting (Western blot) and enzyme-linked immunosorbent assay (ELISA) were used for identification of LAPTM4B-35 protein in the blood of HCC patients and normal individuals. Ultrafiltration and ultracentrifugation were used to isolate and purify exosomes from the culture medium of HCC cells.
Results
LAPTM4B-35 protein existed in the blood from HCC patients and normal donors that were demonstrated through Western blot and ELISA. LAPTM4B-35 was also released into the culture medium of HCC cells in the form of exosomes. Preliminary experiments showed that the average and the median of LAPTM4B-35 protein level in the blood of HCC patients (n=43) were both significantly higher than that in the blood of normal donors (n=33) through sandwich ELISA.
Conclusion
It is promising that the LAPTM4B-35 protein which is released from HCC cells in the form of exosomes into their extraenvironment may be exploited as a novel cancer biomarker for HCC serological diagnosis.
Keywords: Hepatocellular carcinoma; Exosomes; LAPTM4B-35; Biomarkers, tumor
LAPTM4B-35是北京大学基础医学院细胞生物学系肿瘤细胞分子生物学研究室发现、克隆并鉴定的一个新的人类LAPTM4B基因(NCBI GenBank NM-018407,Gene ID=55353)编码的蛋白质同型分子之一[1]。经免疫组织化学和免疫印迹分析(Wes-tern blot)表明,LAPTM4B-35蛋白分别在71.8% (51/71)和76.9% (50/65)的人肝癌组织中表达水平升高2倍以上,其表达水平与肝癌的恶性程度(病理分级)、转移和耐药性呈正相关,与患者的术后存活期呈负相关;多因素回归分析表明,LAPTM4B-35蛋白是肝癌的独立预后因子[2-3]。更有意义的是,LAPTM4B-35蛋白的过表达还与肝癌这一高复发肿瘤的复发率呈正相关[3]。可见,LAPTM4B-35蛋白可能是一个肝癌诊断、病情监测和预后判断的新标志物。我们的前期研究还表明,LAPTM4B-35蛋白的过表达可导致细胞的恶性转化和肿瘤生成[4-5],促进细胞的生长失控、迁移、侵袭潜能增强[6]和多药耐药[7]。通过RNA干扰(RNA interference, RNAi)敲低肿瘤内源性LAPTM4B基因及其编码的LAPTM4B-35蛋白可抑制裸鼠体内人肝细胞癌移植物的生长和转移[8],因此LAPTM4B-35蛋白可能是一个重要的肿瘤治疗新靶标。
很多肿瘤标志物的血清学检测是通过酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)方法进行的。ELISA所检测的血清抗原多为可溶性蛋白质,而LAPTM4B-35是一个4次穿膜的蛋白质[1],因结构中含4个疏水性的穿膜结构域而具有很强的亲脂性,用去垢剂处理细胞裂解液时,其存在于去垢剂相而非水相[9],因此,欲建立适用的血清学检测方法就需要了解其在血液中的存在形式。
近年的大量研究表明,脂类和蛋白质在细胞膜中并非均匀分布而是组装成不同成分、不同特性和不同功能的微区。细胞表面的膜微区经内化形成(胞)内体,进而或再循环至细胞表面,或形成晚期内体/多泡体,多泡体可与质膜融合而释放多泡体内的小膜泡到细胞外,如此释放的小膜泡称为外排体(exosome)。各种正常细胞和肿瘤细胞都释放多种由不同分子组成的外排体,因此可存在于血液、尿液、羊水、胸水和腹水中。各种外排体均具有一些共同的特性,如直径在30~100 nm、具有相同的密度和脂双层膜、具有共同的和细胞类型特异的蛋白质位于其膜中或腔内。在外排体膜中最普遍存在的是4次穿膜蛋白质[10-11]。外排体含有其来源细胞所特有的蛋白质,来自于肿瘤细胞的则含有肿瘤相关抗原,因而可用于肿瘤的诊断或作为肿瘤疫苗[12-18]。
本文通过ELISA和Western blot方法鉴定肝癌患者血清中和肝癌细胞的培养上清液中是否存在LAPTM4B-35蛋白,旨在探讨体内生长的恶性肿瘤细胞是否释放LAPTM4B-35抗原到血液中以及其在血液中的存在形式,为建立血清学定量检测诊断方法奠定基础,并探讨LAPTM4B-35蛋白作为肝癌诊断新标志物的应用价值。
1. 资料与方法
1.1. 材料
BEL-7402人肝细胞癌细胞系由本研究室保存,针对LAPTM4B-35蛋白两个表位的多抗(LAPTM4B-N10-pAb和LAPTM4B-EC2-pAb)由本研究室用钥孔血蓝蛋白(keyhole limpet hemocyanin, KLH)耦联的两个10肽抗原免疫兔制备抗血清,并经Protein A和抗原-亲和柱纯化为高亲和性的IgG。LAPTM4B-EC1-mAb由北京晶美生物技术公司制备,BSA-EC2-10肽抗原由中国科学院化学研究所合成及耦联。
肝癌组织(手术切除标本)和患者血清由中国人民解放军第302医院(现名中国人民解放军总医院第五医学中心)肝胆外科提供,新鲜组织于手术离体后立即放入液氮中冷冻,然后置-80 ℃冻存。
应用的仪器和试剂包括:100 ku MWCO Centriplus离心超滤管(Millipore公司)、96孔酶标板(Nunc公司)、DMEM培养基(Invitrogen公司)、新生牛血清(Biochrom,德国)、重水(美国CIL,国内分装)、考马斯亮蓝G250和R250(Sigma公司)、NC硝酸纤维素膜(Whatman公司)、ECL化学发光试剂盒(Pierce公司)、BCA蛋白定量试剂盒(Pierce公司)、Purified mouse anti-Integrin α5 MAb(BD公司)、Goat Anti-Rabbit IgG-HRP和Goat Anti-mouse IgG-HRP(Santa Cruz公司)。
细胞裂解液:Tris-Cl (pH 7.6) 10 mmol/L、NaCl 150 mmol/L、EDTA 1 mmol/L、0.5%(体积分数)NP40、PMSF 1 mmol/L、aprotinin 1 mg/L、Pepstatin A 1 mg/L。
ELISA包被缓冲液为0.05 mol/L碳酸盐缓冲液(pH 9.6),封闭液为含3%(体积分数)BSA的PBS溶液(pH 7.4),洗板液为含0.05%(体积分数)Tween-20的PBS溶液(pH 7.4),稀释液为含1%(体积分数)BSA的PBS溶液(pH 7.4),底物反应液为0.1 mol/L柠檬酸-磷酸盐缓冲液(pH 5.0),反应终止液为4 mol/L H2SO4。
1.2. 细胞培养
BEL-7402人肝细胞癌细胞用内含1%(质量分数)青霉素、链霉素,10%(体积分数)新生牛血清的DMEM培养基培养,置于37 ℃、5%(体积分数)CO2细胞培养箱中,细胞生长至对数期时收集细胞培养上清液。
1.3. 总蛋白的提取
1.3.1. 细胞总膜蛋白的提取
取长势良好的细胞,经PBS漂洗后,用0.25%(质量分数)粗胰酶消化,离心,弃去上清液,在细胞沉淀中加入适量预冷的含去垢剂的细胞裂解液,于1 200 W功率、冰浴中间断超声处理共2 min (实际超声1 min),然后置于冰浴中30~60 min。于12 000×g、4 ℃下离心15 min以去除细胞碎片,上清液中含细胞的总膜蛋白,冻存于-80 ℃备用。
1.3.2. 组织总膜蛋白的提取
将冻存的经组织病理确诊为肝细胞癌的肿瘤组织置于冰上,用剪刀剪成小碎块,挑取约0.1 g湿重组织放入手动玻璃匀浆器中,每管加入1 mL预冷的含去垢剂的细胞裂解液,于冰浴中充分匀浆,超声处理及之后的操作同上。
1.4. 外排体的分离与纯化
将收集的细胞培养上清液500 mL经300×g、4 ℃离心10 min,去除细胞取上清液;1 200×g、4 ℃离心10 min,去除死细胞,收集上清液;10 000×g、4 ℃离心20 min,去除细胞碎片,收集上清液。经100 ku MWCO Centriplus离心超滤管超滤浓缩(1 200×g、4 ℃离心45 min)得到10 mL浓缩液,将浓缩液均分为4份,每份用PBS溶液稀释补足至4 mL并混匀,然后移至5 mL超速离心管中,该管底铺有1 mL用重水配置的30%(质量分数)蔗糖垫,经100 000×g、4 ℃超速离心45 min,收集底部的液体1.5 mL,再连续两次使用PBS溶液稀释至5 mL,同等条件下超速离心,收集底部含外排体的沉积物,用PBS稀释至2.5 mL,作为外排体提取物置于-80 ℃保存备用[19]。
1.5. 外排体所含蛋白质的定量测定
使用Bradford法检测外排体的蛋白质浓度。
1.6. 分离蛋白质组分
取外排体悬液30 μL或同等蛋白质含量的BEL-7402细胞膜提取物,加入适量的4×上样缓冲液,100 ℃煮沸3 min,上样于10%(体积分数)的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)分离胶的顶部,电泳结束后进行考马斯亮蓝染色,脱色后使用凝胶成像系统扫描,并用Scion Image对凝胶图像进行分析。
1.7. Western blot分析
取肝癌患者血清5 μL、或正常人血清5 μL、或外排体悬液60 μL及同等蛋白质含量的肝癌组织膜提取物,于SDS-PAGE电泳后,将分离胶转移至硝酸纤维素膜。5%(质量分数)脱脂牛奶室温封闭2 h,加入anti-LAPTM4B-N10pAb或anti-Integrin α5 mAb作为一抗,分别按照体积比1 ∶1 000、1 ∶2 000稀释,4 ℃孵育过夜。分别加入Goat Anti-Rabbit IgG-HRP、Goat Anti-mouse IgG-HRP(体积比1 ∶3 000稀释)室温孵育1 h,最后用ECL化学发光试剂盒进行放射自显影并扫描结果。
1.8. ELISA直接法分析肝癌细胞释放的外排体及肝癌患者血清中的LAPTM4B-35蛋白
用包被液将BSA-EC2-10肽以体积比1 ∶1 000稀释(原液浓度为1 g/L),外排体提取物原液及肝癌患者血清按照体积比1 ∶10稀释(即原液10 μL,包被液90 μL)后包被酶标板,同时设置阴性对照组,4 ℃孵育过夜。用3%(体积分数)BSA于37 ℃封闭2 h后,加入LAPTM4B-EC2-pAb作为一抗(体积比1 ∶1 000稀释)37 ℃孵育1.5 h,加入Goat Anti-Rabbit IgG-HRP作为二抗(体积比1 ∶2 000稀释)37 ℃孵育40 min,其余步骤按照常规的直接法ELISA程序操作,但洗板时动作要轻柔,最后测定光密度(D492 nm)并分析结果。
1.9. ELISA夹心法分析正常人和原发性肝细胞癌患者血清中的LAPTM4B-35蛋白
以Anti-LAPTM4B-N10-pAb为捕获抗体包被酶标板(1 mg/L),置于4 ℃过夜,封闭2 h,常规洗板4次(用PBST洗3次,第4次用双蒸水洗,每孔300 μL,每次3 min),然后加入血清50 μL/孔,于37 ℃孵育2 h,洗板后加入检测抗体Anti-EC1-mAb(100 μL/孔),于37 ℃孵育1.5 h,洗板4次后加入新鲜配制的底物反应液(100 μL/孔),于37 ℃避光显色至空白D492 nm的读数值控制在1.0左右,用2 mol/L H2SO4终止反应,加50 μL/孔,震荡混匀,测定492 nm处光密度值(D492 nm)。
1.10. 统计学分析
采用SPSS 12.0软件进行统计学分析,计量资料以三次独立实验数据的均值±标准差表示,等级资料以中位数(最小值,最大值)表示,组间两两比较采用Student‘s t检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. 肝癌患者血液中LAPTM4B-35蛋白的鉴定
2.1.1. Western blot鉴定肝癌患者和正常人血清中的LAPTM4B-35蛋白
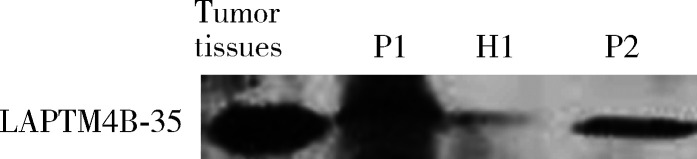
用自制、纯化的anti-LAPTM4B-N10pAb多抗对肝癌患者和正常人血清中的LAPTM4B-35蛋白进行Western blot分析,结果表明,不论是肝癌患者还是正常人血清中都含有LAPTM4B-35蛋白,肝癌患者血清中的LAPTM4B-35蛋白似乎高于正常人(图 1)。
图 1.
Western blot分析正常人与肝癌患者血清中LAPTM4B-35蛋白的表达
Western blot analysis of LAPTM4B-35 protein in serum of healthy individual and hepatocellular carcinoma patients
P1 and P2, serum from HCC patients; H1, serum from normal indivi-dual.
2.1.2. ELISA直接法鉴定肝癌患者血清中的LAPTM4B-35蛋白
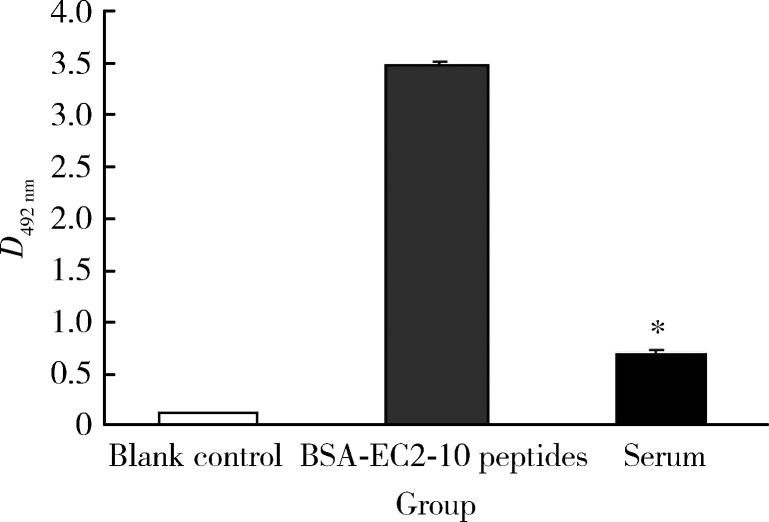
直接以肝癌患者的血清或化学合成的BSA-EC2-10肽多价抗原包被酶标板,用LAPTM4B-EC2-pAb多抗进行ELISA检测,与Wes-tern blot结果一致,ELISA直接法检测的肝癌患者血清中存在LAPTM4B-35抗原,且含量显著高于阴性对照组,两组差异有统计学意义(P < 0.001, 图 2)。但是,LAPTM4B-35含量低于BSA-EC2-10肽抗原的阳性对照组,其原因一方面可能由于外排体中含有多种蛋白质,LAPTM4B-35蛋白只占其中的一部分,而BSA-EC2-10肽是多价的纯抗原,故可与抗体结合的有效抗原浓度差别很大;另一方面可能由于血液中的LAPTM4B-35蛋白并非可溶性分子,而以外排体形式存在,以致其被酶标板表面吸附的效率和牢度不如可溶性的合成抗原短肽。
图 2.
ELISA直接法分析肝癌患者血清中LAPTM4B-35蛋白的表达
Direct ELISA analysis of LAPTM4B-35 protein in serum of hepatocellular carcinoma patients
* P < 0.001, serum group vs. blank control group.
2.2. 肝癌细胞培养上清液中的外排体蛋白质定量
根据标准曲线得出的公式: y=0.012 4x+0.085 3, 计算出肝癌细胞培养上清液的外排体提取物中蛋白质浓度约为0.969 0 g/L。
2.3. 肝癌细胞培养上清液中外排体的SDS-PAGE分析谱
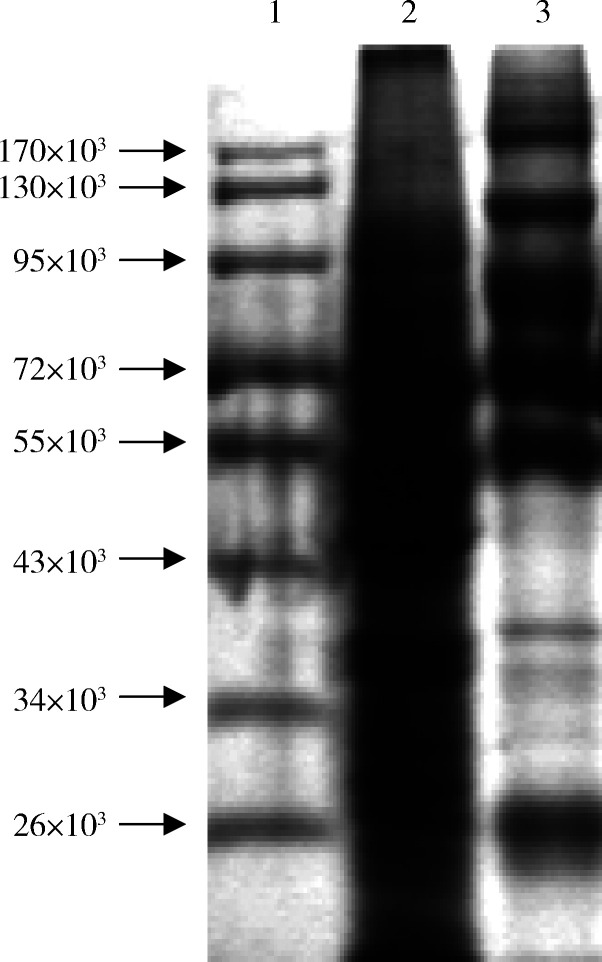
以SDS-PAGE分析肝癌细胞培养上清液中外排体的蛋白质组分,结果见图 3。在蛋白质总量相等的情况下,来源于BEL-7402肝癌细胞培养上清液的外排体蛋白质组分总体上比细胞膜总提取物的蛋白质组分简单,其中有的成分得到富集,有的成分有所减少,表明外排体中的蛋白质组分与细胞膜总提取物中的组分不同。
图 3.
SDS-PAGE分析BEL-7402肝癌细胞来源的外排体和细胞膜提取物中的蛋白质组分
SDS-PAGE profiles of cellular extracts and exosomes from BEL-7402 hepatocellular carcinoma cells
1, molecular marker; 2, cellular extracts; 3, exosomes.
2.4. 肝癌细胞培养上清液的外排体中所含LAPTM4B-35蛋白
采用Western blot分析LAPTM4B-35蛋白在肝癌组织膜提取物和BEL-7402肝癌细胞培养上清液来源的外排体中的表达,结果表明二者均存在LAPTM4B-35蛋白,其在肝癌组织膜提取物中的表达量高于外排体(图 4)。
图 4.
Western blot鉴定LAPTM4B-35蛋白在肝癌组织膜提取物和来源于BEL-7402肝癌细胞外排体中的表达
Western blot profiles of LAPTM4B-35 protein in membrance extracts from hepatocellular carcinoma tissues and exosomes from BEL-7402 hepatocellular carcinoma cells
1 and 2, tumor tissues; 3 and 4, exosomes.
2.5. ELISA检测肝癌细胞释放的外排体中的LAPTM4B-35蛋白
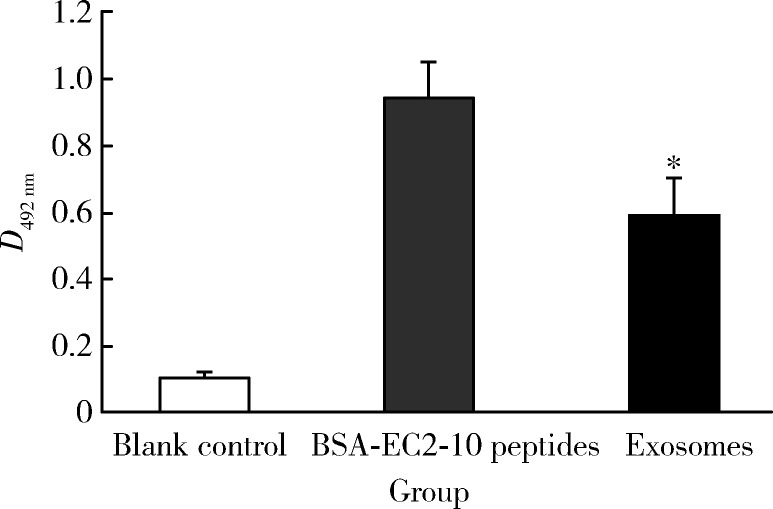
直接用外排体提取液或BSA-EC2-10肽包被96孔板,使用LAPTM4B-EC2-pAb进行检测,得到阳性结果,即外排体中含有LAPTM4B-35蛋白。BSA-EC2-10肽对照组的D492 nm为0.944 7±0.105 5,外排体组的D492 nm为0.594 3±0.111 1(空白对照组的D492 nm为0.106 0±0.015 5)。
外排体组的包被蛋白质总量远高于BSA-EC2-10肽组(10.0 ∶0.1 μg),但是前者的D492 nm值约为后者的2/3,一方面是因为在外排体中还含有LAPTM4B-35蛋白以外的其他蛋白质,另一方面是因为外排体以小囊泡的形式存在,不容易被96孔板吸附,而且在洗板时容易脱落。
图 5结果显示,ELISA直接法检测肝癌细胞释放的外排体中的LAPTM4B-35蛋白含量显著高于空白对照组,两组差异有统计学意义(P < 0.001)。
图 5.
ELISA直接法鉴定外排体中的LAPTM4B-35蛋白
LAPTM4B-35 protein in exosomes identified by direct ELISA
* P < 0.001, exosomes group vs. blank control group.
2.6. ELISA检测肝细胞癌患者和正常人血清中的LAPTM4B-35蛋白
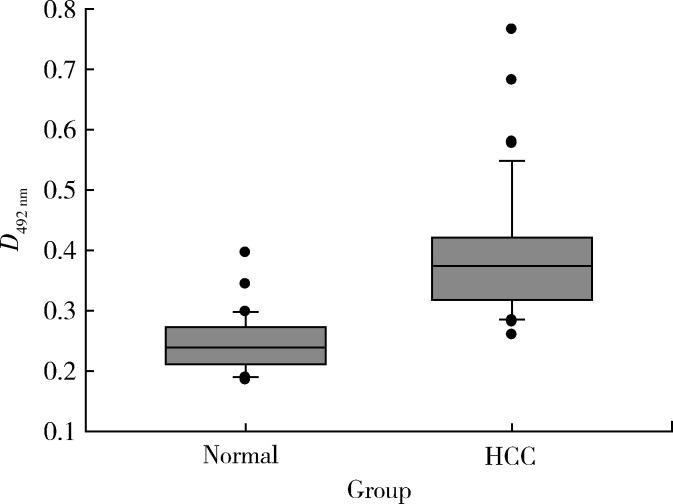
采用以Anti-LAPTM4B-N10-pAb为捕获抗体,以anti-EC1-mAb为检测抗体的ELISA双抗体夹心法检测33例正常人和43例肝细胞癌患者血清中的LAPTM4B-35蛋白,结果显示,肝癌患者血清中的LAPTM4B-35蛋白含量显著高于正常人,两组差异有统计学意义(图 6,P < 0.001)。
图 6.
ELISA夹心法检测正常人和肝癌患者血清中LAPTM4B-35蛋白水平
LAPTM4B-35 protein levels in serum from normal individuals and hepatocellular carcinoma patients detected by sandwich ELISA
P < 0.001, normal vs. HCC. Normal, normal individuals (n=33); HCC, hepatocellular carcinoma patients (n=43).
3. 讨论
在世界范围肝癌占肿瘤死亡的第4位或第5位,在中国为第3位,某些地区为第1位。每年全球肝癌新发病例84.1万,中国新发病例39.3万,占全球肝癌新发病例的46.7%,每年全球因肝癌死亡病例78.2万,中国为36.9万,占全球肝癌死亡病例的47.2%,而且发病年龄也趋于年轻化。肝癌的治愈率低而复发率高,严重威胁人们健康。肝癌治愈率低的主要原因之一是缺乏早期诊断和病情监测的灵敏指标。影像诊断的准确性高而灵敏度低,组织病理诊断是诊断的金标准但需要有创采得肿瘤组织。目前广泛采用的肝癌血清学标志物甲胎蛋白(alpha-fetoprotein, AFP)灵敏度高而特异性不够,其假阴性和假阳性率均为30%,因此,迫切需要探索新的肝癌诊断标志物。本研究室发现、克隆和鉴定的LAPTM4B基因编码的LAPTM4B-35蛋白在76.9%的肝癌组织中表达上调2倍以上,61.5%上调4倍以上,其表达水平与肝癌的恶性度、生长速度、转移、复发、多药耐药以及患者的术后存活期等均有良好相关性,而且是一个很好的独立预后因子和治疗靶标[20]。本文通过Western blot和ELISA法检测到肝癌细胞培养上清液中存在含LAPTM4B-35蛋白的外排体,两种方法都表明肝癌患者的血液中也存在LAPTM4B-35蛋白,鉴于其不溶于水的亲脂性,推测其存在形式可能也是外排体。
关于外排体的生物生成、释放和生物学活性以及在疾病诊断与治疗上的应用近年颇受重视,近年的相关研究数量很多。血液、尿液及各种分泌物中外排体的检测和应用已引起医学界关注,被认为在肿瘤诊断和治疗中有良好的应用前景,特别是在前列腺癌[13]、卵巢癌[14]和鼻咽癌[15]的诊断中。然而,由于外排体是不均一的小囊泡而非可溶性分子,而且整合在外排体中的膜分子存在方向性,在建立ELISA检测方法上难度较大。
本研究采用ELISA双抗体夹心法检测结果表明,肝癌患者血清中的LAPTM4B-35蛋白水平显著高于正常人,为建立适用于临床血清学诊断的方法奠定了基础。由于观察时间短,对于患者血清中的LAPTM4B-35蛋白水平与肿瘤复发、转移的关系尚难得出结论。应用这种检测方法诊断肝癌的特异性和灵敏度,以及与AFP相比的优劣情况,有待进行更大样本量的分析以得出结论。
2019年美国MyBio Source Inc.公司推出了检测LAPTM4B-35蛋白的ELISA试剂盒,德国明斯特(Münster)大学医院与武汉大学肝胆疾病研究院合作使用该试剂盒检测胰腺导管腺癌患者(169例)、慢性胰腺炎患者(40例)和正常人(30例)血清中LAPTM4B-35蛋白的水平,结果表明,LAPTM4B-35蛋白在胰腺导管腺癌的肿瘤组织和患者血清中的表达水平比正常人和慢性胰腺炎患者显著增加,且血液中LAPTM4B-35蛋白水平低的患者术后无复发存活期和总存活时间较长[21]。这项研究为采用ELISA方法检测血液中LAPTM4B-35蛋白水平的可行性和以其作为某些恶性肿瘤的诊断和预后标志物提供了进一步的佐证。
志谢
感谢中国医学科学院肿瘤医院肝胆外科吴健雄主任和刘立国医生、中国人民解放军第302医院(现名中国人民解放军总医院第五医学中心)肝胆外科刘振文主任和齐瑞兆医生以及北京大学肿瘤医院检验科张青云主任对本研究提供的帮助
Funding Statement
北京市教委“产学研”共建合作项目(ZH100010502)
Supported by the Beijing Municipal Education Commission ChanXueYan Build Cooperation Projects (ZH100010502)
References
- 1.Shao GZ, Zhou RL, Zhang QY, et al. Molecular cloning and characterization of LAPTM4B, a novel gene upregulated in hepatocellular carcinoma. Oncogene. 2003;22(32):5060–5069. doi: 10.1038/sj.onc.1206832. [DOI] [PubMed] [Google Scholar]
- 2.Yang H, Xiong FX, Lin M, et al. LAPTM4B-35 is a novel diagnostic marker and a prognostic factor of hepatocellular carcinoma. J Surgical Oncology. 2010;101(5):363–369. doi: 10.1002/jso.21489. [DOI] [PubMed] [Google Scholar]
- 3.Yang H, Xiong FX, Lin M, et al. LAPTM4B-35 overexpression is a risk factor for tumor recurrence and poor prognosis in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2010;136(2):275–281. doi: 10.1007/s00432-009-0659-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.何 静, 邵 根泽, 周 柔丽, et al. 肝癌中高表达的新基因LAPTM4B对细胞增殖及成瘤性的影响. 北京大学学报(医学版) 2003;35(4):348–352. doi: 10.3321/j.issn:1671-167X.2003.04.003. [DOI] [Google Scholar]
- 5.Li L, Shan Y, Yang H, et al. Upregulation of LAPTM4B-35 promotes malignant transformation and tumorigenesis in L02 human liver cell line. Anat Rec (Hoboken) 2011;294(7):1135–1142. doi: 10.1002/ar.21421. [DOI] [PubMed] [Google Scholar]
- 6.Liu XR, Xiong FX, Wei XH, et al. LAPTM4B-35, a novel tetratransmembrane protein and its PPRP motif play critical roles in proliferation and metastatic potential of HCC cells. Cancer Sci. 2009;100(12):2335–2340. doi: 10.1111/j.1349-7006.2009.01346.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Li L, Wei XH, Pan YP, et al. LAPTM4B: A novel cancer-asso-ciated gene motivates multi-drug resistance through efflux and activating PI3K/Akt signaling. Oncogene. 2010;29(43):5785–5795. doi: 10.1038/onc.2010.303. [DOI] [PubMed] [Google Scholar]
- 8.Yang H, Xiong FX, Wei XH, et al. LAPTM4B-35 promotes growth and metastasis of hepatocelluar carcinoma. Cancer Lett. 2010;264(2):209–217. doi: 10.1016/j.canlet.2010.02.006. [DOI] [PubMed] [Google Scholar]
- 9.刘 歆荣, 周 柔丽, 张 青云, et al. 人肝癌相关新基因编码产物LAPTM4B的鉴定及其生物学特性. 北京大学学报(医学版) 2003;35(4):340–347. doi: 10.3321/j.issn:1671-167X.2003.04.002. [DOI] [Google Scholar]
- 10.Keller S, Sanderson MP, Stoeck A, et al. Exosomes: from biogenesis and secretion to biological function. Immunol Lett. 2006;107(2):102–108. doi: 10.1016/j.imlet.2006.09.005. doi: 10.1016/j.imlet.2006.09.005. [DOI] [PubMed] [Google Scholar]
- 11.Simons M, Raposo G. Exosomes: vesicular carriers for intercellular communication. Curr Opin Cell Biol. 2009;21(4):575–581. doi: 10.1016/j.ceb.2009.03.007. [DOI] [PubMed] [Google Scholar]
- 12.Simpson RJ. Exosomes: proteomic insights and diagnostic potential. Expert Rev Proteomics. 2009;6(3):267–283. doi: 10.1586/epr.09.17. [DOI] [PubMed] [Google Scholar]
- 13.Mitchell PJ, Welton J, Staffurth J. Can urinary exosomes act as treatment response markers in prostate cancer? J Transl Med. 2009;7:4. doi: 10.1186/1479-5876-7-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Nilsson J, Skog J, Nordstrand A, et al. Prostate cancer-derived urine exosomes: a novel approach to biomarkers for prostate cancer. Br J Cancer. 2009;100(10):1603–1607. doi: 10.1038/sj.bjc.6605058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Théry C, Amigorena S, Raposo G, et al. Isolation and characte-rization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. 2006;Chapter 3:Unit 3.22. doi: 10.1002/0471143030.cb0322s30. [DOI] [PubMed] [Google Scholar]
- 16.Navabi H, Croston D, Hobot J, et al. Preperation of human ova-rian cancer ascites-derived exosomes for a clinical trial. Blood Cells Mol Dis. 2005;35(2):149–152. doi: 10.1016/j.bcmd.2005.06.008. [DOI] [PubMed] [Google Scholar]
- 17.Houali K, Wang X, Shimizu Y, et al. A new diagnostic marker for secreted Epstein-Barr virus encoded LMP1 and BARF1, oncoproteins in the serum and saliva of patients with nasopharyn-geal carcinoma. Clin Cancer Res. 2007;13(17):4993–5000. doi: 10.1158/1078-0432.CCR-06-2945. [DOI] [PubMed] [Google Scholar]
- 18.Viaud S, Théry C, Ploix S, et al. Dendritic cell-derived exosomes for cancer immunotherapy: what's next? Cancer Res. 2010;70(4):1281–1285. doi: 10.1158/0008-5472.CAN-09-3276. [DOI] [PubMed] [Google Scholar]
- 19.Koga K, Matsumoto K, Akiyoshi T, et al. Purification, characte-rization and biological significance of tumor-derived exosomes. Anticancer Res. 2005;25(6A):3703–3707. [PubMed] [Google Scholar]
- 20.Zhou RL. LAPTM4B: a novel diagnostic biomarker and therapeutic target for hepatocellular carcinoma [M]// Wan-Yee Lau. Hepatocellular carcinoma: Basic research. Philippines: InTech Press, 2012: 1-34.
- 21.Yang Z, Senninger N, Flammang I, et al. Clinical impact of circulating LAPTM4B-35 in pancreatic ductal adenocarcinoma. J Cancer Res Clin Oncol. 2019;145(5):1165–1178. doi: 10.1007/s00432-019-02863-w. [DOI] [PMC free article] [PubMed] [Google Scholar]