Abstract
目的
探讨Ki-67、Cyclin D1、P53和P16在成都地区有辛辣饮食习惯的白斑(OLK)及OLK癌变患者中的表达。
方法
将成都地区有辛辣饮食习惯的30例OLK患者和无辛辣饮食习惯的15例OLK患者,分别分成OLK不伴上皮异常增生(OLK−)、OLK伴轻-中度上皮异常增生(OLK+)、OLK伴重度上皮异常增生或癌变(OLK++/OSCC)3组,采用免疫组化检测Ki-67、Cyclin D1、P53和P16在各组的表达,并对结果进行统计分析。
结果
在有/无辛辣饮食习惯的OLK及癌变患者中,Ki-67和P53在OLK+组和OLK++/OSCC组的表达高于OLK−组(P<0.05),Cyclin D1在OLK++/OSCC组的表达高于OLK−组(P<0.05),P16在OLK++/OSCC组的表达低于OLK−组(P<0.05)。Ki-67、Cyclin D1、P53、P16在有和无辛辣饮食习惯的OLK患者中的表达差异无统计学意义(P>0.05)。Ki-67与Cyclin D1的表达成正相关(r=0.439,P=0.015)。
结论
辛辣饮食习惯对OLK及癌变患者Ki-67、Cyclin D1、P53和P16的表达无影响,但是Ki-67、Cyclin D1和P53表达随OLK病变的进展而升高,P16表达随病变进展而降低。
Keywords: 辛辣饮食, 口腔白斑, 癌变, 口腔黏膜潜在恶性疾患
Abstract
Objective
To investigate the expression of Ki-67, Cyclin D1, P53, and P16 in patients with oral leukoplakia (OLK) and OLK cancerization who have aspicy diet in Chengdu.
Methods
Thirtypatients with OLK andspicy diet and 15 patients with OLK without spicy diet in Chengdu were divided into three groups: hyperplastic OLK (OLK−), OLK with mild to moderate dysplasia (OLK+), and severe dysplastic OLK or oral squamous cell carcinoma (OSCC) transforming from OLK (OLK++/OSCC). The expression of Ki-67, Cyclin D1, P53, and P16 were detected by immunohistochemistry and statistically analyzed.
Results
The expression of Ki-67 and P53 in patients with or without spicy diet in the OLK+and OLK++/OSCC groups were stronger than that of the OLK− group (P<0.05). The OLK++/OSCC group showed a higher expression of Cyclin D1 and lower expression of P16 than the OLK− group (P<0.05). The expression of Ki-67, Cyclin D1, P53, and P16 in patients with spicy diet and without spicy diet had no substantial difference. The expression of Ki-67 and Cyclin D1 showed a positive correlation (r=0.439, P=0.015).
Conclusion
Spicy diet did not have an influence on the expression of Ki-67, Cyclin D1, P53, and P16 in patients with OLK and OSCC. The expression of Ki-67, Cyclin D1, and P53 increased with the development of OLK, whereas P16 showed opposite expression trend.
Keywords: spicy diet, oral leukoplakia, cancerization, oral potentially malignant disorders
口腔白斑(oral leukoplakia,OLK)是指发生在口腔黏膜上的不能被擦掉的白色斑块,经临床和病理学检测不能诊断为其他任何疾病者。OLK属于口腔黏膜潜在恶性疾患[1],有3%~5%的OLK可发展为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC),其转变为OSCC的风险比正常人高50~100倍,平均癌变病程达8.2年[2]–[3]。因此,OLK恶变潜能的评价及早期干预对OSCC的预防有重要意义。
由于气候、文化等自然和社会因素的影响,成都地区人群喜食辛辣食物[4]。近年来,随着人们对“饮食对健康的影响”关注度的提高,辛辣饮食在OLK癌变过程中的作用逐渐引起人们的关注。目前关于辛辣饮食在肿瘤发生发展中的作用仍有较大争议。部分研究[5]认为食用辛辣刺激性食物是导致上消化道癌变的主要诱因之一,部分研究[6]认为辛辣饮食是肿瘤发生发展的保护因素,还有研究[7]认为辛辣饮食与肿瘤发生发展之间无明显相关性。但是,关于辛辣食物与OLK癌变的相关关系目前尚无研究[8]。在OLK治疗上,要求患者清淡饮食,消除刺激性食物对口腔黏膜的刺激,提示辛辣饮食对OLK癌变可能有促进作用。因此,本研究通过检测Ki-67、Cyclin D1、P53和P16在有辛辣饮食习惯的成都地区OLK及癌变患者中的表达,分析其与临床病理参数的关系,旨在探讨分子标记物在早期预测有辛辣饮食习惯OLK患者癌变过程中的意义。
1. 材料和方法
1.1. 材料
1.1.1. 标本来源
收集整理2016年1—12月四川大学华西口腔医院病理科存档的45例患者的OLK蜡块。实验组为有辛辣饮食习惯的OLK及癌变患者(30例),其中OLK不伴上皮异常增生(OLK−)、OLK伴轻-中度上皮异常增生(OLK+)、OLK伴重度上皮异常增生或癌变(OLK++/OSCC)患者各10例;纳入标准:成都地区,临床和组织病理活检均诊断为口腔黏膜OLK,每周至少有3 d吃辣且持续5年以上,术前未行放化疗。对照组为无辛辣饮食习惯的OLK及癌变患者(15例),其中OLK−组、OLK+组、OLK++/OSCC组各5例;纳入标准要求患者每月至多1 d吃辣,即无辛辣饮食习惯,其他同实验组。所有切片均由2位经验丰富的副主任医师职称以上的病理科医师重新阅片确认。
1.1.2. 试剂
鼠抗人Ki-67单克隆抗体(1∶800)、兔抗人Cyclin D1单克隆抗体(1∶100)、鼠抗人P53单克隆抗体(1∶800)、鼠抗人P16单克隆抗体(1∶200)(福州迈新生物技术开发有限公司),二抗及DAB显色试剂盒(徕卡生物系统上海贸易有限公司)。
1.2. 实验方法
使用Leica BOND-MAX全自动免疫组化染色仪对标本进行Ki-67、Cyclin D1、P53、P16单克隆抗体染色。用已知阳性的标本做阳性对照,磷酸盐缓冲液代替一抗做阴性对照。
由2位病理专家双盲独立阅片,每例组织切片在显微镜下随机选取5个高倍视野(× 400)。Ki-67、Cyclin D1和P53阳性表达于胞核,呈棕黄色反应;P16阳性主要定位于胞浆,少部分位于胞核,呈棕黄色颗粒。
阳性结果判定采用半定量积分法。1)首先对染色程度进行评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;2)再按阳性细胞所占百分比评分:≤5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;3)染色程度评分与阳性细胞所占百分比评分相乘即为总积分,<1分为阴性,≥1分为阳性。
1.3. 统计学分析
采用SPSS 21.0软件进行统计分析。计数资料以例数(n)和百分数(%)表示,采用卡方检验或Fisher四格表确切概率法进行检验,相关性分析采用Spearman等级相关分析,双侧P<0.05认为差异有统计学意义。
2. 结果
2.1. 有/无辛辣饮食习惯的OLK及癌变患者的临床基本资料分析
有/无辛辣饮食习惯的OLK及癌变患者的临床基本资料情况见表1。统计分析表明,性别、年龄、发病部位等参数在有/无辛辣饮食习惯的OLK−组、OLK+组和OLK++/OSCC组之间的差异均无统计学意义(P>0.05,表1)。
表 1. 有/无辛辣饮食习惯的OLK及癌变患者的临床基本资料.
Tab 1 Basic clinical data analysis of OLK and cancerous patients with or without spicy diet
| 项目 | n/% | 有辛辣饮食习惯 |
无辛辣饮食习惯 |
||||||||
| OLK− | OLK+ | OLK++/OSCC | χ2值 | P值 | OLK− | OLK+ | OLK++/OSCC | χ2值 | P值 | ||
| 性别 | 4.946 | 0.103 | 2.184 | 0.500 | |||||||
| 男 | 23/51.1 | 4 | 7 | 2 | 4 | 2 | 4 | ||||
| 女 | 22/48.9 | 6 | 3 | 8 | 1 | 3 | 1 | ||||
| 年龄/岁 | 1.861 | 0.534 | 3.482 | 0.301 | |||||||
| ≥60 | 23/51.1 | 4 | 5 | 7 | 1 | 4 | 2 | ||||
| <60 | 22/48.9 | 6 | 5 | 3 | 4 | 1 | 3 | ||||
| 部位 | 3.345 | 0.272 | 4.017 | 0.251 | |||||||
| 舌部口底 | 21/46.7 | 3 | 7 | 6 | 0 | 3 | 2 | ||||
| 颊部 | 24/53.3 | 7 | 3 | 4 | 5 | 2 | 3 | ||||
2.2. Ki-67、Cyclin D1、P53和P16在有/无辛辣饮食习惯的OLK及癌变患者中的表达
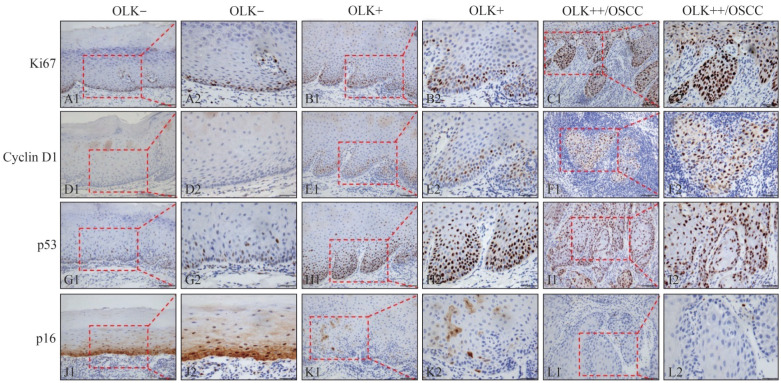
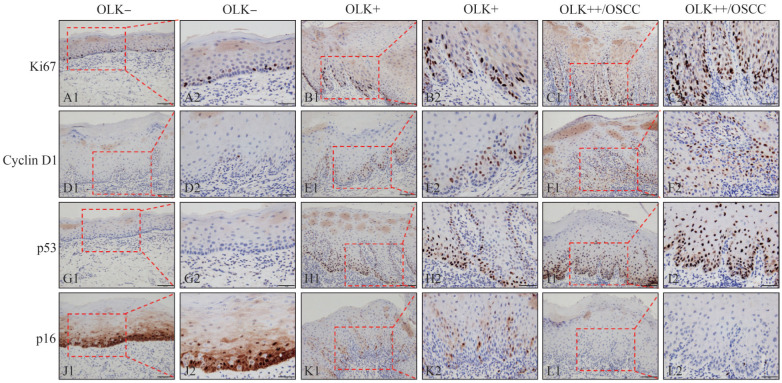
不论有/无辛辣饮食习惯患者,Ki-67在OLK−组均以阴性表达为主,少量阳性细胞主要集中在基底副基底层;在OLK+组和OLK++/OSCC组均以阳性表达为主,阳性细胞扩散至棘层且弥漫性分布,即基底上层模式(图1、2)。统计分析(表2)表明,在有辛辣饮食习惯患者中,Ki-67在OLK+组和OLK++/OSCC组的表达高于OLK−组(P<0.05),但OLK+组和OLK++/OSCC组之间差异无统计学意义(P>0.05);在无辛辣饮食习惯患者中,Ki-67各组间的表达差异与无辛辣饮食习惯患者一致。Ki-67表达在有/无辛辣饮食习惯的OLK各组之间的差异无统计学意义(P>0.05,表2)。
图 1. Ki-67、Cyclin D1、P53和P16在有辛辣饮食习惯的OLK各组中的表达 免疫组织化学.
Fig 1 Expression of Ki-67, Cyclin D1, P53 and P16 in every group with spicy diet immunohistochemistry
A1~L1:× 200;A2~L2:× 400。A2~L2为A1~L1方框内的放大。
图 2. Ki-67、Cyclin D1、P53和P16在无辛辣饮食习惯的OLK各组中的表达 免疫组织化学.
Fig 2 Expression of Ki-67, Cyclin D1, P53 and P16 in every group without spicy diet immunohistochemistry
A1~L1:× 200;A2~L2:× 400。A2~L2为A1~L1方框内的放大。
表 2. Ki-67、Cyclin D1、P53和P16在有/无辛辣饮食习惯的OLK各组中免疫组织化学染色结果.
Tab 2 Immunohistochemistry staining results of Ki-67, Cyclin D1, P53 and P16 in every group with or without spicy diet
| 项目 | 有辛辣饮食习惯 |
无辛辣饮食习惯 |
||||
| - | + | P值 | - | + | P值 | |
| Ki-67 | ||||||
| OLK−组 | 1 | 9 | <0.05 a | 1 | 4 | <0.05 a |
| OLK+组 | 0 | 10 | >0.05b | 0 | 5 | >0.05b |
| OLK++/OSCC组 | 0 | 10 | <0.05c | 0 | 5 | <0.05c |
| Cyclin D1 | ||||||
| OLK−组 | 3 | 7 | >0.05 a | 2 | 3 | >0.05 a |
| OLK+组 | 1 | 9 | >0.05b | 1 | 4 | >0.05b |
| OLK++/OSCC组 | 0 | 10 | <0.05c | 0 | 5 | <0.05c |
| P53 | ||||||
| OLK−组 | 1 | 9 | <0.05 a | 0 | 5 | <0.05 a |
| OLK+组 | 2 | 8 | >0.05b | 1 | 4 | >0.05b |
| OLK++/OSCC组 | 2 | 8 | <0.05c | 1 | 4 | <0.05c |
| P16 | ||||||
| OLK−组 | 1 | 9 | >0.05 a | 1 | 4 | >0.05 a |
| OLK+组 | 5 | 5 | >0.05b | 2 | 3 | >0.05b |
| OLK++/OSCC组 | 7 | 3 | <0.05c | 4 | 1 | <0.05c |
注:a为OLK−组与OLK+组比较,b为OLK+组与OLK++/OSCC组进行比较,c为OLK−组与OLK++/OSCC组比较。
不论有/无辛辣饮食习惯患者,Cyclin D1在OLK−组表达均较弱,OLK+组表达稍有增强,在OLK++/OSCC组大都呈强阳性着色(图1、2)。统计分析(表2)表明,在有辛辣饮食习惯患者中,Cyclin D1在OLK++/OSCC组的表达高于OLK−组(P<0.05),但其余组间的差异无统计学意义(P>0.05);在无辛辣饮食习惯患者中,Cyclin D1各组间的表达差异与有辛辣饮食习惯患者一致。Cyclin D1表达在有/无辛辣饮食习惯的OLK各组之间的差异无统计学意义(P>0.05,表2)。
不论有/无辛辣饮食习惯患者,P53在OLK−组均呈弱阴性表达,而在OLK+组和OLK++/OSCC组均呈强阳性着色(图1)。统计分析(表2)表明,在有辛辣饮食习惯患者中,P53在OLK+组和OLK++/OSCC组的表达高于OLK−组(P<0.05),但OLK+组和OLK++/OSCC组之间的差异无统计学意义(P>0.05);在无辛辣饮食习惯患者中,P53各组间的表达差异与伴有辛辣饮食习惯患者一致。P53表达在有/无辛辣饮食习惯的OLK各组之间的差异无统计学意义(P>0.05,表2)。
不论有/无辛辣饮食习惯患者,P16在OLK−组阳性表达均较强,棕黄色颗粒在基底副基底层弥散分布,甚至可达棘层;而在OLK+组和OLK++/OSCC组表达呈减弱趋势,尤其OLK++/OSCC组以阴性表达为主(图1)。统计分析(表2)表明,在有辛辣饮食习惯患者中,P16在OLK++/OSCC组的表达低于OLK−组(P=0.048),其余组别间的差异无统计学意义(P>0.05);在无辛辣饮食习惯患者中,P16各组间的表达差异与伴有辛辣饮食习惯患者一致。P16表达在有/无辛辣饮食习惯的OLK各组之间的差异无统计学意义(P>0.05,表2)。
2.3. Ki-67、Cyclin D1、P53和P16的表达与有辛辣饮食习惯的OLK及癌变患者临床病理资料的关系
由于Ki-67、Cyclin D1、P53和P16的表达在有和无辛辣饮食习惯的OLK患者中无差异,因此,仅对有辛辣饮食习惯的OLK及癌变患者进行分析。
Ki-67、Cyclin D1、P53、P16的表达与有辛辣饮食习惯的OLK及癌变患者临床病理资料的关系见表3。统计分析表明,Ki-67、Cyclin D1、P53和P16的表达在不同性别、年龄、发病部位之间的差异均无统计学意义(P>0.05)。
表 3. Ki-67、Cyclin D1、P53、P16的表达与有辛辣饮食习惯的OLK及癌变患者临床病理资料的关系.
Tab 3 The relationship between the expression of Ki-67, Cyclin D1, P53, P16 and the clinicopathological data of OLK and cancerous patients with spicy diet
| 项目 | n | Ki-67 |
Cyclin D1 |
P53 |
P16 |
||||||||
| 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | ||
| 性别 | 1.000 | 1.000 | 0.355 | 1.000 | |||||||||
| 男 | 13 | 13 | 0 | 11 | 2 | 12 | 1 | 7 | 6 | ||||
| 女 | 17 | 16 | 1 | 15 | 2 | 13 | 4 | 10 | 7 | ||||
| 年龄/岁 | 0.467 | 0.315 | 1.000 | 1.000 | |||||||||
| ≥60 | 16 | 16 | 0 | 15 | 1 | 13 | 3 | 9 | 7 | ||||
| <60 | 14 | 13 | 1 | 11 | 3 | 12 | 2 | 8 | 6 | ||||
| 部位 | 0.467 | 0.602 | 1.000 | 0.484 | |||||||||
| 舌部口底 | 16 | 16 | 0 | 13 | 3 | 13 | 3 | 8 | 8 | ||||
| 颊部 | 14 | 13 | 1 | 13 | 1 | 12 | 2 | 9 | 5 | ||||
2.4. Ki-67、Cyclin D1、P53和P16在有辛辣饮食习惯的OLK及癌变患者中表达的相关性
Spearman等级相关分析(表4)表明,有辛辣饮食习惯的OLK及癌变患者中Ki-67的表达与Cyclin D1成正相关(r=0.439,P=0.015);其余分子标记物之间的表达无相关性(P>0.05)。
表 4. Ki-67、Cyclin D1、P53和P16在有辛辣饮食习惯的OLK及癌变患者中表达的相关性.
Tab 4 Correlation of Ki-67, Cyclin D1, P53 and P16 expression of OLK and cancerous patients with spicy diet
| 项目 | Ki-67 |
Cyclin D1 |
P53 |
P16 |
||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| Ki-67 | - | - | 0.439 | 0.015 | 0.182 | 0.337 | -0.187 | 0.322 |
| Cyclin D1 | 0.439 | 0.015 | - | - | 0.291 | 0.119 | -0.264 | 0.159 |
| P53 | 0.182 | 0.337 | 0.291 | 0.119 | - | - | -0.119 | 0.530 |
| P16 | -0.187 | 0.322 | -0.264 | 0.159 | -0.119 | 0.530 | - | - |
3. 讨论
Ki-67表达随异常增生程度的加重而呈上升趋势,因此被广泛用作细胞增殖标记物[9]–[10]。在正常口腔黏膜和良性病变中,Ki-67微弱表达于基底层细胞,提示其具有一定的分裂增殖能力;在分化较好的肿瘤中,Ki-67阳性表达于癌巢周边;在低分化肿瘤中Ki-67呈强阳性表达,且着色弥散分布[11]。在本研究中,Ki-67在OLK+组和OLK++/OSCC组的表达显著高于OLK−组,与既往研究结果一致。但在本研究中OLK+组和OLK++/OSCC组之间的差异无统计学意义,可能原因为OLK+组和OLK++/OSCC组的定义受主观因素影响较大,不同研究对异常增生程度的判定可能有所区别;此外,大多数研究分组为OLK组、OLK伴上皮异常增生组和OSCC组,缺乏异常增生和OSCC之间的过渡状态,使Ki-67在两组间的表达差异较明显,而本研究在分组上更呈现出OLK癌变的一个动态的连续性过程。
Cyclin D1的过表达可加速细胞从G1期到S期的转换,致细胞增殖失控而恶性化,目前已在多种肿瘤中发现Cyclin D1的过表达[12]–[13]。姜倩[3]研究发现,Cyclin D1在正常黏膜、单纯增生型OLK、异常增生型OLK和OSCC中的表达呈动态变化,阳性率分别为20.00%、58.33%、72.22%和81.08%(P<0.05),提示随着OLK进展,细胞的增殖活性显著增强。在本研究中,Cyclin D1在OLK++/OSCC组的表达高于OLK−组,与Cyclin D1的作用机制及既往研究一致;但OLK+组和其余两组间的差异均无统计学意义。总体而言,Cyclin D1的表达随其恶性程度升高而升高。
P53基因是迄今为止发现的与人类肿瘤相关性最高的抑癌基因。P53基因有野生型和突变型两种,野生型P53在诱导细胞凋亡、抑制细胞恶性增殖中起重要作用,而突变型P53的产物不仅结构发生改变,稳定性增强,失去抑癌作用,还能促进细胞的恶性转化,有利于肿瘤发生[14]–[15]。李群等[16]研究发现,P53在正常黏膜、单纯增生OLK、异常增生OLK和OSCC中的阳性率分别为0.0%、13.3%、52.6%和78.4%,提示P53突变与口腔黏膜上皮细胞从单纯增生向异常增生转化有关。本研究发现,P53在OLK+组和OLK++/OSCC组的表达高于OLK−组(P<0.05),说明P53突变也参与有辛辣饮食习惯的OLK患者癌变的早期阶段;结合P53的作用机制,进一步提示基因组不稳定性的增加与OLK癌变相一致。
P16基因突变、缺失或甲基化等导致功能缺失时,则失去对细胞分裂的负性调控,导致细胞恶性增殖甚至癌变[17]–[18],该机制在多种肿瘤的研究中得到证实,如宫颈癌、膀胱癌、消化系统肿瘤、头颈癌等[19]。程晓华等[20]发现P16在正常黏膜、单纯增生型OLK、异常增生型OLK和OSCC中阳性率依次下降,认为P16表达下降可以作为OLK癌变的指征之一。本研究发现P16在OLK++/OSCC组的表达高于OLK−组(P<0.05),提示有辛辣饮食习惯的OSCC患者组织中也存在明显的P16蛋白表达缺失,它的减少使细胞生长抑制作用减弱,易于发生癌变。这些研究均提示随着OLK病变进展,P16蛋白的表达水平下降,P16蛋白表达的缺失可作为OLK癌变的早期分子标记物。
OLK的癌变与原癌基因和抑癌基因的表达失衡有关,在正常情况下这两种基因处于动态平衡,相互制约;但在外界或遗传因素作用下,原癌基因过度表达或抑癌基因表达不足,诱导细胞过度增殖甚至发生癌变[11],[19]。肿瘤的发生是多基因相互作用的结果。本研究中原癌基因Cyclin D1、突变型抑癌基因P53的过表达及抑癌基因P16失活的同时出现也为这一学说提供佐证。作为细胞周期正、负调控因子,P16可与Cyclin D1竞争性结合CDK4/CDK6,研究[21]–[22]发现Cyclin D1与P16在OSCC中的表达呈负相关。但在本研究中,这两个因子的表达虽呈负相关趋势,但差异不具有统计学意义(P>0.05),可能原因为本研究中将重度上皮异常增生型OLK和OSCC早期阶段作为一组,而对方研究中探讨分析的是这两个分子在OSCC中的表达相关性,因此造成结果的差异,两者的具体关系有待进一步大样本研究。本研究发现在OLK癌变过程中,Ki-67和Cyclin D1在组织中的表达成正相关(r=0.439,P=0.015),进一步说明原癌基因Cyclin D1的过表达可显著促进细胞增殖,诱导OLK癌变的发生。
本研究结果表明,Ki-67、Cyclin D1和P53的表达随OLK病变的进展而升高,P16的表达随病变进展而降低。但是,Ki-67、Cyclin D1、P53和P16在有辛辣饮食习惯的OLK患者和无辛辣饮食习惯的OLK患者之间的表达无明显差异。这与Ibiebele等[7]研究结果一致,其对澳大利亚食道癌患者进行问卷调查发现,辛辣食物的摄入频率与食道癌的风险无关。提示:辛辣饮食与肿瘤发生发展之间无明显相关性。但是,Yan等[5]对中国黄河流域2 419例胃癌患者研究发现,饮食习惯是影响胃癌的一个重要因素,其中经常食用油炸或烧烤食品、食用高盐高脂和辛辣食品、饮用浓煮砖茶是与胃癌相关的3个重要因素。Phukan等[23]对502例印度食管癌研究发现,辛辣和热烫饮食与食管癌风险呈正相关。更为重要的是,部分研究认为辛辣饮食是肿瘤发生发展的保护因素。姜黄、黑种草籽、生姜、大蒜、胡椒、辣椒等辛辣香料可诱导细胞凋亡、抑制肿瘤细胞增殖、迁移和侵袭,增加肿瘤细胞对放疗和化疗的敏感性,在肺癌、肝癌、乳腺癌、胃癌、胰腺癌和宫颈癌等多种恶性肿瘤的预防和治疗中有重要作用[6],[24]–[25]。
结合目前对辛辣饮食与肿瘤发生发展关系的研究现状和本实验的研究结果,各研究者对辛辣饮食与肿瘤发生发展关系的研究结果不一致而引发争议可能存在以下原因:缺乏用量化的指标来定义辛辣食物摄入的程度,不同研究对辛辣饮食的判定标准不一致,即每周辛辣饮食频率和每次摄入量达到多少算作辛辣饮食;与不同地区人群的个体差异性有关,不同种族人群的生活环境和生活习惯对辛辣饮食作用有一定的影响;口腔作为辛辣食物摄入的第一道关口,有可能受辛辣食物的危险因素和保护因素的双重作用;本研究样本量较小,可能对统计结果的准确性造成一定影响。因此,辛辣饮食对OLK发生发展的影响有待进一步多中心和大样本量研究,以增加结果的可靠性。
Funding Statement
[基金项目] 四川大学华西口腔医院临床研究项目(LCYJ2019-8)
Supported by: Foundation:Clinical Research Project of West China Hospital of Stomatology of Sichuan University (LCYJ2019-8).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Reibel J, Gale N, Hille J, et al. WHO classification of head and neck tumours. 4th ed. Lyon: IARC; 2017. Oral potentially malignant disorders and oral epithelial dysplasia[M]//El-Naggar AK, Chan JK, Grandis JR, et al; pp. 112–115. [Google Scholar]
- 2.Cawson RA. Leukoplakia and oral cancer[J] Proc Royal Soc Med. 1969;62(6):610–615. [PMC free article] [PubMed] [Google Scholar]
- 3.姜 倩. 人口腔白斑及鳞状细胞癌中NF-κB/p65、cyclin D1及CD105表达的研究[D] 郑州: 郑州大学; 2007. pp. 1–27. [Google Scholar]; Jiang Q. Study on the expression of NF-ΚB/p65, cyclin D1 and CD105 in human oral leukoplakia and squamous cell carcinoma[D] Zhengzhou: Zhengzhou University; 2007. pp. 1–27. [Google Scholar]
- 4.蓝 勇. 中国饮食辛辣口味的地理分布及其成因研究[J] 人文地理. 2001;16(5):84–88. [Google Scholar]; Lan Y. Study on the geographical distribution and causes of Chinese food spicy flavors[J] Human Geograp. 2001;16(5):84–88. [Google Scholar]
- 5.Yan S, Li B, Bai ZZ, et al. Clinical epidemiology of gastric cancer in Hehuang valley of China: a 10-year epidemiological study of gastric cancer[J] World J Gastroenterol. 2014;20(30):10486–10494. doi: 10.3748/wjg.v20.i30.10486. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zheng J, Zhou Y, Li Y, et al. Spices for prevention and treatment of cancers[J] Nutrients. 2016;8(8):E495. doi: 10.3390/nu8080495. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Ibiebele TI, Taylor AR, Whiteman DC, et al. Eating habits and risk of esophageal cancers: a population-based case-control study[J] Cancer Causes Control. 2010;21(9):1475–1484. doi: 10.1007/s10552-010-9576-8. [DOI] [PubMed] [Google Scholar]
- 8.Winn DM. Diet and nutrition in the etiology of oral cancer[J] Am J Clin Nutr. 1995;61(2):437S–445S. doi: 10.1093/ajcn/61.2.437S. [DOI] [PubMed] [Google Scholar]
- 9.Urruticoechea A, Smith IE, Dowsett M. Proliferation marker Ki-67 in early breast cancer[J] J Clin Oncol. 2005;23(28):7212–7220. doi: 10.1200/JCO.2005.07.501. [DOI] [PubMed] [Google Scholar]
- 10.Menon SS, Guruvayoorappan C, Sakthivel KM, et al. Ki-67 protein as a tumour proliferation marker[J] Clin Chim Acta. 2019;491:39–45. doi: 10.1016/j.cca.2019.01.011. [DOI] [PubMed] [Google Scholar]
- 11.Nasser W, Flechtenmacher C, Holzinger D, et al. Aberrant expression of p53, p16INK4a and Ki-67 as basic biomarker for malignant progression of oral leukoplakias[J] J Oral Pathol Med. 2011;40(8):629–635. doi: 10.1111/j.1600-0714.2011.01026.x. [DOI] [PubMed] [Google Scholar]
- 12.Stacey DW. Cyclin D1 serves as a cell cycle regulatory switch in actively proliferating cells[J] Curr Opin Cell Biol. 2003;15(2):158–163. doi: 10.1016/s0955-0674(03)00008-5. [DOI] [PubMed] [Google Scholar]
- 13.Arnold A, Papanikolaou A. Cyclin D1 in breast cancer pathogenesis[J] J Clin Oncol. 2005;23(18):4215–4224. doi: 10.1200/JCO.2005.05.064. [DOI] [PubMed] [Google Scholar]
- 14.Joerger AC, Fersht AR. The p53 pathway: origins, inactivation in cancer, and emerging therapeutic approaches[J] Annu Rev Biochem. 2016;85:375–404. doi: 10.1146/annurev-biochem-060815-014710. [DOI] [PubMed] [Google Scholar]
- 15.Bykov VJ, Eriksson SE, Bianchi J, et al. Targeting mutant p53 for efficient cancer therapy[J] Nat Rev Cancer. 2018;18(2):89–102. doi: 10.1038/nrc.2017.109. [DOI] [PubMed] [Google Scholar]
- 16.李 群, 关 为群, 张 杨安, et al. 骨膜蛋白和P53在口腔白斑及鳞状细胞癌组织中的表达及意义[J] 国际口腔医学杂志. 2019;46(1):5–11. [Google Scholar]; Li Q, Guan WQ, Zhang YA, et al. Expression and significance of periosteal protein and P53 in oral leukoplakia and squamous cell carcinoma[J] Int J Stomatol. 2019;46(1):5–11. [Google Scholar]
- 17.Witkiewicz AK, Knudsen KE, Dicker AP, et al. The meaning of p16(ink4a) expression in tumors: functional significance, clinical associations and future developments[J] Cell Cycle. 2011;10(15):2497–2503. doi: 10.4161/cc.10.15.16776. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zhao R, Choi BY, Lee MH, et al. Implications of genetic and epigenetic alterations of CDKN2A p16(INK4a) in cancer[J] EBioMedicine. 2016;8:30–39. doi: 10.1016/j.ebiom.2016.04.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.March-Villalba JA, Ramos-Soler D, Soriano-Sarrió P, et al. Immunohistochemical expression of Ki-67, Cyclin D1, p16INK4a, and Survivin as a predictive tool for recurrence and progression-free survival in papillary urothelial bladder cancer pTa/pT1 G2 (WHO 1973)[J] Urol Oncol. 2019;37(2):158–165. doi: 10.1016/j.urolonc.2018.10.005. [DOI] [PubMed] [Google Scholar]
- 20.程 晓华, 陈 学升. P16在口腔白斑和鳞癌组织中的表达及其意义[J] 广东牙病防治. 2010;18(10):521–523. [Google Scholar]; Cheng XH, Chen XS. Expression of P16 in oral leukoplakia and oral squamous cell carcinoma[J] J Dent Prev Treat. 2010;18(10):521–523. [Google Scholar]
- 21.Ryu HJ, Kim EK, Heo SJ, et al. Architectural patterns of p16 immunohistochemical expression associated with cancer immunity and prognosis of head and neck squamous cell carcinoma[J] APMIS. 2017;125(11):974–984. doi: 10.1111/apm.12744. [DOI] [PubMed] [Google Scholar]
- 22.Padhi SS, Roy S, Kar M, et al. Role of CDKN2A/p16 expression in the prognostication of oral squamous cell carcinoma[J] Oral Oncol. 2017;73:27–35. doi: 10.1016/j.oraloncology.2017.07.030. [DOI] [PubMed] [Google Scholar]
- 23.Phukan RK, Chetia CK, Ali MS, et al. Role of dietary habits in the development of esophageal cancer in Assam, the north-eastern region of India[J] Nutr Cancer. 2001;39(2):204–209. doi: 10.1207/S15327914nc392_7. [DOI] [PubMed] [Google Scholar]
- 24.Tawani A, Amanullah A, Mishra A, et al. Evidences for Piperine inhibiting cancer by targeting human G-quadruplex DNA sequences[J] Sci Rep. 2016;6:39239. doi: 10.1038/srep39239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Vendrely V, Amintas S, Noel C, et al. Combination treatment of resveratrol and capsaicin radiosensitizes pancreatic tumor cells by unbalancing DNA repair response to radiotherapy towards cell death[J] Cancer Lett. 2019;451:1–10. doi: 10.1016/j.canlet.2019.02.038. [DOI] [PubMed] [Google Scholar]