1. Introdução
Atualmente, há grande variedade de estratégias intervencionistas - tanto transcateter, quanto cirúrgicas - que podem ser indicadas para pacientes portadores de valvopatia cardíaca, com objetivo de redução da morbimortalidade associada a esta doença. O correto momento de indicação e o tipo de tratamento intervencionista estão atrelados ao preciso diagnóstico anatômico e funcional da valvopatia cardíaca e a uma minuciosa avaliação global do paciente. Estas Diretrizes Brasileira de Valvopatias de 2020, além da compilação de evidências científicas e opinião de especialistas, mantém o ideal de ser extremamente útil ao apoio à decisão frente o paciente portador de valvopatia e tem três características que a diferencia:
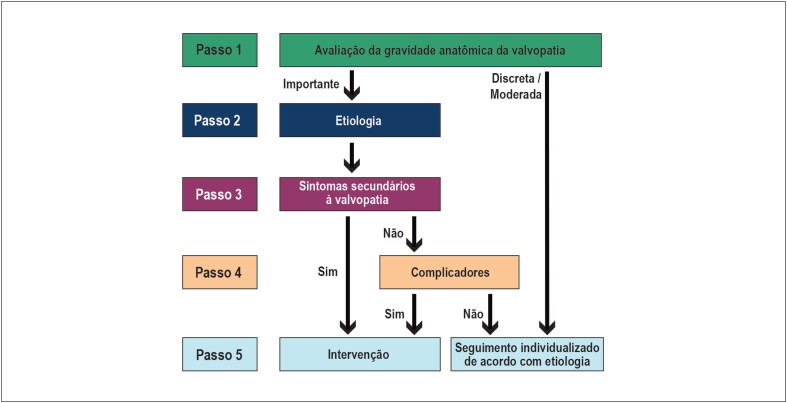
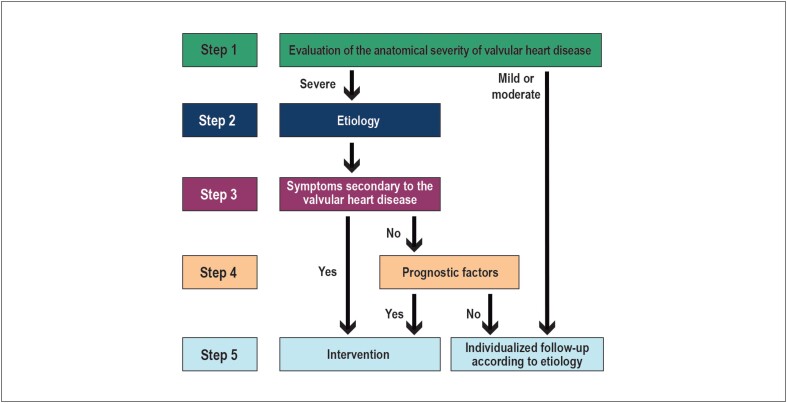
Manutenção do fluxograma inovador proposto na edição de 2017, com passos sequenciais que norteiam o diagnóstico anatômico, etiológico e funcional, definindo a conduta alinhada às melhores práticas, com uso racional de recursos (Figura 1);
Aumento do número de recomendações a serem consultadas na tentativa de contemplar as múltiplas possibilidades frente o aumento da complexidade dos pacientes;
Comparação das recomendações destas diretrizes com as principais diretrizes internacionais — American College of Cardiology/American Heart Association (ACC/AHA) 2017 e European Society of Cardiology/European Association for CardioThoracic Surgery (ESC/EACTS) 2017 – permitindo individualização da nossa população.1,2
Figura 1. Algoritmo com passos para diagnóstico anatômico, etiológico e funcional, além da definição de conduta.
Esta edição de 2020 contempla o raciocínio frente o paciente portador de valvopatia não importante e enfatiza a necessidade de ponderar a possibilidade de intervenção transcateter para idosos independente do risco presumido para cirurgia convencional e para todos pacientes com valva nativa ou prótese com risco presumido mais elevado para cirurgia convencional. A despeito de grandes avanços e maior disponibilização de exames de imagem, há manutenção da recomendação de avaliação clínica detalhada que ainda é imprescindível para diagnóstico, tomada de conduta e relacionamento médico-paciente.
Abaixo, os passos recomendados a serem seguidos:
Primeiro passo: certificar-se de que a valvopatia é anatomicamente importante e, se confirmada, progredir para segundo passo. Caso não seja, procurar diagnósticos diferenciais em paciente sintomático e monitorizar evolução em paciente assintomático;
Segundo passo: avaliar a etiologia, incluindo história clínica e antecedentes pessoais, em conjunção com exames complementares;
Terceiro passo: avaliar os sintomas - fundamental na decisão de intervenção. O tratamento farmacológico está indicado para alívio dos sintomas até o tratamento intervencionista da doença valvar;
Quarto passo: avaliação de complicadores - anatômicos e/ou funcionais (especialmente hipertensão pulmonar [HP], remodelamento ventricular, disfunção sistólica, dilatação aneurismática de aorta, fibrilação atrial [FA]). Pode ser determinante para intervenção nos pacientes assintomáticos;
Quinto passo: tipo de intervenção - o procedimento de correção da doença valvar pode ser cirúrgico ou transcateter, com indicação individualizada dependendo do risco operatório, das comorbidades e da decisão do Heart Team.
2. O Heart Team
O Heart Team é um conceito no qual um conjunto de diferentes profissionais com experiência em doenças valvares compartilha a decisão sobre o tratamento mais adequado para um determinado paciente. Com a grande variedade de estratégias intervencionistas disponíveis para o tratamento do paciente portador de valvopatia, o Heart Team é fundamental para análise do risco/benefício e custo/eficácia de cada estratégia e auxílio à tomada de decisão. É composto por diversas subespecialidades cardiológicas, que exercerão papéis diferentes e fundamentais em cada passo do cuidado: desde o cardiologista clínico, a quem caberá a seleção e indicação de pacientes, além do acompanhamento pré e pós-intervenção, até o cirurgião cardíaco e o hemodinamicista, que serão os profissionais responsáveis pela concretização dos procedimentos indicados pelo Heart Team. Além destes, o radiologista será importante na análise de dados para avaliar a possibilidade técnica de realização de cada tipo de intervenção, e o ecocardiografista, além de avaliar os dados pré-operatórios poderá também acompanhar o procedimento, colaborando para um melhor resultado.1,2
3. Avaliação de Risco Operatório
A indicação da intervenção nos pacientes valvares deve ser sempre baseada na comparação do benefício e do provável risco do procedimento proposto. Para tal fim, alguns escores online são utilizados, dentre eles o EuroSCORE II (http://www.euroscore.org/calc.html) e o STS (Society of Thoracic Surgeons, http://riskcalc.sts.org/stswebriskcalc/#/calculate), validados em diferentes populações, com capacidade preditiva de mortalidade em 30 dias. Pacientes com STS < 4% são convencionalmente considerados de baixo risco cirúrgico, enquanto aqueles com escore entre 4-8% têm risco intermediário e aqueles com escore > 8% tem alto risco. Em relação ao EuroSCORE II, quando menor que 4% o paciente é considerado de baixo risco e, se escore > 4%, risco aumentado. Caso ocorra discrepância entre os escores, devemos utilizar aquele cujo risco estimado foi maior.3–8
Importante ressaltar que ambos os escores não incluem alguns fatores relacionados a desfechos prognósticos, como fragilidade e contraindicações específicas aos procedimentos, como, por exemplo, aorta em porcelana. Além disso, a avaliação do risco não substitui a impressão da avaliação clínica individual e a decisão da intervenção deve ser sempre compartilhada com paciente e familiares.
4. Fragilidade
Fragilidade é uma entidade que denota um estado de vulnerabilidade do idoso, associado à fraqueza física e baixa reserva fisiológica. Tem extrema relevância na avaliação individualizada devido principalmente a 2 fatores:
-
–
é um preditor de eventos, como mortalidade, tempo de hospitalização e declínio funcional, após intervenção cirúrgica ou transcateter;
-
–
não é contemplada nos escores de risco de uso rotineiro.
Vários escores e ferramentas estão disponíveis para a avaliação e quantificação da fragilidade, através da mensuração de dados relacionados ao status funcional, atividades instrumentais diárias, nutrição, cognição, independência para atividades, dentre outros. Importante que a avaliação da fragilidade não seja apenas subjetiva (eyeball test), mas sim um conjunto da impressão clínica associada a várias medidas/escores objetivos.9–14
5. Estenose Mitral
O exame físico é o primeiro recurso utilizado para avaliação anatômica da estenose mitral (EM). Pacientes com EM discreta a moderada poderão já apresentar estalido de abertura da valva mitral e sopro diastólico em ruflar mitral, com formato em decrescendo, com início logo após o estalido. Nos pacientes com ritmo sinusal, o sopro apresenta um reforço pré-sistólico no final da diástole. Entretanto, é nos pacientes com EM importante que as alterações propedêuticas são mais evidentes, assim como surgem as alterações eletrocardiográficas e radiológicas. Tais alterações presentes em pacientes com EM importante encontram-se no Quadro 1.
Quadro 1. Passo 1: Diagnóstico de estenose mitral importante15.
| Características de estenose mitral importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
AE: átrio esquerdo; AVM: área valvar mitral; FA: fibrilação atrial; IT: insuficiência tricúspide; PSAP: pressão sistólica da artéria pulmonar; VE: ventrículo esquerdo.
A ecocardiografia é o principal exame complementar para a avaliação anatômica da valva mitral, sendo fundamental para a definição da gravidade da valvopatia, das repercussões hemodinâmicas e dos parâmetros que estão relacionados à chance de sucesso das intervenções, com avaliação individualizada de cada componente da valva (anel valvar, cúspides valvares, aparato subvalvar).
Os parâmetros ecocardiográficos que classificam a gravidade da EM são a área valvar mitral (AVM), que pode ser aferida pela planimetria, pelo PHT (da sigla em inglês, pressure half time) ou pela equação de continuidade, e o gradiente diastólico transvalvar mitral.15
Do ponto de vista epidemiológico (Quadro 2), a EM segue apresentando como sua principal etiologia a febre reumática (FR), mantendo sua prevalência em países em desenvolvimento, inclusive no Brasil. Nestes países, a doença valvar reumática mantém uma estimativa de prevalência de 1 a 7 para cada 1000 crianças em estudos clínicos, podendo este número ser até 10 vezes maior com uso da ecocardiografia para screening populacional. Nos países desenvolvidos, as estatísticas apontam a EM como responsável por cerca de 9% do total das valvopatias nos países europeus, e apresentando uma prevalência de 0,1% nos Estados Unidos. Nestes países, a predominância dos casos ocorre em pacientes idosos e em imigrantes jovens, provenientes dos países em desenvolvimento.16–18
Quadro 2. Passo 2: Avaliação da etiologia da estenose mitral importante16,17.
| Características etiológicas | |
|---|---|
| Febre reumática |
|
| Degenerativa (calcificação do anel valvar) |
|
| Causas raras |
|
Além da etiologia reumática, cresce proporcionalmente o número de pacientes portadores de EM de etiologia degenerativa, ocasionada por calcificação do anel mitral, que pode se estender para a base dos folhetos valvares, gerando restrição para a movimentação das cúspides, com consequente restrição para o esvaziamento atrial. A prevalência estimada de calcificação do anel mitral está em torno de 10% na população idosa. Destes pacientes, cerca de 1 a 2% desenvolvem EM.19
Outras causas raras de EM incluem doenças reumatológicas (como lúpus eritematoso sistêmico ou artrite reumatoide), doenças de depósito (como doença de Fabry), doença de Whipple, terapia com metisergida ou anorexígenos, síndrome carcinóide ou alterações anatômicas congênitas da valva mitral, como valva mitral em paraquedas ou hipoplasia da valva mitral.
Nos pacientes com EM importante, é necessário estar atento ao possível surgimento de sintomas (Quadro 3), sendo o mais comum dispneia (classe funcional [CF] II a IV da New York Heart Association [NYHA]). Em particular, dispneia pode surgir em situações que levam ao aumento da pressão venocapilar pulmonar (esforço físico, gestação, fibrilação atrial). Com o passar do tempo, pode surgir mesmo em repouso, inclusive com ortopneia associada. Outros sintomas que podem se desenvolver são palpitações, hemoptise, disfonia, disfagia, tosse e eventos embólicos.
Quadro 3. Passo 3: Avaliação de sintomas na estenose mitral importante.
| Sintomas | |
|---|---|
| Dispneia (NYHA II – IV) |
|
Paralelamente à avaliação dos sintomas, o acompanhamento dos pacientes deverá incluir também a busca por possíveis complicadores (Quadro 4). No caso da EM importante, as alterações funcionais relevantes são a presença de HP significativa (pressão sistólica da artéria pulmonar –PSAP maior que 50 mmHg em repouso ou maior que 60mmHg no esforço) ou FA de início recente (desencadeada nos últimos meses).
Quadro 4. Passo 4: Avaliação de complicadores da estenose mitral importante.
| Complicadores | |
|---|---|
| Hipertensão pulmonar |
|
| FA de início recente |
|
INR: razão normalizada internacional; PSAP: pressão sistólica da artéria pulmonar; AE: átrio esquerdo; FA: fibrilação atrial; INR: razão normalizada internacional; PSAP: pressão sistólica da artéria pulmonar.
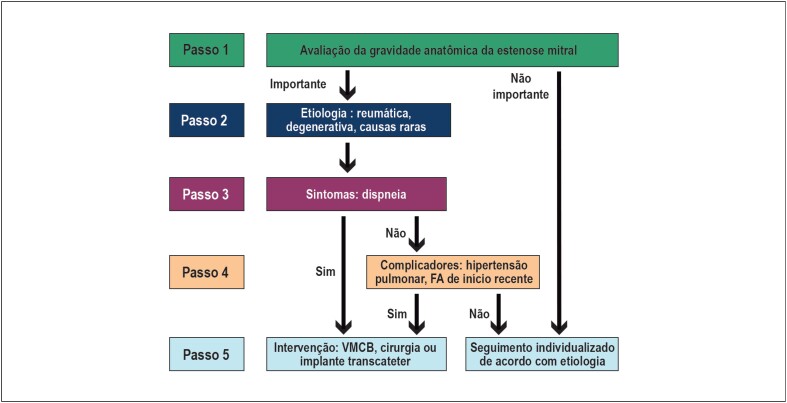
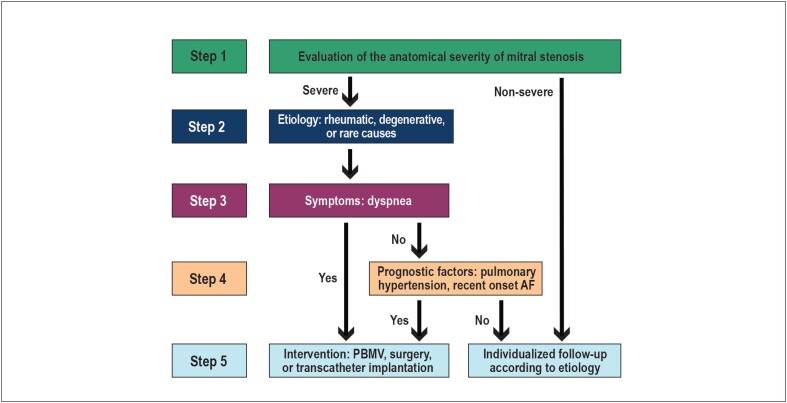
Os tipos de intervenção disponíveis e as indicações das referidas intervenções estão descritas nos Quadros 5 e 6 e Figura 2. A valvoplastia mitral por cateter-balão (VMCB) segue sendo o tratamento de escolha para os pacientes com EM de etiologia reumática, nos quais predomina a calcificação e fusão comissurais, desde que apresentem anatomia valvar favorável (pela avaliação do escore de Wilkins-Block – Quadro 7), e na ausência de contraindicações (insuficiência mitral [IM] moderada a importante e trombo em AE). O escore de Wilkins-Block consiste na avaliação ecocardiográfica da valva mitral com ênfase na descrição dos aspectos estruturais. Quatro parâmetros são considerados: mobilidade dos folhetos, espessamento valvar, grau de calcificação e acometimento do aparato subvalvar. Uma graduação de um a quatro pontos para cada item resulta num escore que pode variar de 4 a 16 pontos. Pacientes com escore de Wilkins-Block inferior ou igual a 8 são candidatos a VMCB, na ausência de outras contraindicações. Nos pacientes mais sintomáticos (NYHA III ou IV) ou com complicadores e que apresentem anatomia desfavorável à VMCB ou contraindicações ao procedimento percutâneo, o tratamento cirúrgico da valva mitral passa a ser a opção terapêutica de escolha. A cirurgia poderá consistir na comissurotomia mitral ou, nos casos em que há comprometimento valvar muito significativo, sem possibilidade de manutenção da valva nativa, na troca valvar por prótese biológica ou mecânica.20,21
Quadro 5. Passo 5: Tipo de intervenção na estenose mitral importante15,17,20–25.
| Tipo | Considerações |
|---|---|
| Valvoplastia mitral por cateter-balão |
|
| Tratamento cirúrgico (comissurotomia/troca valvar) |
|
| Implante valvar mitral transcateter (valve-in-MAC) |
|
Individualizar em casos de escore ecocardiográfico 9-10. Pacientes com calcificação e aparato subvalvar com pontuações menores que 3 têm maiores taxas de sucesso com VMCB. AE: átrio esquerdo; CF: classe funcional; EM: estenose mitral; IM: insuficiência mitral; MAC: mitral annulus calcificatio; VMCB: valvoplastia mitral por cateter-balão.
Quadro 6. Estenose mitral: Recomendações1,2,15,17,20–25.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Valvoplastia mitral por cateter-balão |
|
I A | I A | I B |
|
I C | IIb C (se FA) | IIa C (se alto risco tromboembólico ou de deterioração hemodinâmica) | |
| Tratamento cirúrgico (comissurotomia/troca valvar) |
|
I B | I B | I C |
|
IIa C | IIb C (Embolia recorrente) |
– | |
|
IIb C* | – | – | |
|
I C | I C | – | |
| Implante valvar mitral transcateter (valve-in-MAC) |
|
IIb C* | – | – |
Considerar discussão junto ao Heart Team. AHA: American Heart Association; CF: classe funcional; EM: estenose mitral; ESC: European Society of Cardiology; MAC: mitral annulus calcificatio; SBC: Sociedade Brasileira de Cardiologia; VMCB: valvoplastia mitral por cateter-balão.
Figura 2. Algoritmo para tomada de decisão na estenose mitral. FA: fibrilação atrial; VMCB: valvoplastia mitral por cateter-balão.
Quadro 7. Escore ecocardiográfico de Wilkins-Block.
Mobilidade dos folhetos:
|
Acometimento subvalvar:
|
Espessura dos folhetos:
|
Calcificação valvar:
|
No caso dos pacientes com EM degenerativa, por outro lado, a VMCB não é uma opção terapêutica, uma vez que não há fusão comissural, e sim calcificação do anel valvar, podendo ou não se estender para a base dos folhetos. Além disso, nestes pacientes, que habitualmente são mais idosos e frequentemente portadores de múltiplas comorbidades, o risco cirúrgico é significativamente mais elevado. O procedimento cirúrgico é acompanhado de dificuldades técnicas que podem aumentar as chances de complicações, incluindo disjunção atrioventricular, lesão da artéria circunflexa e sangramento da parede ventricular. Desta forma, o tratamento inicial de escolha é clínico, com controle de frequência cardíaca com betabloqueador, bloqueador de canal de cálcio ou ivabradina (quando em ritmo sinusal e não tolerar medicações anteriores), associado a diurético.22 Caso haja controle adequado dos sintomas com esta estratégia, o paciente poderá permanecer sem indicação de novas intervenções. Para os pacientes refratários ao tratamento clínico, entretanto, faz-se necessário considerar a possibilidade de intervenção cirúrgica, nos casos de risco baixo a moderado, ou do eventual implante de prótese mitral por via transcateter. Nestes casos, o implante transcateter ocorre utilizando como apoio para a prótese valvar a calcificação importante do anel mitral, sendo o procedimento habitualmente referido na literatura em língua inglesa como valve-in-MAC (mitral annulus calcification). Há ainda uma experiência limitada com este procedimento, realizado nos estudos clínicos mais frequentemente por via transeptal ou transapical. Apresenta ainda um alto índice de complicações, incluindo leak paravalvar, obstrução da via de saída do VE, embolização da prótese, e taxa de mortalidade que pode chegar a 25% em 30 dias e 54% em 12 meses. Requer, portanto, um número maior de estudos, que possibilitem uma menor taxa de complicações, para a expansão de suas indicações.23–25
O acompanhamento clínico do paciente, enquanto apresentar valvopatia anatomicamente não importante é realizado com consultas e reavaliações ecocardiográficas periódicas (Quadro 8). No paciente com EM não importante, reavaliações podem ser realizadas a cada 1 ano. Não é esperado rotineiramente que pacientes com área valvar ≥ 1,5 cm2 desenvolvam sintomas ou complicadores. No caso de surgimento destas alterações, antes que o paciente desenvolva valvopatia anatomicamente importante, é imperativo considerar a possibilidade de que outros diagnósticos diferenciais sejam responsáveis pelas mesmas. O paciente com EM importante, por sua vez, deverá ser reavaliado em intervalos menores de tempo, habitualmente a cada 6 a 12 meses.
Quadro 8. Estenose mitral: Acompanhamento individualizado1,2.
| Estenose mitral | Acompanhamento | SBC | AHA | ESC |
|---|---|---|---|---|
| Importante assintomático e sem complicadores |
|
A cada 6-12 meses | A cada 12 meses | A cada 12 meses |
|
I C | IIb C | – | |
| Não importante (AVM > 1,5 cm² e gradiente médio AE/VE < 5 mmHg) |
|
A cada 1 ano | A cada 3-5 anos | A cada 2-3 anos |
AE: átrio esquerdo; AHA: American Heart Association; AVM: área valvar mitral; ESC: European Society of Cardiology; SBC: Sociedade Brasileira de Cardiologia; VE: ventrículo esquerdo; VMCB: valvoplastia mitral por cateter-balão.
6. Insuficiência Mitral Primária Crônica
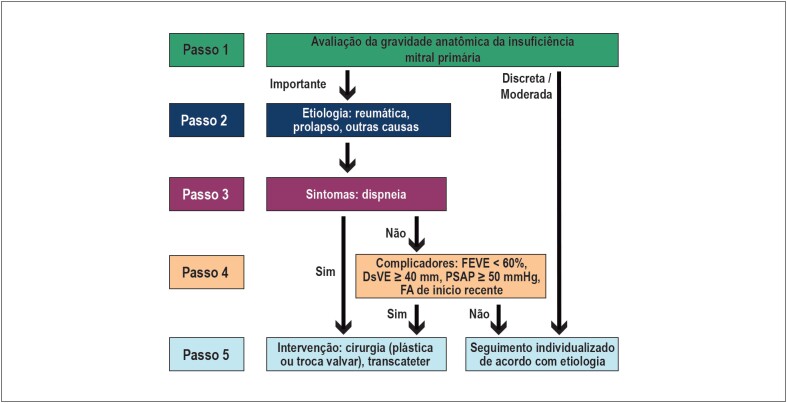
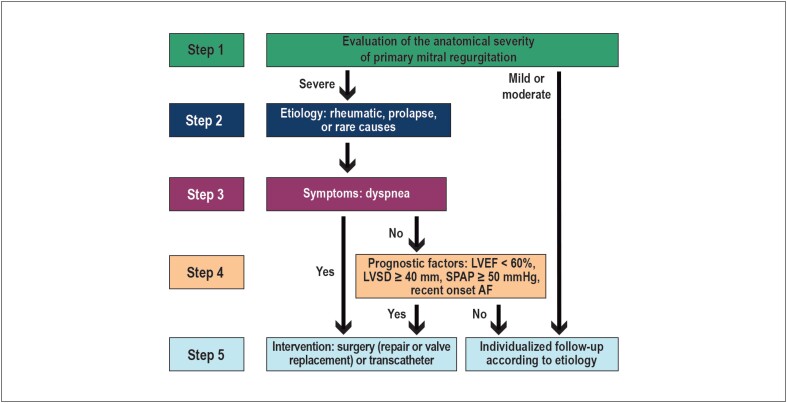
Para a tomada de decisão frente a um paciente com IM primária crônica, recomenda-se que sejam seguidos os 5 passos do algoritmo de abordagem das valvopatias, conforme detalhado abaixo e posteriormente resumido na Figura 3.
Figura 3. Algoritmo para tomada de decisão na insuficiência mitral crônica primária. DSVE: diâmetro sistólico do ventrículo esquerdo; FEVE: fração de ejeção do VE; PSAP: pressão sistólica da artéria pulmonar.
Além de confirmar a presença da valvopatia, o ecocardiograma transtorácico é o principal exame empregado para a definição da gravidade anatômica da IM. Diversos parâmetros podem ser utilizados para essa quantificação, sendo de fundamental importância um exame detalhado e completo (Quadro 9).
Quadro 9. Passo 1: Diagnóstico de insuficiência mitral primária importante26–32.
| Características de insuficiência mitral primária importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
| Ressonância Magnética |
|
AE: átrio esquerdo; ERO: área efetiva do orifício regurgitante; FA: fibrilação atrial; IM: insuficiência mitral; VE: ventrículo esquerdo.
Os pacientes com IM anatomicamente discreta ou moderada deverão ser mantidos em acompanhamento clínico e ecocardiográfico periódicos, sem indicação de intervenção (medicamentosa ou cirúrgica) para interrupção da história natural da doença valvar. Por outro lado, pacientes com IM importante devem prosseguir no fluxograma de avaliação específica, buscando-se sintomas secundários à valvopatia e/ou presença de complicadores.
Os pacientes com IM deverão ter definida a etiologia da valvopatia, uma vez que o seguimento clínico e a programação terapêutica (momento e tipo de intervenção), quando indicada, poderão ser diferentes conforme a causa da IM (Quadro 10). Apesar dos avanços nos métodos diagnósticos, o ecocardiograma transtorácico ainda é o primeiro e principal exame indicado para a quantificação anatômica e para a avaliação etiológica de pacientes com IM. 33–35
Quadro 10. Passo 2: Avaliação de etiologia na insuficiência mitral primária importante 33–35.
| Características etiológicas | |
|---|---|
| Reumática |
|
| Prolapso da valva mitral e doenças associadas (“flail”, Barlow) |
|
| Outras causas |
|
AE: átrio esquerdo.
O principal sintoma apresentado pelos pacientes com IM anatomicamente importante é dispneia, a qual deve ser valorizada mesmo que ainda não limite as atividades habituais (CF II). Caso haja dúvida quanto à presença de sintomas, pode ser solicitado um teste ergométrico ou ergoespirométrico (Quadro 11). Uma vez confirmada a presença de sintomas, e sendo estes secundários à IM, os pacientes devem receber indicação de intervenção da valvopatia, conforme descrito no Passo 5 (Quadro 12).
Quadro 11. Passo 3: Avaliação de sintomas na insuficiência mitral primária importante.
| Sintomas | |
|---|---|
| Dispneia (CF II-IV) e fadiga/fraqueza |
|
CF: classe funcional; FA: fibrilação atrial.
Quadro 12. Passo 5: Tipo de intervenção na insuficiência mitral primária importante 39–52.
| Tipo de intervenção | Considerações |
|---|---|
| Plástica da valva mitral |
|
| Troca da valva mitral |
|
| Clipagem percutânea da valva mitral |
|
IM: insuficiência mitral.
Pacientes com IM importante assintomáticos devem ser periodicamente reavaliados quanto ao desenvolvimento ou não de alterações anatômicas e/ou funcionais secundárias à doença valvar (Quadro 13). Os complicadores associados à IM são: disfunção sistólica do ventrículo esquerdo (VE) (fração de ejeção do VE [FEVE] < 60%), dilatação do VE (diâmetro sistólico do VE [DSVE] ≥ 40 mm), HP (PSAP ≥ 50 mmHg em repouso ou ≥ 60mmHg ao esforço) e FA de início recente (desencadeada nos últimos meses).36–38 Aumento do volume atrial esquerdo (especialmente quando ≥ 60 ml/m2) pode ser considerado um complicador anatômico na IM, devendo ser levado em consideração na definição de conduta, uma vez que está associado a pior prognóstico. Além disso, caso haja queda progressiva da FEVE ou dilatação progressiva do VE em exames de imagem seriados, mesmo antes de atingidos os limites especificados acima, intervenção valvar mitral deve ser considerada.
Quadro 13. Passo 4: Avaliação de complicadores na insuficiência mitral primária importante36–38.
| Complicadores | |
|---|---|
| Ecocardiograma |
|
| Eletrocardiograma |
|
AE: átrio esquerdo; DSVE: diâmetro sistólico do ventrículo esquerdo; FA: fibrilação atrial; FEVE: fração de ejeção do ventrículo esquerdo; PSAP: pressão sistólica da artéria pulmonar.
Após confirmada a presença de IM anatomicamente importante, analisada e definida a etiologia e, por fim, assegurada a presença de sintomas secundários à valvopatia e/ou de complicadores, o paciente sem contraindicação deverá receber indicação de intervenção da valvopatia (Quadro 13 e 14). Nesses casos, a cirurgia de plástica mitral é o tratamento de escolha, caso a etiologia (principalmente prolapso) e a anatomia sejam favoráveis, e o procedimento seja realizado em hospital capacitado e com cirurgião experiente. Em caso contrário, está indicada a cirurgia de troca valvar mitral.39–52
Quadro 14. Insuficiência mitral primária: Recomendações1,2,39–52.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Plástica da valva mitral (centros com experiência) | Reumáticos | |||
|
IIb C | IIb C | – | |
|
IIb B | IIb B | – | |
| IIb B | – | – | ||
|
III | – | – | |
| Não reumáticos | ||||
|
I B | I B | I B | |
|
I B | I B | I B (DSVE≥45 mm) | |
| IIa B | IIa B | IIa B | ||
|
IIa B | IIa B | IIa C (AE ≥ 60 ml/m² e ritmo sinusal) | |
| Troca da valva mitral | Reumáticos | |||
|
I B | – | – | |
|
I B | – | – | |
| IIa B | – | – | ||
|
III | – | – | |
| Não reumáticos | ||||
|
I B | I B | I B | |
|
I B | I B | I C (DSVE≥45 mm) | |
| IIa C | IIa C | IIa B | ||
|
III | III | III | |
| Clipagem percutânea da valva mitral |
|
IIa B * | IIb B | IIb C |
Em centros com Heart Team. AHA: American Heart Association; CF: classe funcional; DSVE: diâmetro sistólico do ventrículo esquerdo; ESC: European Society of Cardiology; FA: fibrilação atrial; FEVE: fração de ejeção do VE; IM: insuficiência mitral; PSAP: pressão sistólica da artéria pulmonar; SBC: Sociedade Brasileira de Cardiologia.
Intervenções transcateter têm indicação restrita para pacientes com IM primária e devem ser decididas após discussão com o Heart Team. Da mesma forma, pacientes com contraindicação ou que apresentem elevado risco associado à cirurgia convencional, devem ser previamente discutidos com o Heart Team antes de terem sua conduta definida.
Quando, apesar da presença de IM anatomicamente importante, o paciente não apresentar sintomas nem complicadores, este deverá ser seguido de maneira individualizada, com acompanhamento clínico semestral e avaliação ecocardiográfica com intervalo máximo de 1 ano (Quadro 15).
Quadro 15. Insuficiência mitral primária: Acompanhamento individualizado1,2.
| Insuficiência mitral primária | Acompanhamento | SBC | AHA | ESC |
|---|---|---|---|---|
| Importante assintomático e sem complicadores |
|
A cada 6 meses a 1 ano | A cada 6 meses a 1 ano | A cada 6 meses |
|
I B | I B | – | |
| Moderada (Área do jato 20- 40% da área do AE, Fração regurgitante 30-49%, Volume regurgitante 30-59 mL/batimento, Vena contracta 0,3-0,69 cm, ERO 0,2-0,39 cm²) |
|
A cada 1-2 anos | A cada 1-2 anos | A cada 1-2 anos |
|
IIa C | IIa C | – | |
| Discreta (Área do jato < 20% da área do AE, Fração regurgitante < 30%, Volume regurgitante < 30 mL/batimento, Vena contracta < 0,3 cm, ERO < 0,2-0,39mm²) |
|
A cada 2-3 anos | A cada 3-5 anos | – |
AE: átrio esquerdo; AHA: American Heart Association; ERO: área efetiva do orifício regurgitante; ESC: European Society of Cardiology; SBC: Sociedade Brasileira de Cardiologia.
Por outro lado, pacientes com IM anatomicamente moderada devem ter avaliação clínica anual e realizar ecocardiograma a cada 2 anos.
7. Insuficiência Mitral Secundária
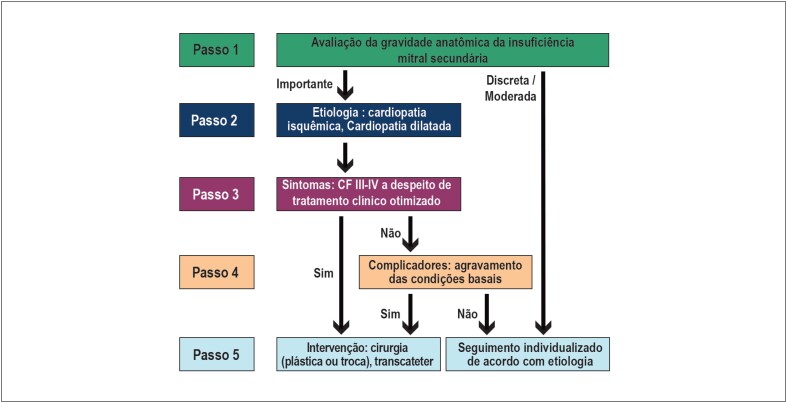
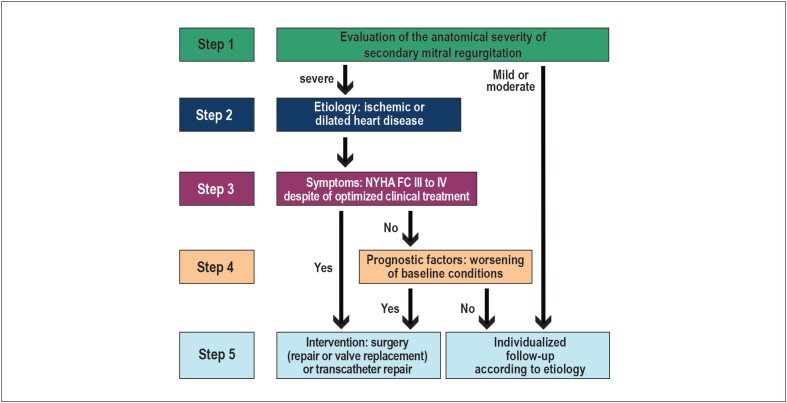
A IM secundária decorre de alterações ventriculares (disfunção e/ou dilatação), enquanto que os folhetos valvares mitrais e as cordoalhas são normais. Nesse contexto, há uma sobrecarga adicional ao VE pela regurgitação mitral, culminando num pior prognóstico. As principais etiologias são: doença arterial coronária (IM isquêmica) e miocardiopatia dilatada (dilatação anular e/ou mau posicionamento). Por esses motivos, o tratamento ideal é controverso, uma vez que a correção valvar não é curativa. De maneira geral, está indicada intervenção em pacientes que se mantêm sintomáticos, a despeito de tratamento medicamentoso otimizado. Mesmo assim, a decisão terapêutica deve ser individualizada e, sempre que possível, compartilhada com o Heart Team.53
Como muitas vezes o exame físico é frustro para o diagnóstico da IM secundária, o ecocardiograma transtorácico é exame fundamental. Há evidências de que limites menores da área do orifício regurgitante e do volume regurgitante estão associados a pior prognóstico, quando comparados com IM primária. Todavia, para quantificação da gravidade anatômica da IM secundária, os limites ecocardiográficos utilizados são os mesmos da IM primária. Em casos de dissociação clinicoecocardiográfica, a realização de estudo hemodinâmico com ventriculografia esquerda ou ressonância magnética podem ajudar na definição (Quadro 16).27–32,54
Quadro 16. Passo 1: Diagnóstico de insuficiência mitral secundária importante27–32,54.
| Características de insuficiência mitral secundária importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
| Ressonância Magnética |
|
Considerar a possibilidade de insuficiência mitral anatomicamente importante em presença de ERO entre 0,3-0,4 cm ² quando associado a disfunção sistólica importante. ERO: área efetiva do orifício regurgitante; IM: insuficiência mitral.
O ecocardiograma fornece as principais informações necessárias para se estabelecer a etiologia da IM secundária, especialmente pela análise de alterações do VE (Quadro 17). A cineangiocoronariografia, por sua vez, tem papel importante no diagnóstico de doença arterial coronária obstrutiva que pode ser causa de IM.53
Quadro 17. Passo 2: Avaliação da etiologia na insuficiência mitral secundária importante53.
| Características etiológicas | |
|---|---|
| Isquêmica |
|
| Dilatada |
|
Exames para avaliação de viabilidade miocárdica (como ressonância nuclear magnética) podem ser úteis em pacientes com IM isquêmica, nos quais há programação de revascularização miocárdica.
O principal sintoma apresentado por pacientes com IM secundária é dispneia, a qual pode decorrer da disfunção ventricular esquerda e/ou da regurgitação mitral associada (Quadro 18).
Quadro 18. Passo 3: Avaliação de sintomas na insuficiência mitral secundária importante.
| Sintomas | |
|---|---|
| Dispneia e fadiga/fraqueza |
|
Pacientes com sintomas importantes (CF NYHA III e IV) e persistentes, a despeito de tratamento otimizado para insuficiência cardíaca (incluindo terapia de ressincronização, quando indicada), devem ser considerados para intervenção de maneira individualizada.
Não há complicadores específicos para pacientes com IM secundária, uma vez que a origem do problema está na doença ventricular (Quadro 19). Todavia, caso haja agravamento da dilatação e/ou da disfunção do VE, sem fator causal aparente, a valvopatia mitral concomitante pode ser considerada responsável.55,56
Quadro 19. Passo 4: Avaliação de complicadores na insuficiência mitral secundária importante55,56.
| Complicadores | |
|---|---|
| Avaliação clinicoecocardiográfica |
|
FEVE: fração de ejeção do ventrículo esquerdo.
A indicação de intervenção em pacientes com IM secundária é controversa (Quadros 20 e 21). Em pacientes com IM isquêmica, candidatos à cirurgia de revascularização miocárdica, a abordagem simultânea da valvopatia mitral deve ser considerada. Por outro lado, em pacientes sem indicação de revascularização, a abordagem cirúrgica isolada da IM está associada à elevada mortalidade, altas taxas de recorrência da IM e não há evidência de benefício em termos de sobrevida.53,57–66
Quadro 20. Passo 5: Tipo de intervenção na insuficiência mitral secundária importante53,57–72.
| Tipo | Considerações |
|---|---|
| Cirurgia (plástica ou troca valvar) |
|
| Clipagem percutânea da valva mitral |
|
DSVE: diâmetro sistólico do ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo.
Quadro 21. Insuficiência mitral secundária: Recomendações na insuficiência mitral secundária importante1,2,53,57–72.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Troca ou Plástica da valva mitral | Isquêmica | |||
|
IIb B | IIb B | IIb C | |
| IIa B | IIa B | I C (FEVE > 30%) IIa C (FEVE < 30%) |
||
| Dilatada | ||||
|
IIb B | IIb B | IIb C | |
| Clipagem percutânea da valva mitral | Isquêmica | |||
|
IIa B | – | IIb C (FE < 30%) |
|
| Dilatada | ||||
|
IIa B | – | IIb C (FE < 30%) |
AHA: American Heart Association; CF: classe funcional; ESC: European Society of Cardiology; SBC: Sociedade Brasileira de Cardiologia.
Em pacientes com IM secundária a cardiomiopatia dilatada, a indicação de intervenção na valvopatia mitral é ainda mais restrita. Enquanto a cirurgia valvar mitral isolada não mostrou benefício nesse cenário, novas evidências mostraram benefício da intervenção transcateter em pacientes com IM secundária, FEVE ≥ 20% e sintomáticos a despeito de tratamento clínico otimizado, desde que o procedimento não seja indicado em fases mais avançadas da história natural da valvopatia. 67–72
Para indicação mais adequada e abordagem mais completa, os casos de IM secundária devem ser discutidos com o Heart Team antes da tomada de decisão (Figura 4).
Figura 4. Algoritmo para tomada de decisão na insuficiência mitral secundária. CF: classe funcional.
8. Estenose Aórtica
A estenose aórtica (EAo) apresenta prevalência crescente na atualidade em razão do aumento da expectativa de vida e do consequente envelhecimento da população brasileira. Atualmente, a causa mais comum de EAo é a calcificação/degeneração aórtica, que acomete principalmente pacientes idosos. O tratamento transcateter tornou-se uma opção à troca valvar cirúrgica não só em pacientes frágeis e de alto risco, mas também nos outros extratos de risco operatório. Dessa maneira, o Heart Team torna-se cada vez mais importante e necessário para a decisão da intervenção em tais pacientes.73
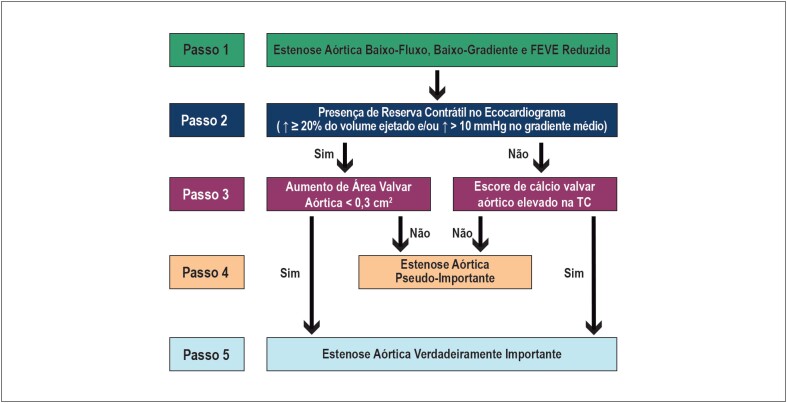
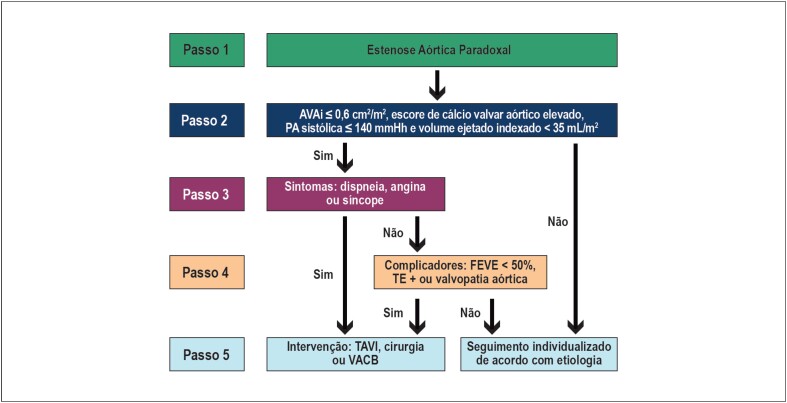
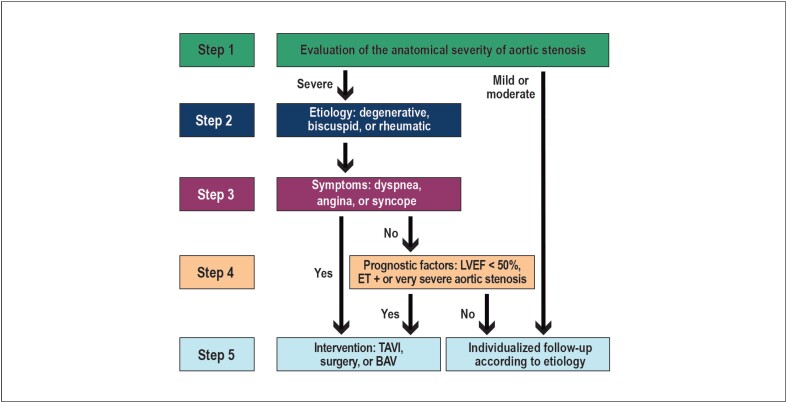
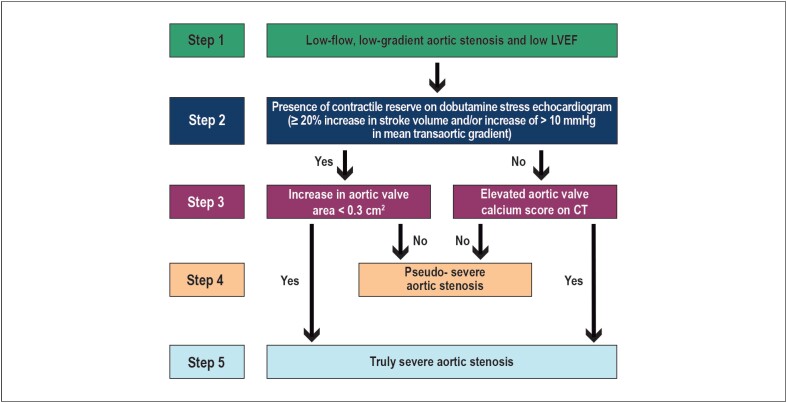
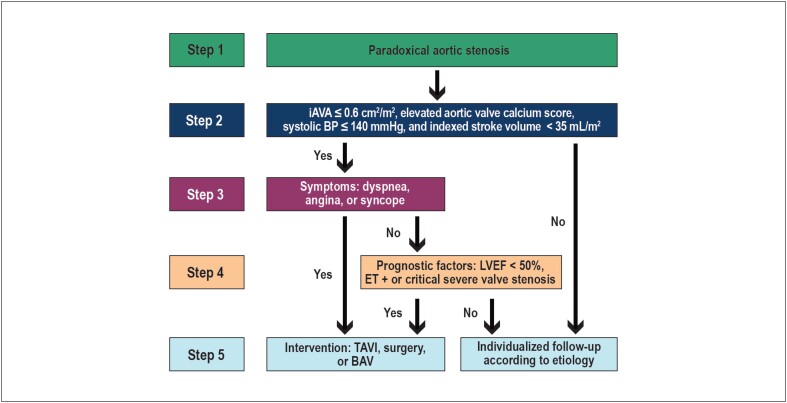
De acordo com as evidências atuais e seguindo as recomendações das diretrizes brasileiras de 2017, o primeiro passo para a avaliação do paciente com EAo para indicação de intervenção é a definição da gravidade anatômica da valvopatia (Quadro 22). Até o presente momento, apenas pacientes com EAo anatomicamente importante têm benefício de intervenção. A EAo importante é definida ecocardiograficamente com área valvar aórtica (AVA) ≤ 1,0 cm² e/ou AVA indexada ≤ 0,6 cm²/m² na presença de gradiente médio VE/aorta ≥ 40 mmHg ou velocidade máxima do jato aórtico ≥ 4,0 m/s. Pacientes com EAo baixo-fluxo e baixo-gradiente (AVA ≤ 1,0 cm² e gradiente médio VE/aorta < 40 mmHg) quando confirmada a gravidade anatômica, também podem ter indicação de intervenção. No caso daqueles com EAo baixo-fluxo e baixo-gradiente e FEVE preservada, é necessária a realização de escore de cálcio valvar que, se elevado (maior que 1300 AU para mulheres e maior que 2000 AU para homens), confirma EAo importante.74–82 Já naqueles com EAo baixo-fluxo e baixo-gradiente e FEVE reduzida, deve ser realizado ecocardiograma com estresse com dobutamina. Se houver reserva contrátil e a AVA mantiver reduzida, definimos EAo importante.83–86 Se não houver reserva contrátil, também deve ser realizada a avaliação com escore de cálcio valvar para definição da gravidade anatômica.74–78,87 Tais pacientes sem reserva contrátil também têm benefício com a realização de intervenção cirúrgica ou transcateter.
Quadro 22. Passo 1: Diagnóstico de estenose aórtica importante74–87.
| Característica de estenose aórtica importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma | |
| Ecocardiograma sob estresse com dobutamina |
|
| Tomografia computadorizada de tórax multidetectora |
|
| Estudo hemodinâmico |
|
| Situação especial |
|
Nos casos de EAo com baixo-fluxo, baixo-gradiente e FEVE preservada ou reduzida, devemos atentar para possíveis erros de aferição das medidas ecocardiográficas. AVA: área valvar aórtica; EAo: estenose aórtica; FEVE: fração de ejeção do VE; VE: ventrículo esquerdo.
O segundo passo é a avaliação da etiologia (Quadro 23).88,89 Nos países desenvolvidos, existe maior prevalência de etiologia degenerativa/calcifica nos idosos, enquanto em países subdesenvolvidos, as etiologias reumática e bicúspide predominam em pacientes jovens. No Brasil, devido a sua pirâmide etária transicional, típica de países em desenvolvimento, encontramos um pico bimodal de prevalência de EAo, ou seja, encontramos pacientes de todas as etiologias nas diferentes faixas etárias. A importância da definição da etiologia da EAo também se traduz na escolha do tratamento (Passo 5). Pacientes com EAo reumática usualmente são jovens e não foram contemplados nos estudos de implante transcateter de bioprótese aórtica (TAVI, do inglês transcatheter aortic valve implantation). A grande maioria dos pacientes estudados apresentava etiologia degenerativa. Entretanto, já existem evidências da factibilidade do procedimento em pacientes com válvula aórtica bicúspide.90
Quadro 23. Passo 2: avaliação da etiologia na estenose aórtica importante88,89.
| Características etiológicas | |
|---|---|
| Aterosclerótica/degenerativa |
|
| Reumática |
|
| Bicúspide |
|
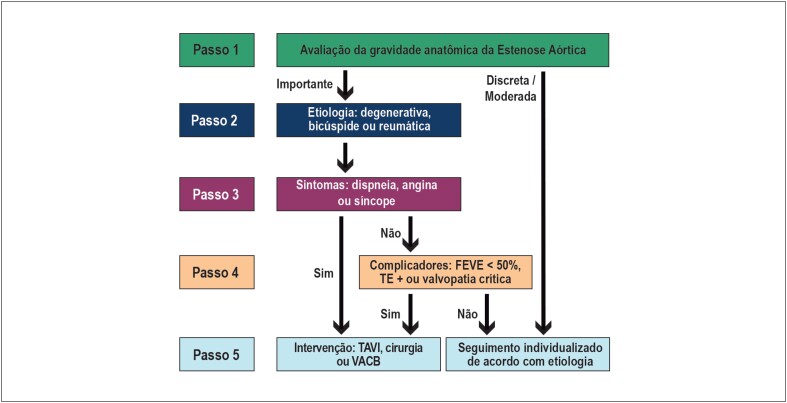
O terceiro passo trata-se da avaliação de sintomas atribuíveis à valvopatia (Quadro 24). Pacientes com EAo importante e dispneia, angina ou síncope têm indicação inequívoca de intervenção.
Quadro 24. Passo 3: Avaliação de sintomas na estenose aórtica importante.
| Sintomas | |
|---|---|
| Dispneia |
|
| Angina |
|
| Síncope |
|
No caso de ausência de sintomas, devemos avaliar a presença de complicadores para indicar intervenção (Quadro 25).91–95 Atualmente, os complicadores contemplados nas diretrizes são:
Quadro 25. Passo 4: Avaliação de complicadores na estenose aórtica importante91–98.
| Complicadores | |
|---|---|
| Ecocardiograma |
|
| Teste ergométrico/ergoespirométrico |
|
AVA: área valvar aórtica; FEVE: fração de ejeção do VE; VE: ventrículo esquerdo.
-
–
Ecocardiograma: disfunção de VE (FEVE < 50%) e/ou marcadores de mau prognóstico (AVA < 0,7 cm2, velocidade máxima do jato aórtico > 5,0 m/s, gradiente médio VE/Aorta > 60 mmHg).96
-
–
Teste ergométrico: ausência de reserva inotrópica no teste ergométrico e/ou baixa capacidade funcional, hipotensão arterial durante esforço (queda de 20 mmHg na pressão arterial sistólica) e/ou presença de sintomas em baixas carga.97,98
O quinto e último passo é a escolha da intervenção (Quadros 26, 27 e Figura 5, 6 e 7). A TAVI transfemoral é preferível em relação aos outros acessos torácicos (transaórtico e transapical) por ser menos invasiva e com menor taxa de complicações. Assim, tais acessos são recomendados apenas quando há contraindicação técnica para a realização do acesso femoral.
Quadro 26. Passo 5: tipo de intervenção na estenose aórtica importante90,99–132.
| Tipo | Considerações |
|---|---|
| Cirurgia de troca valvar aórtica* |
|
| Implante de bioprótese aórtica transcateter - TAVI |
|
| Valvoplastia aórtica por cateter-balão |
|
As diretrizes europeias a norte-americanas atuais são categóricas na indicação preferencial da TAVI em detrimento da cirurgia para pacientes inoperáveis, frágeis e/ou de alto risco cirúrgico (avaliados pelos escores STS e EuroSCORE II). Entretanto, após a publicação de tais diretrizes, 4 trabalhos comparando a TAVI com a cirurgia em pacientes de baixo risco cirúrgico foram publicados. A metanálise de tais estudos demonstrou redução de mortalidade em 1 ano a favor da TAVI transfemoral. Tais resultados sugerem que a TAVI transfemoral deva ser o tratamento preferencial nestes pacientes. Entretanto, um ponto de relevância é a média etária de 75,4 anos e a carência de estudos sobre a durabilidade a longo prazo de tais próteses. Dessa maneira, em pacientes de baixo risco, e estendendo para o risco intermediário, devemos evitar o procedimento em pacientes com menos de 70 anos de idade até que dados robustos de durabilidade das próteses sejam publicados. STS: Society of Thoracic Surgeons; TAVI: implante transcateter de bioprótese aórtica.
Quadro 27. Estenose aórtica: Recomendações1,2,90,99–132.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Tratamento cirúrgico convencional ou TAVI* |
|
I A | I A | I B |
|
I B | I B | I C | |
| IIa B | IIa B | I C | ||
|
IIa C | IIa B | IIa C (BNP elevado para idade; PSAP>60 mmHg; velocidade máxima do jato > 5,5 m/s) | |
| Situações especiais | ||||
|
IIa B | IIa B | I C | |
| IIa C | – | IIa C | ||
| IIa C | IIa C | IIa C | ||
| Escolha da intervenção entre cirurgia e TAVI** |
|
I A | I A | I B |
| IIb A | – | – | ||
|
I A | I A | I B | |
| IIa A | I A | – | ||
|
I A | IIa B | I B | |
| IIa A | I B | I B | ||
|
I A | – | – | |
| I A | I B | I B | ||
|
IIb C | – | – | |
| I A | I B | I B | ||
| Valvoplastia aórtica por cateter-balão* |
|
IIa C | IIb C | IIb C |
|
IIb C | – | – |
Pré-requisito obrigatório: avaliação por Heart Team institucional, contemplando risco cirúrgico, grau de fragilidade, condições anatômicas e comorbidades.
Outros aspectos como factibilidade técnica, riscos e benefícios de cada procedimento, escolha do paciente, experiência local e disponibilidade dos procedimentos também devem ser levados em consideração para a escolha da técnica. As diretrizes americanas e europeias foram publicadas antes dos trabalhos de TAVI no contexto de baixo risco cirúrgico. Devemos levar tais dados em consideração na comparação das evidências das 3 diretrizes (SBC, AHA e ESC). AHA: American Heart Association; AVA: área valvar aórtica; CF: classe funcional; EAo: estenose aórtica; ESC: European Society of Cardiology; FEVE: fração de ejeção do VE; SBC: Sociedade Brasileira de Cardiologia; TAVI: implante transcateter de bioprótese aórtica; VE: ventrículo esquerdo.
Figura 5. Algoritmo para tomada de decisão na estenose aórtica. FEVE: fração de ejeção do ventrículo esquerdo; TE: teste ergométrico; TAVI: implante de bioprótese aórtica transcateter (da sigla em inglês, transcateter aortic valve implantation); VACB: valvoplastia aórtica cateter-balão.
Figura 6. Algoritmo para confirmação da gravidade anatômica na estenose aórtica baixo-fluxo, baixo-gradiente com fração de ejeção reduzida. FEVE: fração de ejeção do ventrículo esquerdo; TC: tomografia computadorizada.
Figura 7. Algoritmo para tomada de decisão na estenose aórtica paradoxal. AVAi: área valvar aórtica indexada; PA: pressão arterial; FEVE: fração de ejeção do ventrículo esquerdo; TE: teste ergométrico; TAVI: implante de bioprótese aórtica transcateter (da sigla em inglês, transcatheter aortic valve implantation); VACB: valvoplastia aórtica cateter-balão.
Todas as diretrizes atuais são categóricas na indicação preferencial da TAVI em detrimento da cirurgia para pacientes inoperáveis, frágeis e/ou de alto risco cirúrgico (avaliados pelos escores STS e EuroSCORE II).99–113 Entretanto, após a publicação de tais diretrizes, 4 trabalhos comparando a TAVI com a cirurgia em pacientes de baixo risco cirúrgico foram publicados. A metanálise de tais estudos demonstrou redução de mortalidade em 1 ano a favor da TAVI transfemoral. Tais resultados sugerem que a TAVI transfemoral deva ser o tratamento preferencial em tais pacientes. Entretanto, um ponto de relevância é a média etária de 75,4 anos. Dessa maneira, em pacientes de baixo risco, e estendendo para o risco intermediário, devemos evitar o procedimento em pacientes com menos de 70 anos de idade até que dados robustos de durabilidade das próteses sejam publicados. 100,114–120
Outro aspecto relevante e unânime nas diretrizes brasileiras e internacionais é a necessidade de avaliação de cada caso por um Heart Team. Outros aspectos como factibilidade técnica, riscos e benefícios de cada procedimento, escolha do paciente, experiência local e disponibilidade dos procedimentos também devem ser levados em consideração para a escolha da técnica.
Alguns grupos de pacientes devem ser monitorizados frequentemente devido o risco de evolução da valvopatia para um quadro que necessite de intervenção (Quadro 28). Tais grupos são:
Quadro 28. Estenose aórtica: Acompanhamento individualizado1,2.
| Estenose aórtica | Acompanhamento | SBC | AHA | ESC |
|---|---|---|---|---|
| Importante assintomático e sem complicadores |
|
A cada 6 meses | A cada 0,5-1 ano | A cada 6 meses |
|
I C | I B | I C | |
| Moderada (AVA entre 1,0-1,5 cm² e gradiente médio VE/Aorta 25-39 mmHg) |
|
A cada ano | A cada 1-2 anos | A cada ano |
|
IIa C | IIa C | IIa C | |
| Discreta (AVA > 1,5 cm² e gradiente médio VE/Aorta < 25 mmHg) |
|
A cada 2-3 anos | A cada 3-5 anos | A cada 2-3 anos |
AHA: American Heart Association; AVA: área valvar aórtica; ESC: European Society of Cardiology; SBC: Sociedade Brasileira de Cardiologia; VE: ventrículo esquerdo.
-
–
EAo importante assintomático e sem complicadores: até o presente momento, apresentam indicação cirurgia valvar apenas se submetidos a outros procedimentos cardiovasculares invasivos (revascularização coronária, aorta ascendente ou outra válvula). Trabalhos avaliando o benefício de intervenção precoce neste grupo de pacientes estão em andamento.
-
–
EAo moderada, definida como AVA entre 1,0-1,5 cm² e gradiente médio VE/Aorta 25-39 mmHg: apresentam indicação cirurgia valvar apenas se submetidos a outros procedimentos cardiovasculares invasivos (revascularização coronária, aorta ascendente ou outra válvula).
-
–
EAo discreta, definida como AVA > 1,5 cm² e gradiente médio VE/Aorta < 25 mmHg: indicação apenas de acompanhamento clínico/ecocardiográfico.
9. Insuficiência Aórtica Crônica
A abordagem clínica escalonada através de cinco passos (Figura 8), marco das Diretrizes Brasileiras de Valvopatias, também é recomendada para o manejo da insuficiência aórtica (IAo) crônica. O primeiro passo para o manejo apropriado dos portadores de IAo consiste na caracterização de sua gravidade anatômica, sobretudo a identificação dos portadores de lesões anatomicamente importantes. O Quadro 29 apresenta os principais achados de exame clínico e de métodos complementares para definição de IAo importante.133,134 De maneira geral, o ecocardiograma transtorácico ainda representa a principal ferramenta para diagnóstico e gradação da gravidade da IAo. A ecocardiografia tridimensional tem sido cada vez mais incorporada na avaliação complementar, especialmente nos casos de limitação na análise bidimensional (jatos excêntricos, determinação anatômica como em valvopatia bicúspide). Além disso, recentemente, destaca-se o surgimento de estudos com a aplicação de ressonância magnética de coração na avaliação da IAo, com possibilidade de aquisição de novos marcadores diagnósticos e prognósticos como a fração regurgitante e estimativa do volume diastólico final do ventrículo esquerdo.134
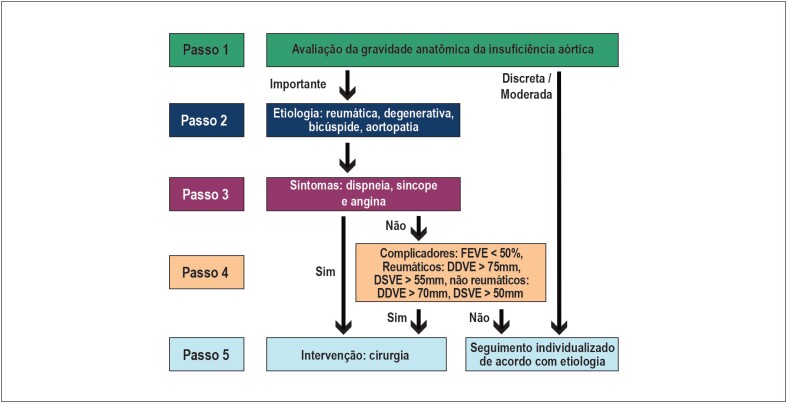
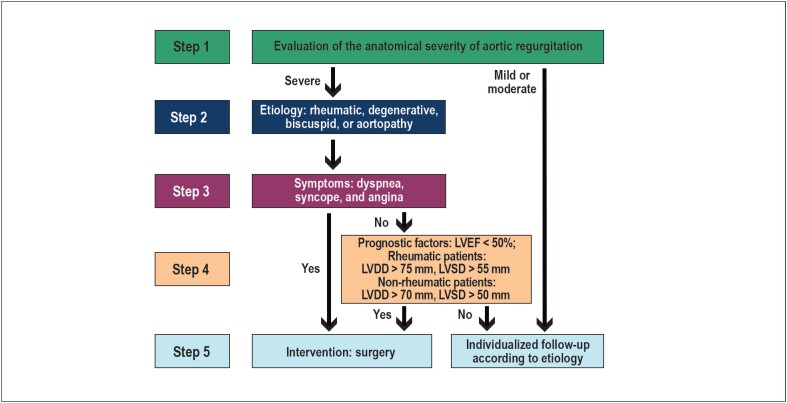
Figura 8. Algoritmo para tomada de decisão na insuficiência aórtica crônica. DDVE: diâmetro diastólico do ventrículo esquerdo; DSVE: diâmetro sistólico do ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo.
Quadro 29. Passo 1: Diagnóstico de insuficiência aórtica importante133,134.
| Característica de Insuficiência Aórtica importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
| Ressonância Magnética |
|
| Angiotomografia de aorta |
|
ERO: área efetiva do orifício regurgitante; VE: ventrículo esquerdo.
No segundo passo (Quadro 30), há que se verificar a etiologia responsável pela IAo. Do ponto de vista etiopatogênico, a IAo crônica relaciona-se a alterações anatômicas relacionadas aos folhetos das semilunares e/ou patologias do ânulo valvar aórtico. Dentre as causas condicionadas por disfunção dos folhetos valvares destacam-se a sequela reumática (ainda uma das principais etiologias no Brasil), endocardite infecciosa (EI), degenerativa, malformações congênitas como a valvopatia bicúspide e degeneração mixomatosa. Quanto às alterações relacionadas ao anel valvar aórtico, destacamos a dissecção de aorta ascendente, dilatações aneurismáticas (provocadas principalmente por hipertensão arterial sistêmica e doenças do colágeno como Marfan e Ehlers-Danlos), espondiloartropatias soronegativas (espondilite anquilosante, doença de Reiter), aortite sifilítica e arterite de Takayasu.135,136
Quadro 30. Passo 2: Avaliação da etiologia na insuficiência aórtica importante135,136.
| Características etiológicas | |
|---|---|
| Reumática |
|
| Aterosclerótica |
|
| Bicúspide |
|
| Doenças relacionadas à alteração da geometria da raiz da aorta |
|
| Outras |
|
EAo: estenose aórtica.
O terceiro passo (Quadro 31) caracteriza-se pela avaliação de sintomas relacionados à IAo. A identificação dos sintomas pode ser tarefa difícil na rotina assistencial, sobretudo em pacientes idosos que comumente recorrem à prática de autolimitação. Nestes casos, a incorporação de testes funcionais provocativos, como a ergoespirometria, pode auxiliar na identificação destes “assintomáticos” autolimitados. Tendo em vista a elevada morbimortalidade relacionada à instalação de sintomas, sua identificação condiciona o referenciamento do paciente para a intervenção cirúrgica.
Quadro 31. Passo 3: Avaliação de sintomas na insuficiência aórtica importante.
| Sintomas | |
|---|---|
| Dispneia |
|
| Angina |
|
| Síncope |
|
VE: ventrículo esquerdo.
No quarto passo (Quadro 32), destaca-se a avaliação de complicadores relacionados à IAo. Este estágio tem especial relevância nos pacientes assintomáticos. O principal complicador da IAo consiste na perda de função sistólica do VE, relacionada ao estresse sistólico e dilatação ventricular. Chaliki et al, em estudo retrospectivo, verificaram reduzida sobrevida em portadores de IAo com FEVE inferior a 50%. As taxas de mortalidade pós-operatória também foram influenciadas pela função ventricular (14% para pacientes com FEVE inferior a 35%, 6,7% para FEVE entre 35 a 50% e 3,7% para pacientes com FEVE superior a 50%, p = 0,02). 137
Quadro 32. Passo 4: Avaliação de complicadores134,137, 137–139,141.
| Complicadores | |
|---|---|
| Ecocardiograma |
|
| Ressonância Magnética |
|
| Angiotomografia |
|
DDVE: diâmetro diastólico do ventrículo esquerdo; DSVE: diâmetro sistólico do ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo;; VE: ventrículo esquerdo.
O remodelamento ventricular ainda representa uma ambivalência clínica: de um lado o aumento dos diâmetros ventriculares funciona como um mecanismo adaptativo à sobrecarga volumétrica; por outro lado, o remodelamento ventricular pode determinar pior prognóstico, sobretudo em populações não reumáticas. Em estudo nacional conduzido com 75 pacientes assintomáticos com IAo importante de etiologia reumática, a estratégia de indicar tratamento cirúrgico baseada no surgimento de sintomas mesmo em pacientes com diâmetro diastólico do VE (DDVE) maior que 75mm e DSVE maior que 55mm com função de VE normal foi eficaz em promover a melhora da qualidade de vida e regressão da dilatação, com taxa de sobrevida de 90,6% em dez anos.138 Por outro lado, estudos prospectivos com populações com maior predomínio de IAo não reumática verificaram que valores de DSVE acima de 50 mm associaram-se com desfechos clínicos compostos (morte, sintomas e/ou disfunção ventricular) de até 19%/ano. Mais recentemente, há evidências de que a indexação destes diâmetros pela superfície corpórea seja mais apropriada, sobretudo para mulheres. Um estudo com 246 pacientes com IAo assintomáticos verificou que valores de DSVE indexado iguais ou superiores a 25 mm/m2 associaram-se a desfechos negativos (mortalidade, sintomas e disfunção ventricular).139 Mais recentemente, estudos avaliaram o papel do peptídeo natriurético cerebral (BNP: sigla do inglês Brain Natriuretic Peptide) na IAo. Valores de corte de 130 pg/mL para BNP e 602 pg/mL para o NT-pro-BNP associaram-se com desfechos clínicos adversos. A combinação destes valores de BNP com parâmetros ecocardiográficos pode melhorar a capacidade de estratificação dos pacientes assintomáticos. Elevações persistentes de BNP durante o seguimento clínico também foram relacionadas a eventos clínicos adversos.140
Parâmetros ecocardiográficos funcionais como o estresse longitudinal também são preditores evolutivos na IAo assintomática, influenciando inclusive os resultados pós-operatórios. A limitação para utilização clínica do estresse longitudinal na IAo consiste na divergência para os pontos de corte a serem utilizados.
Outro complicador relacionado à IAo consiste na fibrose miocárdica pelo realce tardio. A ressonância magnética de coração com realce tardio é o principal método de imagem capaz para sua quantificação. Estudos demonstram que a presença de fibrose miocárdica influencia o período pós-operatório, associando-se à persistência de sintomas, falência de recuperação da função ventricular e maior mortalidade.141 Ainda relativo à ressonância magnética, novos estudos demonstram que fração regurgitante acima de 33% e volume diastólico final do VE acima de 246 ml foram associados a menor sobrevida livre de cirurgia. Estes novos parâmetros podem melhorar a estratificação dos pacientes assintomáticos, assegurando indicações cirúrgicas mais precisas.134
Por fim, no quinto passo, definimos a necessidade de intervenção na IAo (Quadros 33 e 34). O tratamento cirúrgico com troca valvar aórtica consiste ainda na principal terapia intervencionista na IAo.142,143 As taxas de mortalidade cirúrgica variam de 1% (procedimento de troca valvar isolada) até 7% (procedimentos combinados). O aparecimento de sintomas, redução da função sistólica e remodelamento excessivo do VE geram pior prognóstico e, portanto, são os principais deflagradores do tratamento cirúrgico. Como exposto anteriormente, novos complicadores relacionados à fibrose miocárdica, remodelamento ventricular e comportamento de biomarcadores podem representar potenciais deflagradores de intervenção. O acompanhamento clínico dos pacientes sem indicação de intervenção está descrito no Quadro 35.
Quadro 33. Passo 5: Intervenção na insuficiência aórtica importante142,143.
| Tipo de intervenção | Considerações |
|---|---|
| Cirurgia (troca valvar) |
|
| TAVI |
|
TAVI: implante transcateter de bioprótese aórtica.
Quadro 34. Insuficiência aórtica: Recomendações1,2,142,143.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Cirurgia de troca valvar |
|
I B | I B | I B |
|
I B | I B | I B | |
|
IIa B Reumático DDVE > 75 mm ou DSVE > 55 mm IIa B Não reumático DDVE > 70 mm ou DSVE > 50 mm ou DSVE indexado > 25 mm/m² |
IIa C DDVE > 70 mm ou DSVE > 50 mm ou DSVE indexado > 25 mm/m² |
IIa B DDVE > 70 mm ou DSVE > 50 mm ou DSVE indexado >25 mm/m² |
|
| Implante valvar transcateter – TAVI* |
|
IIb C* | – | – |
Considerar discussão junto ao Heart Team. AHA: American Heart Association; DDVE: diâmetro diastólico do ventrículo esquerdo; DSVE: diâmetro sistólico do ventrículo esquerdo; ESC: European Society of Cardiology; FEVE: fração de ejeção do VE; SBC: Sociedade Brasileira de Cardiologia; TAVI: implante transcateter de bioprótese aórtica.
Quadro 35. Insuficiência aórtica: Acompanhamento individualizado1,2.
| Insuficiência aórtica | Acompanhamento | SBC | AHA | ESC |
|---|---|---|---|---|
| Importante assintomático e sem complicadores |
|
A cada 0,5 a 1 ano | A cada 0,5 a 1 ano | A cada 3 a 6 meses |
|
I C | I C | I C | |
| Moderada (Vena contracta 0,3-0,6 cm, Largura do jato 0,25-0,64, Fração regurgitante 30-49%, Volume regurgitante 30-59mL/batimento, ERO 0,10-0,29 cm²) |
|
A cada 1-2 anos | A cada 1-2 anos | A cada 1-2 anos |
|
IIa C | IIa C | – | |
| Discreta (Vena contracta < 0,3 cm, Largura do jato < 0,25, Fração regurgitante < 30%, Volume regurgitante < 30 ml/batimento, ERO < 0,10 cm²) |
|
A cada 3-5 anos | A cada 3-5 anos | A cada 1-2 anos |
AHA: American Heart Association; ERO: área efetiva do orifício regurgitante; ESC: European Society of Cardiology; SBC: Sociedade Brasileira de Cardiologia.
10. Estenose Tricúspide
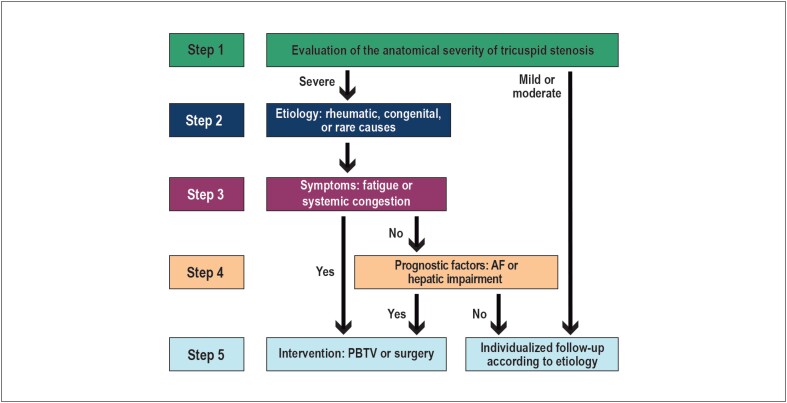
A estenose tricúspide (ET) é uma valvopatia rara, habitualmente associada à IT. O ecocardiograma mantém-se como principal ferramenta para definição da gravidade anatômica (Quadro 36). 144
Quadro 36. Passo 1: Diagnóstico de estenose tricúspide importante144.
| Características de Estenose Tricúspide importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
| Ressonância Magnética |
|
AD: átrio direito; FA: fibrilação atrial; PHT: pressure half time.
Sua etiologia mais comum é a doença reumática, e neste caso geralmente ocorre concomitantemente ao comprometimento da valva mitral e/ou da valva aórtica. Ocorre espessamento e retração das cúspides, com acometimento comissural. Outras possíveis causas de ET são ainda mais raras, e estão descritas no Quadro 37.145–147
Quadro 37. Passo 2: Avaliação da etiologia na estenose tricúspide importante145–147.
| Características etiológicas | |
|---|---|
| Reumática |
|
| Outras |
|
Tanto os sintomas quanto as alterações do exame físico restringem-se habitualmente aos pacientes com ET anatomicamente importante. O sintoma mais comumente encontrado é a fadiga, que pode estar associada a sintomas de insuficiência cardíaca de câmaras direitas (Quadro 38).
Quadro 38. Passo 3: Avaliação de sintomas na estenose tricúspide importante.
| Sintomas | |
|---|---|
| Fadiga |
|
Quando os pacientes forem portadores de ET importante, mas ainda não tiverem sintomas secundários à valvopatia, deve ser avaliado se apresentam ou não complicadores (Quadro 39).
Quadro 39. Passo 4: Avaliação de complicadores na estenose tricúspide importante.
| Complicadores | |
|---|---|
| Eletrocardiograma |
|
| Congestão sistêmica |
|
FA: fibrilação atrial.
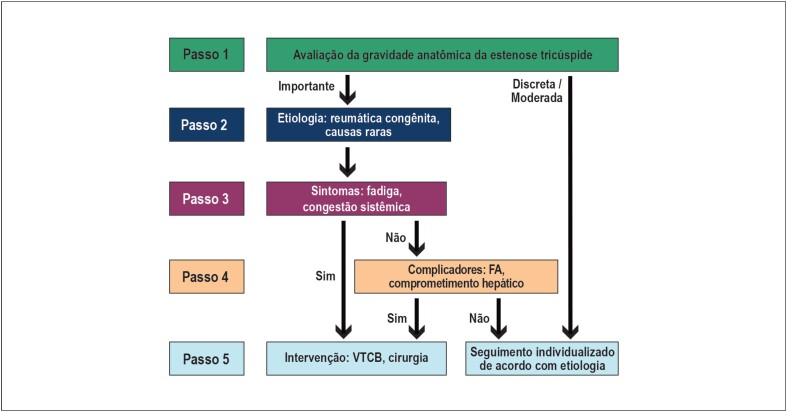
A presença de sintomas ou dos complicadores descritos acarreta na indicação de intervenção sobre a valvopatia. Apesar da raridade dos casos e da escassez da literatura, a valvoplastia tricúspide por cateter-balão (VCTB) ainda é o tratamento de escolha (Quadros 40, 41 e Figura 9).148
Quadro 40. Passo 5: Tipo de intervenção na estenose tricúspide importante148.
| Tipo | Considerações |
|---|---|
| Valvoplastia tricúspide por balão |
|
| Troca da valva tricúspide |
|
Quadro 41. Estenose tricúspide: Recomendações1,2,148.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Valvoplastia tricúspide por cateter-balão |
|
IIa C | IIb C | – |
|
I C | I C | – | |
|
III | – | – | |
| Troca da valva tricúspide ou plástica (comissurotomia) |
|
I C | I C | I C |
|
IIa C | I C | I C | |
|
I C | – | – |
AHA: American Heart Association; ESC: European Society of Cardiology; ET: estenose tricúspide; SBC: Sociedade Brasileira de Cardiologia; VTCB: valvoplastia tricúspide por cateter-balão.
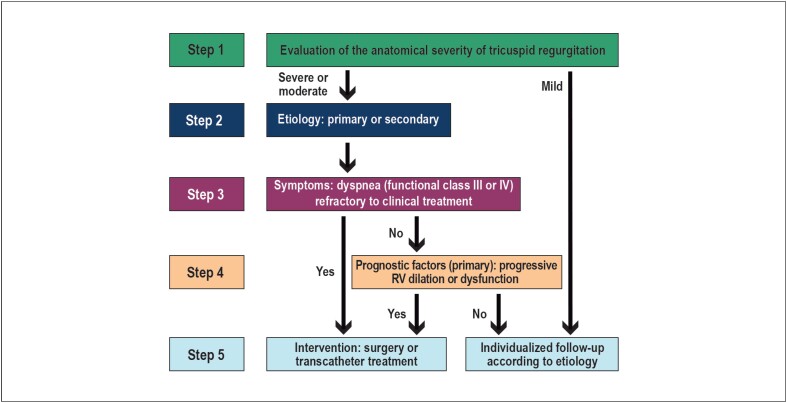
Figura 9. Algoritmo para tomada de decisão na estenose tricúspide. FA: fibrilação atrial; VTCB: valvoplastia tricúspide por cateter-balão.
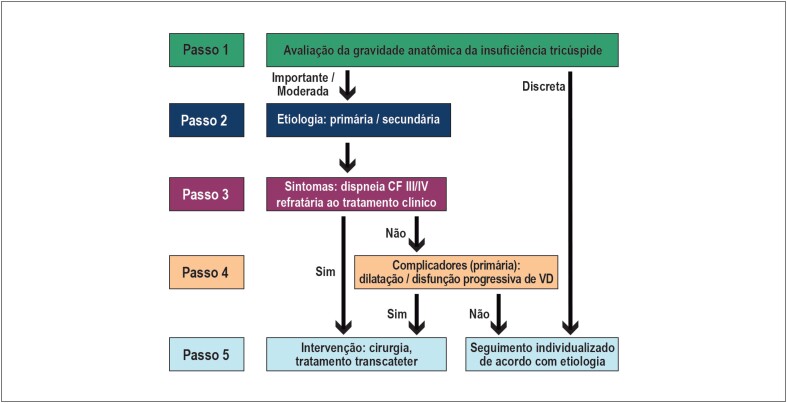
11. Insuficiência Tricúspide
Pacientes com insuficiência tricúspide (IT) discreta habitualmente não requerem qualquer tipo de abordagem direcionada à valva tricúspide. Os pacientes com IT moderada a importante são aqueles que exigirão um acompanhamento específico, em particular relacionado ao esclarecimento da etiologia da valvopatia e das repercussões a ela associadas (Quadro 42).149
Quadro 42. Passo 1: Diagnóstico de insuficiência tricúspide importante149.
| Características de Insuficiência Tricúspide Importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
| Ressonância Magnética |
|
FA: fibrilação atrial; ERO: área efetiva do orifício regurgitante; PSAP: pressão sistólica da artéria pulmonar.
A IT é habitualmente funcional, secundária a condições clínicas que levam à dilatação do anel valvar tricúspide, principalmente envolvendo as câmaras cardíacas esquerdas (doenças valvares ou cardiomiopatias) e/ou HP. Os casos de IT primária em geral estão relacionados à doença reumática, podendo ainda estar associados a intervenções médicas (biópsias endomiocárdicas de repetição, presença de eletrodos de marcapasso ou cardiodesfibrilador implantável) ou ocorrer em consequência de EI ou outras causas mais raras (Quadro 43).150
Quadro 43. Passo 2: Avaliação da etiologia na insuficiência tricúspide importante150.
| Características etiológicas | |
|---|---|
| Primária |
|
| Secundária |
|
| Causas raras |
|
FA: fibrilação atrial; HP: hipertensão pulmonar.
Nos pacientes com IT importante, conforme aumenta o período de tempo em que o paciente mantém disfunção valvar significativa, poderão surgir sintomas que terão impacto significativo para a tomada de decisão sobre o melhor tratamento a ser instituído (Quadro 44).
Quadro 44. Passo 3: Avaliação de sintomas na insuficiência tricúspide importante.
| Sintomas | |
|---|---|
| Dispneia (NYHA II – IV) |
|
| Fadiga |
|
IT: insuficiência tricúspide; NYHA: New York Heart Association.
Por outro lado, mesmo naqueles pacientes que não apresentarem sintomas pode haver evolução com remodelamento do ventrículo direito, que poderá justificar intervenção sobre a valva. Assim, os pacientes com dilatação ou disfunção (exceto importante) do ventrículo direito serão considerados como portadores de fator complicador (Quadro 45).
Quadro 45. Passo 4: Avaliação de complicadores na insuficiência tricúspide importante.
| Complicadores | |
|---|---|
| Ecocardiograma |
|
IT: insuficiência tricúspide.
Novos dados têm elucidado a importância prognóstica da IT. Um estudo recentemente publicado encontrou uma prevalência de IT moderada a importante de 0,55% na população, sendo 72% dos casos secundários à presença de valvopatia esquerda (49,5%) ou HP (23%). Neste estudo, apenas 8% dos casos ocorreram de forma isolada. Os pacientes com IT isolada moderada a importante apresentaram maior taxa de mortalidade (risco relativo 1,68, com IC 95% 1,04 a 2,6, p = 0,03), confirmando dados que haviam sido publicados pelo mesmo grupo já em 2014.151 Esta maior mortalidade foi também demonstrada em uma metanálise recente, na qual foram incluídos 70 estudos, tendo sido encontrado quase o dobro de mortalidade nos pacientes portadores de IT moderada ou importante (risco relativo 1,95, IC 95% 1,75 a 2,17). Esta maior taxa de óbito foi mantida nas análises mesmo após serem feitos ajustes pela presença ou não de disfunção do ventrículo direito, de HP, de FA, de IM ou de disfunção de VE.152
O tratamento intervencionista de escolha, quando indicado, será a plástica da valva tricúspide, com utilização de anel protético capaz de diminuir o diâmetro do anel tricuspídeo, melhorar a coaptação dos folhetos valvares e corrigir a regurgitação. A troca valvar fica reservada aos pacientes sem condição anatômica para que seja realizada plástica com resultado satisfatório. Cabe observar que a abordagem cirúrgica isolada sobre a valva tricúspide segue sendo pouco indicada atualmente, e apresenta o maior risco cirúrgico entre as cirurgias valvares, com taxas de mortalidade cirúrgica que variam de 8,8% a 9,7%. Além disso, apesar dos estudos que demonstram aumento da taxa de mortalidade em pacientes com IT moderada a importante, ainda não há dados demonstrando melhora de sobrevida com o tratamento cirúrgico. Assim, a indicação cirúrgica ainda tem como principal objetivo, nesta população, a melhora dos sintomas e a prevenção de disfunção importante do ventrículo direito.153–155
Paralelamente à cirurgia, tem crescido o número de estudos voltados ao tratamento intervencionista percutâneo da IT. Diversos dispositivos foram desenvolvidos, com estratégias que se baseiam na diminuição do anel valvar tricuspídeo, ou na melhora da coaptação entre os folhetos, ou ainda nos implantes valvares transcateter. Novos dados estarão disponíveis no futuro, e poderão dar maior suporte ao Heart Team para a indicação do implante destes dispositivos em pacientes com IT (Quadros 46, 47 e Figura 10) 149,156–158
Quadro 46. Passo 5: Tipo de intervenção na insuficiência tricúspide importante149,151–158.
| Tipo | Considerações |
|---|---|
| Plástica tricúspide com anel protético |
|
| |
| |
| Troca valvar cirúrgica |
|
| Implante valvar transcateter |
|
IT: insuficiência tricúspide.
Quadro 47. Insuficiência tricúspide: Recomendações1,2,149,151–158.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Plástica tricúspide com anel protético |
|
I C | I C | I C |
|
IIa C | IIa B | IIa C | |
|
IIa C | IIa B | IIa C | |
|
IIa C | IIb C | IIa C | |
|
IIa C | IIa C | IIa C | |
|
IIb C | IIb C | IIa C | |
| Troca valvar cirúrgica |
|
I C | I C | I C |
|
I B | – | – | |
| Implante valvar tricúspide transcateter |
|
IIb C* | – | – |
Considerar discussão junto ao Heart Team. AHA: American Heart Association; ESC: European Society of Cardiology; IT: insuficiência tricúspide; SBC: Sociedade Brasileira de Cardiologia.
Figura 10. Algoritmo para tomada de decisão na insuficiência tricúspide. VD: ventrículo direito.
12. Disfunção de Prótese Valvar
Após cirurgia de troca valvar, os seguimentos clínico e ecocardiográfico periódicos devem ser realizados para a detecção precoce de disfunção de prótese, assim como para a identificação de sintomas e complicadores anatômicos e funcionais secundários a essa disfunção.
O principal exame para suspeita e diagnóstico da disfunção de prótese é o ecocardiograma transtorácico. Entretanto, ecocardiograma transesofágico e a angiotomografia de aorta com sincronizada ao ECG ganham espaço principalmente na avaliação de trombose de bioprótese (Quadros 48 e 49).159
Quadro 48. Passo 1: Diagnóstico de disfunção de prótese valvar importante.
| Características da Disfunção de Prótese Valvar Importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma transtorácico |
|
| Ecocardiograma transesofágico |
|
| Estudo hemodinâmico com manometria |
|
| Angiotomografia de aorta sincronizada ao ECG |
|
AOE: área efetiva do orifício; ECG: eletrocardiograma; TAVI: implante transcateter de bioprótese aórtica.
Quadro 49. Passo 2: Avaliação da etiologia da disfunção de prótese valvar importante159.
| Características etiológicas | |
|---|---|
| Estenose de prótese | |
| Regurgitação de prótese |
|
AOE: área efetiva do orifício.
O sintoma mais frequentemente encontrado é a dispneia, decorrente da congestão venocapilar pulmonar consequente a disfunção valvar (Quadro 50).
Quadro 50. Passo 3: Avaliação de sintomas da disfunção de prótese valvar importante.
| Sintomas | |
|---|---|
| Dispneia (NYHA II – IV) |
|
NYHA: New York Heart Association.
A avaliação de complicadores na disfunção de prótese é complexa pois em muitos casos o paciente já apresenta HP, dilatação ou disfunção ventricular decorrente da valvopatia prévia. Dessa maneira, a progressão de tais alterações deve ser notada e levada em consideração para indicação de intervenção (Quadro 51).
Quadro 51. Passo 4: Avaliação de complicadores da disfunção de prótese valvar importante.
| Complicadores | |
|---|---|
| Ecocardiograma |
|
| Anemia hemolítica |
|
HP: hipertensão pulmonar; VE: ventrículo esquerdo.
Novos procedimentos, como tratamento percutâneo de regurgitação paravalvar e valve-in-valve já são realidade e estão incluídos nas novas Diretrizes (Quadros 52 e 53).159–162
Quadro 52. Passo 5: Tipo de intervenção da disfunção de prótese valvar importante 159–162.
| Tipo | Considerações |
|---|---|
| Cirurgia (retroca valvar) |
|
| Intervenção por cateter - Valve-in-valve |
|
| Oclusão percutânea de regurgitação paravalvar |
|
CF: classe funcional.
Quadro 53. Disfunção de prótese valvar: Recomendações1,2,159–162.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Retroca valvar cirúrgica |
|
I B | I B | I C |
|
IB | I B | I C | |
|
IIa C | IIa C* | IIa C | |
| Oclusão percutânea de regurgitação paravalvar |
|
IIa B | IIa B | – |
| Valve-in-valve |
|
IIa B | IIa B | IIa C |
Bioprótese aórtica com regurgitação. AHA: American Heart Association; ESC: European Society of Cardiology; SBC: Sociedade Brasileira de Cardiologia.
13. Doença Multivalvar
Considera-se doença multivalvar o acometimento primário de duas ou mais valvas. Portanto, são excluídas dessa classificação valvopatias secundárias a uma valvopatia primária, como é o caso da IT funcional, consequente à doença mitral, assim como a IM secundária ao remodelamento ventricular esquerdo consequente à valvopatia aórtica (Quadro 54).163–165
Quadro 54. Passo 1: Diagnóstico de doença multivalvar importante163–165.
| Características de Doença Multivalvar Importante | |
|---|---|
| Exame físico |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico |
|
FA: fibrilação atrial; IT: insuficiência tricúspide; VE: ventrículo esquerdo.
No Brasil, a doença multivalvar é resultado do acometimento reumático na maioria das vezes, porém há um aumento progressivo de doença mitroaórtica degenerativa calcífica (Quadro 55).159
Quadro 55. Passo 2: Avaliação da etiologia da doença multivalvar importante159,163–165.
| Características etiológicas | |
|---|---|
| Febre reumática |
|
| Endocardite Infecciosa |
|
| Calcificação do aparelho valvar |
|
| Síndrome de Marfan/Ehlers-Danlos |
|
Os sintomas geralmente estão associados à valvopatia de maior gravidade anatômica e, nos casos em que ambas são importantes, a valvopatia mais proximal costuma prevalecer (Quadro 56).
Quadro 56. Passo 3: Avaliação de sintomas da doença multivalvar importante.
| Sintomas | |
|---|---|
| Dispneia (NYHA II – IV) |
|
| Dor precordial |
|
| Baixo débito/síncope |
|
EAo: estenose aórtica; HP: hipertensão pulmonar; IM: insuficiência mitral.
Os complicadores, quando presentes, decorrem da valvopatia com maior gravidade anatômica (Quadro 57).
Quadro 57. Passo 4: Avaliação de complicadores da doença multivalvar importante.
| Complicadores | |
|---|---|
| Hipertensão pulmonar |
|
| Fibrilação atrial de início recente |
|
| Aumento de diâmetros ventriculares |
|
AE: átrio esquerdo; PSAP: pressão sistólica da artéria pulmonar.
O tratamento padrão da doença mitroaórtica com sintomas e/ou complicadores é o tratamento cirúrgico, no entanto, as estratégias transcateter podem ser indicadas em casos selecionados, principalmente em pacientes com alto risco presumido para cirurgia convencional (Quadros 58 e 59).163–165
Quadro 58. Passo 5: Tipo de intervenção da doença multivalvar importante163–165.
| Tipo | Considerações |
|---|---|
| Valvoplastia mitral por cateter-balão |
|
| Tratamento cirúrgico (comissurotomia/troca valvar) |
|
| Tratamento transcateter – Valve-in-Valve |
|
| Tratamento transcateter – TAVI e clipagem percutânea mitral |
|
EAo: estenose aórtica; EM: estenose mitral; IM: insuficiência mitral; TAVI: implante transcateter de bioprótese aórtica.
Quadro 59. Doença multivalvar: Recomendações1,2,163–165.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Valvoplastia mitral por cateter-balão |
|
I A | – | – |
| Tratamento cirúrgico/troca valvar |
|
I B | I B | I B |
|
IIa C | – | – | |
|
I C | I C | I C | |
| Tratamento transcateter – Valve-in-Valve |
|
IIb C | – | – |
|
IIb C | – | – | |
| Tratamento transcateter – TAVI e clipagem percutânea mitral® |
|
IIb C | – | – |
|
IIb C | – | – |
AHA: American Heart Association; EAo: estenose aórtica; ESC: European Society of Cardiology; IM: insuficiência mitral; SBC: Sociedade Brasileira de Cardiologia; TAVI: implante transcateter de bioprótese aórtica.
14. Avaliação da Doença Arterial Coronariana
Pacientes com indicação de cirurgia valvar devem ser submetidos à avaliação de doença arterial coronariana com cineangiocoronariografia se: idade maior que 40 anos, suspeita de doença arterial coronariana (fatores de risco para aterosclerose [diabetes, dislipidemia, hipertensão arterial, dentre outros], eventos prévios, angina), disfunção ventricular esquerda ou para avaliação de etiologia na IM secundária.166–168 A avaliação poderá ser com angiotomografia de coronária nos casos de pacientes com baixa ou intermediária probabilidade de doença arterial coronária. Se a angiotomografia demonstrar lesões significativas ou duvidosas, o paciente deverá ser submetido à cineangiocoronariografia (Quadro 60).169–171
Quadro 60. Intervenção na doença arterial coronária concomitante à intervenção Valvar: Recomendações1,2,166–171.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Revascularização miocárdica cirúrgica | Indicação de intervenção valvar cirúrgica e lesão coronária ≥ 70% | I C | IIa C | I C |
| Angioplastia coronária | Indicação de intervenção valvar transcateter e lesão coronária ≥ 70% em segmento proximal | IIa C | IIa C | IIa C |
AHA: American Heart Association; ESC: European Society of Cardiology; IM: insuficiência mitral; SBC: Sociedade Brasileira de Cardiologia.
15. Anticoagulação
Os dois complicadores de maior impacto na história natural da doença valvar são as alterações hemodinâmicas e o tromboembolismo. O acidente vascular cerebral é o evento tromboembólico de maior significância clínica, acometendo até 20% dos indivíduos com FA associada à doença valvar. Está recomendada a aplicação do escore CHA2DS2-VASc para decisão quanto à anticoagulação, exceto nos pacientes portadores de EM reumática e naqueles com prótese mecânica. Os critérios para anticoagulação são os mesmos em portadores de FA paroxística, persistente ou permanente. As principais indicações de anticoagulação estão descritas no Quadro 61.
Quadro 61. Indicações de anticoagulação oral1,2, 172–183.
| Condição clínica | Medicação | SBC | AHA | ESC |
|---|---|---|---|---|
| Valva nativa | ||||
|
Varfarina | I B | I B | I B |
| DOACs | III C | III C | III C | |
| AAS | IIb B | – | – | |
|
Varfarina | I B | I C | I B |
| DOACs | IIa C | IIa C | IIa B | |
| AAS | IIb B | – | – | |
|
Varfarina | I B | I B | – |
| DOACs | III C | – | – | |
| AAS | IIb C | – | – | |
| Prótese biológica | ||||
|
Varfarina | I B | I B | I C |
| DOACs | IIb B | – | – | |
| AAS | IIb C | – | – | |
|
Varfarina | IIb | IIa B | IIa C |
| DOACs | III C | – | – | |
| AAS | IIb | – | – | |
|
Varfarina | IIb B | IIa B | IIb C |
| DOACs | III C | – | – | |
| AAS | IIb B | – | IIa C | |
| TAVI | ||||
|
Varfarina | I B | – | – |
| DOACs | IIb C | – | – | |
| AAS + clopidogrel | III B | – | – | |
| AAS | III C | – | – | |
|
Varfarina | III B | IIb B 3 meses | IIb C 3 meses |
| DOACs | III B | – | – | |
| AAS ou clopidogrel indefinidamente | IIa B | – | IIb C | |
| AAS + clopidogrel 3-6 meses | IIb B | IIb C | IIa C | |
|
AAS + clopidogrel até 12 meses conforme tipo de stent | IIa C | IIb | – |
|
DOAC + clopidogrel | IIa C | – | – |
| Varfarina + AAS + clopidogrel 1m, seguido de varfarina + clopidogrel até 12m | IIb C | – | – | |
| Prótese mecânica | ||||
| Varfarina | I B | I A | I B | |
| DOACs | III B | III B | III B | |
| Varfarina + AAS rotineiramente | III C | IIa B | – | |
| Varfarina + AAS após evento tromboembólico com INR terapêutico | IIa B | – | IIa C | |
Considerar anticoagulação com varfarina nos indivíduos com EM com episódios de taquicardia atrial sustentada ou aumento de AE (≥ 50 mm de diâmetro anteroposterior ou ≥ 50 ml/m² de volume de AE) e contraste espontâneo. AAS: ácido acetilsalicílico; AHA: American Heart Association; DOACs: anticoagulantes orais diretos; ESC: European Society of Cardiology; EM: estenose mitral; FA: fibrilação atrial; IM: insuficiência mitral; INR: razão normalizada internacional; SBC: Sociedade Brasileira de Cardiologia; TAVI: implante transcateter de bioprótese aórtica.
Atualmente a anticoagulação oral como forma de prevenir eventos tromboembólicos nos portadores de doença valvar ainda é feita predominantemente com antagonistas da vitamina K (sigla em inglês VKA – vitamin K antagonist), sendo a varfarina o atual representante desta classe no Brasil. É uma estratégia segura iniciar a varfarina na dose de 5mg/dia para indivíduos abaixo dos 65 anos e 2,5 mg/dia acima dos 65 anos. O tempo de protrombina deverá ser dosado no 3º dia para avaliação de hiper-responsividade à medicação e novamente no 5º dia, data a partir da qual a dose passa a ser ajustada. Nesta fase os exames devem ser feitas com intervalo de até 5 dias, até que se atinja nível terapêutico. A razão normalizada internacional (INR) deverá ficar entre 2,0 e 3,0, exceto para os portadores de prótese mecânica em posição mitral, prótese mecânica aórtica associada à FA, estados de hipercoagulabilidade e eventos cardioembólicos na vigência de INR entre 2,0 e 3,0. Nestes casos, o alvo passa a ser 2,5 a 3,5. O controle da INR habitualmente é realizado mensalmente, sendo razoável o controle a cada dois meses em pacientes com doses estáveis de longa data e que não foram expostos a novos fatores que interajam com a varfarina (Quadro 62). No caso de INR fora do alvo, deve ser coletado novo exame mais precocemente, em 1 a 2 semanas. O ajuste de dose deve ser em média 10-15% da dose semanal e devem ser investigados os fatores que ocasionaram a oscilação da INR. O monitoramento do tempo de protrombina com dispositivos point-of-care fornece informações rápidas e confiáveis, porém sua disponibilidade ainda é limitada pelo alto custo do aparelho e tiras.
Quadro 62. Ajuste de dose da varfarina.
| Valor de INR | Ajuste de dose |
|---|---|
| ≤ 1,5 | Aumentar 15% na dose semanal |
| 1,51 – 1,99 | Aumentar 10% na dose semanal |
| 2 – 3* | Manter dose |
| 3,01 – 4,0 | Reduzir 15% na dose semanal |
| 4,01 – 4,99 | Suspender 1 dose e reduzir 10% na dose semanal |
| 5,0 – 8,99 | Suspender a varfarina até INR 2-3 e reiniciar com 15% menos da dose semanal |
| ≥ 9,00 | Internação hospitalar, suspender a varfarina em média por 4 dias, prescrever vitamina K na dose de 1 a 2,5 mg por via oral a ser repetida em 24-48 horas se não houver redução para INR <5,0 e reiniciar a anticoagulação após INR próximo aos valores-alvo (abaixo de 4) |
Considerar manutenção da dose semanal da varfarina se INR até 3,5; desde que a medicação não tenha sido iniciada recentemente e realizar nova dosagem em 1-2 semanas. No caso de alvo terapêutico de INR entre 2,5 a 3,5 o ajuste de dose deverá ser realizado para valores 0,5 maiores, exceto se INR ≥ 9,0. INR: razão normalizada internacional.
Sabe-se que quanto maior o tempo no alvo terapêutico (sigla em inglês TTR – time in therapeutic range), menor o risco de eventos tromboembólicos e de sangramento. Em um estudo com 119 pacientes com doença valvar mitral e FA, 78,2% dos indivíduos apresentavam INR <2,0 no momento do evento tromboembólico. Para valores de INR <1,7 a probabilidade destes dobrou e para valores abaixo de 1,5, triplicou. As dificuldades no manejo dos VKAs decorrem da grande variabilidade de dose individual, interação com alimentos e medicações, além da necessidade de monitorização frequente. Os pacientes devem ser aconselhados a evitar o consumo de álcool e manter equilíbrio na dieta, especialmente em relação aos alimentos ricos em vitamina K, como verduras e legumes verdes. Estes alimentos não devem ser excluídos da rotina alimentar.
Nos últimos anos, o papel dos anticoagulantes orais diretos (sigla em inglês DOACs – direct oral anticoagulants) tem se tornado progressivamente maior. A dosagem das medicações disponíveis no Brasil encontra-se no Quadro 63. Múltiplos ensaios clínicos envolvendo portadores de valvopatias estão em andamento. A maior parte das informações atuais são provenientes de análises de subgrupos dos principais estudos com os DOACs, além de estudos de coorte retrospectiva.
Quadro 63. Dose dos anticoagulantes orais diretos para profilaxia de eventos tromboembólicos na fibrilação atrial177–180.
| Anticoagulante | Dose habitual | Ajuste de dose | Contraindicações |
|---|---|---|---|
| Dabigatrana | 150 mg 2x/dia | ≥ 80 anos e/ou alto risco de sangramento: 110 mg 2x/dia | Clearance de creatinina < 30 mL/min, uso concomitante de cetoconazol |
| Rivaroxabana | 20 mg 1x/dia | 15mg 1x/dia se Clearance de creatinina < 50 mg/dL | Clearance de creatinina < 15 mL/min, doença hepática associada à coagulopatia |
| Apixabana | 5 mg 2x/dia | 2,5 mg 2x/dia em pacientes com pelo menos 2 de: idade ≥ 80 anos, peso corporal ≤ 60 kg ou creatinina sérica ≥ 1,5 mg/dL | Clearance de creatinina <15mL/min, doença hepática associada à coagulopatia |
| Edoxabana | 60 mg 1x/dia | 30mg 1x/dia | Clearance de creatinina > 95 mL/min ou < 15 mL/min |
Nos portadores de próteses mecânicas, ensaios pré-clínicos envolvendo animais sugeriram que o uso de DOACs poderia ser tão seguro e eficaz quanto a varfarina. No entanto, o estudo clínico RE-ALIGN (Dabigatran versus Warfarin in Patients with Mechanical Heart Valves) que comparou dabigatrana versus varfarina foi interrompido precocemente devido a maior ocorrência do desfecho combinado acidente vascular cerebral, acidente isquêmico transitório, embolia sistêmica, infarto do miocárdio e morte (9% versus 5%; hazard ratio 1,94, IC 95% 0,64-5,86) e de sangramento (27% versus 12%, p < 0,05) no primeiro grupo. O estudo envolveu 252 pacientes e utilizou dabigatrana nas dosagens de 150, 220 e 300mg administrados a cada 12 horas de acordo com o clearance de creatinina, tendo sido a dose ajustada para nível sérico acima de 50 ng/mL. Sendo assim, não indicamos o uso de DOACs nos portadores de prótese mecânica. 176
Embora os grandes ensaios clínicos que validaram o uso dos DOACs na FA tenham excluído indivíduos com EM importante e próteses valvares mecânicas, estes estudos incluíram indivíduos com outras valvopatias. No estudo ARISTOTLE (Apixaban versus Warfarin in Patients with Atrial Fibrillation) 26,4% dos participantes apresentavam valvopatia moderada ou importante, no RE-LY (Dabigatran versus Warfarin in Patients with Atrial Fibrillation) 21,8%, no ROCKET AF (Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation) 14,1% e, por fim, no ENGAGE AF (Edoxaban versus Warfarin in Patients with Atrial Fibrillation) 13%. As subanálises destes estudos sugeriram eficácia dos DOACs em comparação à varfarina nos indivíduos com FA e doença valvar, excluídas as próteses mecânicas e EM importante. O ARISTOTLE e o ENGAGE-AF contemplaram indivíduos com biopróteses. 177–180
Apesar dos resultados negativos nos indivíduos portadores de próteses valvares mecânicas, a dabigatrana mostrou-se eficaz em prevenir a formação de trombos intracardíacos em indivíduos com prótese biológica aórtica e/ou mitral no estudo unicêntrico brasileiro DAWA (Dabigatran Versus Warfarin After Bioprosthesis Valve Replacement for the Management of Atrial Fibrillation Postoperatively).175
Uma coorte sul coreana com 2230 pacientes avaliou indivíduos com FA e EM de diferentes etiologias e gravidades anatômicas comparando o uso off-label dos DOACs em relação à varfarina. Os eventos isquêmicos ocorreram em 2,22%/ano no grupo DOAC versus 4,19%/ano no grupo varfarina (hazard ratio 0,28; IC 95% 0,18-0,45) e os sangramentos intracranianos em 0,49% no grupo DOAC versus 0,93% no grupo varfarina (hazard ratio 0,53; IC 95% 0,22-1,26). Este estudo reforça a hipótese da eficácia dos DOACs na EM. Deve-se ter atenção para o fato de que o tempo de INR em faixa terapêutica (TTR – time in therapeutic range) não foi avaliado nesta coorte. 181 Em um estudo observacional multicêntrico, os pacientes coreanos tinham apenas 31% de valores de INR no alvo terapêutico.
O primeiro regime antitrombótico que se adotou para os indivíduos submetidos ao TAVI em ritmo sinusal foi a dupla antiagregação com AAS e clopidogrel por 6 meses, extrapolando-se a experiência com stents e tendo em vista o período esperado para que ocorra endotelização da prótese. Uma metanálise de três ensaios clínicos pequenos recentes mostrou que a antiagregação com AAS ou clopidogrel isoladamente não mostrou aumento de mortalidade em 30 dias frente à dupla antiagregação (odds ratio 5,2 versus 3,2%, p = 0,447), bem como de eventos isquêmicos (3,8 versus 3,8%, p = 0,999), além de ter ocorrido maior chance de sangramento no grupo dupla antiagregação (odds ratio 2,24; IC 95% 1,12-4,46; p = 0,022). 173
Há evidências através de ecocardiograma transesofágico e angiotomografia computadorizada da ocorrência de espessamento de folhetos após a TAVI em até 13% dos pacientes, o que pode corresponder a formação de trombos e tem se associado ao aumento na incidência de acidentes isquêmicos transitórios e acidente vascular cerebral.174 Coortes observacionais nas quais os indivíduos receberam VKA ou DOACs indicaram que o uso destas medicações poderia ser seguro na prevenção de eventos. Entretanto, foi publicado recentemente o estudo multicêntrico GALILEO (Global Study Comparing a Rivaroxaban-based Antithrombotic Strategy to an Antiplatelet-based Strategy After Transcatheter Aortic Valve Replacement to Optimize Clinical Outcomes) que envolveu 1644 pacientes sem indicação de dupla antiagregação ou anticoagulação prévios e comparou o uso de rivaroxabana 10 mg/dia (associada a AAS 75-100 mg/dia nos primeiros 3 meses) versus AAS 75-100 mg (associada a clopidogrel 75mg/dia nos primeiros 3 meses). O estudo foi interrompido precocemente devido a maior ocorrência de eventos trombóticos no grupo rivaroxabana (9,8 e 7,2 por 100 pessoas-ano; hazard ratio 1,35, IC 95% 1,01-1,81; p = 0,04), bem como sangramentos (4,3 e 2,8 por 100 pessoas-ano; hazard ratio 1,5, IC 95% 0,95-2,37; p = 0,08) e mortes (5,8 e 3,4 por 100 pessoas-ano; hazard ratio 1,69, IC 95% 1,13-2,53). 172
15.1. Procedimentos Cirúrgicos
Nos procedimentos cirúrgicos com baixo risco de sangramento e possibilidade de hemostasia, como na cirurgia de catarata, glaucoma, dermatológicas pequenas, cirurgias odontológicas gengival, raspagem periodontal e extração de até 3 dentes simultaneamente sugere-se a manutenção da anticoagulação oral. No caso da varfarina, a INR deverá estar em faixa terapêutica, tendo sido dosado nas 24 a 48 horas que precedem o procedimento. No caso dos DOACs, idealmente o procedimento não deverá ser feito nas horas subsequentes ao uso destes medicamentos para evitar seu pico de ação.
Diante de procedimentos que impliquem em maior risco de sangramento devido ao porte cirúrgico ou dificuldade de hemostasia, está indicada a ponte com heparina nos indivíduos em uso de VKA. Fazem parte destes a cineangiocoronariografia, endoscopia ou colonoscopia com polipectomia, postectomia, vasectomia, biópsias de órgãos internos e cirurgias de maior porte. Neste caso, a varfarina deverá ser suspensa nos 5 dias que precedem o procedimento, devendo a heparina ser iniciada 3 dias antes do mesmo. No caso da heparina de baixo peso molecular, a última dose deverá ser administrada 24 horas antes do procedimento e a heparina não fracionada deverá ser suspensa 4 a 6 horas antes. A heparina em geral é reintroduzida 12 horas após, desde que a hemostasia tenha sido adequada. A varfarina, em geral, é reiniciada no dia subsequente. Deverá ser coletado INR em 5 dias e a heparina suspensa assim que for atingido o alvo terapêutico. Nas cirurgias de emergência, idealmente deverá ser administrado o complexo protrombínico 50 UI/kg intravenoso.
O rápido início da ação dos DOACs (2-4 horas) e a meia vida curta dispensam a necessidade do uso da ponte de heparina. Para procedimento eletivo de baixo risco de sangramento, recomenda-se a suspensão 24 horas antes da cirurgia, e nos casos de elevado risco de sangramento ou sítio de difícil hemostasia 48 horas antes. Na cirurgia emergencial, recomenda-se o uso do antídoto idarucizumab nos indivíduos em uso de dabigatrana na dose total de 5 g endovenosa (duas alíquotas de 2,5 g). Ainda não está disponível no Brasil o andexanet alfa (AndexXa), antídoto dos inibidores do fator Xa.
16. Trombose de Prótese Valvar
A trombose de prótese valvar é evento incomum, sendo mais frequente em próteses mecânicas, principalmente em posição mitral, este evento cursa com alta morbimortalidade. Pode ser assintomática ou se manifestar com síndrome de insuficiência cardíaca, baixo débito e até mesmo a morte. O diagnóstico e suspeita usualmente se dão através do ecocardiograma transtorácico, podendo ser confirmado pelo método transesofágico (Quadros 64, 65 e 66).
Quadro 64. Passo 1: Diagnóstico de trombose de prótese valvar.
| Características da Trombose de Prótese | |
|---|---|
| Avaliação clínica |
|
| Eletrocardiograma |
|
| Radiografia de tórax |
|
| Ecocardiograma |
|
| Estudo hemodinâmico (fluoroscopia) |
|
INR: razão normalizada internacional.
Quadro 65. Passo 2: Avaliação da etiologia da trombose de prótese valvar.
| Características etiológicas | |
|---|---|
| Anticoagulação ineficaz |
|
INR: razão normalizada internacional.
Quadro 66. Passo 3: Avaliação de sintomas da trombose de prótese valvar.
| Sintomas | |
|---|---|
| Dispneia |
|
| Dor Precordial |
|
| Baixo débito/Síncope |
|
CF: classe funcional.
O principal complicador da trombose é o tamanho do trombo devido ao risco de embolia e obstrução valvar (Quadro 67).
Quadro 67. Passo 4: Avaliação de complicadores da trombose de prótese valvar.
| Complicadores | |
|---|---|
| Alto risco de embolização associada à trombólise |
|
| Hipertensão pulmonar |
|
| FA de início recente |
|
AE: átrio esquerdo; EM: estenose mitral; FA: fibrilação atrial; PSAP: pressão sistólica da artéria pulmonar.
As recomendações das diretrizes internacionais são heterogêneas em relação ao tratamento e há carência de estudos randomizados nesta área (Quadros 68 e 69). Na trombose de prótese sem repercussão hemodinâmica significativa (CF I e II) e sem obstrução de fluxo valvar nos exames complementares, é indicada anticoagulação oral e monitorização ambulatorial com imagem. No caso de trombo grande (especialmente maior do que 8mm) e/ou móvel, portanto, com elevado risco de embolização, está indicada internação hospitalar para anticoagulação venosa. Não havendo resolução do trombo em exames de imagem realizados a cada 5 a 7 dias, pode ser considerada fibrinólise e/ou cirurgia.184,185
Quadro 68. Passo 5: Tipo de intervenção da trombose de prótese valvar184,185.
| Tipo | Considerações |
|---|---|
| Trombólise |
|
| Cirurgia valvar |
|
rTPA: recombinant tissue plasminogen activator.
Quadro 69. Trombose de prótese: Recomendações1,2,184,185.
| Intervenção | Condição clínica | SBC | AHA | ESC |
|---|---|---|---|---|
| Trombólise |
|
IIa B | IIa B | – |
|
IIa B | IIa B | – | |
| Cirurgia valvar |
|
IB | I B | I C |
|
IIa C | IIa C | IIa C (trombo >10mm) |
NYHA: New York Heart Association.
Nos casos em que há comprometimento hemodinâmico mais significativo (CF III e IV), habitualmente são indicadas administração de terapia fibrinolítica ou cirurgia valvar. Recentemente, há tendência de priorização da fibrinólise frente à cirurgia, com base em dados de metanálise de 48 estudos. Na decisão sobre estas últimas duas estratégias, é recomendada discussão em Heart Team, devendo ser pesados riscos da fibrinólise (procedimento de primeira escolha) e da cirurgia individualmente. Favorecem a fibrinólise: alto risco cirúrgico, baixo risco de sangramento, acometimento de valvas direitas, primeiro episódio de trombose valvar, trombo menor do que 1cm². Havendo instabilidade hemodinâmica, o tratamento de escolha é a cirurgia, podendo ser considerada a fibrinólise em indivíduos de elevado risco cirúrgico. Os fatores que favorecem o procedimento cirúrgico são: contraindicação à fibrinólise, alto risco de sangramento, baixo risco cirúrgico, suspeita de pannus associado à trombose e necessidade de outros procedimentos cirúrgicos cardíacos concomitantes (ex: revascularização do miocárdio).184,185
17. Profilaxia da Febre Reumática
A FR, e consequente a Cardiopatia Reumática Crônica, permanece como a mais importante causa de valvopatia adquirida no Brasil. A Doença Reumática é das que acarretam maiores custos para o Sistema Único de Saúde e para a comunidade em geral, pois acomete indivíduos muito jovens e frequentemente determina múltiplas internações hospitalares e cirurgias. Permanece como a principal causa de valvopatia adquirida em nosso meio. Diminuir esta incidência permanece objetivo importantíssimo, considerado que esta, das doenças cardiológicas, é com certeza a mais facilmente prevenível.
17.1. Profilaxia Primária da Febre Reumática
Para diminuir a incidência de FR, a medida de maior impacto é a profilaxia primária, impedindo que os indivíduos suscetíveis venham a contrair a doença (Quadros 70 e 71). Recentemente encontramos dificuldades sérias para realizar a profilaxia primária: o suprimento de Penicilina G benzatina está errático, com frequentes desabastecimentos da medicação. Além disso, restrições a locais de aplicação da medicação por preocupações com reações alérgicas e falta de familiaridade de profissionais de saúde primária com a aplicação intramuscular fazem com que seja cada vez mais difícil a realização da profilaxia primária por via intramuscular. Este fato irá certamente contribuir para o aumento da incidência da doença nos próximos anos.
Quadro 70. Regimes terapêuticos indicados para a faringoamigdalite estreptocócica – profilaxia primária da febre reumática186–193.
| Medicação | Dose | Via de administração / Duração | Comentários | |
|---|---|---|---|---|
| Penicilinas e derivados | ||||
| Benzilpenicilina G benzatina | 600.000 UI até 25 kg, 1.200.000 UI acima de 25 kg | Intramuscular Dose única | Medicação de escolha: dose única, alta eficácia e baixo custo | |
| Amoxicilina | 50 mg/kg para crianças e 1,5g diárias para adultos, divididos em 2 a 3 tomadas | Via Oral 10 dias | Baixa aderência ao tratamento completo | |
| Fenoximetilpenicilina | 250 mg 2 a 3x ao dia até 25 kg, 500 mg 3x ao dia > 25 kg | Via Oral 10 dias | Baixa aderência ao tratamento completo | |
| Para pacientes alérgicos à penicilina | ||||
| Clindamicina | 20 mg/kg dividido 3x ao dia, adultos: 300 a 600 mg 3x ao dia | Via Oral 10 dias | Frequente intolerância gastrointestinal | |
| Azitromicina | 12 mg/kg em dose única diária. Para adultos, 500 mg 1x ao dia | Via Oral 5 dias | Única antibioticoterapia por via oral que pode erradicar o estreptococo em menos de 10 dias | |
| Claritromicina | 15 mg/kg 2x ao dia ou para adultos, 250 mg 2x ao dia | Via Oral 10 dias | ||
IM: insuficiência mitral.
Quadro 71. Recomendações para profilaxia primária da febre reumática186–193.
Classe I
|
Classe IIa
|
Classe III
|
Terapias por via oral não devem ser usadas rotineiramente, pois em geral é necessário o uso de 10 dias de terapêutica para a completa erradicação dos estreptococos da orofaringe. Por isso há um risco muito grande da não aderência ao tratamento completo, fazendo com que o paciente tenha risco de desenvolver surto reumático. Tratamentos com base em 5 dias de Azitromicina foram propostos, mas ainda não possuem estudo clínico validando seu uso em faringoamigdalites.186–193
17.2. Profilaxia Secundária da Febre Reumática
Para pacientes que já tem o diagnóstico de FR, é indicada a profilaxia secundária para a prevenção de novos surtos de FR (Quadros 72 e 73). A droga de escolha é a Benzilpenicilina G benzatina, nas mesmas doses de 600.000 UI para crianças com até 27 kg e 1.200.000 UI acima deste peso, com intervalo máximo de três semanas. Aplicações mensais de Penicilina Benzatina não proporcionarem proteção adequada aos portadores de doença reumática em países com alta endemicidade da doença como o nosso.194–198 Para pacientes com alergia a penicilina está indicada a Sulfadiazina, na dose de 1 g/dia, sendo necessário o controle de possíveis quadros leucopênicos.
Quadro 72. Profilaxia secundária para a febre reumática: Medicações recomendadas e posologia194–200.
| Medicação | Dose e periodicidade | Recorrência/Notas | |
|---|---|---|---|
| Benzilpenicilina G benzatina | < 25 kg – 600.000UI > 25 kg – 1.200.000 UI 15/15 dias nos dois primeiros anos do surto 21/21 dias nos anos subsequentes |
Recorrência de 0,3% ao ano Medicação de escolha |
|
| Fenoximetilpenicilina | 250 mg por boca 2x ao dia | Recorrência de 5% ao ano – não deve ser usada como alternativa à penicilina G benzatina | |
| Para pacientes alérgicos à penicilina | Sulfadiazina | < 25 kg – 500 mg ao dia > 25 kg – 1g ao dia |
Recorrência de 1,3% ao ano Pode ser usado até concluída dessensibilização à penicilina |
| Para alérgicos à Penicilina e à sulfadiazina | Eritromicina | 250 mg 2x ao dia | Regime de profilaxia empírico, não foi objeto de estudos em profilaxia secundária da FR – só deve ser usado excepcionalmente. |
FR: febre reumática.
Quadro 73. Recomendações para a profilaxia secundária da febre reumática194–200.
Classe I
|
Classe IIa
|
Classe IIb
|
Classe III
|
FR: febre reumática.
A alternativa frente ao desabastecimento recente de Penicilina G benzatina é a sulfadiazina, que frequentemente está disponível para doenças reumatológicas no sistema público de saúde, listada nos regimes de medicação de alto custo. Devemos lembrar também que apenas a Penicilina G Benzatina e a Sulfadiazina possuem estudos controlados com eficácia comprovada para a profilaxia secundária da FR.199–200
17.3. Os Critérios de Suspensão das Profilaxias (Quadro 74)
Quadro 74. Duração da profilaxia secundária para febre reumática.
| Categoria | Duração |
|---|---|
| FR sem cardite: quadros puros de artrite ou coréia | Até os 18 anos ou 5 anos após o último surto de FR, o que for mais longo |
| FR com cardite, mas sem sequelas ou com sequelas valvares muito leves (exceto lesões estenóticas, mesmo que leves) | Até os 25 anos ou 10 anos após o último surto |
| FR com cardite e sequelas graves. Pacientes submetidos à cirurgia cardíaca | Até os 40 anos no mínimo. Por toda a vida se exposição ocupacional. |
FR: febre reumática.
-
–
Pacientes sem acometimento cardíaco, apenas com manifestação articular ou coréia “pura” – suspender aos 18 anos ou 5 anos após o surto reumático;
-
–
Pacientes com cardite durante o surto agudo que não apresentam sequelas tardias ou apresentam sequelas muito discretas – suspender aos 25 anos ou dez anos após o último surto reumático;
-
–
Pacientes nos quais é retirada a profilaxia e os sintomas retornam deverão ter profilaxia mantida por mais 5 anos.
-
–
Pacientes com acometimento cardíaco, mesmo discreto, deverão ter profilaxia prolongada, de preferência por toda a vida, e quando isso não for possível até a quarta década. Devemos quando da suspensão da medicação sempre pesquisar sobre contato ocupacional com fontes de estreptococos.
18. Profilaxia de Endocardite Infecciosa nas Valvopatias
A EI é complicação grave das valvopatias, sendo frequentemente fatal. Desta forma, havendo a possibilidade de fazer profilaxia para tal entidade, a mesma deveria ser aplicada. Com este intuito, foram utilizados vários esquemas antibióticos, porém com pouca evidência em estudos controlados, principalmente pela dificuldade em se realizar estudo controlado de grande porte com medicações já em domínio público.
Os estreptococos fazem parte da flora normal da orofaringe e trato gastrointestinal e causam pelo menos 50% das EI adquiridas na comunidade em nosso meio. Demonstrou-se bacteremia pelos estreptococos do grupo viridans em até 61% dos pacientes, após extração dentária e cirurgia periodontal (36% a 88%). E estudos experimentais em animais mostraram que a profilaxia antibiótica era capaz de evitar EI por estreptococos viridans e enterococos.201,202
Mais recentemente tem se notado que há bacteremias espontâneas, de origem especialmente dentária e gengival, em situações do dia-a-dia. Assim, atividades prosaicas rotineiras, como escovação de dentes (0 a 50%), uso de fio dental (20% a 68%), uso de palito de dentes e mesmo mastigação de refeição (7% a 51%), são associadas à bacteremia. Desse modo, a carga de bacteremia espontânea, não determinada por intervenção odontológica, seria maior do que a determinada por tratamentos dentários. Um estudo teórico da bacteremia cumulativa, durante cerca de um ano, calculou que a bacteremia do dia-a-dia é seis vezes maior do que a bacteremia causada por uma extração dentária isolada. Considerando que a indicação de profilaxia dentária recomenda duas visitas por ano ao dentista, percebe-se um impacto das atividades do dia-a-dia na geração de bacteremias muito maior do que a própria intervenção dentária. Trabalhos epidemiológicos recentes não mostram relação entre tratamento dentário duas semanas antes e episódios de EI.203–208
Por este motivo, mais importante que a profilaxia antes de procedimentos dentários é a manutenção de ótima saúde bucal em valvopatas. Aqueles com boa saúde bucal tem menor possibilidade de bacteremia em atividades cotidianas. Assim devemos focar mais na prevenção não farmacológica que na profilaxia farmacológica. Faz parte da profilaxia não farmacológica da EI reforçar em todas as consultas a necessidade de se manter uma ótima saúde bucal e aumentar a frequência das consultas odontológicas, de duas (recomendação para a população em geral) para quatro vezes ao ano. Devemos ressaltar que muitas das afecções odontológicas que mais causam EI são oligossintomáticas, como a gengivite e lesões periapicais endodônticas.209
Para pacientes submetidos a intervenções dentárias, existe crescente evidência de que a profilaxia antibiótica previne apenas um número muito pequeno de casos. Entretanto há evidências recentes que abolir totalmente a profilaxia antibiótica pode levar ao aumento da incidência da EI. O Instituto Nacional de Saúde e Excelência Clínica (NICE – sigla em inglês), instituição britânica, propôs que não seja realizada profilaxia para EI em nenhuma ocasião.210 Como consequência observou-se uma diminuição da prescrição da profilaxia antibiótica antes de tratamentos dentários seguindo de um aumento do número de casos de EI.211 Assim temos evidência empírica que abolir o completamente a profilaxia antibiótica pode levar a um aumento dos casos de EI. Desta maneira preconizamos a manutenção da profilaxia antibiótica antes de procedimentos dentários, gastrointestinais e geniturinários.
Todo paciente com valvopatia moderada a importante, seja de etiologia reumática, degenerativa, ou portador de prótese valvar deve realizar profilaxia não farmacológica e farmacológica para EI, visto que todos pacientes com EI apresentam alta morbimortalidade.
18.1. Profilaxia Não Farmacológica da Endocardite Infecciosa
A profilaxia não farmacológica da EI pode ser mais eficaz que a farmacológica por atuar na prevenção primária de fontes comprovadas de bacteremia (Quadro 75). Destacamos como medidas prioritárias para o valvopata manutenção de ótima saúde bucal, evitar procedimentos de arte corporal invasiva, como o implante de piercings e tatuagens.
Quadro 75. Profilaxia não farmacológica da endocardite infecciosa.
| Recomendação | Grau de recomendação | Nível de evidência |
|---|---|---|
| Reforço da necessidade de manter boa saúde bucal e hábitos adequados de higiene durante consultas médicas. | I | C |
| Consultas odontológicas trimestrais | I | C |
| Tatuagem | III | C |
| Piercings em pele | III | C |
| Piercings língua e mucosas | III | C |
Com relação à arte corporal (procedimentos como tatuagens e piercings) a mesma deve ser contraindicada. O piercing leva à formação de um trajeto que precisa ser epitelizado, e até este processo ser completo é fonte de contínua bacteremia, sendo abundantes na literatura relatos de endocardite, inclusive com desfecho fatal, relacionado a implantes de piercings. É importante que os pacientes sejam informados dos riscos do procedimento, assim como os médicos devem sempre abordar esse assunto quando atendem pacientes que tem ou que pretendem ter arte corporal.212
18.2. Profilaxia da Endocardite Infecciosa para Procedimentos Dentários (Quadros 76, 77 e 78)
Quadro 76. Indicações de profilaxia para procedimentos dentários.
| Com alta probabilidade de bacteremia significativa | Sem alta probabilidade de bacteremia significativa |
|---|---|
| Procedimentos que envolvem a manipulação de tecido gengival, região periodontal ou perfuração da mucosa oral. | Anestesia local em tecido não infectado |
| Radiografia odontológica | |
| Colocação ou remoção de aparelhos ortodônticos | |
| Ajuste de aparelhos ortodônticos | |
| Colocação de peças em aparelhos ortodônticos | |
| Queda natural de dente-de-leite | |
| Sangramento oriundo de trauma da mucosa oral ou lábios |
Quadro 77. Profilaxia antibiótica de endocardite em valvopatias.
| Indicação | Recomendação | Nível de evidência |
|---|---|---|
| Pacientes com valvopatia moderada e importante, assim como portadores de prótese valvar, e que serão submetidos a procedimentos odontológicos de alta probabilidade de bacteremia significativa. | I | C |
| Pacientes com risco elevado para endocardite infecciosa grave* e que serão submetidos a procedimentos geniturinários ou gastrointestinais associados à lesão de mucosa. | IIa | C |
| Pacientes com risco elevado para endocardite infecciosa grave* e que serão submetidos a procedimentos esofágicos ou do trato respiratório associado à lesão de mucosa. | IIa | C |
| Pacientes com PVM sem regurgitação, pacientes após cirurgia de revascularização miocárdica ou após colocação de stents, com sopros cardíacos inocentes, portadores de marcapasso ou desfibrilador, com doença de Kawasaki ou FR sem disfunção valvar, que serão submetidos a procedimentos odontológicos, do trato respiratório, geniturinário ou gastrointestinal. | III | C |
| Pacientes submetidos a procedimentos que não envolvam risco de bacteremia. | III | C |
Risco elevado para EI grave: prótese valvar cardíaca, EI prévia, cardiopatia congênita não reparada ou corrigida parcialmente ou corrigida com material protético, transplantado cardíaco com valvopatia. FR: febre reumática; PVM: prolapso da valva mitral.
Quadro 78. Esquemas de profilaxia para endocardite infecciosa antes de procedimentos dentários.
| Via de administração | Medicação | Dose única 1 hora antes do procedimento | |
|---|---|---|---|
| Criança | Adulto | ||
| Oral | Amoxicilina | 50 mg/kg | 2 g |
| Oral (alergia à penicilina) | Clindamicina | 20 mg/kg | 600 mg |
| Azitromicina ou claritromicina | 15 mg/kg | 500 mg | |
| Parenteral (endovenoso ou intramuscular) | Ampicilina | 50 mg/kg | 2 g |
| Cefazolina ou ceftriaxone | 50 mg/kg | 1 g | |
| Parenteral (endovenoso ou intramuscular) (alergia à penicilina) | Clindamicina | 20 mg/kg | 600 mg |
IM: insuficiência mitral.
O antibiótico deve ser ministrado, uma hora antes do procedimento. O regime usado deve impedir a bacteremia por estreptococos viridans sempre que for manipulado tecido da gengiva ou da região periapical do dente. O antibiótico de escolha, se não houver alergia, é a amoxicilina, por sua absorção adequada e pela suscetibilidade do agente infeccioso. No entanto, têm sido descritas resistências de várias cepas desse micro-organismo a esse antibiótico. Para pacientes alérgicos a penicilina utiliza-se clindamicina, azitromicina ou claritromicina.
18.3. Profilaxia da Endocardite Infecciosa para Procedimentos no Trato Respiratório
Pacientes a serem submetidos à incisão ou biópsia da mucosa do trato respiratório, como cirurgias otorrinolaringológicas, devem receber esquema antibiótico semelhantes ao utilizados para afecções da boca.
18.4. Profilaxia da Endocardite Infecciosa para Procedimentos nos Tratos Geniturinário e Gastrointestinal
Os enterococos fazem parte da flora normal do trato gastrointestinal e podem causar EI. Assim, considerando a falta de adequada evidência científica, as diretrizes americanas e europeias passaram a não mais indicar profilaxia antibiótica antes de intervenções nestas localizações.213,214 No entanto, considerando a gravidade de uma eventual ocorrência de EI decorrente destas fontes, foi optado, no atual documento, por considerar a profilaxia para pacientes com risco elevado para EI grave e que serão submetidos a procedimentos geniturinários ou gastrointestinais associados a lesão de mucosa (Quadro 79).215 Na presença de infecções instaladas nos tratos geniturinário e gastrointestinal, o tratamento deve incluir antibióticos que ajam contra o enterococo.
Quadro 79. Profilaxia antibiótica parenteral para procedimentos do trato gastrointestinal e geniturinário.
| Via de administração | Medicação | Dose única 1 hora antes do procedimento | ||
|---|---|---|---|---|
| Criança | Adulto | |||
| Parenteral (endovenoso) | Ampicilina + | 50 mg/kg | 2 g | |
| Gentamicina | 1,5 mg/kg | |||
| Parenteral (endovenoso) - alergia à penicilina | Vancomicina + | 20 mg/kg | 1 g | |
| Gentamicina | 1,5 mg/kg | |||
19. Gravidez, Planejamento Familiar e Contracepção
19.1. Aconselhamento Prévio à Gravidez
A estratificação do risco das doenças valvares para o planejamento de gravidez deve ser fundamentada no diagnóstico anatômico da lesão valvar que classifica a gestação em riscos alto, intermediário e aceitável (Quadro 80).
Quadro 80. Classificação dos riscos das doenças valvares para gravidez.
| Risco Alto | Risco intermediário | Risco aceitável |
|---|---|---|
| EM importante | Prótese biológica com disfunção moderada | Doença valvar discreta |
| EAo importante Prótese biológica estenótica/calcificada Prótese mecânica com disfunção |
Estenose valvar pulmonar | Prótese biológica sem disfunção |
| Prótese mecânica mitral > Prótese mecânica aorta | Sem fatores complicadores |
EAo: estenose aórtica; EM: estenose mitral.
A concomitância de fatores complicadores deve ser considerada como agravante do prognóstico materno e fetal, (Quadro 81).216
Quadro 81. Condições agravantes do prognóstico da gravidez em portadoras de doença valvar216.
|
CF: classe funcional; FA: fibrilação atrial; HP: hipertensão pulmonar; NYHA: New York Heart Association.
No planejamento de gravidez, considera-se que a intervenção percutânea ou cirúrgica deva ser indicada em pacientes com doença valvar importante, mesmo em pacientes assintomáticas, porque CF I/II não assegura boa evolução materna, em lesões obstrutivas graves. (Quadro 82).217
Quadro 82. Recomendações para conduta em doença valvar nativa no planejamento familiar e durante a gestação217.
| Doença valvar | Planejamento Familiar Intervenção | Gestação | ||
|---|---|---|---|---|
| Risco Materno | Risco fetal | Intervenção | ||
| Estenose mitral importante AVM < 1,5 cm2 |
Considerar VMCB ou cirurgia: CF III/IV ou CF I/II + PSAP > 50 mmHg ou FA início recente |
Risco aumentado: CF III/IV e/ou FA |
Prematuridade Restrição de crescimento intrauterino Perda fetal Aumentado em CF III/IV |
Betabloqueador Diurético Anticoagulação se FA Se refratária CF materna III/IV considerar VMCB ou cirurgia |
| Estenose aórtica importante AVA ≤ 1 cm2 |
Considerar valvoplastia cateter-balão ou cirurgia: Sintomática ou Assintomática + Teste ergométrico alterado ou FEVE < 50% ou AVA < 0,7 cm2 gradiente médio > 60 mmHg ou Valva bicúspide + diâmetro de aorta > 45 mm |
Risco aumentado IC Arritmia Síncope Morte súbita Dissecção Ao |
Complicações Prematuridade Restrição de crescimento intrauterino Perda fetal |
Repouso Uso de diuréticos é controverso Considerar betabloqueador ou bloqueador do canal de cálcio + Anticoagulação se FA Considerar valvoplastia cateter-balão ou cirurgia se insuficiência cardíaca ou síncope |
| Insuficiência mitral importante | Considerar cirurgia (plástica/prótese): CF ≥ II ou Assintomática + FEVE ≤ 60% + PSAP ≥ 50 mmHg + DSVE ≥ 40 mm |
Insuficiência cardíaca FA Risco aumentado se FEVE < 35% |
Baixo risco | Diurético, vasodilatador Digoxina, Betabloqueador Considerar cirurgia ou clipagem percutânea mitral® se insuficiência cardíaca refratária |
| Insuficiência Aórtica importante | Considerar cirurgia: Sintomática CF ≥ II ou Fatores complicadores FEVE < 50% DDVE > 70 mm (75 se reumática) DSVE > 50 mm (55 se reumática) Considerar intervenção em aorta proximal: Valva bicúspide isolada diâmetro de aorta > 45 mm |
Baixo risco se assintomática e FEVE normal Risco de Insuficiência cardíaca e/ou FA se CF > II ou FEVE < 35% |
Baixo risco | Diurético, vasodilatador, Digoxina Considerar cirurgia se insuficiência cardíaca refratária Considerar intervenção em aorta proximal: Valva bicúspide isolada com diâmetro de aorta > 45 mm |
AVA: área valvar aórtica; AVM: área valvar mitral; CF: classe funcional; DDVE: diâmetro diastólico do ventrículo esquerdo; DSVE: diâmetro sistólico do ventrículo esquerdo; FA: fibrilação atrial; FEVE: fração de ejeção do VE; IC: insuficiência cardíaca; PSAP: pressão sistólica da artéria pulmonar; VMCB: valvoplastia mitral por cateter-balão.
Em contrapartida, as lesões de regurgitação apresentam melhor prognóstico quando a fração FEVE é preservada e os raros casos que complicam são aqueles que já apresentavam indicação cirúrgica prévia a gestação.
Durante a gestação, o princípio básico para a prevenção e tratamento das complicações é priorizar as medidas gerais e selecionar fármacos não teratogênicos com doses ajustadas à idade gestacional. O Quadro 83 apresenta os fármacos e doses diárias mais frequentemente utilizados no controle das complicações da doença valvar durante a gestação.218
Quadro 83. Recomendações Gerais e farmacológicas durante a gestação218.
|
Medidas intervencionistas em doenças valvares durante a gestação são reservadas para os casos refratários ao tratamento clínico. Os procedimentos percutâneos devem ser preferidos à cirurgia e as propostas de tratamento devem ser discutidas pelo Heart Team, compartilhada com a equipe obstétrica. A valvoplastia por cateter balão na EAo tem sido indicada quando a etiologia é congênita ou na tentativa de resgate da vida materna em casos extremos de gravidade. Em contrapartida a VMCB é segura com resultados equivalentes aos da cirurgia, contudo requer critérios clássicos de indicação tais como a ausência de trombo em AE, IM no máximo de grau discreto e escore ecocardiográfico de Wilkins-Block ≤ 8.
19.2. Próteses Valvares
Do ponto de vista hemodinâmico, tanto as próteses mecânicas como as biológicas melhoram a capacidade funcional e proporcionam semelhante evolução clínica durante a gravidez, contudo a prótese biológica parece ser mais vantajosa porque não requer anticoagulação (Quadro 84). A durabilidade limitada com possibilidade de reoperação em curto prazo, inclusive durante a gravidez, são as maiores restrições no implante de próteses biológicas em mulheres jovens.
Quadro 84. Prótese valvar com função normal e riscos para a gestação.
| Prótese biológica com FEVE normal | Prótese mecânica com FEVE normal | ||
|---|---|---|---|
| Risco materno | Risco fetal | Risco materno | Resultados fetais |
| Risco baixo | Risco baixo | Risco intermediário Requer anticoagulação | Alto risco |
| Não requer anticoagulação | Embolia sistêmica Trombose de prótese Hemorragia | Embriopatia varfarínica Perdas fetais Prematuridade Hemorragia perinatal | |
FEVE: fração de ejeção do VE.
A conduta perante a disfunção de prótese durante a gravidez deve sempre priorizar a vida materna e as propostas devem ser discutidas com Heart Team, e compartilhadas com a equipe obstétrica (Quadro 85).
Quadro 85. Conduta em próteses com disfunção durante a gestação.
| Prótese biológica | Prótese mecânica | ||
|---|---|---|---|
| Risco materno | Risco fetal | Risco materno | Risco fetal |
| Disfunção com predomínio de insuficiência, CF I/II e FEVE normal Considerar medidas farmacológicas | Risco baixo | Disfunção com insuficiência “paravalvar” leve a moderada, sem hemólise significativa ou insuficiência cardíaca grave Considerar medidas farmacológicas para insuficiência cardíaca e anemia IM severa ou hemólise significativa Considerar intervenção Insuficiência cardíaca e/ou hemólise sintomáticas Considerar fechamento percutâneo do “leak” paravalvar ou cirurgia (alto risco de recidiva) |
Alto risco fetal se cirurgia |
| Disfunção com predomínio de estenose valvar com calcificação (mitral, aórtica ou tricúspide) Riscos de insuficiência cardíaca grave, choque, morte súbita Sempre considerar Implante percutâneo ou transapical (valve-in-valve) ou cirurgia |
Alto risco fetal Perda fetal Prematuridade |
Trombose prótese mecânica Considerar intervenção de emergência (trombólise ou cirurgia) Estenose de prótese mecânica por crescimento endotelial intravalvar- Pannus ou mismatch Necessidade de intervenção é rara Se necessário, considerar cirurgia |
Alto risco fetal se cirurgia |
CF: classe funcional; FEVE: fração de ejeção do VE; IM: insuficiência mitral.
O esquema da anticoagulação para pacientes portadoras de prótese mecânica é ainda controverso.218,219 Até o momento não há uma orientação uniforme e aceita amplamente. Fatores a serem considerados incluem: preferência da paciente, expertise do médico assistente, recursos no atendimento e disponibilidade de controle adequado da coagulação.
As recomendações para a prevenção de tromboembolismo em próteses mecânicas pretendem atender aos requisitos ideais de um posicionamento baseadas na documentação da literatura, na vivência dos autores e que seja efetiva para a realidade dos diversos Serviços. Entende-se que a dinâmica da anticoagulação permanente para portadoras de próteses mecânicas seja multidisciplinar e fragmentada em cinco momentos: preconcepção, cada trimestre, parto e puerpério, apresentada no Quadro 86 e Figura 11. O rigoroso controle da anticoagulação e doses dos anticoagulantes devem ser ajustados de acordo com as metas convencionais.
Quadro 86. Controles da anticoagulação em prótese mecânica durante a gravidez.
| Idade gestacional (semanas) | Anticoagulante | Controle |
|---|---|---|
| Entre 6ª e 12ª | Heparina de baixo peso molecular 1,0 mg/kg subcutânea 12/12 horas ou Heparina não fracionada endovenosa 18 UI/kg/hora em bomba infusão (< 30.000 UI) |
Anti-Xa: 0.8-1.2 U/ml/ TTPa 1,5 vez a 2,0 vezes do valor controle |
| 12ª até a 36ª | Varfarina na dose de acordo com INR | Aórtica INR entre 2,5 e 3,0 Mitral INR 3,0 e 3,5 |
| Após 36ª até o parto | Heparina de baixo peso molecular 1,0 mg/kg subcutânea 12/12 horas ou Heparina não fracionada endovenosa 18 UI/kg/hora em bomba de infusão (< 30.000 UI) |
Anti-Xa: 0.8-1.2 U/ml TTPa 1,5 vez a 2,0 vezes do valor controle |
| Puerpério | Heparina de baixo peso molecular 1,0 mg/kg subcutânea 12/12 horas Heparina não fracionada endovenosa 18 UI/kg/hora em bomba de infusão (< 30.000 UI) Varfarina alcançar INR alvo para alta hospitalar |
Anti-Xa: 0.8-1.2 U/ml TTPa 1,5 vez a 2,0 vezes do valor controle INR entre 2,0 e 2,5 |
TTPa: tempo de tromboplastina parcial ativada; INR: razão normalizada internacional.
Figura 11. Algoritmo com recomendações para anticoagulação em portadoras de próteses mecânicas para gravidez, parto e puerpério. AVK: antagonista da vitamina K, HCG: gonadotrofina coriônica, HBPM SC: heparina de baixo peso molecular subcutânea; HNF IV: heparina não fracionada intravenosa.
Momento 1 - Orientação quanto ao diagnóstico precoce da gravidez: Esclarecimento sobre a obrigatoriedade em manter a anticoagulação, a disponibilidade dos anticoagulantes e os seus riscos em todas as etapas da gestação, parto e puerpério. A orientação inclui a informação sobre a importância do diagnóstico precoce da gravidez em reduzir a ocorrência da embriopatia, que ocorre entre 6ª e 9ª semana de gestação. Nesta consulta é fornecido um pedido de exame para a dosagem de gonadotrofina coriônica beta (βHCG) que deve ser realizado à primeira dúvida de atraso menstrual.
Momento 2 - Primeiro trimestre: confirmado o diagnóstico da gravidez (βHCG e ultrassonografia obstétrica), deve ser realizado a substituição da varfarina pela heparina que permite uma conciliação entre o benefício da prevenção de trombose materna e o malefício da embriopatia. Em pacientes que chegam na 1ª visita médica com idade gestacional além da 6ª semana, a varfarina não deve ser suspensa. O casal deve ser informado da possibilidade da embriopatia e que os riscos da substituição pela heparina, neste momento, não são mais justificados.
Momento 3 - Segundo trimestre: retorno ao anticoagulante oral. O retorno para à varfarina ajusta-se à suposição de abreviar o uso da heparina e do menor risco da embriopatia. A proposta é manter as doses de varfarina de acordo com as metas de anteriores à gestação, com controle da INR semanal ou quinzenal. A reintrodução da varfarina deve obedecer a dinâmica da transição, ou seja, simultânea à heparina de baixo peso molecular subcutânea ou à heparina não fracionada endovenosa até o alcance da meta da INR.
Momento 4 - terceiro trimestre: considerar a hospitalização, redirecionar para a anticoagulação parenteral e planejar o parto. A hospitalização deve ser programada com 36 semanas de gestação para o uso de heparina de baixo peso molecular subcutânea ou heparina não fracionada endovenosa.
Momento 5 - puerpério: reintrodução da anticoagulação oral e alta hospitalar. Decorrido 6 horas do parto e em ausência de complicação materna, a heparina não fracionada endovenosa ou heparina de baixo peso molecular subcutânea em doses terapêuticas devem ser reintroduzidas. A varfarina deve ser prescrita 48 horas após o parto, obedecendo a dinâmica de transição em conjunto com a heparina até o valor de 2,0 da INR, quando é dada a alta hospitalar.
19.3. Parto e Puerpério
A programação do parto deve ser multidisciplinar a partir da 34ª semana de gestação. Considera-se o parto vaginal mais vantajoso porque está associado a menor perda sanguínea e menores riscos trombótico e infeccioso. As técnicas anestésicas sequenciais, com bloqueio do neuroeixo, apresentam vantagens hemodinâmicas porque permitem a forma gradual do bloqueio simpático. Os casos de indicação materna de cesárea geralmente requerem anestesia geral (Quadro 87).
Quadro 87. Recomendações para via de parto e anestesia em portadoras de doença valvar.
|
19.4. Contracepção
A seleção dos métodos de contracepção para mulheres com doenças valvares exige a parceria multidisciplinar – ginecologista e cardiologista – para busca da segurança, eficácia, tolerância e fácil acesso. Nesse sentido, a orientação para a prescrição deve se apoiar nos Critérios de Elegilibidade dos Contraceptivos que classifica os anticoncepcionais em quatro categorias de risco e no índice de Pearl que calcula a eficácia do método considerando o número de gravidez em 100 mulheres no primeiro ano do uso do método.220,221 Para pacientes portadoras de doença valvar a tendência atual é se indicar os métodos que contenham progesterona isolada ou os combinados de progesterona com estrógeno natural na forma injetável/mensal, porque são seguros, eficazes e de fácil acesso (Quadro 88). Embora os dispositivos intrauterinos estejam classificados na categoria 2 eles não têm sido indicados em portadoras de doenças valvares mesmo que não complicada, pelo presumível risco inerente de EI.
Quadro 88. Critérios médicos de elegibilidade (modificado)* e índice de eficácia para o uso de contraceptivo em portadoras de doença valvar220,221.
| Contraceptivos disponíveis | AHCO | Injetável mensal | Pílula de progesterona | Injetável de progesterona | Implante de progesterona | DIU de cobre | DIU com levonorgestrel |
|---|---|---|---|---|---|---|---|
| Doença valvar | |||||||
| Não complicada | 2 | 1 | 1 | 1 | 1 | 3/4 | 3/4 |
| Fatores complicadores | 4 | 4 | 1 | 1 | 1 | 4 | 4 |
| Eficácia | 8 | 3 | 3 | 3 | 0,05 | 0,8 | 0,1 |
Fatores complicador: Eficácia (Índice de Pearl) calculada em número de gravidez em 100 mulheres com uso habitual do método. Critérios de Elegibilidade: categoria 1- não há restrição quanto ao uso do método; categoria 2- vantagens de usar o método geralmente superam os riscos teóricos ou comprovados; categoria 3- os riscos teóricos ou comprovados geralmente superam as vantagens de usar o método e categoria 4- condição que representa um risco de saúde inaceitável se o método contraceptivo for usado. AHCO: anticoncepcional hormonal combinado oral; DIU: dispositivo intrauterino.
Glossary
Lista de Abreviaturas:
- βHCG:
gonadotrofina coriônica beta
- ACC/AHA:
American College of Cardiology/American Heart Association
- AD:
átrio direito
- AE:
átrio esquerdo
- AOE:
área efetiva do orifício
- AAS:
ácido acetilsalicílico
- AHCO:
anticoncepcional hormonal combinado oral
- AVA:
área valvar aórtica
- AVM:
área valvar mitral
- BNP:
peptídeo natriurético cerebral
- CF:
classe funcional
- DDVE:
diâmetro diastólico do ventrículo esquerdo
- DIU:
dispositivo intrauterino
- DOACs:
anticoagulantes orais diretos
- DSVE:
diâmetro sistólico do ventrículo esquerdo
- EAo:
estenose aórtica
- ECG:
eletrocardiograma
- EI:
endocardite infecciosa
- EM:
estenose mitral
- ERO:
área efetiva do orifício regurgitante
- ESC/EACTS:
European Society of Cardiology/European Association for CardioThoracic Surgery
- ET:
estenose tricúspide
- FA:
fibrilação atrial
- FEVE:
fração de ejeção do ventrículo esquerdo
- FR:
febre reumática
- HP:
hipertensão pulmonar
- IAo:
insuficiência aórtica
- IC:
insuficiência cardíaca
- IM:
insuficiência mitral
- INR:
razão normalizada internacional
- IT:
insuficiência tricúspide
- NYHA:
New York Heart Association
- PHT:
pressure half time
- PSAP:
pressão sistólica da artéria pulmonar
- rTPA:
recombinant tissue plasminogen activator.
- SBC:
Sociedade Brasileira de Cardiologia
- STS:
Society of Thoracic Surgeons
- TAVI:
implante transcateter de bioprótese aórtica
- TTPa:
tempo de tromboplastina parcial ativada
- VE:
ventrículo esquerdo
- VKA:
antagonistas da vitamina K
- VMCB:
valvoplastia mitral por cateter-balão
- VTCB:
valvoplastia tricúspide por cateter-balão
Footnotes
Realização: Departamento de Cardiologia Clínica da Sociedade Brasileira de Cardiologia (DCC-SBC)
Conselho de Normatizações e Diretrizes (2020-2021): Brivaldo Markman Filho, Antonio Carlos Sobral Sousa, Aurora Felice Castro Issa, Bruno Ramos Nascimento, Harry Correa Filho, Marcelo Luiz Campos Vieira
Coordenador de Normatizações e Diretrizes (2020-2021): Brivaldo Markman Filho
Nota: estas Atualizações se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
Referências
- 1.1. Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease. Eu Heart J.2017;38(36):2739-91. [DOI] [PubMed]
- 2.2. AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2017;70(2):252-89. [DOI] [PubMed]
- 3.3. O'Brien SM, Shahian DM, Filardo G, Ferraris VA, Haan CK, Rich JB, et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 2—isolated valve surgery. Ann Thorac Surg. 2009;88(1):S23-S42. [DOI] [PubMed]
- 4.4. Shahian DM, O'Brien SM, Filardo G, Ferraris VA, Haan CK, Rich JB, et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 3—valve plus coronary artery bypass grafting surgery. Ann Thorac Surg. 2009;88(1):S43-S62. [DOI] [PubMed]
- 5.5. Dewey TM, Brown D, Ryan WH, Herbert MA, Prince SL, Mack MJ. Reliability of risk algorithms in predicting early and late operative outcomes in high-risk patients undergoing aortic valve replacement. J Thorac Cardiovasc Surg. 2008;135(1):180-7. [DOI] [PubMed]
- 6.6. Nashef SA, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, et al. Euroscore II. Eur J Cardio Thorac Surg. 2012;41(4):734-45. [DOI] [PubMed]
- 7.7. Osnabrugge RL, Speir AM, Head SJ, Fonner CE, Fonner E, Kappetein AP, et al. Performance of EuroSCORE II in a large US database: implications for transcatheter aortic valve implantation. Eur J Cardio Thorac Surg. 2014;46(3):400-8. [DOI] [PubMed]
- 8.8. Barili F, Pacini D, Capo A, Rasovic O, Grossi C, Alamanni F, et al. Does EuroSCORE II perform better than its original versions? A multicentre validation study. Eur Heart J. 2013;34(1):22-9. [DOI] [PubMed]
- 9.9. Lee DH, Buth KJ, Martin B-J, Yip AM, Hirsch GM. Frail patients are at increased risk for mortality and prolonged institutional care after cardiac surgery. Circulation. 2010;121(8):973-8. [DOI] [PubMed]
- 10.10. Stortecky S, Schoenenberger AW, Moser A, Kalesan B, Jüni P, Carrel T, et al. Evaluation of multidimensional geriatric assessment as a predictor of mortality and cardiovascular events after transcatheter aortic valve implantation. JACC. Cardiovasc Interv. 2012;5(5):489-96. [DOI] [PubMed]
- 11.11. Puls M, Sobisiak B, Bleckmann A, Jacobshagen C, Danner BC, Huenlich M, et al. Impact of frailty on short-and long-term morbidity and mortality after transcatheter aortic valve implantation: risk assessment by Katz Index of activities of daily living. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. Eurointervention.2014;10(5):609-19. [DOI] [PubMed]
- 12.12. Afilalo J, Lauck S, Kim DH, Lefèvre T, Piazza N, Lachapelle K, et al. Frailty in older adults undergoing aortic valve replacement: the FRAILTY-AVR study.J Am Coll Cardiol. 2017;70(6):689-700. [DOI] [PubMed]
- 13.13. Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, et al. Frailty in older adults: evidence for a phenotype. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. J Gerontol A Biol Sci Med Sci. 2001;56(3):M146-M57. [DOI] [PubMed]
- 14.14. Katz S, Downs TD, Cash HR, Grotz RC. Progress in development of the index of ADL. Gerontologist. 1970;10(1_Part_1):20-30. [DOI] [PubMed]
- 15.15. Nishimura RA, Vahanian A, Eleid MF, Mack MJ. Mitral valve disease—current management and future challenges. Lancet. 2016;387(10025):1324-34. [DOI] [PubMed]
- 16.16. Iung B, Vahanian A. Epidemiology of valvular heart disease in the adult. Nat Rev Cardiol. 2011;8(3):162- 72. [DOI] [PubMed]
- 17.17. Banovic M, Da Costa M. Degenerative mitral stenosis: from pathophysiology to challenging interventional treatment. Curr Probl Cardiol. 2019;44(1):10-35. [DOI] [PubMed]
- 18.18. Iung B, Baron G, Butchart EG, Delahaye F, Gohlke-Bärwolf C, Levang OW, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. Eur Heart J. 2003;24(13):1231-43. [DOI] [PubMed]
- 19.19. Nkomo VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study. Lancet. 2006;368(9540):1005-11. [DOI] [PubMed]
- 20.20. Meneguz-Moreno RA, Costa JR, Gomes NL, Braga SL, Ramos AI, Meneghelo Z, et al. Very long term follow-up after percutaneous balloon mitral valvuloplasty. JACC: Cardiovasc Interv. 2018;11(19):1945-52. [DOI] [PubMed]
- 21.21. Mitrev L, Desai N, Awad A, Sabir S, editors. Interventional Echocardiography of the MV: what the interventionalist wants to know. Semin Cardiothorac Vasc Anesth.2019;23(1):37-47. [DOI] [PubMed]
- 22.22. Ghadimi N, Kaveh S, Shabaninejad H, Lijassi A, Mehr AZ, Hosseinifard H. Comparative efficacy of ivabradine versus beta-blockers in patients with mitral stenosis in sinus rhythm: systematic review and meta-analysis. Int J Clin Pharm. 2019;41(1):22-9. [DOI] [PubMed]
- 23.23. Guerrero M, Dvir D, Himbert D, Urena M, Eleid M, Wang DD, et al. Transcatheter mitral valve replacement in native mitral valve disease with severe mitral annular calcification: results from the first multicenter global registry. JACC: Cardiovasc Interv. 2016;9(13):1361-71. [DOI] [PubMed]
- 24.24. Guerrero M, Urena M, Himbert D, Wang DD, Eleid M, Kodali S, et al. 1-year outcomes of transcatheter mitral valve replacement in patients with severe mitral annular calcification. J Am Coll Cardiol. 2018;71(17):1841-53. [DOI] [PubMed]
- 25.25. Sud K, Agarwal S, Parashar A, Raza MQ, Patel K, Min D, et al. Degenerative mitral stenosis: unmet need for percutaneous interventions. Circulation. 2016;133(16):1594-604. [DOI] [PubMed]
- 26.26. Shah PM. Echocardiographic diagnosis of mitral valve prolapse. J Am Soc Echocardiogr. 1994;7(3 Pt 1):286-93. [DOI] [PubMed]
- 27.27. Uretsky S, Gillam L, Lang R, Chaudhry FA, Argulian E, Supariwala A, et al. Discordance between echocardiography and MRI in the assessment of mitral regurgitation severity: a prospective multicenter trial. J Am Coll Cardiol. 2015;65(11):1078-88. [DOI] [PubMed]
- 28.28. Thavendiranathan P, Phelan D, Collier P, Thomas JD, Flamm SD, Marwick TH. Quantitative assessment of mitral regurgitation: how best to do it. JACC: Cardiovasc Imaging. 2012;5(11):1161-75. [DOI] [PubMed]
- 29.29. Cawley PJ, Hamilton-Craig C, Owens DS, Krieger EV, Strugnell WE, Mitsumori L, et al. Prospective comparison of valve regurgitation quantitation by cardiac magnetic resonance imaging and transthoracic echocardiography. Circ Cardiovasc Imaging. 2013;6(1):48-57. [DOI] [PubMed]
- 30.30. Cavalcante JL, Kusunose K, Obuchowski NA, Jellis C, Griffin BP, Flamm SD, et al. Prognostic impact of ischemic mitral regurgitation severity and myocardial infarct quantification by cardiovascular magnetic resonance. JACC Cardiovasc Imaging. 2019; Dec 18.pii: S1936-878X(19)31026-5. [DOI] [PubMed]
- 31.31. Uretsky S, Argulian E, Narula J, Wolff SD. Use of cardiac magnetic resonance imaging in assessing mitral regurgitation: current evidence. J Am Coll Cardiol.. 2018;71(5):547-63. [DOI] [PubMed]
- 32.32. Uretsky S, Argulian E, Supariwala A, Marcoff L, Koulogiannis K, Aldaia L, et al. A comparative assessment of echocardiographic parameters for determining primary mitral regurgitation severity using magnetic resonance imaging as a reference standard. J Am Soc Echocardiogr. 2018;31(9):992-9. [DOI] [PubMed]
- 33.33. Krivokapich J, Child JS, Dadourian BJ, Perloff JK. Reassessment of echocardiographic criteria for diagnosis of mitral valve prolapse. Am J Cardiol. 1988;61(1):131-5. [DOI] [PubMed]
- 34.34. Marks AR, Choong CY, Sanfilippo AJ, Ferré M, Weyman AE. Identification of high-risk and low-risk subgroups of patients with mitral-valve prolapse. N Engl J Med. 1989;320(16):1031-6. [DOI] [PubMed]
- 35.35. Boudoulas H, Kolibash AJ Jr, Baker P, King BD, Wooley CF. Mitral valve prolapse and the mitral valve prolapse syndrome: a diagnostic classification and pathogenesis of symptoms. Am Heart J. 1989;118(4):796-818. [DOI] [PubMed]
- 36.36. Avierinos J-F, Gersh BJ, Melton Iii LJ, Bailey KR, Shub C, Nishimura RA, et al. Natural history of asymptomatic mitral valve prolapse in the community. Circulation. 2002;106(11):1355-61. [DOI] [PubMed]
- 37.37. Grigioni F, Benfari G, Vanoverschelde J-L, Tribouilloy C, Avierinos J-F, Bursi F, et al. Long-term implications of atrial fibrillation in patients with degenerative mitral regurgitation. J Am Coll Cardiol. 2019;73(3):264-74. [DOI] [PubMed]
- 38.38. Grigioni F, Avierinos J-F, Ling LH, Scott CG, Bailey KR, Tajik AJ, et al. Atrial fibrillation complicating the course of degenerative mitral regurgitation: determinants and long-term outcome. J Am Coll Cardiol. 2002;40(1):84-92. [DOI] [PubMed]
- 39.39. Rosa VEE, Fernandes JRC, Lopes ASdSA, Accorsi TAD, Tarasoutchi F. Recommendation of early surgery in primary mitral regurgitation: pros and cons. Arq Bras Cardiol. 2016;107(2):173-5. [DOI] [PMC free article] [PubMed]
- 40.40. Moss RR, Humphries KH, Gao M, Thompson CR, Abel JG, Fradet G, et al. Outcome of mitral valve repair or replacement: a comparison by propensity score analysis. Circulation. 2003;108(10_suppl_1):II-90-II-7. [DOI] [PubMed]
- 41.41. Flameng W, Herijgers P, Bogaerts K. Recurrence of mitral valve regurgitation after mitral valve repair in degenerative valve disease. Circulation. 2003;107(12):1609-13. [DOI] [PubMed]
- 42.42. Ling LH, Enriquez-Sarano M, Seward JB, Orszulak TA, Schaff HV, Bailey KR, et al. Early surgery in patients with mitral regurgitation due to flail leaflets: a long-term outcome study. Circulation. 1997;96(6):1819-25. [DOI] [PubMed]
- 43.43. Thourani VH, Weintraub WS, Guyton RA, Jones EL, Williams WH, Elkabbani S, et al. Outcomes and long-term survival for patients undergoing mitral valve repair versus replacement: effect of age and concomitant coronary artery bypass grafting. Circulation. 2003;108(3):298-304. [DOI] [PubMed]
- 44.44. Enriquez-Sarano M, Schaff HV, Orszulak TA, Tajik AJ, Bailey KR, Frye RL. Valve repair improves the outcome of surgery for mitral regurgitation: a multivariate analysis. Circulation. 1995;91(4):1022-8. [DOI] [PubMed]
- 45.45. Enriquez-Sarano M, Freeman WK, Tribouilloy CM, Orszulak TA, Khandheria BK, Seward JB, et al. Functional anatomy of mitral regurgitation: accuracy and outcome implications of transesophageal echocardiography. J Am Coll Cardiol. 1999;34(4):1129-36. [DOI] [PubMed]
- 46.46. David TE, Ivanov J, Armstrong S, Christie D, Rakowski H. A comparison of outcomes of mitral valve repair for degenerative disease with posterior, anterior, and bileaflet prolapse. J Thorac Cardiovasc Surg.2005;130(5):1242-9. [DOI] [PubMed]
- 47.47. Chauvaud S, Fuzellier J-F, Berrebi A, Deloche A, Fabiani JN, Carpentier A. Long-term (29 years) results of reconstructive surgery in rheumatic mitral valve insufficiency. Circulation. 2001;104(Suppl_1):I-12-I-5. [DOI] [PubMed]
- 48.48. Suri RM, Schaff HV, Dearani JA, Sundt III TM, Daly RC, Mullany CJ, et al. Survival advantage and improved durability of mitral repair for leaflet prolapse subsets in the current era. The Annals of thoracic surgery. 2006;82(3):819-26. [DOI] [PubMed]
- 49.49. Enriquez-Sarano M, Tajik AJ, Schaff HV, Orszulak TA, Bailey KR, Frye RL. Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. Circulation. 1994;90(2):830-7. [DOI] [PubMed]
- 50.50. Rosenhek R, Rader F, Klaar U, Gabriel H, Krejc M, Kalbeck D, et al. Outcome of watchful waiting in asymptomatic severe mitral regurgitation. Circulation. 2006;113(18):2238-44. [DOI] [PubMed]
- 51.51. Kang DH, Kim JH, Rim JH, Kim MJ, Yun SC, Song M, et al. Comparison of early surgery versus conventional treatment in asymptomatic severe mitral regurgitation. Circulation. 2009;119(6):797-804. [DOI] [PubMed]
- 52.52. Feldman T, Kar S, Rinaldi M, Fail P, Hermiller J, Smalling R, et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. J Am Coll Cardiol. 2009;54(8):686-94. [DOI] [PubMed]
- 53.53. Grigioni F, Enriquez-Sarano M, Zehr KJ, Bailey KR, Tajik AJ. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation. 2001;103(13):1759-64. [DOI] [PubMed]
- 54.54. Agricola E, Oppizzi M, Pisani M, Meris A, Maisano F, Margonato A. Ischemic mitral regurgitation: mechanisms and echocardiographic classification. European Journal of Echocardiography. 2008;9(2):207-21. [DOI] [PubMed]
- 55.55. Le Tourneau T, Richardson M, Juthier F, Modine T, Fayad G, Polge AS, et al. Echocardiography predictors and prognostic value of pulmonary artery systolic pressure in chronic organic mitral regurgitation. Heart. 2010;96(16):1311-7. [DOI] [PubMed]
- 56.56. Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol. 2015;65(12):1231-48. [DOI] [PubMed]
- 57.57. Grossi EA, Goldberg JD, LaPietra A, Ye X, Zakow P, Sussman M, et al. Ischemic mitral valve reconstruction and replacement: comparison of long-term survival and complications. J Thorac Cardiovasc Surg. 2001;122(6):1107-24. [DOI] [PubMed]
- 58.58. Gillinov AM, Wierup PN, Blackstone EH, Bishay ES, Cosgrove DM, White J, et al. Is repair preferable to replacement for ischemic mitral regurgitation? J Thorac Cardiovasc Surg. 2001;122(6):1125-41. [DOI] [PubMed]
- 59.59. Kim YH, Czer LS, Soukiasian HJ, De Robertis M, Magliato KE, Blanche C, et al. Ischemic mitral regurgitation: revascularization alone versus revascularization and mitral valve repair. Ann Thorac Surg. 2005;79(6):1895-901. [DOI] [PubMed]
- 60.60. Alfieri O, Maisano F, De Bonis M, Stefano PL, Torracca L, Oppizzi M, et al. The double-orifice technique in mitral valve repair: a simple solution for complex problems. J Thorac Cardiovasc Surg. 2001; 2001;122(4):674-81. [DOI] [PubMed]
- 61.61. Feldman T, Foster E, Glower DD, Kar S, Rinaldi MJ, Fail PS, et al. Percutaneous repair or surgery for mitral regurgitation. N Engl J Med. 2011;364(15):1395-406. [DOI] [PubMed]
- 62.62. Lodhi MU, Usman MS, Siddiqi TJ, Khan MS, Khan MAA, Khan SU, et al. Percutaneous Mitral Valve Repair versus Optimal Medical Therapy in Patients with Functional Mitral Regurgitation: A Systematic Review and Meta-Analysis. J Interv Cardiol. 2019 Apr 21;2019:27531.46 [DOI] [PMC free article] [PubMed]
- 63.63. Stone GW, Lindenfeld J, Abraham WT, Kar S, Lim DS, Mishell JM, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med.. 2018;379(24):2307-18. [DOI] [PubMed]
- 64.64. Kamperidis V, van Wijngaarden SE, van Rosendael PJ, Kong WKF, Regeer MV, van der Kley F, et al. Mitral valve repair for secondary mitral regurgitation in non-ischaemic dilated cardiomyopathy is associated with left ventricular reverse remodelling and increase of forward flow. Eur Heart J Cardiovasc Imaging. 2018;19(2):208-15. [DOI] [PubMed]
- 65.65. AATSIschemic Mitral Regurgitation Consensus., Kron I, LaPar D, Acker M, Adams D, Ailawadi G, et al. 2016 Update to The American Association for Thoracic Surgery consensus guidelines. J Thorac Cardiovasc Surg. 2017;153(5):e97-e114. [DOI] [PubMed]
- 66.66. Tatum JM, Bowdish ME, Mack WJ, Quinn AM, Cohen RG, Hackmann AE, et al. Outcomes after mitral valve repair. A single-center 16-year experience. J Thorac Cardiovasc Surg. 2017;154(3):822-30. [DOI] [PubMed]
- 67.67. Iung B, Armoiry X, Vahanian A, Boutitie F, Mewton N, Trochu JN, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation: outcomes at 2 years. Eur J Heart Fail.2019;21(12):1619-27. [DOI] [PubMed]
- 68.68. Obadia J-F, Messika-Zeitoun D, Leurent G, Iung B, Bonnet G, Piriou N, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med. 2018;379(24):2297-306. [DOI] [PubMed]
- 69.69. Daimon M, Shiota T, Gillinov AM, Hayase M, Ruel M, Cohn WE, et al. Percutaneous mitral valve repair for chronic ischemic mitral regurgitation: a real-time three-dimensional echocardiographic study in an ovine model. Circulation. 2005;111(17):2183-9. [DOI] [PubMed]
- 70.70. Obadia J-F, Armoiry X, Iung B, Lefevre T, Mewton N, Messika-Zeitoun D, et al. The MITRA-FR study: design and rationale of a randomised study of percutaneous mitral valve repair compared with optimal medical management alone for severe secondary mitral regurgitation. EuroIntervention. 2015;10(11):1354-60. [DOI] [PubMed]
- 71.71. Naoum C, Blanke P, Cavalcante JL, Leipsic J. Cardiac computed tomography and magnetic resonance imaging in the evaluation of mitral and tricuspid valve disease: implications for transcatheter interventions. Circ Cardiovasc Imaging. 2017;10(3):e005331. [DOI] [PubMed]
- 72.72. Alkhouli M, Wolfe S, Alqahtani F, Aljohani S, Mills J, Gnegy S, et al. The feasibility of transcatheter edge-to-edge repair in the management of acute severe ischemic mitral regurgitation. JACC: Cardiovasc Interv. 2017;10(5):529-31. [DOI] [PubMed]
- 73.73. Rosa VEE, Lopes ASdSA, Accorsi TAD, Lemos PA. Is heart team fundamental to aortic stenosis transcatheter treatment? Arq Bras Cardiol. 2014;102(5):e55. [DOI] [PMC free article] [PubMed]
- 74.74. Clavel M-A, Pibarot P, Messika-Zeitoun D, Capoulade R, Malouf J, Aggarval S, et al. Impact of aortic valve calcification, as measured by MDCT, on survival in patients with aortic stenosis: results of an international registry study. J Am Coll Cardiol. 2014;64(12):1202-13. [DOI] [PMC free article] [PubMed]
- 75.75. Cowell S, Newby D, Burton J, White A, Northridge D, Boon N, et al. Aortic valve calcification on computed tomography predicts the severity of aortic stenosis. Clin Radiol. 2003;58(9):712-6. [DOI] [PubMed]
- 76.76. Messika-Zeitoun D, Aubry M-C, Detaint D, Bielak LF, Peyser PA, Sheedy PF, et al. Evaluation and clinical implications of aortic valve calcification measured by electron-beam computed tomography. Circulation. 2004;110(3):356-62. [DOI] [PubMed]
- 77.77. Kaden JJ, Freyer S, Weisser G, Willingstorfer W, Bilbal A, Pfleger S, et al. Correlation of degree of aortic valve stenosis by Doppler echocardiogram to quantity of calcium in the valve by electron beam tomography. Am J Cardiol. 2002;90(5):554-7. [DOI] [PubMed]
- 78.78. Pawade T, Sheth T, Guzzetti E, Dweck MR, Clavel M-A. Why and how to measure aortic valve calcification in patients with aortic stenosis. JACC: Cardiovasc Imaging. 2019;12(9):1835-48. [DOI] [PubMed]
- 79.79. Dumesnil JG, Pibarot P, Carabello B. Paradoxical low flow and/or low gradient severe aortic stenosis despite preserved left ventricular ejection fraction: implications for diagnosis and treatment. Eur Heart J. 2010;31(3):281-9. [DOI] [PMC free article] [PubMed]
- 80.80. Barasch E, Fan D, Chukwu EO, Han J, Passick M, Petillo F, et al. Severe isolated aortic stenosis with normal left ventricular systolic function and low transvalvular gradients: pathophysiologic and prognostic insights. J Heart Valve Dis. 2008;17(1):81-8. [PubMed]
- 81.81. Jander N, Minners J, Holme I, Gerdts E, Boman K, Brudi P, et al. Outcome of patients with low-gradient “severe” aortic stenosis and preserved ejection fraction. Circulation. 2011;123(8):887-95. [DOI] [PubMed]
- 82.82. Minners J, Allgeier M, Gohlke-Baerwolf C, Kienzle RP, Neumann FJ, Jander N. Inconsistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart. 2010;96(18):1463-8. [DOI] [PubMed]
- 83.83. Clavel MA, Magne J, Pibarot P. Low-gradient aortic stenosis. Eur Heart J. 2016;37(34):2645-57. [DOI] [PMC free article] [PubMed]
- 84.84. Dumesnil JG, Pibarot P. Low-flow, low-gradient severe aortic stenosis in patients with normal ejection fraction. Curr Opin Cardiol. 2013;28(5):524-30. [DOI] [PubMed]
- 85.85. Rosa VEE, Accorsi TAD, Fernandes JRC, Lopes ASdSA, Sampaio RO, Tarasoutchi F. Low-flow aortic stenosis and reduced ejection fraction: new insights. Arq Bras Cardiol. 2015;105(1):82-5. [DOI] [PMC free article] [PubMed]
- 86.86. deFilippi CR, Willett DL, Brickner ME, Appleton CP, Yancy CW, Eichhorn EJ, et al. Usefulness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients. Am J Cardiol. 1995;75(2):191-4. [DOI] [PubMed]
- 87.87. Cueff C, Serfaty J-M, Cimadevilla C, Laissy J-P, Himbert D, Tubach F, et al. Measurement of aortic valve calcification using multislice computed tomography: correlation with haemodynamic severity of aortic stenosis and clinical implication for patients with low ejection fraction. Heart. 2011;97(9):721-6. [DOI] [PubMed]
- 88.88. Zusman O, Pressman GS, Banai S, Finkelstein A, Topilsky Y. Intervention versus observation in symptomatic patients with normal flow low gradient severe aortic stenosis. JACC: Cardiovasc Imaging. 2018;11(9):1225-32. [DOI] [PubMed]
- 89.89. Carter Storch R, Møller JE, Christensen NL, Irmukhadenov A, Rasmussen LM, Pecini R, et al. Postoperative reverse remodeling and symptomatic improvement in normal-flow low-gradient aortic stenosis after aortic valve replacement. Circ Cardiovasc Imaging. 2017;10(12):e006580. [DOI] [PubMed]
- 90.90. Takagi H, Hari Y, Kawai N, Kuno T, Ando T, Group A. Meta-analysis of transcatheter aortic valve implantation for bicuspid versus tricuspid aortic valves. J Cardiol. 2019;74(1):40-8. [DOI] [PubMed]
- 91.91. Rosenhek R, Binder T, Porenta G, Lang I, Christ G, Schemper M, et al. Predictors of outcome in severe, asymptomatic aortic stenosis. N Engl J Med. 2000;343(9):611-7. [DOI] [PubMed]
- 92.92. Otto CM, Burwash IG, Legget ME, Munt BI, Fujioka M, Healy NL, et al. Prospective study of asymptomatic valvular aortic stenosis: clinical, echocardiographic, and exercise predictors of outcome. Circulation. 1997;95(9):2262-70. [DOI] [PubMed]
- 93.93. Pellikka PA, Sarano ME, Nishimura RA, Malouf JF, Bailey KR, Scott CG, et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis during prolonged follow-up. Circulation. 2005;111(24):3290-5. [DOI] [PubMed]
- 94.94. Rahimtoola SH. Valvular heart disease: a perspective on the asymptomatic patient with severe valvular aortic stenosis. Eur Heart J. 2008;29(14):1783-90. [DOI] [PubMed]
- 95.95. Dal Bianco JP, Khandheria BK, Mookadam F, Gentile F, Sengupta PP. Management of asymptomatic severe aortic stenosis. J Am Coll Cardiol. 2008;52(16):1279-92. [DOI] [PubMed]
- 96.96. Connolly HM, Oh JK, Orszulak TA, Osborn SL, Roger VL, Hodge DO, et al. Aortic valve replacement for aortic stenosis with severe left ventricular dysfunction: prognostic indicators. Circulation. 1997;95(10):2395-400. [DOI] [PubMed]
- 97.97. Amato M, Moffa P. Prognosis of asymptomatic aortic valve stenosis evaluated with exercise test. Arq Bras Cardiol. 1998;70(4):251-5. [DOI] [PubMed]
- 98.98. Das P, Rimington H, Chambers J. Exercise testing to stratify risk in aortic stenosis. Eur Heart J. 2005;26(13):1309-13. [DOI] [PubMed]
- 99.99. Reardon MJ, Van Mieghem NM, Popma JJ, Kleiman NS, Søndergaard L, Mumtaz M, et al. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376(14):1321-31. [DOI] [PubMed]
- 100.100. Leon MB, Smith CR, Mack MJ, Makkar RR, Svensson LG, Kodali SK, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374(17):1609-20. [DOI] [PubMed]
- 101.101. Reardon MJ, Kleiman NS, Adams DH, Yakubov SJ, Coselli JS, Deeb GM, et al. Outcomes in the randomized CoreValve US pivotal high risk trial in patients with a Society of Thoracic Surgeons risk score of 7% or less. JAMA Cardiol. 2016;1(8):945-9. [DOI] [PubMed]
- 102.102. Reardon MJ, Adams DH, Coselli JS, Deeb GM, Kleiman NS, Chetcuti S, et al. Self-expanding transcatheter aortic valve replacement using alternative access sites in symptomatic patients with severe aortic stenosis deemed extreme risk of surgery. J Thorac Cardiovasc Surg. 2014;148(6):2869-76. e7. [DOI] [PubMed]
- 103.103. Popma JJ, Adams DH, Reardon MJ, Yakubov SJ, Kleiman NS, Heimansohn D, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63(19):1972-81. [DOI] [PubMed]
- 104.104. Reardon MJ, Adams DH, Kleiman NS, Yakubov SJ, Coselli JS, Deeb GM, et al. 2-year outcomes in patients undergoing surgical or self-expanding transcatheter aortic valve replacement. J Am Coll Cardiol. 2015;66(2):113-21. [DOI] [PubMed]
- 105.105. Souza ALS, Salgado CG, Mourilhe-Rocha R, Mesquita ET, Lima LCLC, Mattos ND, et al. Transcatheter aortic valve implantation and morbidity and mortality-related factors: a 5-year experience in Brazil. Arq Bras Cardiol. 2016;106(6):519-27. [DOI] [PMC free article] [PubMed]
- 106.106. Ribeiro HB, Lerakis S, Gilard M, Cavalcante JL, Makkar R, Herrmann HC, et al. Transcatheter aortic valve replacement in patients with low-flow, low-gradient aortic stenosis: the TOPAS-TAVI registry. J Am Coll Cardiol. 2018;71(12):1297-308. [DOI] [PubMed]
- 107.107. Tchetche D, Dumonteil N, Sauguet A, Descoutures F, Luz A, Garcia O, et al. Thirty-day outcome and vascular complications after transarterial aortic valve implantation using both Edwards Sapien and Medtronic CoreValve bioprostheses in a mixed population. EuroIntervention. 2010;5(6):659-65. [DOI] [PubMed]
- 108.108. Walther T, Simon P, Dewey T, Wimmer-Greinecker G, Falk V, Kasimir MT, et al. Transapical minimally invasive aortic valve implantation: multicenter experience. Circulation. 2007;116(11 Suppl): I-240-I-5. [DOI] [PubMed]
- 109.109. Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363(17):1597-607. [DOI] [PubMed]
- 110.110. Smith CR, Leon MB, Mack MJ, Miller DC, Moses JW, Svensson LG, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364(23):2187-98. [DOI] [PubMed]
- 111.111. Zahn R, Gerckens U, Grube E, Linke A, Sievert H, Eggebrecht H, et al. Transcatheter aortic valve implantation: first results from a multi-centre real-world registry. Eur Heart J. 2011;32(2):198-204. [DOI] [PubMed]
- 112.112. Tamburino C, Capodanno D, Ramondo A, Petronio AS, Ettori F, Santoro G, et al. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation. 2011;123(3):299-308. [DOI] [PubMed]
- 113.113. Webb JG, Pasupati S, Humphries K, Thompson C, Altwegg L, Moss R, et al. Percutaneous transarterial aortic valve replacement in selected high-risk patients with aortic stenosis. Circulation. 2007;116(7):755-63. [DOI] [PubMed]
- 114.114. Blackman DJ, Saraf S, MacCarthy PA, Myat A, Anderson SG, Malkin CJ, et al. Long-term durability of transcatheter aortic valve prostheses. J Am Coll Cardiol. 2019;73(5):537-45. [DOI] [PubMed]
- 115.115. Søndergaard L, Ihlemann N, Capodanno D, Jørgensen TH, Nissen H, Kjeldsen BJ, et al. Durability of transcatheter and surgical bioprosthetic aortic valves in patients at lower surgical risk. Am Coll Cardiol. 2019;73(5):546-53. [DOI] [PubMed]
- 116.116. Thyregod HGH, Ihlemann N, Jørgensen TH, Nissen H, Kjeldsen BJ, Petursson P, et al. Five-year clinical and echocardiographic outcomes from the Nordic Aortic Valve Intervention (NOTION) randomized clinical trial in lower surgical risk patients. Circulation. 2019;139(4):2714-23. [DOI] [PubMed]
- 117.117. Popma JJ, Deeb GM, Yakubov SJ, Mumtaz M, Gada H, O'Hair D, et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. N Engl J Med. 2019;380(18):1706-15. [DOI] [PubMed]
- 118.118. Mack MJ, Leon MB, Thourani VH, Makkar R, Kodali SK, Russo M, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380(18):1695-705. [DOI] [PubMed]
- 119.119. Serruys PW, Modolo R, Reardon M, Miyazaki Y, Windecker S, Popma J, et al. One-year outcomes of patients with severe aortic stenosis and an STS PROM of less than three percent in the SURTAVI trial. EuroIntervention.2018;14(8):877-83. [DOI] [PubMed]
- 120.120. Siontis GC, Overtchouk P, Cahill TJ, Modine T, Prendergast B, Praz F, et al. Transcatheter aortic valve implantation vs. surgical aortic valve replacement for treatment of symptomatic severe aortic stenosis: an updated meta-analysis. Eur Heart J. 2019;40(38):3143-53. [DOI] [PubMed]
- 121.121. Lund O. Preoperative risk evaluation and stratification of long-term survival after valve replacement for aortic stenosis. Reasons for earlier operative intervention. Circulation. 1990;82(1):124-39. [DOI] [PubMed]
- 122.122. Kvidal P, Bergström R, Hörte LG, Ståhle E. Observed and relative survival after aortic valve replacement. J Am Coll Cardiol. 2000;35(3):747-56. [DOI] [PubMed]
- 123.123. Brown JM, O'Brien SM, Wu C, Sikora JAH, Griffith BP, Gammie JS. Isolated aortic valve replacement in North America comprising 108,687 patients in 10 years: changes in risks, valve types, and outcomes in the Society of Thoracic Surgeons National Database. J Thorac Cardiovasc Surg. 2009;137(1):82-90. [DOI] [PubMed]
- 124.124. Thourani VH, Ailawadi G, Szeto WY, Dewey TM, Guyton RA, Mack MJ, et al. Outcomes of surgical aortic valve replacement in high-risk patients: a multiinstitutional study. Ann Thorac Surg. 2011;91(1):49-56. [DOI] [PubMed]
- 125.125. Carabello BA. Evaluation and management of patients with aortic stenosis. Circulation. 2002;105(15):1746-50. [DOI] [PubMed]
- 126.126. Carabello BA. Timing of valve replacement in aortic stenosis: moving closer to perfection. Circulation. 1997;95(9):2241-3. [DOI] [PubMed]
- 127.127. Likosky DS, Sorensen MJ, Dacey LJ, Baribeau YR, Leavitt BJ, DiScipio AW, et al. Long-term survival of the very elderly undergoing aortic valve surgery. Circulation. 2009;120(11 Suppl): S127-S33. [DOI] [PubMed]
- 128.128. Brinkman WT, Hoffman W, Dewey TM, Culica D, Prince SL, Herbert MA, et al. Aortic valve replacement surgery: comparison of outcomes in matched sternotomy and PORT ACCESS groups. Ann Thorac Surg. 2010;90(1):131-5. [DOI] [PubMed]
- 129.129. Kuntz RE, Tosteson AN, Berman AD, Goldman L, Gordon PC, Leonard BM, et al. Predictors of event-free survival after balloon aortic valvuloplasty. N Engl J Med. 1991;325(1):17-23. [DOI] [PubMed]
- 130.130. Cribier A, Saoudi N, Berland J, Savin T, Rocha P, Letac B. Percutaneous transluminal valvuloplasty of acquired aortic stenosis in elderly patients: an alternative to valve replacement? Lancet. 1986;327(8472):63-7. [DOI] [PubMed]
- 131.131. Block PC, Palacios IF. Clinical and hemodynamic follow-up after percutaneous aortic valvuloplasty in the elderly. Am J Cardiol. 1988;62(10):760-3. [DOI] [PubMed]
- 132.132. Kapadia SR, Goel SS, Yuksel U, Agarwal S, Pettersson G, Svensson LG, et al. Lessons learned from balloon aortic valvuloplasty experience from the pre-transcatheter aortic valve implantation era. J Interv Cardiol. 2010;23(5):499-508. [DOI] [PubMed]
- 133.133. Detaint D, Messika-Zeitoun D, Maalouf J, Tribouilloy C, Mahoney DW, Tajik AJ, et al. Quantitative echocardiographic determinants of clinical outcome in asymptomatic patients with aortic regurgitation: a prospective study. JACC: Cardiovasc Imaging. 2008;1(1):1-11. [DOI] [PubMed]
- 134.134. Myerson SG, d'Arcy J, Mohiaddin R, Greenwood JP, Karamitsos TD, Francis JM, et al. Aortic regurgitation quantification using cardiovascular magnetic resonance: association with clinical outcome. Circulation. 2012;126(12):1452-60. [DOI] [PubMed]
- 135.135. Fox ER, Wilson RS, Penman AD, King JJ, Towery JG, Butler KR, et al. Epidemiology of pure valvular regurgitation in the large middle-aged African American cohort of the Atherosclerosis Risk in Communities study. Am Heart J. 2007;154(6):1229-34. [DOI] [PubMed]
- 136.136. d'Arcy JL, Coffey S, Loudon MA, Kennedy A, Pearson-Stuttard J, Birks J, et al. Large-scale community echocardiographic screening reveals a major burden of undiagnosed valvular heart disease in older people: the OxVALVE Population Cohort Study. Eur Heart J. 2016;37(47):3515-22. [DOI] [PMC free article] [PubMed]
- 137.137. Chaliki HP, Mohty D, Avierinos J-F, Scott CG, Schaff HV, Tajik AJ, et al. Outcomes after aortic valve replacement in patients with severe aortic regurgitation and markedly reduced left ventricular function. Circulation. 2002;106(21):2687-93. [DOI] [PubMed]
- 138.138. Tarasoutchi F, Grinberg M, Spina GS, Sampaio RO, Rossi EG, Pomerantzeff P, et al. Ten-year clinical laboratory follow-up after application of a symptom-based therapeutic strategy to patients with severe chronic aortic regurgitation of predominant rheumatic etiology. J Am Coll Cardiol. 2003;41(8):1316-24. [DOI] [PubMed]
- 139.139. Dujardin KS, Enriquez-Sarano M, Schaff HV, Bailey KR, Seward JB, Tajik AJ. Mortality and morbidity of aortic regurgitation in clinical practice: a long-term follow-up study. Circulation. 1999;99(14):1851-7. [DOI] [PubMed]
- 140.140. Weber M, Hausen M, Arnold R, Moellmann H, Nef H, Elsaesser A, et al. Diagnostic and prognostic value of N-terminal pro B-type natriuretic peptide (NT-proBNP) in patients with chronic aortic regurgitation. Int J Cardiol. 2008;127(3):321-7. [DOI] [PubMed]
- 141.141. Azevedo CF, Nigri M, Higuchi ML, Pomerantzeff PM, Spina GS, Sampaio RO, et al. Prognostic significance of myocardial fibrosis quantification by histopathology and magnetic resonance imaging in patients with severe aortic valve disease.J Am Coll Cardiol. 2010;56(4):278-87. [DOI] [PubMed]
- 142.142. Tornos P, Sambola A, Permanyer-Miralda G, Evangelista A, Gomez Z, Soler-Soler J. Long-term outcome of surgically treated aortic regurgitation: influence of guideline adherence toward early surgery. J Am Coll Cardiol. 2006;47(5):1012-7. [DOI] [PubMed]
- 143.143. Klodas E, Enriquez-Sarano M, Tajik AJ, Mullany CJ, Bailey KR, Seward JB. Optimizing timing of surgical correction in patients with severe aortic regurgitation: role of symptoms. J Am Coll Cardiol. 1997;30(3):746-52. [DOI] [PubMed]
- 144.144. Goswami KC, Rao MB, Dev V, Shrivastava S. Juvenile tricuspid stenosis and rheumatic tricuspid valve disease: an echocardiographic study. Int J Cardiol. 1999;72(1):83-6. [DOI] [PubMed]
- 145.145. Hauck AJ, Freeman DP. Ackermann DM, DanielsonGK, Edwards WD. Surgical pathology of the tricuspid valve: a study of 363 cases spanning 25 years. Mayo Clinic Proc.1988 sep;63(9):551-63. [DOI] [PubMed]
- 146.146. Daniels SJ, Mintz GS, Kotler MN. Rheumatic tricuspid valve disease: two-dimensional echocardiographic, hemodynamic, and angiographic correlations. Am J Cardiol. 1983;51(3):492-6. [DOI] [PubMed]
- 147.147. Kulkarni SK, Moorthy N, Ramalingam R. Valvular heart disease in Antiphospholipid antibody syndrome: Isolated Tricuspid stenosis. Echocardiography. 2019;36(3):598-601. [DOI] [PubMed]
- 148.148. Bhardwaj R, Sharma R. Balloon dilatation of isolated severe tricuspid valve stenosis. Indian Heart J. 2015;67:S78-S80. [DOI] [PMC free article] [PubMed]
- 149.149. Rodés-Cabau J, Taramasso M, T O'Gara P. Diagnosis and treatment of tricuspid valve disease: current and future perspectives. Lancet. 2016;388(10058):2431-42. [DOI] [PubMed]
- 150.150. Prihadi EA, Delgado V, Leon MB, Enriquez-Sarano M, Topilsky Y, Bax JJ. Morphologic types of tricuspid regurgitation: characteristics and prognostic implications. JACC: Cardiovasc Imaging. 2019;12(3):491-9. [DOI] [PubMed]
- 151.151. Topilsky Y, Maltais S, Inojosa JM, Oguz D, Michelena H, Maalouf J, et al. Burden of tricuspid regurgitation in patients diagnosed in the community setting. JACC Cardiovasc Imaging. 2019 Mar;12(3):433-42. [DOI] [PubMed]
- 152.152. Wang N, Fulcher J, Abeysuriya N, McGrady M, Wilcox I, Celermajer D, et al. Tricuspid regurgitation is associated with increased mortality independent of pulmonary pressures and right heart failure: a systematic review and meta-analysis. Eur Heart J. 2019;40(5):476-84. [DOI] [PubMed]
- 153.153. Topilsky Y, Nkomo VT, Vatury O, Michelena HI, Letourneau T, Suri RM, et al. Clinical outcome of isolated tricuspid regurgitation. JACC Cardiovasc Imaging. 2014;7(12):1185-94. [DOI] [PubMed]
- 154.154. Zack CJ, Fender EA, Chandrashekar P, Reddy YN, Bennett CE, Stulak JM, et al. National trends and outcomes in isolated tricuspid valve surgery. J Am Coll Cardiol. 2017;70(24):2953-60. [DOI] [PubMed]
- 155.155. Axtell AL, Bhambhani V, Moonsamy P, Healy EW, Picard MH, Sundt III TM, et al. Surgery does not improve survival in patients with isolated severe tricuspid regurgitation. J Am Coll Cardiol. 2019;74(6):715-25. [DOI] [PMC free article] [PubMed]
- 156.156. Nickenig G, Kowalski M, Hausleiter J, Braun D, Schofer J, Yzeiraj E, et al. Transcatheter treatment of severe tricuspid regurgitation with the edge-to-edge MitraClip technique. Circulation. 2017;135(19):1802-14. [DOI] [PubMed]
- 157.157. Oliveira DC, Oliveira CG. The Forgotten, Not Studied or Not Valorized Tricuspid Valve: The Transcatheter Revolution Is Coming. Cardiol Res. 2019;10(4):199-206 [DOI] [PMC free article] [PubMed]
- 158.158. Asmarats L, Puri R, Latib A, Navia JL, Rodés-Cabau J. Transcatheter tricuspid valve interventions: landscape, challenges, and future directions. J Am Coll Cardiol. 2018;71(25):2935-56. [DOI] [PubMed]
- 159.159. Al. 2010; Taweel A, Almahmoud MF, Khairandish Y, Ahmad M. Degenerative mitral valve stenosis: Diagnosis and management. Echocardiography. 2019;36(10):1901-9. [DOI] [PubMed]
- 160.160. Gotzmann M, Mügge A, Bojara W. Transcatheter aortic valve implantation for treatment of patients with degenerated aortic bioprostheses—valve-in-valve technique. Cathet Cardiovasc Interv.2010;76(7):1000-6. [DOI] [PubMed]
- 161.161. Webb JG, Wood DA, Ye J, Gurvitch R, Masson J-B, Rodés-Cabau J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic heart valves. Circulation. 2010;121(16):184-57. [DOI] [PubMed]
- 162.162. Tabata N, Sinning J-M, Kaikita K, Tsujita K, Nickenig G, Werner N. Current status and future perspective of structural heart disease intervention. J Cardiol.20;:74(1):1-12. [DOI] [PubMed]
- 163.163. Venneri L, Khattar RS, Senior R. Assessment of complex multi-valve disease and prosthetic valves. Heart Lung Circ. 2019;28(9):1436-46. [DOI] [PubMed]
- 164.164. Leal MT, Passos LSA, Guarçoni FV, Aguiar JMdS, Silva RBRd, Paula TMNd, et al. Rheumatic heart disease in the modern era: recent developments and current challenges. Rev Soc Bras Med Trop. 2019 Mar 14;52:e20180041 [DOI] [PubMed]
- 165.165. Watkins DA, Beaton AZ, Carapetis JR, Karthikeyan G, Mayosi BM, Wyber R, et al. Rheumatic heart disease worldwide: JACC scientific expert panel. J Am Coll Cardiol. Cardiol. 2018;72(12):1397-416. [DOI] [PubMed]
- 166.166. Task Force members ATF, Windecker S, Kolh P, Alfonso F, Collet J-P, Cremer J, et al. 2014 ESC/EACTS guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35(37):2541-619. [DOI] [PubMed]
- 167.167. Hillis LD, Smith PK, Anderson JL, Bittl JA, Bridges CR, Byrne JG, et al. 2011 ACCF/AHA guideline for coronary artery bypass graft surgery: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines developed in collaboration with the American Association for Thoracic Surgery, Society of Cardiovascular Anesthesiologists, and Society of Thoracic Surgeons. Am Coll Cardiol. 2011;58(24):2584-614. [DOI] [PubMed]
- 168.168. Members WC, Mark DB, Berman DS, Budoff MJ, Carr JJ, Gerber TC, et al. ACCF/ACR/AHA/NASCI/SAIP/SCAI/SCCT 2010 expert consensus document on coronary computed tomographic angiography: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. Circulation. 2010;121(22):2509-43. [DOI] [PubMed]
- 169.169. Gilard M, Cornily J-C, Pennec P-Y, Joret C, Le Gal G, Mansourati J, et al. Accuracy of multislice computed tomography in the preoperative assessment of coronary disease in patients with aortic valve stenosis. J Am Coll Cardiol. 2006;47(10):2020-4. [DOI] [PubMed]
- 170.170. Manghat N, Morgan-Hughes G, Broadley A, Undy M, Wright D, Marshall A, et al. 16-detector row computed tomographic coronary angiography in patients undergoing evaluation for aortic valve replacement: comparison with catheter angiography. Clin Cardiol. 2006;61(9):749-57. [DOI] [PubMed]
- 171.171. Meijboom WB, Mollet NR, Van Mieghem CA, Kluin J, Weustink AC, Pugliese F, et al. Pre-operative computed tomography coronary angiography to detect significant coronary artery disease in patients referred for cardiac valve surgery. J Am Coll Cardiol. 2006;48(8):1658-65. [DOI] [PubMed]
- 172.172. Dangas GD, Tijssen JG, Wöhrle J, Søndergaard L, Gilard M, Möllmann H, et al. A controlled trial of rivaroxaban after transcatheter aortic-valve replacement. N Engl J Med. 2020;382(2):120-9. [DOI] [PubMed]
- 173.173. Maes F, Stabile E, Ussia GP, Tamburino C, Pucciarelli A, Masson JB, et al. Meta-analysis comparing single versus dual antiplatelet therapy following transcatheter aortic valve implantation. Am J Cardiol. 2018;122(2):310-5. [DOI] [PubMed]
- 174.174. Chakravarty T, Søndergaard L, Friedman J, De Backer O, Berman D, Kofoed KF, et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. Lancet. 2017;389(10087):2383-92. [DOI] [PubMed]
- 175.175. Duraes AR, de Souza Roriz P, de Almeida Nunes B, e Albuquerque FP, de Bulhoes FV, de Souza Fernandes AM, et al. Dabigatran versus warfarin after bioprosthesis valve replacement for the management of atrial fibrillation postoperatively: DAWA pilot study. Drugs R D. 2016;16(2):149-54. [DOI] [PMC free article] [PubMed]
- 176.176. Eikelboom JW, Connolly SJ, Brueckmann M, Granger CB, Kappetein AP, Mack MJ, et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med. 2013;369(13):1206-14. [DOI] [PubMed]
- 177.177. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883-91. [DOI] [PubMed]
- 178.178. Lopes RD, Alexander JH, Al-Khatib SM, Ansell J, Diaz R, Easton JD, et al. Apixaban for reduction in stroke and other ThromboemboLic events in atrial fibrillation (ARISTOTLE) trial: design and rationale. Am Heart J. 2010;159(3):331-9. [DOI] [PubMed]
- 179.179. Ezekowitz MD, Nagarakanti R, Noack H, Brueckmann M, Litherland C, Jacobs M, et al. Comparison of dabigatran and warfarin in patients with atrial fibrillation and valvular heart disease: the RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulant Therapy). Circulation. 2016;134(8):589-98. [DOI] [PubMed]
- 180.180. De Caterina R, Renda G, Carnicelli AP, Nordio F, Trevisan M, Mercuri MF, et al. Valvular heart disease patients on edoxaban or warfarin in the ENGAGE AF-TIMI 48 trial. J Am Coll Cardiol. 2017;69(11):1372-82. [DOI] [PubMed]
- 181.181. Kim JY, Kim S-H, Myong J-P, Kim YR, Kim T-S, Kim J-H, et al. Outcomes of direct oral anticoagulants in patients with mitral stenosis. J Am Coll Cardiol. 2019;73(10):1123-31. [DOI] [PubMed]
- 182.182. Noseworthy PA, Yao X, Shah ND, Gersh BJ. Comparative effectiveness and safety of non-vitamin K antagonist oral anticoagulants versus warfarin in patients with atrial fibrillation and valvular heart disease. Int J Cardiol.2016 Apr 15;209:181-3. [DOI] [PubMed]
- 183.183. de Lara Lavitola P, Sampaio RO, de Oliveira WA, Bôer BN, Tarasoutchi F, Spina GS, et al. Warfarin or aspirin in embolism prevention in patients with mitral valvulopathy and atrial fibrillation. Arq Bras Cardiol. 2010;95(6):749-55. [DOI] [PubMed]
- 184.184. Biteker M, Altun I, Basaran O, Dogan V, Yildirim B, Ergun G. Treatment of prosthetic valve thrombosis: current evidence and future directions. J Clin Med Res. 2015;7(12):93-6. [DOI] [PMC free article] [PubMed]
- 185.185. Castilho F, De Sousa M, Mendonca A, Ribeiro A, Cáceres-Lóriga F. Thrombolytic therapy or surgery for valve prosthesis thrombosis: systematic review and meta-analysis. J Thromb Haemost. 2014;12(8):1218-28. [DOI] [PubMed]
- 186.186. Gerber MA, Baltimore RS, Eaton CB, Gewitz M, Rowley AH, Shulman ST, et al. Prevention of rheumatic fever and diagnosis and treatment of acute Streptococcal pharyngitis: a scientific statement from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Translational Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research: endorsed by the American Academy of Pediatrics. Circulation. 2009;119(11):1541-51. [DOI] [PubMed]
- 187.187. Bisno AL, Gerber MA, Gwaltney Jr JM, Kaplan EL, Schwartz RH. Practice guidelines for the diagnosis and management of group A streptococcal pharyngitis. Clin Infect Dis. 2002;35(2):113-25. [DOI] [PubMed]
- 188.188. Martin JM, Green M. Group A streptococcus. Semin Pediatr Infect Dis. 2006;17(3):140-8 [DOI] [PubMed]
- 189.189. Robertson KA, Volmink JA, Mayosi BM. Antibiotics for the primary prevention of acute rheumatic fever: a meta-analysis. BMC Cardiovasc Dis Disord. 2005;5(1):11. [DOI] [PMC free article] [PubMed]
- 190.190. Beggs S, Peterson G, Tompson A, editors. Antibiotic use for the prevention and treatment of rheumatic fever and rheumatic heart disease in children. Report for the 2nd Meeting of World Health Organization's Subcommittee of the Expert Committee of the Selection and Use of Essential Medicines. Washington; 2008.
- 191.191. Pichichero ME. A review of evidence supporting the American Academy of Pediatrics recommendation for prescribing cephalosporin antibiotics for penicillin-allergic patients. Pediatrics. 2005;115(4):1048-57. [DOI] [PubMed]
- 192.192. Gerber MA. Antibiotic resistance in group A streptococci. Pediatr Clin. 1995;42(3):539-51. [DOI] [PubMed]
- 193.193. Cohen R, Reinert P, De La Rocque F, Levy C, Boucherat M, Robert M, et al. Comparison of two dosages of azithromycin for three days versus penicillin V for ten days in acute group A streptococcal tonsillopharyngitis. Pediatr Infect Dis J.21(4):297-303. [DOI] [PubMed]
- 194.194. Lue H-C, Wu M-H, Wang J-K, Wu F-F, Wu Y-N. Three-versus four-week administration of benzathine penicillin G: effects on incidence of streptococcal infections and recurrences of rheumatic fever. Pediatrics. 1996;97(6):984-8. [PubMed]
- 195.195. Oran B, Taştekin A, Karaaslan S, Baş L, Ayçiçek A, Çeri A, et al. Prophylactic efficiency of 3-weekly benzathine penicillin G in rheumatic fever. Indian J Pediatr. 2000;67(3):163-7. [DOI] [PubMed]
- 196.196. Carapetis JR, McDonald M, Wilson NJ. Acute rheumatic fever. Lancet. 2005;366(9480):155-68. [DOI] [PubMed]
- 197.197. Manyemba J, Mayosi BM. Penicillin for secondary prevention of rheumatic fever. Cochrane Database Syst Rev.2002;(3):CD002227. [DOI] [PMC free article] [PubMed]
- 198.198. Meira ZMA, Mota CdCC, Tonelli E, Nunan EA, Mitre AMMC, Moreira NSdPC. Evaluation of secondary prophylactic schemes, based on benzathine penicillin G, for rheumatic fever in children. J Pediatr. 1993;123(1):156-8. [DOI] [PubMed]
- 199.199. Coonan KM, Kaplan EL. In vitro susceptibility of recent North American group A streptococcal isolates to eleven oral antibiotics. Pediatr Infect Dis J. 1994;13(7):630-5. [DOI] [PubMed]
- 200.200. Seppälä H, Nissinen A, Järvinen H, Huovinen S, Henriksson T, Herva E, et al. Resistance to erythromycin in group A streptococci. N Engl J Med. 1992;326(5):292-7. [DOI] [PubMed]
- 201.201. Okell C, Elliott MB. Bacteriaemia and Oral Sepsis with Special Reference to the Aetiology of Subacute Endocarditis. Lancet. 1935;226(5851):869-72.
- 202.202. Roberts G, Gardner P, Longhurst P, Black A, Lucas V. Intensity of bacteraemia associated with conservative dental procedures in children. Br Dental J. 2000;188(2):95-8. [DOI] [PubMed]
- 203.203. Glauser M, Bernard J, Moreillon P, Francioli P. Successful single-dose amoxicillin prophylaxis against experimental streptococcal endocarditis: evidence for two mechanisms of protection. J Infect Dis. 1983;147(3):568-75. [DOI] [PubMed]
- 204.204. Seymour R, Lowry R, Whitworth J, Martin M. Infective endocarditis, dentistry and antibiotic prophylaxis; time for a rethink? Br Dental J. 2000;189(11):610-6. [DOI] [PubMed]
- 205.205. Lucas V, Roberts G. Odontogenic bacteremia following tooth cleaning procedures in children. Pediatr Dent 2000;22(2):96-100. [PubMed]
- 206.206. Al-Karaawi Z, Lucas V, Gelbier M, Roberts G. Dental procedures in children with severe congenital heart disease: a theoretical analysis of prophylaxis and non-prophylaxis procedures. Heart. 2001;85(1):66. [DOI] [PMC free article] [PubMed]
- 207.207. Roberts G, Lucas V, Omar J. Bacterial endocarditis and orthodontics. J r Coll Surg Edinb. 2000;45(3):141-5. [PubMed]
- 208.208. Roberts GJ. Dentists are innocent! “Everyday” bacteremia is the real culprit: A review and assessment of the evidence that dental surgical procedures are a principal cause of bacterial endocarditis in children. Pediatr Cardiol. 1999;20(5):317-25. [DOI] [PubMed]
- 209.209. Drangsholt MT. A new causal model of dental diseases associated with endocarditis. Ann Periondontol. 1998;3(1):184-96. [DOI] [PubMed]
- 210.210. Centre for Clinical Practice at NICE (UK). Prophylaxis against infective endocarditis: antimicrobial prophylaxis against infective endocarditis in adults and children undergoing interventional procedures. 2008.[Cited in 2019 May 20] Available from: https://www.ncbi.nlm.nih.gov/pubmed/21656971 [PubMed]
- 211.211. Dayer MJ, Jones S, Prendergast B, Baddour LM, Lockhart PB, Thornhill MH. Incidence of infective endocarditis in England, 2000–13: a secular trend, interrupted time-series analysis. Lancet. 2015;385(9974):1219-28. [DOI] [PMC free article] [PubMed]
- 212.212. Armstrong ML, DeBoer S, Cetta F. Infective endocarditis after body art: a review of the literature and concerns. J Adolesc Health. 2008;43(3):217-25. [DOI] [PubMed]
- 213.213. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta J-P, Del Zotti F, et al. 2015 ESC guidelines for the management of infective endocarditis: the task force for the management of infective endocarditis of the European Society of Cardiology (ESC) endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015;36(44):3075-128. [DOI] [PubMed]
- 214.214. Wilson W, Taubert KA, Gewitz M, Lockhart PB, Baddour LM, Levison M, et al. Prevention of infective endocarditis: guidelines from the American heart association: a guideline from the American heart association rheumatic fever, endocarditis, and Kawasaki disease committee, council on cardiovascular disease in the young, and the council on clinical cardiology, council on cardiovascular surgery and anesthesia, and the quality of care and outcomes research interdisciplinary working group. Circulation. 2007;116(15):1736-54. [DOI] [PubMed]
- 215.215. Strom BL, Abrutyn E, Berlin JA, Kinman JL, Feldman RS, Stolley PD, et al. Risk factors for infective endocarditis: oral hygiene and nondental exposures. Circulation. 2000;102(23):2842-8. [DOI] [PubMed]
- 216.216. van Hagen IM, Thorne SA, Taha N, Youssef G, Elnagar A, Gabriel H, et al. Pregnancy outcomes in women with rheumatic mitral valve disease: results from the registry of pregnancy and cardiac disease. Circulation. 2018;137(8):806-16. [DOI] [PubMed]
- 217.217. Avila WS, Rossi EG, Ramires JAF, Grinberg M, Bortolotto MRL, Zugaib M, et al. Pregnancy in patients with heart disease: experience with 1,000 cases. Clinical Cardiology: An International Indexed and Peer-Reviewed Journal for Advances in the Treatment of Cardiovasc Disease. 2003;26(3):135-42. [DOI] [PMC free article] [PubMed]
- 218.218. Sliwa K, Johnson MR, Zilla P, Roos-Hesselink JW. Management of valvular disease in pregnancy: a global perspective. Eur Heart J. 2015;36(18):1078-89. [DOI] [PubMed]
- 219.219. Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, Blomstrom-Lundqvist C, Cifkova R, De Bonis M, et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Kardiol Pol (Polish Heart Journal). 2019;77(3):245-326. [DOI] [PubMed]
- 220.220. World Health Organization. (WHO) Health Worker Role in Providing Safe Abortion Care and Post Abortion Contraception. Geneva;2015. [PubMed]
- 221.221. Poli MEH, Mello CR, Machado RB, Pinho Neto JS, Spinola PG, Tomas G, et al. Manual de anticoncepção da FEBRASGO. Femina. 2009;37(9):459-92.