Abstract
目的
探讨单份非血缘脐血干细胞移植(UCBT)治疗高危/难治儿童急性髓系白血病(AML)的疗效。
方法
对2008年6月至2018年12月期间接受UCBT的160例高危/难治AML(不含急性早幼粒细胞白血病)患儿进行回顾性分析。全部病例均采用清髓性预处理方案,应用环孢素A(CsA)联合短程霉酚酸酯(MMF)预防移植物抗宿主病(GVHD)。
结果
160例AML患儿中男103例、女57例,中位年龄7(1~14)岁,中位体重23(8~77)kg。移植后42 d中性粒细胞累积植入率为95.0%(95%CI 90.0%~97.5%),移植后120 d血小板累积植入率为85.5%(95%CI 83.3%~93.4%),中性粒细胞、血小板植入中位时间分别为移植后16(11~38)d、35(13~158)d。Ⅱ~Ⅳ、Ⅲ~Ⅳ度急性GVHD发生率分别为37.3%(95%CI 29.3%~45.2%)、27.3%(95%CI 20.0%~35.0%),慢性GVHD发生率为22.4%(95%CI 15.5%~28.7%)。可评估的移植后360 d移植相关死亡率(TRM)为13.1%(95%CI 8.4%~18.9%)。移植后5年累积复发率为13.8%(95%CI 8.5%~20.3%),无病生存(DFS)率为71.7%(95%CI 62.7%~77.8%)、总生存(OS)率为72.2%(95%CI 64.1%~78.7%),无GVHD无复发生存(GRFS)率为56.1%(95%CI 46.1%~64.9%)。移植前处于第1次完全缓解(CR1)期(95例)、第2次完全缓解(CR2)期(28例)、未缓解患者(37例)的移植后5年累积复发率分别为5.3%(95%CI 1.9%~11.1%)、19.9%(95%CI 6.9%~37.7%)、30.9%(95%CI 14.3%~49.2%)(P=0.001),移植后5年OS率分别为79.9%(95%CI 70.3%~86.7%)、71.1%(95%CI 50.4%~84.4%)、52.9%(95%CI 33.0%~69.3%)(χ2=7.552,P=0.020)。
结论
UCBT是治愈高危/难治儿童AML安全、有效的治疗方法。第1次完全缓解期进行UCBT有利于改善预后。
Keywords: 脐血干细胞移植, 儿童, 急性髓系白血病
Abstract
Objective
To retrospectively analyze the clinical outcomes of single unrelated cord blood transplantation(UCBT)in children with high risk and refractory acute myeloid leukemia(AML).
Methods
Between June 2008 and December 2018, a total of 160 consecutive pediatric patients with AML received single UCBT(excluding acute promyelocytic leukemia). Myeloablative conditioning(MAC)regimen were applied. All patients received a combination of cyclosporine A(CsA)and mycophenolate mofetil(MMF)for the prophylaxis of graft-versus-host disease(GVHD).
Results
The cumulative incidence of neutrophil cells engraftment at day +42 and platelet recovery at day +120 was 95.0%(95% CI 90.0%–97.5%)at a median of 16 days after transplantation(range, 11–38 days)and 85.5%(95% CI 83.3%–93.4%)with a median time to recovery of 35 days(range, 13–158), respectively. Incidence of grades Ⅱ-Ⅳ and Ⅲ-Ⅳ acute GVHD and chronic GVHD were 37.3%(95% CI 29.3%–45.2%), 27.3%(95% CI 20.0%–35.0%)and 22.4%(95% CI 15.5%–28.7%), respectively. The transplant-related mortality(TRM)at 360 day was 13.1%(95% CI 8.4%–18.9%). The 5-year cumulative incidence of relapse was 13.8%(95% CI 8.5%–20.3%). The 5-year disease-free survival(DFS)and overall survival(OS)were 71.7%(95% CI 62.7%–77.8%)and 72.2%(95% CI 64.1%–78.7%), respectively. The 5-year GVHD and relapse free survival(GRFS)was 56.1%(95% CI 46.1%–64.9%). The 5-year cumulative recurrence rates of CR1, CR2, and NR groups were 5.3%, 19.9%, and 30.9%(P=0.001), and the 5-year OS rates were 79.9%(95%CI 70.3%–86.7%), 71.1%(95%CI 50.4%–84.4%)and 52.9%(95%CI 33.0%–69.3%)(χ2=7.552, P=0.020), respectively.
Conclusion
For pediatric patients with high risk and refractory AML, UCBT is a safe and effective treatment option, and it is favorable to improve the survival rate in CR1 stage.
Keywords: Cord blood hematopoietic stem cell transplantation, Children, Acute myeloid leukemia
儿童急性髓系白血病(AML)占儿童急性白血病的15%~20%[1]。分层治疗及化疗方案优化极大改善了儿童AML的预后,5年总生存(OS)率可达60%[2]–[3]。但单纯化疗对高危及复发/难治的儿童AML疗效有限[4]。造血干细胞移植技术的进步,特别是非血缘脐血干细胞移植(UCBT)在儿童恶性血液病中的应用为更多患儿带来了治愈机会,而且较低的复发率和慢性GVHD发生率显著改善了患儿的长期生存质量[5]。我们对近年来接受UCBT的160例高危/难治儿童AML(不含急性早幼粒细胞白血病)患者进行回顾性分析,旨在探讨UCBT治疗高危/难治儿童AML的远期疗效。
病例与方法
1. 病例选择:本研究纳入2008年6月至2018年12月期间在本中心接受UCBT的160例高危/难治儿童AML患者(不含急性早幼粒细胞白血病)。高危定义如下[6]–[8]:①伴有预后差的染色体核型或分子遗传学标志;②骨髓增生异常综合征(MDS)转AML;③高白细胞计数(WBC≥100×109/L);④合并中枢神经系统白血病(CNSL)。难治定义如下:①经过标准方案治疗2个疗程无效的初治病例;②达完全缓解(CR)并经巩固强化治疗后12个月内复发;③达CR并经巩固强化治疗12个月后复发但常规化疗无效;④多次(≥2次)复发;⑤持续存在髓外白血病。移植指征参考《儿童恶性血液病脐带血移植专家共识》[8]。所有患儿及监护人均在充分告知病情、治疗方案后签署知情同意书,所有操作均获得中国科学技术大学附属第一医院(安徽省立医院)伦理委员会批准。
2. 脐血选择:根据人类白细胞抗原(HLA)相合程度及冻存前总的有核细胞计数(TNC)、CD34+细胞数量选择脐血。单份脐血选择原则[9]–[10]:供-受者间HLA位点低分辨配型(HLA-A、-B、-DRB1)≥4/6相合,TNC≥3.0×107/kg(患者体重)且CD34+细胞数≥1.2×105/kg(患者体重)。当HLA配型采用HLAA、-B、-C和-DRB1时,尽量选择HLA≥5/8相合;高危患者如果没有其他选择,也可选择HLA 4/8位点相合的脐血。
3. 预处理及GVHD预防方案:均采用清髓性预处理:①以全身照射(TBI)为主方案:TBI总剂量12 Gy(分4次照射),阿糖胞苷(Ara-C)2 g/m2每12 h 1次×2 d,环磷酰胺(Cy)60 mg·kg−1·d−1 ×2 d。②Bu/Cy/Flu方案:氟达拉滨(Flu)30 mg·m−2·d−1静脉滴注,−8 d~−5 d;白消安(Bu)根据患儿体重给药:<9 kg者1 mg/kg,9~<16 kg者1.2 mg/kg,16~<23 kg者1.1 mg/kg,23~34 kg者0.95 mg/kg,>34 kg者0.8 mg/kg,每6 h 1次静脉滴注,−7 d~−4 d;Cy 60 mg·kg−1·d−1静脉滴注,−3 d、−2 d。③Bu/Cy/Ara-C方案:Ara-C 2 g/m2,每12 h 1次,−9 d、−8 d;Bu和Cy同上。采用化疗预处理的患者,有脑膜白血病史或脑膜白血病高危因素时,加用卡氮芥250 mg/m2。
GVHD的预防均采用环孢素A(CsA)联合短程霉酚酸酯(MMF)[5]。
4. 植入前综合征(PES)的诊断及处理:PES是UCBT相对独特且发生率较高的移植相关并发症,定义为中性粒细胞植入6 d前出现的非感染性发热(≥38.3 °C)、非药物所致的红斑性皮疹、非感染性腹泻、体重较基础体重增加10%[11]。根据PES发生时间以及症状轻重进行分层治疗,加用甲泼尼龙(MP)0.5~2 mg·kg−1 ·d−1静脉滴注,对MP耐药者加用CD25单抗等联合治疗。
5. 支持及对症处理:预防真菌、病毒、肺孢子菌的方案及肝静脉闭塞症、出血性膀胱炎的防治见文献[5]。自移植后6 d(+6 d)开始给予重组人粒细胞集落刺激因子(G-CSF)5~10 µg·kg−1·d−1,外周血白细胞计数≥4.0×109/L后继续用药2 d。血制品输注前均经X线照射(25 Gy)。
6. 植入检测及随访:所有患儿均留取移植前和移植后第7、14、21 d外周血标本以及移植后28 d骨髓标本,采用短串联重复序列聚合酶链反应(STR-PCR)方法检测植入早期供、患者嵌合体。移植后21 d白细胞无升高趋势且供者嵌合<90%且呈动态下降趋势,28 d后中性粒细胞绝对计数(ANC)<0.5×109/L且STR-PCR检测供者细胞比例<5%定义为原发性植入失败。中性粒细胞及血小板的植入定义见文献[5]。所有患者移植后前4个月每月检测骨髓象、染色体核型、微小残留病(MRD)、WT1融合基因拷贝数及发病时阳性融合基因,移植后半年至1年期间每3个月检测1次,移植后第2~5年每6个月检测1次。GVHD的诊断和分级采用国内指南[12]及NIH标准[13]。采用查阅门诊/住院病历和电话随访方式获得患者生存状况。
7. 统计学处理:采用SPSS 21.0统计软件分析,生存时间以“中位数(范围)”表示。OS率、无病生存(DFS)率、无GVHD无复发生存(GRFS)率采用Kaplan-Meier生存曲线分析,组间生存比较采用Log-rank检验。单因素分析采用Logistic回归分析。粒细胞及血小板植入率、PES发生率、急性GVHD发生率、移植相关死亡率(TRM)和复发率采用R软件竞争风险模型计算累积发生率。累积发生率的比较应用R软件中的Gray检验。P<0.05为差异有统计学意义。
结果
1. 患者资料:本研究纳入在本中心接受UCBT的160例儿童AML患者,其中男103例、女57例,中位年龄7(1~14)岁,中位体重23(8~77)kg。移植前疾病状态:第1次CR(CR1)95例(59.4%),第2次CR(CR2)28例(17.5%),未缓解(NR)37例(23.1%);预处理:TBI/Cy/Ara-C方案9例(5.6%),Bu/Cy/Flu方案121例(75.6%),Bu/Cy/Ara-C方案30例(18.8%)。
2. 脐血特征:HLA配型相合度:6/6全相合20例(12.5%),≥4/6相合140例(87.5%);ABO血型主次均相合83例(52%),不相合77例(48%)。输入复温后脐血TNC中位数为5.23(1.68~17.27)×107/kg,CD34+细胞中位数为2.54(0.51~13.78)×105/kg。
3. 造血重建情况:152例患者获得粒系造血重建。移植后42 d中性粒细胞累积植入率为95.0%(95%CI 90.0%~97.5%),移植后120 d血小板累积植入率为85.5%(95%CI 83.3%~93.4%),中性粒细胞、血小板植入中位时间分别为移植后16(11~38)d、35(13~158)d。单因素分析结果显示,移植前疾病状态、分子遗传学特征、患者年龄、患者体重、患者性别、HLA相合度、ABO血型相合度对植入均无影响。8例未获造血重建患者中5例行挽救性单倍型造血干细胞移植(haplo-HSCT),2例存活至今。
4. GVHD发生情况:86例患者发生急性GVHD,其中Ⅰ度32例;Ⅱ~Ⅳ度54例,累积发生率为37.3%(95%CI 29.3%~45.2%);Ⅲ~Ⅳ度38例,累积发生率为27.3%(95% CI 20.0%~35.0%)。142例患者移植后生存时间超过100 d,其中34例发生慢性GVHD,累积发生率为22.4%(95% CI 15.5%~28.7%),局限型23例,其中22例以皮疹、皮肤脱屑为主要表现,加用MP、芦可替尼和或甲氨蝶呤(MTX)后症状控制,1例出现口腔黏膜干燥、溃疡,使用免疫抑制剂后好转;广泛型慢性GVHD11例,出现皮疹、腹泻和或气喘,加用MP、芦可替尼、MTX、MMF、他克莫司等药物治疗,9例症状控制,2例因肺慢性GVHD死亡。
5. 并发症:全部152例患者中112例在移植后5~17 d诊断为PES,累积发生率为73.7%(95%CI 65.6%~79.8%),其中98例在给予MP 0.5~2.0 mg·kg−1·d−1治疗后症状得到控制,其余14例迁延进展为皮肤、肠道急性GVHD(其中Ⅳ度肠道急性GVHD 10例)。进展为急性GVHD的14例患者中,7例治疗后好转,7例症状未控制,4例因Ⅳ度肠道aGVHD死亡。
29例(18.1%)患者在移植后2~27 d发生血流感染,病原菌包括大肠杆菌(7例)、草绿色链球菌(6例)、肺炎克雷伯杆菌(5例)、奇异变形杆菌(1例)、表皮葡萄球菌(2例)、类干酪乳杆菌(1例)、缓症链球菌(2例)、革兰阳性球菌(3例)、铜绿假单胞菌(1例),屎肠球菌(1例)。101例(63.1%)患者在移植后15~60 d发生巨细胞病毒(CMV)血症。38例患者检出血CMV-DNA>103拷贝数/L,其中1例经肠镜明确为CMV肠炎,1例经肺泡灌洗明确为CMV肺炎,经更昔洛韦/膦甲酸钠联合静脉注射免疫球蛋白治疗后转阴。
23例(14.4%)患者发生出血性膀胱炎,经碱化尿液、利尿、抗病毒等治疗后痊愈。1例患者发生血栓性微血管病变并最终死亡,2例患者发生噬血细胞综合征并最终死亡,1例患者发生肝静脉闭塞病并因咯血死亡。
6. 生存分析:随访截至2020年11月30日,存活患者中位随访时间为4.0(2.0~12.7)年。移植后180 d、360 d TRM分别为11.9%(95% CI 7.4%~17.4%)、13.1%(95%CI 8.4%~18.9%)。其中PES组的360 d TRM明显高于未发生PES组[15.2%(95% CI 9.2%~22.5%)对2.5%(95% CI 0.2%~11.4%),P=0.034]。20例患者复发,中位复发时间为移植后157(30~1569)d,仅有1例发生于移植2年后,3例合并髓外复发,其他为单独骨髓复发。移植后5年累积复发率为13.8%(95%CI 8.5%~20.3%),PES组、无PES组的移植后5年累积复发率分别为11.4%(95% CI 5.7%~19.2%)、17.5%(95%CI 7.6%~30.8%)(P=0.140)。移植前CR1(95例)、CR2(28例)、NR组(37例)移植后5年累积复发率分别为5.3%(95%CI 1.9%~11.1%)、19.9%(95%CI 6.9%~37.7%)、30.9%(95%CI 14.3%~49.2%)(P=0.001)。
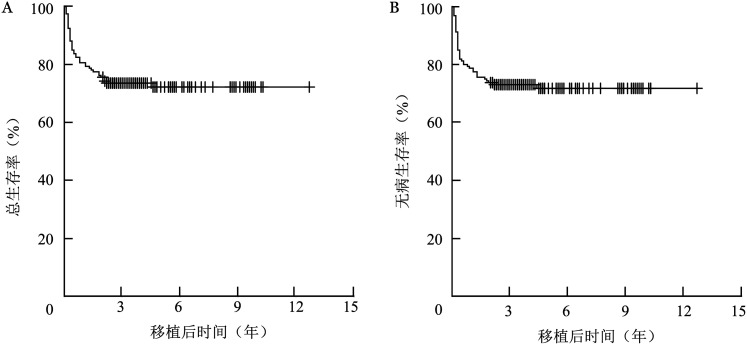
移植后5年OS率为72.2%(95%CI 64.1%~78.7%),DFS率为71.7%(95%CI 62.7%~77.8%),GRFS率为56.1%(95%CI 46.1%~64.9%),生存曲线见图1。移植前CR1(95例)、CR2(28例)、NR组(37例)的移植后5年OS率分别为79.9%(95%CI 70.3%~86.7%)、71.1%(95%CI 50.4%~84.4%)、52.9%(95% CI 33.0%~69.3%)(χ2=7.552,P=0.020),生存曲线见图2。
图1. 160例高危/难治急性髓系白血病患儿脐血干细胞移植后总生存曲线(A)和无病生存曲线(B).
图2. 移植前不同疾病状态高危/难治急性髓系白血病患儿脐血干细胞移植后总生存曲线(A)和无病生存曲线(B).
CR1:第1次完全缓解;CR2:第2次完全缓解;NR:未缓解
全部160例患者中43例死亡,其中19例(44%)死于复发,24例(55.8%)为移植相关死亡,包括Ⅳ度肠道aGVHD 8例、重症感染7例、多脏器功能衰竭4例、广泛型cGVHD 3例(其中UCBT 2例,haplo-HSCT挽救治疗后1例)、脑出血1例,咯血1例。
讨论
本组患儿均采用了不含抗胸腺细胞球蛋白(ATG)的清髓性预处理方案,移植后42 d中性粒细胞累积植入率为95.0%(95%CI 90.0%~97.5%)。最近一项纳入331例患者的国内多中心单份UCBT研究[14]显示,TBI/Cy预处理组(200例)粒细胞植入率高于Bu/Cy预处理组(131例)(98.0%对91.6%,P<0.001),但Bu/Cy预处理组粒细胞植入时间较TBI/Cy组短(16 d对19 d,P<0.001)。本组160例AML患儿资料也得到类似结果(其中126例包含在上述多中心研究中)。
PES是UCBT相对特异的临床表现,不同中心报道的发生率不同[11]。本组病例PES发生率达73.7%(95%CI 65.6%~79.8%),其中12.5%的病例迁延进展为急性GVHD。我们既往研究发现,PES和急性GVHD有相关性[15],大多患者对MP治疗反应良好,但治疗不及时或对MP耐药的患者易迁延进展为急性GVHD,治疗难度大,抗CD25单抗、芦可替尼等二线药物治疗有一定疗效,但仍有部分患者因重度急性GVHD死亡。Isobe等[11]研究发现PES可降低成人AML患者的复发率。本研究PES组、无PES组的移植后5年累积复发率分别为11.4%(95% CI 5.7%~19.2%)、17.5%(95% CI 7.6%~30.8%)(P=0.140),提示PES对儿童AML患者移植后复发率的影响与以往研究不同有待进一步研究。
本组病例均为高危/难治儿童AML患者,UCBT后5年累积复发率仅为13.8%(95% CI 8.5%~20.3%)。复发率低的原因可能与清髓性预处理、弱化GVHD预防方案(仅用CsA及短程MMF且不含ATG),从而缩短移植后免疫重建时间、加快移植物抗白血病作用(GVL)发生有关。单因素分析发现移植前疾病状态是影响复发的高危因素。CR1、CR2、NR组的5年累积复发率分别为5.3%(95% CI 1.9%~11.1%)、19.9%(95% CI 6.9%~37.7%)、30.9%(95% CI 14.3%~49.2%)(P=0.001)。因此,我们认为具有移植指征的高危/难治患儿在CR1期进行UCBT可获得较高的无复发生存率,这与日本的一项多中心研究[16]结果相一致。
本组病例移植后5年DFS、OS率分别为71.7%(95% CI 62.7%~77.8%)、72.2%(95% CI 64.1%~78.7%),GRFS率为56.1%(95% CI 46.1%~64.9%)。CR1组移植后5年OS率高达79.9%。2015年Zheng等[5]比较了UCBT与同胞全相合移植治疗儿童高危/进展期急性白血病的疗效,其中包括了54例AML(UCBT 40例,allo-PBSCT/BMT 14例),UCBT组AML患者的5年OS率为58.1%,5年DFS率为55.7%;allo-PBSCT/BMT组AML患者的5年OS率为55.6%,5年DFS率为32.7%。相较于以往,本组病例的OS和DFS都明显提高,可能与近几年我们对早期并发症(如PES)的识别和处理、治疗GVHD新药的应用以及对HLA配型的认识更加深入等均有一定相关性。
综上,本组病例资料显示,采用不含ATG清髓预处理UCBT是高危/难治AML患儿安全、有效的治疗选择,CR1状态下进行UCBT有利于获得更好的预后。
Funding Statement
基金项目:国家自然科学基金(81470350);中央高校基本科研业务费专项资金;“科大新医学”联合基金创新团队项目(WK9110000001)
Fund program: Natural Science Foundation of China(81470350); The Fundamental Research Funds for the Central Universities; “HKUST NEW MEDICINE” Joint Fund Innovation Team Project(WK9110000001)
References
- 1.陈 霞, 阮 敏, 刘 芳, et al. CAG预激方案诱导治疗儿童急性髓系白血病26例临床观察[J] 中华血液学杂志. 2019;40(7):594–596. doi: 10.3760/cma.j.issn.0253-2727.2019.07.011. [DOI] [Google Scholar]
- 2.Rubnitz JE. Current Management of Childhood Acute Myeloid Leukemia[J] Paediatr Drugs. 2017;19(1):1–10. doi: 10.1007/s40272-016-0200-6. [DOI] [PubMed] [Google Scholar]
- 3.Song TY, Lee SH, Kim G, et al. Improvement of treatment outcome over 2 decades in children with acute myeloid leukemia[J] Blood Res. 2018;53(1):25–34. doi: 10.5045/br.2018.53.1.25. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Horan JT, Alonzo TA, Lyman GH, et al. Impact of disease risk on efficacy of matched related bone marrow transplantation for pediatric acute myeloid leukemia: the Children's Oncology Group[J] J Clin Oncol. 2008;26(35):5797–5801. doi: 10.1200/JCO.2007.13.5244. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zheng CC, Zhu XY, Tang BL, et al. Comparative analysis of unrelated cord blood transplantation and HLA-matched sibling hematopoietic stem cell transplantation in children with high-risk or advanced acute leukemia[J] Ann Hematol. 2015;94(3):473–480. doi: 10.1007/s00277-014-2213-y. [DOI] [PubMed] [Google Scholar]
- 6.Creutzig U, van den Heuvel-Eibrink MM, Gibson B, et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel[J] Blood. 2012;120(16):3187–3205. doi: 10.1182/blood-2012-03-362608. [DOI] [PubMed] [Google Scholar]
- 7.竺 晓凡. 如何提高儿童急性髓系白血病的疗效[J] 中国当代儿科杂志. 2014;16(2):108–110. doi: 10.7499/j.issn.1008-8830.2014.02.002. [DOI] [PubMed] [Google Scholar]
- 8.中华医学会儿科学分会血液学组. 儿童恶性血液病脐带血移植专家共识[J] 中华儿科杂志. 2016;54(11):804–807. doi: 10.3760/cma.j.issn.0578-1310.2016.11.002. [DOI] [Google Scholar]
- 9.Hough R, Danby R, Russell N, et al. Recommendations for a standard UK approach to incorporating umbilical cord blood into clinical transplantation practice: an update on cord blood unit selection, donor selection algorithms and conditioning protocols[J] Br J Haematol. 2016;172(3):360–370. doi: 10.1111/bjh.13802. [DOI] [PubMed] [Google Scholar]
- 10.孙 自敏, 汤 宝林. 我如何用单份脐血干细胞移植治疗成人恶性血液病[J] 中华血液学杂志. 2019;40(6):449–452. doi: 10.3760/cma.j.issn.0253-2727.2019.06.001. [DOI] [Google Scholar]
- 11.Isobe M, Konuma T, Kato S, et al. Development of pre-engraftment syndrome, but not acute graft-versus-host disease, reduces relapse rate of acute myeloid leukemia after single cord blood transplantation[J] Biol Blood Marrow Transplant. 2019;25(6):1187–1196. doi: 10.1016/j.bbmt.2019.02.007. [DOI] [PubMed] [Google Scholar]
- 12.中华医学会血液学分会干细胞应用学组. 中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅲ)—急性移植物抗宿主病(2020年版)[J] 中华血液学杂志. 2020;41(7):529–536. doi: 10.3760/cma.j.issn.0253-2727.2020.07.001. [DOI] [Google Scholar]
- 13.Jagasia MH, Greinix HT, Arora M, et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: I. The 2014 Diagnosis and Staging Working Group report[J] Biol Blood Marrow Transplant. 2015;21(3):389–401. doi: 10.1016/j.bbmt.2014.12.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Tang BL, Zhu XY, Zheng CC, et al. Retrospective cohort study comparing the outcomes of intravenous busulfan vs. total-body irradiation after single cord blood transplantation[J] Bone Marrow Transplant. 2019;54(10):1614–1624. doi: 10.1038/s41409-019-0441-4. [DOI] [PubMed] [Google Scholar]
- 15.Wang X, Liu H, Li L, et al. Pre-engraftment syndrome after unrelated donor umbilical cord blood transplantation in patients with hematologic malignancies[J] Eur J Haematol. 2012;88(1):39–45. doi: 10.1111/j.1600-0609.2011.01709.x. [DOI] [PubMed] [Google Scholar]
- 16.Hyakuna N, Hashii Y, Ishida H, et al. Retrospective analysis of children with high-risk acute myeloid leukemia who underwent allogeneic hematopoietic stem cell transplantation following complete remission with initial induction chemotherapy in the AML-05 clinical trial[J] Pediatr Blood Cancer. 2019;66(10):e27875. doi: 10.1002/pbc.27875. [DOI] [PubMed] [Google Scholar]