Abstract
目的
探讨通过构建材料表面微纳结构联合涂覆抗菌肽提升钛金属抗菌性能的可行性。
方法
取钛片进行喷砂酸蚀(sandblasted large-grit acid-etched,SLA)及碱热处理(alkali-heat treatment,AHT),构建微纳结构;然后表面旋涂 10、30、50、70、90 μg 抗菌肽聚合物。扫描电镜观察处理前后钛片表面形貌,能谱仪分析表面 C、N、O、Ti 4 种元素含量比例。将表面载有不同量抗菌肽聚合物的钛片与金黄色葡萄球菌液共培养,24 h 后观察抑菌圈形成情况,并测量抑菌圈直径。另将处理前、SLA 处理、SLA+ AHT 处理、载有 90 μg 抗菌肽聚合物的钛片分别与金黄色葡萄球菌以及大肠杆菌共培养,3 h 后扫描电镜观察两种细菌在材料表面的黏附情况,3、6、9、12、24 h 测量菌液吸光度(A)值,评价钛片抗菌效果。
结果
扫描电镜下观察,SLA+AHT 处理钛片表面构建包含微米及纳米级孔洞的多级结构;旋涂抗菌肽聚合物后表面孔径<200 nm 的孔洞几乎已被覆盖。元素分析显示,随着抗菌肽聚合物旋涂量的增加,C 元素含量不断增加;但直至含量达 70 μg 时才检测到 N 元素。培养 24 h 后,载有不同量抗菌肽聚合物钛片周围均出现明显抑菌圈,其中 90 μg 钛片大于其余钛片,比较差异均有统计学意义(P<0.05)。抗菌实验结果显示,载抗菌肽聚合物的钛片表面细菌黏附量较其余钛片明显减少,菌液A 值明显降低,比较差异有统计学意义(P<0.05)。
结论
通过在材料表面制备微纳结构并涂覆抗菌肽,可赋予钛金属表面优良的抗菌性能。
Keywords: 钛, 微纳结构, 抗菌肽, 抗菌性能, 植入材料
Abstract
Objective
To investigate the effects of micro/nano-structure and antimicrobial peptides (AMPs) on antibacterial properties of titanium (Ti) metallic surface.
Methods
Ti disks were treated via sandblasted large-grit acid-etched (SLA) and alkali-heat treatment (AHT) to build the micro/nano-structure, on which AMPs were spin-coated with a certain amount (10, 30, 50, 70, and 90 μg). Scanning electron microscope (SEM) and energy dispersive spectroscopy (EDS) were used to observe the surface structure and characterize the surface elements (i.e. contents of C, N, O, and Ti). Ti disks loaded with AMPs of difference amounts were co-cultured with Staphylococcus aureus (S. aureus) for 24 hours. After that, the formation and dimension of antibacterial circle were measured. Furthermore, the Ti disks treated with different approaches (untreated, SLA treatment, SLA+THA treatment, and 90 μg AMPs-loaded samples) were co-cultured with S. aureus and Escherichia coli (E.coli) for 3 hours, bacterial adhesion on the disks were evaluated by using SEM. The antibacterial performances in solution were quantitatively evaluated by immersing the Ti disks in bacterial solutions and measuring the absorbance (A) values.
Results
It was found that the nanoporous structure could be easily constructed by SLA+AHT approach. After spin-coating AMPs, the nanopores with the diameter less than 200 nm were almost covered. According to the element analysis, with the increase of AMPs, the C content gradually increased; the N content was not detected until AMPs amount reached 70 μg on the disks. The diameter of antibacterial circle clearly depended on the AMPs amount. The Ti disks loaded with 90 μg AMPs had significantly larger antibacterial circles than the other Ti disks (P<0.05). Based on the SEM observation, the Ti disks loaded with 90 μg AMPs has the least bacterial attachment compared with the other Ti disks (P<0.05). TheA value of bacterial solution immersed with the Ti disks loaded with 90 μg AMPs was much lower than the other Ti disks (P<0.05).
Conclusion
The approach of micro/nano-structure and AMPs can improve the antibacterial properties of Ti metallic surface.
Keywords: Titanium, micro/nano-structure, antibacterial peptides, antibacterial property, implant material
近年来由于植入器械(如骨科材料和牙种植体)的钛材化,使得钛基材植入器械的国产化成为研究热点[1-5]。钛及其合金植入人体后,极易引起细菌等微生物在其表面黏附,从而导致感染的发生。感染一旦出现,可能引起局部组织破坏和植入物失效,也可能导致严重的疾病和并发症。感染和炎症的发生主要与细菌在植入体表面形成生物膜有关,生物膜的形成显著增强了膜内细菌对机体免疫系统、抗生素以及化学杀菌剂的抵抗力[6-8],细菌生物膜类感染的根除极具挑战性。因此,抑制感染的重点集中在避免细菌生物膜的形成,减少细菌污染的可能和完善生物材料表面的性能。有学者提出,生物植入材料表面需具备抗细菌黏附和持久的抗菌性能[9-10]。赋予金属植入材料抑菌、抗菌能力的常用方法有两种:调控材料表面的理化性质来抑制细菌的黏附;采用物理共混、表面涂覆、化学键合等方式加载抗生素/抗菌元素[11-12]。抗生素的应用受限于细菌的耐药性[13-14],抗菌元素如纳米银[15]和抗菌肽[16-17]由于具有广谱高效的抗菌活性成为研究热点。
抗菌肽是一类具有抗菌活性的小分子多肽,其耐热、耐酸性强,水溶性好,具有高速的杀菌能力和广谱的抗菌活性。已有学者采用物理吸附、层层自组装或聚多巴胺键合的方法将抗菌肽载至钛片表面[18-20],使钛片具有抗菌作用。相比抗生素和纳米银而言,抗菌肽的价格相对较高,如何高效又便捷地将抗菌肽载于金属表面显得尤为重要。本研究采用于材料表面制备微纳结构与涂覆抗菌肽相结合的策略,以期实现钛植入材料有效、持久的抗菌效果。
1. 材料与方法
1.1. 主要试剂及仪器
钛片由威海威高洁丽康生物材料有限公司提供,为直径 10 mm、厚 1 mm 的圆片。无水乙醇、丙酮、盐酸、NaOH、氯化钠、无水乙醇(分析纯)、2.5% 戊二醛溶液(上海凌峰化学试剂有限公司);大肠杆菌、金黄色葡萄球菌(中国普通微生物菌种保藏管理中心);营养肉汤(上海创赛科技有限公司)。
高温马弗炉(河南鑫科仪器有限公司);恒温干燥箱(上海申贤恒温设备厂);AL104 电子天平[梅特勒-托利多国际贸易(上海)有限公司];LDZX-50KBS 高压灭菌锅(上海申安医疗器械厂);DHP-9012 恒温培养箱(上海一恒科学仪器有限公司);S4800 场发射扫描电镜(Hitachi 公司,日本);QUANTAX 400-30 型能谱仪(Bruker AXS 公司,德国);SPECTRAmax 84 酶标仪(Molecular Devices 公司,美国);KW-4B 台式匀胶仪(北京赛德凯斯电子有限公司)。
1.2. 钛片表面微纳结构制备
① 钛片表面前处理:取钛片行喷砂酸蚀(sandblasted large-grit acid-etched,SLA)处理后,分别用去离子水、无水乙醇、丙酮超声清洗表面 20 min,除去表面油污和杂质,再用去离子水清洗后烘干备用。② 钛片表面纳米结构化:将 SLA 处理后的钛片进一步行碱热处理(alkali-heat treatment,AHT)。在锥形瓶中配制 5 mol/L NaOH 溶液 200 mL,放入 SLA 处理后的钛片,超声 2 min 除去材料表面气泡,然后放入 60℃ 恒温箱中 24 h,取出后去离子水清洗 3 次,37℃ 下干燥 48 h。将碱蚀后的材料装进坩埚中,放入马弗炉,以 5℃/min 速率从室温升温至 600℃,保持 60 min,最后自然降至室温。各步骤处理后,采用扫描电镜观察钛片表面改变情况。
1.3. 钛片抗菌表面的制备
称取 8 mg 依据文献[17]方法合成的抗菌肽,用 4 mL 超纯水溶解,制成浓度为 2 mg/mL 的抗菌肽聚合物溶液。将台式匀胶仪置于超净台中,用镊子夹取 1.2 中经 SLA+AHT 处理后的钛片放置在匀胶仪转盘上,打开真空泵开关,按下固定按钮,样品固定在转盘上。将抗菌肽聚合物溶液滴至钛片上,设定转盘转速为 80 r/min,2 min 后待表面液体铺展均匀,提高转速至 200 r/min,1 min 后取下样品,置于 24 孔板内,确认旋涂处理的样品表面朝上。按照以上方法制备表面载有 10、30、50、70、90 μg 抗菌肽聚合物的钛片,备用。
1.4. 钛片表面的特性表征
取载有 10、30、50、70、90 μg 抗菌肽聚合物的钛片,喷金 30 s 后扫描电镜观察表面形貌,电压 10.0 kV。同时采用能谱仪对钛片表面进行元素分析,选取样品中心区域,记录 C、N、O、Ti 4 种元素含量比例。
1.5. 钛片抑菌及抗菌性能评价
1.5.1. 抑菌圈实验
将 200 μL 1×106CFU/mL 金黄色葡萄球菌菌液滴在固体琼脂平板上,L 型涂布棒均匀涂抹,将载有不同抗菌肽聚合物(10、30、50、70、90 μg)的钛片置于琼脂层上,旋涂处理面向下。于 37℃ 恒温培养箱内培养 24 h 后取出,观察抑菌圈形成情况,并用刻度尺测量抑菌圈直径,各取 3 个样本进行测量。
1.5.2. 滴液染菌实验
将处理前、SLA 处理、SLA+ AHT 处理、载有 90 μg 抗菌肽聚合物的钛片样品分别置于 24 孔板中,旋涂处理面朝上。分别将 50 μL 1×107CFU/mL 大肠杆菌以及金黄色葡萄球菌菌液滴加至样品表面,将样品孔周围所有孔内加入 1 mL 生理盐水,置于 37℃ 恒温培养箱培养 3 h。取出样品,1 mL 生理盐水冲洗,置于 2.5% 戊二醛溶液浸泡 20 min,超纯水清洗,50%、60%、75%、85%、100% 乙醇脱水,干燥,扫描电镜下观察两种细菌在钛片表面的黏附情况,并计算表面细菌黏附数量。各取 3 个样本进行检测。
1.5.3. 菌悬液浓度测定
将处理前、SLA 处理、SLA+AHT 处理、载有 90 μg 抗菌肽聚合物的钛片置于 24 孔板中,旋涂处理面朝上。分别将 50 μL 1×107 CFU/mL 大肠杆菌或金黄色葡萄球菌菌液滴加至样品表面,加入 950 μL 营养肉汤缓慢混合均匀后,置于 37℃ 恒温培养箱培养 3、6、9、12、24 h 后,采用酶标仪测定菌液的吸光度( A )值。以未加钛片的 50 μL 1×107CFU/mL 菌液和 950 μL 营养肉汤的混合液作为空白对照。实验重复 3 次。
1.6. 统计学方法
采用 JMP 统计软件进行分析。数据以均值±标准差表示,组间比较采用单因素方差分析,两两比较采用 LSD 检验,检验水准 α=0.05。
2. 结果
2.1. 钛片表面形貌及特性表征
2.1.1. 表面形貌
扫描电镜观察,处理前的钛片表面平整,金属加工纹路清晰可见; SLA 处理后的钛片表面遍布二级孔洞结构,孔径分别为 2~5 μm 和 20~30 μm;SLA+AHT 处理后钛片表面在维持一定微米结构基础上,遍布孔径约 200 nm 的纳米壁薄孔洞,与“泡发银耳”结构类似,提示采用 SLA+AHT 处理方法可在钛片表面构建包含微米及纳米级孔洞的多级结构(图 1、2)。
图 1.
The macroscopic observation of the Ti disks after different treatments
不同处理后钛片表面大体观察
a. 处理前;b. SLA 处理后;c. SLA+AHT 处理后
a. Untreated; b. After SLA treatment; c. After SLA+AHT treatment
图 2.
Surface morphology of the Ti disks observed by SEM
扫描电镜观察不同处理后钛片表面形貌
a. 处理前(×1 000);b. SLA 处理后(×10 k);c. SLA+AHT 处理后(×10 k)
a. Untreated (×1 000); b. After SLA treatment (×10 k); c. After SLA+AHT treatment (×10 k)

采用旋涂方式将抗菌肽聚合物均匀地涂覆于 SLA+AHT 处理后的钛片表面,与未涂覆抗菌肽聚合物的钛片相比,钛片表面孔壁明显增厚,表面孔径<200 nm 的孔洞几乎被抗菌肽覆盖,孔径>500 nm 的孔洞结构仍保留。提示通过旋涂方式可以将抗菌聚合物涂覆至纳米尺度的孔洞中(图 3)。
图 3.
Surface morphology of the Ti disks observed by SEM
扫描电镜观察抗菌肽聚合物涂覆前后钛片表面形貌
左:旋涂前;右:旋涂后 a. ×2 000;b. ×80 k
Left: Before spin-coating; Right: After spin-coating a. ×2 000; b. ×80 k
2.1.2. 表面特性表征
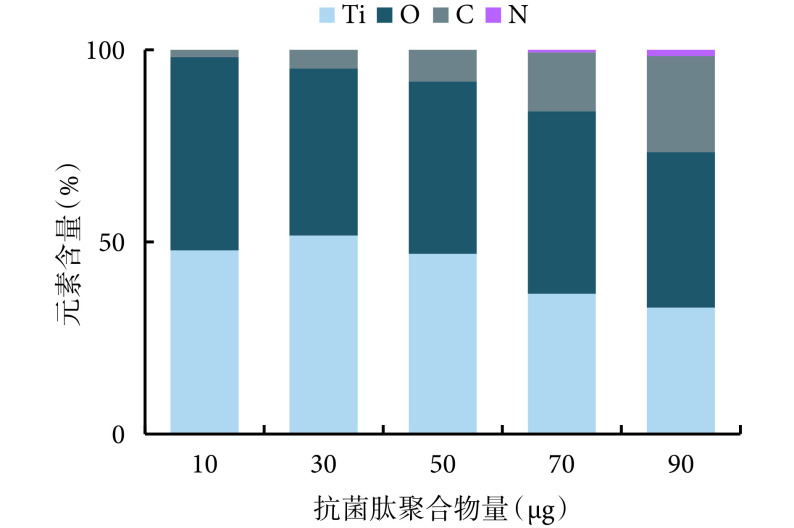
抗菌肽的特征元素是 C、N。元素分析显示,随着抗菌肽聚合物旋涂量的增加,C 元素含量不断增加;其中,50、70、90 μg 钛片的 C 含量明显大于 10、30 μg 钛片,70、90 μg 钛片大于 50 μg 钛片,90 μg 钛片大于 70 μg 钛片,比较差异均有统计学意义(P<0.05)。而直至抗菌肽聚合物旋涂量达 70 μg 时才检测到微量 N 元素,当含量增加到 90 μg 时,N 元素含量略有增加,但组间比较差异无统计学意义(P>0.05)。见图 4。
图 4.
EDS analysis on the Ti disks with different AMPs loading after SLA+AHT treatment
载有不同量抗菌肽聚合物的钛片表面元素含量分析
2.2. 抑菌及抗菌性能评价
2.2.1. 抑菌圈实验
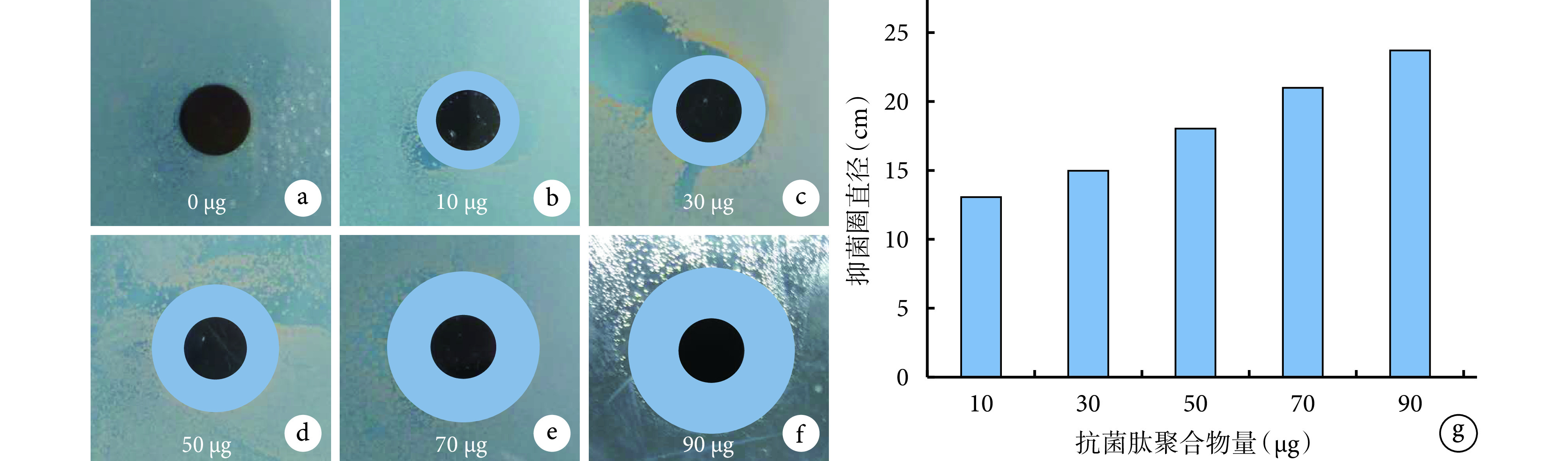
培养 24 h,与对照样品(0 μg)相比,载有不同量抗菌肽聚合物的钛片周围均表现出明显抑菌圈,且抑菌圈随着抗菌肽聚合物量的增加而扩大。其中,50、70、90 μg 钛片抑菌圈直径明显大于 10、30 μg 钛片,70、90 μg 钛片大于 50 μg 钛片,90 μg 钛片大于 70 μg 钛片,比较差异均有统计学意义(P<0.05)。见图 5。
图 5.
Observation of the inhibition zone on the Ti disks with different AMPs loading after 24 hours culture
培养 24 h 后载有不同量抗菌肽聚合物的钛片周围抑菌圈观察
a~f. 载有 0、10、30、50、70、90 μg 抗菌肽聚合物的钛片抑菌圈;g. 抑菌圈直径比较
a~f. 0, 10, 30, 50, 70, and 90 μg-loaded samples; g. Diameter comparison of the inhibition zone
2.2.2. 滴液染菌实验
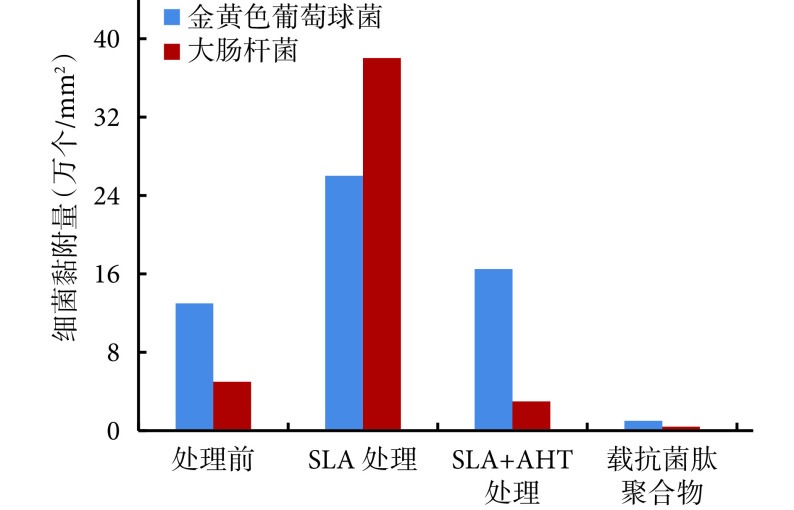
扫描电镜下观察,处理前以及 SLA+AHT 处理后的钛片表面留存的金黄色葡萄球菌以及大肠杆菌均较少,而 SLA 处理后的钛片表面黏附了大量细菌。载有 90 μg 抗菌肽聚合物的钛片表面仅有极少量金黄色葡萄球菌,几乎未见到大肠杆菌;并且黏附的金黄色葡萄球菌表面出现褶皱,提示细菌为死亡状态,在后续处理中脱水变形(图 6)。各钛片表面两种细菌黏附数量见图 7。相比于处理前钛片,SLA 处理后的钛片表面两种细菌黏附数量明显增加,载抗菌肽聚合物的钛片表面明显减少;相比于 SLA 处理后钛片,SLA+AHT 处理后和载抗菌肽聚合物的钛片表面细菌黏附量明显减少;载抗菌肽聚合物的钛片表面细菌黏附量较 SLA+AHT 处理后钛片明显减少;以上比较差异均有统计学意义(P<0.05)。
图 6.
Observation of bacterial attachment on Ti disks surfaces with different treatments (×10 k)
扫描电镜观察不同处理后钛片表面的细菌黏附情况(×10 k)
从左至右分别为处理前、SLA 处理、SLA+AHT 处理、载抗菌肽聚合物钛片 a. 金黄色葡萄球菌;b. 大肠杆菌
From left to right for untreated, SLA treatment, SLA+AHT treatment, and AMP-loaded Ti disks a. Attachment of S. aureus; b. Attachment of E. coli

图 7.
Bacterial amounts attached on the different Ti disks
不同处理后钛片表面的两种细菌黏附量比较
2.2.3. 菌液浓度测定
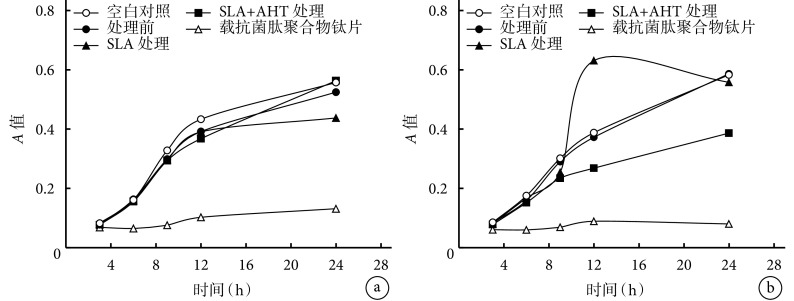
金黄色葡萄球菌观察:随培养时间延长,空白菌液、处理前、SLA 处理后以及 SLA+AHT 处理后钛片菌液的 A 值明显增加,提示金黄色葡萄球菌数目增多,但 12 h 后 A 值增加趋势减缓;而随培养时间增加,载抗菌肽聚合物钛片菌液的 A 值仅略增加,提示金黄色葡萄球菌数量无明显增加。除培养 3 h 外,其余各时间点空白菌液、处理前、SLA 处理后以及 SLA+AHT 处理后钛片 A 值比较差异无统计学意义(P>0.05),但均高于载有抗菌肽聚合物的钛片(P<0.05)。见图 8a。
图 8.
Comparison of A values of bacterial solutions with immersed different Ti disks
两种菌液不同时间点 A 值比较
a. 金黄色葡萄球菌;b. 大肠杆菌
a. S. aureus; b. E.coli
大肠杆菌观察:随培养时间延长,空白菌液、处理前、SLA+AHT 处理后以及载抗菌肽聚合物钛片菌液 A 值总体呈增加趋势,其中 SLA 处理后和载抗菌肽聚合物钛片的 A 值先增加,至 12 h 后减少。培养 3、6、9 h,空白菌液、处理前、SLA 处理后以及 SLA+AHT 处理后钛片的 A 值比较差异无统计学意义(P>0.05)。12 h,SLA 处理后钛片菌液A 值最高、载抗菌肽聚合物钛片最低,与其他组比较差异有统计学意义(P<0.05);而 SLA+AHT 处理后钛片低于处理前钛片和空白菌液(P<0.05),处理前钛片和空白菌液间比较差异无统计学意义(P>0.05)。24 h,空白菌液、处理前、SLA 处理后钛片的A 值差异无统计学意义(P>0.05),高于 SLA+AHT 处理及载抗菌肽聚合物钛片(P<0.05);而 SLA+AHT 处理后钛片高于载抗菌肽聚合物钛片(P<0.05)。见图 8b。
3. 讨论
为避免植入材料相关感染的发生,一方面要保证植入过程中严格遵守无菌原则,另一方面则应改善材料的表面性能,进而掐断生物膜形成的源头。植入材料表面的抗菌改性包含减少甚至避免细菌的黏附和有效地杀死细菌两方面。前者可以通过改变材料表面的物化性质(如亲水性、吸水率、表面自由能、表面润湿性)、表面电性质(表面电荷、ζ 电位)、表面形貌等来抑制细菌的黏附;后者则需要在表面引入抗菌分子(如金属离子、抗生素类、非抗生素类有机分子)[13-14, 18-21]。
SLA 处理有利于材料表面粗糙化和微米孔洞的形成,进而利于成骨细胞的黏附、增殖和分化[22]。同时,表面的粗糙化结构及疏水特性(接触角约为 110°)明显地增强了细菌的黏附。为了维持材料表面与成骨细胞的紧密接触,同时又减少细菌的黏附,表面亲疏水特性调控是最为简便的方式。聚乙二醇是目前研究较多的亲水化合物,已有研究表明,密集的聚乙二醇链具有高度亲水性,能在生物材料表面形成空间和渗透压屏障,能有效地减少细菌的吸附 [7, 23-24]。本研究采用了 AHT 处理方式进行纳米结构的构建和亲水化调控,处理后表面呈现超亲水特性(去离子水滴加于表面立刻浸润平铺),钛片表面金黄色葡萄球菌和大肠杆菌黏附数量比 SLA 处理后钛片表面的黏附量有不同程度减少。但是,SLA+AHT 处理后钛片表面对溶液中大肠杆菌的增长有一定的抑制作用,表现为 SLA+AHT 处理后钛片样品 A 值明显低于空白菌液、处理前、SLA 处理后钛片样品;SLA+AHT 处理后钛片表面对溶液中金黄色葡萄球菌的增殖没有显著作用,空白菌液、处理前、SLA 处理以及 SLA+AHT 处理后钛片样品的 A 值无统计学差异。由此可见,AHT 处理对降低细菌的表面黏附量具有显著作用,但是很难杀死细菌悬液中细菌,仅仅依靠表面亲疏水性的调控很难掐断生物膜形成的源头。因此,本研究在对钛片表面进行纳米结构调控外,结合了旋涂抗菌肽的策略。
抗菌肽的合成、应用及其抗菌机制是近期研究的热点之一,阳离子抗菌肽接枝到钛金属材料表面或将聚乙二醇-赖氨酸自组装到钛金属材料表面均赋予其明显抗菌作用。本研究采用的抗菌肽具有阳离子单元、亲疏水性可控的特性。抗菌钛片样品制备过程中,当涂覆量<50 μg 时,旋涂过程抗菌肽聚合物溶液几乎没有损失(没有溶液甩落在样品表面以外)。当超过该剂量时,每增加 10 μg 溶液,体积都会有少许离心损失,当旋涂量增加到 100 μg 时,离心损失量不可忽略。因此,后续实验中我们选择钛片表面最大旋涂量为 90 μg。SLA 和 AHT 处理处理后,成功在钛片表面构建了微米、纳米多级结构,旋涂抗菌肽聚合物溶液后可以将其加载于纳米孔洞中。不仅如此,具有阳离子单元的抗菌肽与 AHT 的负电表面有较强的静电作用。因此,载有抗菌肽聚合物的钛片表面表现出显著的杀菌作用,载抗菌肽聚合物钛片样品A 值显著低于其他处理后钛片。相比 SLA 处理和 SLA+AHT 处理后钛片,载有抗菌肽聚合物的钛片不仅表现出良好的减少细菌黏附作用,同时也表现出对大肠杆菌和金黄色葡萄球菌的优良抑制作用。
综上述,采用 SLA 和 AHT 处理方法,有效地增强了钛片表面亲水性,一定程度上阻止大肠杆菌和金黄色葡萄球菌的黏附;通过旋涂方法在纳米结构表面成功装载抗菌肽,其在琼脂中和菌液中均有良好的释放和扩散,杀菌效果明显。表明通过调控材料表面结构及结合抗菌肽的策略可以有效地减少或避免植入材料表面细菌生物膜的形成。
Funding Statement
中国科学院-威高研究发展计划(攻关项目[2017]005号);国家自然科学基金面上项目(31570971);国家自然科学基金创新群体项目(51621002);上海市国际科技合作项目(18520710100);国家外国专家局“111”引智项目(B14018)
Chinese Academy of Sciences-Wego Holding Co. Research and Development Program ([2017]005); National Natural Science Foundation of China (31570971); National Natural Science Foundation of China for Innovative Research Groups (51621002); Shanghai International S&T Cooperation Project (18520710100); Funds of State Administration of Foreign Experts Affairs P.R.China (B14018)
Contributor Information
宏燕 何 (Hongyan HE), Email: .
昌胜 刘 (Changsheng LIU), Email: liucs@ecust.edu.cn.
References
- 1.Bai Y, Zhou R, Cao J, et al Microarc oxidation coating covered Ti implants with micro-scale gouges formed by a multi-step treatment for improving osseointegration. Mater Sci Eng C Mater Biol Appl. 2017;76:908–917. doi: 10.1016/j.msec.2017.03.071. [DOI] [PubMed] [Google Scholar]
- 2.Prakash C, Uddin MS Surface modification of β-phase Ti implant by hydroaxyapatite mixed electric discharge machining to enhance the corrosion resistance and in-vitro bioactivity . Surf Coat Tech. 2017;326:134–145. [Google Scholar]
- 3.Murphy M, Walczak MS, Thomas AG, et al Toward optimizing dental implant performance: Surface characterization of Ti and TiZr implant materials. Dent Mater. 2017;33:43–53. doi: 10.1016/j.dental.2016.10.001. [DOI] [PubMed] [Google Scholar]
- 4.Adesanya O, Sprowson A, Masters J, et al Review of the role of dynamic 18F-NaF PET in diagnosing and distinguishing between septic and aseptic loosening in hip prosthesis. J Orthop Surg Res. 2015;10(1):1–5. doi: 10.1186/s13018-014-0147-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Trtica M, Stasic J, Batani D, et al Laser-assisted surface modification of Ti-implant in air and water environment. Appl Surf Sci. 2018;428:669–675. [Google Scholar]
- 6.Pantaroto HN, Ricomini-Filho AP, Bertolini M, et al Antibacterial photocatalytic activity of different crystalline TiO2 phases in oral multispecies biofilm . Dent Mater. 2018;34(7):e182–e195. doi: 10.1016/j.dental.2018.03.011. [DOI] [PubMed] [Google Scholar]
- 7.Skovdal SM, Jørgensen NP, Petersen E, et al Ultra-dense polymer brush coating reduces Staphylococcus epidermidis biofilms on medical implants and improves antibiotic treatment outcome. Acta Biomater. 2018;76:46–55. doi: 10.1016/j.actbio.2018.07.002. [DOI] [PubMed] [Google Scholar]
- 8.Schneider S, Rudolph M, Bause V, et al Electrochemical removal of biofilms from titanium dental implant surfaces. Bioelectrochemistry. 2018;121:84–94. doi: 10.1016/j.bioelechem.2018.01.008. [DOI] [PubMed] [Google Scholar]
- 9.Kim S, Park C, Cheon KH, et al Antibacterial and bioactive properties of stabilized silver on titanium with a nanostructured surface for dental applications. Appl Surf Sci. 2018;451:232–240. [Google Scholar]
- 10.Weng Y, Liu H, Ji S, et al A promising orthopedic implant material with enhanced osteogenic and antibacterial activity: Al2O3-coated aluminum alloy . Appl Surf Sci. 2018;457:1025–1034. [Google Scholar]
- 11.Diaz-Gomez L, Concheiro A, Alvarez-Lorenzo C Functionalization of titanium implants with phase-transited lysozyme for gentle immobilization of antimicrobial lysozyme. Appl Surf Sci. 2018;452:32–42. [Google Scholar]
- 12.Hickok NJ, Shapiro IM, Chen AF The impact of incorporating antimicrobials into implant surfaces. J Dent Res. 2018;97(1):14–22. doi: 10.1177/0022034517731768. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Raj RM, Priya P, Raj V Gentamicin-loaded ceramic-biopolymer dual layer coatings on the Ti with improved bioactive and corrosion resistance properties for orthopedic applications. J Mech Behav Biome. 2018;82:299–309. doi: 10.1016/j.jmbbm.2017.12.033. [DOI] [PubMed] [Google Scholar]
- 14.Xiang Y, Liu X, Mao C, et al Infection-prevention on Ti implants by controlled drug release from folic acid/ZnO quantum dots sealed titania nanotubes. Mater Sci Eng C. 2018;85:214–224. doi: 10.1016/j.msec.2017.12.034. [DOI] [PubMed] [Google Scholar]
- 15.Dos Santos CA, Seckler MM, Ingle AP, et al Silver nanoparticles: therapeutical uses, toxicity, and safety issues. J Pharm Sci. 2014;103(7):1931–1944. doi: 10.1002/jps.24001. [DOI] [PubMed] [Google Scholar]
- 16.Chakraborty S, Liu R, Hayouka Z, et al Ternary nylon-3 copolymers as host-defense peptide mimics: beyond hydrophobic and cationic subunits. J Am Chem Soc. 2014;136(41):14530–14535. doi: 10.1021/ja507576a. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Liu R, Chen X, Falk SP, et al Structure-activity relationships among antifungal nylon-3 polymers: materials active against drug-resistant strains of candida albicans. J Am Chem Soc. 2014;136(11):4333–4342. doi: 10.1021/ja500036r. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Geng H, Yuan Y, Adayi A, et al Engineered chimeric peptides with antimicrobial and titanium-binding functions to inhibit biofilm formation on Ti implants. Mater Sci Eng C. 2018;82:141–154. doi: 10.1016/j.msec.2017.08.062. [DOI] [PubMed] [Google Scholar]
- 19.Shi J, Liu Y, Wang Y, et al Biological and immunotoxicity evaluation of antimicrobial peptide-loaded coatings using a layer-by-layer process on titanium. Sci Rep. 2015;5:16336. doi: 10.1038/srep16336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.He Y, Zhang Y, Shen X, et al The fabrication and in vitro properties of antibacterial polydopamine-LL-37-POPC coatings on micro-arc oxidized titanium . Colloid Surf B. 2018;170:54–63. doi: 10.1016/j.colsurfb.2018.05.070. [DOI] [PubMed] [Google Scholar]
- 21.Qian Y, Qi F, Chen Q, et al Surface modified with a host defense peptide-mimicking β-peptide polymer kills bacteria on contact with high efficacy. ACS Appl Mater Interfaces. 2018;10(18):15395–15400. doi: 10.1021/acsami.8b01117. [DOI] [PubMed] [Google Scholar]
- 22.Qin J, He H, Zhang W, et al Effective incorporation of rhBMP-2 on implantable titanium disks with microstructures by using electrostatic spraying deposition. RSC Advances. 2016;6(57):51914–51923. [Google Scholar]
- 23.Trino LD, Dias LFG, Albano LGS, et al Zinc oxide surface functionalization and related effects on corrosion resistance of titanium implants. Ceram Int. 2018;44(4):4000–4008. [Google Scholar]
- 24.Dou X, Zhang D, Feng C, et al Bioinspired hierarchical surface structures with tunable wettability for regulating bacteria adhesion. ACS Nano. 2015;9(11):10664–10672. doi: 10.1021/acsnano.5b04231. [DOI] [PubMed] [Google Scholar]