Abstract
大段骨缺损修复一直是骨科领域亟待解决的一大难题,骨修复材料是解决这一难题切实可行的方法。近年,骨修复材料发展迅速,已经从自体骨、同种异体骨、惰性材料发展到高活性、多功能的骨组织工程支架材料。通过广泛回顾文献,从骨修复材料活性机制、骨修复材料的应用及新型骨修复材料的探索三方面,总结骨修复材料研究现状与进展,并展望发展方向。
Keywords: 骨修复材料, 成骨机制, 成骨活性
Abstract
Large bone defect repair is a difficult problem to be solved urgently in orthopaedic field, and the application of bone repair materials is a feasible method to solve this problem. Therefore, bone repair materials have been continuously developed, and have evolved from autogenous bone grafts, allograft bone grafts, and inert materials to highly active and multifunctional bone tissue engineering scaffold materials. In this paper, the related mechanism of bone repair materials, the application of bone repair materials, and the exploration of new bone repair materials are introduced to present the research status and advance of the bone repair materials, and the development direction is also prospected.
Keywords: Bone repair material, osteogenesis mechanism, osteogenic activity
由疾病或创伤引起的大段骨缺损一直是骨科领域亟待解决的一大难题。目前,临床主要采用自体或同种异体骨移植修复骨缺损,但存在来源有限、免疫排斥反应导致植入失败等不足。为了解决上述问题,人工合成骨修复材料成为研究热点。它来源广泛、无免疫原性,不仅能为受损骨组织提供结构支撑,还能与周围组织整合,对骨修复与再生具有一定促进作用,为较大范围骨缺损修复提供了新方法。本文从骨修复材料活性机制、骨修复材料的应用及新型骨修复材料的探索三方面,总结相关研究现状与进展,展望发展方向。
1. 骨修复材料活性机制
骨修复材料的研发既往均基于传统生物学原理,即材料直接刺激成骨分化。基于此,目前大部分研究都致力于优化骨修复材料的生物力学和物理化学性质,以诱导细胞向成骨方向分化,并取得了一定成功。然而,体外细胞研究与动物体内研究的实验结果存在不一致,提示材料介导的骨修复机制尚未完全明确。
早期研究主要通过检测成骨相关基因表达情况,来判定某一材料是否可用于骨修复及其骨修复能力[1-2],缺乏对材料植入体内后修复机制的研究。近年来,研究者已开始进行更深层次的机制研究,即骨修复材料对成骨相关信号通路的影响。例如,通过细胞表面标记物以及 mRNA 来研究丝素材料对成骨信号传导的调控,发现丝素材料促进骨再生的主要机制是通过抑制 Notch 通路和激发 WNT 通路来增强 Runx2 和 ALP 的表达[3];β-磷酸钙可以激发 BMP-2 通路[4]和 WNT 通路[5],从而促进成骨;镁离子可以通过 TRPM7/PI3K 信号通路上调 Runx2 和 ALP 的表达,进而显著提高成骨细胞的成骨活性[6]。同时,研究者也对复合材料进行了相关研究。例如,Liu 等[7]发现纳米羟基磷灰石(nano hydroxyapatite,nHA)和丝素蛋白复合支架通过 IL-1α 自分泌/旁分泌信号环路来增加 IL-1α 的分泌量,进而上调 BMP-2 的表达,增强骨再生。
此外,材料的一些物理化学性质对成骨相关信号通路的影响也受到了关注。研究表明,材料表面微纳米形貌,特别是纳米分层多孔结构,可以激发 Hedgehog-Gli1[8]、FAK-ERK1/2[9]以及 ILK/ERK1/2 和 ILK/p38[10]通路;增加基质硬度可以通过 WNT 通路促进牙髓干细胞的增殖与成骨向分化[11];随着基质硬度提高,巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)含量增加,从而激活 MIF 介导的 AKT/YAP/RUNX2 表达,有利于 hMSCs 的成骨分化[12]。此外,通过表面改性引入的化学成分也可以影响成骨相关信号通路[13]。Wu 等[14]用氧化石墨烯修饰 β-磷酸钙陶瓷三维支架材料表面,发现修饰后的陶瓷材料可以通过激活 Wnt/β-catenin 信号通路诱导干细胞成骨分化。
除了对信号通路进行大量研究,研究者们还对其他与骨修复材料促进成骨的相关机制进行了探讨。例如,生物材料可以调节 miRNA(基因表达后的转录调控因子)的表达水平,进而影响成骨 [15];nHA 可以刺激成骨细胞 DNA 启动子甲基化,从而影响 ALP 的表达[16];骨修复材料对生长因子的增强效应[17]等。
2. 骨修复材料的应用
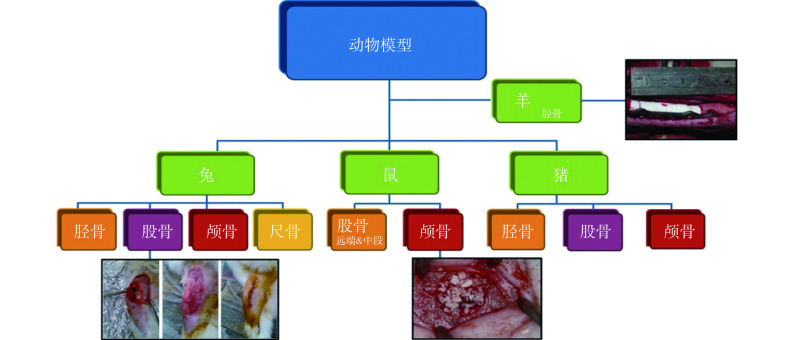
目前,应用于骨组织修复与再生方面的材料种类很多,涵盖了无机非金属、金属以及有机高分子三大类材料,其中一些材料在动物与临床研究中已取得了显著性成果。材料研究中常用的骨缺损动物模型类型[18-21]见图 1。
图 1.
Bone defect animal models for testing efficacy of bone repair biomaterials
用于检测骨修复材料性能的骨缺损动物模型
2.1. 无机非金属材料
无机非金属材料具有与天然骨良好的亲和性,可在人体内稳定存在,适合用作人体硬组织部位的替换材料。磷酸钙、生物活性玻璃是骨修复研究中常用的无机非金属材料。
其中,磷酸钙有良好的生物降解性、理想的生物相容性和骨传导性。磷酸钙表面能形成磷灰石层,与骨组织通过化学键稳定结合,进而提高与受损骨间的整合效果[22]。HA 是一种具有代表性的磷酸钙,呈弱碱性,为天然骨的主要无机成分。研究已证实 HA 具有良好的成骨活性,早在 20 世纪 90 年代就有临床使用 HA 修复骨缺损的报道[23]。近年来也有对 nHA 的临床研究,如 Zhu 等[24]使用 nHA 修复 27 例骨缺损患者,骨缺损范围 0.3 cm×1.0 cm~3.0 cm×6.5 cm,经平均 18.5 个月随访,发现 nHA 具有良好的生物相容性,无相关副作用。目前市场上已有以磷酸钙为主体的各类骨修复材料,如同时经过美国食品药品监督管理局(FDA)与我国 CFDA 审批的伯克利人工骨。然而,由于 HA 的断裂强度较低,具有较高的脆性,在体内的降解速率难以预测,不适合直接用于修复大范围骨缺损。
生物活性玻璃在生理环境下可生物降解,并释放促进成骨离子。它能与天然骨形成骨性结合,具有骨传导性。但玻璃自身脆性和较低抗弯强度限制了其在硬组织修复中的应用。特别是活性玻璃在体内呈现较差的抗疲劳性能,只能用于修复承受力要求较小部位的骨缺损,如牙、软骨[25],产品包括美国 PerioGlas(倍骼生)、NovaBone(固骼生)等。
2.2. 金属材料
金属材料是研究最早的生物材料,具有良好的抗拉强度和韧性,特别适合机体硬组织缺损修复。常用的金属材料包括不锈钢、钴铬合金、钛合金以及镁合金,其中不锈钢和钴铬合金最早用于临床骨科,并获得较好效果。不锈钢价格低廉且机械性能好,目前临床应用广泛,但存在抗腐蚀性能差的问题。钴铬合金具有较好的耐磨性能,但其生物毒性不容忽视。随后,惰性金属钛及钛合金用于骨科领域,其对成骨细胞的黏附和生长无影响,具有较强的机械性能。但钛合金与天然骨组织的弹性模量不匹配,远强于骨的机械性能,使其植入体内后会对周围骨组织产生应力屏蔽效应,骨组织会因缺乏应力刺激而生长不良甚至退化 [26]。此外,值得注意的是,金属材料植入体内后会发生磨损或腐蚀,进而产生有毒的金属离子或颗粒,导致炎症级联反应,因此不适宜长期植入和修复大面积骨缺损[27]。
目前,镁及镁合金成为用于骨修复的热点金属材料。控制镁离子微量释放可以促进成骨细胞的体外生长,提高骨组织愈合能力[28]。然而,纯镁的生物降解速度过快,难以满足受损骨组织的力学要求;过快降解亦会造成局部过碱化,并释放大量氢气,对成骨细胞的黏附和生长产生抑制作用。因此,研究者常通过合金技术将其制备成镁合金再用于研究。镁合金的降解速度较纯镁慢,同时抗拉强度和断裂韧性更好,使其能用作骨修复材料。目前已有大量镁合金骨修复材料被批准商用,如德国 MAGNEZIX 系列产品[29]、韩国 K-MET 螺钉[30]等。我国研究者对用于固定移植自体骨的可降解镁螺钉已进行了上百例临床试验[31]。
2.3. 有机高分子材料
骨组织工程研究中常用的有机高分子材料,根据来源可分为天然高分子与人工合成高分子两类。其中,天然高分子包括胶原、纤维蛋白、丝素蛋白、甲壳素、透明质酸、海藻酸钠和壳聚糖等;人工合成高分子包括聚乳酸(polylactic acid,PLA)、聚己内酯和聚乳酸-羟基乙酸共聚物等。胶原是天然骨中有机质的主要组成成分,具有良好的生物相容性。它能为钙盐沉积提供位点,同时还能与调控细胞矿化的蛋白相结合,促进骨基质矿化。但存在机械强度较低、降解过快等不可调控的缺陷[32],实际应用中多与 HA 复合,如韩国 GENOSS 公司的 Orthopedic OSTEON™ ⅡCollagen 等产品。
而人工合成材料可通过改变成型工艺参数等条件,使其具备可控的分子量、孔隙率和降解速度,因而在骨缺损修复中具有更显著的优势[33]。在经美国 FDA 批准用于临床的有机高分子材料中,PLA 因其独特的性质已被广泛用于骨修复领域[34],如美国 Biotrak 和日本 Osteotrans-MX 等产品。它的降解产物乳酸是人体正常活动产生的代谢产物之一,因而具有良好的生物相容性。此外,PLA 还具有较好的力学性能和可塑性,易于加工成型,已被广泛用作骨折内固定材料、骨修复支架材料等。然而,PLA 存在亲水性较差、降解速率快等缺陷,且中间产物会在局部范围内积累而导致 pH 值较低。因此,PLA 直接用于修复骨缺损效果并不理想,需要加入其他材料进行性能优化。
丝素蛋白是骨修复材料中的新型材料,它具有良好的柔韧性和抗拉伸强度,以及较好的透气、透湿性和生物降解功能。此外,丝素蛋白固化结晶方式多样,易于保持高度生物亲和性以及形成特殊的多孔结构。与其他有机高分子材料相比,丝素蛋白具有更优良的力学性能和生物活性,并且在体内能被多种蛋白酶和胶原酶分解,降解后的产物为氨基酸,安全无毒 [35]。大鼠体内植入实验表明,与 PLA 支架相比,静电纺丝丝素蛋白支架明显促进了颅骨损伤的修复[36]。然而,丝素蛋白支架虽然具有良好的生物力学强度,但是仍难以达到天然骨强度,此外其矿化能力有限。
2.4. 复合材料
近年来骨修复材料的选择,已经从天然成分组织中提取的简单材料发展为人工合成的高分子材料;由单一组分材料发展成各种具有良好性能的复合材料以及表面修饰材料。复合材料是根据材料的优缺点,将两种或以上的不同材料进行复合制得,不仅兼具组分材料的性质,还可以得到单组分材料不具备的新性能[37]。高分子材料、陶瓷材料及天然衍生材料既可作为复合材料的基质,也可以作为增强物或填料,它们能够相互搭配以组合形成大量性质各异的复合材料。2006 年有研究者使用几丁质纤维增强的 nHA/胶原/左旋聚乳酸复合材料成功修复了长约 40 mm 的山羊胫骨骨缺损[19]。
3. 新型骨修复材料的探索
由金属、陶瓷、高分子和复合材料制成的骨修复材料被广泛用于骨修复,虽然这些合成的材料具有满意的机械性能和生物相容性,以及其他优异的性能,但与自体/同种异体骨移植相比,仍然存在一些先天性缺陷,例如金属材料的离子释放、高分子材料强度差、陶瓷材料脆性大、复合材料降解性不可控等。因此,探索新的骨修复材料、优化材料功能、改进材料制备方法、优化材料结构,以提升骨修复材料的生物相容性、活性、力学性能及降解性能是骨修复材料的发展方向。
3.1. 新型材料种类
3.1.1. 碳素材料
碳素材料因具有优异的机械性能与生物相容性引起了研究者的关注,近年来新兴的碳素材料主要包括碳纳米管与石墨烯材料。
碳纳米管具有单层或多层石墨管状结构,良好的机械性能、导电性能和表面性能,使其成为生物医学领域的一大热点材料。多壁碳纳米管(multi walled carbon nanotubes,MWNTs)具有更多的石墨管层,其直径一般为 1~100 nm,长度>5 mm,结构更加稳定,在骨修复领域的应用更为广泛。MWNTs 这一尺寸特性使其特别适用于模拟细胞外基质中的纤维蛋白,尤其是胶原蛋白[38]。与胶原蛋白相比,碳纳米管的机械性能更强,能够为骨组织提供更好的支撑。此外,与Ⅰ型胶原相比,在碳纳米管表面上骨关联细胞能更好地黏附和增殖[38]。体外研究表明,碳纳米管无毒且有良好的生物相容性[39];其独特的纳米结构能特异性吸附大量蛋白,从而促进干细胞向成骨方向分化[40]。虽然纯碳纳米管的亲水性较差,易于团聚,但只要对其表面加以改性,引入亲水基团,就可直接改变材料的亲疏水性和分散性[41]。因此,碳纳米管有望成为骨修复中最具应用前景的无机纳米材料。
石墨烯材料主要包括石墨烯及其衍生物,具有高机械强度、高比表面积、高导电、高导热、低密度等独特的物理化学特性,因此近年来在生物医学领域,特别是在骨修复材料领域受到了广泛关注。已有研究表明,石墨烯材料具有良好生物学性能,对成骨细胞无毒性,能促进成骨细胞黏附和增殖[42],并且能促进 BMSCs 向成骨细胞分化[43]。除此之外,石墨烯材料还具有抗菌性[44]和载药缓释性[45],能与各类材料组合制备纳米复合材料,展现了其在骨修复领域的良好应用前景。但目前石墨烯材料的研究还处于体外实验和动物实验阶段,在进一步开展体内实验前仍存在诸多问题,如石墨烯材料的长期毒性和降解性能等。
3.1.2. 掺金属离子材料
将一些金属离子添加至骨修复材料中,可合成理化和生物性能更优良的复合材料,目前的研究主要集中于添加锶离子、锌离子以及镁离子。
锶是人骨骼中一种重要的微量亲骨性元素,能够增加骨骼强度,促进骨形成以及抑制骨吸收[46]。研究者们将锶添加至骨修复材料后植入骨缺损部位,结果发现锶离子直接于特定缺陷位置释放,从而促进成骨甚至血管化[47]。除了提高生物活性,锶的掺入还能显著改善材料性能,如提高材料的硬度、压缩强度、拉伸强度、降解性、吸水性等[48-49]。
锌也是骨骼系统正常生长和发育的一个重要微量元素,在体内外皆能促进成骨,同时能够抑制破骨细胞的成熟与增殖[50]。锌可通过 TGF-β 信号通路使可促进骨再生的各类因子表达上调,如可促进基质合成的Ⅰ型胶原、促进基质矿化的 ALP 和骨钙素、抑制破骨细胞的骨保护素等 [51]。此外,锌具有抑制炎性反应[52]和抑菌[53]的作用。需要注意的是,虽然锌具有理想的成骨能力,但在体内超过一定浓度就会产生生物毒性反应[54],因此在添加锌时需要选择有效的缓释体系。
镁是骨组织无机成分中的重要元素,能够提高成骨细胞活性和抑制破骨细胞增殖[55]。镁缺乏会导致骨生长停止、骨质疏松和骨脆性[56],这和镁离子可以激活 TRPM7/PI3K 信号通路有关[6]。研究表明,骨修复材料中添加镁后也表现出抑菌[57]、促血管化[58]等特性。
然而,相关研究中添加金属离子方法不同,研究结果以及金属离子最佳添加浓度也不一致,目前各类掺金属离子材料研究仍停留在动物实验阶段,尚无临床研究成果。
3.1.3. 天然生物质碳酸钙
珊瑚是最早获得深入研究并应用于临床的天然生物质碳酸钙[59]。珊瑚的结构类似于松质骨,其初始机械性质与人体骨骼相近;已被证明具有良好生物相容性、骨传导性和可降解性,还可作为生长因子的适当载体,并允许细胞附着、生长、扩散和分化[60]。在实际应用中常将珊瑚转化为 HA,使其在保留本身优良结构特性的同时获得骨诱导性,从而增强骨修复作用。天然珊瑚可塑性较差,并且属于国家保护的珍贵自然资源,限制了其临床大规模应用。
墨鱼骨具有良好的三维多孔房架式网状结构,且资源丰富[61]。兔体内实验表明,与人工合成 HA 相比,墨鱼骨转化 HA 修复后缺损处的新生骨量更多、骨传导性更好[62],有望取代天然珊瑚来源 HA 在骨缺损修复临床上的应用。
珍珠层也是具有一定成骨作用的天然生物质碳酸钙材料,主要由约 97% 无机碳酸钙与约 3% 有机质组成,具有与骨骼类似的结构特点。珍珠层良好的生物相容性、骨诱导、骨传导和骨整合特性均已经过人体试验证实,它是一种具有潜力的骨修复材料[63]。
3.1.4. 脱细胞基质材料
脱细胞基质材料是通过物理、化学和生物化学等方法去除组织和器官中的细胞,以及其他抗原成分,获得的具有接近细胞外基质天然结构与形状,并保留了活性成分和维持形状的胶原蛋白、纤连蛋白、多糖、糖蛋白等成分的天然材料[64]。脱细胞基质材料具有良好的生物学性能、组织相容性,植入人体内无免疫排斥现象,在体内可以起到支持、连接细胞的作用,同时其三维空间结构及包含的细胞因子有利于细胞黏附和增殖分化。
脱细胞骨基质(decellularized bone matrix,DBM)是将骨组织中的活细胞杀死、脂肪皂化处理后得到的骨修复材料,在降低抗原性的同时又保留了骨原有结构、力学性质,因而具有良好生物及理化性能[65],同时由于其具有骨传导性和骨诱导性能加速骨再生[66]。Chen 等[67]使用 0.5% 十二烷基硫酸钠和 0.1%NH4OH 成功制备了 DBM,而后在体内与体外实验中发现 DBM 可促进 MSCs 增殖和成骨分化,实现有效的骨再生,是一种有应用前景的骨修复材料。除了 DBM 外,其他可应用于骨修复的脱细胞基质材料也受到了关注[68-69]。对于脱细胞基质材料,虽然已有部分产品投入临床,如美国 AlloSource 公司的 AlloFuse 系列产品,但由于其成分复杂,植入体内后的再生机制尚不明确。
3.1.5. 其他
除了上述 4 类材料以外,鱼胶原和介孔二氧化硅纳米球是可用于骨缺损修复的新兴材料。鱼胶原具有低抗原性、低过敏性以及来源广泛等优点,研究者主要探讨其替代目前大量使用的哺乳动物胶原可行性。体外实验表明,鱼胶原可以增加前成骨细胞的 ALP、骨钙素和骨涎蛋白的基因表达[70]。进一步研究表明,鱼胶原复合材料与传统胶原复合材料成骨能力相当,甚至更加优良[71]。
介孔二氧化硅纳米球可以通过释放硅离子来提高 BMSCs 的 ALP 活性,以及成骨相关基因和蛋白的表达,进而刺激其向成骨细胞分化[72]。同时,这种中空微球材料还具有载药缓释性。这种递送刺激性离子和功能性药物的材料为构建用于骨组织再生的多功能生物材料系统提供了新的策略。
3.2. 优化功能
3.2.1. 多功能材料
骨修复材料发展至今,对其功能要求越来越高,单一的促进成骨功能已经满足不了临床使用需求。近年来,多功能材料已成为研究方向。实现骨修复材料的多功能化,主要方法是复合多种材料。这种复合不是简单地混合达到性能互补的目的,如改善机械性能、中和降解产物的 pH 值、改善降解速率、促进细胞黏附和增殖等,而是赋予材料更多的功能。如 Liu 等[73]开发的乙腈环三聚体结合了荧光性能和诱导成骨能力,这种材料在需要生物成像和骨修复的生物医学应用方面具有巨大潜力;Cai 等[74]设计了一种由 rhBMP-2、搭载抗生素的 nHA 以及藻酸盐/明胶凝胶组成的多功能生物材料,这种材料具有抗菌、减轻炎症、增强新骨和血管形成的功能;向生物活性玻璃体系中添加银离子、铜离子和锶离子可以使其具有杀菌功能[75];通过载药体系,甚至可以使材料具备抗癌能力[76]。而就目前来讲,添加活性因子是一种切实可行的实现骨修复材料多功能化的方法。
3.2.2. 添加活性因子
骨修复材料已经由惰性材料发展至具有一定成骨能力的活性材料。为了进一步提高材料的生物活性和成骨能力,研究者开始将生物活性分子结合于材料表面。在生物活性分子中,与具有较长氨基酸序列的活性蛋白相比,成骨相关多肽因合成成本低、稳定性强,更适合与材料结合用于骨修复 [77]。通常可利用非共价与共价两种方式将成骨相关多肽结合于材料表面。由于非共价作用力较弱,成骨相关多肽往往不能与材料有效结合,而且会在初始阶段引发爆释,所以多肽的作用不能得到明显发挥[78]。而共价方式则有效地提高了多肽与材料之间的作用力,延长了植入体内后的相互作用时间,可控制分子取向,使功能化表面具有较高的稳定性,更有利于多肽在体内缓慢释放,从而有利于多肽作用的发挥[79]。
但是,已有研究表明通过共价方式将活性分子结合到材料上会在一定程度上影响材料活性[80],不同的共价结合对生物分子活性的影响也可能不同[81]。目前的研究大多只是指出所研究的共价结合可能会对生物分子活性造成影响,缺乏揭示共价结合对生物分子活性影响规律的系统研究。
将骨生长因子与胶原结合结构域(collagen-binding domain,CBD)组合,制成可特异性结合胶原的融合蛋白,是近年来新兴的一种用于开发基于胶原的骨修复材料的方法。这种方法为生长因子提供了合适的递送载体,使其能在骨缺损部位持续稳定释放,且不会改变生长因子的天然生物活性。大鼠体内实验表明,与植入 DBM 同时施用相同浓度的 bFGF 相比,搭载 CBD-bFGF 的 DBM 可加速大鼠股骨缺损处的新骨形成[82]。
3.3. 优化结构
大段骨缺损的修复效果往往取决于骨修复材料的结构。因为材料结构,特别是材料表面结构,会影响细胞接种效率、细胞反应、血管生成以及最终的骨形成。结构参数包括孔径和孔隙率、孔隙形状和纤维取向和表面性质等。例如,小孔有利于细胞接种,但限制细胞活力、细胞增殖和分化;孔径的几何形状影响细胞的排列和再生骨的结构[83]。因此,许多研究者探究了不同的材料组合、制备方法、制备工艺,以优化材料结构,进而获得更优的性能。
新的制备方法不断被开发,其中 3D 打印是当前的研究热点。传统的骨组织工程支架材料仅是对天然骨化学组成的简单模仿,并未再现天然骨组织多级结构。与传统支架加工工艺相比,3D 生物打印技术不仅可以提供定制化的材料外部结构,还可以控制支架内部微结构,为多级多尺度复杂组织的重建提供了可能。这种便捷地制备形状可控的多孔支架材料的技术,已被广泛应用于生物材料和骨组织工程领域[84-86]。3D 打印支架具有多孔结构,将材料植入缺损部位后,营养物质和细胞会沿着孔向内渗入支架内部,进而有利于骨组织向内长入,最终促进骨缺损的修复[85]。3D 打印的主要局限在于打印分辨率不足以实现理想微结构的打印,低温 3D 打印技术或许是解决这一局限性的有效手段[87]。
运用仿生学原理和纳米自组装技术模仿天然骨的成分及结构特征,也是目前骨修复材料研究的前沿课题。Liu 等[88]提出改良的“自下而上”仿生矿化法制备三维拓扑结构的纤维内矿化胶原(hierarchical intrafibrillarly-mineralized collagen,HIMC)。实验结果表明,仿生合成的 HIMC 支架材料具有与天然骨极其相似的纳米结构,能够更好地促进干细胞在支架材料表面的黏附、增殖与矿化,且具有与天然骨类似的应力分散能力及降解速率;体内研究表明在 HIMC 支架材料引导下生成的新骨量更多,分布更广,尤其是新生骨胶原与天然骨胶原的排列及机械性能一致。
“功能梯度材料”这个概念也引起了骨修复材料领域的关注。功能梯度材料的组成、微观结构以及相关特性可以在空间上有所变化,而人体骨骼本身就可以被认为是分级材料,因此功能梯度材料可能是骨科移植物的理想候选者,因为功能梯度可以被设计成模仿原始骨组织的性质。使用功能梯度材料有望降低应力屏蔽效应以及骨-种植体结合界面处的有害剪切应力[89]。
除了对材料的整体结构优化,作为直接与人体组织接触的材料表面,对其进行优化也是提升材料性能的一个重要手段。表面改性是一种目前常用的对材料表面结构与功能进行优化的方法。骨修复材料表面改性可改善材料表面的物理化学性质、增强细胞在材料表面的黏附和与材料表面的相互作用,从而有效提高骨修复材料的细胞相容性[90-91]。目前常用的表面改性方法有表面涂层、接枝、等离子体改性等。但是表面涂层容易剥落,接枝改性过程繁琐,等离子体处理则由于等离子体侵入深度有限而受到限制[92],为此,下一步应着眼于研究更简单有效的表面改性方法。
通过表面改性方法以及一些特殊的制备工艺,即可实现材料表面的图案化,近年来研究者对图案化应用于骨修复领域也进行了探索。如 Sankar 等[93]制备了微图案化的 SU-8 纳米纤维,发现图案化的表面诱导了 MSCs 的成骨分化,同时细胞会沿着图案分层和旋转,类似于体内各向异性多层骨组织结构。除了成骨相关细胞,巨噬细胞的行为也会受到材料表面图案化的影响。在图案化的钛表面巨噬细胞倾向于 M2 极化,而传统钛涂层上的巨噬细胞表现出更高的 M1 极化,这种 M2 极化的倾向导致材料表面上骨诱导性细胞因子的上调,从而提供了有利的成骨微环境。因此,材料表面图案化可能是赋予植入材料良好的骨免疫调节性质的潜在方法[94]。
目前研究常用的骨修复材料结构改良方法昂贵且耗时。因此,Boccaccio 等[95]提出了一种算法,将支架的参数有限元模型与数值优化方法和计算力学调节模型相结合,用于预测最佳的骨修复支架微观结构。
4. 展望
骨修复材料是修复人体骨组织缺损高效可行的方法,但目前尚无完全符合要求的骨修复材料,特别是用于大段骨缺损修复的材料。主要存在以下问题:① 骨组织修复过程中血运重建缓慢,因此有必要开发新的加快血管化的方法;② 骨修复材料与自体骨组织的整合也存在问题,表面优化和载药控释或许是可行的解决手段;③ 目前许多研究忽略了免疫细胞和破骨细胞的重要性,理想的骨修复材料应同时具备促进成骨向分化、抑制破骨细胞以及调节巨噬细胞的功能;④ 材料降解速率与组织生长速率不够匹配,需要系统研究体内生物力学环境下材料结构和力学性能变化,材料降解以及骨组织再生之间的关系规律,以优化骨修复材料。随着对成骨机制研究的深入、生物材料领域的不断发展以及材料科学技术的进步,有望研制出符合人体骨修复要求的理想材料。
Biography
李晓明,工学博士,教授、博士生导师,北京市科技新星,教育部新世纪优秀人才,霍英东青年教师基金获得者。主要从事生物材料和组织工程等方面的研究工作,以第一作者发表 SCI 论文 40 余篇,SCI 引用 2 000 余次,出版专著 3 部。现任中国生物材料学会仿生材料分会副主任委员;兼任《Biomaterials Advances》主编,《Journal of Nanomaterials》、《Biomed Research International》、《International Journal of Polymer Science》等杂志首席客座编辑
Funding Statement
国家自然科学基金资助项目(31771042);先进材料教育部重点实验室开放课题(2018AML06);高等学校学科创新引智计划(B13003)
National Natural Science Foundation of China (31771042); Funds of Key Laboratory of Advanced Materials of Ministry of Education (2018AML06); Program of Introducing Talents of Discipline to Universities (B13003)
Contributor Information
瑜波 樊 (Yubo FAN), Email: yubofan@buaa.edu.cn.
晓明 李 (Xiaoming LI), Email: x.m.li@hotmail.com.
References
- 1.Li X, van Blitterswijk CA, Feng Q, et al The effect of calcium phosphate microstructure on bone-related cells in vitro . Biomaterials. 2008;29(23):3306–3316. doi: 10.1016/j.biomaterials.2008.04.039. [DOI] [PubMed] [Google Scholar]
- 2.Li X, Liu H, Niu X, et al The use of carbon nanotubes to induce osteogenic differentiation of human adipose-derived MSCs in vitro, and ectopic bone formation in vivo . Biomaterials. 2012;33(19):4818–4827. doi: 10.1016/j.biomaterials.2012.03.045. [DOI] [PubMed] [Google Scholar]
- 3.Midha S, Murab S, Ghosh S Osteogenic signaling on silk-based matrices. Biomaterials. 2016;97:133–153. doi: 10.1016/j.biomaterials.2016.04.020. [DOI] [PubMed] [Google Scholar]
- 4.Chen Z, Wu C, Gu W, et al Osteogenic differentiation of bone marrow MSCs by β-tricalcium phosphate stimulating macrophages via BMP2 signalling pathway. Biomaterials. 2014;35(5):1507–1518. doi: 10.1016/j.biomaterials.2013.11.014. [DOI] [PubMed] [Google Scholar]
- 5.Chen Z, Wu C, Yuen J, et al Influence of osteocytes in the in vitro and in vivo β-tricalcium phosphate-stimulated osteogenesis . J Biomed Mater Res Part A. 2014;102(8):2813–2823. doi: 10.1002/jbm.a.34954. [DOI] [PubMed] [Google Scholar]
- 6.Zhang X, Zu H, Zhao D, et al Ion channel functional protein kinase TRPM7 regulates Mg ions to promote the osteoinduction of human osteoblast via PI3K pathway: In vitro simulation of the bone-repairing effect of Mg-based alloy implant . Acta Biomater. 2017;63:369–382. doi: 10.1016/j.actbio.2017.08.051. [DOI] [PubMed] [Google Scholar]
- 7.Liu H, Xu GW, Wang YF, et al Composite scaffolds of nano-hydroxyapatite and silk fibroin enhance mesenchymal stem cell-based bone regeneration via the interleukin 1 alpha autocrine/paracrine signaling loop. Biomaterials. 2015;49:103–112. doi: 10.1016/j.biomaterials.2015.01.017. [DOI] [PubMed] [Google Scholar]
- 8.Lin Y, Huang Y, He J, et al Role of Hedgehog-Gli1 signaling in the enhanced proliferation and differentiation of MG63 cells enabled by hierarchical micro-/nanotextured topography. Int J Nanomedicine. 2017;12:3267–3280. doi: 10.2147/IJN.S135045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pan H, Xie Y, Zhang Z, et al Hierarchical macropore/nano surface regulates stem cell fate through a ROCK-related signaling pathway. Rsc Advances. 2017;7(14):8521–8532. [Google Scholar]
- 10.Wang W, Liu Q, Zhang Y, et al Involvement of ILK/ERK1/2 and ILK/p38 pathways in mediating the enhanced osteoblast differentiation by micro/nanotopography. Acta Biomater. 2014;10(8):3705–3715. doi: 10.1016/j.actbio.2014.04.019. [DOI] [PubMed] [Google Scholar]
- 11.Liu N, Zhou M, Zhang Q, et al Stiffness regulates the proliferation and osteogenic/odontogenic differentiation of human dental pulp stem cells via the WNT signalling pathway. Cell Prolif. 2018;51(2):e12435. doi: 10.1111/cpr.12435. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Yuan H, Zhou Y, Lee MS, et al A Newly Identified Mechanism Involved in Regulation of Human Mesenchymal Stem Cells by Fibrous Substrate Stiffness. Acta Biomater. 2016;42:247–257. doi: 10.1016/j.actbio.2016.06.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chen S, Guo Y, Liu R, et al Tuning surface properties of bone biomaterials to manipulate osteoblastic cell adhesion and the signaling pathways for the enhancement of early osseointegration. Colloids Surf B Biointerfaces. 2018;164:58–69. doi: 10.1016/j.colsurfb.2018.01.022. [DOI] [PubMed] [Google Scholar]
- 14.Wu C, Xia L, Han P, et al Graphene-oxide-modified β-tricalcium phosphate bioceramics stimulate in vitro and in vivo osteogenesis . Carbon. 2015;93:116–129. [Google Scholar]
- 15.Sriram M, Sainitya R, Kalyanaraman V, et al Biomaterials mediated microRNA delivery for bone tissue engineering. Inter J Biol Macromol. 2015;74:404–412. doi: 10.1016/j.ijbiomac.2014.12.034. [DOI] [PubMed] [Google Scholar]
- 16.Ha SW, Jang HL, Nam KT, et al Nano-hydroxyapatite modulates osteoblast lineage commitment by stimulation of DNA methylation and regulation of gene expression. Biomaterials. 2015;65:32–42. doi: 10.1016/j.biomaterials.2015.06.039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chen R, Wang J, Liu C Biomaterials act as enhancers of growth factors in bone regeneration. Advanced Functional Materials. 2016;26(48):8810–8823. [Google Scholar]
- 18.Peric M, Dumic-Cule I, Grcevic D, et al The rational use of animal models in the evaluation of novel bone regenerative therapies. Bone. 2015;70(1):73–86. doi: 10.1016/j.bone.2014.07.010. [DOI] [PubMed] [Google Scholar]
- 19.Li X, Feng Q, Liu X, et al Collagen-based implants reinforced by chitin fibres in a goat shank bone defect model. Biomaterials. 2006;27(9):1917–1923. doi: 10.1016/j.biomaterials.2005.11.013. [DOI] [PubMed] [Google Scholar]
- 20.Kargozar S, Lotfibakhshaiesh N, Ai J, et al Strontium- and cobalt-substituted bioactive glasses seeded with human umbilical cord perivascular cells to promote bone regeneration via enhanced osteogenic and angiogenic activities. Acta Biomater. 2017;58:502–514. doi: 10.1016/j.actbio.2017.06.021. [DOI] [PubMed] [Google Scholar]
- 21.Durão SF, Gomes PS, Colaço BJ, et al The biomaterial-mediated healing of critical size bone defects in the ovariectomized rat. Osteoporos Int. 2014;25(5):1535–1545. doi: 10.1007/s00198-014-2656-y. [DOI] [PubMed] [Google Scholar]
- 22.Wopenka B, Pasteris JD A mineralogical perspective on the apatite in bone. Materials Science and Engineering C. 2005;25(2):131–143. [Google Scholar]
- 23.Friedman CD, Costantino PD, Takagi S, et al BoneSource hydroxyapatite cement: a novel biomaterial for craniofacial skeletal tissue engineering and reconstruction. J Biomed Mater Res. 1998;43(4):428–432. doi: 10.1002/(sici)1097-4636(199824)43:4<428::aid-jbm10>3.0.co;2-0. [DOI] [PubMed] [Google Scholar]
- 24.Zhu W, Wang D, Xiong J, et al Study on clinical application of nano-hydroxyapatite bone in bone defect repair. Artif Cells Nanomed Biotechnol. 2015;43(6):361–365. doi: 10.3109/21691401.2014.893521. [DOI] [PubMed] [Google Scholar]
- 25.Rahaman MN, Day DE, Bal BS, et al Bioactive glass in tissue engineering. Acta Biomater. 2011;7(6):2355–2373. doi: 10.1016/j.actbio.2011.03.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Nagels J, Stokdijk M, Rozing PM Stress shielding and bone resorption in shoulder arthroplasty. J Shoulder Elbow Surg. 2003;12(1):35–39. doi: 10.1067/mse.2003.22. [DOI] [PubMed] [Google Scholar]
- 27.Jacobs JJ, Gilbert JL, Urban RM Corrosion of metal orthopaedic implants. J Bone Joint Surg (Am) 1998;80(2):268–282. doi: 10.2106/00004623-199802000-00015. [DOI] [PubMed] [Google Scholar]
- 28.Vormann J Magnesium: nutrition and metabolism. Mol Aspects Med. 2003;24(1-3):27–37. doi: 10.1016/s0098-2997(02)00089-4. [DOI] [PubMed] [Google Scholar]
- 29.Seitz JM, Lucas A, Kirschner M Magnesium-based compression screws: A novelty in the clinical use of implants. JOM. 2016;68(4):1177–1182. [Google Scholar]
- 30.Lee JW, Han HS, Han KJ, et al Long-term clinical study and multiscale analysis of in vivo biodegradation mechanism of Mg alloy . Proc Natl Acad Sci U S A. 2016;113(3):716–721. doi: 10.1073/pnas.1518238113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Zhao D, Huang S, Lu F, et al Vascularized bone grafting fixed by biodegradable magnesium screw for treating osteonecrosis of the femoral head. Biomaterials. 2016;81(1):84–92. doi: 10.1016/j.biomaterials.2015.11.038. [DOI] [PubMed] [Google Scholar]
- 32.Chan BP, Hui TY, Wong MY, et al Mesenchymal stem cell-encapsulated collagen microspheres for bone tissue engineering. Tissue Eng Part C Methods. 2010;16(2):225–235. doi: 10.1089/ten.tec.2008.0709. [DOI] [PubMed] [Google Scholar]
- 33.Winkler T, Sass FA, Duda GN, et al A review of biomaterials in bone defect healing, remaining shortcomings and future opportunities for bone tissue engineering: The unsolved challenge. Bone Joint Res. 2018;7(3):232–243. doi: 10.1302/2046-3758.73.BJR-2017-0270.R1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Félix Lanao RP, Jonker AM, Wolke JG, et al Physicochemical properties and applications of poly (lactic-co-glycolic acid) for use in bone regeneration. Tissue Eng Part B Rev. 2013;19(4):380–390. doi: 10.1089/ten.teb.2012.0443. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Liu B, Song YW, Jin L, et al Silk structure and degradation. Colloids Surf B Biointerfaces. 2015;(131):122–128. doi: 10.1016/j.colsurfb.2015.04.040. [DOI] [PubMed] [Google Scholar]
- 36.Park SY, Ki CS, Park YH, et al Electrospun silk fibroin scaffolds with macropores for bone regeneration: an in vitro and in vivo study . Tissue Eng Part A. 2010;16(4):1271–1279. doi: 10.1089/ten.TEA.2009.0328. [DOI] [PubMed] [Google Scholar]
- 37.Tatara AM, Mikos AG Tissue Engineering in Orthopaedics. J Bone Joint Surg (Am) 2016;98(13):1132–1139. doi: 10.2106/JBJS.16.00299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Newman P, Minett A, Ellis-Behnke R, et al Carbon nanotubes: their potential and pitfalls for bone tissue regeneration and engineering. Nanomedicine. 2013;9(8):1139–1158. doi: 10.1016/j.nano.2013.06.001. [DOI] [PubMed] [Google Scholar]
- 39.Zhou L, Forman HJ, Ge Y, et al Multi-walled carbon nanotubes: A cytotoxicity study in relation to functionalization, dose and dispersion. Toxicology in Vitro. 2017;42:292–298. doi: 10.1016/j.tiv.2017.04.027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Li X, Zhao T, Sun L, et al The applications of conductive nanomaterials in the biomedical field. J Biomed Mater Res A. 2016;104(1):322–339. doi: 10.1002/jbm.a.35537. [DOI] [PubMed] [Google Scholar]
- 41.Mehra NK, Mishra V, Jain NK A review of ligand tethered surface engineered carbon nanotubes. Biomaterials. 2014;35(4):1267–1283. doi: 10.1016/j.biomaterials.2013.10.032. [DOI] [PubMed] [Google Scholar]
- 42.Luo Y, Shen H, Fang Y, et al Enhanced proliferation and osteogenic differentiation of mesenchymal stem cells on graphene oxide-incorporated electrospun poly (lactic-co-glycolic acid) nanofibrous mats. ACS Appl Mater Interfaces. 2015;7(11):6331–6639. doi: 10.1021/acsami.5b00862. [DOI] [PubMed] [Google Scholar]
- 43.Mo X, Wei Y, Zhang X, et al Enhanced stem cell osteogenic differentiation by bioactive glass functionalized graphene oxide substrates. Journal of Nanomaterials. 2016;4:1–11. [Google Scholar]
- 44.Li J, Gang W, Zhu H, et al Antibacterial activity of large-area monolayer graphene film manipulated by charge transfer. Sci Rep. 2014;4(3):4359–4366. doi: 10.1038/srep04359. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Justin R, Chen B Characterisation and drug release performance of biodegradable chitosan-graphene oxide nanocomposites. Carbohydr Polym. 2014;103:70–80. doi: 10.1016/j.carbpol.2013.12.012. [DOI] [PubMed] [Google Scholar]
- 46.Quade M, Schumacher M, Bernhardt A, et al Strontium-modification of porous scaffolds from mineralized collagen for potential use in bone defect therapy. Mater Sci Eng C Mater Biol Appl. 2018;84:159–167. doi: 10.1016/j.msec.2017.11.038. [DOI] [PubMed] [Google Scholar]
- 47.Zhao S, Zhang J, Zhu M, et al Three-dimensional printed strontium-containing mesoporous bioactive glass scaffolds for repairing rat critical-sized calvarial defects. Acta Biomater. 2015;12(1):270–280. doi: 10.1016/j.actbio.2014.10.015. [DOI] [PubMed] [Google Scholar]
- 48.Fernandes JS, Gentile P, Martins M, et al Reinforcement of poly-L-lactic acid electrospun membranes with strontium borosilicate bioactive glasses for bone tissue engineering. Acta Biomater. 2016;44:168–177. doi: 10.1016/j.actbio.2016.08.042. [DOI] [PubMed] [Google Scholar]
- 49.Zehbe R, Zehbe K Strontium doped poly-ε-caprolactone composite scaffolds made by reactive foaming. Mater Sci Eng C Mater Biol Appl. 2016;67:259–266. doi: 10.1016/j.msec.2016.05.045. [DOI] [PubMed] [Google Scholar]
- 50.Cruz R, Calasans-Maia J, Sartoretto S, et al Does the incorporation of zinc into calcium phosphate improve bone repair? A systematic review. Ceramics International. 2017;44(2):1240–1249. [Google Scholar]
- 51.Shepherd DV, Kauppinen K, Brooks RA, et al An in vitro study into the effect of zinc substituted hydroxyapatite on osteoclast number and activity . J Biomed Mater Res A. 2015;102(11):4136–4141. doi: 10.1002/jbm.a.35089. [DOI] [PubMed] [Google Scholar]
- 52.Montazerolghaem M, Ning Y, Engqvist H, et al Simvastatin and zinc synergistically enhance osteoblasts activity and decrease the acute response of inflammatory cells. J Mater Sci Mater Med. 2016;27(2):23. doi: 10.1007/s10856-015-5639-4. [DOI] [PubMed] [Google Scholar]
- 53.Liu P, Zhao Y, Yuan Z, et al Construction of Zn-incorporated multilayer films to promote osteoblasts growth and reduce bacterial adhesion. Mater Sci Eng C Mater Biol Appl. 2017;75:998–1005. doi: 10.1016/j.msec.2017.03.020. [DOI] [PubMed] [Google Scholar]
- 54.Zhang D, Wong CS, Wen C, et al Cellular responses of osteoblast-like cells to seventeen elemental metals. J Biomed Mater Res A. 2017;105(1):148–158. doi: 10.1002/jbm.a.35895. [DOI] [PubMed] [Google Scholar]
- 55.Bondarenko A, Angrisani N, Meyer-Lindenberg A, et al Magnesium-based bone implants: Immunohistochemical analysis of peri-implant osteogenesis by evaluation of osteopontin and osteocalcin expression. J Biomed Mater Res A. 2014;102(5):1449–1457. doi: 10.1002/jbm.a.34828. [DOI] [PubMed] [Google Scholar]
- 56.Yoshizawa S, Brown A, Barchowsky A, et al Magnesium ion stimulation of bone marrow stromal cells enhances osteogenic activity, simulating the effect of magnesium alloy degradation. Acta Biomater. 2014;10(6):2834–2842. doi: 10.1016/j.actbio.2014.02.002. [DOI] [PubMed] [Google Scholar]
- 57.Moghanian A, Sedghi A, Ghorbanoghli A, et al The effect of magnesium content on in vitro, bioactivity, biological behavior and antibacterial activity of sol-gel derived 58S bioactive glass . Ceramics International. 2018;44(8):9422–9432. [Google Scholar]
- 58.Bose S, Tarafder S, Bandyopadhyay A Effect of chemistry on osteogenesis and angiogenesis towards bone tissue engineering using 3D printed scaffolds. Ann Biomed Eng. 2016;45(1):261–272. doi: 10.1007/s10439-016-1646-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Sivakumar M, Kumar TS, Shantha KL, et al Development of hydroxyapatite derived from Indian coral. Biomaterials. 1996;17(17):1709–1714. doi: 10.1016/0142-9612(96)87651-4. [DOI] [PubMed] [Google Scholar]
- 60.Viateau V, Manassero M, Sensébé L, et al Comparative study of the osteogenic ability of four different ceramic constructs in an ectopic large animal model. J Tissue Eng Regen Med. 2016;10(3):E177–E187. doi: 10.1002/term.1782. [DOI] [PubMed] [Google Scholar]
- 61.Cadman J, Zhou S, Chen Y, et al Cuttlebone: Characterisation, application and development of biomimetic materials. Journal of Bionic Engineering. 2012;9(3):367–376. [Google Scholar]
- 62.Lambert F, Bacevic M, Layrolle P, et al Impact of biomaterial microtopography on bone regeneration: comparison of three hydroxyapatites. Clin Oral Implants Res. 2017;28(10):e201–e207. doi: 10.1111/clr.12986. [DOI] [PubMed] [Google Scholar]
- 63.Zhang G, Brion A, Willemin AS, et al Nacre, a natural, multi-use and timely biomaterial for bone graft substitution. J Biomed Mater Res A. 2017;105(2):662–671. doi: 10.1002/jbm.a.35939. [DOI] [PubMed] [Google Scholar]
- 64.Rana D, Zreiqat H, Benkirane-Jessel N, et al Development of decellularized scaffolds for stem cell-driven tissue engineering. J Tissue Eng Regen Med. 2017;11(4):942–965. doi: 10.1002/term.2061. [DOI] [PubMed] [Google Scholar]
- 65.Datta P, Chatterjee J, Dhara S Phosphate functionalized and lactic acid containing graft copolymer: synthesis and evaluation as biomaterial for bone tissue engineering applications. J Biomater Sci Polym Ed. 2013;24(6):696–713. doi: 10.1080/09205063.2012.707428. [DOI] [PubMed] [Google Scholar]
- 66.Gruskin E, Doll BA, Futrell FW, et al Demineralized bone matrix in bone repair: History and use. Adv Drug Deliv Rev. 2012;64(12):1063–1077. doi: 10.1016/j.addr.2012.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Chen G, Lv Y. Decellularized bone matrix scaffold for bone regeneration. Methods Mol Biol, 2017.[Epub ahead of print]
- 68.Cunniffe GM, Vinardell T, Murphy JM, et al Porous decellularized tissue engineered hypertrophic cartilage as a scaffold for large bone defect healing. Acta Biomater. 2015;23:82–90. doi: 10.1016/j.actbio.2015.05.031. [DOI] [PubMed] [Google Scholar]
- 69.Jeong WH, Roh TS, Kim YS, et al Acceleration of osteogenesis by platelet-rich plasma with acellular dermal matrix in a calvarial defect model. Childs Nerv Sys. 2016;32(9):1653–1659. doi: 10.1007/s00381-016-3150-y. [DOI] [PubMed] [Google Scholar]
- 70.Capati MLF, Nakazono A, Yamamoto K, et al Fish collagen promotes the expression of genes related to osteoblastic activity. International Journal of Ploymer Science. 2016;2:1–7. [Google Scholar]
- 71.Elango J, Zhang J, Bao B, et al Rheological, biocompatibility and osteogenesis assessment of fish collagen scaffold for bone tissue engineering. Int J Biol Macromol. 2016;91:51–59. doi: 10.1016/j.ijbiomac.2016.05.067. [DOI] [PubMed] [Google Scholar]
- 72.Shi M, Zhou Y, Shao J, et al Stimulation of osteogenesis and angiogenesis of hBMSCs by delivering Si ions and functional drug from mesoporous silica nanospheres. Acta Biomater. 2015;21:178–189. doi: 10.1016/j.actbio.2015.04.019. [DOI] [PubMed] [Google Scholar]
- 73.Liu X, Xie Y, Liu R, et al A cyclo-trimer of acetonitrile combining fluorescent property with ability to induce osteogenesis and its potential as multifunctional biomaterial. Acta Biomater. 2018;65:163–173. doi: 10.1016/j.actbio.2017.10.031. [DOI] [PubMed] [Google Scholar]
- 74.Cai Y, Yu J, Kundu SC, et al Multifunctional nano-hydroxyapatite and alginate/gelatin based sticky gel composites for potential bone regeneration. Materials Chemistry & Physics. 2016;181:227–233. [Google Scholar]
- 75.Fernandes JS, Gentile P, Pires RA, et al Multifunctional bioactive glass and glass-ceramic biomaterials with antibacterial properties for repair and regeneration of bone tissue. Acta Biomater. 2017;59:2–11. doi: 10.1016/j.actbio.2017.06.046. [DOI] [PubMed] [Google Scholar]
- 76.Koshy S T, Mooney DJ Biomaterials for enhancing anti-cancer immunity. Curr Opin Biotechnol. 2016;40:1–8. doi: 10.1016/j.copbio.2016.02.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Kesireddy V, Kasper FK Approaches for building bioactive elements into synthetic scaffolds for bone tissue engineering. J Mater Chem B. 2016;4(42):6773–6786. doi: 10.1039/C6TB00783J. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Costa F, Carvalho IF, Montelaro RC, et al Covalent immobilization of antimicrobial peptides (AMPs) onto biomaterial surfaces. Acta Biomater. 2011;7(4):1431–1440. doi: 10.1016/j.actbio.2010.11.005. [DOI] [PubMed] [Google Scholar]
- 79.Song SH, Lee SJ, Rhee SH Synthesis of biodegradable poly (ε-caprolactone)-organosiloxane hybrid with carboxylate groups. J Biomed Mater Res B Appl Biomater. 2012;100(5):1289–1297. doi: 10.1002/jbm.b.32695. [DOI] [PubMed] [Google Scholar]
- 80.Moeinzadeh S, Barati D, Sarvestani SK, et al Experimental and computational investigation of the effect of hydrophobicity on aggregation and osteoinductive potential of BMP-2-derived peptide in a hydrogel matrix. Tissue Eng Part A. 2015;21(1-2):134–146. doi: 10.1089/ten.tea.2013.0775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Lieb E, Hacker J, Tessmar J, et al Mediating specific cell adhesion to low-adhesive diblock copolymers by instant modification with cyclic RGD peptides. Biomaterials. 2005;26(15):2333–2341. doi: 10.1016/j.biomaterials.2004.07.010. [DOI] [PubMed] [Google Scholar]
- 82.Uchida K, Matsushita O, Naruse K, et al Acceleration of periosteal bone formation by human basic fibroblast growth factor containing a collagen-binding domain from Clostridium histolyticum collagenase. J Biomed Mater Res A. 2014;102(6):1737–1743. doi: 10.1002/jbm.a.34841. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Bobbert FSL, Zadpoor AA Effects of bone substitute architecture and surface properties on cell response, angiogenesis, and structure of new bone. Journal of Materials Chemistry B. 2017;5(31):6175–6192. doi: 10.1039/c7tb00741h. [DOI] [PubMed] [Google Scholar]
- 84.Li X, Cui R, Sun L, et al 3D-Printed biopolymers for tissue engineering application. International Journal of Polymer Science. 2014;2014(24):1–13. [Google Scholar]
- 85.Guvendiren M, Molde J, Soares R, et al Designing biomaterials for 3D printing. ACS Biomater Sci Eng. 2016;2(10):1679–1693. doi: 10.1021/acsbiomaterials.6b00121. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Feng C, Zhang W, Deng C, et al 3D printing of lotus root-like biomimetic materials for cell delivery and tissue regeneration. Adv Sci (Weinh) 2017;4(12):1700401. doi: 10.1002/advs.201700401. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Lai Y, Cao H, Wang X, et al Porous composite scaffold incorporating osteogenic phytomolecule icariin for promoting skeletal regeneration in challenging osteonecrotic bone in rabbits. Biomaterials. 2018;153:1–13. doi: 10.1016/j.biomaterials.2017.10.025. [DOI] [PubMed] [Google Scholar]
- 88.Liu Y, Liu S, Luo D, et al Hierarchically staggered nanostructure of mineralized collagen as a bone-grafting scaffold. Adv Mater. 2016;28(39):8740–8748. doi: 10.1002/adma.201602628. [DOI] [PubMed] [Google Scholar]
- 89.Sola A, Bellucci D, Cannillo V Functionally graded materials for orthopedic applications - an update on design and manufacturing. Biotechnol Adv. 2016;34(5):504–531. doi: 10.1016/j.biotechadv.2015.12.013. [DOI] [PubMed] [Google Scholar]
- 90.Tverdokhlebov SI, Bolbasov EN, Shesterikov EV, et al Modification of polylactic acid surface using RF plasma discharge with sputter deposition of a hydroxyapatite target for increased biocompatibility. Applied Surface Science. 2015;329:32–39. [Google Scholar]
- 91.van Oirschot BA, Eman RM, Habibovic P, et al Osteophilic properties of bone implant surface modifications in a cassette model on a decorticated goat spinal transverse process. Acta Biomater. 2016;37:195–205. doi: 10.1016/j.actbio.2016.03.037. [DOI] [PubMed] [Google Scholar]
- 92.Huang S, Liang N, Hu Y, et al Polydopamine-assisted surface modification for bone biosubstitutes. Biomed Res Int. 2016;2016:2389895. doi: 10.1155/2016/2389895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Sankar S, Kakunuri M, Eswaramoorthy SD, et al Effect of patterned electrospun hierarchical structures on alignment and differentiation of mesenchymal stem cells: Biomimicking bone. Journal of Tissue Engineering & Regenerative Medicine. 2018;12(4):e2073–e2084. doi: 10.1002/term.2640. [DOI] [PubMed] [Google Scholar]
- 94.Zhang Z, Xie Y, Pan H, et al Influence of patterned titanium coatings on polarization of macrophage and osteogenic differentiation of bone marrow stem cells. J Biomater Appl. 2018;32(7):977–986. doi: 10.1177/0885328217746802. [DOI] [PubMed] [Google Scholar]
- 95.Boccaccio A, Uva AE, Fiorentino M, et al A mechanobiology-based algorithm to optimize the microstructure geometry of bone tissue scaffolds. Int J Biol Sci. 2016;12(1):1–17. doi: 10.7150/ijbs.13158. [DOI] [PMC free article] [PubMed] [Google Scholar]