Abstract
脊髓损伤修复迄今仍是世界性的医学难题。戴建武教授团队近 20 年来专注脊髓损伤再生修复研究,建立了哺乳动物脊髓大段缺损全横断损伤模型,包括啮齿类、犬及非人灵长类全横断脊髓损伤模型,并于 2015 年 1 月 16 日在国际上首先开展了神经再生胶原支架材料修复完全性脊髓损伤的临床研究。文章依据领域研究进展,分析了脊髓完全性损伤后运动功能恢复的 3 种可能机制:① 运动神经长轴突再生通过损伤区域;② 损伤区新生的神经元连接损伤的两个断端,形成连接;③ 前述两种机制都存在。大量不同动物全横断脊髓损伤模型及再生修复研究结果均表明,神经再生胶原支架移植治疗全横断脊髓损伤动物是通过引导内源神经元形成桥接改善运动功能。在不同脊髓损伤模型中,特别是大段缺损全横断脊髓损伤模型中,长的轴突生长非常有限,无法满足动物运动功能恢复的要求。在全横断脊髓损伤动物模型中,通过功能修饰的神经再生胶原支架移植促进新神经元产生并形成桥接改善运动功能相比引导运动轴突再生更可行,是全横断脊髓损伤后运动功能恢复的主要机制。但在再生修复时如何促进更多的神经元产生、形成正确的桥接并实现更好的运动功能恢复等都是亟待解决的重要问题。
Keywords: 脊髓损伤, 运动轴突再生, 神经干细胞, 生物支架
Abstract
Spinal cord injury (SCI), especially the complete SCI, usually results in complete paralysis below the level of the injury and seriously affects the patient’s quality of life. SCI repair is still a worldwide medical problem. In the last twenty years, Professor DAI Jianwu and his team pioneered complete SCI model by removing spinal tissue with varied lengths in rodents, canine, and non-human primates to verify therapeutic effect of different repair strategies. Moreover, they also started the first clinical study of functional collagen scaffold on patients with acute complete SCI on January 16th, 2015. This review mainly focusses on the possible mechanisms responsible for complete SCI. In common, recovery of some sensory and motor functions post complete SCI include the following three contributing reasons. ① Regeneration of long ascending and descending axons throughout the lesion site to re-connect the original targets; ② New neural circuits formed in the lesion site by newly generated neurons post injury, which effectively re-connect the transected stumps; ③ The combined effect of ① and ②. The numerous studies have confirmed that neural circuits rebuilt across the injury site by newborn neurons might be the main mechanisms for functional recovery of animals from rodents to dogs. In many SCI model, especially the complete spinal cord transection model, many studies have convincingly demonstrated that the quantity and length of regenerated long descending axons, particularly like CST fibers, are too few to across the lesion site that is millimeters in length to realize motor functional recovery. Hence, it is more feasible in guiding neuronal relays formation by bio-scaffolds implantation than directing long motor axons regeneration in improving motor function of animals with complete spinal cord transection. However, some other issues such as promoting more neuronal relays formation, debugging wrong connections, and maintaining adequate neural circuits for functional recovery are urgent problems to be addressed.
Keywords: Spinal cord injury, motor axon regeneration, neural stem cells, bio-scaffold
脊髓损伤后,因脊髓组织受损会导致损伤节段以下部分或完全性的感觉及运动功能缺失[1]。由外部物理撞击导致的创伤性脊髓损伤,伤后早期主要表现为严重的脊髓组织损伤及神经细胞死亡,之后会引发严重的继发性损伤,如局部缺血、炎症、大量神经元和少突胶质细胞死亡、胶质瘢痕以及囊性空洞形成等[2]。近年研究发现,成年哺乳动物创伤性脊髓损伤后的原发及继发性损伤会逐渐改变损伤部位的细胞组成及组织结构,最终在损伤部位形成一个阻止轴突再生的抑制微环境。此外,除了抑制微环境形成外,成年神经元的内在生长潜力较差也是导致脊髓自发再生可能性低的重要因素,最终导致永久性神经缺损[3-6]。但有研究发现,通过调节神经细胞的内在生长潜力或移除脊髓损伤微环境中的某些抑制因素(单一或组合),一些成年神经元和轴突仍具有一定再生能力[5, 7-11]。
虽然脊髓损伤不会显著影响患者寿命,但可能导致患者生理和心理问题,高昂的治疗费用也会给患者家庭及社会带来沉重负担[12]。目前,脊髓损伤的临床治疗仍集中在稳定病变组织结构,防止对邻近脊髓组织的进一步损害,以及通过康复提高患者生活自理能力[13-14],尚缺少有效促进神经再生和功能恢复的治疗方案,而完全性脊髓损伤的修复被认为是临床研究中最具挑战性的问题之一[15]。
近年,动物实验研究已为创伤性脊髓损伤的治疗提供了一些新的概念和可行方案,并显示出临床转化潜力。我们团队在近 20 年的脊髓损伤再生修复研究中,成功建立了哺乳动物脊髓大段缺损完全损伤模型,包括啮齿类、犬及非人灵长类模型,在临床研究中也取得了突破性进展。现对神经再生胶原支架移植治疗完全性脊髓损伤动物实验研究的成果,以及通过引导内源性神经元形成桥接改善运动功能的相关研究进展进行总结,并探讨完全性脊髓损伤动物中运动功能改善的机制,旨在为下一步完全性脊髓损伤的相关研究提供参考。
1. 全横断脊髓损伤动物模型制备相关研究
近年用于脊髓损伤修复基础研究及治疗评价的创伤性脊髓损伤动物模型较多,包括挫伤、挤压伤、横切及化学损伤等不同致伤因素制备的模型[16-17]。与上述创伤性脊髓损伤模型相比,完全性脊髓损伤模型完全排除了轴突芽生的可能性,可以真实反映轴突再生情况,为研究轴突再生提供了最理想的平台[18]。目前,许多研究人员将完全性脊髓损伤动物模型作为检验神经再生的金标准。与啮齿类动物模型相比,大动物(如犬)模型在损伤症状、不良预后和康复训练等方面与临床患者更相似[19],近十年间完全性脊髓损伤模型从啮齿动物到大动物逐渐得到改进和完善[20]。但是,由于轴突纤维和脊髓神经元的缺失,完全性脊髓损伤模型制备后实验动物会出现永久性瘫痪以及一系列继发性并发症,如褥疮、骨质疏松、深静脉血栓、尿路感染、肌肉痉挛和呼吸并发症等[20],因此术后护理要求极高,提高了该类模型使用的难度[21-23]。
在完全性脊髓损伤模型修复研究过程中,我们团队建立了大鼠 3~6 mm 缺损的全横断急性及陈旧性脊髓损伤模型,通过自主研发的神经再生胶原支架结合再生因子或生物拮抗分子[24-27]、人 MSCs[28]、神经干细胞[27, 29]等进行修复,治疗后大鼠运动功能均不同程度恢复[30]。我们还率先建立了犬 5 mm~2 cm 急性及陈旧性脊髓损伤模型[20, 31-36],通过 6 批次近 300 只犬的实验,证实神经再生胶原支架结合神经再生因子或生物拮抗分子[31-32, 36]、人 MSCs[33]可有效促进损伤部位神经再生及犬运动功能的恢复[20]。此外,我们还成功制备了恒河猴 T9 长段(6 mm)急性全横断脊髓损伤模型,并通过此模型验证了神经再生胶原支架复合生长因子 NT3 在神经损伤修复中的作用。术后 10 个月,与空白对照组以及单纯支架材料组相比,实验组恒河猴运动诱发电位以及后肢运动功能明显改善,损伤区内的胶质瘢痕沉积明显减少,而且可见更多的有序神经纤维再生、轴突髓鞘化以及突触形成。
2. 用于修复完全性脊髓损伤的神经再生胶原支架制备及相关研究
随着生物材料领域的发展,许多生物支架也应用于各种类型脊髓损伤修复,部分生物支架显示出了一定的临床应用潜力。研究表明,功能生物支架移植可促使损伤部位产生运动神经元,包括五羟色胺能(5-HT 阳性)、乙酰胆碱能(chAT 阳性)、多巴胺能(TH 阳性)神经元[26, 33, 36-37]。这表明基于功能修饰的生物材料治疗方案可以有效促进脊髓损伤部位的神经再生,恢复运动功能。
在脊髓损伤修复中使用的生物支架大多是由重复单元组成的天然聚合物,其具有容易获得、抗原性低、生物相容性好和可降解等优势[38]。一种理想的修复脊髓损伤的生物支架需要具备以下性质:① 生物支架能为受损的轴突和神经元的重新生长和迁移提供结构上的支持;② 生物支架具有可调节的生化特性,与脊髓组织机械特性相匹配,而且能够引导神经元及轴突的生长及迁移[39];③ 生物支架应易于使用某些具有生物活性的多肽或蛋白因子进行修饰或功能化,实现特定的修复效果;④ 移植入体内的生物支架可以在适当时间内降解,被再生神经组织所替代;⑤ 生物支架及其降解产物无细胞毒性且免疫原性低。我们团队在近 20 年的研究中,设计研发了一系列神经再生胶原支架,将其移植至损伤造成的缺口时能起到连接两断端的作用。这些功能修饰后的神经再生胶原支架不仅能在脊髓横断或瘢痕切除后起到物理连接的作用,而且还可以引导内源性神经干细胞分化,促进组织再生及运动功能恢复[40]。
特定的生长因子对组织再生修复具有促进作用。为了实现结合在功能胶原生物支架上的生长因子能长时间缓释,我们构建了胶原结合肽(collagen-binding domain,CBD)修饰的生长因子 BDNF(CBD-BDNF),与神经再生胶原支架结合治疗完全性脊髓损伤比格犬(实验组),观察发现治疗 38 周后,与空白对照组相比,实验组胶质瘢痕明显减少,而且大量神经纤维可以长入损伤区域,超过 40% 的犬在 26~38 周可以站立甚至行走[32]。
由于完全性脊髓损伤后激活的神经干细胞表达 EGF 受体(EGF receptor,EGFR),因此我们利用临床药物西妥昔单抗(一种 EGFR 的抗体)与神经再生胶原支架共同孵育,并将修饰后支架移植至大鼠全横断脊髓损伤模型的损伤部位。损伤后 15 d,可见内源激活的神经干细胞在损伤部位富集和分化。而在犬全横断脊髓损伤模型中,移植西妥昔单抗修饰功能生物材料 9 个月后,可以部分恢复运动诱发电位反应,显著改善后肢的运动功能[36]。
为了进一步实现结合在胶原支架上的西妥昔单抗长时间缓释,我们构建了特异性结合 EGFR 抗体的神经再生胶原支架。我们选取了 EGFR 抗体西妥昔单抗蛋白上的功能单元 Fab,结合一段 CBD,成功构建 CBD-Fab 表达载体。在确认修饰后的蛋白生物活性保持不变后,我们将 CBD-Fab 修饰的神经再生胶原支架移植入完全性脊髓损伤大鼠中。结果表明,该支架可以通过与神经干细胞表面 EGFR 结合,特异性吸附神经干细胞,促进其在损伤部位存留及向神经元分化,同时还可以降低胶质瘢痕的沉积,改善大鼠运动功能[26]。而且,将该神经再生胶原支架与外源性神经干细胞一同移植入完全性脊髓损伤大鼠的损伤区,体外移植及体内损伤激活的神经干细胞均会被特异性吸附并存留在支架上,且外源及内源神经干细胞均能分化为神经元[27]。
除了西妥昔单抗及其功能单元外,我们近期研究还证实载有抗癌药物紫杉醇的神经再生胶原支架能够有效促进犬长距离脊髓全横断损伤后的轴突再生、神经元再生、电生理和运动功能恢复[34]。此外,将人 MSCs 及外源神经干细胞复合胶原神经再生支架进行移植,同样可以促进大鼠及犬的神经纤维再生、轴突髓鞘化以及突触形成,经过治疗的比格犬可以用瘫痪的后肢站立甚至行走[28-29, 33, 35]。
在临床前研究的基础上,我们于 2015 年 1 月 16 日首次开展了神经再生胶原支架移植治疗完全性脊髓损伤的临床研究。在前期 5 例患者中,首次采用术中电生理等手段鉴定神经组织和瘢痕组织,并实施了对瘢痕组织的安全清除,同时进行神经再生胶原支架的移植。经过 1 年的随访,结果表明神经再生胶原支架移植治疗脊髓损伤安全可行[41]。随后的研究表明,神经再生胶原支架结合 MSCs 可以促进部分陈旧性完全性脊髓损伤患者植物神经功能改善、感觉平面下降以及手指的运动功能改善等[42]。在急性脊髓损伤临床研究中,建立了综合 ASIA 评分、影像学和电生理等的严格急性完全性脊髓损伤判定标准,目前已入组 10 余例急性脊髓损伤患者,部分入组患者出现较准确的大小便感觉,下肢出现自主的运动功能恢复,并伴随有中断的感觉诱发电位和运动诱发电位的恢复。
综上所述,经过因子、拮抗剂修饰或复合干细胞的神经再生胶原支架可以有效促进神经再生,实现全横断损伤啮齿动物及犬的运动功能恢复。
3. 完全性脊髓损伤运动功能恢复机制研究
鉴于完全性脊髓损伤模型在轴突再生验证研究中的有效作用,近年来已有越来越多的研究人员运用这种完全性脊髓损伤,尤其是应用胸段完全性脊髓损伤模型(可以完全截断下肢的上行及下行神经传导)来研究神经再生及下肢运动功能的恢复。这些研究使用了很多单一或者组合的治疗策略,如生长因子[43]、生物活性拮抗剂或多肽[18, 24-27]、临床用药[36, 44]、外源细胞移植[27, 33, 35, 37, 45-51],以及功能性生物支架移植[24-27, 29, 32-36, 52-56],这些治疗策略对完全性脊髓损伤动物的神经再生或运动功能恢复均有不同程度的作用,也对脊髓损伤后功能恢复的机制进行了初步探讨。目前研究认为完全性脊髓损伤运动功能恢复机制有 3 种可能的理论,分别为长的运动轴突再生穿过损伤区,损伤区神经元形成桥接连接损伤的两个断端,或者两者兼具。
3.1. 运动神经轴突再生理论
研究表明,损伤区的抑制微环境阻碍了轴突再次生长,在无有效干预下,切断的轴突不太可能自发延伸甚至穿过损伤区,更不可能与它原定的或新的靶向神经元形成连接[57]。因此,一些研究人员尝试通过改善完全性横断后的微环境来促进运动功能的恢复,如通过外周神经搭桥、细胞移植、生物工程方法构建基质或支架等。
在完全性脊髓损伤动物治疗研究中,在损伤部位常能检测到再生的运动性轴突,主要包括组成皮质脊髓束(corticospinal tract,CST)、缝核脊髓束、网状脊髓束和红核脊髓束的轴突。这些调节运动功能的下行神经纤维束对改善动物的运动功能非常重要。其中,CST 由于在自主性运动功能恢复中的关键作用备受关注。许多研究者认为,在严重脊髓损伤后,CST 的再生可能是恢复前肢和后肢运动功能的方法。
回顾分析近十年来完全性脊髓损伤动物轴突再生及运动功能恢复的研究[18, 24-27, 33, 35-37, 43-50, 52-54, 56, 58-65],我们发现超过一半的研究通过不同的治疗策略显著改善了完全性脊髓损伤动物的运动功能,常用方法包括人工构建神经支架或基质移植修复,同时还可以结合药物、蛋白因子、各种外源性细胞(如雪旺细胞、嗅神经鞘胶质细胞、神经干细胞、MSCs、少突胶质前体细胞、骨髓基质细胞)以及其他替代物。这些研究均表明,某些截断的轴突在损伤后会继续生长,包括五羟色胺能、乙酰胆碱能及多巴胺能的轴突。但是,这些研究中几乎都没能发现完全性截断后的脊髓中有 CST 轴突延伸或穿过损伤区。
早期研究结果表明,只有将大鼠胚胎期脊髓移植至大鼠全横断损伤模型的损伤部位,才有可能支持 CST 轴突的再生[66]。在近期的一项研究中,Kadoya 等[59]将从胚胎期 14 d 的大鼠脊髓原基中分离获得的神经前体细胞移植入 T3 段完全截断的大鼠模型中,发现部分 CST 轴突可以再生,最长达 1.5 mm。除了胚胎期脊髓移植外,Yang 等[54]将壳聚糖材料复合神经营养因子 NT3 移植至完全性横断脊髓大鼠损伤区,发现治疗 1 个月后小部分 CST 纤维可以从头端长入损伤区域,穿过 5 mm 长的损伤区域,进入大鼠尾椎脊髓。但是,CST 纤维的这种再生仍需要通过标记技术得到更准确的结果,以验证其可信度和可重复性。
在对 CST 轴突再生或芽生的研究中,人们发现了许多抑制或促进因素。在抑制信号通路中研究最多的是 Nogo 介导的抑制信号通路[67-70] 以及雷帕霉素靶蛋白 mTOR 的抑制因子磷酸酶-张力蛋白基因(phosphatase and tensin homolog,PTEN) [71-74]。但是,这些研究使用的模型并非完全性横断脊髓损伤,而是挤压伤或背侧半横切损伤。在 CST 轴突再生的研究中,即使是脊髓完全性挤压伤模型中,仍有可能存在残留的 CST 轴突,其结果也备受争议。
即使不考虑模型类型及 CST 能否再生,CST 轴突的再生或芽生与运动功能恢复间的关系同样难以定论。Jin 等[75]的研究发现,条件性敲除感觉运动皮层中细胞因子激活通路的抑制因子 SOCS3,可以促进未损伤的 CST 轴突向去神经化的脊髓中芽生。此外,如果同时敲除 PTEN,CST 轴突芽生的数量及训练后的运动功能恢复程度都会显著提高。同时,Geoffroy 等[76]也发现 PTEN 及 PTEN/Nogo 敲除的小鼠中,虽然 CST 轴突的芽生明显增强,但小鼠功能恢复并不明显。上述研究报道结果中运动功能恢复的差异可能与不同基因敲除小鼠的运动功能恢复程度不同,以及 CST 轴突的芽生数量及其与尾端靶向神经元的成功连接与否有关,但也使学者们对啮齿动物中 CST 在运动功能中的作用提出了质疑。
目前,研究发现了越来越多可以促进 CST 轴突芽生或再生的蛋白因子,如肝配蛋白 B3 及其受体 EphA4[77-78]、Krüppel 样因子 7[79]、信号转导及转录激活因子 3[80]、传统型蛋白激酶 C[81]、转录因子 Sox11[82]及 mTOR 的靶蛋白核糖体 S6 激酶 1[83]。虽然这些研究都表明在非完全性脊髓损伤的啮齿动物中 CST 轴突可以延伸穿过损伤区,但由于模型的局限性,这些结论都很难证实是否是截断的 CST 轴突的再生。因此,仍需在完全性横断的脊髓损伤模型中证实是否存在与运动功能相关的 CST 轴突的再生。
迄今为止,最新的关于 CST 再生的综述为 2012 年由 Tuszynski 及 Steward 发表的[57]。有一些研究认为观察到 CST 再生的现象缺乏时间及可重复性的检验。因此,在完全性脊髓损伤动物中通过脊髓移植或人工构建支架移植使 CST 纤维再生缺乏足够的文献证实。
综上所述,对于脊髓损伤后 CST 轴突的生长,已有的研究大多认为其主要是通过残存的完整的神经纤维芽生来实现功能恢复;而即使是有部分横断的 CST 生长,其再生距离和数量也非常有限,迄今尚缺乏客观研究证实全横断后运动轴突(如 CST 轴突)可以再生穿过损伤缺口实现运动功能恢复。由目前的研究结果来看,通过 CST 轴突长距离再生实现完全性脊髓损伤动物的运动功能恢复的可行性仍未可知。
3.2. 内源性神经桥接理论
在全横断脊髓损伤的啮齿动物及犬模型中,很多治疗方案都可以显著改善动物模型运动功能。由于全横断后运动轴突(如 CST 轴突)再生机制至今仍未明确,有些学者提出在重新连接截断的脊髓束并恢复运动功能中起重要作用的并非运动轴突再生,而是外源或内源神经元分化形成桥接,连接损伤的两个断端[36-37, 51, 54, 84]。移植或内源的神经干细胞可以定向分化成多种神经元,在损伤部位形成神经桥接,促使新的突触连接,形成环路,改善脊髓损伤后动物的运动功能[36-37, 54]。基于这种理论,外源神经干细胞/神经前体细胞近年来被广泛应用于脊髓损伤的治疗。在动物实验中,外源神经干细胞/神经前体细胞移植后可分化为神经细胞,补充损伤部位缺失的神经元及营养因子,重新形成神经桥接,促进运动功能的恢复[37, 47, 85-86]。
但是,外源神经干细胞/神经前体细胞移植应用于临床还面临巨大的挑战。首先,除存在的伦理问题外,从人的胚胎组织中获得的神经前体细胞仍存在成瘤的风险;其次,由于成人自体神经前体细胞很难获得,接受同种异体神经前体细胞移植的患者必须通过免疫抑制来减弱免疫排斥反应;再次,成人神经前体细胞的体外扩增目前还非常困难,使得临床上很难获得足够量的细胞进行移植[87]。最后,移植用神经前体细胞最合适的来源、数量,给药途径及移植的方式目前都不清楚[87]。因此,我们重点关注人工构建的神经再生胶原支架引导内源神经干细胞发挥作用,来改善啮齿动物和犬的运动功能的进展。
3.2.1. 内源神经干细胞来源
许多研究已证明,位于成体脊髓中央管中的室管膜细胞具有神经干细胞样潜能[88-89]。这些细胞在正常组织中并不活动,但在损伤后的脊髓组织中会被激活并迁移至损伤部位[88, 90-91]。在脑缺血或中风后,脑组织中的神经干细胞会分化为神经元,并替代受损的神经元,修复神经连接[92-93]。但是,被激活的室管膜细胞在损伤后 4 周内倾向于分化为胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)阴性(未成熟的)的星形胶质细胞(占所有星形胶质细胞的 53%),并未分化为神经元[94]。其余 47% 由幼稚星形胶质细胞分化的 GFAP 阳性(成熟的)的星形胶质细胞会积聚在损伤区中央,并形成密集的胶质瘢痕,这是小鼠受伤 2 周后轴突再生的主要障碍[95-96]。
近年来,研究认为巢蛋白(nestin)/脑脂质结合蛋白(brain lipid binding protein,BLBP)阳性的神经干细胞存在于中央管及正常脊髓中,据此我们在 T8 段脊髓全横断损伤的大鼠模型中发现了体内脊髓来源的神经干细胞的激活时间轴[36]。损伤发生后,nestin 阳性的神经干细胞在损伤脊髓的邻近节段中大量聚集,在第 5 天达高峰,并随着离损伤部位的距离增加而逐渐减少。此外,中央管及脊髓中的神经干细胞与室管膜细胞的特征有所区别,中央管中由损伤激活的神经干细胞可被常规的神经干细胞标记物 nestin 和 BLBP 所标记,但却不能被干细胞的标记物 Sox2 标记,而中央管中的室管膜细胞可以被这 3 种标记物同时标记。Yang 等及我们近期研究均表明,脊髓完全性截断后,小部分 nestin 阳性的神经干细胞会自发分化为神经元,这种分化效率会随着药物的使用而提高[36, 54]。上述研究结果提示,如果经过适当的引导,内源神经干细胞可能相比室管膜细胞更有可能成为治疗完全性脊髓损伤的一种细胞来源。
3.2.2. 神经再生胶原支架作用
通过啮齿动物及犬的全横断脊髓损伤模型进行大量脊髓损伤再生修复研究后,我们发现虽然神经再生胶原支架很难在脊髓完全性横断后促进运动轴突的再生,但研究结果均支持完全性脊髓损伤后运动功能恢复机制中的第 2 种理论,即经过功能性修饰后的神经再生胶原支架可以引导内源性神经干细胞分化,形成神经桥接,重新连接损伤的两个断端,实现完全性横断的脊髓损伤动物的运动功能改善。
在将小鼠 T8 段脊髓完全截断 5 d 后,大部分被激活的神经干细胞会聚集在邻近损伤部位的脊髓组织中,而只有很少一部分出现在损伤区中心[36]。这是由于完全性横断会造成脊髓组织中一定长度缺口,如果缺乏适合的引导,被损伤激活的神经干细胞就无法迁移。在利用神经再生胶原支架结合西妥昔单抗治疗完全性脊髓损伤大鼠的研究中,在损伤后 15 d,虽然不同治疗组损伤部位的头端及尾端都观察到相似数量的神经干细胞,但功能修饰的神经再生胶原支架移植组与单纯神经再生胶原支架移植组相比,损伤中心部位神经干细胞的密度明显更高[36]。我们近期的一系列研究表明,被损伤激活的神经干细胞不会自发地迁移至损伤部位,而经过适当修饰的功能支架可以在适当的时间释放和分布生物活性因子,引导内源神经干细胞的迁移路线[26-27, 30, 36, 97]。
除了在大鼠完全性脊髓损伤模型中证明了特定修饰的神经再生胶原支架可以促进内源损伤激活的神经干细胞在损伤部位富集及分化外,我们研究还证实了大动物(犬)的完全性脊髓损伤模型中同样存在神经发生。在移植后 9 个月,我们在损伤部位同样观察到了更多成熟的神经元[36],而且这些神经元可以在损伤部位发育为具有髓鞘化轴突及突触结构的各种功能神经元,如五羟色胺能、乙酰胆碱能及多巴胺能神经元[36]。基于以上研究结果,我们提出了功能修饰的神经再生胶原支架可以引导损伤激活的神经干细胞分化为神经元,形成神经桥接,连接损伤的两个断端,进而促进运动功能恢复的理论[40, 42, 98]。
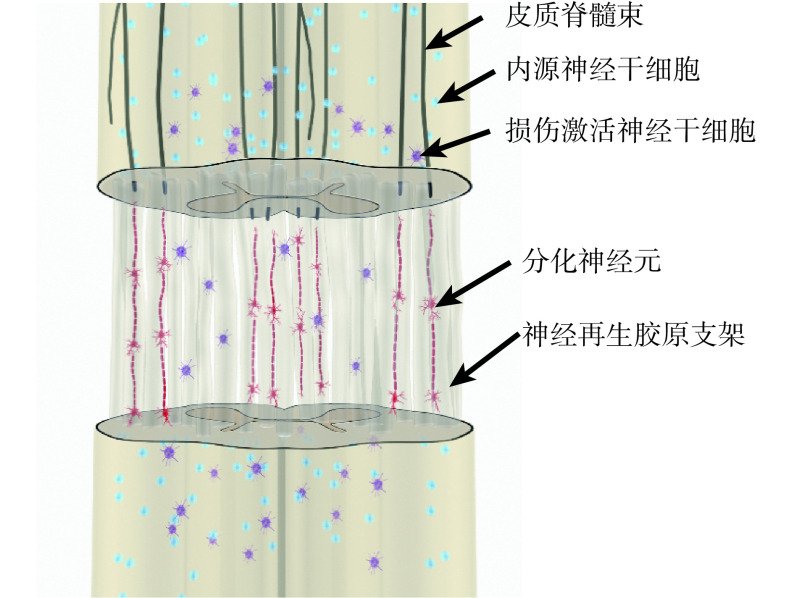
综上述,相关研究提示在完全性脊髓损伤动物模型中,尚缺少客观充分证据证实运动轴突,尤其是 CST 轴突可以再生。因此,3 种完全性脊髓损伤运动功能恢复的可能机制中,只有第 2 种内源神经桥接机制更可行(图 1)。
图 1.
Guiding neuronal relays formation by bio-scaffolds implantation is more feasible than directing long motor axons regeneration in improving motor function of animals with complete spinal cord transection
完全性脊髓损伤后,皮质脊髓束无法再生穿过损伤部 位;功能修饰的神经再生胶原支架可以引导损伤激活的 内源神经干细胞分化为神经元,形成神经桥接,连接 损伤的两个断端,促进运动功能恢复
成功引导内源脊髓神经干细胞迁移至损伤部位只是完全性脊髓损伤后形成新的神经桥接并恢复运动功能的第一步,这些迁移至损伤部位的神经干细胞及其子代如何才能向神经元分化、成熟并形成新的功能连接,是接下来需要考虑和解决的问题。
4. 展望
大量研究表明,仅阻断细胞外抑制因素促进受伤轴突或长脊髓束再生无明显效果,在神经元中可能存在重要细胞和分子机制来控制轴突再生[8-9, 11, 15, 99-102]。目前报道的组合治疗策略中,尚无一种能很好地在全横断脊髓损伤动物中促进运动轴突(如 CST)长距离生长并穿过损伤区。由于 CST 轴突是控制人体自主运动功能最重要的运动轴突,可能必须有足够的 CST 纤维再生穿过损伤区,并与原定的尾端靶向神经元精确联接,才能显著地促进运动功能的恢复。
因此,引导内源神经干细胞的再生可能是除了 CST 轴突再生之外更为可行的恢复运动功能的策略。虽然严重的脊髓损伤使大量的神经元丢失、神经回路被扰乱、运动功能严重受损,但也同时激活了处于静息状态的内源脊髓神经干细胞。如果能够引导这些神经干细胞及其子代迁移至损伤部位,它们就会为神经功能重建提供充足的细胞来源。因此,损伤激活的内源神经干细胞是一种潜在的治疗细胞源。然而,将这种方法用于临床尚有大量问题需要解决。成体动物脊髓损伤后,内源脊髓神经干细胞(包括室管膜细胞)已被证实可以被损伤激活并大量扩增[103],但尚无研究报道导致脊髓神经干细胞激活和向损伤区边缘迁移的原因或诱导因素,相关机制也未明确。此外,不同内源神经干细胞的分化能力及分化特性可能也存在差异。成年室管膜细胞在体外培养时会表现出类似神经干细胞的特性,具有多能性,可分化为星形胶质细胞、少突胶质细胞及神经元[93],但体内的室管膜细胞在脊髓损伤后并不能分化为神经元,而且我们的研究也发现,与有定向神经元分化能力的神经干细胞相比,室管膜细胞在体内表现出非常不同的分化特性[36]。
完全性脊髓损伤后修复的主要目的是重建受损的神经环路。因此,明确损伤后激活的内源性脊髓神经干细胞的分化能力和特性,以及影响不同细胞向神经元分化的因子和信号通路对于形成神经元桥接、连接损伤断端来说是亟待解决的问题。将修饰后的功能神经胶原支架移植入损伤部位,构建适合神经元分化的微环境,可以有效引导损伤激活的神经干细胞分化形成更多的神经元及少突胶质细胞,进而促进损伤部位的神经再生、髓鞘化,重建损伤部位的神经桥接。
即使在损伤部位有足够的神经再生、轴突髓鞘化,形成充足的神经桥接,有时运动功能的恢复也不如预期。如 Lu 等的研究发现,在大鼠 T3 全横断脊髓损伤的亚急性期,通过移植过表达 BDNF 大鼠 MSCs 后可以观察到损伤部位神经桥接及突触的形成,但运动功能反而变得更差。事实上,一些关于促进轴突再生的研究也表明,CST 再生也直接导致了运动功能恶化[49, 104]。这种神经桥接的形成与运动功能恶化之间矛盾的原因可能是由于再生的轴突未能与下游靶向神经元形成正确的突触连接造成的。因此,如何在重建神经桥接中促进新生轴突与下游靶向神经元间形成正确而有效的连接,是今后设计全横断脊髓损伤治疗方案时必须要考虑的重要问题。
Biography
戴建武:中国科学院遗传与发育生物学研究所研究员,中国科学院“百人计划”入选者;国家杰出青年基金获得者;国务院政府特殊津贴获得者。戴建武再生医学团队突破了再生医学产品研发的关键技术,研制了基于胶原蛋白的能有效引导组织再生的智能生物材料系列产品,率先组织领导了包括子宫内膜再生、脊髓损伤再生、心肌再生、卵巢早衰再生修复等多个产品的临床研究。主持国家自然科学基金重点项目、中国科学院干细胞与再生医学战略性先导科技专项项目等省部级以上重大项目 20 余项;是连续两届国家重点科学研究计划干细胞专项项目(973 管理)首席科学家,国家重点研发计划项目首席科学家。在 Cell、Circulation、Stem Cells、Biomaterials 等杂志上发表 SCI 论文 200 余篇,被引用 4 000 余次。申请及获授权国内外专利 30 余项,获国家科学技术进步奖二等奖 1 项,中央电视台 2014 年度十大科技创新人物,第六届中国侨界再生医学创新成果奖,2017 年中国细胞生物学会干细胞生物学分会干细胞成果转化奖
Funding Statement
国家重点研发计划(2016YFC1101500、2017YFA0104700);中国科学院重点部署项目(ZDRW-ZS-2016-2)
National Key Research and Development Program of China (2016YFC1101500, 2017YFA0104700); Key Research Program of the Chinese Academy of Sciences (ZDRW-ZS-2016-2)
References
- 1.Thuret S, Moon L, Gage FH Therapeutic interventions after spinal cord injury. Nature Reviews Neuroscience. 2006;7(8):628–643. doi: 10.1038/nrn1955. [DOI] [PubMed] [Google Scholar]
- 2.Ahuja CS, Wilson JR, Nori S, et al Traumatic spinal cord injury. Nat Rev Dis Primers. 2017;3:17018. doi: 10.1038/nrdp.2017.18. [DOI] [PubMed] [Google Scholar]
- 3.He Z, Koprivica V The Nogo signaling pathway for regeneration block. Annu Rev Neurosci. 2004;27:341–368. doi: 10.1146/annurev.neuro.27.070203.144340. [DOI] [PubMed] [Google Scholar]
- 4.Filbin MT Recapitulate development to promote axonal regeneration: good or bad approach? Philos Trans R Soc Lond B Biol Sci. 2006;361(1473):1565–1574. doi: 10.1098/rstb.2006.1885. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Fitch MT, Silver J CNS injury, glial scars, and inflammation: Inhibitory extracellular matrices and regeneration failure. Exp Neurol. 2008;209(2):294–301. doi: 10.1016/j.expneurol.2007.05.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Kadoya K, Tsukada S, Lu P, et al Combined intrinsic and extrinsic neuronal mechanisms facilitate bridging axonal regeneration one year after spinal cord injury. Neuron. 2009;64(2):165–172. doi: 10.1016/j.neuron.2009.09.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Giger RJ, Venkatesh K, Chivatakarn O, et al Mechanisms of CNS myelin inhibition: evidence for distinct and neuronal cell type specific receptor systems. Restor Neurol Neurosci. 2008;26(2-3):97–115. [PMC free article] [PubMed] [Google Scholar]
- 8.Sun F, He Z Neuronal intrinsic barriers for axon regeneration in the adult CNS. Curr Opin Neurobiol. 2010;20(4):510–518. doi: 10.1016/j.conb.2010.03.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Liu K, Tedeschi A, Park KK, et al Neuronal intrinsic mechanisms of axon regeneration. Annu Rev Neurosci. 2011;34:131–152. doi: 10.1146/annurev-neuro-061010-113723. [DOI] [PubMed] [Google Scholar]
- 10.McCreedy DA, Sakiyama-Elbert SE Combination therapies in the CNS: engineering the environment. Neurosci Lett. 2012;519(2):115–121. doi: 10.1016/j.neulet.2012.02.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Tedeschi A, Bradke F Spatial and temporal arrangement of neuronal intrinsic and extrinsic mechanisms controlling axon regeneration. Curr Opin Neurobiol. 2017;42:118–127. doi: 10.1016/j.conb.2016.12.005. [DOI] [PubMed] [Google Scholar]
- 12.Selvarajah S, Hammond ER, Haider AH, et al The burden of acute traumatic spinal cord injury among adults in the united states: an update. J Neurotrauma. 2014;31(3):228–238. doi: 10.1089/neu.2013.3098. [DOI] [PubMed] [Google Scholar]
- 13.Wilson JR, Forgione N, Fehlings MG Emerging therapies for acute traumatic spinal cord injury. Canadian Medical Association Journal. 2013;185(6):485–492. doi: 10.1503/cmaj.121206. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Dvorak MF, Noonan VK, Fallah N, et al The influence of time from injury to surgery on motor recovery and length of hospital stay in acute traumatic spinal cord injury: an observational Canadian cohort study. J Neurotrauma. 2015;32(9):645–654. doi: 10.1089/neu.2014.3632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Giger RJ, Hollis ER 2nd, Tuszynski MH Guidance molecules in axon regeneration. Cold Spring Harb Perspect Biol. 2010;2(7):a001867. doi: 10.1101/cshperspect.a001867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kwon BK, Oxland TR, Tetzlaff W Animal models used in spinal cord regeneration research. Spine (Phila Pa 1976) 2002;27(14):1504–1510. doi: 10.1097/00007632-200207150-00005. [DOI] [PubMed] [Google Scholar]
- 17.Akhtar AZ, Pippin JJ, Sandusky CB Animal models in spinal cord injury: a review. Rev Neurosci. 2008;19(1):47–60. doi: 10.1515/revneuro.2008.19.1.47. [DOI] [PubMed] [Google Scholar]
- 18.Han Q, Jin W, Xiao Z, et al The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 2010;31(35):9212–9220. doi: 10.1016/j.biomaterials.2010.08.040. [DOI] [PubMed] [Google Scholar]
- 19.Jeffery ND, Lakatos A, Franklin RJ Autologous olfactory glial cell transplantation is reliable and safe in naturally occurring canine spinal cord injury. J Neurotrauma. 2005;22(11):1282–1293. doi: 10.1089/neu.2005.22.1282. [DOI] [PubMed] [Google Scholar]
- 20.Han S, Li X, Xiao Z, et al Complete canine spinal cord transection model: a large animal model for the translational research of spinal cord regeneration. Sci China Life Sci. 2018;61(1):115–117. doi: 10.1007/s11427-017-9049-y. [DOI] [PubMed] [Google Scholar]
- 21.Raineteau O, Schwab ME Plasticity of motor systems after incomplete spinal cord injury. Nat Rev Neurosci. 2001;2(4):263–273. doi: 10.1038/35067570. [DOI] [PubMed] [Google Scholar]
- 22.Courtine G, Song B, Roy RR, et al Recovery of supraspinal control of stepping via indirect propriospinal relay connections after spinal cord injury. Nat Med. 2008;14(1):69–74. doi: 10.1038/nm1682. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Rosenzweig ES, Courtine G, Jindrich DL, et al Extensive spontaneous plasticity of corticospinal projections after primate spinal cord injury. Nat Neurosci. 2010;13(12):1505–1510. doi: 10.1038/nn.2691. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Li X, Han J, Zhao Y, et al Functionalized collagen scaffold neutralizing the myelin-inhibitory molecules promoted neurites outgrowth in vitro and facilitated spinal cord regeneration in vivo . ACS Appl Mater Interfaces. 2015;7(25):13960–13971. doi: 10.1021/acsami.5b03879. [DOI] [PubMed] [Google Scholar]
- 25.Li X, Han J, Zhao Y, et al Functionalized collagen scaffold implantation and cAMP administration collectively facilitate spinal cord regeneration. Acta Biomater. 2016;30:233–245. doi: 10.1016/j.actbio.2015.11.023. [DOI] [PubMed] [Google Scholar]
- 26.Fan C, Li X, Xiao Z, et al A modified collagen scaffold facilitates endogenous neurogenesis for acute spinal cord injury repair. Acta Biomater. 2017;51:304–316. doi: 10.1016/j.actbio.2017.01.009. [DOI] [PubMed] [Google Scholar]
- 27.Xu B, Zhao Y, Xiao Z, et al A Dual Functional Scaffold Tethered with EGFR Antibody Promotes Neural Stem Cell Retention and Neuronal Differentiation for Spinal Cord Injury Repair. Adv Healthc Mater. 2017;6(9):12. doi: 10.1002/adhm.201601279. [DOI] [PubMed] [Google Scholar]
- 28.Wang N, Xiao Z, Zhao Y, et al Collagen scaffold combined with human umbilical cord-derived mesenchymal stem cells promote functional recovery after scar resection in rats with chronic spinal cord injury. J Tissue Eng Regen Med. 2018;12(2):e1154–e1163. doi: 10.1002/term.2450. [DOI] [PubMed] [Google Scholar]
- 29.Li, X, Liu SM, Zhao YN, et al Training neural stem cells on functional collagen scaffolds for severe spinal cord injury repair. Advanced Functional Materials. 2016;26(32):5835–5847. [Google Scholar]
- 30.Zhao Y, Xiao Z, Chen B, et al The neuronal differentiation microenvironment is essential for spinal cord injury repair. Organogenesis. 2017;13(3):63–70. doi: 10.1080/15476278.2017.1329789. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Han S, Wang B, Jin W, et al The collagen scaffold with collagen binding BDNF enhances functional recovery by facilitating peripheral nerve infiltrating and ingrowth in canine complete spinal cord transection. Spinal Cord. 2014;52(12):867–873. doi: 10.1038/sc.2014.173. [DOI] [PubMed] [Google Scholar]
- 32.Han S, Wang B, Jin W, et al The linear-ordered collagen scaffold-BDNF complex significantly promotes functional recovery after completely transected spinal cord injury in canine. Biomaterials. 2015;41:89–96. doi: 10.1016/j.biomaterials.2014.11.031. [DOI] [PubMed] [Google Scholar]
- 33.Han S, Xiao Z, Li X, et al Human placenta-derived mesenchymal stem cells loaded on linear ordered collagen scaffold improves functional recovery after completely transected spinal cord injury in canine. Sci China Life Sci. 2018;61(1):2–13. doi: 10.1007/s11427-016-9002-6. [DOI] [PubMed] [Google Scholar]
- 34.Yin W, Li X, Zhao Y, et al Taxol-modified collagen scaffold implantation promotes functional recovery after long-distance spinal cord complete transection in canines. Biomater Sci. 2018;6(5):1099–1108. doi: 10.1039/c8bm00125a. [DOI] [PubMed] [Google Scholar]
- 35.Li X, Tan J, Xiao Z, et al Transplantation of hUCMSCs seeded collagen scaffolds reduces scar formation and promotes functional recovery in canines with chronic spinal cord injury. Sci Rep. 2017;7:43559. doi: 10.1038/srep43559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Li X, Zhao Y, Cheng S, et al Cetuximab modified collagen scaffold directs neurogenesis of injury-activated endogenous neural stem cells for acute spinal cord injury repair. Biomaterials. 2017;137:73–86. doi: 10.1016/j.biomaterials.2017.05.027. [DOI] [PubMed] [Google Scholar]
- 37.Lu P, Wang Y, Graham L, et al Long-distance growth and connectivity of neural stem cells after severe spinal cord injury. Cell. 2012;150(6):1264–1273. doi: 10.1016/j.cell.2012.08.020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Jenkins AD, Kratochvil P, Stepto RFT, et al Glossary of basic terms in polymer science. Pure and Applied Chemistry. 1996;68(12):2287–2311. [Google Scholar]
- 39.Williams DF On the mechanisms of biocompatibility. Biomaterials. 2008;29(20):2941–2953. doi: 10.1016/j.biomaterials.2008.04.023. [DOI] [PubMed] [Google Scholar]
- 40.Xiao ZF, Chen B, Dai JW Building the regenerative microenvironment with functional Biomaterials for spinal cord injury repair. Journal of Spine. 2016;S7:005. [Google Scholar]
- 41.Xiao Z, Tang F, Tang J, et al One-year clinical study of NeuroRegen scaffold implantation following scar resection in complete chronic spinal cord injury patients. Sci China Life Sci. 2016;59(7):647–655. doi: 10.1007/s11427-016-5080-z. [DOI] [PubMed] [Google Scholar]
- 42.Zhao Y, Tang F, Xiao Z, et al Clinical study of NeuroRegen scaffold combined with human mesenchymal stem cells for the repair of chronic complete spinal cord injury. Cell Transplant. 2017;26(5):891–900. doi: 10.3727/096368917X695038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Fan J, Xiao Z, Zhang H, et al Linear ordered collagen scaffolds loaded with collagen-binding neurotrophin-3 promote axonal regeneration and partial functional recovery after complete spinal cord transection. J Neurotrauma. 2010;27(9):1671–1683. doi: 10.1089/neu.2010.1281. [DOI] [PubMed] [Google Scholar]
- 44.Ibarra A, Hernández E, Lomeli J, et al Cyclosporin-A enhances non-functional axonal growing after complete spinal cord transection. Brain Res. 2007;1149:200–209. doi: 10.1016/j.brainres.2007.02.056. [DOI] [PubMed] [Google Scholar]
- 45.Guest JD, Herrera L, Margitich I, et al Xenografts of expanded primate olfactory ensheathing glia support transient behavioral recovery that is independent of serotonergic or corticospinal axonal regeneration in nude rats following spinal cord transection. Exp Neurol. 2008;212(2):261–274. doi: 10.1016/j.expneurol.2008.03.010. [DOI] [PubMed] [Google Scholar]
- 46.Yang CC, Shih YH, Ko MH, et al Transplantation of human umbilical mesenchymal stem cells from Wharton’s jelly after complete transection of the rat spinal cord. PLoS One. 2008;3(10):e3336. doi: 10.1371/journal.pone.0003336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Abematsu M, Tsujimura K, Yamano M, et al Neurons derived from transplanted neural stem cells restore disrupted neuronal circuitry in a mouse model of spinal cord injury. J Clin Invest. 2010;120(9):3255–3266. doi: 10.1172/JCI42957. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Guo X, Zahir T, Mothe A, et al The effect of growth factors and soluble Nogo-66 receptor protein on transplanted neural stem/progenitor survival and axonal regeneration after complete transection of rat spinal cord. Cell Transplant. 2012;21(6):1177–1197. doi: 10.3727/096368911X612503. [DOI] [PubMed] [Google Scholar]
- 49.Lu P, Blesch A, Graham L, et al Motor axonal regeneration after partial and complete spinal cord transection. J Neurosci. 2012;32(24):8208–8218. doi: 10.1523/JNEUROSCI.0308-12.2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Hou S, Tom VJ, Graham L, et al Partial restoration of cardiovascular function by embryonic neural stem cell grafts after complete spinal cord transection. J Neurosci. 2013;33(43):17138–17149. doi: 10.1523/JNEUROSCI.2851-13.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Lu P, Woodruff G, Wang Y, et al Long-distance axonal growth from human induced pluripotent stem cells after spinal cord injury. Neuron. 2014;83(4):789–796. doi: 10.1016/j.neuron.2014.07.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Du BL, Xiong Y, Zeng CG, et al Transplantation of artificial neural construct partly improved spinal tissue repair and functional recovery in rats with spinal cord transection. Brain Res. 2011;1400:87–98. doi: 10.1016/j.brainres.2011.05.019. [DOI] [PubMed] [Google Scholar]
- 53.Gao M, Lu P, Bednark B, et al Templated agarose scaffolds for the support of motor axon regeneration into sites of complete spinal cord transection. Biomaterials. 2013;34(5):1529–1536. doi: 10.1016/j.biomaterials.2012.10.070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Yang Z, Zhang A, Duan H, et al NT3-chitosan elicits robust endogenous neurogenesis to enable functional recovery after spinal cord injury. Proc Natl Acad Sci U S A. 2015;112(43):13354–13359. doi: 10.1073/pnas.1510194112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Li X, Li M, Sun J, et al Radially aligned electrospun fibers with continuous gradient of SDF1α for the guidance of neural stem cells. Small. 2016;12(36):5009–5018. doi: 10.1002/smll.201601285. [DOI] [PubMed] [Google Scholar]
- 56.Ganz J, Shor E, Guo S, et al Implantation of 3D constructs embedded with oral mucosa-derived cells induces functional recovery in rats with complete spinal cord transection. Front Neurosci. 2017;11:589. doi: 10.3389/fnins.2017.00589. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Tuszynski MH, Steward O Concepts and methods for the study of axonal regeneration in the CNS. Neuron. 2012;74(5):777–791. doi: 10.1016/j.neuron.2012.05.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Deng L, Ruan Y, Chen C, et al Characterization of dendritic morphology and neurotransmitter phenotype of thoracic descending propriospinal neurons after complete spinal cord transection and GDNF treatment. Exp Neurol. 2016;277:103–114. doi: 10.1016/j.expneurol.2015.12.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Kadoya K, Lu P, Nguyen K, et al Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 2016;22(5):479–487. doi: 10.1038/nm.4066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Khankan RR, Griffis KG, Haggerty-Skeans JR, et al Olfactory ensheathing cell transplantation after a complete spinal cord transection mediates neuroprotective and immunomodulatory mechanisms to facilitate regeneration. J Neurosci. 2016;36(23):6269–6286. doi: 10.1523/JNEUROSCI.0085-16.2016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Knudsen EB, Moxon KA Restoration of hindlimb movements after complete spinal cord injury using brain-controlled functional electrical stimulation. Front Neurosci. 2017;11:715. doi: 10.3389/fnins.2017.00715. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Lee YS, Wu S, Arinzeh TL, et al Enhanced noradrenergic axon regeneration into schwann cell-filled PVDF-TrFE conduits after complete spinal cord transection. Biotechnol Bioeng. 2017;114(2):444–456. doi: 10.1002/bit.26088. [DOI] [PubMed] [Google Scholar]
- 63.Ren S, Liu ZH, Wu Q, et al Polyethylene glycol-induced motor recovery after total spinal transection in rats. CNS Neurosci Ther. 2017;23(8):680–685. doi: 10.1111/cns.12713. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Tian T, Yu Z, Zhang N, et al Modified acellular nerve-delivering PMSCs improve functional recovery in rats after complete spinal cord transection. Biomater Sci. 2017;5(12):2480–2492. doi: 10.1039/c7bm00485k. [DOI] [PubMed] [Google Scholar]
- 65.Yang C, Li X, Sun L, et al Potential of human dental stem cells in repairing the complete transection of rat spinal cord. J Neural Eng. 2017;14(2):026005. doi: 10.1088/1741-2552/aa596b. [DOI] [PubMed] [Google Scholar]
- 66.Coumans JV, Lin TT, Dai HN, et al Axonal regeneration and functional recovery after complete spinal cord transection in rats by delayed treatment with transplants and neurotrophins. J Neurosci. 2001;21(23):9334–9344. doi: 10.1523/JNEUROSCI.21-23-09334.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Kim JE, Li S, GrandPré T, et al Axon regeneration in young adult mice lacking Nogo-A/B. Neuron. 2003;38(2):187–199. doi: 10.1016/s0896-6273(03)00147-8. [DOI] [PubMed] [Google Scholar]
- 68.Simonen M, Pedersen V, Weinmann O, et al Systemic deletion of the myelin-associated outgrowth inhibitor Nogo-A improves regenerative and plastic responses after spinal cord injury. Neuron. 2003;38(2):201–211. doi: 10.1016/s0896-6273(03)00226-5. [DOI] [PubMed] [Google Scholar]
- 69.Zheng B, Ho C, Li S, et al Lack of enhanced spinal regeneration in Nogo-deficient mice. Neuron. 2003;38(2):213–224. doi: 10.1016/s0896-6273(03)00225-3. [DOI] [PubMed] [Google Scholar]
- 70.Lee JK, Chan AF, Luu SM, et al Reassessment of corticospinal tract regeneration in Nogo-deficient mice. J Neurosci. 2009;29(27):8649–8654. doi: 10.1523/JNEUROSCI.1864-09.2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Zukor K, Belin S, Wang C, et al Short hairpin RNA against PTEN enhances regenerative growth of corticospinal tract axons after spinal cord injury. J Neurosci. 2013;33(39):15350–15361. doi: 10.1523/JNEUROSCI.2510-13.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Lewandowski G, Steward O AAVshRNA-mediated suppression of PTEN in adult rats in combination with salmon fibrin administration enables regenerative growth of corticospinal axons and enhances recovery of voluntary motor function after cervical spinal cord injury. J Neurosci. 2014;34(30):9951–9962. doi: 10.1523/JNEUROSCI.1996-14.2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Danilov CA, Steward O Conditional genetic deletion of PTEN after a spinal cord injury enhances regenerative growth of CST axons and motor function recovery in mice. Experimental Neurology. 2015;266:147–160. doi: 10.1016/j.expneurol.2015.02.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Du K, Zheng S, Zhang Q, et al Pten deletion promotes regrowth of corticospinal tract axons 1 year after spinal cord injury. J Neurosci. 2015;35(26):9754–9763. doi: 10.1523/JNEUROSCI.3637-14.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Jin D, Liu Y, Sun F, et al Restoration of skilled locomotion by sprouting corticospinal axons induced by co-deletion of PTEN and SOCS3. Nat Commun. 2015;6:8074. doi: 10.1038/ncomms9074. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Geoffroy CG, Lorenzana AO, Kwan JP, et al Effects of PTEN and Nogo codeletion on corticospinal axon sprouting and regeneration in mice. J Neurosci. 2015;35(16):6413–6428. doi: 10.1523/JNEUROSCI.4013-14.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Fabes J, Anderson P, Brennan C, et al Regeneration-enhancing effects of EphA4 blocking peptide following corticospinal tract injury in adult rat spinal cord. Eur J Neurosci. 2007;26(9):2496–2505. doi: 10.1111/j.1460-9568.2007.05859.x. [DOI] [PubMed] [Google Scholar]
- 78.Omoto S, Ueno M, Mochio S, et al Corticospinal tract fibers cross the ephrin-B3-negative part of the midline of the spinal cord after brain injury. Neurosci Res. 2011;69(3):187–195. doi: 10.1016/j.neures.2010.12.004. [DOI] [PubMed] [Google Scholar]
- 79.Blackmore MG, Wang Z, Lerch JK, et al Krüppel-like Factor 7 engineered for transcriptional activation promotes axon regeneration in the adult corticospinal tract. Proc Natl Acad Sci U S A. 2012;109(19):7517–7522. doi: 10.1073/pnas.1120684109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Lang C, Bradley PM, Jacobi A, et al STAT3 promotes corticospinal remodelling and functional recovery after spinal cord injury. EMBO Rep. 2013;14(10):931–937. doi: 10.1038/embor.2013.117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Wang X, Hu J, She Y, et al Cortical PKC inhibition promotes axonal regeneration of the corticospinal tract and forelimb functional recovery after cervical dorsal spinal hemisection in adult rats. Cereb Cortex. 2014;24(11):3069–3079. doi: 10.1093/cercor/bht162. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Wang Z, Reynolds A, Kirry A, et al Overexpression of Sox11 promotes corticospinal tract regeneration after spinal injury while interfering with functional recovery. J Neurosci. 2015;35(7):3139–3145. doi: 10.1523/JNEUROSCI.2832-14.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Al-Ali H, Ding Y, Slepak T, et al The mTOR substrate S6 kinase 1 (S6K1) is a negative regulator of axon regeneration and a potential grug target for central nervous system injury. J Neurosci. 2017;37(30):7079–7095. doi: 10.1523/JNEUROSCI.0931-17.2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Lu P, Kadoya K, Tuszynski MH Axonal growth and connectivity from neural stem cell grafts in models of spinal cord injury. Curr Opin Neurobiol. 2014;27:103–109. doi: 10.1016/j.conb.2014.03.010. [DOI] [PubMed] [Google Scholar]
- 85.Bonner JF, Connors TM, Silverman WF, et al Grafted neural progenitors integrate and restore synaptic connectivity across the injured spinal cord. J Neurosci. 2011;31(12):4675–4686. doi: 10.1523/JNEUROSCI.4130-10.2011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Cusimano M, Biziato D, Brambilla E, et al Transplanted neural stem/precursor cells instruct phagocytes and reduce secondary tissue damage in the injured spinal cord. Brain. 2012;135(Pt 2):447–460. doi: 10.1093/brain/awr339. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Mothe AJ, Tator CH Review of transplantation of neural stem/progenitor cells for spinal cord injury. Int J Dev Neurosci. 2013;31(7):701–713. doi: 10.1016/j.ijdevneu.2013.07.004. [DOI] [PubMed] [Google Scholar]
- 88.Meletis K, Barnabé-Heider F, Carlén M, et al Spinal cord injury reveals multilineage differentiation of ependymal cells. PLoS Biol. 2008;6(7):e182. doi: 10.1371/journal.pbio.0060182. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Hamilton LK, Truong MK, Bednarczyk MR, et al Cellular organization of the central canal ependymal zone, a niche of latent neural stem cells in the adult mammalian spinal cord. Neuroscience. 2009;164(3):1044–1056. doi: 10.1016/j.neuroscience.2009.09.006. [DOI] [PubMed] [Google Scholar]
- 90.McDonough A, Martínez-Cerdeño V Endogenous proliferation after spinal cord injury in animal models. Stem Cells Int. 2012;2012:387513. doi: 10.1155/2012/387513. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Lacroix S, Hamilton LK, Vaugeois A, et al Central canal ependymal cells proliferate extensively in response to traumatic spinal cord injury but not demyelinating lesions. PLoS One. 2014;9(1):e85916. doi: 10.1371/journal.pone.0085916. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Mothe AJ, Tator CH Proliferation, migration, and differentiation of endogenous ependymal region stem/progenitor cells following minimal spinal cord injury in the adult rat. Neuroscience. 2005;131(1):177–187. doi: 10.1016/j.neuroscience.2004.10.011. [DOI] [PubMed] [Google Scholar]
- 93.Sabelström H, Stenudd M, Frisén J Neural stem cells in the adult spinal cord. Exp Neurol. 2014;260:44–49. doi: 10.1016/j.expneurol.2013.01.026. [DOI] [PubMed] [Google Scholar]
- 94.Barnabé-Heider F, Göritz C, Sabelström H, et al Origin of new glial cells in intact and injured adult spinal cord. Cell Stem Cell. 2010;7(4):470–482. doi: 10.1016/j.stem.2010.07.014. [DOI] [PubMed] [Google Scholar]
- 95.Karimi-Abdolrezaee S, Billakanti R Reactive astrogliosis after spinal cord injury-beneficial and detrimental effects. Mol Neurobiol. 2012;46(2):251–264. doi: 10.1007/s12035-012-8287-4. [DOI] [PubMed] [Google Scholar]
- 96.Hara M, Kobayakawa K, Ohkawa Y, et al Interaction of reactive astrocytes with type I collagen induces astrocytic scar formation through the integrin-N-cadherin pathway after spinal cord injury. Nat Med. 2017;23(7):818–828. doi: 10.1038/nm.4354. [DOI] [PubMed] [Google Scholar]
- 97.Li X, Dai J Bridging the gap with functional collagen scaffolds: tuning endogenous neural stem cells for severe spinal cord injury repair. Biomater Sci. 2018;6(2):265–271. doi: 10.1039/c7bm00974g. [DOI] [PubMed] [Google Scholar]
- 98.Chen B, Xiao ZF, Zhao YN, et al Functional biomaterial-based regenerative microenvironment for spinal cord injury repair. National Science Review. 2017;4(4):530–532. [Google Scholar]
- 99.Mar FM, Bonni A, Sousa MM Cell intrinsic control of axon regeneration. EMBO Rep. 2014;15(3):254–263. doi: 10.1002/embr.201337723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Kaplan A, Ong Tone S, Fournier AE Extrinsic and intrinsic regulation of axon regeneration at a crossroads. Front Mol Neurosci. 2015;8:27. doi: 10.3389/fnmol.2015.00027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Weng YL, Joseph J, An R, et al Epigenetic regulation of axonal regenerative capacity. Epigenomics. 2016;8(10):1429–1442. doi: 10.2217/epi-2016-0058. [DOI] [PubMed] [Google Scholar]
- 102.Hilton BJ, Bradke F Can injured adult CNS axons regenerate by recapitulating development? Development. 2017;144(19):3417–3429. doi: 10.1242/dev.148312. [DOI] [PubMed] [Google Scholar]
- 103.Grégoire CA, Goldenstein BL, Floriddia EM, et al Endogenous neural stem cell responses to stroke and spinal cord injury. Glia. 2015;63(8):1469–1482. doi: 10.1002/glia.22851. [DOI] [PubMed] [Google Scholar]
- 104.Takeoka A, Jindrich DL, Muñoz-Quiles C, et al Axon regeneration can facilitate or suppress hindlimb function after olfactory ensheathing glia transplantation. J Neurosci. 2011;31(11):4298–4310. doi: 10.1523/JNEUROSCI.4967-10.2011. [DOI] [PMC free article] [PubMed] [Google Scholar]