Abstract
目的
介绍一种采用自制单孔通道经腋窝切口于腔镜下行乳房皮下腺体切除术(nipple-sparing mastectomy,NSM)联合即刻乳房重建的手术方法。
方法
2017 年 1 月—2018 年 2 月,收治 15 例乳腺癌女性患者,采用自制单孔通道经腋窝切口于腔镜下行 NSM 联合即刻乳房重建。患者年龄 27~45 岁,平均 37.5 岁。乳腺癌分期 Ⅰ期 5 例、Ⅱ期 10 例。病程 1~24 个月,平均 8 个月。肿瘤位于左侧 8 例、右侧 7 例。肿瘤直径 1.5~3.0 cm,平均 2.6 cm;肿瘤距离乳头 1.8~4.0 cm,平均 2.3 cm。
结果
术后出现乳头表层皮肤坏死 1 例,皮下积液 1 例;均未出现皮下气肿、皮瓣坏死。1 例术后病理检查提示乳头后方组织阳性,行乳头切除。患者均获随访,随访时间 7~17 个月,平均 11 个月。重建乳房外观采用 Harris 评价标准:获优 4 例、良 10 例、一般 1 例。随访期间未发现肿瘤复发或转移。
结论
采用自制单孔通道经腋窝切口于腔镜下行 NSM 联合即刻乳房重建安全可行,美容效果好,为乳腺癌治疗提供了一种新选择。
Keywords: 乳腺癌, 乳房皮下腺体切除术, 腔镜, 乳房重建
Abstract
Objective
To introduce an surgical technique of endoscopic nipple-sparing mastectomy (NSM) combined with immediate breast reconstruction through simple single-port access that placed in axillary incision.
Methods
Between January 2017 and February 2018, 15 female patients with breast cancer (stageⅠ in 5 cases and stage Ⅱ in 10 cases) were treated with endoscopic NSM combined with immediate breast reconstruction through simple single-port access that placed in axillary incision. They were 27-45 years old (mean, 37.5 years). The disease duration ranged from 1 to 24 months (mean, 8 months). The tumor located at the left breast in 8 cases and at the right breast in 7 cases. The diameter of tumor ranged from 1.5 to 3.0 cm (mean, 2.6 cm). The distance between tumor and nipple was 1.8-4.0 cm (mean, 2.3 cm).
Results
After operation, the nipple epidermal necrosis occurred in 1 case, and subcutaneous effusion in 1 case. No subcutaneous emphysema or skin flap necrosis occurred. Postoperative pathological examination showed that 1 case was nipple involvement and was treated with nipple resection. All patients were followed up 7-17 months (mean, 11 months). According to the Harris assessment criteria for appearance of reconstructed breast, there were 4 cases of excellent, 10 cases of good, and 1 case of poor. No tumor recurrence or metastasis occurred during follow-up.
Conclusion
It is a safe and feasible method of endoscopic NSM combined with immediate breast reconstruction through simple single-port access that placed in axillary incision, and can obtain good cosmetic results. It is a new option to breast reconstruction.
Keywords: Breast cancer, nipple-sparing mastectomy, endoscopy, breast reconstruction
手术切除是乳腺癌治疗方法的重要组成部分,切除术后的乳房重建受到越来越多关注。乳头乳晕复合体是乳房美学的重要因素,传统乳腺癌手术或保留皮肤的乳房切除术(skin-sparing mastectomy,SSM)均切除了该复合体,导致重建的乳房美学效果不够理想。乳房皮下腺体切除术(nipple-sparing mastectomy,NSM)则保留了乳头乳晕复合体,使乳房重建后可以达到较理想的美学效果。Didier 等[1]的调查研究也显示,接受 NSM 及乳房重建治疗的乳腺癌患者,术后对自身身体外形有较高满意度。随着腔镜技术在乳腺外科的广泛应用,腔镜下乳腺癌手术因具有切口小且隐蔽的优势获得了关注。2017 年 1 月—2018 年 2 月,我们对 15 例乳腺癌患者采用经腋窝切口腔镜下 NSM 并即刻乳房重建治疗,获得较好效果。报告如下。
1. 临床资料
1.1. 一般资料
本组均为女性患者;年龄 27~45 岁,平均 37.5 岁。术前均经穿刺活检或真空辅助肿物旋切活检证实为乳腺癌,乳房皮肤无浸润;Ⅰ期 5 例、Ⅱ期 10 例。病程 1~24 个月,平均 8 个月。肿瘤位于左侧 8 例、右侧 7 例。肿瘤直径 1.5~3.0 cm,平均 2.6 cm;肿瘤距离乳头 1.8~4.0 cm,平均 2.3 cm。患者有强烈的乳房重建欲望。
1.2. 手术方法
1.2.1. 自制单孔通道
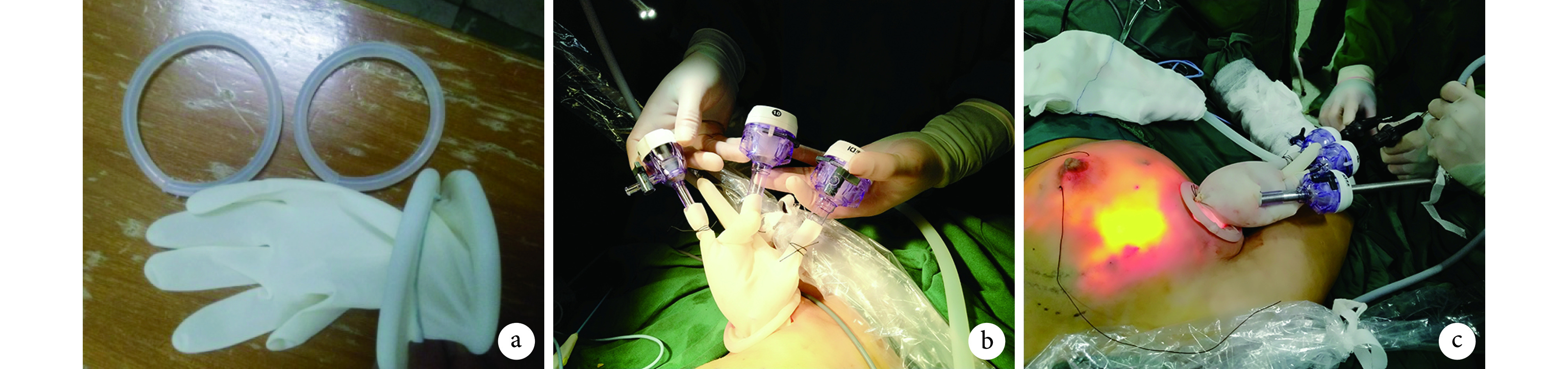
用橡胶棒制作 2 个直径 6~7 cm 的橡胶圈,取 1 只无菌手套,将手套腕部反折包裹第 1 个橡胶圈,再反折手套远端包裹第 2 个橡胶圈。用剪刀剪去拇指、中指和小指远端,经手套上的 3 个缺口分别置入直径 10 mm 的 Trocar 2 个、直径 5 mm 的 Trocar 1 个,分别用丝线固定。术中经 Trocar 置入腔镜器械。见图 1。
图 1.
The schematic diagram of simple single-port access
自制单孔通道示意图
a. 制作橡胶圈并手套包裹;b. Trocar 固定在手套内;c. 经 Trocar 置入腔镜器械
a. Rubber rings were made and coated with glove; b. Trocars were fixed in the glove; c. Endoscopic instruments were put into chest via Trocars
1.2.2. 手术操作
术前先标记乳房边缘、乳房下皱襞、胸骨正中线。气管插管全麻后,患者取平卧位,患侧上肢上展,无菌巾包裹上肢,以利于术中调整手臂位置,为经腋窝切口行 NSM 预留操作空间。
首先,行腋窝前哨淋巴结活检或腋窝淋巴结清扫。于肿瘤周围皮下多点注射亚甲蓝注射液 1 mL,按摩注射部位及周围,促进药物弥散,10 min 后进行手术。于腋窝腋毛分布区下界附近皮肤皱褶处取一顺皱褶方向、长约 5 cm 的弧形切口,切开皮肤及皮下组织,沿皮下向腋毛区方向分离,在胸小肌旁近侧胸壁切开腋筋膜,于无血管区分离,由上向下、由内向外寻找呈蓝染的淋巴结并切除,淋巴结送术中病理检查。本组 3 例病理检查结果为阳性,其中淋巴结转移 1 枚 2 例、转移 3 枚 1 例,行腋窝淋巴结清扫;12 例为阴性则保腋窝。
然后,采用自制单孔通道经腋窝切口于腔镜下行 NSM。经腋窝切口注射脂肪溶解液(含生理盐水 250 mL、灭菌注射用水 250 mL、2% 盐酸利多卡因 20 mL 和肾上腺素 1 mL),由切口皮下扇形向乳房方向注射,注射约 20 min 后进行抽脂。用带侧孔的金属钝头吸引器,经腋窝皮下扇形向乳房方向皮下抽吸脂肪。充分抽脂后,用电刀于腋窝切口下方皮下分离皮瓣,分离范围直径 6~7 cm,以有足够空间置入自制单孔通道为度。将自制单孔通道经腋窝切口置入皮下,此时乳房皮下形成一个密闭空间;连接气腹机,充 CO2,维持气压约 1 kPa。经 Trocar 置入 30° 腔镜及常规腔镜器械,先用剪刀剪断 Cooper 韧带,游离乳房皮瓣至术前标记的乳房边缘,乳头后方用剪刀锐性分离,并留取乳头后方组织 2 块;其中 1 块送术中冰冻病理检查,确认无肿瘤残留;另 1 块送术后石蜡病理检查。超声刀分离乳腺外上界,找到胸大肌,沿胸大肌筋膜下分离,逐渐向乳腺各边界分离,切除乳腺,经腋窝切口取出。注意乳房后方组织保留约 5 mm 厚。
最后行即刻乳房重建,本组 9 例采用假体重建、6 例采用背阔肌肌瓣重建。① 假体重建:超声刀分离胸大肌后间隙下方达乳房下皱襞,内侧达胸骨旁,采用 280~340 mL 扩张器(上海威宁整形制品有限公司)测试后确定植入假体大小,本组均采用美国 Mentor 公司假体,其中 180 mL 2 例、210 mL 2 例、250 mL 3 例、280 mL 1 例、300 mL 1 例。于胸大肌后植入假体,根据健侧乳房调整假体位置。缝合胸大肌外侧缘包裹假体,若胸大肌不能完全缝合者,使用补片(2 例)或分离前锯肌筋膜(3 例),与胸大肌外侧缘缝合包裹假体。术毕,于胸大肌前、后各留置引流管 1 根。② 背阔肌肌瓣重建:选择背阔肌肌瓣重建者,于平卧位时即经腋窝切口游离胸背血管及神经;然后更换为侧卧位,于背部另作切口或于腋中线及腋后线另置入 Trocar,联合腋窝切口于腔镜辅助下进行背阔肌肌瓣游离。患者背阔肌肌瓣切取范围为 14 cm×6 cm~16 cm×8 cm。再次恢复平卧位,经侧胸壁隧道将游离背阔肌肌瓣转移至前胸壁皮下,经腋窝切口切断背阔肌在肱骨附着点周围的肌束,进行重建乳房塑形,于乳房及背部皮下分别留置引流管 1 根。
1.3. 术后处理及重建乳房外观评价标准
术后密切观察乳头血运;待连续 3 d 引流管引流量少于 15 mL/d 后拔管。假体重建者穿塑形胸衣固定 3 个月,预防移位。根据术后病理检查结果,选择辅助化疗 15 例、内分泌治疗 7 例、靶向治疗 5 例。术后每 3 个月门诊复查 1 次。
重建乳房外观评价采用 Harris 评价标准[2]:优,再造乳房与健侧乳房大小基本相等,位置对称,患者非常满意;良,再造乳房与健侧乳房大小位置差异较小,着装后双乳无明显差异,患者比较满意; 一般:双侧乳房明显不对称,着装后双乳差异明显,患者不满意; 差:再造乳房严重变形。
2. 结果
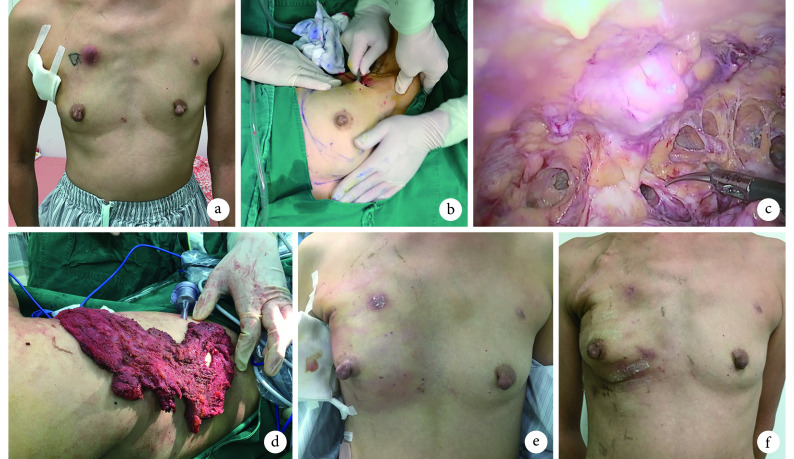
本组患者均顺利完成手术。术后病理检查提示均为浸润性导管癌,合并导管原位癌 4 例。术后 1 例出现乳头表层皮肤坏死,未作特殊处理,1 个月后表皮脱落,乳头存活良好;1 例出现皮下积液,于彩色超声引导下穿刺抽液后恢复。均未出现皮下气肿、皮瓣坏死。15 例患者乳头后组织术中冰冻病理检查均为阴性;术后病理检查提示阳性 1 例,术后 2 周行乳头切除,乳房外形改变不明显。患者均获随访,随访时间 7~17 个月,平均 11 个月。末次随访时,重建乳房外观评价获优 4 例、良 10 例、一般 1 例(术后假体移位不满意)。随访期间未发现肿瘤复发或转移。见图 2。
图 2.
A 43-year-old female patient with right breast tumor (stage Ⅱ)
患者,女,43 岁,右乳腺癌(Ⅱ期)
a. 术前乳房外观;b.术中作腋窝切口;c. 术中于腔镜下行 NSM;d.术中切取背阔肌肌瓣重建乳房;e. 术后 2 d 乳房外观;f. 术后 6 周乳房外观
a. Preoperative appearance of breast; b. The axillary incision was made during operation; c. Endoscopic NSM during operation; d. Breast was reconstructed with latissimus dorsi muscle flap; e. Appearance of breast at 2 days after operation; f. Appearance of breast at 6 weeks after operation
3. 讨论
3.1. 自制单孔通道的优势
① 避免在乳房表面或乳晕区作切口,增加美学效果。传统开放手术需在乳房表面或乳晕旁作切口进行肿物切除和重建手术,术后遗留瘢痕可能影响重建乳房外观。腔镜辅助手术仍需作乳晕区小切口,然后在腔镜辅助下切除乳腺,并经该切口植入假体 [3]。全腔镜手术一般为充气法建立操作空间,镜下完成乳腺切除,其 Trocar 入路一般位于腋窝或乳腺边缘 [2, 4-7],但需延长切口或另作腋窝切口以取出乳腺和植入假体。本组通过自制单孔通道,仅需经腋窝切口即可完成 NSM,无需在乳房表面及乳晕旁作切口,瘢痕较隐蔽,明显提高术后美学效果。
② 降低乳头的坏死率。如果在乳晕区作切口,可能增加术后乳头坏死的几率 。Ahn 等 [8]研究提示,切口方式是导致 NSM 后乳头乳晕复合体坏死的危险因素之一,因此应尽量避免在乳晕区作切口;如果不能避免,应选择在乳晕下半部作切口。Carlson 等[9]对 71 例接受 NSM 的患者进行分析发现,采用乳晕旁切口行 NSM 后,乳头坏死率较高。本组仅采用腋窝切口,有效降低了因切口导致的乳头坏死风险。
③ 采用常规腔镜手术器械即可完成手术。由于乳房无自然腔道,腔镜术中常需特殊器械辅助建立手术空间。 Ho 等 [10]报道经腋窝切口使用特殊乳腺拉钩,在腔镜辅助下完成乳腺皮瓣分离,之后在直视下切除乳腺。Lai 等[11-12]报道采用经腋窝或联合乳晕切口于腔镜下切除乳腺时,均需要特殊的乳腺拉钩,帮助建立手术空间。而本组采用常规腔镜手术器械即完成手术。
④ 于同一切口完成乳房、腋窝手术及乳房重建。蔡小勇等[13]报道了经腋窝切口单孔腔镜下切除乳腺纤维瘤的方法。我们借鉴其方法,自制单孔通道经腋窝切口完成腔镜下 NSM,同时应用同一切口行腋窝淋巴结处理及乳房重建。
⑤ 与单孔通道相比价格更低。Tukenmez 等[14]报道先通过腋窝皱襞至乳腺外侧缘 3 cm 的切口完成前哨淋巴结活检,再沿胸大肌外侧缘延长切口至 4~6 cm,经腋窝切口置入单孔通道,于腔镜下完成 NSM,最后植入假体重建乳房。该术式中采用的单孔通道价格昂贵,本组采用自制单孔通道,材料易获得,制作简便,费用低。
3.2. 手术注意事项
① 术中分离乳头后方时,建议用剪刀进行锐性分离,用电刀或其他能量外科设备分离可能导致热传导,损伤乳头乳晕真皮血管网,增加术后乳头坏死率。术中助手可向上提捏乳头或用 7 号丝线缝合于乳头皮下提拉乳头,以增加张力,便于寻找解剖层次及分离。也可以利用水分离技术分离乳头后方组织,Rossi 等[15]提出于乳晕皮下注射肾上腺素生理盐水,使乳头后方组织水肿,乳晕区皮肤与腺体间隙增大,有效降低乳头乳晕复合体游离难度以及缺血发生风险。因乳头乳晕区皮下组织少,乳管汇聚于此,乳头后方组织切除过多会增加乳头坏死发生风险,切除过少则增加乳腺组织残留几率,这是 NSM 手术难点之一。Rusby 等[16]研究发现,若保留乳头皮下组织 2 mm,即可保留 50% 乳头血供;若保留乳头皮下组织 5 mm,则可保留 68% 血供。故本组乳头后方组织保留约 5 mm,术后仅 1 例出现乳头表层皮肤坏死。② 乳房内侧胸骨旁有胸廓内动脉的肋间穿支,一旦损伤出血易导致术野不清,腋窝切口至乳房内侧距离远,镜下止血有一定难度,因此分离乳房内侧时需谨慎、注意辨别,建议采用超声刀分离。③ 吸脂过程中,为避免破坏皮瓣真皮下血管网,导致皮瓣缺血或坏死,注意勿将金属吸引头的侧孔正对着皮肤。④ 对皮下脂肪较薄患者进行吸脂操作可能存在困难,此类患者不宜通过吸脂建立手术操作空间,可采用其他方法,如非溶脂法、直接于镜下分离皮瓣等。
3.3. 手术体会
① 在完成腋窝前哨淋巴结活检或腋窝淋巴结清扫后,经腋窝切口置入自制单孔通道,其功能类似于单孔腹腔镜穿刺器,可将乳房及腋窝皮下重新形成封闭的空间,有利于充气法暴露术野,建立操作空间。解剖分离顺序建议先分离乳腺皮瓣至乳腺边缘,再将乳腺从胸大肌筋膜分离;若先分离胸大肌筋膜,因 CO2 压力会将乳腺组织向皮下及皮肤方向挤压,乳腺尚连于皮下组织,此时分离乳腺皮瓣张力不够,解剖相对困难。
② 术中用常规腔镜器械经自制单孔通道进行操作时也会存在“筷子”效应,器械手柄相互干扰,影响操作。但自制单孔通道有别于腹腔镜用的单孔通道,腹腔镜用的单孔通道上的器械通道是固定的,而自制的单孔通道由手套、橡胶圈和 Trocar 组成,Trocar 在橡胶圈中是可移动的,可以调整 Trocar 在橡胶圈中的位置,减少术中器械相互干扰。
③ 相对于腋窝的位置,乳房内下象限距离最远,而乳腺组织在乳头区域较厚,相对于腋窝切口高,分离内下象限时光源往往被腺体遮避,尤其是乳房较大的患者该现象较明显。因此,在外上象限分离后,可以先分离内上及外下象限,最后从两侧向内下象限会师。
④ 传统开放乳腺癌根治术需切除胸大肌筋膜,而全腔镜法 NSM 均用溶脂方法去除乳房后间隙的脂肪,未切除胸大肌筋膜。通过本组治疗,我们认为使用超声刀,可以不行乳房后间隙溶脂,利用超声刀分离可一并切除胸大肌筋膜。使用超声刀分离乳房内侧缘和胸大肌前筋膜时,还能对穿支血管达到良好的止血效果。
综上述,自制单孔通道经腋窝切口腔镜下 NSM 联合即刻乳房重建安全、可行,患者对重建乳房外观满意率高。但是本研究病例数少、随访时间短,且缺少对照研究,有待增加标本量及延长随访时间进一步验证效果。此外,乳房皮下抽脂操作是否会增加肿瘤皮下种植的风险,目前尚无相关报道。刘宝胤等[2]采用皮下抽脂方法建立手术操作空间,乳腔镜辅助乳腺癌腺体切除假体植入一期成形,术后随访时间 3~41 个月,均未发现肿瘤复发。本组随访亦未发现复发患者,但仍需进一步随访观察。与传统方法比较,腔镜手术时间较长,医疗费用较高,Lai 等[17]报道腔镜下乳房切除术需时约 157 min。但我们认为随着经验积累,经过一定学习曲线后可进一步缩短手术时间;虽然医疗费用较传统术式有一定增加,但由于能达到较好的美学效果,大部分有重建意愿的患者可以接受。
References
- 1.Didier F, Radice D, Gandini S, et al Does nipple preservation in mastectomy improve satisfaction with cosmetic results, psychological adjustment, body image and sexuality? Breast Cancer Res Treat. 2009;118(3):623–633. doi: 10.1007/s10549-008-0238-4. [DOI] [PubMed] [Google Scholar]
- 2.刘宝胤, 丁毅, 骆成玉, 等 乳腔镜辅助乳腺癌腺体切除假体植入一期成形 17 例报告. 中国现代手术学杂志. 2013;17(2):104–107. [Google Scholar]
- 3.张敬, 钟青, 赵长啸, 等 腔镜辅助下乳晕区小切口皮下全乳腺体切除一期假体植入术. 徐州医学院学报. 2013;33(10):673–675. [Google Scholar]
- 4.范林军, 姜军, 杨新华, 等 全腔镜乳腺癌皮下腺体切除一期假体植入乳房重建. 中国微创外科杂志. 2008;8(6):484–487. [Google Scholar]
- 5.杨华伟, 刘剑仑, 唐玮, 等 全腔镜下保留乳头乳晕皮下腺体切除术的临床应用. 广西医科大学学报. 2013;30(4):600–602. [Google Scholar]
- 6.王子函, 滕长胜, 葛智成, 等 全腔镜乳房皮下腺体切除术加腔镜前哨淋巴结活检术治疗乳腺癌的临床应用. 临床和实验医学杂志. 2015;14(15):1297–1301. [Google Scholar]
- 7.佘青, 李有怀, 程永刚, 等 全腔镜乳房皮下腺体切除术联合腔镜前哨淋巴结活检术治疗早中期乳腺癌的技巧探讨. 川北医学院学报. 2016;31(5):756–758. [Google Scholar]
- 8.Ahn SJ, Woo TY, Lee DW, et al Nipple-areolar complex ischemia and necrosis in nipple-sparing mastectomy. Eur J Surg Oncol. 2018;44(8):1170–1176. doi: 10.1016/j.ejso.2018.05.006. [DOI] [PubMed] [Google Scholar]
- 9.Carlson GW, Chu CK, Moyer HR, et al Predictors of nipple ischemia after nipple sparing mastectomy. Breast J. 2014;20(1):69–73. doi: 10.1111/tbj.12208. [DOI] [PubMed] [Google Scholar]
- 10.Ho WS, Ying SY, Chan AC Endoscopic-assisted subcutaneous mastectomy and axillary dissection with immediate mammary prosthesis reconstruction for early breast cancer. Surg Endosc. 2002;16(2):302–306. doi: 10.1007/s004640000203. [DOI] [PubMed] [Google Scholar]
- 11.Lai HW, Wu HS, Chuang KL, et al Endoscopy-assisted total mastectomy followed by immediate pedicled transverse rectus abdominis musculocutaneous (TRAM) flap reconstruction: preliminary results of 48 patients. Surg Innov. 2015;22(4):382–389. doi: 10.1177/1553350614546003. [DOI] [PubMed] [Google Scholar]
- 12.Lai HW, Chen ST, Chen DR, et al Current trends in and indications for endoscopy-assisted breast surgery for breast cancer: results from a six-year study conducted by the Taiwan Endoscopic Breast Surgery Cooperative Group. PLoS ONE. 2016;11(3):e0150310. doi: 10.1371/journal.pone.0150310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.蔡小勇, 晏益核, 潘孟 常规腔镜器械经腋窝入路行单孔乳房纤维腺瘤切除术 1 例报告. 腹腔镜外科杂志. 2012;17(2):159–160. [Google Scholar]
- 14.Tukenmez M, Ozden BC, Agcaoglu O, et al Videoendoscopic single-port nipple-sparing mastectomy and immediate reconstruction. Journal of Laparoscopic & Advanced Surgical Techniques. 2014;24(2):77–82. doi: 10.1089/lap.2013.0172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Rossi C, Mingozzi M, Curcio A, et al Nipple areola complex sparing mastectomy. Gland Surg. 2015;4(6):528–540. doi: 10.3978/j.issn.2227-684X.2015.04.12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Rusby JE, Brachtel EF, Taghian A, et al George Peters Award. Microscopic anatomy within the nipple: implications for nipple-sparing mastectomy. Am J Surg. 2007;194(4):433–437. doi: 10.1016/j.amjsurg.2007.06.019. [DOI] [PubMed] [Google Scholar]
- 17.Lai HW, Lin SL, Chen ST, et al Single-axillary-incision endoscopic-assisted hybrid technique for nipple-sparing mastectomy: technique, preliminary results, and patient-reported cosmetic outcome from preliminary 50 procedures. Ann Surg Oncol. 2018;25(5):1340–1349. doi: 10.1245/s10434-018-6383-z. [DOI] [PubMed] [Google Scholar]