Abstract
目的
探讨脂肪干细胞来源外泌体(adipose-derived stem cell released exosomes,ADSC-Exos)对人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖、迁移及管样分化的影响。
方法
取吸脂患者自愿捐赠的脂肪组织,采用酶消化法分离培养获得 ADSCs,并行流式细胞检测及成脂诱导鉴定。收集第 3 代 ADSCs 上清液提取外泌体,透射电镜观察其形态,Western blot 检测其膜表面标志性蛋白 Alix 和 CD63,用纳米颗粒跟踪分析仪 NanoSight 分析外泌体粒径分布范围。用 PKH26 荧光标记的 ADSC-Exos 与 HUVECs 共培养后,共聚焦显微镜观察 ADSC-Exos 能否进入 HUVECs。将 ADSC-Exos 与 HUVECs 共培养 1、2、3、4、5 d,CCK-8 法检测 ADSC-Exos 对 HUVECs 增殖影响;共培养 12 h 时 ELISA 法检测细胞上清液 VEGF 蛋白表达量。采用 Transwell 迁移实验检测 ADSC-Exos 对 HUVECs 迁移能力的影响。通过体外 Matrigel 基质胶实验,观察 ADSC-Exos 对 HUVECs 管状结构形成的影响;将 HUVECs 与 Matrigel 基质胶混合后联合 ADSC-Exos 注射在 BALB/c 雄性裸鼠皮下,2 周后检测基质胶中新生血管情况,计算平均血管密度(mean blood vessel density,MVD)。上述实验均以等量 PBS 作为对照。
结果
经鉴定所培养细胞符合 ADSCs 的特征。ADSC-Exos 为形态一致的圆形或椭圆形膜性囊泡,表达标志性蛋白 Alix 和 CD63,粒径范围 30~200 nm。共聚焦显微镜观察示 ADSC-Exos 可被 HUVECs 摄取。CCK-8 法检测示,各时间点实验组细胞增殖均优于对照组(P<0.05)。Transwell 实验结果显示,实验组跨膜迁移细胞数较对照组显著增多(t=9.534,P=0.000)。在体外 Matrigel 胶成管实验中,实验组管样结构数明显多于对照组(t=15.910,P=0.000);在体内实验中,实验组 MVD 亦显著高于对照组(t=16.710,P=0.000)。ELISA 检测示,实验组细胞上清液 VEGF 蛋白表达量明显高于对照组(t=21.470,P=0.000)。
结论
ADSC-Exos 可促进 HUVECs 增殖、迁移及管样结构形成,提示 ADSC-Exos 可促进血管新生。
Keywords: 脂肪干细胞, 外泌体, 血管新生, 人脐静脉血管内皮细胞
Abstract
Objective
To explore the effects of adipose-derived stem cell released exosomes (ADSC-Exos) on the proliferation, migration, and tube-like differentiation of human umbilical vein endothelial cells (HUVECs).
Methods
Adipose tissue voluntarily donated by liposuction patients was obtained. The ADSCs were harvested by enzyme digestion and identified by flow cytometry and adipogenic induction. The ADSC-Exos were extracted from the supernatant of the 3rd generation ADSCs and the morphology was observed by transmission electron microscopy. The surface proteins (Alix and CD63) were detected by Western blot. The nanoparticle tracking analyzer NanoSight was used to analyze the size distribution of ADSC-Exos. After co-culture of PKH26 fluorescently labeled ADSC-Exos with HUVECs, confocal microscopy had been used to observe whether ADSC-Exos could absorbed by HUVECs. ADSC-Exos and HUVECs were co-cultured for 1, 2, 3, 4, and 5 days. The effect of ADSC-Exos on the proliferation of HUVECs was detected by cell counting kit 8 (CCK-8) assay. The expression of VEGF protein in the supernatant of HUVECs with or without ADSC-Exos had been detected by ELISA after 12 hours. Transwell migration assay was used to detect the effect of ADSC-Exos on the migration ability of HUVECs. The effect of ADSC-Exos on the tubular structure formation of HUVECs was observed by Matrigel experiments in vitro. The formation of subcutaneous tubular structure in vivo was observed in BALB/c male nude mice via the injection of HUVECs and Matrigel with or without ADSC-Exos. After 2 weeks, the neovascularization in Matrigel was measured and mean blood vessel density (MVD) was calculated. The above experiments were all controlled by the same amount of PBS.
Results
After identification, the cultured cells were consistent with the characteristics of ADSCs. ADSC-Exos were circular or elliptical membranous vesicle with uniform morphology under transmission electron microscopy, and expresses the signature proteins Alix and CD63 with particle size ranging from 30 to 200 nm. Confocal microscopy results showed that ADSC-Exos could be absorbed by HUVECs. The CCK-8 analysis showed that the cell proliferation of the experimental group was better than that of the control group at each time point (P<0.05). The result of Transwell showed that the trans-membrane migration cells in the experimental group were significantly more than that in the control group (t=9.534, P=0.000). In vitro, Matrigel tube-forming experiment showed that the number of tube-like structures in the experimental group was significantly higher than that of the control group (t=15.910, P=0.000). In vivo, the MVD of the experimental group was significantly higher than that of the control group (t=16.710, P=0.000). The ELISA assay showed that the expression of VEGF protein in the supernatant of the experimental group was significantly higher than that of the control group (t=21.470, P=0.000).
Conclusion
ADSC-Exos can promote proliferation, migration, and tube-like structure formation of HUVECs, suggesting that ADSC-Exos can promote angiogenesisin vitro and in vivo.
Keywords: Adipose-derived stem cells, exosomes, angiogenesis, human umbilical vein endothelial cells
脂肪干细胞(adipose-derived stem cells,ADSCs)是人体储量最为丰富的 MSCs,因具有获取途径方便、对供区损伤小、干细胞储量大等优势,常用于多种组织再生与修复治疗中[1]。有研究证明,ADSCs 移植可促进血管新生[2]。进一步研究发现,移植的 ADSCs 主要通过旁分泌方式调控组织微环境,包括免疫调节、趋化宿主干细胞等[3]。
细胞外囊泡(extracellular vesicle,EV)是细胞间沟通的关键工具,通过转运蛋白质、生物活性磷脂和 RNA 等来参与细胞之间的通讯[4]。EV 共分为 3 种:凋亡小体、外泌体和微泡。其中外泌体是由体内多种细胞分泌的纳米级囊泡,其表面和内部含多种生物活性物质,包括 microRNA 及多种蛋白质[5-6]。现已明确外泌体可参与细胞间的信息交流,主要通过识别细胞表面信号分子并结合或与靶细胞膜融合,将其携带的内容物导入受体细胞,进而影响受体细胞[7]。由此可见,外泌体可影响细胞间通讯,且外泌体携带来源于亲代细胞的 microRNA、蛋白质和脂质等[3],提示 ADSCs 来源外泌体(ADSCs released exosomes,ADSC-Exos)可能在促血管形成方面有重要作用。为此,我们用 ADSC-Exos 与人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)共培养,观察 ADSC-Exos 处理后的 HUVECs 细胞增殖、迁移及管样分化情况,以期为促进血管新生提供新思路及新方法。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
SPF 级 6 周龄雄性单纯 T 细胞缺陷 BALB/c 裸鼠 12 只,体质量(20±5)g,由南昌大学实验动物中心提供。
实验用游离脂肪组织由在南昌大学第二附属医院整形美容科接受吸脂术的健康女性自愿捐赠,患者年龄 25~40 岁,本研究获医院伦理委员会批准。HUVECs 购自美国 Sciencell 公司。DMEM 培养基、FBS、0.25% 胰蛋白酶-0.02%EDTA(GIBCO 公司,美国);Ⅰ型胶原酶、地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、吲哚美辛、油红 O 染色剂、PKH26 细胞膜标记荧光染色剂(Sigma 公司,美国);鼠抗人 CD34、CD45、CD49d、CD90、CD105、CD106 多克隆抗体(eBioscience 公司,美国);Matrigel 基质胶、Transwell 小室(Corning 公司,美国);BCA 蛋白质定量试剂盒、细胞计数试剂盒 8(cell counting kit 8,CCK-8;同仁公司,日本);表面标志物 Alix、CD63、β-actin 多克隆抗体(Abcam 公司,美国)。
倒置相差显微镜(Olympus 公司,日本);流式细胞仪(BD 公司,美国);CO2 培养箱、多功能酶标仪(Thermo 公司,美国);透射电镜(ZEISS 公司,德国);纳米颗粒跟踪分析仪 NanoSight(Malvern 公司,英国);共聚焦荧光显微镜(Leica 公司,德国);超高速离心机(Beckman 公司,美国)。
1.2. ADSCs 分离培养与鉴定
无菌条件下,采集吸脂术获得的游离脂肪组织 10 mL,PBS 反复冲洗去除血液、结缔组织后,加入等体积 0.2%Ⅰ型胶原酶,置于 37℃ 恒温水浴箱消化,直至变为糊状。200 μm 金属筛网过滤后,以离心半径 20 cm、1 200 r/min 离心 5 min,弃上清,保留最下层的沉淀。培养基重悬沉淀后接种于培养瓶内,置于 37℃、5%CO2 培养箱中培养,2~3 d 后首次换液,之后每隔 1 d 换液 1 次,待细胞融合至 90% 后传代。取第 3 代细胞行 HE 染色,倒置相差显微镜下观察细胞形态变化;流式细胞术鉴定细胞表面标志性抗原 CD49d、CD90、CD105、CD34、CD45、CD106;采用成脂分化培养基诱导培养,倒置相差显微镜下观察细胞形态变化,14 d 后油红 O 染色观察成脂分化情况。
1.3. ADSC-Exos 分离纯化及鉴定
1.3.1. ADSC-Exos 分离纯化
4℃ 条件下,FBS 经 100 000×g 超速离心 7 h 后,取上清液制备去除外泌体的完全培养基。取对数生长期的第 3 代 ADSCs,用去除外泌体的完全培养基培养 48 h 后,收集上清培养液,密度梯度离心法分离、提取外泌体。具体操作如下:4℃ 条件下, 300×g 离心 10 min,弃沉淀;3 000×g 离心 20 min,弃沉淀;10 000×g 离心 30 min,弃沉淀;100 000×g 离心 70 min,收集沉淀,PBS 重悬;再次 100 000×g 离心 70 min,去上清,以 PBS 重悬,0.22 μm 滤膜过滤。将获取的 ADSC-Exos 于–80℃ 保存备用。
1.3.2. ADSC-Exos 鉴定
① 透射电镜观察 ADSC-Exos 形态:取 ADSC-Exos 10 μL 滴于透射电镜专用的载样铜网上,常温静置 2 min,滤纸吸去浮液,用 1%(W/V)磷钨酸溶液染色 5 min 后,滤纸吸去多余染色液,晾干,透射电镜观察 ADSC-Exos 形态。② Western blot 检测 ADSC-Exos 膜表面标志性蛋白:取 ADSC-Exos 以 100 000×g 离心 90 min 后,弃上清,加入 100 μL RIPA 裂解液,吹打使裂解液和 ADSC-Exos 充分混合,冰上裂解 30 min。4℃、12 000 ×g 离心 30 min,吸取上清液置于 1.5 mL EP 管中,–80℃ 冻存。BCA 法检测蛋白浓度,加入 5×Loading Buffer,99℃ 变性 10 min。取 40 μg/孔上样至 10%SDS-PAGE 胶,80 V 电泳 30 min,120 V 电泳 1 h,采用湿法转膜,220 mA 转膜 1 h,5%牛血清白蛋白室温封闭 1 h,5%牛血清白蛋白稀释一抗 Alix、CD63、β-actin,4℃ 孵育一抗过夜。TBST 漂洗 10 min,洗涤 3 次,加入二抗室温孵育 1 h,加入显影液,上机曝光。以 ADSCs 作为对照,方法步骤同上。③ ADSC-Exos 粒径分布分析:取浓度为 100 μg/mL 的 ADSC-Exos 100 μL 重悬于 1.5 mL PBS 内,经纳米颗粒跟踪分析仪 NanoSight 进行检测。
1.4. ADSC-Exos 与 HUVECs 共培养观察
1.4.1. ADSC-Exos 能否进入 HUVECs 观察
取浓度为 100 μg/mL 的 ADSC-Exos 备用液 100 μL 重悬于 1 mL PBS 内,然后加入 4 μL PKH26 荧光染料溶液,37℃ 孵育 20 min 后,将混合物于 4℃ 条件下,以 100 000×g 离心 70 min,弃上清液,并将 ADSC-Exos 轻轻重悬于 10 mL PBS 中;于 4℃ 条件下,100 000×g 离心 70 min,以去除多余染料,弃上清液,将 ADSC-Exos 重悬于 100 μL PBS 中备用。
取第 5 代 HUVECs 重悬于无血清培养基中,置于 37℃、5%CO2 培养箱中,待细胞贴壁后加入上述 PKH26 荧光标记的 ADSC-Exos,孵育 12 h 后采用 PBS 洗涤细胞 2 次,4% 多聚甲醛固定、DAPI 染色。共聚焦荧光显微镜下观察 ADSC-Exos 是否进入细胞,镜下 PKH26 荧光标记的 ADSC-Exos 呈红色荧光。
1.4.2. ADSC-Exos 对 HUVECs 增殖的影响
取对数生长期的第 5 代 HUVECs,消化离心后用无血清培养基重悬,调整细胞密度为 1×104个/mL,接种于 96 孔板,每孔 100 μL 细胞悬液。置于 37℃、5%CO2 培养箱中培养,24 h 后待细胞完全贴壁弃培养液,每孔加入无血清培养基 90 μL,然后将细胞分为两组,其中实验组添加浓度为 100 μg/mL 的 ADSC-Exos 10 μL,对照组添加等量 PBS;每孔液体体积均为 100 μL。分别培养 1、2、3、4、5 d,每组取 5 孔,每孔加入 10 μL CCK-8 溶液,继续孵育 2 h 后,采用多功能酶标仪检测各孔在 450 nm 波长下的吸光度(A)值。
1.4.3. ADSC-Exos 对 HUVECs 迁移能力的影响
取对数期生长期的第 5 代 HUVECs,用无血清培养基重悬,调整细胞密度为 2×105个/mL。实验分为两组,Transwell 上室均接种 200 μL 细胞悬液;实验组下室加入无血清培养基 500 μL 和 100 μg/mL ADSC-Exos 10 μL,对照组下室加入无血清培养基 500 μL 和 PBS 10 μL。24 h 后终止培养,用无菌棉签轻轻拭去上室残留细胞,4% 多聚甲醛固定 20 min,弃去固定液,蒸馏水漂洗 2 次,结晶紫染色 20 min,弃去染液,蒸馏水冲洗后于倒置相差显微镜下观察,每组取 6 个随机视野计数跨膜迁移细胞,取均值。实验重复 3 次。
1.4.4. ADSC-Exos 体外促进 HUVECs 管样结构形成实验
将 Matrigel 基质胶置于 96 孔板中,37℃ 孵育 30 min 使其凝固。用无血清培养基重悬第 5 代 HUVECs 后接种至 96 孔板中,每孔 2×104个细胞。实验分为两组:实验组加入含 100 μg/mL 的 ADSC-Exos 10 μL,对照组添加等量 PBS。每组 5 个复孔。于 37℃ 处理 12 h 后,倒置相差显微镜下观察管状结构形成情况,计数每孔管样结构数量。
1.4.5. ADSC-Exos 体内促进 HUVECs 成血管实验
将 1×106个 HUVECs 与 0.5 mL Matrigel 基质胶混合。取 12 只 BALB/c 裸鼠,腹腔注射 1.5% 戊巴比妥(40 mg/kg)麻醉后,将上述混合液联合 100 μL 含 ADSC-Exos(100 μg/mL)的 PBS 混悬液,共 0.6 mL,注入右侧背部皮下,作为实验组;将以上混合液联合 100 μL PBS 缓冲液,共 0.6 mL,注入左侧背部皮下,作为对照组。2 周后裸鼠同上法麻醉后背部切开,大体观察 Matrigel 基质胶凝固为胶栓,切取基质胶栓置于 4% 多聚甲醛固定 4 h,石蜡切片(片厚 5~8 μm),CD34 免疫组织化学染色,倒置相差显微镜下观察胶栓内新生血管情况,随机取 6 个视野高倍镜下计数微血管,取均值即为平均血管密度(mean blood vessel density,MVD)。
1.4.6. ELISA 法检测细胞上清液 VEGF 蛋白表达
取第 5 代 HUVECs 用无血清培养基重悬后,按 5×104个/孔密度接种至 24 孔板,实验组加入浓度为 100 μg/mL 的 ADSC-Exos 10 μL,对照组加入等量 PBS。每组 5 个复孔。37℃ 培养 12 h 后,取两组细胞上清液,采用 ELISA 试剂盒检测 VEGF 蛋白表达。同时采用 ELISA 法检测 10 μL 浓度为 100 μg/mL ADSC-Exos 中 VEGF 蛋白的表达。
1.5. 统计学方法
采用 Graphpad Prism 6 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. ADSCs 的细胞形态观察及鉴定
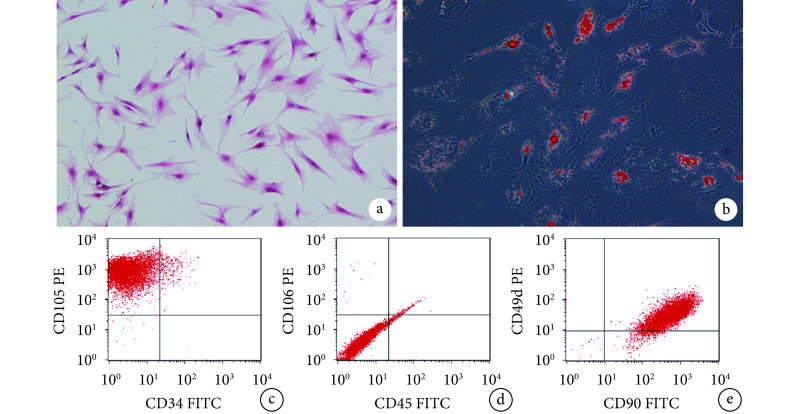
倒置相差显微镜观察示,原代细胞培养 2~3 d 后贴壁生长,7 d 左右可融合至 80%。HE 染色示,第 3 代 ADSCs 形态为均一长梭形,细胞生长密集后呈漩涡状排列,可见密集的贴壁细胞。流式细胞术结果显示,第 3 代 ADSCs 阳性表达 CD49d、CD90、CD105,阴性表达 CD34、CD45、CD106。成脂诱导培养 3 d,倒置相差显微镜下可见细胞质中有折光度高的透亮脂滴形成;培养 14 d 后脂滴逐渐增多变大,细胞形态饱满,细胞质内脂滴形成较多,并融合形成大脂滴,油红 O 染色呈阳性。见图 1。
图 1.
Identification of ADSCs
ADSCs 培养观察
a. 第 3 代 ADSCs HE 染色观察(倒置相差显微镜×100);b. 第 3 代 ADSCs 诱导 14 d 油红 O 染色观察(倒置相差显微镜×200);c~e. 第 3 代 ADSCs 流式细胞术鉴定
a. Morphological observation of the 3rd generation ADSCs by HE staining (Inverted phase contrast microscope×100); b. Oil red O staining observation of the 3rd generation ADSCs after adipogenic induction for 14 days (Inverted phase contrast microscope×200); c-e. Flow cytometry identification of the 3rd generation ADSCs
2.2. ADSC-Exos 鉴定
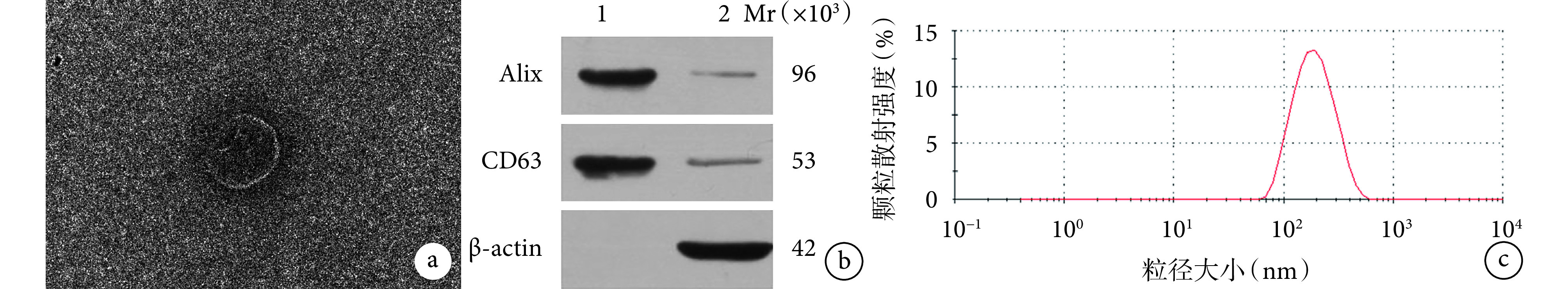
透射电镜观察示,ADSC-Exos 为大小均匀、形态一致的圆形或椭圆形膜性囊泡,边缘清晰。Western blot 检测示,ADSC-Exos 高表达标志蛋白 Alix 和 CD63,而未检测到干细胞中表达的 β-actin,表明分离出的 ADSC-Exos 未受干细胞成分污染。纳米颗粒踪跟分析仪 NanoSight 检测示,ADSC-Exos 粒径范围为 30~200 nm,符合外泌体粒径范围。见图 2。
图 2.
Identification of ADSC-Exos
ADSC-Exos 鉴定
a. 透射电镜观察 ADSC-Exos 形态(×49 k);b. Western blot 检测 ADSC-Exos 膜表面标志性蛋白 Alix 和 CD63 的表达 Mr:相对分子质量 1:ADSC-Exos 2:ADSCs;c. 纳米颗粒踪跟分析仪检测 ADSC-Exos 粒径分布
a. Morphology observation of ADSC-Exos by transmission electron microscopy (×49 k); b. Expressions of surface signature proteins Alix and CD63 by Western blot Mr: Relative molecular mass 1: ADSC-Exos 2: ADSCs; c. Detection of ADSC-Exos particle size distribution by nanoparticle tracking analyzer
2.3. ADSC-Exos 与 HUVECs 共培养观察
2.3.1. ADSC-Exos 能否进入 HUVECs 观察
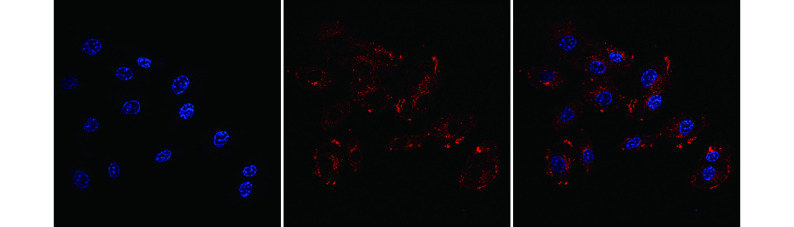
共聚焦显微镜下可见 ADSC-Exos 被 HUVECs 摄取并分布在细胞核周围,表明 ADSC-Exos 可进入 HUVECs。见图 3。
图 3.
Confocal microscopy to observe whether ADSC-Exos could absorbed by HUVECs (×630)
共聚焦显微镜观察 ADSC-Exos 能否进入 HUVECs(×630)
从左至右分别为 DAPI、PKH26 及二者重叠
From left to right for DAPI, PKH26, and merge
2.3.2. ADSC-Exos 对 HUVECs 增殖及迁移能力的影响
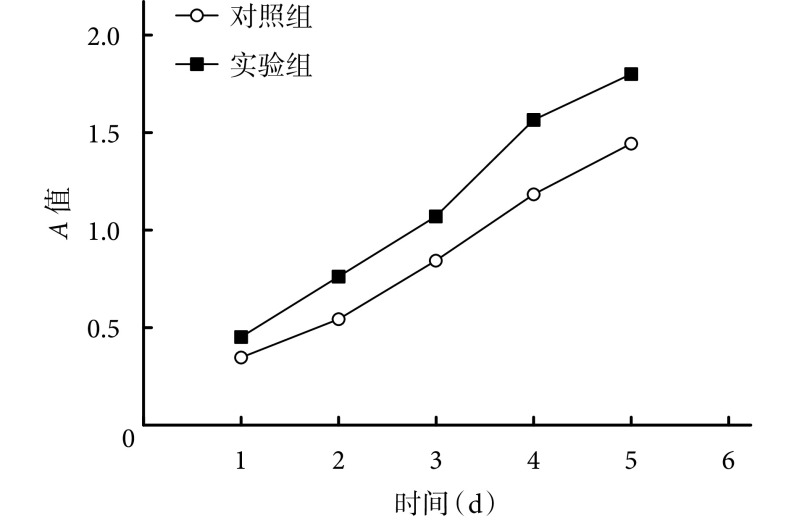
CCK-8 法检测示,实验组各时间点 A 值均显著高于对照组,比较差异有统计学意义(P<0.05)。见图 4。Transwell 迁移实验结果示,实验组跨膜迁移细胞数为(216.7±23.6)个,较对照组(85.1±4.1)个显著增多,比较差异有统计学意义(t=9.534,P=0.000)。见图 5。
图 4.
The A value at different time points in 2 groups by CCK-8 assay
CCK-8 法检测两组不同时间点 A 值
图 5.
Transwell migration experiment results (Inverted phase contrast microscope×200)
Transwell 迁移实验(倒置相差显微镜×200)
a. 对照组;b. 实验组
a. Control group; b. Experimental group
2.3.3. ADSC-Exos 体外促进 HUVECs 管样结构形成实验
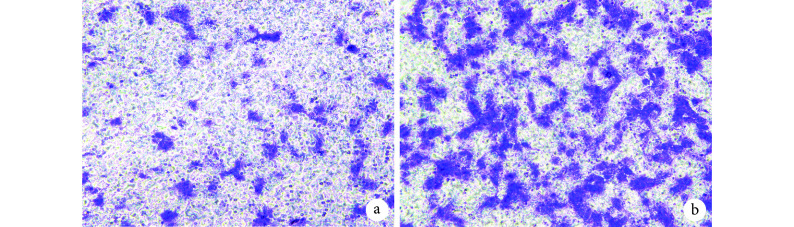
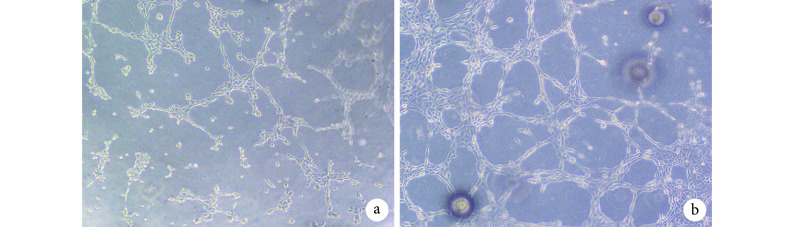
倒置相差显微镜观察示,对照组仅形成未封闭的多边形样结构,实验组有更多的管样结构;实验组形成管样结构比对照组更快速、结构更复杂。见图 6。实验组管样结构数为(76.0±5.0)个/孔,明显多于对照组的(36.0±2.6)个/孔,比较差异有统计学意义(t=15.910,P=0.000)。
图 6.
Observation of tube-like structures formation in Matrigel (Inverted phase contrast microscope×200)
Matrigel 基质胶内管样结构形成观察(倒置相差显微镜×200)
a. 对照组;b. 实验组
a. Control group; b. Experimental group
2.3.4. ADSC-Exos 体内促进 HUVECs 成血管实验
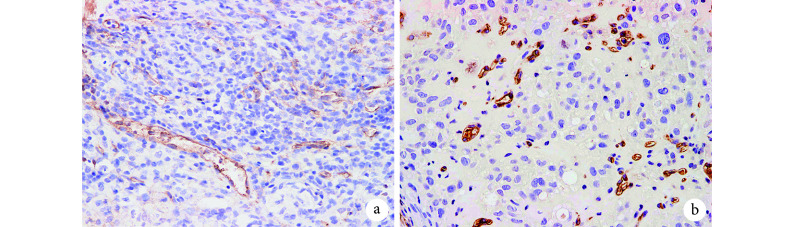
皮下移植 Matrigel 基质胶 2 周后,Matrigel 基质胶凝固为胶栓,实验组有血管长入胶栓,而对照组无血管或较少血管长入。免疫组织化学染色示,实验组 MVD 为(33.4±3.6)个,显著高于对照组的(12.8±2.2)个,比较差异有统计学意义(t=16.710,P=0.000)。见图 7。
图 7.
Immunohistochemical staining for neovascularization in Matrigel (Inverted phase contrast microscope×400)
免疫组织化学染色观察 Matrigel 基质胶内新生血管(倒置相差显微镜×400)
a. 对照组;b. 实验组
a. Control group; b. Experimental group
2.4. ELISA 法检测细胞上清液 VEGF 蛋白表达
培养 12 h,实验组细胞上清液 VEGF 蛋白表达量为(164.1±10.2)pg/mL,明显高于对照组的(49.2±6.2)pg/mL,比较差异有统计学意义(t=21.470,P=0.000)。10 μL 浓度为 100 μg/mL ADSC-Exos 中 VEGF 蛋白表达量为(5.2±2.6) pg/mL。
3. 讨论
近年来,Deveza 等[8]发现 ADSCs 上清液有促进 HUVECs 增殖和迁移作用,说明在促进血管新生方面其旁分泌作用可能扮演了重要角色,而旁分泌的外泌体可能就是其中的关键。外泌体最早是由 Johnstone 等[9]在体外培养的绵羊网织红细胞上清液中发现,研究表明几乎所有细胞均可分泌,并广泛存在于母乳、尿液、羊水等体液中[10]。外泌体参与了免疫监视、炎性反应以及肿瘤发生发展多种生理病理过程[11],在细胞间信息交流中起到重要作用[12]。鉴于外泌体特性与其来源的细胞有关,我们推测 ADSC-Exos 可促进血管新生。
目前研究显示,缺血组织的血管修复主要机制为血管发生和血管新生。血管发生是指在胚胎形成过程中,内皮祖细胞迁移到血管化部位,分化成内皮细胞,并聚结形成初始血管丛[13]。来自现有血管的新毛细血管分支的萌芽被称为血管新生[14]。研究发现,循环血液中存在内皮祖细胞,当机体发生创伤、缺血等病理变化时,内皮祖细胞迁移并定植在损伤缺血部位,分泌促血管生成因子,促进侧支血管生长至缺血组织,参与组织的血管新生,促进组织修复[15]。
我们通过建立 ADSC-Exos 与 HUVECs 共培养体系,发现 ADSC-Exos 可以进入 HUVECs 细胞质,并促进 HUVECs 增殖、迁移及管样分化。同时,我们将 HUVECs 与 Matrigel 基质胶混合后联合 ADSC-Exos 注入裸鼠皮下,观察到 14 d 后血管数量显著高于对照组。由此可见,ADSC-Exos 具有体内促血管新生作用,可用于组织工程血管的构建。相比于干细胞移植,采用干细胞外泌体促进血管新生具有更大的优势。首先,外泌体体积更微小,不会堵塞微血管,可以穿过血脑屏障,在干细胞无法到达的微环境发挥作用[16];其次,外泌体更易于保存,–20℃ 保存 6 个月不会丧失其生物活性[17],同时也避免了干细胞移植可能出现的过度增殖和致瘤性;最后,在疾病治疗中,外泌体的用量可以根据治疗进程随时更改,具有充分的可调控性和安全性[18],还可以开发携带 microRNA 或蛋白的外泌体,以克服亲本干细胞的过度增殖和致瘤风险[19]。这些特征都显示出外泌体优于细胞疗法,为无细胞治疗的开发提供了思路[18]。但是目前外泌体的作用机制尚不明确,相关文献报道,外泌体内携带多种 microRNA 和蛋白,移植后可进入宿主细胞并向该宿主细胞靶向传递 microRNA,从而影响其生物活性[7]。因此,结合 ELISA 检测结果,我们推测 ADSC-Exos 在被 HUVECs 摄取的同时,可能将这些物质导入 HUVECs 内,调控其生物学功能,促进 VEGF 的分泌,而不是 ADSC-Exos 中 VEGF 单纯叠加,进而促进 HUVECs 的增殖、迁移和管样分化。
但是,外泌体中的 microRNA 及蛋白成分极其复杂,本研究并未涉及其促血管生成的 microRNA 或蛋白,有关其成分及具体机制将在后续研究中继续探索。此外,近年学者们通过动物实验发现多种细胞和组织来源的外泌体具有促进创面修复的生物学功能,但其具体作用机制还有待研究 [20]。下一步我们会将 ADSC-Exos 运用于更贴近临床病例的动物模型中,如糖尿病创面或皮瓣移植等动物模型,观察 ADSC-Exos 对创面愈合或组织移植后的作用,更有利于探索 ADSC-Exos 的临床应用前景。
Funding Statement
国家自然科学基金资助项目(81660326);江西省自然科学基金资助项目(20171ACB20037)
National Natural Science Foundation of China (81660326); Natural Science Foundation of Jiangxi Province (20171ACB20037)
References
- 1.Rao RR, Stegemann JP Cell-based approaches to the engineering of vascularized bone tissue. Cytotherapy. 2013;15(11):1309–1322. doi: 10.1016/j.jcyt.2013.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Rohringer S, Hofbauer P, Schneider KH, et al Mechanisms of vasculogenesis in 3D fibrin matrices mediated by the interaction of adipose-derived stem cells and endothelial cells. Angiogenesis. 2014;17(4):921–933. doi: 10.1007/s10456-014-9439-0. [DOI] [PubMed] [Google Scholar]
- 3.Than U, Guanzon D, Leavesley D, et al Association of extracellular membrane vesicles with cutaneous wound healing. Int J Mol Sci. 2017;18(5):E956. doi: 10.3390/ijms18050956. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Franquesa M, Hoogduijn MJ, Ripoll E, et al Update on controls for isolation and quantification methodology of extracellular vesicles derived from adipose tissue mesenchymal stem cells. Front Immunol. 2014;5:525. doi: 10.3389/fimmu.2014.00525. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Riazifar M, Pone EJ, Lötvall J, et al Stem cell extracellular vesicles: extended messages of regeneration. Annu Rev Pharmacol Toxicol. 2017;57:125–154. doi: 10.1146/annurev-pharmtox-061616-030146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Li Q, Shao Y, Zhang X, et al Plasma long noncoding RNA protected by exosomes as a potential stable biomarker for gastric cancer. Tumour Biol. 2015;36(3):2007–2012. doi: 10.1007/s13277-014-2807-y. [DOI] [PubMed] [Google Scholar]
- 7.Chen B, Li Q, Zhao B, et al Stem cell-derived extracellular vesicles as a novel potential therapeutic tool for tissue repair. Stem Cells Transl Med. 2017;6(9):1753–1758. doi: 10.1002/sct3.2017.6.issue-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Deveza L, Choi J, Imanbayev G, et al Paracrine release from nonviral engineered adipose-derived stem cells promotes endothelial cell survival and migration in vitro . Stem Cells Dev. 2013;22(3):483–491. doi: 10.1089/scd.2012.0201. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Johnstone RM, Adam M, Hammond JR, et al Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes) J Biol Chem. 1987;262(19):9412–9420. [PubMed] [Google Scholar]
- 10.Cocucci E, Meldolesi J Ectosomes and exosomes: shedding the confusion between extracellular vesicles. Trends Cell Biol. 2015;25(6):364–372. doi: 10.1016/j.tcb.2015.01.004. [DOI] [PubMed] [Google Scholar]
- 11.Konala VB, Mamidi MK, Bhonde R, et al The current landscape of the mesenchymal stromal cell secretome: A new paradigm for cell-free regeneration. Cytotherapy. 2016;18(1):13–24. doi: 10.1016/j.jcyt.2015.10.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bjørge IM, Kim SY, Mano JF, et al Extracellular vesicles, exosomes and shedding vesicles in regenerative medicine-a new paradigm for tissue repair. Biomater Sci. 2017;6(1):60–78. doi: 10.1039/c7bm00479f. [DOI] [PubMed] [Google Scholar]
- 13.Randi AM, Laffan MA Von Willebrand factor and angiogenesis: basic and applied issues. J Thromb Haemost. 2017;15(1):13–20. doi: 10.1111/jth.2017.15.issue-1. [DOI] [PubMed] [Google Scholar]
- 14.Eelen G, de Zeeuw P, Simons M, et al Endothelial cell metabolism in normal and diseased vasculature. Circ Res. 2015;116(7):1231–1244. doi: 10.1161/CIRCRESAHA.116.302855. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Logsdon EA, Finley SD, Popel AS, et al A systems biology view of blood vessel growth and remodeling. J Cell Mol Med. 2014;18(8):1491–1508. doi: 10.1111/jcmm.2014.18.issue-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hessvik NP, Llorente A Current knowledge on exosome biogenesis and release. Cell Mol Life Sci. 2018;75(2):193–208. doi: 10.1007/s00018-017-2595-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Webber J, Clayton A How pure are your vesicles? J Extracell Vesicles. 2013;2:10. doi: 10.3402/jev.v2i0.19861. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Kishore R, Khan M More Than Tiny Sacks: Stem cell exosomes as cell-free modality for cardiac repair. Circ Res. 2016;118(2):330–343. doi: 10.1161/CIRCRESAHA.115.307654. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Ozturk S, Elcin YM. Cardiac stem cell characteristics in physiological and pathological conditions. Curr Pharm Des, 2018. [Epub ahead of print]
- 20.Liang X, Zhang L, Wang S, et al Exosomes secreted by mesenchymal stem cells promote endothelial cell angiogenesis by transferring miR-125a. J Cell Sci. 2016;129(11):2182–2189. doi: 10.1242/jcs.170373. [DOI] [PubMed] [Google Scholar]