Resumo
Fundamento
A doença arterial coronariana (DAC) associada à quimioterapia está se tornando um tema emergente na prática clínica. Contudo, o mecanismo subjacente da quimioterapia associada à DAC permanence incerto.
Objetivos
O estudo investigou a associação entre a quimioterapia e as anomalias anatômicas ateroscleróticas das artérias coronárias dentre pacientes com cancer de pulmão.
Métodos
Foram incluídos pacientes submetidos à angiografia coronária (AGC), entre 2010 e 2017, com câncer de pulmão prévio. Os fatores de risco associados à DAC e os dados sobre o câncer de pulmão foram avaliados. Avaliamos as anomalias das artérias coronárias de acordo com o escore SYNTAX (SXescore) calculado à AGC. Na análise de regressão logística, o escore SYNTAX foi classificado como alto (SXescoreALTO) se ≥22. Os dados foram analisados através de estatística descritiva e análise de regressão.
Resultados
Ao todo, 94 pacientes foram incluídos no estudo. O SXescore foi mais alto no grupo com quimioterapia quando comparado com o grupo sem quimioterapia (25,25, IIQ [4,50–30,00] versus 16,50, IIQ [5,00–22,00]; p = 0,0195). A taxa do SXescoreALTO foi maior no grupo com quimioterapia do que no no grupo sem quimioterapia (58,33% versus 25,86; p = 0,0016). Tanto a análise de regressão logística univariada (OR: 4,013; 95% IC:1,655–9,731) quanto a multivariada (OR: 5,868; 95% IC:1,778–19,367) revelaram que a quimioterapia aumentou o risco de uma maior taxa do SXescoreALTO. A análise multivariada de regressão logística Stepwise mostrou que o risco para DAC anatômica mais grave aumenta com a quimioterapia como um todo em 5.323 vezes (95% IC: 2,002–14,152), e com o regime à base de platina em 5,850 vezes (95% IC: 2,027–16,879).
Conclusões
A quimioterapia está associada com a complexidade e gravidade anatômica da DAC, o que pode explicar, em parte, o maior risco de DAC associada à quimioterapia dentre pacientes com câncer de pulmão. (Arq Bras Cardiol. 2020; [online].ahead print, PP.0-0)
Keywords: Doença da Artéria Coronariana/fisiopatologia, Neoplasias Pulmonares/tratamento farmacológico, Pontuação de Propensão, Syntax Escore, Angioplastia/métodos, Fatores de Risco
Introdução
As estratégias de tratameto modernas levaram à melhora nas chances de sobrevivência ao diagnóstico de câncer. Entretanto, esses ganhos têm um custo.1 A toxicidade cardiovascular é uma potencial complicação a curto ou longo prazo de várias terapias anticâncer e está se tornando uma das maiores preocupações no que diz respeito aos efeitos colaterais desse tipo de tratamento.2 As doenças do coração que podem ser induzidas por agentes quimioterápicos anticâncer incluem a disfunção cardíaca, a isquemia cardíaca, a arritmia, o AVC e a hipertensão arterial pulmonar.1,3,4 A doença arterial coronariana (DAC) associada à quimioterapia está se tornando um problema clínico emergente, o qual é difícil de administrar, devido as suas várias manifestações clínicas e ao complicado mecanismo fisiopatológico envolvido.5-7 Eventos coronarianos induzidos pela quimioterapia que ocorreram logo após a administração dos agentes quimioterápicos, possivelmente em decorrência de trombose aguda ou vasoespasmo, já foram relatados.3,8 Entretanto, a patogênese da DAC crônica associada à quimioterapia ainda não é conhecida.
O câncer de pulmão é o câncer incidental mais comum, e a principal causa de morte por câncer.9 A quimioterapia é um tratamento importante contra o câncer de pulmão.10,11Sabe-se que os agentes quimioterápicos para o câncer de pulmão, inclusive taxanos, cisplatina, carboplatina, bevacizumabe, sorafenibe e erlotinibe,3,10,12 causam infarto agudo do miocárdio. Desse modo, faz-se necessário investigar o efeito a longo prazo da quimioterapia sobre as alterações anatômicas da artéria coronária nos pacientes com câncer de pulmão.
A complexidade e características das lesões coronárias são preditores conhecidos de complicações periprocedimentais e de mortalidade a longo prazo.13-15 O escore SYNTAX (SXescore) foi desenvolvido para caracterizar prospectivamente a vasculatura coronariana por números de lesões e seus impactos funcionais, localização e complexidade.16-18 É uma ferramenta importante para classificar a complexidade da DAC e para a estratificação de risco de pacientes que estão sendo considerados para revascularização, e vem demonstrando valor satisfatório como um preditor de eventos cardíacos adversos significativos, incluindo a morte cardíaca. Os SXescores mais altos, indicativos de doenças mais complexas, hipoteticamente representam um desafio terapêutico maior, além de apresentarem prognósticos cardíacos potencialmente piores.16,17,19-21
Estudos recentes utilizaram o SXescore para quantificar a gravidade da DAC dentre pacientes com câncer, buscando examinar principalmente o efeito da radioterapia sobre a DAC.20,21 No presente estudo, utilizamos o SXescore para avaliar a complexidade e gravidade da DAC dentre pacientes com câncer de pulmão, a fim de investigar a relação entre a quimioterapia e a DAC. Também observamos o efeito da radioterapia e de outros fatores de risco sobre a gravidade anatômica das artérias coronárias dentre esses pacientes.
Métodos
Desenho e pacientes do estudo
Foi utilizado um desenho de estudo transversal hospitalar. Os pacientes do estudo foram admitidos no Hospital Geral Chinês do PLA para se submeterem à angiografia coronária (AGC) devido à suspeita de angina de peito ou estenose da artéria coronária revelada pela angiotomografia computadorizada, entre 2010 e 2017. Além disso, os pacientes deveriam ter recebido anteriormente diagnóstico definitivo de câncer de pulmão. Os pacientes que haviam sido submetidos à intervenção coronária percutânea prévia foram excluídos.
Examinamos minuciosamente os registros médicos eletrônicos dos pacientes no que diz respeito à história do câncer de pulmão, incluindo o diagnóstico, a idade à época do diagnóstico, localização e histórico do tratamento (quimioterapia e radioterapia). Revisamos o sexo, a idade à epoca da AGC, o índice de massa corporal (IMC), o histórico familiar de doenças cardiovasculares (DCVs), o uso de tabaco, a hipertensão, o diabetes, a hiperlipidemia e o perfil lipídico. Esses dados foram extraídos utilizando a plataforma de dados de pesquisa clínica criada pela Xiliu Data. Algumas informações foram checadas via telephone com os próprios pacientes ou seus familiares.
A angiografia coronária e o SXescore
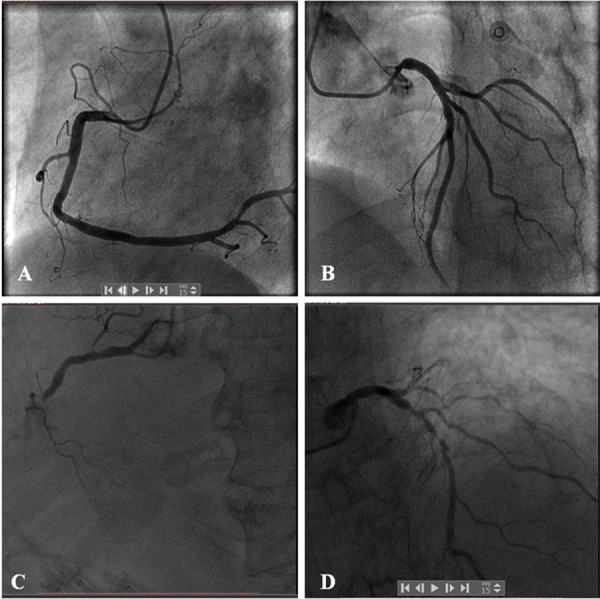
A partir do angiograma diagnóstico basal, pontuamos separadamente cada estenose coronária ≥50% em vasos com diâmetro ≥1,5 mm. Em seguida, somamos os escores para obter o SXescore global, que havíamos calculado prospectivamente utilizando o algaritmo SXescore (já totalmente descrito na literatura).16,17,22 Todas as variávies angiográficas pertinentes ao cálculo do SXescore foram computadas “às cegas” por 2 cardiologistas intervencionistas experientes. Quando havia divergência entre os dois cardiologistas em relação ao cálculo do SXescore de algum paciente, os mesmos discutiam o angiograma e atribuíam um SXescore comum para o paciente. Os SXescores finais foram calculados por paciente e salvos em uma base de dados dedicada. A Figura 1 mostra dois exemplos representativos de SXescores, tendo como base a AGC.
Figura 1. – SXescore da artéria coronária à AGC. AGCs representativos de um paciente com SXbaixo (SXescore = 2; A–B) e um paciente com SXalto (SXescore = 38; C–D) .
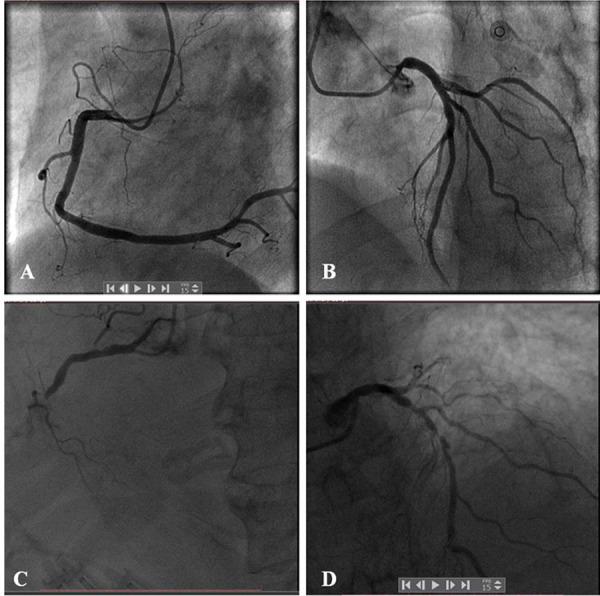
No estudo, o Sxescore de 22 foi o tercil superior. Definimos os graus do SXescore como SXbaixo (<22) ou SXalto (≥22). Por meio de análise de regressão logística, definimos que o grau do SXescore seria alto se o SXescore ≥22.
Análise estatística
As estatísticas descritivas basais estão apresentadas como frequências e percentuais para variáveis categóricas e como média ± desvio padrão (DP) e mediana (interval interquartil [IIQ]) para variáveis contínuas. Avaliamos a normalidade dos dados utilizando o teste de assimetria e curtose. As diferenças entre grupos de estudo foram avaliadas usando o teste Qui-quadrado ou o teste exato de Fisher para dados categóricos, e o teste T foi utilizado para dados contínuos. Utilizamos o teste T para comparar as médias entre os grupos quando as variáveis estavam distribuídas normalmente, e um teste não paramétrico quando as mesmas não estavam distribuídas normalmente. O Qui-quadrado ou o teste exato de Fisher foram utilizados para examinar as diferenças para medidas categóricas. Avaliamos as relações entre a quimioterapia e a complexidade da DAC por meio de análise de regressão logística, ajustando as covariáveis relacionadas, que incluíram: idade, gênero, IMC, tabagismo, histórico familiar de DACs, hipertensão, diabetes e hiperlipidemia. As razões de probabilidade (OR) e os intervalos de confiança [ICs] em 95% foram calculados. Todos os valores de p foram bicaudais, e o nível de significância estatística de 0,05 foi adotado. Todas as análises estatísticas foram realizadas utilizando o programa SAS, versão 9.3 (SAS Institute, Inc., Cary, Carolina do Norte, EUA).
Resultados
Características dos pacientes
Incluímos no estudo 94 pacientes com câncer de pulmão prévio, que haviam sido submetidos à AGC no Hospital Geral Chinês do PLA, entre 2010 e 2017. Ao todo, foram incluídos 73 homens e 21 mulheres (M:F = 3,48). Dentre os participantes, oitenta e cinco foram diagnosticados com câncer de pulmão de células não pequenas, e os outros 9 pacientes com câncer de pulmão de células pequenas. Trinta e seis pacientes tinham histórico de quimioterapia. Dentre os pacientes com quimioterapia, 28 pacientes receberam regimes à base de platina. A quimioterapia à base de platina, em combinação principalmente com gencitabina ou docetaxe (e outros agentes), foi utilizada em pacientes com câncer de pulmão em células não pequenas. Em pacientes com câncer de pulmão em células pequenas, foi utilizada uma combinação quimioterápica de compostos de platina e etoposido. Um paciente recebeu antraciclina (Farmorubicina) que reconhecidamente tem um efeito cardiotóxico. Cinco pacientes receberam inibidores da tirosina quinase. Três pacientes não posuíam informações detalhadas sobre os regimes de quimioterapia. Cinquenta e oito pacientes não receberam quimioterapia.
Não foram observadas diferenças significativas em relação aos fatores de risco convencionais de DAC (hipertensão, hiperlipidemia, diabetes ou histórico de tabagismo) entre os grupos com quimioterapia e sem quimioterapia. No grupo com quimioterapia, mais pacientes receberam radioterapia do que no grupo sem quimioterapia (p < 0,0001). A variação do tempo de intervalo entre o diagnóstico de câncer e a CAG foi discrepante entre os dois grupos. As características dos pacientes estão listadas na Tabela 1.
Tabela 1. – Características dos pacientes estratificados por histórico de quimioterapia.
| Características | Grupo com quimioterapia (n = 36) | Grupo sem quimioterapia (n = 58) | Valor de p |
|---|---|---|---|
| Gênero | 0,6257 | ||
| Masculino | 27 (75,00%) | 46 (79,31%) | |
| Feminino | 9 (25,00%) | 12 (20,69%) | |
| Idade à AGC (anos) | 0,077 | ||
| <60 | 3 (8,33%) | 13 (22,41%) | |
| ≥60 | 33 (91,67%) | 45 (77,59%) | |
| Tempo de intervalo entre o diagnóstico de câncer e a AGC (anos) | 0,000 | ||
| ≤2 | 17 (47,22%) | 48 (82,76%) | |
| >2 | 19 (52,78%) | 10 (17,24%) | |
| Tipos de câncer de pulmão | 0,081 | ||
| Câncer de pulmão de células não pequenas | 30 (83,33%) | 55 (94,83%) | |
| Câncer de pulmão de células pequenas | 6 (16,67%) | 3 (5,17%) | |
| Regimes de quimioterapia | NA | ||
| Platina + | 28 (77,78%) | -- | |
| Inibidores de tirosina quinase apenas | 5 (13,89%) | -- | |
| Regimes não verificados | 3(8,33%) | -- | |
| Radioterapia | <0,0001 | ||
| Não | 19 (52,78%) | 54 (93,10%) | |
| Sim | 17 (47,22%) | 4 (6,90%) | |
| IMC | 24,81 ± 2,89 | 25,32 ± 2,79 | 0,3944 |
| Hipertensão | 0,2455 | ||
| Não | 12 (34,29%) | 27 (46,55%) | |
| Sim | 23 (65,71%) | 31 (53,45%) | |
| Diabetes | 0,9343 | ||
| Não | 28 (80,00%) | 46 (80,70%) | |
| Sim | 7 (20,00%) | 11 (19,30%) | |
| Hiperlipidemia | 0,5157 | ||
| Não | 29 (82,86%) | 50 (87,72%) | |
| Sim | 6 (17,14%) | 7 (12,28%) | |
| Tabagismo | 0,8938 | ||
| Não | 18 (51,43%) | 29 (50,00%) | |
| Sim | 17 (48,57%) | 29 (50,00%) | |
| Consumo de álcool | 0,1640 | ||
| Não | 45 (73,77%) | 56 (62,92%) | |
| Sim | 16 (26,23%) | 33 (37,08%) | |
| Colesterol | 4,15 ± 1,08 | 4,25 ± 1,10 | 0,6896 |
| Trigliceríde | 1,38 ± 0,71 | 1,49 ± 0,99 | 0,7905 |
| Colesterol de lipoproteínas de baixa densidade | 2,58 ± 0,96 | 2,48 ± 0,88 | 0,6999 |
| Colesterol de lipoproteínas de alta densidade | 1,17 ± 0,34 | 1,33 ± 0,87 | 0,8345 |
AGC: angiografia coronária; IMC: índice de massa corporal.
Análise da associação entre a quimioterapia e o SXescoreALTO
Os pacientes que foram submetidos à quimioterapia desenvolveram DAC anatômica mais grave em relação àqueles que não foram submetidos à quimioterapia. O SXescore foi significativamente mais alto no grupo com quimioterapia em relação ao grupo sem quimioterapia (25,25, IIQ [4,50–30,00] versus 16,50, IIQ [5,00–22,00]; p = 0,0195). De acordo com a definicão de graus do SXescore, o percentual do SXalto foi significamente maior no grupo com quimioterapia do que no grupo sem quimioterapia (58,33% versus 25,86%; p = 0,0016). Os detalhes estão listados na Tabela 2.
Tabela 2. – SXescore e graus do SXescore nos pacientes com câncer de pulmão estratificados por quimioterapia ou radioterapia.
| Variáveis | Variável estatística | Estratificação por quimioterapia | Estratificação por radioterapia | ||||
|---|---|---|---|---|---|---|---|
|
| |||||||
| Grupo com quimioterapia (n = 36) | Grupo sem quimioterapia (n = 36) | Valor de p | Grupo com radioterapia | Grupo sem radioterapia | Valor de p | ||
| SXescore | 0,3045 | ||||||
| Média ± DP | 20,00 ± 12,70 | 14,96 ± 10,47 | 0,0195 | 18,67 ± 12,58 | 16,38 ± 11,31 | ||
| Mediana | 25,25 | 16,50 | 22,00 | 19,00 | |||
| Q1–Q3 | 4,50–30,00 | 5,00–22,00 | 5,00–30,00 | 5,00–25,00 | |||
| Mín–máx | 0,00–38,00 | 0,00–38,00 | 1,00–35,50 | 0,00–38,00 | |||
| Grau do SXescore | 0,0016 | 0,1319 | |||||
| SXbaixo (<22) | N (%) | 15 (41,67%) | 43 (74,14%) | 10 (47,62%) | 48 (65,75%) | ||
| SXalto (≥22) | N (%) | 21 (58,33%) | 15 (25,86%) | 11 (52,38%) | 25 (34,25%) | ||
A radioterapia é outro tratamento importante contra o câncer de pulmão. No nosso estudo, o SXescore foi mais alto no grupo com radioterapia do que no grupo sem radioterapia (22,00, IIQ [5,00–30,00] versus 19,00, IIQ [5,00–25,00]; p = 0,3045). O percentual do SXalto foi maior no grupo com radioterapia do que no grupo sem radioterapia (52,38% versus 34,25%; p = 0,1319). Entretanto, não houve diferenças significativas tanto para o SXescore quanto para a taxa do SXalto entre os grupos com radioterapia e sem radioterapia. Comparada com a radioterapia, a quimioterapia mostrou efeitos piores sobre as anomalias das artérias coronárias dentre os pacientes com câncer de pulmão. Os resultados estão apresentados na Tabela 2.
A análise de regressão logística univariada mostrou que a quimioterapia aumentou significativamente a taxa do SXalto em 4,013 vezes (95% IC: 1,655–9,731). A OR da radioterapia para o SXalto foi 2,112 (95% IC: 0,790–5,646), o que não mostrou significância estatística evidente. O tabagismo, como um fator de risco cardiovascular convencional, aumentou significativamente a taxa do SXalto em 3,182 vezes (95% IC: 1,327–7,628). A OR de outros fatores de risco cardiovasculares para o SXalto foram >1, mas não mostraram significância estatística evidente. Na análise de regressão logística multivariada, a quimioterapia aumentou o risco de DAC com anomalias anatômicas mais graves em 5,868 vezes (95% IC: 1,778-19,367). As ORs da radioterapia e do tabagismo para o SXalto foram 1,124 (95% IC: 0,286–4,416) e 3,035 (95% IC: 1,036–8,893), respectivamente. Os resultados estão apresentados na Tabela 3.
Tabela 3. – Análise de regressão logística pela gravidade anatômica da artéria coronária nos pacientes com câncer de pulmão.
| Variáveis | Modelo univariado | Modelo multivariado | ||
|---|---|---|---|---|
|
| ||||
| OR (95% IC) | p | OR (95% IC) | p | |
| Idade (anos) | 0,9427 | 0,642 | ||
| <60 | Ref | Ref | ||
| ≥60 | 1,042 (0,343–3,161) | 0,723 (0,184–2,840) | ||
| Gênero | 0,1278 | 0,362 | ||
| Feminino | Ref | Ref | ||
| Masculino | 2,326 (0,781–7,140) | 1,856 (0,490–7,021) | ||
| IMC | 0,4538 | 0,428 | ||
| <25 | Ref | Ref | ||
| ≥25 | 1,376 (0,597–3,168) | 1,528 (0,536–4,355) | ||
| Tabagismo | 0,0095 | 0,043 | ||
| Não | Ref | Ref | ||
| Sim | 3,182 (1,327–7,628) | 3,035 (1,036–8,893) | ||
| Histórico familiar de DAC | 0,2467 | 0,659 | ||
| Não | Ref | Ref | ||
| Sim | 2,011 (0,617–6,563) | 1,379 (0,331–5,754) | ||
| Hipertensão | 0,9667 | 0,748 | ||
| Não | Ref | Ref | ||
| Sim | 1,018 (0,437–2,372) | 1,180 (0,431–3,234) | ||
| Diabetes tipo 2 | 0,5338 | 0,501 | ||
| Não | Ref | Ref | ||
| Sim | 1,393 (0,491–3,953) | 1,561 (0,426–5,721) | ||
| Hiperlipidemia | 0,9732 | 0,616 | ||
| Não | Ref | Ref | ||
| Sim | 1,021 (0,306–3,410) | 0,677 (0,147–3,118) | ||
| Intervalo de tempo entre o diagnóstico de câncer e a ACG (anos) | 0,2914 | 0,899 | ||
| ≤2 | Ref | Ref | ||
| >2 | 1,484 (0,609–3,617) | 1,075 (0,350–3,301) | ||
| Radioterapia | 0,136 | 0,867 | ||
| Não | Ref | Ref | ||
| Sim | 2,112 (0,790–5,646) | 1,124 (0,286–4,416) | ||
| Quimioterapia | 0,0021 | 0,004 | ||
| Não | Ref | Ref | ||
| Sim | 4,013 (1,655–9,731) | 5,868 (1,778–19,367) | ||
IMC: índice de massa corpora; DAC: doença arterial coronariana; ACG: angiografia coronária.
Na regressão logística multivariada Stepwise ajustada para fatores de risco relacionados à DAC (idade, gênero, IMC, tabagismo, histórico familiar de DCVs, hipertensão, diabetes e hiperlipidemia), e para fatores de risco relacionados ao câncer de pulmão (histórico de radioterapia e quimioterapia), a quimioterapia como um todo e o tabagismo aumentaram significativamente a taxa do SXalto em 5.323 vezes (95% IC: 2,002–14,152) e 3.646 vezes (95% IC:1,374–9,678), respectivamente. Além disso, detectamos que, no que diz respeito aos efeitos do regime à base de platina sobre a DAC anatômica, os resultados foram semelhantes, sendo que a OR do regime à base de platina foi 5,850 (95% IC: 2,027–16,879) e a OR do tabagismo foi 3,670 (95% IC: 1,303–10,339). Os resultados estão apresentados na Tabela 4.
Tabela 4. – Modelo de regressão logística multivariada Stepwise para gravidade anatômica da artéria coronária dentre pacientes com câncer de pulmão.
| Variáveis | OR | 95% IC | Valor de p |
|---|---|---|---|
| Total de pacientes (n=94) | |||
| Tabagismo | 3,646 | 1,374-9,678 | 0,009 |
| Quimioterapia | 5,323 | 2,002-14,152 | 0,001 |
| Pacientes, exceto com ITQ ou RNV (n=86) | |||
| Tabagismo | 3,670 | 1,303-10,339 | 0,14 |
| Quimioterapia | 5,850 | 2,027-16,879 | 0,007 |
ITQ: inibidores da tirosina-quinase; RNV: regimes não verificados.
Discussão
Até onde temos conhecimento, este estudo é o primeiro a demonstrar quantitativamente que a quimioterapia está relacionada com a complexidade anatômica e a gravidade da DAC dentre os pacientes com câncer de pulmão, usando o SXescore com base nos angiogramas coronários.
A terapia antineoplásica é frequentemente dificultada pelo desenvolvimento de complicações cardiovasculares, tais como insuficiência cardíaca, infarto do miocárdio, hipertensão, tromboembolismo, prolongação do QT e bradicardia.23 Até o momento, as doenças do coração induzidas por quimioterapia relatadas com mais frequência são a disfunção e a insuficiência cardíaca, conforme avaliado à ecocardiografia.1,24,25 Os eventos da artéria coronária relacionados à quimioterapia estão se tornando problemas clínicos importantes dentre a população com câncer submetidas à quimioterapia.5-7 Eventos agudos da artéria coronária que ocorreram logo após a administração de agentes quimioterápicos foram relatados.3,8 Haugnes et al.,26mostraram um risco 5,7 vezes maior de DAC, e um risco de infarto do miocárdio 3,1 vezes maior, nos regimes à base de cisplatina, quando comparados com a cirurgia isolada, em um tempo médio de observação de 19 anos.26 O presente estudo investigou a associação entre a quimioterapia e as anomalias anatômicas das artérias coronárias dentre pacientes com câncer de pulmão.
O câncer de pulmão é o câncer incidental mais comum e é a principal causa de morte por câncer.9 O estudo avaliou as anomalias anatômicas das artérias coronárias através do SXescore e investigou a relação entre a quimioterapia e a complexidade anatômica da DAC dentre pacientes com câncer de pulmão. Os resultados mostraram que tanto a taxa do SXescore quanto a do SXalto foram significativamente maiores nos pacientes que foram submetidos à quimioterapia, quando comparados com pacientes que não foram. A análise de regressão logística multivariada Stepwise mostrou que o risco de CAD anatômica mais grave aumenta devido à quimioterapia como um todo em 5,323 vezes, e com os regimes à base de platina, em 5,850 vezes. Os resultados indicam que a quimioterapia está associada com a complexidade anatômica e a gravidade da DAC, o que pode, ao menos em parte, explicar a morbidade mais elevada a longo prazo da DAC associada à quimioterapia, inclusive o infarto do miocárdio.26 Até onde sabemos, nenhum outro estudo semelhante de grande porte detectou quantitativamente a associação entre a quimioterapia e a gravidade e complexidade anatômica da DAC dentre pacientes com câncer de pulmão.
Embora a DAC associada à quimioterapia esteja se tornando uma questão emergente, o mecanismo subjacente da DAC associada à quimioterapia permanence desconhecido. Os eventos agudos da artéria coronária que ocorreram logo após a administração de agentes quimioterápicos foram decorrentes possivelmente de trombose aguda ou vasoespasmo.3,8 Nosso estudo indicou que os eventos coronários a longo prazo associados à quimiterapia podem ser decorrentes de anomalias anatômicas mais graves induzidas por agentes quimioterápicos. No presente estudo, cerca de 90% dos pacientes tinham câncer de pulmão em células não pequenas, e os outros pacientes tinham câncer de pulmão em células pequenas. A maioria dos regimes de quimioterapia dos pacientes do estudo envolvia mais de um agente quimioterápico, a maioria dos quais contêm platina. A platina foi a base da quimioterapia para a maioria dos pacientes. Cinco pacientes receberam gefitinibe. No estudo, um paciente recebeu antraciclina, que é conhecida por seu efeito cardiotóxico. É razoável determinar que as células endoteliais desempenham um papel importante durante a patogênse da DAC anatômica crônica, e a lesão endotelial induzida por agentes quimioterápicos pode ser a causa central da DAC associada à quimioterapia. Cada paciente do estudo recebeu vários agentes quimioterápicos. Desse modo, foi difícil deduzir qual deles desempenhou o papel mais importante no desenvolvimento da DAC associada à quimioterapia. Já que a platina é o agente mais utilizado, talvez ela seja um dos agentes mais importantes que precisam de estudos adicionais para ilustrar o mecanismo subjacente da DAC associada à quimioterapia.
A radioterapia desempenha um papel fundamental no tratamento do câncer de pulmão.27 Estudos anteriores demonstraram o efeito da radiação sobre as doenças do coração.20,28-30 No presente estudo, ambos o SXescore e o percentual do SXalto foram mais altos no grupo com radioterapia do que no grupo sem radioterapia, mas não houve diferenças significativas entre os dois grupos. Na análise de regressão logística, a OR da radioterapia para o SXalto foi 2,112 (95% IC, 0,790–5,646), o que indica a probabilidade de a radioterapia aumentar a complexidade das artérias corronárias. Porém, os resultados não mostraram diferenças significantes. Os dados ambíguos podem ser o resultado da menor amostra de pacientes que receberam radioterapia dentre a população estudada. Com base nos resultados já mencionados, talvez possamos afirmar que a quimioterapia pode desempenhar um papel mais importante do que se pensa atualmente no que diz respeito à DAC. Entretanto, nós não podemos afirmar que a quimioterapia é pior que a radiografia em termos de DAC, principalmente devido à pequena amostra, sem dados individuais suficientes para cada agente quimioterápico. Acreditamos que os resultados são interessantes e merecem estudos futuros.
A doença cardíaca que se manifesta após o câncer pode ser decorrente de vários mecanismos: riscos cardiovasculares compartilhados entre o câncer e a doença cardiovascular, estados inflamatórios associados com malignidades e/ou efeitos cardiotóxicos do tratamento do câncer. A idade, o gênero, o uso de tabaco, o histórico familiar de DAC, a hipertensão, o diabetes tipo 2 e a hiperlipidemia são fatores de risco bastante conhecidos de DAC.31-35 O tabagismo é um fator de risco bem conhecido e comum tanto de DAC quanto de câncer de pulmão. No nosso estudo, metade dos pacientes com câncer de pulmão eram tabagistas, o que é consistente com os dados nacionais, mostrando que cerca de 57% dos pacientes diagnósticados com câncer de pulmão são fumantes ou ex-fumantes.36 No nosso estudo, outros fatores de risco cardiovascular também aumentaram a gravidade da DAC, mas aqueles fatores de risco não demonstraram significância estatística evidente para o aumento do SXescore. Por outro lado, o tabagismo mostrou mais efeitos significativos sobre o aumento do risco para SXalto em 3.646 vezes.
Além disso, o tempo de duração do câncer de pulmão pode desempenhar um papel na progressão da DAC. No estudo, coletamos dados do tempo de intervalo entre o diagnóstico do câncer e a AGC. Embora o tempo de intervalo entre o diagnóstico do câncer e a AGC tenha sido discrepante entre os dois grupos (possivelmente por se tratar de um estudo retrospectivo de pequeno porte), o modelo logístico multivariado com ajuste adicional para a variável tempo de intervalo ainda mostrou diferenças significativas na gravidade da DAC entre os pacientes com quimioterapia e aqueles sem quimioterapia.
Nosso estudo tem várias limitações. Em primeiro lugar, trata-se de um estudo unicêntrico com uma amostra pequena, realizado com uma população específica de pacientes que haviam tido câncer de pulmão e necessitado de AGC devido à suspeita de DAC grave. Um número menor de pacientes recebeu radioterapia. Dentre os 94 pacientes do estudo, 21 pacientes costumavam receber radioterapia. Em particular, apenas 4 pacientes (6,9%) tinham histórico de radioterapia no grupo sem quimioterapia. Os resultados da amostra da população de pacientes, por ser pequena e específica, podem ser desviantes. Em segundo lugar, este foi um estudo retrospectivo, que pode carecer de algumas informações valiosas acerca dos pacientes. Seria útil saber o estágio do câncer de pulmão na apresentação inicial. Aqueles que receberam quimioterapia podem ter tido uma doença mais avançada e, consequentemente, mais inflamação, por um período mais longo de tempo, o que pode causar aterosclerose e contribuir para os resultados observados neste estudo. Entretanto, nós não recebemos dados tão amplos sobre os pacientes. Em terceiro lugar, nós não investigamos se SXescore estava associado com eventos cardiovasculares a longo prazo nos pacientes do estudo. Estudos clínicos adicionais prospectivos e em larga escala podem ser necessários para verificar o efeito da quimioterapia sobre a anomalia anatômica da DAC e o mecanismo subjacente da DAC associada à quimioterapia.
Conclusões
Em resumo, o presente estudo demonstra que a quimioterapia está associada à gravidade e complexidade anatômica da DAC a longo prazo. Os resultados podem explicar em parte o fato de pacientes com câncer e histórico de quimioterapia apresentarem um risco mais elevado de eventos da artéria coronária, quando comparados com pacientes sem histórico de quimioterapia. Entretanto, devido às limitações, um estudo prospectivo de larga escala, bem como pesquisas futuras fisiopatológicas e moleculares, serão necessários para melhor ilustrar a associação entre a quimioterapia e a DAC, e o mecanismo subjacente da CAD associada à quimioterapia.
Funding Statement
Fontes de financiamento. O presente estudo foi financiado pelo National Natural Science Foundation of China, número 81770237.
Vinculação acadêmica
Este artigo é parte de dissertação de Mestrado de Qian Yang pela Chinese PLA general hospital.
Aprovação ética e consentimento informado
Este estudo foi aprovado pelo Comitê de Ética do Chinese PLA General Hospital sob o número de protocolo 52019-223-02. Todos os procedimentos envolvidos nesse estudo estão de acordo com a Declaração de Helsinki de 1975, atualizada em 2013.
Fontes de financiamento. O presente estudo foi financiado pelo National Natural Science Foundation of China, número 81770237.
Referências
- 1.1. Curigliano G, Cardinale D, Dent S, Criscitiello C, Aseyev O, Lenihan D, et al. Cardiotoxicity of anticancer treatments: Epidemiology, detection, and management. CA Cancer J Clin. 2016;66(4):309-25. [DOI] [PubMed]
- 2.2. Curigliano G, Cardinale D, Suter T, Plataniotis G, de Azambuja E, Sandri MT, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol. 2012;23 Suppl 7:vii155-66. [DOI] [PubMed]
- 3.3. Zerna C, Guenther M, Folprecht G, Puetz V. Acute ischaemic stroke and myocardial infarction after chemotherapy with vinorelbine for non-small cell lung cancer: a case report. J Chemother. 2017;29(1):49-53. [DOI] [PubMed]
- 4.4. Suh KJ, Lee JY, Shin DY, Koh Y, Bang SM, Yoon SS, et al. Analysis of adverse events associated with dasatinib and nilotinib treatments in chronic-phase chronic myeloid leukemia patients outside clinical trials. Int J Hematol. 2017;106(2):229-39. [DOI] [PubMed]
- 5.5. Chang HM, Moudgil R, Scarabelli T, Okwuosa TM, Yeh ETH. Cardiovascular Complications of Cancer Therapy: Best Practices in Diagnosis, Prevention, and Management: Part 1. J Am Coll Cardiol .2017;70(20):2536-51. [DOI] [PMC free article] [PubMed]
- 6.6. Bertolini A, Flumanò M, Fusco O, Muffatti A, Scarinci A, Pontiggia G, et al. Acute cardiotoxicity during capecitabine treatment: a case report. Tumori. 2001;87(3):200-6. [DOI] [PubMed]
- 7.7. Shoemaker L, Arora U, Rocha Lima C. 5-fluorouracil-induced coronary vasospasm. Cancer Control .2004;11(1):46-9. [DOI] [PubMed]
- 8.8. Rao AS, Kumar R, Narayanan GS. A rare case of cisplatin-induced acute myocardial infarction in a patient receiving chemoradiation for lung cancer. J Cancer Res Ther. 2015;11(4):983-5. [DOI] [PubMed]
- 9.9. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66(2):115-32. [DOI] [PubMed]
- 10.10. Pilkington G, Boland A, Brown T, Oyee J, Bagust A, Dickson R. A systematic review of the clinical effectiveness of first-line chemotherapy for adult patients with locally advanced or metastatic non-small cell lung cancer. Thorax. 2015;70(4):359-67. [DOI] [PubMed]
- 11.11. Du L, Morgensztern D. Chemotherapy for Advanced-Stage Non-Small Cell Lung Cancer. Cancer J .2015;21(5):366-70. [DOI] [PubMed]
- 12.12. Roy A, Khanna N, Senguttuvan NB. Rituximab-vincristine chemotherapy-induced acute anterior wall myocardial infarction with cardiogenic shock. Tex Heart Inst J. 2014;41(1):80-2. [DOI] [PMC free article] [PubMed]
- 13.13. van Gaal WJ, Ponnuthurai FA, Selvanayagam J, Testa L, Porto I, Neubauer S, et al. The Syntax score predicts peri-procedural myocardial necrosis during percutaneous coronary intervention. Int J Cardiol. 2009;135(1):60-5. [DOI] [PubMed]
- 14.14. Ellis SG, Roubin GS, King SB, 3rd, Douglas JS, Jr., Weintraub WS, Thomas RG, et al. Angiographic and clinical predictors of acute closure after native vessel coronary angioplasty. Circulation .1988;77(2):372-9. [DOI] [PubMed]
- 15.15. Ekici B, Kutuk U, Alhan A, Tore HF. The relationship between serum uric acid levels and angiographic severity of coronary heart disease. Kardiol Pol .2015;73(7):533-8. [DOI] [PubMed]
- 16.16. Sianos G, Morel MA, Kappetein AP, Morice MC, Colombo A, Dawkins K, et al. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease. EuroIntervention. 2005;1(2):219-27. [PubMed]
- 17.17. Wykrzykowska JJ, Garg S, Girasis C, de Vries T, Morel MA, van Es GA, et al. Value of the SYNTAX score for risk assessment in the all-comers population of the randomized multicenter LEADERS (Limus Eluted from A Durable versus ERodable Stent coating) trial. J Am Coll Cardiol. 2010;56(4):272-7. [DOI] [PubMed]
- 18.18. Stone GW, Sabik JF, Serruys PW, Simonton CA, Genereux P, Puskas J, et al. Everolimus-Eluting Stents or Bypass Surgery for Left Main Coronary Artery Disease. N Engl J Med. 2016;375(23):2223-35. [DOI] [PubMed]
- 19.19. Girasis C, Garg S, Raber L, Sarno G, Morel MA, Garcia-Garcia HM, et al. SYNTAX score and Clinical SYNTAX score as predictors of very long-term clinical outcomes in patients undergoing percutaneous coronary interventions: a substudy of SIRolimus-eluting stent compared with pacliTAXel-eluting stent for coronary revascularization (SIRTAX) trial. Eur Heart J. 2011;32(24):3115-27. [DOI] [PubMed]
- 20.20. Hu S, Gao H, Zhang J, Han X, Yang Q, Zhang J, et al. Association between Radiotherapy and Anatomic Severity of Coronary Artery Disease: A Propensity Score Matching Comparison Among Adult-Onset Thoracic Cancer Survivors. Cardiology. 2018;140(4):239-46. [DOI] [PubMed]
- 21.21. Reed GW, Rossi JE, Masri A, Griffin BP, Ellis SG, Kapadia SR, et al. Angiographic predictors of adverse outcomes after percutaneous coronary intervention in patients with radiation associated coronary artery disease. Catheter Cardiovasc Interv. 2019;94(3):E104-E110. [DOI] [PubMed]
- 22.22. Serruys PW, Morice MC, Kappetein AP, Colombo A, Holmes DR, Mack MJ, et al. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N Engl J Med .2009;360(10):961-72. [DOI] [PubMed]
- 23.23. Yeh ET, Tong AT, Lenihan DJ, Yusuf SW, Swafford J, Champion C, et al. Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management. Circulation. 2004;109(25):3122-31. [DOI] [PubMed]
- 24.24. Chavez-MacGregor M, Zhang N, Buchholz TA, Zhang Y, Niu J, Elting L, et al. Trastuzumab-related cardiotoxicity among older patients with breast cancer. J Clin Oncol. 2013;31(33):4222-8. [DOI] [PMC free article] [PubMed]
- 25.25. Giza DE, Iliescu G, Hassan S, Marmagkiolis K, Iliescu C. Cancer as a Risk Factor for Cardiovascular Disease. Curr Oncol Rep. 2017;19(6):39. [DOI] [PubMed]
- 26.26. Haugnes HS, Wethal T, Aass N, Dahl O, Klepp O, Langberg CW, et al. Cardiovascular risk factors and morbidity in long-term survivors of testicular cancer: a 20-year follow-up study. J Clin Oncol. 2010;28(30):4649-57. [DOI] [PubMed]
- 27.27. Rossi A, Tay R, Chiramel J, Prelaj A, Califano R. Current and future therapeutic approaches for the treatment of small cell lung cancer. Expert Rev Anticancer Ther. 2018;18(5):473-86. [DOI] [PubMed]
- 28.28. Hu S, Chen Y, Li L, Chen J, Wu B, Zhou X, et al. Effects of adenovirus-mediated delivery of the human hepatocyte growth factor gene in experimental radiation-induced heart disease. Int J Radiat Oncol Biol Phys. 2009;75(5):1537-44. [DOI] [PubMed]
- 29.29. Kupeli S, Hazirolan T, Varan A, Akata D, Alehan D, Hayran M, et al. Evaluation of coronary artery disease by computed tomography angiography in patients treated for childhood Hodgkin’s lymphoma. J Clin Oncol. 2010;28(6):1025-30. [DOI] [PubMed]
- 30.30. van Rosendael AR, Daniels LA, Dimitriu-Leen AC, Smit JM, van Rosendael PJ, Schalij MJ, et al. Different manifestation of irradiation induced coronary artery disease detected with coronary computed tomography compared with matched non-irradiated controls. Radiother Oncol. 2017;125(1):55-61. [DOI] [PubMed]
- 31.31. Brezinka V, Padmos I. Coronary heart disease risk factors in women. Eur Heart J. 1994;15(11):1571-84. [DOI] [PubMed]
- 32.32. Neaton JD, Wentworth D. Serum cholesterol, blood pressure, cigarette smoking, and death from coronary heart disease. Overall findings and differences by age for 316,099 white men. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med. 1992;152(1):56-64. [PubMed]
- 33.33. Adams KF, Schatzkin A, Harris TB, Kipnis V, Mouw T, Ballard-Barbash R, et al. Overweight, obesity, and mortality in a large prospective cohort of persons 50 to 71 years old. N Engl J Med. 2006;355(8):763-78. [DOI] [PubMed]
- 34.34. Barthelemy O, Jacqueminet S, Rouzet F, Isnard R, Bouzamondo A, Le Guludec D, et al. Intensive cardiovascular risk factors therapy and prevalence of silent myocardial ischaemia in patients with type 2 diabetes. Arch Cardiovasc Dis. 2008;101(9):539-46. [DOI] [PubMed]
- 35.35. Jaumdally JR, Lip GY, Varma C. Traditional risk factors for coronary atherosclerosis in Indo Asians: the need for a reappraisal. Curr Pharm Des 2006;12(13):1611-21. [DOI] [PubMed]
- 36.36. Li Y, Shi J, Yu S, Wang L, Liu J, Ren J, et al. Effect of socioeconomic status on stage at diagnosis of lung cancer in a hospital-based multicenter retrospective clinical epidemiological study in China, 2005-2014. Cancer Med 2017;6(10):2440-2452. [DOI] [PMC free article] [PubMed]