Abstract
Obwohl urologische maligne Erkrankungen mit etwa 100.000 Neuerkrankungen pro Jahr eine relevante gesundheitsökonomische Aufgabe darstellen, existieren kaum Erkenntnisse über die Struktur und Entwicklung der entsprechenden tumorchirurgischen Eingriffe an den mehr als 400 urologisch-chirurgisch tätigen Kliniken in Deutschland. Somit erfassten wir mittels Datenbankabfrage der DRG-Datenbank („diagnosis related groups“) des statistischen Bundesamtes sämtliche Fälle von 5 großen tumorchirurgischen Eingriffen in Deutschland (Prostatektomie, Zystektomie, Nierentumoroperation, retroperitoneale Lymphadenektomie, penischirurgische Eingriffe) von 2006 bis 2013 (bzw. 2016) und untersuchten die Einflüsse von technischen Neuerungen sowie Leitlinienänderungen auf die Entwicklungen der Fallzahlen. Zudem analysierten wir die Zusammenhänge zwischen jährlicher Fallzahl und perioperativem Ergebnis. Die Ergebnisse zeigten eine deutliche Korrelation zwischen Fallzahlvolumen (und damit Expertise) einer Klinik und einem verbesserten perioperativen Ergebnis. Dennoch existiert kaum Tendenz zur Zentralisierung bei diesen uroonkologischen Eingriffen. Die Fallzahlentwicklungen scheinen vielmehr vom Werbeeffekt durch technische Innovationen oder auch vom regionalen Bezug der Patienten zu einer bestimmten Klinik abhängig zu sein. Zentral gesteuerte Versuche mittels Einführung von Mindestfallzahlen oder der freiwilligen Zertifizierung von Zentren hatten in der Vergangenheit nur geringen Einfluss auf die Fallzahlverteilungen.
Schlüsselwörter: Versorgungsforschung, Urologische Malignome, Tumorchirurgie, Fallzahlen, Robotische Chirurgie
Abstract
Although urologic cancer represents a relevant health economic burden with about 100,000 new cases per year, hardly any knowledge exists about the structure and development of the corresponding uro-oncological interventions at the more than 400 urological surgical hospitals in Germany. Thus, we identified all cases of 5 major tumor surgery procedures in Germany from the DRG (diagnosis-related group) database of the Federal Statistical Office (prostatectomy, cystectomy, renal tumor surgery, retroperitoneal lymphadenectomy, penis surgery) from 2006–2013 (or 2016) by database query and investigated the influences of technical innovations, as well as guideline changes on the developments of case numbers. In addition, we analyzed the correlations between annual case numbers and perioperative outcomes. The results showed a clear correlation between case volume (and thus expertise) of a hospital and an improved perioperative outcome. Nevertheless, there is hardly any tendency towards centralization in these uro-oncological interventions. The development in the number of cases seems to depend more on the effect of advertising by means of technical innovations or the regional relation of the patients to a certain clinic. In the past, centrally controlled attempts to introduce minimum case numbers or voluntary certification of centers had little influence on the distribution of case numbers.
Keywords: Health care research, Urologic malignancies, Tumor surgery, Caseload, Robotic surgery
Hintergrund
Maligne Erkrankungen auf dem Gebiet der Urologie stellen mit etwa 100.000 Neuerkrankungen pro Jahr [1] eine relevante medizinische und gesundheitsökonomische Aufgabe dar. Obwohl das Prostatakarzinom den größten Anteil hierbei darstellt (60.000 jährliche Neuerkrankungen), so sind auch das Nierenzellkarzinom und das Harnblasenkarzinom unter den 10 häufigsten soliden onkologischen Neuerkrankungen vertreten [2–4]. Der Keimzelltumor des Hodens oder das Peniskarzinom erscheinen zahlenmäßig zwar deutlich seltener, stellen jedoch aufgrund der besonderen Eigenschaften der jeweiligen Patientengruppen (sehr junge einerseits und sehr alte Patienten andererseits) spezielle Anforderungen an die nationale Gesundheitsversorgung und die jeweils betreuenden Einrichtungen auch trotz geringerer Fallzahlen und somit letztendlich geringerer Expertise [5–9].
Die chirurgische Therapie stellt neben der systemischen Behandlung und der Strahlentherapie eine der 3 Säulen in der Behandlung von urologischen Malignomen dar. Hierbei steht grundsätzlich die Therapie des Primarius mit kurativer Absicht im nicht-metastasierten Stadium oder mit palliativer Intention bei nachgewiesener Metastasierung bspw. zur Symptomkontrolle im Vordergrund. Dadurch lassen sich 5 Standardeingriffe bei den 5 häufigsten oben genannten urologisch-onkologischen Erkrankungen ableiten. Die radikale Prostatektomie beim Prostatakarzinom, die radikale Zystektomie beim Harnblasenkarzinom, die Tumornephrektomie oder Nierenteilresektion bei Nierentumoren, die Ablatio testis beim Keimzelltumor des Hodens und die Penektomie bzw. Penisteilamputation beim Peniskarzinom. Die beiden letztgenannten Tumorentitäten stellen hierbei eine Besonderheit dar, da eine evtl. zugehörige Lymphadenektomie (LAD) in der Regel nicht im Rahmen der operativen Therapie des Primarius, sondern als gesonderter Eingriff erfolgt (inguinale/pelvine): LAD beim Peniskarzinom und retroperitoenale LAD beim Hodentumor [10, 11]. Diese oben genannten operativen Therapien stellen Indexeingriffe dar, anhand derer die Trends der operativen Uroonkologie eines Gesundheitssystems beobachtet und beschrieben werden können [4, 12–14].
Die chirurgische Therapie stellt eine der 3 Säulen in der Behandlung von urologischen Malignomen dar
Erkenntnisse über die Struktur und Entwicklung dieser operativen Therapien in den mehr als 400 urologisch-chirurgisch tätigen Kliniken in Deutschland existierten bis dato jedoch nicht. Zudem wurden die Auswirkungen zahlreicher Einflüsse in der Form von Leitlinienänderungen, technischen Innovationen oder gesundheitspolitischer Maßnahmen bislang nicht untersucht. Somit bestanden unsere Ziele in der Beschreibung und Interpretation der Entwicklungen der operativen Uroonkologie in den letzten 2 Jahrzehnten. Insbesondere wurden hierbei die Einflüsse von technischen Neuerungen (insbesondere der Robotik), Änderungen in den Leitlinienempfehlungen, die Untersuchung des Fallzahleinflusses auf das perioperative Ergebnis und die Diskussion von möglichen gesundheitspolitischen Maßnahmen untersucht.
Methodik
Als primäre Datenquelle wurde die bundesweite Krankenhausabrechnungsdatenbank des Statistischen Bundesamtes verwendet. Die Methoden der Datenextraktion wurden bereits in früheren Publikationen ausführlich beschrieben [16]. Die Diagnosen werden mit dem Standardkodierungssystem ICD-10 (International Classification of Disease Modification 10) kodiert, während für Prozeduren der OPS (Operationen- und Prozedurenschlüssel), eine deutsche Version der internationalen Klassifikation der Prozeduren in der Medizin, implementiert ist. Die Datenbasis bilden die jährlichen deutschen Krankenhausabrechnungsdatensätze, die gemäß gesetzlicher Verpflichtung von deutschen Krankenhäusern an das Statistische Bundesamt übermittelt werden. Die bestehende Datenbank wurde mit zusätzlichen institutionellen Merkmalen (d. h. Lehrstatus, Krankenhausgröße und Standort) ergänzt.
Für ausgewählte Fragestellungen ergänzten wir epidemiologische Daten zur Gesamtinzidenz (Nierenzellkarzinom, Peniskarzinom und Hodenkarzinom) aus dem deutschen „Nationalen Zentrum für Krebsregisterdaten“ am Robert Koch-Institut (RKI; [15]). Für vergleichende Analysen mit dem amerikanischen Gesundheitssystem wurden Behandlungsdaten aus der amerikanischen „Surveillance, Epidemiology, and End Results Program“-(SEER-)Datenbank (für das Nierenzellkarzinom) sowie aus der „nationwide inpatient sample“ (NIS; für das Harnblasenkarzinom und das Nierenzellkarzinom) untersucht.
Korrelationsanalysen erfolgten mittels logistischer Regressionsmodelle. Trendanalysen wurden anhand linearer Regression und mit Wald-Tests mit SAS V9.4 (SAS Institute, Cary, NC) berechnet.
Erfassung der allgemeinen Fallzahlentwicklung
Wir detektierten für die radikale Prostatektomie in Deutschland zwischen 2006 und 2013 eine Dezentralisierung der Versorgung. Im Jahr 2006 wurden in Deutschland insgesamt 28.374 radikale Prostatektomien durchgeführt. Nach einem Maximum von 31.601 Fällen im Jahr 2007 sank diese Zahl auf 21.850 Fälle im Jahr 2013. In allen Krankenhäusern verzeichneten wir einen Rückgang der durchschnittlichen jährlichen Fallzahl von 71,7 im Jahr 2006 auf 56,7 im Jahr 2013 [16].
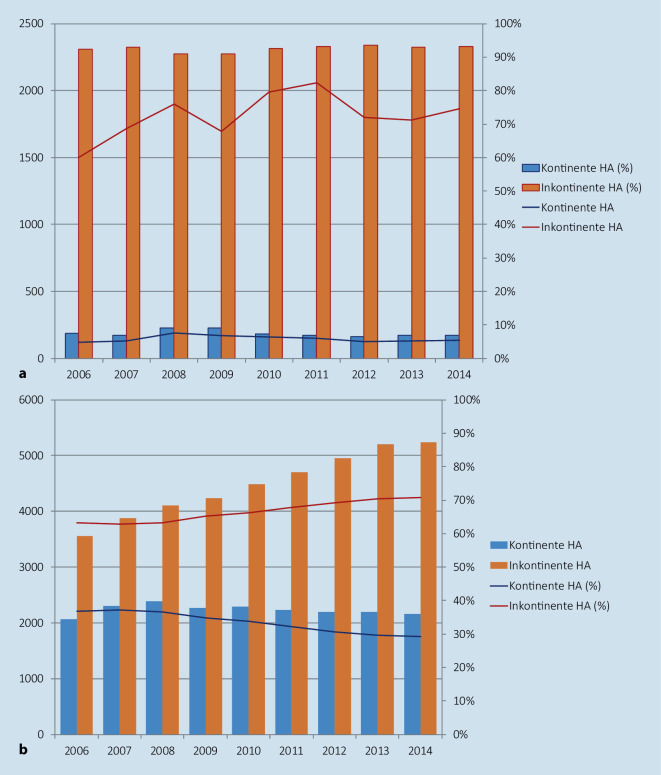
Bezüglich der radikalen Zystektomie wurden in Deutschland im Zeitraum von 2006 bis 2014 mit insgesamt 60.447 Fällen ein Anstieg von 5627 auf 7390 (p < 0,001 für Trends) erfasst. Die jährliche Fallzahl pro Krankenhaus war hierbei in Deutschland wesentlich höher mit 17,9 gegenüber 7,6 Fällen als in den USA (p < 0,001). In Deutschland blieben die Anteile der Zystektomie in Krankenhäusern mit niedriger und hoher Fallzahl stabil bei 0,9 % (p = 0,9) bzw. 14,1 % (p = 0,2). Während des gesamten Studienzeitraums blieb der Anteil der Patienten mit inkontinenter Harnableitung in den USA mit 92,8 % im Jahr 2006 und 93,2 % im Jahr 2014 (p = 0,164) stabil, während er in Deutschland von 63,2 % auf 70,8 % (p < 0,001) anstieg (Abb. 1; [17]). Zunehmendes Alter der Patienten mit vermutlich höherer Komorbidität in den letzten Jahren führte in Deutschland zu einem zunehmenden Einsatz inkontinenter Harnableitungen, während die kontinenten Harnableitungen in den USA offenbar generell eine Seltenheit sind.
Zwischen 2006 und 2014 wurden insgesamt 130.051 Nierentumoroperationen (Nephrektomien und Teilresektionen) für Deutschland (Vollerhebung) aus beiden Abrechnungsdatenbanken erfasst. Die Gesamtzahl der nierenchirurgischen Eingriffe (radikale Nephrektomie und Nierenteilresektion) nahm in dem oben genannten Zeitraum nur leicht zu (in den USA 8,5 %, in Deutschland 11,3 %). Der Anteil der Nierenteilresektion pro Jahr stieg in den USA von 21,5 % auf 39,0 % und in Deutschland von 2,9 % auf 48,4 % [18].
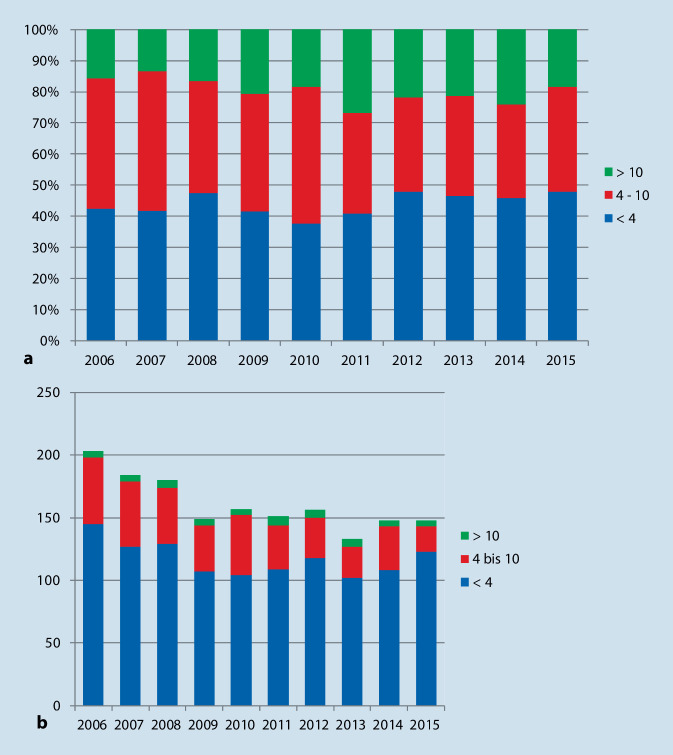
Für die retroperitoneale Lymphadenektomie beim Keimzelltumor zeigte die Analyse von Krebsregisterdaten des RKI (60 % der Gesamtbevölkerung) einen stabilen Verlauf der altersbereinigten Inzidenzrate (Weltstandard) von 9,90 im Jahr 2006 und 9,97 im Jahr 2015 (p = 0,06 für die Trendanalyse). Aus der deutschen Krankenhausabrechnungsdatenbank wurden hierzu 4926 Fälle von retroperitonealer Lymphadenektomie aufgrund eines Keimzelltumors des Hodens extrahiert, die jedoch kontinuierlich von 623 im Jahr 2006 auf 382 im Jahr 2015 abnahmen (p < 0,001). Entgegen dieser Entwicklung stellten wir einen Trend zur unregulierten Zentralisierung in 5 Zentren mit hoher Fallzahl fest (Abb. 2; [19]).
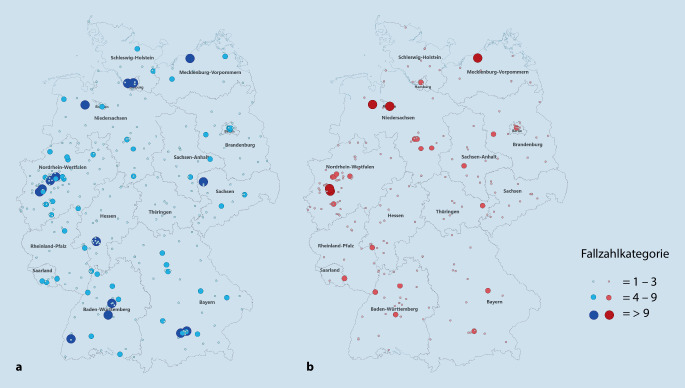
Beim Peniskarzinom wurde eine beständige Zunahme von chirurgischen Eingriffen am Penis (886 im Jahr 2006 auf 1196 im Jahr 2016 [p < 0,001]), der zugehörigen inguinalen und pelvinen Lymphadenektomie (332 im Jahr 2006 auf 590 im Jahr 2016 [p < 0,001]) sowie der Tumorinzidenz (748 auf 971 Fälle [p < 0,001]) festgestellt. Die Auswertung der geographischen Verteilung der Fälle für das Jahr 2016 ergab insbesondere in den ländlichen Gebieten der Bundesländer mit größerer Fläche (z. B. Bayern, Brandenburg, Niedersachsen) ausgedehnte Gebiete ohne Kliniken mit ausreichend hoher Erfahrung in der Peniskarzinomchirurgie (Abb. 3). Die geplante geographische Verteilung von entsprechenden Zentren wäre ein sinnvoller Ansatzpunkt gesundheitspolitischer Maßnahmen um die flächendeckende Versorgung der Patienten auf einem hohen Niveau zu gewährleisten [20].
Einfluss technischer Entwicklungen und Leitlinienänderungen
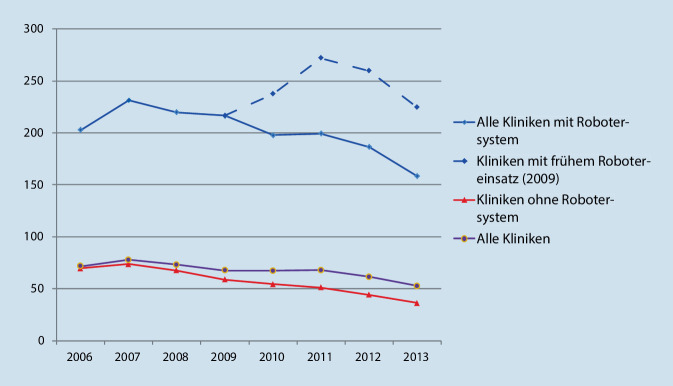
Bei der Prostatektomie war das Vorhandensein eines Robotersystems ein wesentlich wichtigerer Faktor für die Fallzahlentwicklung einer Klinik als die Zertifizierung als Prostatakarzinomzentrum oder der Status einer Universitätsklinik. So konnten, entgegen den insgesamt sinkenden Fallzahlen, Kliniken die einen Operationsroboter bereits vor 2009 einsetzten, ihre Fallzahl von durchschnittlich 202,7 Fällen pro Jahr weitgehend halten. Demgegenüber verzeichneten Krankenhäuser ohne Robotersystem einen Rückgang von 70 auf 36 Fälle pro Jahr (Abb. 4). Die jeweiligen Trends unterschieden sich deutlich (p < 0,001). Ein multivariates Modell für die Fallzahlen im Jahr 2013 zeigte zudem, dass ein Robotersystem (mit einem Multiplikationsfaktor von 7,3; 95 %-Konfidenzintervall [‑KI]: 6,6–8,0) ein wesentlich wichtigerer Faktor für höhere Fallzahlen als die Zertifizierung als Prostatakrebszentrums (Multiplikationsfaktor 1,6; 95 %-KI: 1,50–1,59) ist. Dies zeigt, dass mit dem Prinzip der freiwilligen Zertifizierung derzeit keine Zentralisierung der radikalen Prostatektomie in Deutschland erreicht wird [16].
Während die roboterassistierte radikale Zystektomie in den USA eine gut etablierte Alternative zur offenen Operation mit beständig steigenden Zahlen ist (0,7 % in 2006 auf 20,5 % in 2014 [p < 0,001]), scheint dieser Trend in Deutschland nicht vorhanden zu sein (0 % in 2006 auf 2,3 % in 2014 [p < 0,001]). Wesentliche Gründe hierfür könnten die fehlende Erstattungsfähigkeit der zusätzlichen Kosten der robotergestützten Operation in Deutschland als auch die Sorge vor atypischen Tumorrezidiven nach robotergestützter Zystektomie sein [21].
Die Anteile der robotergestützten Eingriffe bei der Behandlung von Nierentumoren steigt
Die Anteile der robotergestützten Eingriffe bei der Behandlung von Nierentumoren steigt sowohl in den USA als auch in Deutschland (0,2 % n 2006 auf 8,6 % in 2014 [p < 0,001]) stetig an, wobei sie in den USA bereits den Standard bei der Nierenteilresektion darstellen (von 0 % auf 54,5 % [p < 0,001]). Demgegenüber sind die Anteile eines nierenerhaltenden Vorgehens, wie es von den aktuellen Leitlinien gefordert wird, in Deutschland (von 38,5 % auf 72,9 % [p < 0,001]) gegenüber den USA (30,6 % auf 57 % [p < 0,001]) höher. Für den Organerhalt war in beiden Ländern die Durchführung als robotisch gestützte Operation ein stark prädiktiver Faktor (Odds Ratio [OR] 0,14 für die Durchführung einer Nephrektomie in Deutschland und USA OR 0,19).
Die Indikation zur radikalen Nephrektomie scheint immer noch häufig dem Wunsch nach einer laparoskopischen Operationstechnik (in Deutschland um 50 % und in den USA um 80 % wahrscheinlicher) zu folgen. Der Verzicht auf den Organerhalt zugunsten der Operationstechnik steht jedoch klar im Gegensatz zu den Leitlinienempfehlungen [22, 23]. Darüber hinaus zeigte sich die Chance eine radikale Nephrektomie in Krankenhäusern mit geringerem Fallaufkommen zu erhalten fast doppelt so hoch (≤ 20 Fälle pro Jahr: OR 1,9 in Deutschland und OR 1,8 in den USA; [18]).
Wir sahen eine wachsende Tendenz zum Einsatz des Operationsroboters im Rahmen der RLA beim Keimzelltumor. Die Anteile der offenen RLA in Deutschland sanken im beobachteten Zeitraum von 84,8 % auf 77,8 %, während die Anteile am konventionell laparoskopischen Zugang von 15,2 % auf 16,5 % und der roboterassistierten RLA von 0 % auf 5,7 % stieg (p = 0,027 zum Trendvergleich). Allerdings erfolgte dies offensichtlich eher bei weniger ausgedehnten Erkrankungen und technisch weniger anspruchsvollen Eingriffen [19]. Der ausgeprägte Rückgang der Fallzahlen der RLA im untersuchten Zeitraum bei gleichzeitiger Stabilität der Tumorinzidenzen und -stadien ist gemäß unseren Studien in erster Linie auf eine konstante Reduktion des Indikationsbereichs in den Leitlinien zurückzuführen. So wurde in der Fassung der EAU-Leitlinie (European Association of Urology) des Jahres 2005 die RLA neben einer adjuvanten Chemotherapie für Patienten mit einem nicht-seminomatösen Keimzelltumor im klinischen Stadium IA empfohlen, die sich keiner Surveillance unterziehen wollen und für Patienten im klinischen Stadium IB neben einer Surveillance mit hohem Risiko für einen Rückfall, die sich keiner Chemotherapie unterziehen können oder wollen [24].
Im Jahr 2008 zeigte eine randomisierte, kontrollierte Phase-III-Studie eine Überlegenheit für die Chemotherapie gegenüber der RLA hinsichtlich der Rezidivraten im adjuvanten Setting für Patienten im Stadium I der Erkrankung [25]. In der Folge kam es 2009 zur Änderung der Leitlinienempfehlungen, sodass eine Operation in der adjuvanten Situation nur noch bei Patienten mit einer Kontraindikation für eine Chemotherapie in Betracht gezogen werden sollte, was wiederum den Stellenwert der adjuvanten oder diagnostischen RLA deutlich reduzierte und zu sinkenden Fallzahlen führte [26].
Während die Bedeutung der robotischen Chirurgie in der Therapie des Peniskarzinoms auf die pelvine Lymphadenektomie begrenzt ist, zeigen wachsende Anteile an organerhaltender Penischirurgie (Zunahme der Teilamputation von 45,8 % in 2006 auf 53,8 % in 2016 [p < 0,001]) sowie der Einsatz der Sentinel-Technik bei der inguinalen Lymphadenektomie (14,2 % im Jahr 2006 auf 21,9 % im Jahr 2016; [20]) eine zunehmende Umsetzung der aktuellen Leitlinien [11, 27].
Verhältnis von Fallzahl und Outcome
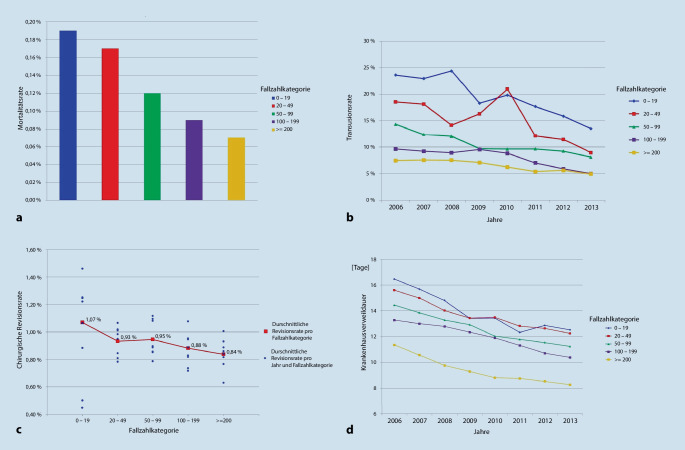
In Bezug auf die radikale Prostatektomie stellten sich klare Vorteile für Krankenhäuser mit hoher jährlicher Fallzahl hinsichtlich aller vier untersuchten Ergebnisse heraus (Mortalität, Bluttransfusionen, chirurgische Revisionsrate und Aufenthaltsdauer; Abb. 5). So zeigten die Ergebnisse eines multivariaten Modells hinsichtlich der Mortalität während des stationären Aufenthalts in Krankenhäusern mit < 50 Fällen pro Jahr ein verdoppeltes Mortalitätsrisiko. In Bezug auf die Transfusionsrate erhöhte eine geringe jährliche Fallzahl (OR 2,8) das Risiko einer Bluttransfusion. Chirurgische Revisionen waren ebenso wahrscheinlicher in Krankenhäusern mit einer kleineren Fallzahl (OR 1,4). Und selbst die Dauer des Klinikaufenthaltes wurde vornehmlich durch die Klinikfallzahl bestimmt. So verkürzte eine jährliche Fallzahl von ≥ 200 den Aufenthalt um durchschnittlich 3 Tage [28].
Ebenso wurden für die radikale Zystektomie deutliche Vorteile bezüglich der Mortalitätsrate und der Krankenhausverweildauer für Kliniken mit hoher jährlicher Fallzahl sowohl in den USA als auch in Deutschland nachgewiesen. Dieser Umstand wird auch von der deutschen Leitlinie ausdrücklich in Bezug auf die Klinikwahl erwähnt [29]. Entsprechend unserer multivariaten Analyse waren von den untersuchten Einflussfaktoren in den USA das zunehmende Alter und die geringere jährliche Fallzahl der Krankenhäuser die wichtigsten Risikofaktoren für Mortalität im Krankenhaus (Tab. 1). In Deutschland zeigten das zunehmende Alter, die geringere jährliche Fallzahl im Krankenhaus und die Art der Harnableitung den größten Einfluss [21]. Trotz dieser Erkenntnisse sind für die radikale Zystektomie keine Zentralisierungstendenzen in Deutschland erkennbar und für die radikale Prostatektomie musste sogar bei insgesamt sinkenden Fallzahlen ein Trend zur Dezentralisierung im beobachteten Zeitraum festgestellt werden. Zusätzliche gesundheitspolitische Maßnahmen könnten hier notwendig werden, um eine entsprechende Entwicklung zu bewirken.
| Land | |||||
|---|---|---|---|---|---|
| USA | Deutschland | ||||
| Variable | OR (95 %-KI) | p-Wert | OR (95 %-KI) | p-Wert | |
| Minimalinvasiver Eingriff | Nein | 1,44 (0,74–2,83) | 0,2854 | 0,89 (0,60–1,31) | 0,5 |
| Ja (Referenz) | 1 | – | 1 | – | |
| Harnableitung | Inkontinent | 1,40 (0,71–2,76) | 0,3374 | 2,04 (1,78–2,34) | < 0,0001 |
| Kontinent (Referenz) | 1 | – | 1 | – | |
| Jährliche Krankenhausfallzahl | 0–3 | 2,26 (1,41–3,62) | 0,0007 | 2,16 (1,37–3,40) | 0,0010 |
| 4–10 | 1,51 (1,00–2,28) | 0,0482 | 1,53 (1,20–1,94) | 0,0005 | |
| 11–25 | 1,58 (1,08–2,31) | 0,0188 | 1,22 (1,22–1,81) | < 0,0001 | |
| 26–50 | 0,78 (0,47–1,30) | 0,3374 | 1,03 (1,03–1,50) | 0,0253 | |
| 50+ (Referenz) | 1 | – | 1 | – | |
| Uniklinikum | Ja | 0,95 (0,69–1,31) | 0,7445 | 1,05 (0,88–1,24) | 0,6 |
| Nein (Referenz) | 1 | – | 1 | – | |
| Krankenhausgröße (Bettenzahl) | Klein | 0,59 (0,36–0,99) | 0,0457 | 0,93 (0,78–1,12) | 0,5 |
| Mittel | 1,09 (0,80–1,51) | 0,5792 | 1,14 (0,99–1,31) | 0,7 | |
| Groß (Referenz) | 1 | – | 1 | – | |
| Geschlecht | Weiblich | 1,07 (0,81–1,41) | 0,6367 | 0,81 (0,72–0,91) | 0,0003 |
| Männlich (Referenz) | 1 | – | 1 | – | |
| Alter (Jahre) | > 50 (Referenz) | 1 | – | 1 | – |
| 50–59 | 0,78 (0,34–1,80) | 0,5644 | 1,08 (0,71–1,66) | 0,7 | |
| 60–69 | 0,88 (0,41–1,89) | 0,7456 | 1,71 (1,15–2,54) | 0,0078 | |
| 70–79 | 2,20 (1,07–4,55) | 0,0330 | 2,35 (1,59–3,47) | < 0,0001 | |
| 80+ | 3,01 (1,43–6,34) | 0,0037 | 3,56 (2,38–5,32) | < 0,0001 | |
OR Odds Ratio, KI Konfidenzintervall
Bei der retroperitonealen Lymphadenektomie wurden erste Tendenzen zu ungesteuerter Zentralisierung im Sinne einer Konzentrierung von insbesondere komplexeren Fällen in 5 deutschen Zentren mit höherer Fallzahl beobachtet. Es zeigten sich nahezu verdoppelte Transfusionsraten in Krankenhäusern mit hoher Fallzahl. Dies lässt sich z. T. dadurch erklären, dass die komplexeren Fälle an diese Zentren überwiesen werden. Diese Annahme wird auch durch deutlich höhere Case-mix-Werte in Krankenhäusern mit hoher Fallzahl sowie in Universitätskliniken gestützt.
Trotz rückläufiger Fallzahlen bei der RLA geht der Trend zur Zentralisierung in großen Zentren
Darüber hinaus zeigte die Untersuchung des chirurgischen Ausmaßes („extents“), dass radikale RLA in großen Zentren häufiger durchgeführt werden als modifizierte RLA oder die Exzision von einzelnen Lymphknoten (sog. „Pick-up-RLA“). Die Überweisung von komplexeren Patienten an erfahrene Zentren ist Teil der von uns beobachteten ungesteuerten Zentralisierung in Deutschland. Trotz dieser komplexen chirurgischen Eingriffe wiesen diese Zentren vergleichbare Mortalitätsraten und eine kürzere Verweildauer im Vergleich zu Kliniken mit geringer Fallzahl auf (10,5 ± 7,7 Tage [hoch] vs. 11,2 ± 7,2 Tage [mittel] vs. 11,4 ± 8,3 Tage [niedrig; p = 0,006]; [19]).
Für die chirurgische Therapie des Peniskarzinoms konnten keine entscheidenden Korrelationen zwischen Fallzahl und postoperativen Ergebnissen festgestellt werden. Dies ist am ehesten den begrenzten Informationen des Datensatzes sowie der geringen Frequenz der entsprechenden Eingriffe und untersuchten Ereignisse geschuldet [20].
Zusammenfassend lässt sich festhalten, dass unsere Ergebnisse in Übereinstimmung mit der internationalen Literatur die Hypothese der Korrelation zwischen Fallzahlvolumen einer Klinik und verbessertem perioperativem Ergebnis unterstützen [18, 19, 21, 28, 30–34]. Dies gilt insbesondere für die Studien zur Prostatektomie, Zystektomie und Nierentumoroperation als auch für die retroperitoneale Lymphadenektomie. Untersuchte Outcomeparameter hierbei waren die Mortalitätsrate, die Transfusionsrate, chirurgische Revision sowie die Krankenhausverweildauer. Dennoch können keine zentral gesteuerten Tendenzen zur Zentralisierung bei den oben genannten uroonkologischen Eingriffen nachgewiesen werden. Zentralisierung im Sinne einer Zunahme der Fallzahlen in Kliniken mit hoher Fallzahl und damit Expertise ergibt sich aus den allgemeinen Fallzahlentwicklungen, welche den allgemeinen Trends bedingt durch Änderungen der Leitlinien und technischer Entwicklung folgen. Fallzahlverteilungen scheinen vielmehr von Werbeeffekten mittels technischer Innovationen oder auch vom regionalen Bezug der Patienten zu einer bestimmten Klinik abhängig zu sein. Zentral gesteuerte Versuche mittels Einführung von Mindestfallzahlmengen oder der freiwilligen Zertifizierung von Zentren hatten in der Vergangenheit nur geringen Einfluss auf die Fallzahlverteilungen [16].
Ausblick
Gerade in Bezug auf Tumorentitäten mit geringer Inzidenz und geringer Frequenz der entsprechenden chirurgischen Eingriffe ist die Aussagekraft von Analysen begrenzter Datensätze einzelner Zentren oder multizentrischer Datensätze von mehreren selektierten Zentren in der Regel einem hohen Selektionsbias unterworfen und spiegelt nicht die tatsächliche Versorgungssituation eines Landes oder einer Region wider. Hierfür sind Analysen von großvolumigen Datensätzen mit Abbildung sämtlicher Gesundheitsversorgungseinrichtungen (insbesondere Krankenhäuser) eines Landes oder eines Gesundheitssystems erforderlich.
Multizentrische Studien helfen, die Faktoren zur Wahl der operativen Einrichtung zu erfassen
Multizentrische Studien helfen durch Befragung der Patienten die entscheidenden Faktoren zur Wahl der operativen Einrichtung zu erfassen (z. B. Einfluss von sozialen Medien oder Onlinewerbung). Eine solche Untersuchung müsste longitudinal und multizentrisch angelegt sein, um diese Faktoren möglichst breit über alle Kategorien von Kliniken und alle Regionen des Landes zu erfassen und eine möglichst repräsentative Aussage treffen zu können. Die entsprechenden Ergebnisse können unter anderem dabei helfen sowohl die Kliniken bezüglich möglicher Werbeeffekte als auch die Patienten gezielt bei der Wahl des Krankenhauses zu beraten. In einer aktuell laufenden Studie unserer Arbeitsgruppe unter dem Dach der GeSRU-Academics (German Society of Residents in Urology) werden bspw. mittels einer multizentrischen Patientenumfrage die Effekte von Onlineplattformen mit Beratungsfunktion bezüglich der geeigneten Kliniken (sog. „Krankenhausnavigatoren“) auf die Auswahl des entsprechenden Krankenhauses durch den Patienten untersucht [35].
Da wie bereits beschrieben die Bildung der Fallzahlkategorien zur Korrelation mit den postoperativen Ergebnissen nicht primär auf vorhandener Evidenz aus der Literatur erfolgen konnte und Erkenntnisse über die eigentlich erforderliche Fallzahl zur Verbesserung des Outcomes bis dato weitgehend fehlen, wird ein zukünftig entscheidender Punkt in der Suche nach Grenzwerten und Mindestfallzahlmengen für bestimmte uroonkologische Eingriffe liegen. In einer aktuellen Studie beschäftigen wir uns bereits mit einer entsprechenden Fragestellung bei der chirurgischen Therapie von Patienten, die einen fortgeschrittenen Nierentumor mit Cavazapfen aufweisen [36]. In einem empirischen Ansatz konnte hierbei ein Schwellenwert von 7 bzw. 8 entsprechenden Eingriffen pro Jahr berechnet werden, wobei es ab dieser Grenze zu einer deutlich geringeren assoziierten Mortalitätsrate pro Jahr kam. Zur Umsetzung dieser wissenschaftlichen Erkenntnisse bedarf es letztendlich eines entsprechenden politischen Willens. Dass eine solche Entwicklung zum Wohle unserer Patienten möglich ist, zeigt sich aus Beispielen anderer Gesundheitswesen [30–34]. Neben der Mindestfallzahl sollten hierbei auch strukturelle Vorgaben und andere qualitätsbezogene Aspekte hinzukommen.
Ferner konnten wir darstellen, dass die Entwicklung der Fallzahlen insgesamt von äußeren Faktoren beeinflusst wird (technische Entwicklungen, Veränderungen von Leitlinienempfehlungen, Entwicklung neuer Therapiekonzepte etc.). Es wird für die Entwicklung von gesundheitspolitischen Konzepten bedeutsam sein solche Einflüsse wie z. B. aktuell auch die COVID-19-Pandemie („coronavirus disease 2019“) zu verstehen und frühzeitig ihre Auswirkungen vorherzusagen. Dies impliziert, dass die von uns begonnen Trendanalysen der urologischen Tumorchirurgie fortgesetzt werden sollten, um diese Auswirkungen in ihrem longitudinalen Verlauf abbilden zu können.
Die Kenntnis der Einflussfaktoren auf die Fallzahlentwicklung ist von gesundheitspolitischer Bedeutung
Eine wesentliche Limitierung in der Aussagekraft unserer Analysen liegt in den beschränkten patientenbezogenen Informationen der verwendeten Datensätze. Wichtige Outcomeparameter wie funktionelle Ergebnisse oder Lebensqualität sind hier nicht berücksichtigt. Ebenso können zahlreiche entscheidende Einflussfaktoren auf die operativen Ergebnisse wie Histologie und Tumorstadium, Komorbidität oder der Performancestatus des Patienten nicht miteinbezogen werden. Somit muss ein zukünftiges Ziel der Versorgungsforschung die Schaffung von repräsentativen (und anonymisierten) Datensätzen auf Bevölkerungsebene sein, die diese Faktoren beinhalten. Hierdurch könnten Patienten in der Zukunft wesentlich besser für chirurgische Interventionen selektioniert und individualisiert über mögliche Risiken und alternative Behandlungsstrategien beraten werden.
Fazit für die Praxis
Zahlreiche Hinweise aus unseren Ergebnissen sowie aus der aktuellen Literatur bestätigen eine deutliche Korrelation zwischen Fallzahlvolumen (und damit Expertise) einer Klinik und einem verbesserten postoperativen Ergebnis.
Trotz dieser Erkenntnisse existiert kaum Initiative oder Tendenz zur Zentralisierung – insbesondere nicht bei ausgedehnten tumorchirurgischen Eingriffen in der deutschen Urologie.
Die Fallzahlverteilung scheint vielmehr von Werbung mittels technischer Innovationen oder auch vom regionalen Bezug der Patienten zu einer bestimmten Einrichtung abhängig zu sein.
Zentral gesteuerte Versuche beispielsweise mittels Einführung von Mindestfallzahlmengen hatten in der Vergangenheit nur geringen Einfluss auf die Fallzahlverteilungen.
Wir konnten zudem zeigen, dass auch das System der freiwilligen Zertifizierung von Zentren nur wenig Einfluss auf die Lenkung von Patienten in Zentren hat.
Einhaltung ethischer Richtlinien
Interessenkonflikt
C. Groeben, R. Koch, M. Baunacke, L. Flegar, A. Borkowetz, C. Thomas und J. Huber geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Die vorliegende Übersicht basiert auf der kumulativen Habilitationsschrift von Herrn Dr. med. Christer Groeben.

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Robert Koch-Institut (2021) Zentrum für Krebsregisterdaten im Robert Koch-Institut: Datenbankabfrage mit Schätzung der Inzidenz, Prävalenz und des Überlebens von Krebs in Deutschland auf Basis der epidemiologischen Landeskrebsregisterdaten. www.krebsdaten.de/abfrage. Zugegriffen: 25. Juni 2021 (10.18444/5.03.01.0005.0015.0002 [Inzidenz, Prävalenz]; 10.18444/5.03.01.0005.0014.0001 [Überleben])
- 2.Aziz A, May M, Burger M, Palisaar RJ, Trinh QD, Fritsche HM, Rink M, Chun F, Martini T, Bolenz C, Mayr R, Pycha A, Nuhn P, Stief C, Novotny V, Wirth M, Seitz C, Noldus J, Gilfrich C, Shariat SF, Brookman-May S, Bastian PJ, Denzinger S, Gierth M, Roghmann F. Prediction of 90-day mortality after radical cystectomy for bladder cancer in a prospective European multicenter cohort. Eur Urol. 2014;66(1):156–163. doi: 10.1016/j.eururo.2013.12.018S0302-2838(13)01379-1. [DOI] [PubMed] [Google Scholar]
- 3.Barres B. Bericht zum Krebsgeschehen in Deutschland. Berlin: Robert Koch-Institut; 2016. [Google Scholar]
- 4.Roghmann F, Sukumar S, Ravi P, Trinh VQ, Meskawi M, Ghani KR, Sammon JD, Friedman AA, Peabody JO, Menon M, Noldus J, Karakiewicz PI, Sun M, Trinh QD. Radical cystectomy in the elderly: national trends and disparities in perioperative outcomes and quality of care. Urol Int. 2014;92(1):27–34. doi: 10.1159/000353091. [DOI] [PubMed] [Google Scholar]
- 5.Christodoulidou M, Sahdev V, Houssein S, Muneer A. Epidemiology of penile cancer. Curr Probl Cancer. 2015;39(3):126–136. doi: 10.1016/j.currproblcancer.2015.03.010. [DOI] [PubMed] [Google Scholar]
- 6.Hakenberg OW, Dräger DL, Erbersdobler A, Naumann CM, Jünemann KP, Protzel C. The diagnosis and treatment of penile cancer. Dtsch Arztebl Int. 2018;115(39):646–652. doi: 10.3238/arztebl.2018.0646. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Znaor A, Lortet-Tieulent J, Laversanne M, Jemal A, Bray F. International testicular cancer incidence trends: generational transitions in 38 countries 1900–1990. Cancer Causes Control. 2015;26(1):151–158. doi: 10.1007/s10552-014-0486-z. [DOI] [PubMed] [Google Scholar]
- 8.Palumbo C, Mistretta FA, Mazzone E, Knipper S, Tian Z, Perrotte P, Antonelli A, Montorsi F, Shariat SF, Saad F, Simeone C, Briganti A, Lattouf JB, Karakiewicz PI. Contemporary incidence and mortality rates in patients with testicular germ cell tumors. Clin Genitourin Cancer. 2019;17(5):e1026–e1035. doi: 10.1016/j.clgc.2019.06.003. [DOI] [PubMed] [Google Scholar]
- 9.Protzel C, Hakenberg OW. Peniskarzinom. Onkologe. 2019;25:1027–1040. doi: 10.1007/s00761-019-00662-z. [DOI] [Google Scholar]
- 10.European Association of Urology . EAU guidelines on testicular cancer 2020. 2020. [Google Scholar]
- 11.Hakenberg OC, Compérat E, Minhas S, Necchi A, Protzel C, Watkin N. Guidelines on penile cancer. Arnhem: European Association of Urology; 2020. [DOI] [PubMed] [Google Scholar]
- 12.Huland H, Graefen M. Changing trends in surgical management of prostate cancer: the end of overtreatment? Eur Urol. 2015;68(2):175–178. doi: 10.1016/j.eururo.2015.02.020. [DOI] [PubMed] [Google Scholar]
- 13.Kim SP, Shah ND, Weight CJ, Thompson RH, Wang JK, Karnes RJ, Han LC, Ziegenfuss JY, Frank I, Tollefson MK, Boorjian SA. Population-based trends in urinary diversion among patients undergoing radical cystectomy for bladder cancer. BJU Int. 2013;112(4):478–484. doi: 10.1111/j.1464-410X.2012.11508.x. [DOI] [PubMed] [Google Scholar]
- 14.Patel HD, Joice GA, Schwen ZR, Semerjian A, Alam R, Srivastava A, Allaf ME, Pierorazio PM. Retroperitoneal lymph node dissection for testicular seminomas: population-based practice and survival outcomes. World J Urol. 2018;36(1):73–78. doi: 10.1007/s00345-017-2099-0. [DOI] [PubMed] [Google Scholar]
- 15.Hager B, Kraywinkel K, Keck B, Katalinic A, Meyer M, Zeissig SR, Stabenow R, Froehner M, Huber J. Integrated prostate cancer centers might cause an overutilization of radiotherapy for low-risk prostate cancer: a comparison of treatment trends in the United States and Germany from 2004 to 2011. Radiother Oncol. 2015;115(1):90–95. doi: 10.1016/j.radonc.2015.02.024. [DOI] [PubMed] [Google Scholar]
- 16.Groeben C, Koch R, Baunacke M, Wirth MP, Huber J. Robots drive the German radical prostatectomy market: a total population analysis from 2006 to 2013. Prostate Cancer Prostatic Dis. 2016;19(4):412–416. doi: 10.1038/pcan.2016.34. [DOI] [PubMed] [Google Scholar]
- 17.Groeben C, Koch R, Baunacke M, Schmid M, Borkowetz A, Wirth MP, Huber J. Urinary diversion after radical cystectomy for bladder cancer: comparing trends in the US and Germany from 2006 to 2014. Ann Surg Oncol. 2018;25(12):3502–3509. doi: 10.1245/s10434-018-6381-1. [DOI] [PubMed] [Google Scholar]
- 18.Flegar L, Groeben C, Koch R, Baunacke M, Borkowetz A, Kraywinkel K, Thomas C, Huber J. Trends in renal tumor surgery in the United States and Germany between 2006 and 2014: organ preservation rate is improving. Ann Surg Oncol. 2020;27(6):1920–1928. doi: 10.1245/s10434-019-08108-x. [DOI] [PubMed] [Google Scholar]
- 19.Groeben C, Koch R, Nestler T, Kraywinkel K, Borkowetz A, Wenzel S, Baunacke M, Thomas C, Huber J. Centralization tendencies of retroperitoneal lymph node dissection for testicular cancer in Germany? A total population-based analysis from 2006 to 2015. World J Urol. 2020;38(7):1765–1772. doi: 10.1007/s00345-019-02972-8. [DOI] [PubMed] [Google Scholar]
- 20.Groeben C, Koch R, Kraywinkel K, Buttmann-Schweiger N, Baunacke M, Borkowetz A, Thomas C, Huber J. Development of incidence and surgical treatment of penile cancer in Germany from 2006 to 2016: potential implications for future management. Ann Surg Oncol. 2021 doi: 10.1245/s10434-021-10189-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Groeben C, Koch R, Baunacke M, Borkowetz A, Wirth MP, Huber J. In-hospital outcomes after radical cystectomy for bladder cancer: comparing national trends in the United States and Germany from 2006 to 2014. Urol Int. 2019;102(3):284–292. doi: 10.1159/000496347. [DOI] [PubMed] [Google Scholar]
- 22.European Association of Urology . Guidelines on renal cell carcinoma. 2020. [Google Scholar]
- 23.Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft DK, AWMF) Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 2.0. 2020. [Google Scholar]
- 24.European Association of Urology . Guidelines on testicular cancer. 2005. [Google Scholar]
- 25.Albers P, Siener R, Krege S, Schmelz HU, Dieckmann KP, Heidenreich A, Kwasny P, Pechoel M, Lehmann J, Kliesch S, Kohrmann KU, Fimmers R, Weissbach L, Loy V, Wittekind C, Hartmann M. Randomized phase III trial comparing retroperitoneal lymph node dissection with one course of bleomycin and etoposide plus cisplatin chemotherapy in the adjuvant treatment of clinical stage I Nonseminomatous testicular germ cell tumors: AUO trial AH 01/94 by the German Testicular Cancer Study Group. J Clin Oncol. 2008;26(18):2966–2972. doi: 10.1200/JCO.2007.12.0899. [DOI] [PubMed] [Google Scholar]
- 26.European Association of Urology . Guidelines on testicular cancer. 2009. [Google Scholar]
- 27.Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft DK, AWMF) S3-Leitlinie Diagnostik, Therapie und Nachsorge des Peniskarzinoms. 2020. [Google Scholar]
- 28.Groeben C, Koch R, Baunacke M, Wirth MP, Huber J. High volume is the key for improving in-hospital outcomes after radical prostatectomy: a total population analysis in Germany from 2006 to 2013. World J Urol. 2017;35(7):1045–1053. doi: 10.1007/s00345-016-1982-4. [DOI] [PubMed] [Google Scholar]
- 29.Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft DK, AWMF) S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. 2016. [Google Scholar]
- 30.Afshar M, Goodfellow H, Jackson-Spence F, Evison F, Parkin J, Bryan RT, Parsons H, James ND, Patel P. Centralisation of radical cystectomies for bladder cancer in England, a decade on from the „Improving Outcomes Guidance“: the case for super centralisation. BJU Int. 2018;121(2):217–224. doi: 10.1111/bju.13929. [DOI] [PubMed] [Google Scholar]
- 31.Cathcart P, Sridhara A, Ramachandran N, Briggs T, Nathan S, Kelly J. Achieving quality assurance of prostate cancer surgery during reorganisation of cancer services. Eur Urol. 2015;68(1):22–29. doi: 10.1016/j.eururo.2015.02.028. [DOI] [PubMed] [Google Scholar]
- 32.Hermans TJ, Fransen van de Putte EE, Fossion LM, Werkhoven EV, Verhoeven RH, van Rhijn BW, Horenblas S. Variations in pelvic lymph node dissection in invasive bladder cancer: A Dutch nationwide population-based study during centralization of care. Urol Oncol. 2016;34(12):532.e7–532.e12. doi: 10.1016/j.urolonc.2016.06.018. [DOI] [PubMed] [Google Scholar]
- 33.Tang V, Clarke L, Gall Z, Shanks JH, Nonaka D, Parr NJ, Elliott PA, Clarke NW, Ramani V, Lau MW, Sangar VK. Should centralized histopathological review in penile cancer be the global standard? BJU Int. 2014;114(3):340–343. doi: 10.1111/bju.12449. [DOI] [PubMed] [Google Scholar]
- 34.Williams SB, Ray-Zack MD, Hudgins HK, Oldenburg J, Trinh QD, Nguyen PL, Shore ND, Wirth MP, O’Brien T, Catto JWF. Impact of centralizing care for genitourinary malignancies to high-volume providers: a systematic review. Eur Urol Oncol. 2019;2(3):265–273. doi: 10.1016/j.euo.2018.10.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Groeben C, Böhm K, Sonntag U, Nestler T, Struck J, Heck M, Baunacke M, Uhlig A, Kölker M, Meyer CP, Becker B, Salem J, Huber J, Leitsmann M. Nutzung von Krankenhausnavigatoren bei uroonkologischen Patienten in Deutschland Ergebnisse der multizentrischen NAVIGATOR-Studie. Urologe. 2021;60(Suppl 1):NN. [Google Scholar]
- 36.Groeben C. Welche Mindestfallzahl befähigt zum sicheren Management von Cava-Zapfen? Eine Totalerhebung von 2.810 Fällen in Deutschland von 2006 bis 2016. Urologe. 2020;59(Suppl 1):S13. [Google Scholar]