Abstract
新生儿脑静脉(窦)血栓(cerebral sinovenous thrombosis,CSVT)是一种实际发病率被严重低估的脑血管疾病,因临床表现无明显特征及传统影像学检查灵敏度低,长期以来被认为是新生儿期罕见疾病。近年来,磁共振技术的发展提高了CSVT的诊断率,该文对新生儿颅内静脉解剖、CSVT及深部静脉血栓临床表现、影像学特征、治疗及预后的研究进展做一综述,旨在提高临床医生对新生儿CSVT的认识,有助于正确诊治。
Keywords: 脑静脉(窦)血栓, 研究进展, 新生儿
Abstract
Neonatal cerebral sinovenous thrombosis (CSVT) is a cerebrovascular disease with a seriously underestimated incidence rate. Due to a lack of specific clinical manifestations and the low sensitivity of conventional imaging examinations, it has long been considered a rare disease in neonates. In recent years, the development of magnetic resonance technology has improved the diagnostic rate of CSVT. This article reviews the research advances in intracranial venous anatomy of neonates and clinical manifestations, imaging features, treatment, and prognosis of CSVT and deep venous thrombosis, in order to improve the understanding and to make correct diagnosis and treatment of neonatal CSVT.
Keywords: Cerebral sinovenous thrombosis, Research advance, Neonate
脑静脉(窦)血栓(cerebral sinovenous thrombosis,CSVT)是一种因单支或多支静脉窦部分或完全堵塞,使引流静脉系统的血流受阻,导致颅内出血及梗死的严重神经系统疾病。多种围生期危险因素与新生儿CSVT发生有关,如缺氧缺血、败血症、呼吸窘迫综合征、脱水等,导致大脑血流动力学不稳定,血管损伤及凝血功能异常,形成静脉窦血栓。由于缺少临床特异性表现,新生儿CSVT诊断难度大,导致临床缺少有效早期治疗,往往预后不良[1-3]。近年影像技术迅速发展,提高了CSVT诊断率,同时发现深部静脉(髓静脉)血栓形成是导致脑白质损伤的重要病理机制[4-5],然而新生儿CSVT及深静脉受累导致脑白质损伤尚未引起广泛重视。本文对新生儿颅内静脉解剖、CSVT及深部静脉血栓临床表现、影像学特征、治疗及预后的研究进展做一综述,深入认识血管源性疾病所致脑损伤的重要临床意义。
1. 流行病学特点
一项荷兰回顾性多中心研究发现每年新生儿CSVT发病率为(2~12)/100 000,在新生儿时期发病率最高,占儿童CSVT的30%~50%[6]。实际发病率应高于该数值,原因主要有:新生儿CSVT临床表现不典型、早期很难及时完善影像学检查、影像技术不成熟及临床医生对其缺乏认识。该病存在性别倾向,男婴CSVT风险更高[1],危险因素包括孕母子痫前期、妊娠糖尿病、产伤、先天性易栓症及感染等[2]。大多数病例发生在生后第1周,临床症状最常见是惊厥,其他包括嗜睡、淡漠、肌张力异常、呕吐、拒乳、呼吸抑制等非特异症状,严重者出现视觉缺陷、癫痫、感觉运动障碍,甚至死亡等不良预后[3,7]。
2. 脑静脉系统的发育和解剖特点
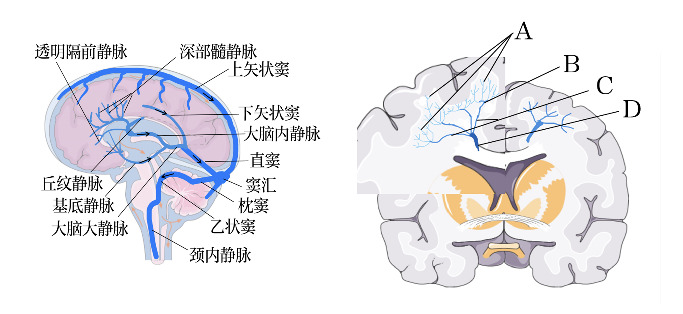
围生期婴儿脑静脉处于一个复杂的重构阶段(表1),许多明确的成人静脉逐渐形成,胚胎静脉逐渐退化[8]。脑半球静脉各级分支如图1 [9],引流通路如图2左。大脑皮质内静脉短而直,有微小外侧支(特别是第3层至第6层皮质细胞层),垂直汇入主干静脉;皮质下静脉呈弓形,位于皮髓质交界处;浅层髓静脉起源于脑回白质或半卵形中央浅部,连接软脑膜静脉;深部髓静脉起源于距软脑膜1~2 cm的位置,汇聚成扇形,血流方向为向心方向[10]。在前额叶汇集过程中形成4个区域(图2右),由浅入深,血管管径逐渐增大,血管数目减少,整体呈放射状扇形结构,34~35周之前深浅髓静脉终末分支发育尚不成熟,这种特殊深部髓静脉结构是发生静脉淤血的重要原因[11]。相比动脉系统,静脉系统结构变异度较高[12],通过磁敏感血管造影发现早产儿多种室管膜下静脉解剖结构,其中差异在于透明隔前静脉与大脑内静脉的交汇点不同,可伴有外侧直静脉和/或丘纹静脉的缺如[13]。由于异常静脉结构及早期血管发育不成熟,在血流动力学不稳定情况下出现血管代偿能力不足,导致脑室内出血,进一步导致深部静脉引流受阻、淤血及血栓形成,伴邻近脑实质急慢性改变:血管源性水肿、细胞毒性水肿、(脑实质、脑室内、软脑膜下)出血、脱髓鞘改变、脑白质软化等[14]。
表1.
胎儿不同时期脑静脉血管发育事件[8]
| 胎龄 | 脑静脉血管发育事件 |
|---|---|
| 40~44 d | 脑静脉主要是由原始横窦、矢状血管丛、原始直窦及原始边缘窦等血管丛构成 |
| 9周 | 室管膜下静脉系统初步形成 |
| 10~12周 | 前脑正中静脉演变为成对的大脑内静脉 |
| 11周 | 中脑深静脉、下纹状体静脉和间脑静脉、中脑静脉和直窦的一条分支流汇合形成罗森塔尔基底静脉 |
| 12周 | 大脑内静脉周围出现髓静脉 |
| 15周 | 毛细血管已逐渐延伸到皮质深层 |
| 22周 | 皮质中毛细血管发育,与软脑膜静脉连通 |
| 27周 | 室管膜下静脉发育成熟,生发基质静脉尚未成熟 |
| 直至28周 | 皮质静脉系统与深部髓静脉之间仍有空隙 |
| 34~35周之前 | 深浅髓静脉终末分支发育尚未成熟 |
图1. 脑半球静脉各级分支[9] .
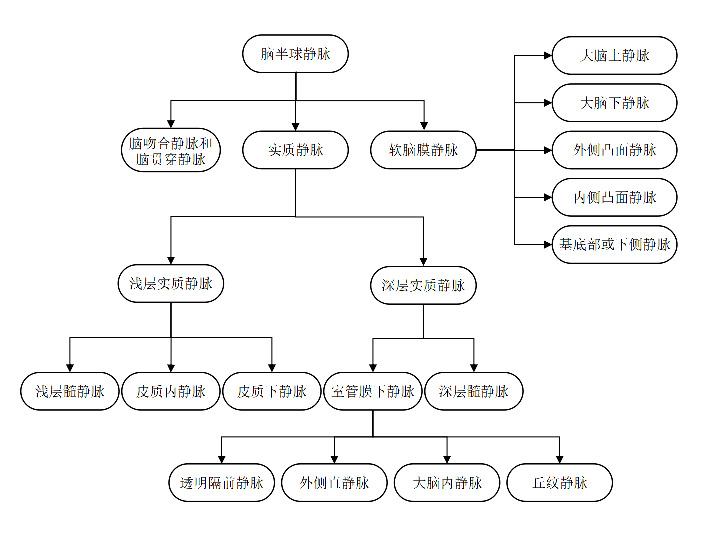
图2. 脑静脉解剖图 左图为大脑部分静脉引流通路,箭头表示血液流动方向。右图为侧脑室上外侧角的深部髓静脉分布形态,存在4处汇集区:第1处汇集位于浅表脑回白质,呈树枝或衣帽架样分布(A);第2处汇集区位于白质中外三分之一处,呈烛台样分布(B),是最重要的汇集区;第3处汇集区位于放射冠中内三分之一,呈掌型分布(C);第4处汇集区为室管膜下交汇处(D),与室管膜下静脉相连,汇入大脑内静脉或基底静脉[10]。.
3. CSVT与髓静脉血栓形成的危险因素
CSVT发生主要关键机制包括血管内皮损伤、凝血抗凝和纤溶相关因子异常,以及血流动力学异常。
3.1. 血管内皮损伤
病原微生物及毒性产物直接或通过炎症反应间接损伤血管内皮细胞,如头皮感染引发静脉炎导致矢状窦血栓形成。机械性损伤也可导致血管内皮损伤,如中心静脉置管[15]、分娩过程中颅骨严重受压等,损伤浅层静脉窦。缺氧缺血、败血症、呼吸窘迫综合征、脱水、代谢性酸中毒、心脏手术等情况下,脑静脉血压发生剧烈波动,引起血管内皮细胞损伤甚至内皮脱落,激活血小板,形成血栓[16-19]。
3.2. 凝血抗凝和纤溶相关因子异常
新生儿凝血系统中,血小板功能低下,凝血因子活性低,促凝和抗凝因子非常有限,对于多种危险因素并存的早产儿,凝血系统储备能力低,极易发生血栓或出血性疾病[20]。促凝血因子水平和抗凝因子水平异常是新生儿CSVT最常见原因之一,通常合并C蛋白缺乏、S蛋白缺乏、抗凝血酶Ⅲ缺乏、V因子莱顿突变和凝血酶原G20210A基因突变,以及血同型半胱氨酸、抗心磷脂抗体、狼疮抗凝剂及脂蛋白水平升高[21-23]。但目前一项多中心研究发现大多数患CSVT的新生儿并不具有遗传性血栓形成倾向,FⅤ G1691A及MTHFR C677T突变的新生儿患CSVT概率与对照组差异无统计学意义[24]。
3.3. 血流动力学异常
红细胞增多症者血黏度增加,血流速减慢,易形成血栓[25]。亚低温疗法治疗新生儿缺氧缺血性脑病也可引发CSVT,长期处于仰卧位的新生儿浅表静脉血栓的发病率升高[26-27]。
4. 临床表现
新生儿CSVT缺乏特异性临床表现及体征,且与病因及损伤严重程度有关。最常见症状是惊厥,可出现淡漠、嗜睡等神经抑制症状,肌张力异常,呼吸暂停等;静脉梗阻引发颅内压升高和脑积水、视乳头水肿、前囟紧张饱满、颅缝增宽、头围增大,严重时形成脑疝,导致死亡[3,28-29]。多处静脉窦血栓的患儿早期临床表现仅为呼吸窘迫、肌张力减低;有无惊厥与是否多窦受累及梗死无关,但颅内出血可增加惊厥发生风险。以上临床表现出现时间与脑损伤影像学表现严重程度无关,但严重神经系统症状与颅内出血及梗死明显相关[30]。深部髓静脉受累导致脑白质损伤研究尚少,也缺乏特异性临床表现,临床上很难与其他原因引起的脑损伤相鉴别[19]。
5. 影像学特点
过去诊断CSVT的影像技术主要是颅脑多普勒和能量超声,磁共振成像(magnetic resonance imaging,MRI)。近年来磁共振静脉血管造影(magnetic resonance venography,MRV)和磁敏感加权成像(susceptibility weighted imaging,SWI)成为主要诊断技术。由于不同影像技术各有利弊,需要多种技术联合应用提高诊断CSVT准确性[31-32]。Goeral等[33]于2018年首次介绍了基于高帧频超高速多普勒技术的超级微血管超声检查(superb microvascular imaging,SMI)在新生儿大脑方面应用,其高分辨率及高帧频率可客观呈现大脑微血管的精细结构,有助于早期发现静脉淤血及脑室周围出血后相关梗死脑区灌注情况,对缺氧缺血脑病、脑结构异常及早产儿脑发育进行动态监测,未来可能成为新生儿颅脑检查的重要手段之一。
不同时期血栓在不同MRI序列的信号变化见表2 [34]。根据血栓累及的范围,CSVT分为2类:(1)孤立性静脉血栓不伴缺血或出血损伤;(2)静脉窦血栓伴静脉源性梗死,占新生儿CSVT 50%~60%,其中75%静脉源性梗死为出血性梗死[16]。静脉窦血栓引发静脉源性出血梗死的部位与脑静脉引流分布有关,如矢状旁皮质下出血可由上矢状窦血栓引发;小脑出血由横窦血栓引发;颞叶外侧出血性梗死由下吻合静脉(vein of labbé)血栓引发[35];丘脑出血及脑室内出血可由Galen's静脉或直窦血栓引发;额叶、颞叶及枕叶深部白质出血可由深部髓静脉血栓引发[36-37](图3~4)。主干静脉窦(上矢状窦、直窦)血栓与双侧脑损伤相关,而分支静脉(大脑内静脉、丘纹静脉)则与单侧脑损伤相关[6]。新生儿CSVT常见于深静脉系统(大脑内静脉、Galen's静脉、直窦、颈内静脉),累及多静脉(窦)[17-18]。Benninger等[38]通过损伤部位大小及数目对深部髓静脉血栓和梗死后脑白质损伤进行评分,有利于评估脑白质损伤严重程度。
表2.
不同时期血栓在不同磁共振序列的信号变化[34]
| 序列 | <24 h(超急性期) | 1~3 d(急性期) | 4~14 d(亚急性期) | >14 d(慢性期) |
|---|---|---|---|---|
| T1WI | 等信号或轻度低信号 | 等信号 | 高信号 | 低信号,可能与正常流空效应混淆 |
| FLAIR | 轻度高信号 | 低信号,可能与正常流空效应相混淆 | 早期低信号,晚期高信号 | 低信号,可能与正常流空效应混淆 |
| SWI | 可能存在低信号 | 低信号 | 早期低信号,晚期低信号可能消失 | 低信号可能消失 |
| T1SE | 充盈缺损 | 充盈缺损 | 晚期高信号,可能与正常流空效应混淆 | 血栓高信号 |
| 2D-TOF MRV | 无血流 | 无血流 | 晚期高信号,可能与正常流空效应混淆 | 无血流 |
| CE-MRV | 充盈缺损 | 充盈缺损 | 晚期高信号,可能与正常流空效应混淆 | 充盈缺损,造影剂给药和成像之间延迟可能导致血栓信号增强 |
注:[T1WI]T1加权成像;[FLAIR]液体衰减反转恢复;[SWI]磁敏感加权成像;[T1SE]自旋回波序列T1加权;[2D-TOF MRV]飞行时间磁共振静脉血管成像;[CE-MRV]增强磁共振静脉血管成像。
图3. 深部髓静脉血栓合并脑室内出血 A、E为T1加权成像横断位,B、F为T2加权成像横断位,C、G为T1加权成像矢状位,D、H为弥散加权成像。该患儿34+6周因“宫内窘迫”剖宫产出生,Apgar评分1 min 5分,5 min 8分。生后13 d,T1加权成像矢状位可见双侧侧脑室上外侧角白质高信号,信号分布与深部髓静脉走行相似,提示深部髓静脉血栓(图C),伴脑室扩张及广泛脑室出血(图B、H),左侧颞叶、枕叶实质出血(图A)。弥散加权成像(图D)显示双侧侧脑室前角周围白质(蓝色箭头)、胼胝体膝部(红色箭头)及左侧颞叶(黄色箭头)实质水肿。生后35 d,双侧脑室旁及半卵圆中心脑白质多发软化(图G),双侧脑室增宽(图E~F)。该图来自盛京医院第二新生儿内科病房患儿磁共振。各箭头所示为相应病灶部位。.
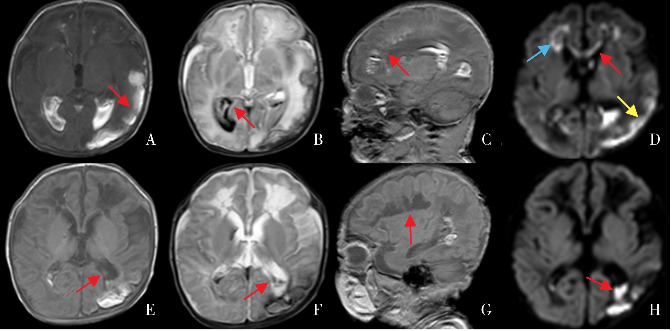
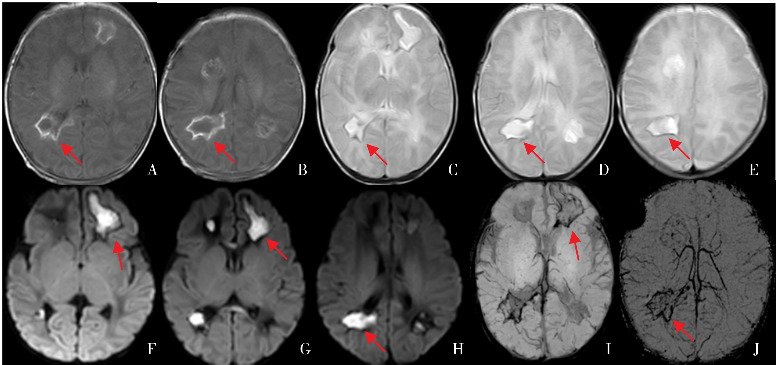
图4. 深部髓静脉受累引发脑白质损伤 A~B为T1加权成像横断位,C~E为T2加权成像横断位,F~H为弥散加权成像,I~J为磁敏感加权成像。该患儿36+2周因“先兆子宫破裂”剖宫产出生。生后2 d,吮吸无力、反应低下、腹胀。生后3 d,发热、循环状态不稳定,C-反应蛋白9.99 mg/L。生后5 d,视频脑电图监测提示频繁电惊厥,脑脊液WBC 120×106/L,单核细胞为主,脑脊液病原学基因诊断未见异常。生后14 d,弥散加权成像显示侧脑室前角、后角白质区域高信号(图F~H);T1加权成像横断位显示侧脑室后角病灶周围高信号,中央低信号(图A~B);T2加权成像横断位中央明显高信号,周围低信号提示病灶液化坏死(图C~E);磁敏感加权成像显示受累区域深部髓静脉引流异常,存在充血或血栓性出血性信号改变(图I~J)。该图来自盛京医院第二新生儿内科病房患儿磁共振。各箭头所示为相应病灶部位。.
6. 治疗及预后
CSVT治疗方法有病因治疗、控制惊厥及抗凝治疗。病因治疗如感染继发的CSVT应用抗生素抗感染,纠正脱水及电解质紊乱,缺氧缺血相关CSVT改善氧合及组织灌注[39]。目前缺乏对新生儿CSVT治疗的临床随机对照实验。抗凝治疗的安全性和疗效一直存在争议,2008年美国心脏协会建议新生儿患CSVT合并凝血障碍、多发脑部或系统性血栓、应用支持疗法病情加重情况下可选择应用抗凝疗法(普通肝素、低分子肝素及口服维生素K拮抗剂)[40]。2011年英国血液学标准委员会建议CSVT未合并颅内出血,建议使用普通肝素或低分子肝素抗凝治疗至少3个月;对于凝血基因异常,持续静脉回流受阻情况,结合影像学表现可延长疗程。CSVT伴微小颅内出血也可使用抗凝疗法[41]。2018年美国血液学会建议无出血情况下单独应用抗凝治疗,反对先溶栓后抗凝。抗凝药物首选低分子肝素和普通肝素,普通肝素用法:早产儿:静脉注射25~50 U/kg,不少于10 min,然后初始维持剂量为15 U/(kg·h),静脉持续输注;足月儿:静脉注射75~100 U/kg,不少于10 min,然后初始维持剂量为28 U/(kg·h),静脉持续输注。低分子肝素用法(依诺肝素):小于2个月且小于5 kg新生儿:每次1.5 mg/kg,每12 h 1次,皮下注射,疗程为6周至3个月,期间5~7 d复查影像学评估血栓再通情况,完全通畅后停止抗凝治疗[42]。近期一病例报道发现新生儿严重CSVT肝素治疗效果不佳时,应用直接凝血酶抑制剂比伐卢定后血栓消退且不伴有相关出血并发症[43]。
新生儿CSVT预后与病因、脑损伤严重程度及血栓位置相关。研究发现深浅静脉系统受累、多处CSVT与死亡呈正相关[3,44]。新生儿CSVT不良预后发生率高于儿童,CSVT近期结局包括CSVT相关死亡(约25%)[45]、血栓扩大和血栓再通;缺乏抗凝治疗增加了血栓扩大的风险[42]。新生儿3~6个月内血栓再通率约85%,单变量分析显示抗凝治疗缺乏、多发性静脉窦受累及深部静脉受累均无法预测血栓再通的概率,且血栓再通与危险因素数目、静脉源性梗死出血、高凝状态、惊厥和性别均无关[46-48]。远期结局包括癫痫和神经功能损伤,如不同程度感觉运动、认知行为及语言障碍等[35,49]。
7. 结语
综上,新生儿CSVT是一类受多种危险因素影响的血管源性疾病,因其临床症状无明显特征,对于高度怀疑的新生儿CSVT,应通过影像方法尽早筛查诊断,早期治疗,阻止血栓扩大,减少神经系统相关损伤,改善神经发育预后,降低后遗症发生率。目前缺乏研究证实现有治疗手段有效性及其对长期预后影响,未来需对不同严重程度的新生儿CSVT或动物模型进行随机对照研究和长期随访,评估抗凝疗法治疗效果及对神经发育结局影响。
参 考 文 献
- 1.Cole L, Dewey D, Letourneau N, et al. Clinical characteristics, risk factors, and outcomes associated with neonatal hemorrhagic stroke: a population-based case-control study[J].JAMA Pediatr, 2017, 171(3): 230-238. DOI: 10.1001/jamapediatrics.2016.4151. PMID: . [DOI] [PubMed] [Google Scholar]
- 2.Wu YW, Miller SP, Chin K, et al. Multiple risk factors in neonatal sinovenous thrombosis[J].Neurology, 2002, 59(3): 438-440. DOI: 10.1212/wnl.59.3.438. PMID: . [DOI] [PubMed] [Google Scholar]
- 3.Whitaker EE, Cipolla MJ. Perinatal stroke[J].Handb Clin Neurol, 2020, 171: 313-326. DOI: 10.1016/B978-0-444-64239-4.00016-3. PMID: . [DOI] [PubMed] [Google Scholar]
- 4.Taoka T, Fukusumi A, Miyasaka T, et al. Structure of the medullary veins of the cerebral hemisphere and related disorders[J].Radiographics, 2017, 37(1): 281-297. DOI: 10.1148/rg.2017160061. PMID: . [DOI] [PubMed] [Google Scholar]
- 5.Vilan A, Ribeiro JM, Reis C, et al. Deep medullary veins and brain injury[J].J Pediatr, 2018, 200: 290-290. e1. DOI: 10.1016/j.jpeds.2018.03.051. PMID: . [DOI] [PubMed] [Google Scholar]
- 6.Berfelo FJ, Kersbergen KJ, van Ommen CH, et al. Neonatal cerebral sinovenous thrombosis from symptom to outcome[J].Stroke, 2010, 41(7): 1382-1388. DOI: 10.1161/STROKEAHA.110.583542. PMID: . [DOI] [PubMed] [Google Scholar]
- 7.Fitzgerald KC, Williams LS, Garg BP, et al. Cerebral sinovenous thrombosis in the neonate[J].Arch Neurol, 2006, 63(3): 405-409. DOI: 10.1001/archneur.63.3.405. PMID: . [DOI] [PubMed] [Google Scholar]
- 8.Raets M, Dudink J, Raybaud C, et al. Brain vein disorders in newborn infants[J].Dev Med Child Neurol, 2015, 57(3): 229-240. DOI: 10.1111/dmcn.12579. PMID: . [DOI] [PubMed] [Google Scholar]
- 9.Shah RS, Jeyaretna DS. Cerebral vascular anatomy and physiology[J].Surgery (Oxf), 2018, 36(11): 606-612. DOI: 10.1016/j.mpsur.2018.09.011. [DOI] [Google Scholar]
- 10.Khalatbari H, Wright JN, Ishak GE, et al. Deep medullary vein engorgement and superficial medullary vein engorgement: two patterns of perinatal venous stroke[J].Pediatr Radiol, 2021, 51(5): 675-685. DOI: 10.1007/s00247-020-04846-3. PMID: . [DOI] [PubMed] [Google Scholar]
- 11.Okudera T, Huang YP, Fukusumi A, et al. Micro-angiographical studies of the medullary venous system of the cerebral hemisphere[J].Neuropathology, 1999, 19(1): 93-111. DOI: 10.1046/j.1440-1789.1999.00215.x. PMID: . [DOI] [PubMed] [Google Scholar]
- 12.Okudera T, Huang YP, Ohta T, et al. Development of posterior fossa dural sinuses, emissary veins, and jugular bulb: morphological and radiologic study[J].AJNR Am J Neuroradiol, 1994, 15(10): 1871-1883. PMID: . [PMC free article] [PubMed] [Google Scholar]
- 13.Tortora D, Severino M, Malova M, et al. Variability of cerebral deep venous system in preterm and term neonates evaluated on MR SWI venography[J].AJNR Am J Neuroradiol, 2016, 37(11): 2144-2149. DOI: 10.3174/ajnr.A4877. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Atienza-Navarro I, Alves-Martinez P, Lubian-Lopez S, et al. Germinal matrix-intraventricular hemorrhage of the preterm newborn and preclinical models: inflammatory considerations[J].Int J Mol Sci, 2020, 21(21): 8343. DOI: 10.3390/ijms21218343. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chan A, Lensing AWA, Kubitza D, et al. Clinical presentation and therapeutic management of venous thrombosis in young children: a retrospective analysis[J].Thromb J, 2018, 16: 29. DOI: 10.1186/s12959-018-0182-4. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Saracco P, Bagna R, Gentilomo C, et al. Clinical data of neonatal systemic thrombosis[J].J Pediatr, 2016, 171: 60-66. e1. DOI: 10.1016/j.jpeds.2015.12.035. PMID: . [DOI] [PubMed] [Google Scholar]
- 17.Lolli V, Molinari F, Pruvo JP, et al. Radiological and clinical features of cerebral sinovenous thrombosis in newborns and older children[J].J Neuroradiol, 2016, 43(4): 280-289. DOI: 10.1016/j.neurad.2015.12.001. PMID: . [DOI] [PubMed] [Google Scholar]
- 18.Claessens NHP, Algra SO, Jansen NJG, et al. Clinical and neuroimaging characteristics of cerebral sinovenous thrombosis in neonates undergoing cardiac surgery[J].J Thorac Cardiovasc Surg, 2018, 155(3): 1150-1158. DOI: 10.1016/j.jtcvs.2017.10.083. PMID: . [DOI] [PubMed] [Google Scholar]
- 19.Maghsoudi M, Babapour B, Shahbazzadegan B, et al. Cerebral venous thrombosis in neonates: two case reports[J].Acta Med Iran, 2018, 56(6): 410-414. [Google Scholar]
- 20.Go H, Ohto H, Nollet KE, et al. Perinatal factors affecting coagulation parameters at birth in preterm and term neonates: a retrospective cohort study[J].Am J Perinatol, 2019, 36(14): 1464-1470. DOI: 10.1055/s-0039-1677867. PMID: . [DOI] [PubMed] [Google Scholar]
- 21.Haidl H, Zöhrer E, Pohl S, et al. New insights into neonatal coagulation: normal clot formation despite lower intra-clot thrombin levels[J].Pediatr Res, 2019, 86(6): 719-724. DOI: 10.1038/s41390-019-0531-4. PMID: . [DOI] [PubMed] [Google Scholar]
- 22.Kenet G, Cohen O, Bajorat T, et al. Insights into neonatal thrombosis[J].Thromb Res, 2019, 181(Suppl 1): S33-S36. DOI: 10.1016/S0049-3848(19)30364-0. PMID: . [DOI] [PubMed] [Google Scholar]
- 23.Turan Ö, Anuk-İnce D, Olcay L, et al. Neonatal cerebral sinovenous thrombosis: two cases, two different gene polymorphisms and risk factors[J].Turk J Pediatr, 2017, 59(1): 71-75. DOI: 10.24953/turkjped.2017.01.012. PMID: . [DOI] [PubMed] [Google Scholar]
- 24.Garrido-Barbero M, Arnaez J, Loureiro B, et al. The role of factor V leiden, prothrombin G20210A, and MTHFR C677T mutations in neonatal cerebral sinovenous thrombosis[J].Clin Appl Thromb Hemost, 2019, 25: 1076029619834352. DOI: 10.1177/1076029619834352. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Sorg AL, Von Kries R, Klemme M, et al. Incidence and risk factors of cerebral sinovenous thrombosis in infants[J].Dev Med Child Neurol, 2021, 63(6): 697-704. DOI: 10.1111/dmcn.14816. PMID: . [DOI] [PubMed] [Google Scholar]
- 26.Radicioni M, Bini V, Chiarini P, et al. Cerebral sinovenous thrombosis in the asphyxiated cooled infants: a prospective observational study[J].Pediatr Neurol, 2017, 66: 63-68. DOI: 10.1016/j.pediatrneurol.2016.09.006. PMID: . [DOI] [PubMed] [Google Scholar]
- 27.Tan M, Deveber G, Shroff M, et al. Sagittal sinus compression is associated with neonatal cerebral sinovenous thrombosis[J].Pediatrics, 2011, 128(2): e429-e435. DOI: 10.1542/peds.2010-3896. PMID: . [DOI] [PubMed] [Google Scholar]
- 28.Mineyko A, Kirton A, Billinghurst L, et al. Seizures and outcome one year after neonatal and childhood cerebral sinovenous thrombosis[J].Pediatr Neurol, 2020, 105: 21-26. DOI: 10.1016/j.pediatrneurol.2019.08.012. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Rossor T, Arichi T, Bhate S, et al. Anticoagulation in the management of neonatal cerebral sinovenous thrombosis: a systematic review and meta-analysis[J].Dev Med Child Neurol, 2018, 60(9): 884-891. DOI: 10.1111/dmcn.13760. PMID: . [DOI] [PubMed] [Google Scholar]
- 30.Nwosu ME, Williams LS, Edwards-Brown M, et al. Neonatal sinovenous thrombosis: presentation and association with imaging[J].Pediatr Neurol, 2008, 39(3): 155-161. DOI: 10.1016/j.pediatrneurol.2008.06.001. PMID: . [DOI] [PubMed] [Google Scholar]
- 31.Wang XH, Zhang LM, Chai YM, et al. Clinical characteristics and outcomes of pediatric cerebral venous sinus thrombosis: an analysis of 30 cases in China[J].Front Pediatr, 2019, 7: 364. DOI: 10.3389/fped.2019.00364. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Kochar PS, Sawhney H, Sharma P, et al. Sonographic diagnosis of neonatal cerebral venous sinus thrombosis[J].J Pediatr Neurol, 2020, 18(5): 236-240. DOI: 10.1055/s-0039-1692216. [DOI] [Google Scholar]
- 33.Goeral K, Hojreh A, Kasprian G, et al. Microvessel ultrasound of neonatal brain parenchyma: feasibility, reproducibility, and normal imaging features by superb microvascular imaging (SMI)[J].Eur Radiol, 2019, 29(4): 2127-2136. DOI: 10.1007/s00330-018-5743-1. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Idbaih A, Boukobza M, Crassard I, et al. MRI of clot in cerebral venous thrombosis: high diagnostic value of susceptibility-weighted images[J].Stroke, 2006, 37(4): 991-995. DOI: 10.1161/01.STR.0000206282.85610.ae. PMID: . [DOI] [PubMed] [Google Scholar]
- 35.Benninger KL, Ruess L, Slaughter LA, et al. Neonatal vein of labbé infarction size is associated with long-term language outcomes[J].Pediatr Neurol, 2017, 72: 70-75. e1. DOI: 10.1016/j.pediatrneurol.2017.03.015. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.van Ommen CH, Sol JJ. Developmental hemostasis and management of central venous catheter thrombosis in neonates[J].Semin Thromb Hemost, 2016, 42(7): 752-759. DOI: 10.1055/s-0036-1592299. PMID: . [DOI] [PubMed] [Google Scholar]
- 37.Strauss T, Sidlik-Muskatel R, Kenet G. Developmental hemostasis: primary hemostasis and evaluation of platelet function in neonates[J].Semin Fetal Neonatal Med, 2011, 16(6): 301-304. DOI: 10.1016/j.siny.2011.07.001. PMID: . [DOI] [PubMed] [Google Scholar]
- 38.Benninger KL, Maitre NL, Ruess L, et al. Mr imaging scoring system for white matter injury after deep medullary vein thrombosis and infarction in neonates[J].AJNR Am J Neuroradiol, 2019, 40(2): 347-352. DOI: 10.3174/ajnr.A5940. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Shlobin NA, LoPresti MA, Beestrum M, et al. Treatment of pediatric cerebral venous sinus thromboses: the role of anticoagulation[J].Childs Nerv Syst, 2020, 36(11): 2621-2633. DOI: 10.1007/s00381-020-04829-7. PMID: . [DOI] [PubMed] [Google Scholar]
- 40.Monagle P, Newall F. Management of thrombosis in children and neonates: practical use of anticoagulants in children[J].Hematology Am Soc Hematol Educ Program, 2018, 2018(1): 399-404. DOI: 10.1182/asheducation-2018.1.399. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Chalmers E, Ganesen V, Liesner R, et al. Guideline on the investigation, management and prevention of venous thrombosis in children[J].Br J Haematol, 2011, 154(2): 196-207. DOI: 10.1111/j.1365-2141.2010.08543.x. PMID: . [DOI] [PubMed] [Google Scholar]
- 42.Monagle P, Cuello CA, Augustine C, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: treatment of pediatric venous thromboembolism[J].Blood Adv, 2018, 2(22): 3292-3316. DOI: 10.1182/bloodadvances.2018024786. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Bertamino M, Severino M, Parodi A, et al. Bivalirudin anticoagulation to overcome heparin resistance in a neonate with cerebral sinovenus thrombosis[J].Blood Coagul Fibrinolysis, 2020, 31(1): 97-100. DOI: 10.1097/MBC.0000000000000879. PMID: . [DOI] [PubMed] [Google Scholar]
- 44.Javed I, Sultan T, Rehman ZU, et al. Clinical spectrum and outcome of cerebral venous sinus thrombosis in children[J].J Coll Physicians Surg Pak, 2018, 28(5): 390-393. DOI: 10.29271/jcpsp.2018.05.390. PMID: . [DOI] [PubMed] [Google Scholar]
- 45.Wasay M, Dai AI, Ansari M, et al. Cerebral venous sinus thrombosis in children: a multicenter cohort from the United States[J].J Child Neurol, 2008, 23(1): 26-31. DOI: 10.1177/0883073807307976. PMID: . [DOI] [PubMed] [Google Scholar]
- 46.Moharir MD, Shroff M, Stephens D, et al. Anticoagulants in pediatric cerebral sinovenous thrombosis: a safety and outcome study[J].Ann Neurol, 2010, 67(5): 590-599. DOI: 10.1002/ana.21936. PMID: . [DOI] [PubMed] [Google Scholar]
- 47.Moharir MD, Shroff M, Pontigon AM, et al. A prospective outcome study of neonatal cerebral sinovenous thrombosis[J].J Child Neurol, 2011, 26(9): 1137-1144. DOI: 10.1177/0883073811408094. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Khatri V, Chan AKC, Stein N, et al. Conservative management of neonatal cerebral sinovenous thrombosis with coexisting thrombophilia[J].Blood Coagul Fibrinolysis, 2018, 29(4): 399-403. DOI: 10.1097/MBC.0000000000000731. PMID: . [DOI] [PubMed] [Google Scholar]
- 49.Benninger KL, Benninger TL, Moore-Clingenpeel M, et al. Deep medullary vein white matter injury global severity score predicts neurodevelopmental impairment[J].J Child Neurol, 2021, 36(4): 253-261. DOI: 10.1177/0883073820967161. PMID: . PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]


