Abstract
目的
探讨脂多糖(lipopolysaccharide,LPS)对破骨细胞生成及其骨吸收功能的作用及机制。
方法
取雄性 C57BL/6 小鼠股骨及胫骨骨髓,分离培养骨髓源巨噬细胞(bone marrow-derived macrophages,BMMs),并行流式细胞仪鉴定。取 BMMs 采用不同浓度 LPS(0、100、200、500、1 000、2 000 ng/mL)培养后,以细胞计数试剂盒 8(cell counting kit 8,CCK-8)检测不同浓度 LPS 对细胞活性影响。为探讨 LPS 对破骨细胞生成的影响,取 BMMs 分为巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)组、M-CSF+核因子 κB 受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)组、M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组,对应培养后行抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色观察,计算破骨细胞面积百分比。为探讨 LPS 对 Connexin43 蛋白及基因表达影响,将 BMMs 分别分为对照组(M-CSF+RANKL)、LPS 组(M-CSF+RANKL+100 ng/mL LPS)以及对照组(M-CSF+RANKL)、50 ng/mL LPS 组(M-CSF+RANKL+50 ng/mL LPS)、100 ng/mL LPS 组(M-CSF+RANKL+100 ng/mL LPS)培养后,行 Western blot 以及实时荧光定量 PCR 检测。为探讨 LPS 对破骨细胞骨吸收能力的影响,将 BMMs 分为 M-CSF 组、M-CSF+RANKL 组、M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组对应培养后,采用骨吸收实验检测骨吸收面积百分比。
结果
流式细胞仪鉴定培养细胞为 BMMs。CCK-8 法检测显示与其他浓度相比,100 ng/mL LPS 明显促进 BMMs 活性(P<0.05)。TRAP 染色示,M-CSF 组未见破骨细胞生成;与 M-CSF+RANKL 组相比,M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组破骨细胞体积更大、细胞核更多,其中后者最显著,3 组破骨细胞面积百分比差异均有统计学意义(P<0.05)。Western blot 检测,LPS 组 Connexin43 蛋白相对表达量较对照组明显提高(P<0.05);实时荧光定量 PCR 检测示,对照组、50 ng/mL LPS 组以及 100 ng/mL LPS 组 Connexin43 基因相对表达量逐渐增加,比较差异有统计学意义(P<0.05)。骨吸收实验示,M-CSF 组未形成破骨细胞骨吸收;M-CSF+RANKL 组、M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组骨吸收面积百分比逐渐增加,比较差异均有统计学意义(P<0.05)。
结论
100 ng/mL LPS 能够促进 Connexin43 的表达,从而使破骨细胞生成增多,骨吸收功能加强。
Keywords: 破骨细胞, 骨髓源巨噬细胞, 脂多糖, 缝隙连接蛋白 43, 小鼠
Abstract
Objective
To study the effect and mechanism of lipopolysaccharide (LPS) on osteoclasts formation and its bone resorption function.
Methods
Bone marrow-derived macrophages (BMMs) were extracted from the marrow of femur and tibia of 4-week-old male C57BL/6 mice. Flow cytometry was used to detect BMMs. The effect of different concentrations of LPS (0, 100, 200, 500, 1 000, 2 000 ng/mL) on BMMs activity was examined by cell counting kit 8 (CCK-8) activity test. In order to investigate the effect of LPS on osteoclastogenesis, BMMs were divided into macrophage colony-stimulating factor (M-CSF) group, M-CSF+receptor activator of nuclear factor κB ligand (RANKL) group, M-CSF+RANKL+50 ng/mL LPS group, M-CSF+RANKL+100 ng/mL LPS group. After the completion of culture, tartrate resistant acid phosphatase (TRAP) staining was used to observe the formation of osteoclasts. In order to investigate the effect of LPS on the expression of Connexin43, BMMs were divided into the control group (M-CSF+RANKL) and the LPS group (M-CSF+RANKL+100 ng/mL LPS); and the control group (M-CSF+RANKL), 50 ng/mL LPS group (M-CSF+RANKL+50 ng/mL LPS), and 100 ng/mL LPS group (M-CSF+RANKL+100 ng/mL LPS). The expressions of Connexin43 mRNA and protein were detected by Western blot and real-time fluorescent quantitative PCR, respectively. In order to investigate the effect of LPS on osteoclast bone resorption, BMMs were divided into M-CSF group, M-CSF+RANKL group, M-CSF+RANKL+50 ng/mL LPS group, and M-CSF+RANKL+100 ng/mL LPS group. Bone absorption test was used to detect the ratio of bone resorption area.
Results
The flow cytometry test confirmed that the cultured cells were BMMs, and CCK-8 activity test proved that the 100 ng/mL LPS could promote the proliferation of BMMs, showing significant differences when compared with the 0, 200, 500, 1 000, and 2 000 ng/mL LPS (P<0.05). TRAP staining showed no osteoclast formation in M-CSF group. Compared with M-CSF+RANKL group, the osteoclasts in M-CSF+RANKL+50 ng/mL LPS group and M-CSF+RANKL+100 ng/mL LPS group were larger with more nuclei, while the osteoclasts in M-CSF+RANKL+100 ng/mL LPS group were more obvious, and the differences in the ratio of osteoclast area between groups were statistically significant (P<0.05). Western blot result showed that the relative expression of Connexin43 protein in LPS group was significantly higher than that in control group (P<0.05). Real-time fluorescent quantitative PCR showed that the relative expression of Connexin43 mRNA in control group, 50 ng/mL LPS group, and 100 ng/mL LPS group increased gradually, and the differences between groups were statistically significant (P<0.05). Bone resorption test showed that osteoclast bone resorption did not form in M-CSF group, but the ratio of bone resorption area increased gradually in M-CSF+RANKL group, M-CSF+RANKL+50 ng/mL LPS group, and M-CSF+RANKL+100 ng/mL LPS group, and the differences between groups were statistically significant (P<0.05).
Conclusion
LPS at concentration of 100 ng/mL can promote the expression of Connexin43, resulting in increased osteoclastogenesis and enhanced osteoclastic bone resorption.
Keywords: Osteoclasts, bone marrow-derived macrophages, lipopolysaccharide, Connexin43, mouse
骨是处于动态平衡中的器官[1]。骨稳态由成骨细胞和破骨细胞共同维持[2],对维持骨骼系统正常功能具有重要意义[3]。骨稳态打破后会导致许多疾病,例如破骨细胞生成增多会导致骨质疏松[4]。破骨细胞是体内唯一能够降解骨基质的终末细胞[5]。巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)与核因子 κB 受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)是两种重要的细胞因子,它们在诱导小鼠骨髓源巨噬细胞(bone marrow-derived macrophages,BMMs)分化为破骨细胞的过程中发挥不可替代的作用[6]。M-CSF 可由许多类型细胞生成,但 RANKL 仅由几种细胞生成,例如成骨细胞、骨细胞、成纤维细胞等[7]。M-CSF 不仅能促进破骨细胞前体细胞的增殖与分化[8],还能促进骨髓祖细胞上 RANKL 的受体 RANK 的表达[9]。脂多糖(lipopolysaccharide,LPS)是革兰阴性杆菌细胞壁的主要成分,可引起炎症性骨损失[10]。研究发现,小鼠成骨细胞和骨髓来源造血干细胞共培养时,LPS 能促进破骨细胞分化[11]。然而 LPS 促进破骨细胞生成的分子机制目前尚未明确。本研究通过采用不同浓度 LPS 培养 BMMs,分析 LPS 对破骨细胞生成、缝隙连接蛋白 43(Connexin43)表达以及骨吸收功能的影响。报告如下。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
4~6 周龄雄性 C57BL/6 小鼠 4 只,体质量(15±3)g,由北京维通利华实验动物技术有限公司提供。α-MEM 培养基、FBS(GIBCO 公司,美国);M-CSF、RANKL(R&D 公司,美国);Connexin43 抗体(Cell Signaling Technology 公司,美国);抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒、LPS(Sigma 公司,美国);CD11b 单克隆抗体(Abcam 公司,英国);BCA 试剂盒、红细胞裂解液、胰蛋白酶(上海碧云天生物技术有限公司);细胞计数试剂盒 8(cell counting kit 8,CCK-8;Dojindo Laboratories 公司,日本);TRIzol 试剂 (Life Technologies 公司,美国);ReverTra Ace® qPCR 试剂盒(Toyobo 公司,日本)。离心机、细胞培养箱(Thermo Fisher Scientific 公司,美国);流式细胞仪(America BD 公司,美国);光学显微镜(Olympus 公司,日本)。
1.2. BMMs 分离、培养及鉴定
1.2.1. BMMs 分离及培养
根据文献[12-14]方法分离培养 BMMs。取 C57BL/6 小鼠颈椎脱臼处死后,取双侧股骨、胫骨,PBS 液冲洗骨髓腔 3 次,收集液体,用红细胞裂解液室温裂解 15 min,然后采用完全培养基(含 10% FBS、1% 青霉素、1% 链霉素的 α-MEM 培养基)于 37℃、5% CO2 条件下培养。培养 3 d 后,贴壁细胞即为 BMMs。采用胰蛋白酶消化细胞,根据实验目的,将其接种于不同细胞培养板进行后续实验。
1.2.2. BMMs 鉴定
弃培养基,细胞用 PBS 清洗 3 遍,胰蛋白酶消化,200 μL 1% 牛血清白蛋白重悬细胞,收集于 1.5 mL tube 管中;分别加入 CD11b 荧光抗体或其同型对照,避光孵育 20 min;加入 PBS,以离心半径 3 cm、3 000 r/min 离心 5min;1% 牛血清白蛋白重悬。流式细胞仪检测 BMMs 表面标志物 CD11b 的表达。
1.3. 不同浓度 LPS 对细胞活性的影响
将 BMMs 接种于 96 孔板,每孔 1×104 个细胞,采用含 30 ng/mL M-CSF 的完全培养基培养。过夜细胞贴壁后,采用含不同浓度 LPS(0、100、200、500、1 000、2 000 ng/mL)和 30 ng/mL M-CSF 的完全培养基,于 37℃、5% CO2 条件下培养。培养后 24、48 h,各浓度组分别取 3 孔,弃培养基,PBS 清洗 3 次。每孔加入含 10% CCK-8 溶液的完全培养基,37℃ 下孵育 4 h,酶标仪 450 nm 波长处检测吸光度(A)值。
1.4. LPS 诱导破骨细胞生成观察
1.4.1. 细胞分组及方法
将 BMMs 接种于 96 孔板,每孔 5×103 个细胞,过夜细胞贴壁后随机分为 4 组。M-CSF 组:采用含 30 ng/mL M-CSF 的完全培养基培养 5 d;M-CSF+RANKL 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 5 d;M-CSF+RANKL+50 ng/mL LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+50 ng/mL LPS 的完全培养基继续培养 2 d;M-CSF+RANKL+100 ng/mL LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+100 ng/mL LPS 的完全培养基继续培养 2 d。培养期间每 2 天更换 1 次培养基。
1.4.2. TRAP 染色观察
取各组细胞,弃培养基,PBS 清洗 3 次;3.7% 多聚甲醛溶液室温处理 15 min 后,0.1% Triton X-100 处理 10 min。37℃、避光条件下,参照试剂盒说明书 TRAP 染色 40 min。光镜下观察,TRAP 阳性细胞呈酒红色,TRAP 染色阳性且细胞核超过 3 个者为破骨细胞。于 4 倍镜下,随机选取 5 个视野,采用 Image J 软件计算破骨细胞面积百分比(破骨细胞面积/视野面积×100%)。
1.5. LPS 对 Connexin43 表达的影响观察
1.5.1. 对 Connexin43 蛋白表达的影响
将 BMMs 接种于 6 孔板,每孔 1×105 个细胞,过夜细胞贴壁后随机分为 2 组。对照组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 4 d;LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+100 ng/mL LPS 的完全培养基继续培养 1 d。培养期间每 2 天更换培养基。
取 2 组细胞,RIPA 冰上裂解 20 min,收集液体于 4℃,离心半径 3 cm、12 000 r/min 离心 5 min。收集上清,根据 BCA 试剂盒测定蛋白浓度。SDS 聚丙烯酰胺凝胶每孔上样 20 μg 蛋白,电泳后转膜至聚偏氟乙烯膜。5% 脱脂牛奶封闭 1 h,加入 Connexin43 一抗,4℃ 摇床轻摇过夜。二抗室温孵育 1 h。GAPDH 用作内参。以与 GAPDH 灰度值比值,作为 Connexin43 蛋白相对表达量。
1.5.2. 对 Connexin43 基因表达的影响
将 BMMs 接种于 6 孔板,每孔 1×105 个细胞,过夜贴壁后随机分为 3 组。对照组;采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 4 d;50 ng/mL LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+50 ng/mL LPS 的完全培养基继续培养 1 d;100 ng/mL LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+100 ng/mL LPS 的完全培养基继续培养 1 d。培养期间每 2 天更换培养基。
取 3 组细胞用 TRIzol 试剂提取细胞总的 RNA,参照 ReverTra Ace® qPCR 试剂盒说明书合成 cDNA。引物序列如下:Connexin43,上游 5'-AAGTGAAAGAGAGGTGCCCA-3',下游 5'- ACAGCGAAAGGCAGACTGTT-3';GAPDH,上游 5'-AAATGGTGAAGGTCGGTGTG-3',下游 5'-TGAAGGGGTCGTTGATGG-3'。用 2–△△Ct法计算目的基因相关表达量。
1.6. LPS 对破骨细胞骨吸收能力的影响
1.6.1. 细胞分组及方法
将 BMMs 接种于 24 孔培养板,每孔 2×104 个细胞,过夜贴壁后随机分为 4 组。M-CSF 组:采用含 30 ng/mL M-CSF 的完全培养基培养 5 d;M-CSF+RANKL 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 5 d;M-CSF+RANKL+50 ng/mL LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+50 ng/mL LPS 的完全培养基继续培养 2 d;M-CSF+RANKL+100 ng/mL LPS 组:采用含 30 ng/mL M-CSF+20 ng/mL RANKL 的完全培养基培养 3 d 后,更换为含 30 ng/mL M-CSF+20 ng/mL RANKL+100 ng/mL LPS 的完全培养基继续培养 2 d。培养期间每 2 天更换培养基。
1.6.2. 破骨细胞骨吸收瘢痕观察
取 4 组细胞,用 10% 次氯酸钠洗去破骨细胞,再用去离子水清洗 3 次。室温晾干后,于 4 倍镜下采集图片。浅色的不规则区域为破骨细胞骨吸收所形成的吸收瘢痕,用 Image J 软件测算骨吸收面积百分比(骨吸收瘢痕面积/视野面积×100%)。
1.7. 统计学方法
采用 SPSS19.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用 Bonferroni 法;检验水准 α=0.05。
2. 结果
2.1. BMMs 形态观察及鉴定
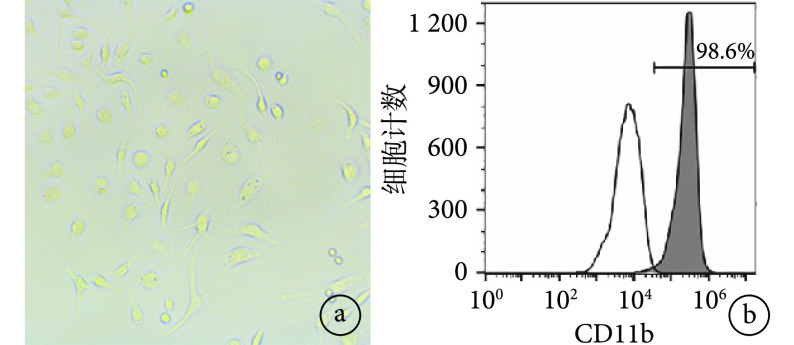
镜下观察 BMMs 呈长梭形,伪足细长(图 1a)。流式细胞仪鉴定示 CD11b 阳性细胞达 98.6%,提示培养的细胞为 BMMs(图 1b)。
图 1.
BMMs morphological observation and identification of CD11b
BMMs 形态观察及 CD11b 鉴定
a. BMMs 细胞形态观察(×4);b. 流式细胞仪鉴定表面特异性抗原 CD11b
a. Observation of BMMs morphology(×4); b. Identification of surface specific antigen CD11b by flow cytometry
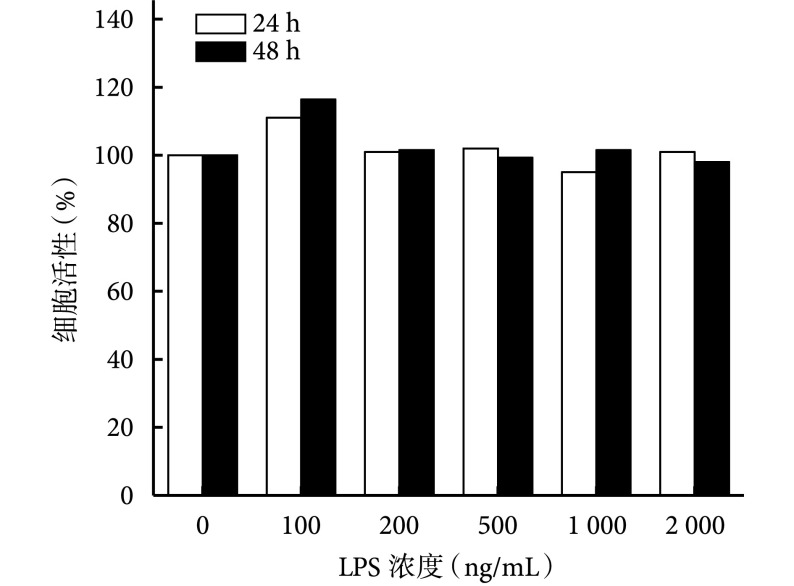
2.2. 不同浓度 LPS 对细胞活性的影响
CCK-8 法检测显示,培养 24、48 h,100 ng/mL 组 A 值明显高于其他各组,比较差异有统计学意义(P<0.05)。其余各组间比较,差异均无统计学意义(P>0.05)。见图 2。
图 2.
CCK-8 detection of BMMs activity after LPS culture at different concentrations
CCK-8 检测不同浓度 LPS 培养后 BMMs 细胞活性
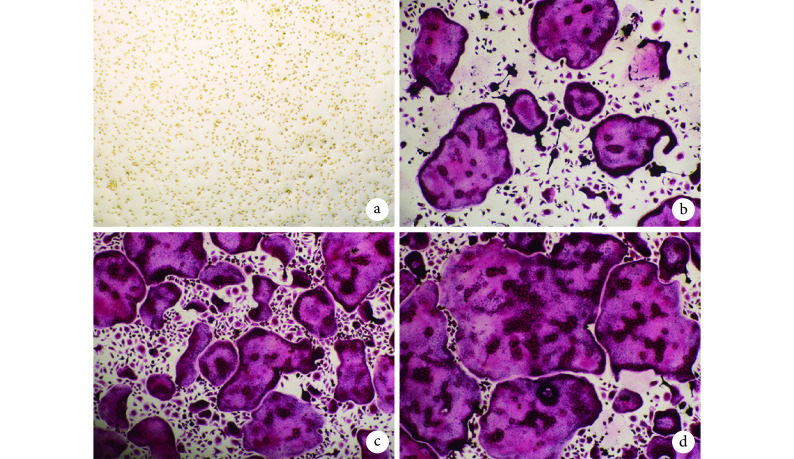
2.3. LPS 诱导破骨细胞生成观察
M-CSF 组未见破骨细胞生成,其余 3 组可见多核破骨细胞。与 M-CSF+RANKL 组相比,M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组破骨细胞体积更大、细胞核更多,其中 M-CSF+RANKL+100 ng/mL LPS 组最显著。见图 3。
图 3.
Observation of TRAP staining in each group after induction (×4)
各组 TRAP 染色观察(×4)
a. M-CSF 组;b. M-CSF+RANKL 组;c. M-CSF+RANKL+50 ng/mL LPS 组;d. M-CSF+RANKL+100 ng/mL LPS 组
a. M-CSF group; b. M-CSF+RANKL group; c. M-CSF+RANKL+50 ng/mL group; d. M-CSF+RANKL+100 ng/mL LPS group
M-CSF+RANKL 组、M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组破骨细胞面积百分比分别为 43.47%±3.19%、68.26%±3.71%、84.36%±4.73%,组间比较差异均有统计学意义(P<0.05)。
2.4. LPS 对 Connexin43 表达的影响观察
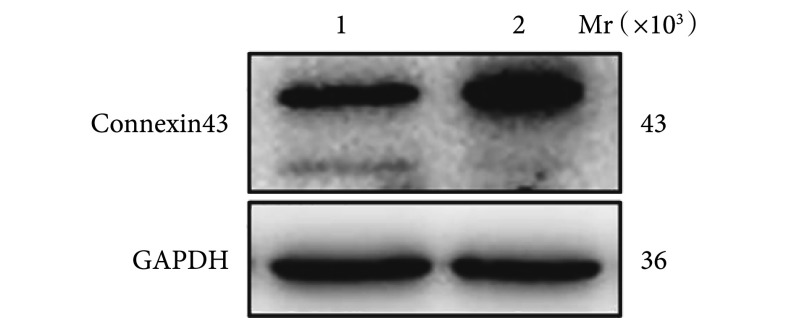
Western blot 检测,LPS 能促进 Connexin43 蛋白表达。LPS 组 Connexin43 蛋白相对表达量为 2.127±0.195,较对照组 1.334±0.163 明显提高,比较差异有统计学意义(F=31.825,P=0.005)。见图 4。
图 4.
Expression of Connexin43 protein detected by Western blot
Western blot 检测 Connexin43 蛋白表达
Mr:相对分子质量 1:对照组 2:LPS 组
Mr: Relative molecular mass 1: Control group 2: LPS group
实时荧光定量 PCR 检测示,LPS 能促进 Connexin43 基因表达。对照组、50 ng/mL LPS 组以及 100 ng/mL LPS 组 Connexin43 基因相对表达量分别为 0.618±0.135、1.112±0.252、2.327±0.285。随 LPS 浓度增加,Connexin43 基因相对表达量逐渐增加,组间比较差异有统计学意义(P<0.05)。
2.5. LPS 对破骨细胞骨吸收能力的影响
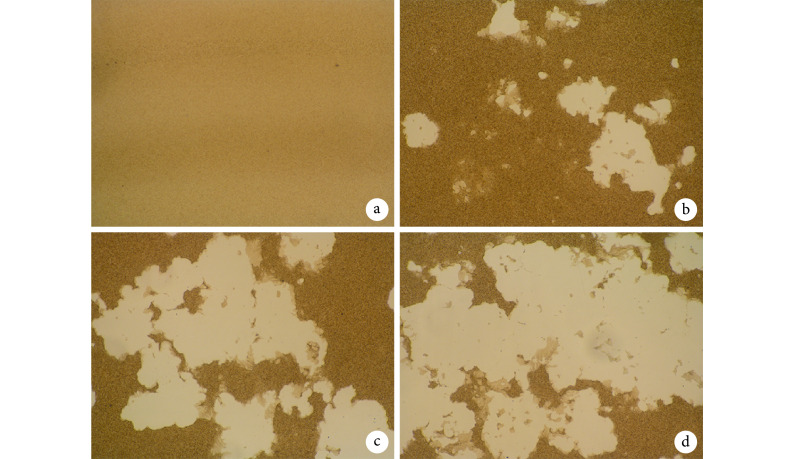
镜下观察,M-CSF 组未形成破骨细胞骨吸收瘢痕。与 M-CSF+RANKL 组相比,M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组破骨细胞的骨吸收功能更强,吸收瘢痕面积更大,M-CSF+RANKL+100 ng/mL LPS 组最显著。见图 5。M-CSF+RANKL 组、M-CSF+RANKL+50 ng/mL LPS 组、M-CSF+RANKL+100 ng/mL LPS 组骨吸收面积百分比分别为 16.70%±4.36%、40.96%±9.61%、62.56%±8.45%,组间比较差异均有统计学意义(P<0.05)。
图 5.
Observation of bone resorption of osteoclasts in each group (×4)
各组破骨细胞骨吸收观察(×4)
a. M-CSF 组;b. M-CSF+RANKL 组;c. M-CSF+RANKL+50 ng/mL LPS 组;d. M-CSF+RANKL+100 ng/mL LPS 组
a. M-CSF group; b. M-CSF+RANKL group; c. M-CSF+RANKL+50 ng/mL group; d. M-CSF+RANKL+100 ng/mL LPS group
3. 讨论
RANKL/RANK/OPG信号轴的发现使体外培养破骨细胞成为了可能[15]。促进破骨细胞生成的信号通路与调节因子有NFATc1、c-fos、NF-κB等,最新研究结果指出,MafB、IRF-8、Bcl6等调节因子可以负调节破骨细胞生成过程,这些负调节因子抑制了NFATc1等的表达,从而抑制破骨细胞相关基因的表达,使破骨细胞形成过程受到抑制[16]。
破骨细胞生成分为 3 个步骤:首先是 BMMs 激活,形成 TRAP 阳性的破骨细胞前体细胞;然后破骨细胞前体细胞相互融合,形成多核巨细胞;最后通过分化和激活成为成熟的破骨细胞[17]。Connexin43 是一种缝隙连接蛋白,主要功能为介导细胞间小分子物质的交换,由相邻两个细胞上并列的两个半通道组成,每个半通道又由六聚体跨膜蛋白组成[15]。文献报道,Connexin43 在成骨细胞、肌细胞等细胞的小分子物质交换中扮演了重要角色[16],而细胞间小分子物质交换又在破骨细胞前体细胞融合过程中具有重要作用。
本实验中,我们先鉴定了培养的细胞即 BMMs,然后经 CCK-8 细胞活性实验发现 100 ng/mL LPS 对 BMMs 活性有明显促进作用。在诱导破骨细胞生成过程中,我们先用 30 ng/mL M-CSF+20 ng/mL RANKL 诱导 3 d 后,再分别加入浓度为 50 ng/mL 或 100 ng/mL 的 LPS,继续培养 2 d。TRAP 染色观察显示,M-CSF 组未见破骨细胞生成,M-CSF+RANKL 组经 RANKL 诱导产生了少量破骨细胞,而两 LPS 组则进一步促进了破骨细胞的生成,生成的破骨细胞数量更多、体积更大、细胞核更多,并且这种效应呈现浓度依赖,破骨细胞面积百分比组间比较差异有统计学意义,提示 LPS 对破骨细胞生成有促进作用。然后,我们进一步观察了 LPS 对破骨细胞骨吸收功能的影响。经诱导 5 d 后,M-CSF 组未形成破骨细胞骨吸收瘢痕,M-CSF+RANKL 组形成了少量破骨细胞骨吸收瘢痕,两 LPS 组形成的破骨细胞骨吸收瘢痕更多、面积更大,且高浓度组效应更明显;骨吸收百分比组间比较差异有统计学意义,提示 LPS 能够增强破骨细胞的骨吸收功能。
调节破骨细胞前体细胞融合的基因有 Connexin43、DC-STAMP、OC-STAMP 等,它们调节破骨细胞前体细胞的迁移,细胞与细胞间的交流,主导破骨细胞前体细胞相互融合[18]。为了研究 LPS 促进破骨细胞生成的具体分子机制,我们探讨了 LPS 对 Connexin43 表达的影响。Connexin43 是一种细胞间的水通道,允许 1 kDa 以下的营养素、代谢产物、离子、小分子等在细胞间彼此交换[19]。其在破骨细胞的形成、破骨细胞发挥骨吸收功能、以及骨重建过程中细胞间相互交流方面发挥了重要的作用。抑制 Connexin43 表达会抑制多核破骨细胞形成[20]。文献报道,在诱导破骨细胞过程中 Connexin43 表达量持续下降,而 RANKL 能减弱 Connexin43 下降的幅度[21]。本研究分析了 LPS 对 Connexin43 蛋白表达量影响,结果显示 LPS 能够显著促进 Connexin43 蛋白表达量的增加。同时,实时荧光定量 PCR 检测示 LPS 能够促进 Connexin43 基因表达,并且浓度越高作用越明显。表明 LPS 通过促进 Connexin43 表达,提升了破骨细胞前体细胞间小分子物质的交换,促进了破骨细胞的生成,使诱导生成的破骨细胞更多、体积更大,进而提升了破骨细胞的骨吸收功能。
细菌感染是导致不必要的骨损失的重要原因。LPS 是革兰阴性菌细胞壁的主要成分,是一种导致炎症性骨损失的病原体[22]。临床上,感染性骨不连、感染性关节炎的患者往往伴有骨吸收异常增强导致的骨破坏。关节置换术后感染的患者也会出现骨吸收异常增强,进而导致假体松动。本实验证实了 LPS 对破骨细胞的生成和其骨吸收功能具有促进作用,提示临床抗感染治疗时,抑制 LPS 吸收是重要关键措施。
综上述,本实验结果显示 LPS 能够促进破骨细胞生成,并且加强破骨细胞的骨吸收功能。作用机制为 LPS 通过促进 Connexin43 表达,从而产生了更多破骨细胞。提示抑制 LPS 吸收可作为一种治疗炎症性骨损失相关疾病的潜在靶点。
Funding Statement
国家中医药行业科研专项项目(201507001);国家自然科学基金资助项目(31172169)
National Scientific Research Projects of Traditional Chinese Medicine (201507001); National Natural Science Foundation of China (31172169)
References
- 1.Karsenty G The complexities of skeletal biology. Nature. 2003;423(6937):316–318. doi: 10.1038/nature01654. [DOI] [PubMed] [Google Scholar]
- 2.Zeng XZ, He LG, Wang S, et al Aconine inhibits RANKL-induced osteoclast differentiation in RAW264.7 cells by suppressing NF-κB and NFATc1 activation and DC-STAMP expression. Acta Pharmacol Sin. 2016;37(2):255–263. doi: 10.1038/aps.2015.85. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Qu X, Zhai Z, Liu X, et al Dioscin inhibits osteoclast differentiation and bone resorption though down-regulating the Akt signaling cascades. Biochem Biophys Res Commun. 2014;443(2):658–665. doi: 10.1016/j.bbrc.2013.12.029. [DOI] [PubMed] [Google Scholar]
- 4.Zhao N, Tsuda H, Murofushi T, et al Chaetocin inhibits RANKL-induced osteoclast differentiation through reduction of Blimp1 in Raw264.7 cells. Life Sci. 2015;143:1–7. doi: 10.1016/j.lfs.2015.10.027. [DOI] [PubMed] [Google Scholar]
- 5.Choe JY, Kim SK Melittin inhibits osteoclast formation through the downregulation of the RANKL-RANK signaling pathway and the inhibition of interleukin-1β in murine macrophages. Int J Mol Med. 2017;39(3):539–548. doi: 10.3892/ijmm.2017.2876. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ye S, Fowler TW, Pavlos NJ, et al LIS1 regulates osteoclast formation and function through its interactions with dynein/dynactin and Plekhm1. PLoS One. 2011;6(11):e27285. doi: 10.1371/journal.pone.0027285. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Strålberg F, Kassem A, Kasprzyowski F, et al Inhibition of lipopolysaccharide-induced osteoclast formation and bone resorption in vitro and in vivo by cysteine proteinase inhibitors . J Leukoc Biol. 2017;101(5):1233–1243. doi: 10.1189/jlb.3A1016-433R. [DOI] [PubMed] [Google Scholar]
- 8.Yasuda H, Shima N, Nakagawa N, et al Osteoclast differentiation factor is ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci U S A. 1998;95(7):3597–3602. doi: 10.1073/pnas.95.7.3597. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Boyce BF Advances in the regulation of osteoclasts and osteoclast functions. J Dent Res. 2013;92(10):860–867. doi: 10.1177/0022034513500306. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chung YH, Chang EJ, Kim SJ, et al Lipopolysaccharide from Prevotella nigrescens stimulates osteoclastogenesis in cocultures of bone marrow mononuclear cells and primary osteoblasts. J Periodontal Res. 2006;41(4):288–296. doi: 10.1111/j.1600-0765.2006.00876.x. [DOI] [PubMed] [Google Scholar]
- 11.Islam S, Hassan F, Tumurkhuu G, et al Bacterial lipopolysaccharide induces osteoclast formation in RAW 264.7 macrophage cells. Biochem Biophys Res Commun. 2007;360(2):346–351. doi: 10.1016/j.bbrc.2007.06.023. [DOI] [PubMed] [Google Scholar]
- 12.Zhai ZJ, Li HW, Liu GW, et al Andrographolide suppresses RANKL-induced osteoclastogenesis in vitro and prevents inflammatory bone loss in vivo . Br J Pharmacol. 2014;171(3):663–675. doi: 10.1111/bph.12463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Qin A, Cheng TS, Lin Z, et al Prevention of wear particle-induced osteolysis by a novel V-ATPase inhibitor saliphenylhalamide through inhibition of osteoclast bone resorption. PLoS One. 2012;7(4):e34132. doi: 10.1371/journal.pone.0034132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zou W, Izawa T, Zhu T, et al Talin1 and Rap1 are critical for osteoclast function. Mol Cell Biol. 2013;33(4):830–844. doi: 10.1128/MCB.00790-12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ilvesaro J, Väänänen K,Tuukkanen J Bone-resorbing osteoclasts contain gap-junctional connexin-43. J Bone Miner Res. 2000;15(5):919–926. doi: 10.1359/jbmr.2000.15.5.919. [DOI] [PubMed] [Google Scholar]
- 16.Hobolt-Pedersen AS, Delaissé JM, Soe L Osteoclast fusion is based on heterogeneity between fusion partners. Calcif Tissue Int. 2014;95(1):73–82. doi: 10.1007/s00223-014-9864-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kang JH, Sim JS, Zheng T, et al F4/80 inhibits osteoclast differentiation via downregulation of nuclear factor of activated T cells, cytoplasmic 1. Arch Pharm Res. 2017;40(4):492–499. doi: 10.1007/s12272-017-0900-7. [DOI] [PubMed] [Google Scholar]
- 18.Lee K, Chung YH, Ahn H, et al Selective regulation of MAPK signaling mediates RANKL-dependent osteoclast differentiation. Int J Biol Sci. 2016;12(2):235–245. doi: 10.7150/ijbs.13814. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kylmäoja E, Kokkonen H, Kauppinen K, et al Osteoclastogenesis is influenced by modulation of gap junctional communication with antiarrhythmic peptides. Calcif Tissue Int. 2013;92(3):270–281. doi: 10.1007/s00223-012-9680-8. [DOI] [PubMed] [Google Scholar]
- 20.Shi C, Zhang H, Louie K, et al BMP signaling mediated by BMPR1A in osteoclasts negatively regulates osteoblast mineralization through suppression of Cx43. J Cell Biochem. 2017;118(3):605–614. doi: 10.1002/jcb.25746. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Schilling AF, Filke S, Lange T, et al Gap junctional communication in human osteoclasts in vitro and in vivo . J Cell Mol Med. 2008;12(6A):2497–2504. doi: 10.1111/j.1582-4934.2008.00275.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Xing Q, de Vos P, Faas MM, et al LPS promotes pre-osteoclast activity by up-regulating CXCR4 via TLR-4. J Dent Res. 2011;90(2):157–162. doi: 10.1177/0022034510379019. [DOI] [PubMed] [Google Scholar]