Abstract
目的
探讨皮肤牵张闭合器在糖尿病足创面修复中的临床应用价值。
方法
回顾分析 2015 年 10 月—2016 年 7 月,采用皮肤牵张闭合器治疗的 24 例糖尿病足患者(试验组)临床资料,与同期采用封闭式负压引流联合植皮修复的 24 例患者(对照组)进行比较。两组患者性别、年龄、侧别、病程、TEXAS 分级分期等一般资料比较,差异均无统计学意义(P>0.05)。两组患者均根据细菌培养结果,同时应用敏感抗生素治疗。
结果
术后试验组及对照组各 1 例发生感染,均经对症处理后创面愈合。其余患者创面均顺利愈合,其中试验组愈合时间为(12.8±11.6)d,较对照组(22.3±10.4)d 显著缩短,比较差异有统计学意义(t=2.987,P=0.005)。两组患者术后均获随访,随访时间 3~12 个月,创面无裂开,随访期间溃疡无复发。
结论
与封闭式负压引流联合植皮修复相比,应用皮肤牵张闭合器治疗糖尿病足创面更简便,能缩短创面愈合时间,且创面愈合外观后与邻近皮肤相似。
Keywords: 糖尿病足, 皮肤牵张闭合器, 封闭式负压引流, 植皮, 创面愈合
Abstract
Objective
To evaluate the clinical value of skin stretching device in repair of diabetic foot wound.
Methods
A retrospective analysis was made on the clinical data of 48 cases with diabetic foot wound who were treated with skin stretching device (trial group, n=24) and with the vacuum sealing drainage combined with skin graft (control group, n=24) respectively between October 2015 and July 2016. There was no significant difference in gender, age, side, course of disease, TEXAS stage between 2 groups (P>0.05). Both patients in 2 groups were treated with sensitive antibiotics according to the results of bacterial culture.
Results
One case in control group was infected and the skin graft failed, and 1 case in trial group was infected after the treatment, and the two wounds healed after symptomatic treatment. The wounds of the other patients healed successfully, and the healing time of the trial group was significantly shorter than that of the control group [(12.8±11.6) days vs. (22.3±10.4) days; t=2.987, P=0.005). All patients were followed up 3-12 months after operation, and no wound dehiscence or recurrence occurred during follow-up.
Conclusion
Compared with the vacuum sealing drainage combined with skin graft, the application of skin stretching device in the repair of diabetic foot wound has advantages, such as easy to operate, shorten the wound healing time, and the appearance of wound was similar with the adjacent skin.
Keywords: Diabetic foot, skin stretching device, vacuum sealing drainage, skin graft, wound healing
糖尿病足是糖尿病远期并发症之一,也是导致糖尿病患者截肢率、致死率高的并发症之一[1]。糖尿病足为下肢远端血管病变合并神经病变,伴或不伴足部感染、溃疡和深部组织破坏。糖尿病足创面愈合慢,治疗费用高,长期创面存在会导致原病情加重[2-3]。传统外科治疗方法包括换药、清创植皮、局部皮瓣修复、游离皮瓣修复等,但治疗周期长,需多次手术,发生感染的风险较大。皮肤牵张闭合器是一种可以使创面在减张情况下逐渐闭合的辅助材料,目前已应用于四肢外伤创面、骶尾部褥疮溃疡创面的治疗。2015 年 10 月—2016 年 7 月,我们采用皮肤牵张闭合器治疗 24 例糖尿病足创面,取得了较好疗效。现与同期采用封闭式负压引流联合植皮修复的 24 例患者进行比较,探讨皮肤牵张闭合器用于该类创面治疗的优势。报告如下。
1. 临床资料
1.1. 患者选择标准
纳入标准:① 糖尿病足患者,TEXAS 分级分期[4]为 2 级 C 期或者 3 级 D 期;② 经正规保守换药治疗无效。排除标准:① 急性感染期创面,创缘组织水肿较严重,组织脆性大;② 清创后周围组织微循环灌注不佳;③ 患者存在严重的心肺疾病,一般身体状况差。2015 年 10 月—2016 年 7 月,共纳入 48 例(48 足)糖尿病足患者。其中,24 例采用皮肤牵张闭合器[5-6]治疗(试验组),24 例采用封闭式负压引流联合植皮[7-9]修复(对照组)。
1.2. 一般资料
试验组:男 15 例,女 9 例;年龄 55~73 岁,平均 65.4 岁。左足 10 例,右足 14 例。患者均为 2 型糖尿病;糖尿病病程 16~40 年,平均 26.9 年。糖尿病足病程 4 个月~2 年,平均 1.16 年。根据 TEXAS 分级分期:2 级 C 期 14 例,3 级 D 期 10 例。术前患者糖化血红蛋白 5.2%~5.9%,平均 5.53%。
对照组:男 10 例,女 14 例;年龄 54~74 岁,平均 65.8 岁。左足 11 例,右足 13 例。患者均为 2 型糖尿病;糖尿病病程 18~36 年,平均 26.9 年。糖尿病足病程 3 个月~2 年,平均 1.04 年。根据 TEXAS 分级分期:2 级 C 期 17 例,3 级 D 期 7 例。术前患者糖化血红蛋白 5.1%~5.7%,平均 5.44%。
两组患者性别、年龄、侧别、病程、TEXAS 分级分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.3. 治疗方法
两组患者入院后均行创面细菌培养,根据细菌培养结果应用敏感抗生素治疗,同时对患者其他并发症进行治疗。
1.3.1. 试验组
采取椎管内麻醉后,患者仰卧于手术台上,常规消毒、铺单,彻底清除坏死组织,包括颜色暗红的炎性肉芽组织,颜色灰白的肌肉组织及无活性的腱性组织,对于坏疽组织彻底清除(如患趾完全坏疽,先行清创截趾术),H2O2 及生理盐水先后冲洗创口。清创或者截趾后创面范围为 6.0 cm×4.5 cm~8.0 cm×5.0 cm。本组均采用拜尔卫姆中国科技发展有限公司的皮肤牵张闭合器。沿创面长轴两边皮肤软组织内、距创缘 1.0~1.5 cm 处,各间断穿入直径 0.8 mm 钩针;然后应用 2 个套杆分别将创口两侧钩针连接,依次组装钩针卡槽、类弹簧对合器;最后连接拉杆。安装完毕后,从 0.5 kg 张力开始牵拉创面两侧皮肤,由于创口两侧皮肤弹性作用,创口面积减小。牵引时注意皮缘血供情况,如术中张力较大,可适当游离创面周围皮下组织,并将类弹簧对合器松至 0 kg 张力,再牵拉至 0.5 kg 张力,以 2 次/min 循环重复,约 5 min,然后依次进行 1.5 kg 和 3.0 kg 牵张力循环牵拉皮肤,共计 15 min,最终保持在 3.0 kg 牵张力(皮缘最大承受牵张力)。此时创缘的紧张度最大,创面未闭合区域应用凡士林纱布覆盖,保证创面逐渐闭合同时充分引流,结束手术。
术后每日 2 次检查皮缘松紧程度,如有皮缘松弛,再次进行上述牵张循环,使皮肤保持在最大牵张力状态,并持续得到延展,直至新延展的皮肤软组织可以闭合创面或者接近闭合后拆除牵伸器,再次手术无张力状态下缝合创口。
1.3.2. 对照组
采取椎管内麻醉后,患者仰卧于手术台上,常规消毒、铺单。首先,彻底清除坏死组织,如患趾坏疽首先行趾离断术,再行创面清创。清创或者截趾后创面范围为 7.0 cm×4.0 cm~8.0 cm×4.5 cm。本组均采用封闭式负压引流联合植皮修复。清创术后先对创面采取封闭式负压吸引,依据创面缺损面积及形状,修剪负压海绵敷料,敷料贴敷于创面上方,然后薄膜覆盖,外接负压装置。术后维持负压 11~16 kPa,注意负压管引流通畅,必要时行生理盐水冲洗引流管。术后 7 d 拆除负压海绵敷料,观察创面肉芽组织生长情况,如创面基底满足植皮条件,则行植皮术,否则继续封闭式负压引流治疗。
依据创面缺损面积及形状,于患肢大腿或者小腿内侧,应用取皮刀切取刃厚皮片;将皮片覆盖于创面,覆盖凡士林纱布后,继续应用负压海绵敷料覆盖,外接负压装置,行封闭式负压引流治疗,维持负压 11~16 kPa。10 d 后更换负压海绵敷料,观察植皮成活情况。
1.4. 统计学方法
采用 SPSS18.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
术后对照组及试验组各 1 例发生感染。对照组感染、植皮失败者经再次封闭式负压引流联合植皮修复后,创面愈合;试验组感染者经拆除皮肤牵张闭合器、清创缝合后,创面换药直至愈合。其余患者创面均顺利愈合,其中试验组愈合时间为(12.8±11.6)d,较对照组(22.3±10.4)d 显著缩短,比较差异有统计学意义(t=2.987,P=0.005)。两组患者术后均获随访,随访时间 3~12 个月,创面无裂开,随访期间溃疡无复发。见图 1。
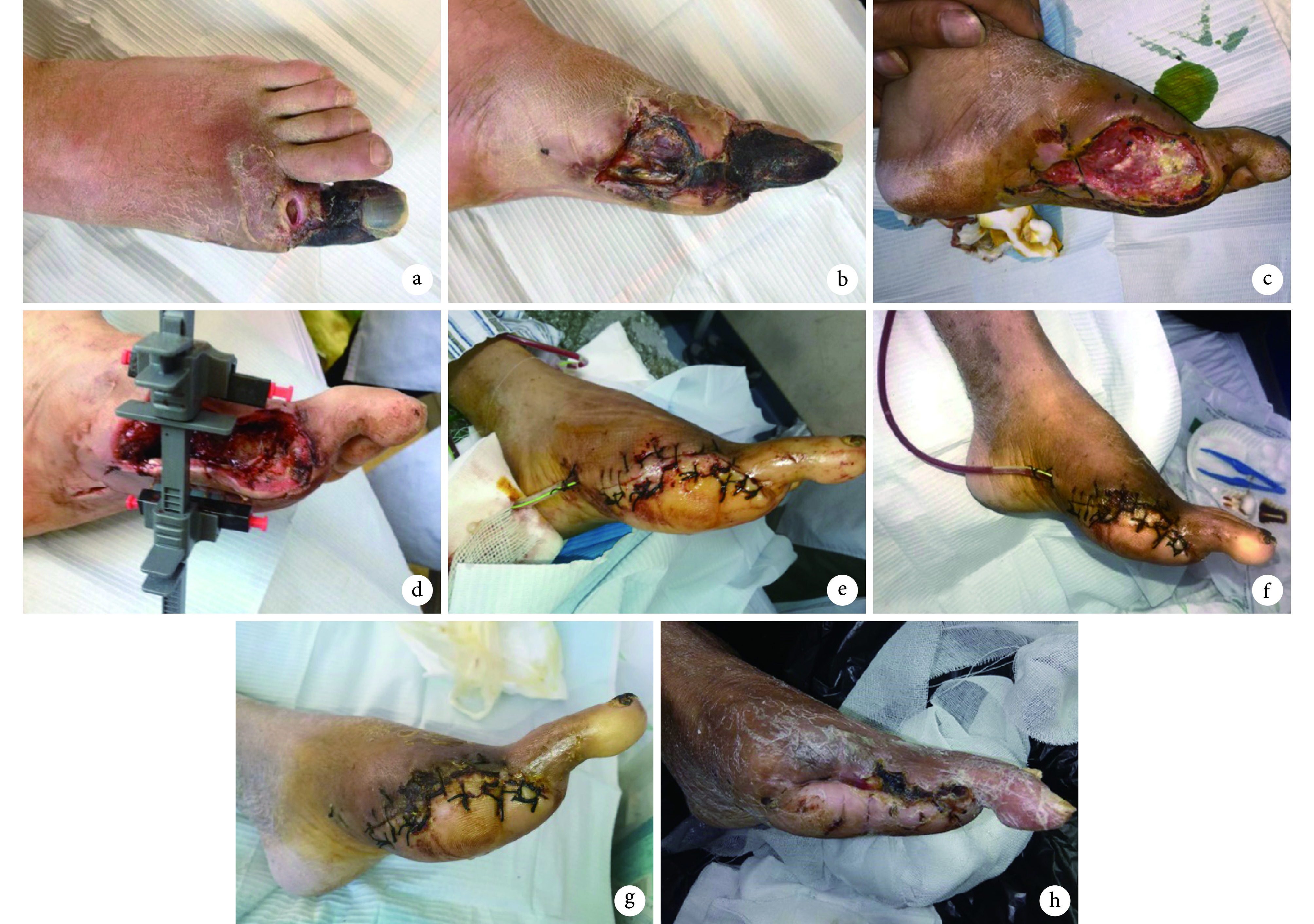
图 1.
A 67-year-old male patient with diabetic foot and gangrene of right foot (TEXAS stage 3 and stage D) in trial group
试验组患者,男,67 岁,右足糖尿病足伴足趾坏疽(TEXAS 分级分期 3 级 D 期)
a、b. 术前;c. 清创及截趾后创面;d. 术中安装皮肤牵张闭合器;e. 术后 5 d 创面拉拢缝合;f. 术后 7 d;g. 术后 14 d;h. 术后 3 个月
a, b. Before operation; c. The wound after debridement and toes amputation; d. Installed the skin stretching device; e. The wound was sutured at 5 days after operation; f. At 7 days after operation; g. At 14 days after operation; h. At 3 months after operation
3. 讨论
目前,临床治疗糖尿病足创面主要 3 种方法。第 1 种为采用各种敷料[10-13](水胶体、水凝胶、藻类敷料等)修复创面,但敷料价格昂贵,患者经济负担较大。第 2 种为封闭式负压引流联合植皮修复,该方法可使创面完全无张力闭合,但是糖尿病足患者下肢血供较差,创面局部存在严重缺血,植皮后可能不成活,而且如取皮面积过大供皮区存在感染可能。第 3 种为皮瓣修复,该方法可修复肌腱、骨等外露创面,但同样因糖尿病足局部血供较差,局部微循环难以很快建立,皮瓣坏死风险高。
皮肤牵张闭合器技术于 1993 年由 Hirshowitz B 提出,但是由于装置较简单,其钩针对皮肤软组织存在副损伤,尤其当牵张力较大时,不利于创缘合拢,反而造成局部皮肤切割性损伤,因此未获得广泛应用,直至 Wilhelm Fleischman 教授对皮肤牵张闭合器进行了改良(即本组采用的器械)[5-6, 14-18]。改良后的皮肤牵张闭合器以最小皮肤牵张力(0.5 kg)作为起始牵张力,当周围皮肤得到初步扩展后,依次增加牵张力(0.5、1.5、3.0 kg),使创缘皮肤组织始终在最大牵张力下牵拉,直至创缘延展的皮肤软组织可以闭合创面或者接近闭合,为无张力闭合创面创造条件。目前,皮肤牵张闭合器已用于皮肤软组织缺损的修复,因创面为邻近周围皮肤拉伸后缝合关闭,所以创面愈合后具有组织学方面的优势。但该技术用于特殊创面(如糖尿病足)治疗的报道较少[5-6, 19]。本研究中,我们采用皮肤牵张闭合器技术治疗糖尿病足创面,均为患足血供较差患者(TEXAS 分级分期 2 级 C 期和 3 级 D 期),取得了较好效果。与封闭式负压引流联合植皮修复相比,有效缩短了治疗时间。我们认为应用皮肤牵张闭合器技术治疗糖尿病足创面,可避免因患足血供差带来的创缘坏死问题,同时以牵张力递进方式保持皮缘最大牵张力的牵拉,稳定了创缘皮肤组织的经皮氧分压,且糖尿病足创口由于皮肤牵张闭合器的使用未一期闭合而留有间隙,此时创口内的分泌物得到更好引流[18, 20]。
但选择皮肤牵张闭合器技术时需要注意以下方面:① 皮肤在非急性牵张过程中,皮肤胶原纤维机械性牵拉 8~12 h 后创缘皮肤松弛,此时创缘的牵张力将减小,不能达到皮肤最大牵张力,因此需要循环牵张,以保持创缘维持在最大牵张力的牵张状态[18]。② 对于糖尿病足急性感染期创面,创缘组织水肿、脆性大,皮肤牵张闭合器的应用达不到延展皮肤的效果,反而会加重皮肤软组织的损伤,因此对于组织脆性较大的创面,首先需要彻底清创和换药治疗,为应用皮肤牵张闭合器技术奠定基础。③ 皮肤牵张闭合器技术是一种以点代面的整体牵拉方式,对于局部皮肤是由三点连接形成的线,经过牵拉后,创缘周围皮肤保持良好的经皮氧分压,从而牵拉形成的新皮肤可以获得足够的微循环血供,但创缘重度缺血(无法建立微循环)时则不宜使用该技术。④ 本研究试验组创面位于足部外侧或内侧的足背皮肤与足底皮肤交界处,由于足底皮肤形成较厚的角质层,皮肤弹性差,如果对足底溃疡进行清创,清创后不易应用皮肤牵张闭合器闭合;试验组创面宽度介于 4.5~6.0 cm之间,创口周围皮肤被牵张后均延展出足够的皮肤以闭合创面;由于糖尿病足患者肢体存在不同程度的缺血,因此创缘皮肤延展性受到影响,但是同样的最大牵张力(3 kg)可以使外伤导致的创面(非糖尿病引起)延展出更多皮肤。⑤ 由于皮肤牵张闭合器需牵拉一段时间,因此需要定期消毒,保持装置及针道相对清洁。
综上述,皮肤牵张闭合器技术可用于糖尿病足创面的治疗,但是其相关适应证及选择标准均有待进一步完善。例如,通过踝肱指数、趾肱指数及血管经皮氧分压等量化指标,评估治疗前后患者皮肤组织缺血程度的变化;采用动态激光多普勒血流监测皮肤牵张后血液灌注情况。此外,还需要开展皮肤牵张闭合器技术基础实验研究,分析皮肤牵张力与牵张后所形成的新生皮肤面积的关系,使皮肤牵张闭合器技术更科学地应用于糖尿病足创面的治疗。
Funding Statement
国家自然科学基金资助项目(81473502)
National Natural Science Foundation of China (81473502)
References
- 1.张敏, 李建香, 马文静, 等 我国糖尿病流行病学和疾病经济负担研究现状. 世界最新医学信息文摘. 2017;17(56):176. [Google Scholar]
- 2.Sanz-Corbalán I, Lázaro-Martínez JL, García-Morales E, et al. Advantages of early diagnosis of diabetic neuropathy in the prevention of diabetic foot ulcers. Diabetes Res Clin Pract, 2017. [Epub ahead of print]
- 3.Sekhar MS, Mk U, Vyas N, et al Development and evaluation of patient information leaflet for diabetic foot ulcer patients. Int J Endocrinol Metab. 2017;15(3):e55454. doi: 10.5812/ijem.55454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Armstrong DG The University of Texas Diabetic Foot Classification System. Ostomy Wound Manage. 1996;42(8):60–61. [PubMed] [Google Scholar]
- 5.鲁明, 张振, 宋明智, 等 拉杆式皮肤扩展器Ⅰ期闭合筋膜间室切开减压术后创面. 中华创伤杂志. 2016;32(3):249–251. [Google Scholar]
- 6.苑博, 王寿宇, 梁海东, 等 新型拉杆式皮肤牵张器在修复 26 例患者四肢皮肤软组织缺损中的应用. 中华烧伤杂志. 2016;32(12):732–734. [Google Scholar]
- 7.任高宏, 黎健伟, 黎润光, 等 桥式皮瓣联合游离植皮负压封闭引流修复下肢大面积环形软组织缺损. 中华外科杂志. 2012;50(1):39–44. [Google Scholar]
- 8.徐成, 鲁延林, 范锟铻 负压封闭引流在糖尿病足治疗中的应用研究. 中国临床研究. 2016;29(5):627–628. [Google Scholar]
- 9.朱新华, 柴益民, 叶吉忠, 等 负压封闭引流和传统修复方法促进糖尿病足愈合的比较. 中国组织工程研究. 2014;18(34):5548–5554. [Google Scholar]
- 10.Takei T, Danjo S, Sakoguchi S, et al. Autoclavable physically-crosslinked chitosan cryogel as a wound dressing. Biosci Bioeng, 2017. [Epub ahead of print]
- 11.Hodgson H, Davidson D, Duncan A, et al Clinical evaluation of a hydro-responsive wound dressing: the Glasgow experience. J Wound Care. 2017;26(11):642–650. doi: 10.12968/jowc.2017.26.11.642. [DOI] [PubMed] [Google Scholar]
- 12.De Marchi JGB, Jornada DS, Silva FK Triclosan resistance reversion by encapsulation in chitosan-coated-nanocapsule containing α-bisabolol as core: development of wound dressing. Int J Nanomedicine. 2017;12:7855–7868. doi: 10.2147/IJN.S143324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.von Cramon L, Markowicz M, Nebendahl J, et al A clinical evaluation of a transparent, absorbent, adhesive wound dressing. Br J Nurs. 2017;26(Sup20):S46–S53. doi: 10.12968/bjon.2017.26.Sup20.S46. [DOI] [PubMed] [Google Scholar]
- 14.Hirshowitz B, Lindenbaum E, Har-Shai Y A skin-stretching device for the harnessing of the viscoelastic properties of skin. Plast Reconstr Surg. 1993;92(2):260–270. doi: 10.1097/00006534-199308000-00010. [DOI] [PubMed] [Google Scholar]
- 15.Melis P, Noorlander ML, van der Horst CM, et al Rapid alignment of collagen fibers in the dermis of undermined and not undermined skin stretched with a skin-stretching device. Plast Reconstr Surg. 2002;109(2):674–680. doi: 10.1097/00006534-200202000-00038. [DOI] [PubMed] [Google Scholar]
- 16.Pavletic MM Use of an external skin-stretching device for wound closure in dogs and cats. J Am Vet Med Assoc. 2000;217(3):350–354. doi: 10.2460/javma.2000.217.350. [DOI] [PubMed] [Google Scholar]
- 17.Melis P, Bos KE, Horenblas S Primary skin closure of a large groin defect after inguinal lymphadenectomy for penile cancer using a skin stretching device. J Urol. 1998;159(1):185–187. doi: 10.1016/s0022-5347(01)64052-7. [DOI] [PubMed] [Google Scholar]
- 18.Song M, Zhang Z, Liu T EASApprox® skin-stretching system: A secure and effective method to achieve wound closure . Exp Ther Med. 2017;14(1):531–538. doi: 10.3892/etm.2017.4539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.董其强, 谷国俊, 王礼军, 等 改良可调式皮肤牵张闭合器在皮肤及软组织缺损修复中的应用. 中国修复重建外科杂志. 2017;31(12):1481–1484. doi: 10.7507/1002-1892.201707103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cheng LF, Lee JT, Hsu H, et al Simple skin-stretching device in assisted tension-free wound closure. Ann Plast Surg. 2017;78(3 Suppl 2):S52–S57. doi: 10.1097/SAP.0000000000001006. [DOI] [PMC free article] [PubMed] [Google Scholar]


