Abstract
目的
探讨椎间孔镜不同入路方式的选择对术中髓核摘除量的影响及术后临床疗效分析。
方法
2011 年 8 月—2014 年 12 月采用腰椎侧后路微创椎间孔镜髓核摘除术治疗 165 例腰椎间盘突出症患者。根据术中椎间孔镜不同入路方式将患者分为 4 组:A 组 42 例采用后外侧入路(Yeung 技术),B 组 40 例采用经典椎间孔入路[经椎间孔内窥镜脊柱系统(transforaminal endoscopic spine system,TESSYS)技术],C 组 43 例采用改良椎间孔入路(improved transforaminal endoscopic access,ITEA),D 组 40 例采用椎板间入路。各组患者性别、年龄、病程、侧别、病变节段等一般资料比较差异无统计学意义(P>0.05),具有可比性。计算并比较 4 组患者髓核摘除量;临床疗效采用疼痛视觉模拟评分(VAS)、Oswestry 功能障碍指数(ODI)、腰椎曲度指数(lumbar curvature index,LCI)和椎间隙高度等进行评估。
结果
A、B、C、D 组术中髓核摘除体积分别为(3.7±0.8)、(3.6±0.7)、(4.5±1.1)、(3.0±0.8)cm3,C 组体积显著大于其余 3 组,D 组体积显著小于其余 3 组,差异均有统计学意义(P<0.05);A、B 组间比较差异无统计学意义(P>0.05)。术中出现脑脊液漏 1 例,无术后椎间隙感染、硬膜外血肿等并发症发生。术后患者切口均Ⅰ期愈合。患者均获随访,随访时间 12~24 个月,平均 18 个月;随访期间无典型术后髓核突出复发症状。术前各组间 ODI 评分、下腰痛 VAS 评分及双下肢 VAS 评分比较差异均无统计学意义(P>0.05);末次随访时各组上述评分均较术前显著改善(P<0.05);各组间比较差异均无统计学意义(P>0.05);各评分改善值各组间比较差异均无统计学意义(P>0.05)。术前及末次随访时各组间比较 LCI 及椎间隙高度差异均无统计学意义(P>0.05);各组末次随访时与术前比较以及末次随访时各组间 LCI 变化值和椎间隙高度丢失比较差异亦无统计学意义(P>0.05)。
结论
腰椎侧后路微创椎间孔镜术中,采用 ITEA 技术的手术操作范围更大,术中探查及摘除责任髓核更彻底;但需要根据患者腰椎间盘突出的症状及特点选择合适的手术入路方式。
Keywords: 髓核摘除术, 椎间孔镜, 微创手术, 腰椎间盘突出症
Abstract
Objective
To investigate the effect and effectiveness analysis of different approaches of transforaminal endoscope on extirpation amount of nuclues pulposus.
Methods
Between August 2011 and December 2014, a total of 165 patients with lumbar disc herniation were retrospectively enrolled and were treated with nucleus pulposus discectomy through transforaminal endoscope. The patients were randomly divided into 4 groups according to different approach of transforaminal endoscope. The posterolateral approach (Yeung’s technology) was used in group A (42 cases), transforaminal endoscopic spine system (TESSYS) technology was used in group B (40 cases), improved transforaminal endoscopic access (ITEA) technology was used in group C (43 cases), and interlaminar approach (40 cases) was used in group D (40 cases). There was no significant difference in gender, age, disease duration, symptomatic side, and segments among 4 groups (P>0.05). The extirpation amount of nuclues pulposus was calculated and compared among 4 groups; the effectiveness was evaluated by pre- and post-operative visual analogue scale (VAS) score, Oswestry disability index (ODI), lumbar curvature index (LCI), and intervertebral height.
Results
The discectomy amount of nucleus pulposus was (3.7±0.8), (3.6±0.7), (4.5±1.1), and (3.0±0.8) cm3 in groups A, B, C, and D, respectively. The amount of group C was significantly larger than that of the other 3 groups (P<0.05), and the amount of group D was significantly smaller than that of the other 3 groups (P<0.05); no significant difference was found between groups A and B (P>0.05). Cerebrospinal fluid leakage was found in 1 case; no other postoperative complications including intervertebral space infection and epidural hematoma was found. All the incisions healed by first intension. All the patients were followed up 12-24 months (mean, 18 months), and no typical symptoms of recurrence was found during the follow-up period. There was no significant difference in preoperative lower back pain VAS score, lower extremities VAS score, and ODI scores among 4 groups (P>0.05). The above scores at last follow-up were significantly improved when compared with preoperative ones in each group (P<0.05), but no significant difference of above scores and recovery values was found among 4 groups (P>0.05). The difference in LCI and intervertebral height at preoperation and at last follow-up were not significant between 4 groups (P>0.05). The difference in LCI and intervertebral height of each group between at preoperation and last follow-up were not significant (P>0.05). And the recovery value of LCI and the lost of height at last follow-up also showed no significant differences between 4 groups (P>0.05).
Conclusion
The ITEA technology can give a wider field of view than other technologies. It is more convenient to find and remove the nucleus pulposus. However, the appropriate operative approaches should be chosen according to the symptoms and characteristics of lumbar disc herniation.
Keywords: Discectomy, transforaminal endoscope, minimally invasive surgery, lumbar disc herniation
椎间孔镜下髓核摘除术治疗腰椎间盘突出症目前已在全国广泛开展。其主要入路方式包括后外侧入路(Yeung 技术)、经典椎间孔入路[经椎间孔内窥镜脊柱系统(transforaminal endoscopic spine system,TESSYS)技术]、改良椎间孔入路(improved transforaminal endoscopic access,ITEA)、椎板间入路[1]。但关于入路方式的选择对探查椎间盘及摘除髓核体积的影响尚存在争议[2]。本研究回顾分析了 2011 年 8 月—2014 年 12 月因腰椎间盘突出症行腰椎侧后路椎间孔镜髓核摘除术的 165 例随访完整患者临床资料,旨在进一步研究不同入路方式的选择对探查椎间盘及摘除髓核体积的影响及临床意义。报告如下。
1. 临床资料
1.1. 一般资料
根据术中椎间孔镜不同入路方式将患者分为 4 组:A 组 42 例采用 Yeung 技术,B 组 40 例采用 TESSYS 技术,C 组 43 例采用 ITEA 技术,D 组 40 例采用椎板间入路。
A 组:男 20 例,女 22 例;年龄 24~56 岁,平均 38.1 岁。病程 4 个月~5 年,平均 2 年。左侧 20 例,右侧 22 例。病变节段:L3、4 10 例,L4、5 24 例,L5、S1 8 例。B 组:男 19 例,女 21 例;年龄 18~58 岁,平均 36.6 岁。病程 2 个月~7 年,平均 2 年。左侧 19 例,右侧 21 例。病变节段:L3、4 11 例,L4、5 22 例,L5、S1 7 例。C 组:男 21 例,女 22 例;年龄 20~60 岁,平均 36.1 岁。病程 4 个月~10 年,平均 2 年。左侧 20 例,右侧 23 例。病变节段:L3、4 12 例,L4、5 21 例,L5、S1 10 例。D 组:男 20 例,女 20 例;年龄 22~60 岁,平均 37.1 岁。病程 5 个月~9 年,平均 2 年。左侧 18 例,右侧 22 例。病变节段:L3、4 9 例,L4、5 23 例,L5、S1 8 例。
所有患者主要症状为腰痛,下肢放射痛、憋胀、麻木,行走困难。查体:主要体征为腰部明显压痛、叩击痛,下肢相应神经支配区域肌力减弱、皮肤感觉减退,跟腱反射减弱,直腿抬高试验均为阳性。X 线片、CT、MRI 影像学检查示腰椎间盘明显退变、髓核脱出、压迫神经根。临床诊断为腰椎间盘突出症,均行腰椎侧后路椎间孔镜髓核摘除术治疗。各组患者性别、年龄、病程、侧别、病变节段等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2. 手术方法
所有患者于局麻下取俯卧位。手术设备为高清椎间孔镜影像系统及手术器械(JoiMax 公司,德国)。
A 组:术前常规椎间盘造影并注射亚甲蓝对退变髓核染色。中线旁开 8~12 cm,突破纤维环,通过安全三角进入椎间盘。镜下摘除被染色的髓核,椎间盘内观察纤维环破裂情况,射频电极进行纤维环成型和环状神经分支阻断。移动套管和内窥镜至椎间盘外,在椎间孔外侧观察神经根和硬膜囊,清理游离髓核组织。
B 组:首先使用定位针插入小关节突外沿;之后应用弧形导杆插入神经弓上方保护下行神经并避免扩孔时损伤硬膜。逐级使用扩孔钻,磨削小关节突,扩大神经孔。工作套管沿纤维环表面进入椎管前方,在内窥镜直视下摘除突出髓核组织。使用镜下骨凿和扩孔钻处理椎管狭窄、增生骨刺及钙化组织。根据病情可调整套管位置进入椎间盘内,处理变性髓核或清理椎间盘。
C 组:首先,缩短其侧方开口距中轴长度,即 L3、4 旁开 8~9 cm,L4、5 旁开 10~11 cm,L5、S1 旁开 12~13 cm。其次,ITEA 术前穿刺定位的头倾角和外展角更大,即 L3、4 头倾角和外展角均为 30~40°,L4、5 头倾角 40~50°、外展角 35~45°,L5、S1 头倾角 50~60°、外展角 40~50°。并且在穿刺过程中要求术中正位片定位穿刺针顶点于棘突连线,侧位片定位穿刺针顶点于下位椎体后上缘,即穿刺针定位时更偏向椎间孔结构的底部和背侧;之后椎间孔镜套筒可更深置入。
D 组:X 线摄像观察下行棘突旁患侧开口,穿刺成功后置入工作通道,连接内镜,探查椎间盘及神经根管,摘除游离及退变髓核组织。患者患肢症状明显减轻,运动、感觉无明显障碍,直腿抬高试验阴性,提示手术效果满意。撤出椎间孔镜系统。
1.3. 术后处理
患者术后口服广谱抗生素预防感染,伤口常规换药,术后第 2 天拔除引流管,在康复医师指导下逐步锻炼及下地活动。术后 3~5 d 出院,术后 10 d 门诊拆线。术后每 3 个月进行随访,并摄腰椎正侧位 X 线片。
1.4. 观测指标
髓核摘除体积测量与计算均由专人完成。在温度 20℃、湿度 40%~50% 条件下,使用滴管(5 mL)与量筒(10 mL,精确度 0.1 mL)进行测量。首先用滴管吸取林格液,小心滴入量筒中,此时读数为 Va;收集术中所摘除的髓核组织置入量筒中,读数为 Vb;髓核摘除体积即为 Vb–Va。
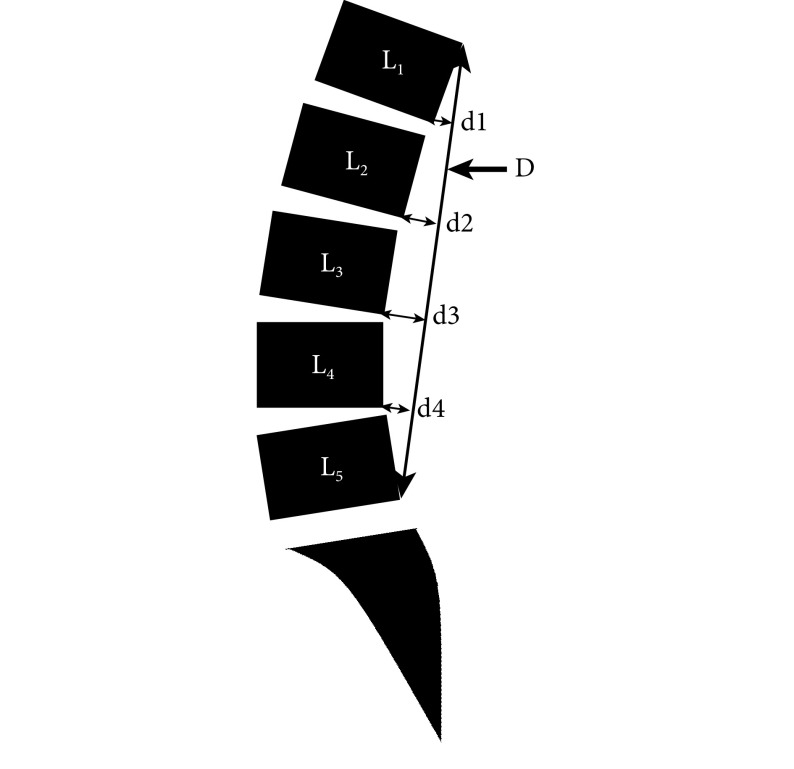
患者手术前后采用疼痛视觉模拟评分(VAS)和 Oswestry 功能障碍指数(ODI)评估下腰痛症状,双下肢疼痛症状采用 VAS 评估,并计算改善值。应用 Photoshop CS5 测量椎体间距离的均值为椎间隙高度。同时测量腰椎曲度指数(lumbar curvature index,LCI),其中 LCI=100×(d1+d2+d3+d4)/D,测量方法为:取 L1 椎体后上角至 L5 椎体后下角作一连线,距离为 D;L1~4 椎体后下角至上述连线的垂直距离分别为 d1~d4;见图 1。
图 1.
Measurement of LCI
LCI 测量
1.5. 统计学方法
采用 SPSS17.0 统计软件进行分析。计量资料以均数±标准差表示,组间比较采用方差分析,两两比较采用 t 检验或 SNK 检验;计数资料组间比较采用秩和检验或 χ2 检验;检验水准 α=0.05。
2. 结果
A、B、C、D 组术中髓核摘除体积分别为(3.7±0.8)、(3.6±0.7)、(4.5±1.1)、(3.0±0.8)cm3,C 组体积显著大于其余 3 组,D 组体积显著小于其余 3 组,差异均有统计学意义(P<0.05);A、B 组间比较差异无统计学意义(P>0.05)。术中出现脑脊液漏 1 例,无术后椎间隙感染、硬膜外血肿等并发症发生。术后患者切口均Ⅰ期愈合。患者均获随访,随访时间 12~24 个月,平均 18 个月;随访期间无典型术后髓核突出复发症状。见图 2~5。术前各组间 ODI 评分、下腰痛 VAS 评分及双下肢 VAS 评分比较差异均无统计学意义(P>0.05);末次随访时各组上述评分均较术前显著改善,差异有统计学意义(P<0.05);各组间比较差异均无统计学意义(P>0.05);各评分改善值各组间比较差异均无统计学意义(P>0.05)。见表 1。术前及末次随访时各组间比较 LCI 及椎间隙高度差异均无统计学意义(P>0.05);各组末次随访时与术前比较以及末次随访时各组间 LCI 变化值和椎间隙高度丢失比较差异亦无统计学意义(P>0.05)。见表 2。
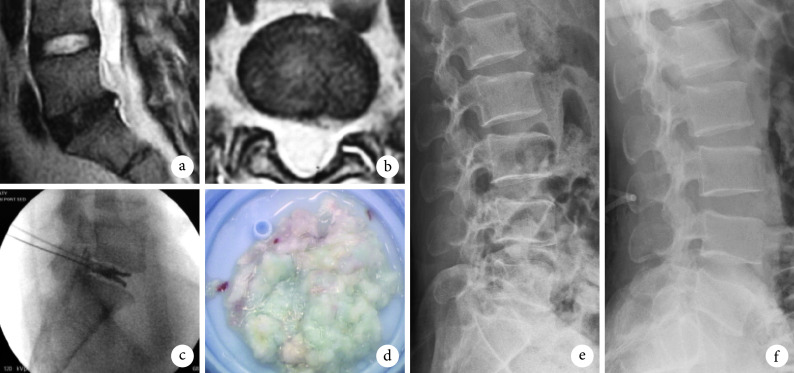
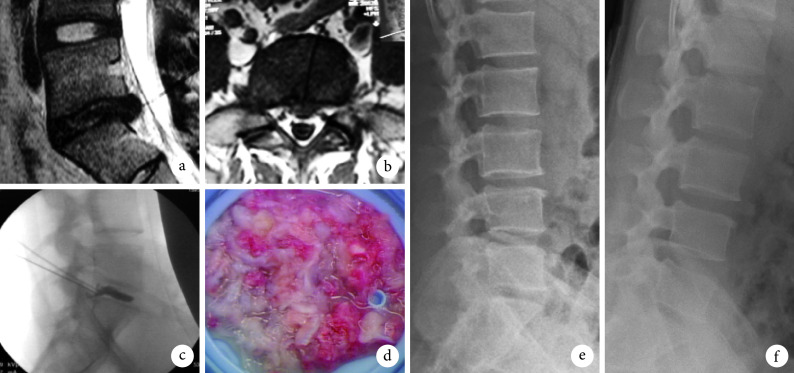
图 2.
A 46-year-old female patient with lumbar disc herniation at L5, S1 in group A
A 组患者,女,46 岁,L5、S1 腰椎间盘突出症
a. 术前矢状面 MRI;b. 术前横截面 MRI;c. 术中椎间盘造影;d. 髓核摘除量;e. 术后即刻侧位 X 线片;f. 术后 1 年侧位 X 线片
a. Sagittal MRI before operation; b. Coronal MRI before operation; c. Lumbar discography; d. Volume of nucleus pulposus; e. Lateral X-ray film at immediate after operation; f. Lateral X-ray film at 1 year after operation
图 5.
A 50-year-old male patient with lumbar disc herniation at L4, 5 in group D
D 组患者,男,50 岁,L4、5 腰椎间盘突出症
a. 术前矢状面 MRI;b. 术前横截面 MRI;c. 术中椎间盘造影;d. 髓核摘除量;e. 术后即刻侧位 X 线片;f. 术后 1 年侧位 X 线片
a. Sagittal MRI before operation; b. Coronal MRI before operation; c. Lumbar discography; d. Volume of nucleus pulposus; e. Lateral X-ray film at immediate after operation; f. Lateral X-ray film at 1 year after operation
表 1.
Comparision of the clinical scores between pre- and post-operation in 4 groups (
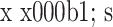 )
)
各组患者临床评分比较(
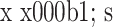 )
)
| 组别
Group |
例数
n |
下腰痛 VAS 评分
VAS scores for lower back pain |
双下肢 VAS 评分
VAS scores for both lower extremities |
|||||||
| 术前
Preoperative |
末次随访
Last follow-up |
统计值
Statistic |
改善值
Recovery |
术前
Preoperative |
末次随访
Last follow-up |
统计值
Statistic |
改善值
Recovery |
|||
| A | 42 | 7.0±2.5 | 2.0±1.6 |
t=10.861
P= 0.000 |
5.0±2.1 | 6.8±1.6 | 1.7±1.3 |
t=6.823
P=0.002 |
5.1±2.0 | |
| B | 40 | 7.2±1.9 | 2.3±1.1 |
t= 9.643
P= 0.000 |
4.9±1.9 | 7.0±1.8 | 1.8±1.2 |
t=6.114
P=0.000 |
5.2±1.9 | |
| C | 43 | 7.0±1.8 | 2.1±1.8 |
t=10.235
P= 0.000 |
4.9±2.2 | 6.7±1.9 | 1.7±1.0 |
t=6.451
P=0.003 |
5.0±2.1 | |
| D | 40 | 7.1±2.0 | 2.1±1.8 |
t=10.235
P= 0.000 |
5.0±2.0 | 6.8±1.5 | 1.8±1.1 |
t=6.451
P=0.003 |
5.0±1.8 | |
| 统计值 Statistic |
F=2.125
P=0.312 |
F=3.176
P=0.064 |
F=2.425
P=0.291 |
F=2.234
P=0.301 |
F=3.155
P=0.070 |
F=2.114
P=0.410 |
||||
表 2.
Comparision of the LCI and intervertebral height between pre- and post-operation in 4 groups (
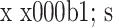 )
)
各组患者 LCI 及椎间隙高度比较(
 )
)
| 组别
Group |
例数
n |
LCI (%) | 椎间隙高度(mm)
Intervertebral height (mm) |
||||||||
| 术前
Preoperative |
末次随访
Last follow-up |
统计值
Statistic |
改变值
Change of LCI |
术前
Preoperative |
术后即刻
Immediate after operation |
末次随访
Last follow-up |
统计值
Statistic |
高度丢失
Lost of height |
|||
| A | 42 | 17.0±5.0 | 15.8±3.3 |
t=2.445
P=0.398 |
1.2±0.8 | 10.4±1.3 | 9.8±1.2 | 8.8±1.9 |
t=2.264
P=0.742 |
1.0±0.7 | |
| B | 40 | 16.9±4.2 | 14.6±3.0 |
t=2.298
P=0.408 |
1.3±1.1 | 10.5±2.0 | 9.7±1.6 | 8.8±1.5 |
t=2.745
P=0.465 |
1.0±0.5 | |
| C | 43 | 16.8±4.4 | 14.6±2.9 |
t=2.298
P=0.408 |
1.2±1.0 | 10.3±1.9 | 9.9±1.8 | 9.0±1.8 |
t=2.745
P=0.465 |
0.9±0.6 | |
| D | 40 | 16.7±4.0 | 14.5±4.0 |
t=2.205
P=0.592 |
1.2±0.9 | 10.4±1.7 | 9.9±1.5 | 8.7±2.0 |
t=2.435
P=0.565 |
1.2±1.0 | |
| 统计值
Statistic |
F=3.932
P=0.245 |
F=3.543
P=0.321 |
F=4.141
P=0.112 |
F=3.324
P=0.214 |
F=4.765
P=0.124 |
F=4.934
P=0.102 |
F=5.125
P=0.105 |
||||
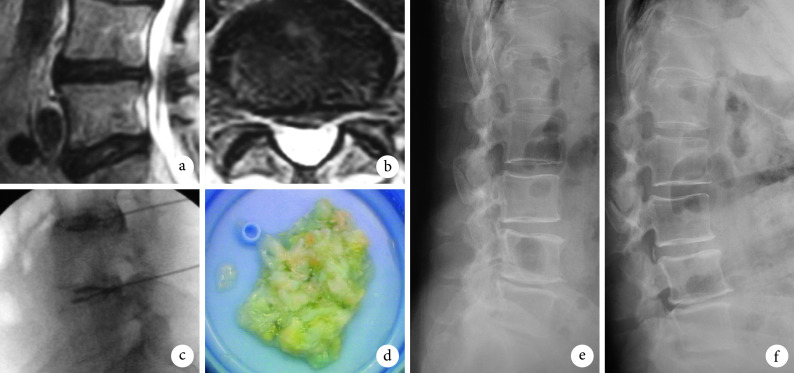
图 3.
A 42-year-old male patient with lumbar disc herniation at L4, 5 in group B
B 组患者,男,42 岁,L4、5 腰椎间盘突出症
a. 术前矢状面 MRI;b. 术前横截面 MRI;c. 术中椎间盘造影;d. 髓核摘除量;e. 术后即刻侧位 X 线片;f. 术后 1 年侧位 X 线片
a. Sagittal MRI before operation; b. Coronal MRI before operation; c. Lumbar discography; d. Volume of nucleus pulposus; e. Lateral X-ray film at immediate after operation; f. Lateral X-ray film at 1 year after operation
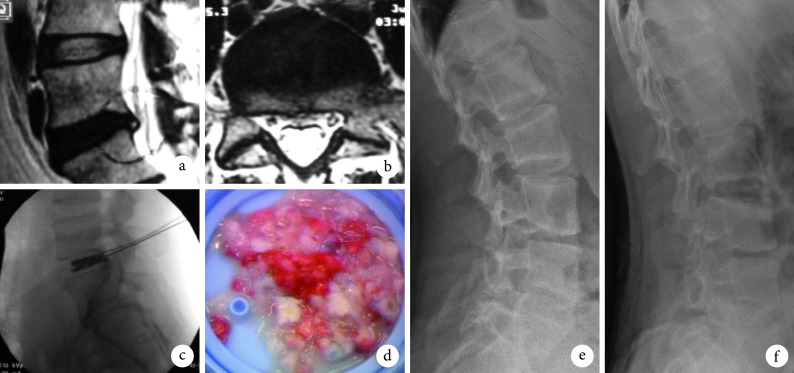
图 4.
A 33-year-old female patient with lumbar disc herniation at L5, S1 in group C
C 组患者,女,33 岁,L5、S1 腰椎间盘突出症
a. 术前矢状面 MRI;b. 术前横截面 MRI;c. 术中椎间盘造影;d. 髓核摘除量;e. 术后即刻侧位 X 线片;f. 术后 1 年侧位 X 线片
a. Sagittal MRI before operation; b. Coronal MRI before operation; c. Lumbar discography; d. Volume of nucleus pulposus; e. Lateral X-ray film at immediate after operation; f. Lateral X-ray film at 1 year after operation
3. 讨论
Yeung 技术的适应证主要包括:包容型椎间盘突出,与椎间盘内髓核有牵连的脱出型、极外侧型突出,椎间盘源性疼痛等[2-3]。后外侧入路具有术中 X 线摄像频率相对较低,对椎管内结构骚扰小,对神经根、硬膜囊、椎间静脉丛损伤几率小等突出优点[2, 4]。并且,此入路在手术过程中不容易损伤髂骨[5]。但是,后外侧入路亦具有一定局限性[6]。通过后外侧入路进入椎管内操作相对较困难,对于髂嵴位置较高的 L5、S1 病变患者尤甚。同时,当患者存在横突较宽、骨赘形成压迫神经根、椎管狭窄、椎间孔小、椎间盘游离、巨大椎间盘脱出(超过椎管 50%)、中央型椎间盘突出、钙化椎间盘等情况时,采用后外侧入路手术难度相对较大[7]。满意解决以上问题显得较为棘手。
TESSYS 技术在 2002 年首先被报道并开展应用[8]。此方法便于摘除脱出和游离的髓核及处理椎间孔狭窄[9],并且对于巨大型椎间盘突出的治疗效果良好[10],目前在我国开展较为广泛。但由于此方法设计之初是针对欧洲人种的腰椎间盘突出症进行治疗[11],对于体型相对较小的亚洲人种,其各项技术参数值显得较大[12]。所以,对于穿刺旁开距离、进针角度及工作通道靶点等立体参数,需要进一步研究设计及改进。本研究中发现此项技术的学习曲线较长,在遇到关节突明显增生、骨赘形成、神经根管骨性狭窄等情况时,手术操作往往较为困难[13]。在本研究中,对 TESSYS 技术入路与 Yeung 技术入路的髓核摘除量进行比较,发现无统计学意义;对术后症状的缓解及神经功能的恢复等方面也无统计学意义。说明两种入路方式尽管不相同,但两者的手术基本理念相同,目标均为摘除责任髓核,最终都可达到缓解患者临床症状的要求。
ITEA 技术是我国在引入 TESSYS 技术的同时,根据手术器械原理及亚洲人种的体型和解剖学特点所进行的技术改良。经过我国脊柱外科医师反复的实践摸索,逐渐技术成型。TESSYS 技术要求侧方开口距离中线长度为:L3、4 旁开 8~10 cm,L4、5 旁开 11~14 cm,L5、S1 旁开 12~16 cm[14]。ITEA 技术入路与 TESSYS 技术入路不同:首先,其侧方开口距离中线长度缩短;其次,ITEA 术前穿刺定位的头倾角和外展角更大;并且,在穿刺过程中要求术中正位片定位穿刺针顶点于棘突连线,侧位片定位穿刺针顶点于下位椎体后上缘。与 TESSYS 技术入路进行比较,ITEA 技术除具有 TESSYS 技术的优点外,手术中发现其操作空间更大,对于神经根管处的减压操作更为方便,对于神经根腹侧及背侧的髓核摘除更彻底;并且,此入路的操作可以探查至椎管内病变结构,在处理游离钙化的髓核以及骨赘时视野更好。ITEA 技术手术理念与 TESSYS 技术、Yeung 技术相同,但 ITEA 技术更侧重于全面减压,尤其是解决神经根管处的压迫。正是由于此理念的支持,使 ITEA 技术在手术操作中具有更深和更宽的通道活动范围;去除突出、游离、钙化的髓核更为彻底。
与以上 3 种方法比较,椎板间入路的手术操作相对简便[15]。在手术过程中,此种入路为垂直于患者腰背部建立椎间孔镜通道[16],其定位及建立工作通道过程中不必考虑髂嵴的影响[17];同时,X 线透射次数较少,因此建立工作通道时间相对缩短[18]。椎板间入路较多适用于 L5、S1 单纯椎间盘突出,其手术入路与椎间盘镜相似,需要术中精准定位及穿刺,使置入的通道可以直接摘除责任髓核。但是,由于椎板间隙较小,造成椎间孔镜通道置入后,其旋转位移的操作空间相对狭窄,适用于中央型椎间盘突出患者。对于进入椎管内游离较远的髓核、神经根管压迫及狭窄等情况操作较困难[19]。本研究课题组认为椎板间入路仅适合中央型椎间盘突出及髂嵴较高的患者;并且,在操作过程中由于工作通道活动范围较小,对于椎间盘内部的对侧退变髓核摘除较困难。手术过程中发现,此入路对于神经根管压迫及狭窄的满意减压亦是捉襟见肘。本研究中,通过进行组间比较发现,椎板间入路组髓核摘除量显著少于其余 3 组,差异有统计学意义。说明操作空间对于退变、游离、钙化髓核的完全摘除及椎管、神经根管的彻底减压有重要意义。在操作过程中,必须反复检查椎管及神经根管内是否已完全摘除退变、游离、钙化的髓核组织[20]。反复探查椎间孔镜的边缘视野,及时发现遗漏的游离髓核[21]。但是严禁反复牵拉神经根进行探查及操作,防止其刺激神经根,导致手术效果不理想[22]。
本研究结果表明采用 ITEA 技术探查范围广,髓核摘除量大于 Yeung 技术、TESSYS 技术与椎板间入路,差异有统计学意义。但在对术后疗效及随访神经功能恢复、椎间高度丢失、曲度改变等情况进行量化比较时,结果无明显统计学意义。说明不同手术入路方案的术中髓核摘除量与术后临床疗效之间无明显关联。
综上述,脊柱科医师在手术前需依据患者的腰椎间盘突出症状、查体、影像学所示病变部位等病情制定手术方案。应科学选择手术入路方式,术中完整摘除退变、脱出、游离、钙化的髓核组织,并且充分减压椎管及神经根管,松解神经根;但严禁反复牵拉神经根进行探查,满意减压才是手术的目的。同时亦需要不断更新手术理念、改进手术技巧,以提高手术安全性并增加治疗效果。我们认为接受椎间孔镜手术理念并熟练掌握此项技术后,融会贯通,四种入路方式均可以达到满意的临床疗效。但由于远外侧或水平入路甚至前侧入路开展极少,样本量极小,不足以将其纳入本研究;若国内外学者开展以上入路的样本例数较多,可以共同合作,以补充本研究的不足。
References
- 1.白一冰, 徐岭, 隰建成, 等 椎间孔镜联合椎间盘造影诊治腰椎间盘突出症. 中华医学杂志. 2012;92(47):3350–3353. [PubMed] [Google Scholar]
- 2.Xin G, Shi-Sheng H, Hai-Long Z Morphometric analysis of the YESS and TESSYS techniques of percutaneous transforaminal endoscopic lumbar discectomy. Clin Anat. 2013;26(6):728–734. doi: 10.1002/ca.22286. [DOI] [PubMed] [Google Scholar]
- 3.李振宙, 吴闻文, 侯树勋, 等 经皮侧后路腰椎间孔成形手术器械的设计及临床应用. 中华骨科杂志. 2011;31(10):1026–1032. [Google Scholar]
- 4.白一冰, 李嵩鹏, 简伟, 等 椎间孔镜下侧隐窝减压治疗腰椎管狭窄的疗效分析. 中国疼痛医学杂志. 2014;20(12):919–921. [Google Scholar]
- 5.Hirano Y, Mizuno J, Takeda M, et al Percutaneous endoscopic lumbar discectomy-early clinical experience. Neurol Med Chir (Tokyo) 2012;52(9):625–630. doi: 10.2176/nmc.52.625. [DOI] [PubMed] [Google Scholar]
- 6.Choi G, Lee SH, Lokhande P, et al Percutaneous endoscopic approach for highly migrated intracanal disc herniations by foraminoplastic technique using rigid working channel endoscope. Spine (Phila Pa 1976) 2008;33(15):E508–E515. doi: 10.1097/BRS.0b013e31817bfa1a. [DOI] [PubMed] [Google Scholar]
- 7.Ahn Y, Kim CH, Lee JH, et al Radiation exposure to the surgeon during percutaneous endoscopic lumbar discectomy: a prospective study. Spine (Phila Pa 1976) 2013;38(7):617–625. doi: 10.1097/BRS.0b013e318275ca58. [DOI] [PubMed] [Google Scholar]
- 8.Kapetanakis S, Charitoudis G, Thomaidis T, et al Health-related quality of life after transforaminal percutaneous endoscopic discectomy: An analysis according to the level of operation. J Craniovertebr Junction Spine. 2017;8(1):44–49. doi: 10.4103/0974-8237.199872. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Choi G, Kim JS, Lokhande P, et al Percutaneous endoscopic lumbar discectomy by transiliac approach: a case report. Spine (Phila Pa 1976) 2009;34(12):E443–E446. doi: 10.1097/BRS.0b013e31817c4f39. [DOI] [PubMed] [Google Scholar]
- 10.Choi G, Prada N, Modi HN, et al Percutaneous endoscopic lumbar herniectomy for high-grade down-migrated L4-L5 disc through an L5-S1 interlaminar approach: a technical note . Minim Invasive Neurosurg. 2010;53(3):147–152. doi: 10.1055/s-0030-1254145. [DOI] [PubMed] [Google Scholar]
- 11.Gupta RS, Wu XT, Hong X, et al Technique of percutaneous transforaminal endoscopic discectomy for the treatment of lumbar disc herniation. Open J Orthop. 2015;(5):208–216. [Google Scholar]
- 12.Ying J, Huang K, Zhu M, et al The effect and feasibility study of transforaminal percutaneous endoscopic lumbar discectomy via superior border of inferior pedicle approach for down-migrated intracanal disc herniations. Medicine (Baltimore) 2016;95(8):e2899. doi: 10.1097/MD.0000000000002899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Mahesha K Percutaneous endoscopic lumbar discectomy: Results of first 100 cases. Indian J Orthop. 2017;51(1):36–42. doi: 10.4103/0019-5413.197520. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kafadar A, Kahraman S, Akbörü M Percutaneous endoscopic transforaminal lumbar discectomy: a critical appraisal. Minim Invasive Neurosurg. 2006;49(2):74–79. doi: 10.1055/s-2006-932184. [DOI] [PubMed] [Google Scholar]
- 15.Choi G, Lee SH, Raiturker PP, et al Percutaneous endoscopic interlaminar discectomy for intracanalicular disc herniations at L5-S1 using a rigid working channel endoscope. Neurosurgery. 2006;58(1 Suppl):O59–O68. doi: 10.1227/01.neu.0000192713.95921.4a. [DOI] [PubMed] [Google Scholar]
- 16.Choi I, Ahn JO, So WS, et al Exiting root injury in transforaminal endoscopic discectomy: Preoperative image considerations for safety. Eur Spine J. 2013;22(11):2481–2487. doi: 10.1007/s00586-013-2849-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ahn Y Percutaneous endoscopic decompression for lumbar spinal stenosis. Expert Rev Med Devices. 2014;11(6):605–616. doi: 10.1586/17434440.2014.940314. [DOI] [PubMed] [Google Scholar]
- 18.Ahn Y, Lee SH, Lee JH, et al Transforaminal percutaneous endoscopic lumbar discectomy for upper lumbar disc herniation: clinical outcome, prognostic factors, and technical consideration. Acta Neurochir (Wien) 2009;151(3):199–206. doi: 10.1007/s00701-009-0204-x. [DOI] [PubMed] [Google Scholar]
- 19.Kim JS, Choi G, Lee SH Percutaneous endoscopic lumbar discectomy via contralateral approach: a technical case report. Spine (Phila Pa 1976) 2011;36(17):E1173–1178. doi: 10.1097/BRS.0b013e3182264458. [DOI] [PubMed] [Google Scholar]
- 20.Ditsworth DA Endoscopic transforaminal lumbar discectomy and reconfiguration: a postero-lateral approach into the spinal canal. Surg Neurol. 1998;49(6):588–598. doi: 10.1016/s0090-3019(98)00004-4. [DOI] [PubMed] [Google Scholar]
- 21.Cho JY, Lee SH, Lee HY Prevention of development of postoperative dysesthesia in transforaminal percutaneous endoscopic lumbar discectomy for intracanalicular lumbar disc herniation: floating retraction technique. Minim Invasive Neurosurg. 2011;54(5-6):214–218. doi: 10.1055/s-0031-1287774. [DOI] [PubMed] [Google Scholar]
- 22.Yeom KS, Choi YS Full endoscopic contralateral transforaminal discectomy for distally migrated lumbar disc herniation. J Orthop Sci. 2011;16(3):263–269. doi: 10.1007/s00776-011-0048-0. [DOI] [PubMed] [Google Scholar]