Abstract
Die Sarkopenie beschreibt einen generalisierten Verlust von Muskelkraft, -masse und -funktion. Sie geht mit reduzierter Lebensqualität und erhöhter Mortalität einher. Zur Identifizierung gefährdeter Patienten in der Primärversorgung dient der Screeningfragebogen für Sarkopenie (SARC-F), welcher fünf Funktionsbereiche des alltäglichen Lebens erfasst. Im Fall einer relevanten Einschränkung sollte die Messung der Handkraft mithilfe eines Dynamometers und/oder die Beinkraft mithilfe des Chair-Rising-Test erfolgen. Bei pathologischen Ergebnissen sollte der relative Skelettmuskelindex z. B. per Dual-Röntgen-Absorptiometrie bestimmt werden. Unterschreitet dieser den geschlechtsspezifischen Grenzwert, ist die Diagnose einer Sarkopenie zu stellen. Bei normwertiger Muskelmasse liegt eine Präsarkopenie vor. In beiden Fällen sollten die Ursachen abgeklärt und eine Therapie begonnen werden. Eine Verlaufsuntersuchung wird zur Differenzierung zwischen akuter und chronischer Sarkopenie und zur Beurteilung der Krankheitsprogression empfohlen.
Schlüsselwörter: Muskelkraft, Skelettmuskel, Sturz, Screening, Immobilität
Abstract
Sarcopenia describes a generalized loss of muscle power, mass and function. It is marked by an impaired quality of life and an increased mortality rate. The SARC‑F questionnaire was developed as a screening tool to identify patients at risk of impairment in primary care. It addresses five functional areas of physical activity in daily life. In case of a relevant impairment this is to be followed by measurement of hand grip strength using a dynamometer and/or of leg muscle strength by the chair rising test. Patients with pathological results should undergo a measurement of the skeletal muscle index, e.g. by Dual-energy X‑ray Absorptiometry. If this lies below the gender-specific threshold, the diagnostic criteria for sarcopenia are met. Cases with normal lean muscle mass are coined as probable sarcopenia. In both cases, causes must be clarified and treatment should be initiated. To differentiate between acute and chronic sarcopenia it is necessary to assess disease progress after a certain period of time.
Keywords: Muscle strength, Skeletal muscle, Falls, Screening, Immobility
Lernziele
Nach der Lektüre dieses Beitrags
können Sie physiologische von pathologischen und akute von chronischen Veränderungen der Skelettmuskulatur unterscheiden.
können Sie die Prävalenz der Sarkopenie in Deutschland einschätzen.
können Sie die Diagnose einer Sarkopenie bzw. einer Präsarkopenie analog des Algorithmus der European Working Group on Sarcopenia in Older People, 2. Version der konsentierten Definition (EWGSOP2), stellen.
können Sie den jeweiligen Stellenwert der Screening- und Diagnosemöglichkeiten beurteilen.
können Sie evidenzbasierte Therapieoptionen der Sarkopenie benennen.
Einleitung
Der Begriff Sarkopenie, zusammengesetzt aus den griechischen Wörtern „sarx“ (Fleisch) und „penia“ (Mangel), wurde erstmals 1989 von Rosenberg eingeführt und beschrieb zunächst ausschließlich einen Mangel an Muskelmasse [1]. Inzwischen steht gemäß der revidierten europäischen Konsensusdefinition aus dem Jahr 2018 (EWGSOP2) die Einschränkung der Muskelkraft als Hauptmerkmal im Vordergrund. Durch den Verlust des stabilisierenden Einflusses von Muskelkraft auf das statische und dynamische Gleichgewicht [2] ist das Sturzrisiko
Sturzrisiko
um das 3,2-Fache erhöht [3]. Sturzfolgen schränken die Mobilität und Selbstständigkeit ein [4], führen zu vermehrten Krankenhauseinweisungen [5] und reduzieren sowohl die Lebensqualität
Lebensqualität
als auch die Lebenserwartung
Lebenserwartung
. So ist die Mortalität um den Faktor 3,6 erhöht [6]. Sarkopenie ist auch mit einer Zunahme des viszeralen Fettanteils assoziiert. Dies begünstigt chronisch proinflammatorische Prozesse, die das kardiovaskuläre Risiko erhöhen sowie die Entstehung von Diabetes mellitus, Demenz, M. Parkinson und Depression fördern [7].
Merke
Bei Sarkopeniepatienten sind das Sturzrisiko um den Faktor 3,2 und die Mortalität um den Faktor 3,6 erhöht.
Fallbeispiel.
Frau H. (79 Jahre alt) ging bis vor einem Jahr täglich mindestens eine Stunde spazieren. Aus Angst vor einer Infektion mit dem „severe acute respiratory syndrome coronavirus type 2“ (SARS-CoV-2) hat sie nun das Haus seit mehreren Monaten nicht mehr verlassen. Sie erhält Essen auf Rädern, jedoch hat der Appetit sehr nachgelassen. Insgesamt hat sie im letzten Jahr ca. 6 kg abgenommen. Vor 4 Monaten kam es durch kurze Unachtsamkeit beim Treppensteigen zu einem Stolpersturz. Zwar blieben Verletzungen aus, doch fühlt sich Frau H. nun deutlich unsicherer beim Gehen. Aus Angst vor einem erneuten Sturz meidet sie das Treppensteigen gänzlich und selbst das Aufstehen bereitet ihr inzwischen aufgrund zunehmender Lumbalgien Schwierigkeiten. Sie sucht ihre Hausärztin auf, die eine Röntgenuntersuchung der LWS veranlasst, in der sich mehrere Sinterungsfrakturen zeigen. Mithilfe einer anschließenden Knochendichtemessung („dual energy x‑ray absorptiometry“, DXA) wird auch der relative Skelettmuskelindex (SMI) bestimmt; er beträgt 5,1 kg/m2. Frau H. fragt die Hausärztin um Rat, wie sie nun wieder auf die Beine kommen könne.
Definition
Sarkopenie bezeichnet ein Syndrom, das durch einen progressiven und generalisierten Verlust von Muskelmasse und -kraft charakterisiert und mit negativen Folgen einschließlich Stürzen, Funktionseinschränkungen und Gebrechlichkeit assoziiert ist [8]. Im Jahr 2016 fand die Sarkopenie als eigenständige Entität mit entsprechender Kodierung (M62.84) erstmals Eingang in die International Statistical Classification of Diseases and Related Health Problems, 10. Auflage (ICD-10), und wurde 2018 auch in Deutschland mit der Chiffre M62.50 ins ICD-10‑GM integriert. Von der Sarkopenie abzugrenzen ist die Kachexie
Kachexie
, die einen kombinierten Verlust von Fett- und Muskelmasse auf dem Boden einer konsumierenden Erkrankung beschreibt [9].
Pathophysiologie
Muskelveränderungen im Alter
Wie alle Organe unterliegt die Muskulatur physiologischen Veränderungen im Alter, die vorwiegend durch eine Atrophie
Atrophie
gekennzeichnet sind. Eine Reduktion der Muskelproteinbiosynthese
Reduktion der Muskelproteinbiosynthese
führt zum Verlust von etwa 40 % der Muskelfasern zwischen der 3. und der 7. Lebensdekade. Dies betrifft v. a. die schnell kontrahierenden Typ-II-Fasern [10], sodass die Schnellkraft doppelt so stark abnimmt wie die Maximalkraft [11].
Die Muskelfunktion verringert sich deutlich schneller als die Muskelmasse [12]. Der durchschnittliche jährliche Verlust an Muskelkraft beträgt bis 4 %, wohingegen sich die Muskelmasse um weniger als 1 % reduziert [13]. Auch die Zahl der Satellitenzellen, die für die Muskelregeneration zuständig sind, verringert sich. So zeigte sich in „Bed Rest studies“, dass sich die Muskelproteinbiosynthese durch Immobilisation von gesunden 80-Jährigen innerhalb von 10 Tagen um 30 % reduziert, was zu einem Verlust von 10 % der Muskelmasse und 16 % der Muskelkraft führt [14].
Der reduzierte Muskelumsatz hat vielfältige Ursachen [15]. Eine wesentliche Rollte spielen die Degeneration der neuromuskulären Endplatte sowie der Verlust motorischer Einheiten [16], aber auch eine reduzierte Aktivität der somatotropen Achse, inflammatorische Prozesse, Mangelernährung und eine verminderte körperliche Aktivität tragen entscheidend dazu bei [17]. Nur etwa 14 % der 70- bis 79-Jährigen bewegen sich gemäß den Empfehlungen 2,5 h/Woche mit moderater Intensität [18].
Merke
Die Muskelkraft lässt im Alter schneller nach als die Muskelmasse.
Mangelernährung
Die Muskulatur ist der größte Aminosäurespeicher
Aminosäurespeicher
. Bei katabolen Vorgängen, beispielsweise im Rahmen von Mangelernährung oder akuten Entzündungen, wird dieser zuerst aufgebraucht, während neurologische Strukturen geschützt werden [19]. Zugleich benötigen Patienten über 70 Jahre eine höhere Proteinzufuhr, um die gleiche myofibrilläre Proteinsyntheserate wie jüngere Patienten zu erreichen [20]. Studien zeigten, dass der tägliche Proteinbedarf zur Stimulierung der myofibrillären Proteinsynthese bei Männern unter 37 Jahren etwa 0,24 g/kgKG beträgt, während Männer über 65 Jahre ca. 0,4 g/kgKG benötigen [21]. Ein wesentlicher Risikofaktor für Sarkopenie ist eine unzureichende Zufuhr von Proteinen, insbesondere ein Mangel der essenziellen Aminosäure Leucin
Leucin
[22].
Merke
Ältere Menschen haben einen höheren Proteinbedarf.
Eine unzureichende Proteinzufuhr ist eine Hauptursache der Sarkopenie.
Weitere Risikofaktoren
Auch endokrinologische Veränderungen
endokrinologische Veränderungen
im Alter können die Entstehung einer Sarkopenie bedingen. Eine Reduktion der anabolen Hormone (im Rahmen eines männlichen Hypogonadismus) ebenso wie eine Resistenz dagegen (Insulin- oder Wachstumshormonresistenz) bewirken eine Beeinträchtigung der Muskelfunktion [23, 24]. Zwillingsstudien zeigen, dass etwa 30 % der Varianz in Muskelmasse und -kraft durch genetische Einflüsse
genetische Einflüsse
bedingt sein können [7]. Darüber hinaus gibt es Hinweise, dass sich ein hohes Geburtsgewicht und eine längere Stilldauer positiv auf Muskelmasse und -kraft auswirken [25]. Auch Adipositas
Adipositas
stellt einen Risikofaktor für Sarkopenie dar, indem sie sowohl zur Verfettung des Skelettmuskels als auch zu einer chronischen Inflammation beiträgt und so die Muskelfunktion beeinträchtigt [15].
Epidemiologie
Angesichts einer internationalen Koexistenz verschiedener Sarkopeniedefinitionen und unterschiedlicher Methoden der Erhebung variieren die Angaben zur Prävalenz von Sarkopenie. Eine epidemiologische Untersuchung in Deutschland in der Region Augsburg ergab unter Anwendung der EWGSOP-1-Kriterien bei 927 Teilnehmern über 65 Jahren eine Prävalenz von 5,7 %, wobei Frauen mit ca. 7,5 % im Vergleich zu Männern mit ca. 4 % häufiger betroffen waren. Bei über 80-Jährigen betrug die Prävalenz 17 % für Frauen und 9 % für Männer [26].
Diagnostik
Screening
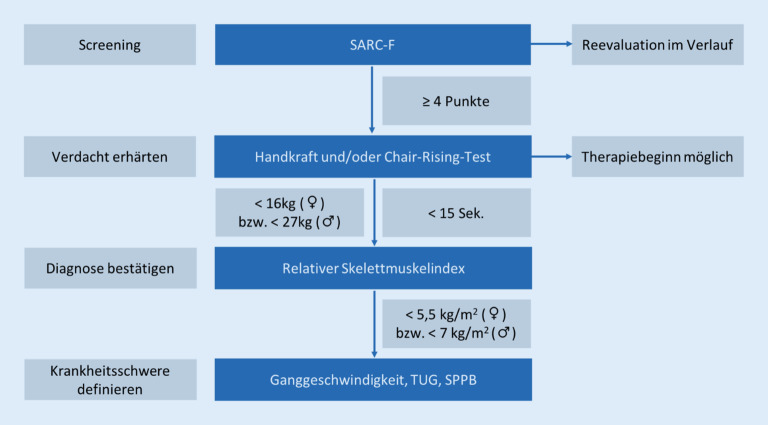
Die Task Force der International Conference on Sarcopenia and Frailty Research (ICSFR) empfiehlt, alle über 65-Jährigen jährlich bzw. nach einschneidenden gesundheitlichen Ereignissen wie beispielsweise stationär behandlungsbedürftigen Stürzen auf Sarkopenie zu screenen [27]. Um Patienten mit Funktionseinschränkungen in der Primärversorgung zu identifizieren, wurde der Screeningfragebogen für Sarkopenie (SARC‑F
SARC‑F
) konzipiert und ins Deutsche übersetzt (Tab. 1; [28]). Er setzt sich aus 5 Fragen zusammen, die sich auf Schwierigkeiten in der Bewältigung alltäglicher Aufgaben
alltäglicher Aufgaben
beziehen. Der Fragebogen kann vom Patienten selbst ausgefüllt werden. Wenn 4 oder mehr Punkte erreicht werden, sollte eine Diagnostik angeschlossen werden, andernfalls eine Reevaluation im Intervall erfolgen.
| Bereich | Frage | Antwort (Punktewert) |
|---|---|---|
| Kraft | Wie schwer fällt es Ihnen, ca. 5 kg zu heben und zu tragen? | Nicht schwer (0) |
| Etwas schwer (1) | ||
| Sehr schwer/nicht möglich (2) | ||
| Gehen | Wie schwer fällt es Ihnen, auf Zimmerebene umherzugehen? | Nicht schwer (0) |
| Etwas schwer (1) | ||
| Sehr schwer, benötige Hilfsmittel oder nicht möglich (2) | ||
| Aufstehen | Wie schwer fällt es Ihnen, vom Stuhl oder vom Bett aufzustehen? | Nicht schwer (0) |
| Etwas schwer (1) | ||
| Sehr schwer oder nicht möglich ohne Hilfe (2) | ||
| Treppensteigen | Wie schwer fällt es Ihnen, eine Treppe mit 10 Stufen zu steigen? | Nicht schwer (0) |
| Etwas schwer (1) | ||
| Sehr schwer oder nicht möglich (2) | ||
| Stürze | Wie oft sind Sie im letzten Jahr gestürzt? | Kein Sturz (0) |
| 1–3 Stürze (1) | ||
| 4 oder mehr Stürze (2) |
Diagnosealgorithmus
Als Eingangsuntersuchung dient die Messung der Handkraft
Handkraft
mithilfe eines Dynamometers und/oder der Beinmuskelkraft
Beinmuskelkraft
mithilfe des „chair rise test“ [8]. Unterschreitet ein Testergebnis den Grenzwert, kann bereits die Diagnose einer Präsarkopenie
Präsarkopenie
(„probable sarcopenia“) gestellt werden (Abb. 1). Analog zum Prädiabetes wird der Präsarkopenie ein Krankheitswert beigemessen, der eine Ursachenabklärung und einen Therapiebeginn rechtfertigt. Im zweiten Schritt erfolgt die Messung der appendikulären Magermasse
appendikulären Magermasse
(ALM) mithilfe der DXA oder der bioelektrischen Impedanzanalyse (BIA). Wenn sowohl die Muskelkraft als auch die Muskelmasse die definierten Grenzwerte unterschreiten, ist die Diagnose Sarkopenie bestätigt.
Merke
Eine Therapieeinleitung und Ursachenabklärung sind bereits bei Vorliegen einer Präsarkopenie indiziert.
Muskelkraft
Zur Bestimmung der isometrischen Handkraft dient ein Dynamometer
Dynamometer
. Dabei werden 3 Messungen von jeder Seite vorgenommen. Beträgt der größte gemessene Wert unter 16 kg bei Frauen bzw. 27 kg bei Männern, gilt dies als pathologisch. Die Beinmuskelkraft wird mithilfe des Chair rise test
Chair rise test
bestimmt. Dabei wird die Zeit gemessen, die ein Patient benötigt, um 5‑mal aus einer sitzenden Position aufzustehen, ohne seine Arme zu benutzen. Als Grenzwert für eine relevante Beeinträchtigung gelten 15 s für beide Geschlechter.
Muskelmasse
Die DXA und die BIA ermöglichen eine Messung der ALM [29]. Um diese ins Verhältnis zu den Körpermaßen zu setzen, wird der SMI
SMI
bestimmt, indem die ALM durch die Körpergröße zum Quadrat dividiert wird. Als Untergrenze wurde ein SMI von 7,0 kg/m2 für Männer bzw. 5,5 kg/m2 für Frauen definiert. Alternativ kann die ALM ins Verhältnis zum BMI gesetzt werden [30].
Fortführung des Fallbeispiels.
Bei Frau H. fällt der Skelettmuskelindex mit einem Wert von 5,1 kg/m2 pathologisch aus. Die Tatsache, dass ihr das Aufstehen aus dem Sitzen schwerfällt, deutet zudem auf eine verminderte Beinkraft hin. Ob eine Sarkopenie vorliegt, lässt sich jedoch nur nach standardisierter Messung der Muskelkraft mithilfe des Chair rise test und/oder des Handdynamometers feststellen.
Bestimmung des Schweregrads
Zur Einordnung des Schweregrads dienen weitere Untersuchungen, die die Muskelfunktion, in erster Linie der unteren Extremitäten, messen. Dazu gehören
die Prüfung der Ganggeschwindigkeit,
der „timed up-and-go test“ (TUG) sowie
die Short Physical Performance Battery (SPPB).
Die Ganggeschwindigkeit wird über eine Distanz von 4 m gemessen, wobei die Verwendung eines Stocks oder einer anderen Gehhilfe erlaubt ist. Eine Geschwindigkeit ≤ 0,8 m/s gilt als Indikator für eine schwere Sarkopenie. Der TUG misst die Zeit, die benötigt wird, um aus einer sitzenden Stuhlposition aufzustehen, zu einer 3 m entfernten Linie zu gehen, sich um 180 Grad zu drehen und sich wieder hinzusetzen. Werden ≥20 s benötigt, deutet dies ebenfalls auf eine schwere Sarkopenie hin. Der SPPB umfasst sowohl die Ganggeschwindigkeit als auch den „chair stand test“ in Kombination mit einem Gleichgewichtstest. Zur Berechnung des SPPB-Scores werden 0 bis 4 Punkte/Aufgabe vergeben. Der Grenzwert für eine schwere Beeinträchtigung beträgt 8 Punkte.
Die Schwere der Sarkopenie hat zunächst weder therapeutische noch diagnostische Konsequenzen. Sie dient vielmehr einer differenzierten Erfassung des Funktionsstatus
Funktionsstatus
, um Therapieoptionen und -bedürfnisse künftig individuell anpassen zu können.
Akute vs. chronische Sarkopenie
Akute Erkrankungen können einen kurzfristigen Therapiebedarf nötig machen und sind von chronischen Einflussfaktoren zu differenzieren, die längerfristige Konzepte erfordern. Zur Verlaufsbeurteilung
Verlaufsbeurteilung
ist eine Wiedervorstellung 3 bis 9 Monate nach der Diagnosestellung empfohlen. Liegen die Einschränkungen weiterhin vor oder sind gar progredient, ist von einer chronischen Sarkopenie auszugehen.
Prävention und Therapie
Körperliches Training
Eine Studie mit über 90-Jährigen zeigte, dass das muskuläre System bis in höchste Alter trainierbar ist, mit einem Zugewinn an Kraft und Funktionalität [31]. Dabei übersteigen die Effekte des körperlichen Trainings auf die Muskulatur deutlich die Effekte alleiniger Ernährungstherapien [32]. Um das Sturzrisiko effektiv zu reduzieren, ist eine Kombination mit einem Gleichgewichtstraining
Gleichgewichtstraining
notwendig [3]. Die Integration sozialer Aktivitäten
sozialer Aktivitäten
wiederum fördert die Compliance und führt zum besseren Trainingsergebnis [33]. Durch konsequentes Training kann mittelfristig Immobilität verhindert und Mortalität reduziert werden [17].
Merke
Krafttraining ist auch bei Hochbetagten noch effektiv.
Ernährung
Eine zusätzliche Ernährungstherapie ist wichtig, um die Trainingseffekte zu steigern [6]. Aufgrund einer verzögerten myofibrillären Proteinbiosynthese bedürfen geriatrische Patienten einer erhöhten Proteinzufuhr
Proteinzufuhr
[34]. Gemäß der Konsensusdefinition der EWGSOP2 ist eine Zufuhr von 1,2 g/kgKG nötig, um die Optimierung der Muskelgesundheit zu gewährleisten [20]. Jedoch sollte bei Patienten mit einer chronischen Nierensuffizienz ohne Dialysepflichtigkeit die Zufuhr von 0,8 g/kgKG nicht überschritten werden [35]. Insbesondere die Aminosäure Leucin zeigte eine positive Wirkung auf die Muskelproteinsynthese: Durch die Zufuhr von 3 g Leucin wird fast eine maximale Proteinsynthese ermöglicht [36].
Merke
Durch eine Supplementierung von essenziellen Aminosäuren, insbesondere Leucin, kann der Trainingseffekt gesteigert werden.
Fazit für die Praxis
Eine im Alter reduzierte myofibrilläre Proteinbiosynthese führt zu einem Verlust v. a. von Muskelkraft. Mangelernährung, endokrinologische Veränderungen und verminderte Aktivität tragen wesentlich zu pathologischen Funktionseinschränkungen bei.
Die Sarkopenie betrifft in Deutschland rund 6 % aller über 65-Jährigen.
Der Screeningfragebogen für Sarkopenie (SARC-F) stellt ein einfaches Screeninginstrument in der Primärversorgung dar.
Zur Sarkopeniediagnostik werden zuerst die Arm- und Beinmuskelkraft und, sofern diese pathologisch erniedrigt ist, der relative Skelettmuskelindex bestimmt.
Ursachenabklärung und Therapie sollten bereits bei Vorliegen einer beeinträchtigten Muskelkraft ohne Reduktion der Muskelmasse eingeleitet werden.
Krafttraining in Verbindung mit ausreichender Proteinzufuhr sind die Maßnahmen mit dem größten nachgewiesenen Nutzen in der Behandlung.
CME-Fragebogen
Welche durchschnittlichen Veränderungen der Skelettmuskulatur hat eine 10-tägige Bettruhe bei einem nichtvorerkrankten 80-Jährigen zur Folge?
Erhöhung des Fettanteils der Muskulatur um 25 %
Einbußen von 30 % der Beinmuskelmasse
Reduktion der Muskelproteinbiosynthese um 30 %
Reduktion der Muskelkraft um 5 %
Reduktion der Schnellkraft (7 %) bei gleichzeitiger Steigerung der Maximalkraft (3 %)
Wie hoch wird die Prävalenz der Sarkopenie in der deutschen Bevölkerung in der Altersgruppe der über 80-Jährigen gemäß einer Studie im Augsburger Raum eingeschätzt?
Circa 5 % der Frauen und ca. 3 % der Männer
Circa 9 % der Frauen und ca. 5 % der Männer
Circa 17 % der Frauen und ca. 9 % der Männer
Circa 34 % der Frauen und ca. 18 % der Männer
Circa 68 % der Frauen und ca. 36 % der Männer
Für welches Setting ist der Screeningfragebogen für Sarkopenie (SARC-F) konzipiert?
Zur Dokumentation für die Bayerische Landesärztekammer vor Durchführung einer Messung der appendikulären Muskelmasse mithilfe der „dual energy X‑ray absorptiometry“ (DXA)
Für die Krankenkasse zur Indikationsprüfung bei Beantragung von Gehhilfen
Für Patienten zur (Selbst‑)Einschätzung des individuellen Sarkopenierisikos
Für die statistische Erfassung der Sarkopenieprävalenz durch Hausärzte
Für klinisch tätige Geriater zur Evaluation einer Auf- oder Übernahmeindikation von Patienten in eine stationäre geriatrische Behandlung
Welche weiteren Kriterien werden neben Gehen, Aufstehen und Kraft im Screeningfragebogen für Sarkopenie (SARC-F) abgefragt?
Hilfsmittelbedarf und kardiovaskuläre Vorerkrankungen
Reaktionsvermögen und sportliche Aktivität
Stoffwechselerkrankungen und Ernährungsgewohnheiten
Tägliche Kalorienaufnahme und Ruhepuls
Treppensteigen und Stürze
Welche Messung ist als erster Schritt in der Sarkopeniediagnostik gemäß dem Algorithmus der European Working Group on Sarcopenia in Older People, 2. Version der konsentierten Definition (EWGSOP2), geeignet?
Messung des Bauchumfangs
Messung der „Chair-rising-test“-Zeit
Messung der Knochendichte
Messung der maximal erreichten Wattzahl im Belastungs-EKG
Messung des Mittoberschenkelumfangs
Ab wann gilt eine Sarkopenie als wahrscheinlich im Sinne einer Präsarkopenie?
Wenn die Handkraft weniger als 16 kg (Frauen) bzw. 27 kg (Männer) beträgt.
Wenn weniger als 5 Kniebeugen am Stück geleistet werden können.
Wenn mehr als 10 s im „chair rising test“ benötigt werden.
Wenn der Patient/die Patientin nicht mehr ohne Hilfsmittel mobil ist.
Wenn nicht mehr als 5 Treppenstufen am Stück gestiegen werden können.
Frau H. (86 Jahre alt) leidet unter M. Parkinson, mit ausgeprägter Gangunsicherheit. Bei einem Stolperzsturz im Bad zog sie sich eine Femurhalsfraktur zu, die operativ mit einer Duokopfprothese versorgt wurde. Die postoperative Mobilisierung gestaltet sich schwierig; Frau H. kann ohne Hilfe nicht aufstehen. Im Rahmen der postoperativen Knochendichtemessung wird auch der Skelettmuskelindex bestimmt, der 4,9 kg/m2 beträgt. Liegt bei Frau H. eine Sarkopenie vor?
Nein, weil die Femurfraktur und der M. Parkinson Ursache der Immobilität sind.
Ja, weil sie nicht selbstständig vom Stuhl aufstehen kann.
Vielleicht, die Frage lässt sich mit den gegebenen Informationen nicht beantworten.
Ja, weil die Muskelmasse pathologisch erniedrigt ist.
Nein, weil die Beeinträchtigungen altersgemäß sind.
Welche Untersuchung dient der Einordnung des Schweregrades bei gesicherter Sarkopenie?
Armvorhaltetest
„Pull test“
Unterberger-Tretversuch
Seiltänzergang
„Timed up-and-go test“
Wann handelt es sich um eine akute Sarkopenie?
Wenn die Ursache der eingeschränkten Beweglichkeit grundsätzlich reversibel ist.
Wenn die bestehende Muskelfunktionseinschränkung in einer Verlaufskontrolle nach 6 Monaten nicht mehr nachzuweisen ist.
Wenn der gemessene Skelettmuskelindex weniger als 20 % unterhalb des geschlechtsspezifischen Grenzwerts liegt.
Wenn eine konsumierende Erkrankung die Ursache der reduzierten Muskelmasse ist.
Wenn eine isolierte Muskelfunktionseinschränkung der oberen bzw. der unteren Extremitäten besteht.
Herr G. (82 Jahre alt) ist langjähriger Raucher und leidet unter einer chronisch obstruktiven Lungenerkrankung (COPD) Grad IV und Mangelernährung (Body-Mass-Index 19,5 kg/m2). Im Rahmen eines akutgeriatrischen Aufenthalts aufgrund einer infektionsassoziierten Exazerbation wurde nun eine Sarkopenie diagnostiziert. Welche Maßnahmen haben einen nachgewiesenen Nutzen zur Behandlung einer Sarkopenie bei Herrn G.?
Altersgerechtes Bodenturnen und mediterrane Kost
Ausdauertraining im aeroben Bereich und Testosteronsubstitution
Hochdosierte Vitamin-D-Einnahme (10.000 I.E. tägl.) und Nahrungsergänzung mit 2 g Lysin am Tag
Krafttraining und Proteinsupplementierung
Vibrationstraining und Atemtherapie
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
A. Schaupp: A. Finanzielle Interessen: A. Schaupp gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: angestellte Assistenzärztin für innere Medizin, Medizinische Klinik IV, LMU Klinikum München | Mitgliedschaft: Deutsche Gesellschaft für Innere Medizin. S. Martini: A. Finanzielle Interessen: S. Martini gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: angestellter Internist m. S. Nephrologie, Geriatrie, Medizinische Klinik IV, LMU, München. R. Schmidmaier: A. Finanzielle Interessen: Vortragshonorar: Nutricia. – B. Nichtfinanzielle Interessen: Stellvertretender Klinikdirektor, Medizinische Klinik und Poliklinik IV, LMU Klinikum | Mitgliedschaften: DGIM, DGG, DGE, GMA, Leitung Bayerisches Osteoporosezentrum, zertifiziertes DVO-Osteologiezentrum, AG Sarkopenie und Osteoporose der DGG (Koleitung), Münchener Akademie für Ärztliche Fortbildung (MAÄF; Vorstand), Förderverein für gesundes und erfolgreiches Altern (Vorstand), Leitlinienkommission Osteoporose des DVO. M. Drey: A. Finanzielle Interessen: Referentenhonorar: Nutricia. – B. Nichtfinanzielle Interessen: Internist, Geriater, Oberarzt, LMU Klinikum, München | Mitgliedschaften: AG Sarkopenie und Osteoporose der DGG (Vorsitzender), Leitlinienkommission Osteoporose.
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Rosenberg IH. Summary comments: epidemiological and methodological problems in determining nutritional status of older persons. Am J Clin Nutr. 1989;50:1231–1233. doi: 10.1093/ajcn/50.5.1231. [DOI] [Google Scholar]
- 2.Wu G. The relation between age-related changes in neuromusculoskeletal system and dynamic postural responses to balance disturbance. J Gerontol A Biol Sci Med Sci. 1998 doi: 10.1093/gerona/53A.4.M320. [DOI] [PubMed] [Google Scholar]
- 3.Landi F, Liperoti R, Russo A, et al. Sarcopenia as a risk factor for falls in elderly individuals: Results from the ilSIRENTE study. Clin Nutr. 2012 doi: 10.1016/j.clnu.2012.02.007. [DOI] [PubMed] [Google Scholar]
- 4.Steffl M, Bohannon RW, Sontakova L, et al. Relationship between sarcopenia and physical activity in older people: a systematic review and meta-analysis. Clin Interv Aging. 2017;12:835–845. doi: 10.2147/CIA.S132940. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Cawthon PM, Lui LY, Taylor BC, et al. Clinical definitions of sarcopenia and risk of hospitalization in community-dwelling older men: the osteoporotic fractures in men study. J Gerontol A Biol Sci Med Sci. 2017 doi: 10.1093/gerona/glw327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Beaudart C, Zaaria M, Pasleau F, et al. Health outcomes of sarcopenia: a systematic review and meta-analysis. PLoS ONE. 2017 doi: 10.1371/journal.pone.0169548. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Stangl M, Böcker W, Chubanov V, et al. Sarcopenia – Endocrinological and Neurological Aspects. Exp Clin Endocrinol Diabetes. 2019;6:8–22. doi: 10.1055/a-0672-1007. [DOI] [PubMed] [Google Scholar]
- 8.Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48:16–31. doi: 10.1093/ageing/afy169. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Argilés JM, Anker SD, Evans WJ, et al. Consensus on cachexia definitions. J Am Med Dir Assoc. 2010;11:229–230. doi: 10.1016/j.jamda.2010.02.004. [DOI] [PubMed] [Google Scholar]
- 10.Tanganelli F, Meinke P, Hofmeister F, et al. Type-2 muscle fiber atrophy is associated with sarcopenia in elderly men with hip fracture. Exp Gerontol. 2021;144:111171. doi: 10.1016/j.exger.2020.111171. [DOI] [PubMed] [Google Scholar]
- 11.Reid KF, Fielding RA. Skeletal muscle power: a critical determinant of physical functioning in older adults. Exerc Sport Sci Rev. 2012 doi: 10.1097/JES.0b013e31823b5f13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Shaw SC, Dennison EM, Cooper C. Epidemiology of sarcopenia: determinants throughout the lifecourse. Calcif Tissue Int. 2017 doi: 10.1007/s00223-017-0277-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Mitchell WK, Williams J, Atherton P, et al. Sarcopenia, dynapenia, and the impact of advancing age on human skeletal muscle size and strength; a quantitative review. Front Physiol. 2012 doi: 10.3389/fphys.2012.00260. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kortebein P, Ferrando A, Lombeida J, et al. Effect of 10 Days of Bed Rest on Skeletal Muscle in Healthy Older Adults. JAMA. 2007;297:1769. doi: 10.1001/jama.297.16.1772-b. [DOI] [PubMed] [Google Scholar]
- 15.Narici MV, Maffulli N. Sarcopenia: characteristics, mechanisms and functional significance. Br Med Bull. 2010;95:139–159. doi: 10.1093/bmb/ldq008. [DOI] [PubMed] [Google Scholar]
- 16.Clark DJ, Patten C, Reid KF, et al. Muscle performance and physical function are associated with voluntary rate of neuromuscular activation in older adults. J Gerontol A Biol Sci Med Sci. 2011 doi: 10.1093/gerona/glq153. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Montero-Fernández N, Serra-Rexach JA. Role of exercise on sarcopenia in the elderly. Eur J Phys Rehabil Med. 2013;49:131–143. [PubMed] [Google Scholar]
- 18.Kurth B‑M. Studie zur Gesundheit Erwachsener in Deutschland. Stress, Schlafstörungen, Depressionen und Burn-out: Wie belastet sind wir? Bundesgesundheitsblatt. 2012;55:980–990. doi: 10.1007/s00103-011-1504-5. [DOI] [Google Scholar]
- 19.Peters A. The selfish brain: Competition for energy resources. Am J Hum Biol. 2011;23:29–34. doi: 10.1002/ajhb.21106. [DOI] [PubMed] [Google Scholar]
- 20.Bauer J, Biolo G, Cederholm T, et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the prot-age study group. J Am Med Dir Assoc. 2013 doi: 10.1016/j.jamda.2013.05.021. [DOI] [PubMed] [Google Scholar]
- 21.Moore DR, Churchward-Venne TA, Witard O, et al. Protein ingestion to stimulate myofibrillar protein synthesis requires greater relative protein intakes in healthy older versus younger men. J Gerontol A Biol Sci Med Sci. 2015 doi: 10.1093/gerona/glu103. [DOI] [PubMed] [Google Scholar]
- 22.Cederholm T, Jensen GL, Correia MITD, et al. GLIM criteria for the diagnosis of malnutrition—a consensus report from the global clinical nutrition community. J Cachexia Sarcopenia Muscle. 2019;10:207–217. doi: 10.1002/jcsm.12383. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Vitale G, Cesari M, Mari D. Aging of the endocrine system and its potential impact on sarcopenia. Eur J Intern Med. 2016;35:10–15. doi: 10.1016/j.ejim.2016.07.017. [DOI] [PubMed] [Google Scholar]
- 24.Ferrari U, Schmidmaier R, Jung T, et al. IGF-I/IGFBP3/ALS deficiency in sarcopenia: low GHBP suggests GH resistance in a subgroup of geriatric patients. J Clin Endocrinol Metab. 2020;106:e1698–e1707. doi: 10.1210/clinem/dgaa972. [DOI] [PubMed] [Google Scholar]
- 25.Dodds RM, Roberts HC, Cooper C, Sayer AA. The epidemiology of Sarcopenia. J Clin Densitom. 2015 doi: 10.1016/j.jocd.2015.04.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Phillips A, Strobl R, Vogt S, et al. Sarcopenia is associated with disability status—results from the KORA-Age study. Osteoporos Int. 2017 doi: 10.1007/s00198-017-4027-y. [DOI] [PubMed] [Google Scholar]
- 27.Dent E, Morley JE, Cruz-Jentoft AJ, et al. International clinical practice guidelines for Sarcopenia (ICFSR): screening, diagnosis and management. J Nutr Health Aging. 2018;22:1148–1161. doi: 10.1007/s12603-018-1139-9. [DOI] [PubMed] [Google Scholar]
- 28.Drey M, Ferrari U, Schraml M, et al. German version of SARC-F: translation, adaption, and validation. J Am Med Dir Assoc. 2020 doi: 10.1016/j.jamda.2019.12.011. [DOI] [PubMed] [Google Scholar]
- 29.Sergi G, De Rui M, Veronese N, et al. Assessing appendicular skeletal muscle mass with bioelectrical impedance analysis in free-living Caucasian older adults. Clin Nutr. 2015 doi: 10.1016/j.clnu.2014.07.010. [DOI] [PubMed] [Google Scholar]
- 30.Studenski SA, Peters KW, Alley DE, et al. The FNIH sarcopenia project: rationale, study description, conference recommendations, and final estimates. J Gerontol A Biol Sci Med Sci. 2014 doi: 10.1093/gerona/glu010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Fiatarone MA. High-intensity strength training in nonagenarians. JAMA. 1990;263:3029. doi: 10.1001/jama.1990.03440220053029. [DOI] [PubMed] [Google Scholar]
- 32.Peterson MD, Sen A, Gordon PM. Influence of resistance exercise on lean body mass in aging adults. Med. Sci. Sports Exerc. 2011;43:249–258. doi: 10.1249/MSS.0b013e3181eb6265. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Corcoran MP, Nelson ME, Sacheck JM, et al. Recruitment of mobility limited older adults into a facility-led exercise-nutrition study: the effect of social involvement. Gerontologist. 2016 doi: 10.1093/geront/gnv018. [DOI] [PubMed] [Google Scholar]
- 34.Cardon-Thomas DK, Riviere T, Tieges Z, Greig CA. Dietary protein in older adults: adequate daily intake but potential for improved distribution. Nutrients. 2017 doi: 10.3390/nu9030184. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Alp Ikizler T, Cano NJ, Franch H, et al. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney Int. 2013;84:1096–1107. doi: 10.1038/ki.2013.147. [DOI] [PubMed] [Google Scholar]
- 36.Wilkinson DJ, Bukhari SSI, Phillips BE, et al. Effects of leucine-enriched essential amino acid and whey protein bolus dosing upon skeletal muscle protein synthesis at rest and after exercise in older women. Clin Nutr. 2018;37:2011–2021. doi: 10.1016/j.clnu.2017.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]