Introduzione
Neisseria meningitidis (N. meningitidis) è un batterio Gram-negativo aerobio, principale causa di malattia batterica invasiva nel mondo [1]. L’uomo rappresenta l’unico ospite naturale del microrganismo.
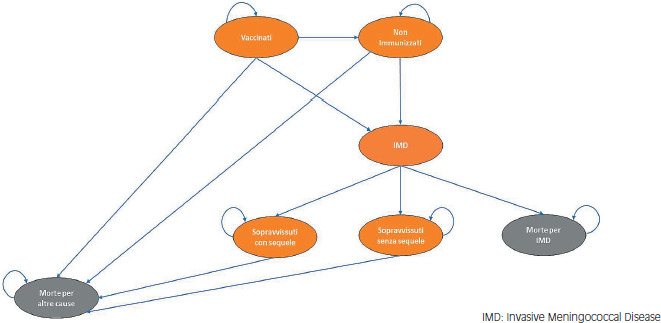
Essendo commensali, i meningococchi non inducono necessariamente la malattia: circa il 10% della popolazione europea è colonizzata in modo asintomatico da N. meningitidis e la maggior parte dei sierogruppi isolati nei portatori sono classificati come non patogeni e non invasivi [2]. La prevalenza di portatori sani varia in rapporto a diversi fattori, quali l’area geografica, l’età dei soggetti, le condizioni socio-economiche e la densità di popolazione [2]. La percentuale di portatori sani può oscillare entro limiti ampi, dall’1-2% fino al 15-20%, limite massimo che può essere raggiunto in comunità chiuse, come ad esempio nei college e nelle caserme [3,4]. Solo occasionalmente e, in particolari condizioni di fragilità dell’ospite, il microrganismo è in grado di penetrare nella mucosa, entrare nel flusso sanguigno e causare grave malattia invasiva. Studi riportano che il maggior rischio è associato al primo episodio di infezione [5-7].
N. meningitidis è circondata da una capsula polisaccaridica e, sulla base delle differenze antigeniche dei polisaccaridi capsulari, il microrganismo è suddiviso in 13 sierogruppi; tra questi, più del 99% dei casi di malattia è provocato da ceppi appartenenti ai sierogruppi A, B, C, W e Y [3,6], la cui distribuzione varia tra le diverse aree geografiche [8-9]. Il sierogruppo X è responsabile di casi di malattia invasiva nell’Africa subsahariana, raro nel resto del mondo [8-10]. La capsula è il principale fattore di virulenza del patogeno.
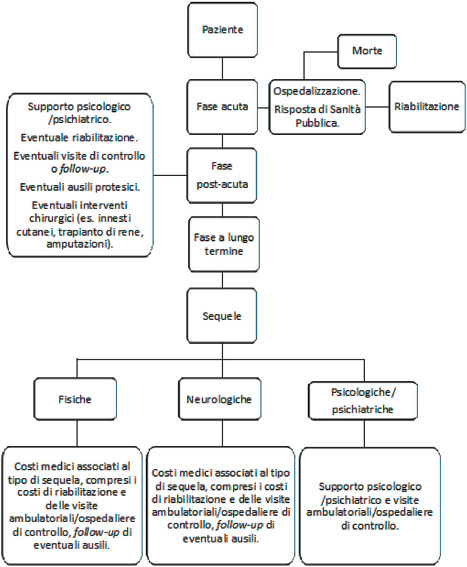
Il tasso di letalità della malattia invasiva da meningococco (IMD) è variabile e un trattamento precoce con antibiotici è fondamentale per determinare un buon esito della malattia. La gravità della malattia è associata, non solo alla sua letalità, ma anche all’alta probabilità di sviluppo di sequele temporanee o permanenti, singole o multiple, che impattano pesantemente sulla qualità di vita del paziente e dei familiari. Le complicanze della IMD sono di varia natura e comprendono sequele fisiche, neurologiche e psichiatriche/psicologiche [11].
In questo capitolo è analizzato il burden della malattia meningococcica suddiviso per fasce di età e per sierogruppi con riferimento alla fase acuta, alla letalità e alle complicanze. Poiché il presente report HTA ha l’obiettivo di valutare una strategia di vaccinazione gratuita multi-coorte con il vaccino quadrivalente coniugato, particolare attenzione è data alla malattia e alle sue complicanze causate dai sierogruppi N. meningitidis A (MenA), N. meningitidis C (MenC), N. meningitidis W (MenW) e N. meningitidis Y (MenY). Inoltre, nel capitolo è anche analizzato l’impatto sociale della malattia correlato alla perdita di qualità di vita dei pazienti e dei familiari [12].
Clinica della malattia meningococcica
La IMD è caratterizzata da un’evoluzione rapida e, talvolta, difficile da diagnosticare. Le manifestazioni cliniche più comuni dell’infezione sono la meningite e la setticemia, anche se in alcuni casi sono presenti entrambi i quadri clinici [11, 13-16]. I sintomi iniziali della malattia, come febbre ad esordio improvviso, mal di testa e mal di gola, possono essere confusi con una moltitudine di altre comuni infezioni respiratorie, compresa l’influenza. Il periodo di incubazione varia da 1 a 14 giorni, anche se solitamente dura meno di 2 giorni [11]. L’esordio dei sintomi specifici di meningite avviene in media dopo 12-15 ore dall’insorgenza della malattia, mentre i sintomi tardivi si presentano in media dopo 15 ore negli infanti e 24 ore nei bambini.
Il pattern clinico può variare a seconda dell’età e le manifestazioni cliniche possono essere più severe e caratterizzate da segni non specifici negli infanti: irritabilità e letargia sono caratteristiche comuni in questa fascia di età. In alcuni casi, all’inizio della malattia possono verificarsi convulsioni con esordio focale [13-16]. In generale, gli infanti mostrano una progressione più rapida della malattia rispetto ai bambini [16].
Come negli adulti, i sintomi più comuni nei bambini sono febbre, nausea, vomito, fotofobia, mal di testa, agitazione, diminuzione del livello di coscienza e rigidità del collo (rara nei bambini di età inferiore ai 2 anni): meno comuni sono le convulsioni e i segni neurologici focali [13-16]. Lo shock settico è più comune nei bambini e progredisce rapidamente, con insufficienza multiorgano e morte entro 24 ore, se non trattato adeguatamente. Uno dei sintomi più comuni associati alla sepsi è la rapida e progressiva eruzione emorragica che di solito inizia agli arti inferiori. Le lesioni cutanee comprendono macule, maculo-papule, orticaria, petecchie, porpora ed ecchimosi. L’eruzione cutanea purpurica può progredire in porpora fulminante, una manifestazione cutanea caratterizzata da coagulazione intravascolare disseminata. Questi casi sono spesso associati a shock settico e necrosi cutanea, ischemia, infarto delle dita o degli arti che di solito richiedono l’amputazione [13-16].
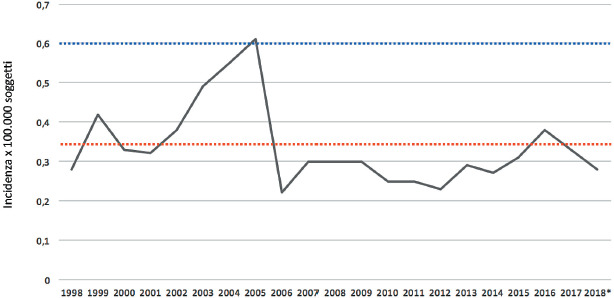
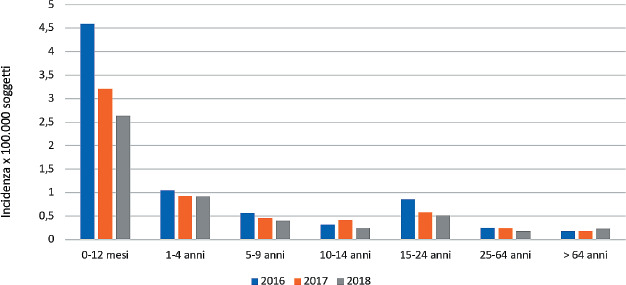
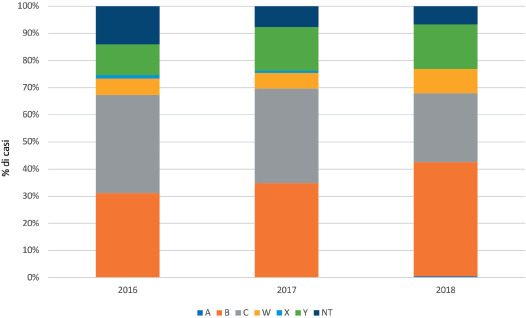
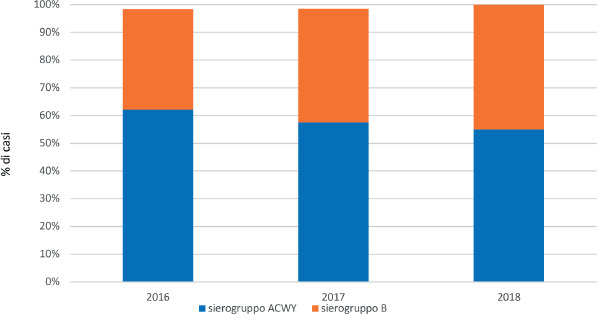
Secondo l’ultimo rapporto di sorveglianza delle malattie batteriche invasive in Italia [17], nel triennio 2017-2019 (ultimi dati disponibili) la presentazione clinica più frequente è stata la meningite (tra il 35% ed il 41 dei casi), seguita da sepsi/batteriemia non associata ad altro quadro clinico (tra il 26 e il 35% dei casi) e da meningite associata a sepsi/batteriemia (tra il 26% e il 30% dei casi). Quadri clinici di polmonite e artrite settica, con isolamento da siti sterili diversi dal sangue, sono stati segnalati raramente. Nei report dell’ISS non sono riportati, attualmente, dati sui quadri clinici associati ai vari sierogruppi, né l’associazione tra il quadro clinico della fase acuta e la probabilità di sviluppare sequele.
Ad oggi, sono pochi i dati in letteratura sia nazionale che internazionale che riportano il quadro clinico della fase acuta suddiviso per fasce di età e sierogruppo, oltre che la durata della degenza correlata alla gravità e al tipo di sintomo.
Al fine di fornire un quadro maggiormente approfondito della problematica sono stati analizzati gli studi condotti nei Paesi ad alto tenore socio-economico, nei quali è stato valutato il quadro clinico della malattia meningococcica suddiviso per gruppi di età e per sierogruppi, considerando un arco temporale successivo al 2000.
Nello studio di Sadarangani et al. [18] è stata valutata l’associazione tra presentazione clinica e decesso/complicanze stratificato per fasce età (0-18 anni e > 18 anni). Gli autori hanno riportato tassi di letalità più elevati negli adulti che avevano una presentazione clinica di shock settico senza meningite (33%) rispetto a quelli che presentavano solo meningite (2,2%). Nella fascia di età < 18 anni, il tasso di sequele era più elevato rispetto alla fascia di età > 18 anni, in particolare negli individui che presentavano nella fase acuta shock settico senza meningite (38%) [18].
Kaplan et al. [19] hanno esaminato dati provenienti da 10 centri ospedalieri dal 2001 al 2005, con l’obiettivo di analizzare i casi di malattia invasiva meningococcica in età pediatrica. Durante il periodo di sorveglianza di 51,5 mesi, si sono verificati 159 episodi di infezioni sistemiche da meningococco. La manifestazione clinica più comune era la meningite, presente nel 70% dei pazienti (112 casi). Complessivamente, 42 bambini (26%) necessitarono di ventilazione meccanica e 52 (33%) ricevettero terapia con vasopressori [19].
Nello studio di Elrod et al. [20] è stata osservata una coorte di 165 pazienti affetti da IMD (sierogruppo non specificato) di età media di 3,6 anni. La degenza variava da 1 a 170 giorni (media 18,9 ± 27,4 giorni). 84 pazienti (50,9%) sono stati ricoverati in terapia intensiva e di questi 11 (6,7%) hanno necessitato di un supporto respiratorio, 14 (8,5%) di un supporto cardiovascolare e 59 (35,8%) di un supporto respiratorio e cardiovascolare. La permanenza complessiva in PICU (Pediatric Intensive Care Unit) variava da 1 a 36 giorni (media complessiva 5,4 ± 5,8 giorni).
Nello studio di Loenenbach et al. [21] sono stati analizzati i dati olandesi di sorveglianza delle IMD da gennaio 2015 a giugno 2018, al fine di confrontare le caratteristiche cliniche di pazienti con malattia da MenW rispetto ai quadri clinici causati da altri sierogruppi. I casi di malattia divisi per sierogruppo hanno riportato un quadro clinico di setticemia e meningite differente per ogni sierogruppo: 45,5% e 16,9% per MenW; 24,7% e 56,5% per MenB; 35,2% e 22,2% per MenY e 28% e 32% per MenC. Inoltre, i pazienti colpiti da MenW presentavano più spesso polmonite (12%) o artrite settica (4,8%) rispetto ai pazienti affetti da MenB (polmonite: 1,6%, artrite settica: 0,8%). I casi di MenY e MenW mostravano manifestazioni cliniche simili, mentre i soggetti con MenC riportavano quadri clinici paragonabili a quelli osservati nei pazienti con MenB. La proporzione di casi con sintomi tipici dell’IMD, come petecchie e rigidità nucale, era più elevata tra i casi di MenB (59%) rispetto ai casi da MenW (19%) e da MenY (20%). I pazienti con MenW e con MenY presentavano più spesso sintomi come diarrea o dolore addominale, tosse, dispnea, dolore durante la respirazione o mal di gola [21].
Fattori di rischio della malattia
Alcuni fattori individuali ed ambientali sono associati ad un maggior rischio di malattia [22-29].
Le condizioni patologiche che compromettono il sistema immunitario aumentano il rischio di contrarre la malattia. In particolare, soggetti affetti da deficit del complemento, da patologie croniche, da asplenia anatomica o funzionale e da immunodeficienze sono tra le categorie di individui per le quali la vaccinazione è fortemente raccomandata [30-35]. Alcuni studi riportano che i bambini e gli adulti HIV+ hanno una probabilità fino a cinque volte superiore rispetto alla popolazione generale di contrarre la malattia meningococcica [5].
Altro fattore associato ad un maggior rischio di malattia sono le precedenti infezioni virali del tratto respiratorio [36].
Alcuni fattori ambientali quali l’esposizione al fumo e la permanenza in spazi chiusi affollati concorrono nell’aumentare il livello di rischio. Infatti, i bambini esposti al fumo passivo risultano avere un maggiore rischio di sviluppare una malattia invasiva da meningococco [35].
Per quanto riguarda gli adolescenti ed i giovani, l’aumento dei casi in queste fasce di età è correlato al loro stile di vita: frequentazione di luoghi chiusi ed affollati (pub o locali), di College, di università, baci con partner differenti, ecc. Infatti, è in queste categorie di individui che si registra il maggior tasso di carriage e, di conseguenza, essi sono considerati i principali veicolatori del microrganismo [23, 24, 26-28].
Letalità della malattia meningococcica
Anche se rara nei Paesi industrializzati, la malattia meningococcica è ancora oggi la principale causa di decesso per malattia invasiva batterica nell’infanzia; la letalità della malattia è variabile da Paese a Paese (8-15%) e in caso di sepsi può raggiungere il 40% [35].
Attualmente il Sistema di Sorveglianza delle Malattie Invasive Batteriche italiano non riporta i dati relativi alla letalità per la malattia invasiva meningococcica [37]. Gli unici dati italiani reperibili dalla letteratura sono quelli provenienti da sorveglianze eseguite in alcune Regioni come Emilia-Romagna, Piemonte e Veneto e derivanti dai report dell’European Centre for Disease Prevention and Control (ECDC).
Come descritto in un report del 2017 [38] in Emilia-Romagna, nel periodo 1999-2016, la letalità complessiva per IMD era del 9,7%. I tassi di letalità hanno mostrato una maggiore aggressività di MenC (15,1%) rispetto al MenB (8,6%). I tassi di letalità più elevati sono stati osservati nella fascia 5-9 anni e nei giovani adulti [38].
In Piemonte, il rapporto 2016 relativo al periodo 2008-2015 ha riportato un tasso di letalità del 12%. Nelle fasce di età maggiori di 5 anni la letalità era inferiore al 12%, mentre era pari al 20% nella fascia di età 0-4 anni [39]. Nel rapporto del 2019 relativo al periodo 2008-2019 è stato riportato un tasso di letalità per IMD del 12% [40].
Nello studio di Baldovin et al. è stata valutata l’effectiveness dei sistemi di sorveglianza della Regione Veneto nel periodo 2007-2014. Gli autori hanno riportato una letalità globale del 14% con un incremento associato all’età dall’8,7% negli infanti (< 1 anno) al 18,4% nei soggetti > 45 anni [41].
Come precedentemente detto, i dati italiani disponibili non sono esaustivi e, pertanto, sono stati analizzati i dati provenienti da Paesi ad alto tenore socio-economico e, in particolare, quelli derivanti da studi europei, canadesi, australiani e americani.
Relativamente all’Europa, l’ultimo rapporto dell’ECDC riporta i dati aggiornati al 2017 ed indica un tasso di letalità globale del 10%. Dei quattro sierogruppi più comuni, la letalità più elevata è stata riscontrata tra i casi di MenW (14%) e MenC (15%), seguiti dai MenY (8%). Sebbene non sia riportato alcun dato per fascia di età, il report riporta un tasso di letalità maggiore nei soggetti di età pari o superiore a 65 anni (18%), seguito dalla fascia di età 50-64 anni (10%) [42].
Nello studio di Garrido-Estepa et al. [43], condotto in Spagna nel periodo 2006-2012, sono riportati i tassi di letalità per fasce di età dovuti al MenC: 0% (< 1 anno), 5,9% (1-4 anni), 20% (5-14 anni), 26,4% (15-24 anni), 24,2% (25-44 anni), 31,5% (45-64 anni) e 23,1% (> 65 anni).
In uno studio olandese, condotto dal 1999 al 2011, gli autori hanno riportato i tassi di letalità per IMD suddivisi per fasce di età ma non per sierogruppo: 0-6 mesi: 2%; 6-24 mesi: 7%; 2-4 anni: 5%; 5-9 anni: 4%; 10-19 anni: 4%; 20-64 anni: 8% e ≥ 65 anni: 39% [44].
Nello studio di Loenenbach et al. [21], condotto in Olanda, nel periodo 2015-2018 è stato riportato il tasso di letalità stratificato per sierogruppo e per fasce di età. La letalità globale era del 4,8% per i bambini < 10 anni; 12,2% nella fascia di età 10-19 anni; 10,2% nella fascia di età 20-64 anni e 8,2% nei pazienti di età > 65 anni. Stratificando per sierogruppo, i tassi di letalità erano: 11,1% nella fascia di età < 10 anni, 24,1 nella fascia di età 10-19 anni, 17,3% nella fascia di età 20-64 anni, 13,8% nella fascia di età ≥ 65 anni per MenW; 0% (< 10 anni), 28,6% (10-19 anni), 7,7% (20-64 anni), 2,7% (≥ 65 anni) per MenY, 0% (< 10 anni), 0% (10-19 anni), 0% (20-64 anni), 90,0% (≥ 65 anni) per MenC. Per tutti i sierogruppi, i tassi di letalità erano maggiori tra i pazienti con setticemia/shock settico. Inoltre, i pazienti che presentavano diarrea senza sintomi specifici avevano tassi di letalità superiori (34%) rispetto a quelli con diarrea e sintomi specifici (18%) e ai pazienti senza diarrea (7,5%). Il tasso di letalità era più alto nei pazienti adulti, in particolare nei pazienti di età ≥ 65 anni [21].
Nello studio di Sadarangani et al. [18] condotto in Canada tra il 2002 e il 2011, è stata riportata la letalità per IMD suddivisa per sierogruppo in due fasce di età: 0-18 anni e > 18 anni. Gli autori hanno riportato un tasso di letalità globale pari all’8,4%: 4,1% nei bambini e adolescenti e 12,5% negli adulti. Le percentuali di letalità, per sierogruppo e per fascia di età, sono state calcolate dagli autori considerando i casi di malattia specifici per sierogruppo e non sul totale dei casi. Stratificando per sierogruppo, il tasso di letalità era 0% per MenA, 5,3% per MenC, 0% per W e 2% per MenY nei bambini/adolescenti e 50% per MenA, 15,1% per MenC, 18,2% per MenW e 13,1% per MenY negli adulti.
Nella revisione di Martinón-Torres [23] del 2016 sono riportati i dati di letalità provenienti da studi olandesi e statunitensi. I dati olandesi indicano una letalità globale per sierogruppo del 9% per MenC, 13% per MenW e 13% per MenY. Stratificando per età, la letalità globale era del 2% negli infanti < 1 anno, 5-7% nella fascia di età 1-5 anni, 4% nella fascia di età 5-10 anni, 4% nella fascia di età 10-19 anni, 8% nella fascia di età 20-65 e 39% in soggetti di età ≥ 65 anni. Stratificando il dato per i sierogruppi C/Y e per fasce di età il tasso di letalità era del 4,9% negli individui di età < 1 anno, del 6,9% nella fascia di età 1-5 anni, del 10,4% nella fascia di età 5-10 anni, del 4% nella fascia di età 10-19 anni, del 13,9% nel gruppo 20-65 anni e del 21,3 nei pazienti di età ≥ 65 anni [23].
Nei bambini statunitensi tra il 2001 e il 2005 il tasso di letalità era del 3,8% nella fascia di età < 5 anni, del 9,5% nel gruppo 6-10 anni e del 21,2% nella fascia di età > 11 anni.
Nella revisione sistematica di Wang et al. [45], sono stati raccolti i dati provenienti da database europei, statunitensi, canadesi ed australiani tra il 2000 ed il 2018 che includevano 163.758 pazienti con IMD. I tassi di letalità variavano dal 4,1% al 20,0%, con un dato complessivo aggregato dell’8,3%. Stratificando per sierogruppi, i tassi di letalità globali erano: 12,8% per il MenW, 12,0% per MenC e 10,8% per MenY.
Sequele associate alla malattia meningococcica
L’impatto sanitario della malattia invasiva meningococcica è rilevante, principalmente a causa delle sequele permanenti che colpiscono un’elevata percentuale di pazienti sopravvissuti, specialmente bambini ed adolescenti, costretti a convivere con sequele singole o multiple di tipo fisico, neurologico e/o psicologico. Le sequele incidono negativamente sulla qualità di vita del paziente, non solo nella fase post-acuta ma in molti casi per l’intero arco di vita. Inoltre, l’impatto negativo delle complicanze della malattia è evidente anche sulla famiglia.
Al fine di reperire gli articoli scientifici utili per il presente report di HTA, sono state condotte ricerche bibliografiche sul motore di ricerca PubMed (www.ncbi.nlm.nih.gov/pubmed).
È stato fissato un limite temporale compreso tra il 2000 e il 2020. Tale scelta è stata determinata dal fatto che i dati provenienti da studi condotti prima del 2000 si riferivano all’impatto globale delle sequele, senza riportare indicazioni sulla tipologia (sequele fisiche, neurologiche, psichiatriche/psicologiche) e, pertanto, non idonei per il presente report.
Sono stati inclusi articoli originali e revisioni sistematiche italiani e internazionali in lingua inglese limitando l’area geografica di riferimento e i dati associati alle sequele causate da MenA, MenC, MenW e MenY.
In riferimento agli articoli internazionali sono stati esclusi i manoscritti con dati riferiti a Paesi con elevata incidenza di malattia (es. cintura africana della meningite) e incluse ricerche condotte in Paesi ad alto tenore socio-economico (Europa, Nord-America e Australia).
Al termine della ricerca automatica sono stati eliminati i duplicati e valutati i titoli e i riassunti. Successivamente sono stati esaminati i testi in extenso. Per individuare eventuali fonti non rilevate attraverso la ricerca automatica, si è proceduto alla ricerca manuale attraverso il controllo della bibliografia dei manoscritti inclusi nella presente overview.
In totale sono stati inclusi nella presente overview 7 articoli originali e 2 revisioni sistematiche.
Le sequele sono state suddivise in tre differenti categorie: fisiche, neurologiche e psichiatriche/psicologiche.
Inizialmente sono state valutate le revisioni sistematiche e successivamente sono stati analizzati i risultati dei singoli studi e suddivisi, ove possibile, per fasce di età e per sierogruppi. Gli studi originali sono riportati per data di pubblicazione (dal meno recente al più recente).
Nella revisione sistematica di Olbrich del 2018 [1] condotta nei Paesi ad alto reddito, sono riportati i dati di 31 studi condotti nel periodo 2001-2016 sulle sequele da IMD, classificati in base alle manifestazioni cliniche e quando possibile per fascia di età. La maggior parte degli studi includeva principalmente casi di IMD in bambini e adolescenti e riportava la probabilità di sviluppare sequele, indipendentemente dal sierogruppo. Tra le sequele fisiche sono state segnalate le amputazioni (sino all’8% nei bambini e al 3% negli adolescenti/adulti) e le cicatrici cutanee (sino al 55% nei bambini, al 18% negli adolescenti e al 2% negli adulti), entrambe riportate più frequentemente nei sopravvissuti alla setticemia rispetto ai sopravvissuti alla meningite. Altre sequele fisiche sono state riportate: deformazione degli arti, danni cutanei e danni renali. Tra le sequele neurologiche la più frequente era la sordità: 19% negli infanti, 13% nei bambini, 12% negli adolescenti e l’8% negli adulti. Sono state, inoltre, considerate anche altre sequele come convulsioni, problemi cognitivi, deficit motori e deficit visivi [1]. Le principali sequele psicologiche riportate erano l’ansia, la difficoltà di apprendimento e i disturbi di comportamento che colpivano una percentuale significativa dei sopravvissuti alla malattia invasiva meningococcica. Inoltre, anche in una percentuale rilevante di familiari e di caregivers erano osservate problematiche di carattere psicologico sia nel breve che nel lungo termine [1].
Nella revisione pubblicata nel 2016 di Martinón-Torres [23], sono state valutate le conseguenze devastanti provocate dalla malattia meningococcica e l’impatto a carico dei familiari e della società, aspetti che frequentemente sono sottostimati. Globalmente le percentuali di sequele stratificate per sierogruppo erano: dal 22,2-34,0% per MenC, 15% per MenW e 54% per MenY. Riguardo alle sequele fisiche, le più frequenti erano le cicatrici cutanee (6,4-48%) e le amputazioni (0,8-14%) riportate con frequenze diverse in base all’età e alla severità della fase acuta della malattia. Altre sequele fisiche segnalate erano l’artrite e le vasculiti (4,7%), le disfunzioni renali (2-8,7%) e i disordini della crescita (6-13,1%). Tra le sequele neurologiche le più comuni erano i deficit della memoria, la sordità unilaterale e bilaterale, le convulsioni e il dolore cronico. Gli autori hanno riportato per la sordità range compresi tra 2-9,3%, per le convulsioni 1,4-13,9%, per i danni cognitivi 2,9-7,5%, per le disabilità neuromotorie 1,2-8,1% e per i danni neurologici generici 3,6%. Per quanto riguarda le sequele psichiatriche la revisione sistematica riporta che il 62% dei bambini manifestava sintomi associati a stress post-traumatico.
Sequele fisiche
Le sequele fisiche correlate alla malattia invasiva meningococcica sono molteplici e comprendono: esiti dermatologici (cicatrici cutanee, necrosi, psoriasi ed eczema), esiti/condizioni muscolo-scheletriche (amputazioni, deformazioni degli arti, artralgia ed artrite), patologie renali (ritenzione urinaria, insufficienza renale acuta e cronica), patologie cardiovascolari (vasculite, trombosi venose e fenomeno di Raynaud), insufficienza cardio-respiratoria, insufficienza surrenale, anemia, malattie polmonari, fatica cronica e malattie autoimmuni.
Nella Tabella I sono riportati gli articoli inclusi nella presente revisione con riferimenti ai dati relativi alle sequele fisiche. In Tabella, le sequele sono suddivise per tipologia e, per ciascuno studio, è riportata la probabilità di sequela, l’area geografica di riferimento, il periodo di studio, l’età media della popolazione studiata e, ove presente, la distribuzione dei diversi sierogruppi.
Tab. I.
Principali sequele fisiche e probabilità di sviluppare sequele.
| Tipo di sequele |
Ref. |
Età |
Probabilità (%) |
Area geografica e periodo di studio |
Denominatore |
Follow-up
|
Note |
|
Amputazioni
|
[20] |
Media alla diagnosi: 3,6 ± 4,4 |
9,1 |
Svizzera
1969-2008 |
165 arruolati |
13 mesi - 17,8 anni (media 10.4 ± 4,8 anni) |
Sierogruppo non specificato |
| 11*
|
136 sopravvissuti*
|
| [19] |
0-19 anni |
1,4*
|
USA
2001-2005 |
146 sopravvissuti |
2001-2005 |
44% dovuto a MenB
26% dovuto a MenC
22% causato da MenY |
| [46] |
Media: 19,3 anni |
3 |
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB
39% causato da MenC
1% causato da MenY |
| [18] |
< 18 anni |
36 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
20 |
69 pazienti con sequele |
|
Cicatrici cutanee
|
[46] |
Media: 19,3 anni |
18 |
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB
39% causato da MenC
1% causato da MenY |
| [48] |
Media alla diagnosi: 24,2 anni |
3,7 |
Germania
2009-2015 |
164 pazienti totali |
2009-2015 |
Sierogruppo non specificato |
| [18] |
< 18 anni |
20 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
16 |
69 pazienti con sequele |
|
Danni cutanei
|
[20] |
Media alla diagnosi: 3, 6± 4,4 |
44,8 |
Svizzera
1969-2008 |
165 arruolati |
13 mesi - 17,8 anni (media 10.4 ± 4,8 anni) |
Sierogruppo non specificato |
| 54,4*
|
136 sopravvissuti*
|
| [19] |
0-19 anni |
12,3*
|
USA
2001-2005 |
146 sopravvissuti |
2001-2005 |
44% dovuto a MenB
26% dovuto a MenC
22% causato da MenY |
| [47] |
Media: 17,6 anni |
14 |
Islanda
2007-2008 |
50 pazienti Men C con sequele |
2007-2008 |
Sierogruppo C |
|
Sequele ortopediche
|
[20] |
Media alla diagnosi: 3,6 ± 4,4 |
6 |
Svizzera
1969-2008 |
165 arruolati |
13 mesi - 17,8 anni (media 10.4 ± 4,8 anni) |
Sierogruppo non specificato |
| 7,4*
|
136 sopravvissuti*
|
| [18] |
< 18 anni |
5 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da Men |
| ≥ 18 anni |
10 |
69 pazienti con sequele |
| [47] |
Media: 17,6 anni |
18 |
Islanda
2007-2008 |
50 pazienti Men C con sequele |
2007-2008 |
Sierogruppo C |
|
Insufficienza renale
|
[48] |
Media alla diagnosi: 24,2 |
7,5 |
Germania
2009-2015 |
164 pazienti totali |
2009-2015 |
Sierogruppo non specificato |
| [18] |
< 18 anni |
7 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
23 |
69 pazienti con sequele |
BAMBINI E ADOLESCENTI
La ricerca americana diretta da Kaplan et al. [19] ha raccolto i dati dei casi di malattia invasiva meningococcica di 10 centri ospedalieri dal 2001 al 2005. Sono stati accertati 159 casi, di cui il 44% dovuto a MenB, il 26% a MenC ed il 22% a MenY. Lo studio ha descritto la distribuzione della malattia per fasce di età: il 25,7% dei casi erano infanti < 12 mesi, il 13,8% erano bambini di 12-24 mesi, il 24,5% bambini dai 2 ai 4 anni e il 35,8% bambini/adolescenti dai 5 ai 19 anni. Lo studio ha riportato una sopravvivenza del 91,8% (146/159) e nei sopravvissuti, le sequele fisiche più frequenti erano le cicatrici (12,3%) e le amputazioni (1,4%). I ricercatori hanno evidenziato che le conseguenze muscolo-scheletriche e i danni renali, in alcuni casi, si manifestano anche diversi anni dopo la fase acuta [19].
In uno studio inglese [46] sono state valutate le sequele di una coorte di adolescenti e giovani, stratificata in due gruppi di età (16-18 anni e 19-22 anni; età media: 19,3 anni), tra il 1999 e il 2000. La valutazione è stata eseguita dopo 18-36 mesi dalla fase acuta. Sono stati analizzati 202 pazienti (101 casi e 101 controlli suddivisi per sesso ed età); 84 casi sono stati accertati in laboratorio come positivi al meningococco, di cui 47 (56%) identificati come MenB, 33 (39%) come MenC, 1 (1,2%) come MenY e 3 (3,6%) non identificati. Il 39,6% aveva sviluppato un quadro di meningite e sepsi, il 32,7% solo meningite e il 26,7% solo setticemia. Le principali sequele fisiche riportate erano le cicatrici cutanee (18%) e almeno un’amputazione (3%) [46].
Nello studio di follow-up di Gottfredsson et al. [47] sono stati intervistati 120 soggetti sopravvissuti alla malattia invasiva meningococcica, dei quali il 41,7% positivi per il MenC. Tra i casi di MenC, le principali sequele riportate erano i danni cutanei (14%) e le complicanze ortopediche (artrite) (18%).
Nello studio canadese di Sadarangani et al. [18] condotto tra il 2002 e il 2011 sono stati analizzati i dati clinici di 868 pazienti: il 55% dei casi era dovuto a MenB, il 18,9% causato da MenC, il 5,3% da MenW e il 17% associato a MenY. Il 48% dei casi erano soggetti di età < 18 anni (419). Considerando solo la fascia pediatrica, i soggetti con sequele erano globalmente il 21%, e stratificando per sierogruppo le percentuali erano: 0% per MenA, 21,8% per MenB, 34,2% per MenC, 16,7% per MenW e 14,3% per MenY. Il 33% dei bambini soffriva di sequele multiple. Considerando esclusivamente i pazienti pediatrici con sequele, le conseguenze fisiche più frequenti erano le amputazioni (36%), le cicatrici cutanee (20%), le disfunzioni renali (7%) e i problemi alle articolazioni (5%) [18].
Nello studio di Elrod et al. [20], sono state analizzate le sequele di 165 bambini colpiti da setticemia meningococcica di età media di 3,6 anni (sierogruppo non specificato). Il 9,1% dei casi aveva subito amputazioni, il 44,8% aveva cicatrici cutanee e il 6% aveva riportato conseguenze ortopediche.
ADULTI
Lo studio di Sadarangani et al. [18] ha analizzato, oltre che i dati riferiti alla popolazione pediatrica, anche quelli relativi alla popolazione adulta. La percentuale globale di individui con sequele nella fascia adulta era il 15,4% per tutti i sierogruppi. Stratificando per sierogruppo, le percentuali di individui con sequele erano: 0% per MenA, 14,6% per MenB, 19,8% per MenC, 9,1% per MenW e 14,1% per MenY. Considerando esclusivamente i soggetti con complicanze, le sequele fisiche più frequentemente riportate erano le disfunzioni renali (23%), le amputazioni (20%), le cicatrici cutanee (16%) e i problemi alle articolazioni (10%) [18].
Lo studio tedesco condotto da Huang et al. [48] tra il 2009 ed il 2015 ha considerato 164 casi di IMD (sierogruppo non specificato) in soggetti di età media pari a 24,2 anni. Le sequele fisiche più frequenti erano le cicatrici cutanee (3,7%) e l’insufficienza renale (7,5%).
Sequele neurologiche
Le sequele neurologiche associate alla malattia invasiva meningococcica comprendono: disfunzioni dell’apparato sensoriale (sordità, cecità, paralisi dei nervi cranici, esotropia, tinniti, intorpidimento, parestesia, sensibilità alla luce); disfunzioni motorie (paralisi, paralisi cerebrale, debolezza muscolare, monoparesi/emiparesi, spasticità, problemi di mobilità, severo deficit neuromotorio e di coordinazione); problemi di comunicazione (afasia, balbuzie, difficoltà nel linguaggio e nella comunicazione); deficit cognitivi (ritardo mentale con Quoziente Intellettivo (QI) < 70, ritardo mentale moderato con QI = 70-85, difficoltà di apprendimento, deficit cognitivi); alterazione delle attività cerebrali (convulsioni epilettiche e non epilettiche, cefalea cronica, emicrania, stato vegetativo, vertigini); altri disordini neurologici (danni ai nervi cranici, idrocefalo, convulsioni febbrili, radiculopatia, empiema subdurale, infarto multicerebrale, ritardo nello sviluppo, disturbi del sonno, letargia).
Nella Tabella II sono riportati gli articoli inclusi nella presente revisione con riferimenti ai dati relativi alle sequele neurologiche. In tabella, le sequele sono suddivise per tipologia e, per ogni studio, è riportata la probabilità di sequela, l’area geografica di riferimento, il periodo di studio, l’età media della popolazione studiata e, ove presente, la distribuzione dei diversi sierogruppi.
Tab. II.
Principali sequele neurologiche e probabilità di sviluppare sequele.
| Tipo di sequele |
(Ref.) |
Età (anni) |
Probabilità (%) |
Area geografica e periodo di studio |
Denominatore |
Follow-up
|
Note |
|
Sequele neurologiche non definite
|
[18] |
< 18 anni |
7 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
14 |
69 pazienti con sequele |
|
Emicrania
|
[47] |
Media: 17,6 anni |
30*
|
Islanda
2007-2008 |
50 pazienti MenC con sequele |
2007-2008 |
Sierogruppo C |
|
Sordità
|
[47] |
Media: 17,6 anni |
14*
|
Islanda
2007-2008 |
50 pazienti MenC con sequele |
2007-2008 |
Sierogruppo C |
| [19] |
0-19 anni |
9,6*
|
USA
2001-2005 |
146 sopravvissuti |
2001-2005 |
44% dei casi dovuto a MenB
26% dovuto a MenC
22% causato da MenY |
| [46] |
Media: 19,3 anni |
12 |
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB
39% causato da MenC
1% causato da MenY |
| [48] |
Media alla diagnosi: 24,2 |
5,7 |
Germania
2009-2015 |
164 pazienti totali |
2009-2015 |
Sierogruppo non specificato |
| [18] |
< 18 anni |
35 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
22 |
69 pazienti con sequele |
|
Disturbi della vista
|
[18] |
< 18 anni |
10 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
23 |
69 pazienti con sequele |
|
Epilessia
|
[19] |
0-19 anni |
6,2*
|
USA
2001-2005 |
146 sopravvissuti |
2001-2005 |
44% dovuto a MenB
26% dovuto a MenC
22% causato da MenY |
| [46] |
Media: 19,3 anni |
2 |
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB
39% causato da MenC
1% causato da MenY |
| [48] |
Media alla diagnosi: 24,2 |
6,8 |
Germania
2009-2015 |
164 pazienti totali |
2009-2015 |
Sierogruppo non specificato |
| [18] |
< 18 anni |
3 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
9 |
69 pazienti con sequele |
|
Deficit
cognitivi
|
[47] |
Media: 17,6 anni |
32*
|
Islanda
2007-2008 |
50 pazienti Men C con sequele |
2007-2008 |
Sierogruppo C |
| [46] |
Media: 19,3 anni |
13 |
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB
39% causato da MenC
1% causato da MenY |
| [18] |
< 18 anni |
1 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
6 |
|
69 pazienti con sequele |
|
Deficit
motori
|
[19] |
0-19 anni |
Atassia: 2,7
Emiplegia: 2 |
USA
2001-2005 |
146 sopravvissuti |
2001-2005 |
44% dovuto a MenB
26% dovuto a MenC
22% causato da MenY |
| [46] |
Media: 19,3 anni |
13 |
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB.
39% causato da MenC
1% causato da MenY |
| [18] |
< 18 anni |
19 |
Canada
2002-2011 |
88 pazienti con sequele |
2002-2011 |
55% dei casi dovuto a MenB
19,9% causato da MenC
5,3% dovuto a MenW
17% causato da MenY |
| ≥ 18 anni |
6 |
69 pazienti con sequele |
BAMBINI E ADOLESCENTI
Nello studio di Kaplan et al. [19] sono state descritte le sequele neurologiche per fasce di età. Gli autori hanno riportato che il 9,6% dei sopravvissuti era affetto da sordità (4,1% aveva sordità unilaterale e il 5,5% sordità bilaterale) e che la perdita di udito era più comune negli infanti e nei bambini piccoli rispetto a quelli di età > 2 anni. Inoltre, gli autori hanno osservato convulsioni nel 6,2% dei pazienti, atassia nel 2,7% e emiplegia nel 2% sopravvissuti [19].
Lo studio di Borg et al. [46] ha riportato che tra i pazienti con sequele, il 12% presentava problemi di udito, il 2% convulsioni, il 13% disturbi del linguaggio, il 17% vertigini ed il 13% deficit motori [46].
Nello studio di Gottfredsson et al. [47], considerando solo i casi di MenC le sequele più frequentemente riportate erano: emicrania nel 30% dei casi, deficit cognitivi 32% dei pazienti e sordità nel 14% dei soggetti sopravvissuti.
Lo studio di Sadarangani et al. [18], considerando esclusivamente i pazienti di età < 18 anni con sequele, ha riportato che il 35% dei soggetti soffriva di problemi all’udito, il 10% di disturbi della vista, il 3% aveva avuto episodi di epilessia, 1% mostrava deficit cognitivi e il 19% deficit motori.
ADULTI
Nello studio di Sadarangani et al. [18] nei pazienti con sequele di età ≥ 18 anni le complicanze maggiormente segnalate erano sordità (22%), disturbi della vista (23%), epilessia (9%), deficit cognitivi (6%) e deficit motori (6%).
Infine, lo studio di Huang et al. [48] ha riportato che il 5,7% dei pazienti presentava sordità ed il 6,8% epilessia.
Sequele psicologico/psichiatriche
Tipicamente, i sintomi psicologici e psichiatrici compaiono in seguito all’ospedalizzazione e sono spesso sottostimati nel medio e nel lungo periodo. La maggioranza dei sopravvissuti soffre di disturbi post-traumatici da stress e, a causa dei devastanti effetti dovuti alle sequele fisiche, spesso le conseguenze psicologiche sono considerate di minore rilievo [49].
Le sequele della sfera psicologica sono suddivise in: disordini da ansia (ansia generalizzata, ansia da separazione, disordine sociale, fobie specifiche); disordini comportamentali (negativismo sfidante, disturbi comportamentali); altri disturbi (depressione, deficit dell’attenzione, disordine dell’attenzione e iperattività, disturbo post-traumatico da stress, disturbo dello spettro autistico, disturbi alimentari).
Gli studi che riportano dati sulle sequele psicologiche/psichiatriche sono pochi e nella maggior parte dei casi non è fatta la suddivisione per sierogruppi e classi di età.
Nella Tabella III sono riportati i dati relativi alle sequele psicologiche/psichiatriche sulla base del tipo di sequela, della probabilità, dell’area geografica, del periodo di studio, dell’età e del sierogruppo, se disponibile.
Tab. III.
Principali sequele psicologiche/psichiatriche e probabilità di sviluppare sequele.
| Tipo di sequele |
Ref. |
Età |
Probabilità (%) |
Area geografica e periodo di studio |
Denominatore |
Follow-up
|
Note |
|
Stress post-traumatico
|
[50] |
Età media 5,7 anni |
10 |
UK
1996-1997 |
29 pazienti totali |
Media:
8,9 mesi |
Sierogruppo non specificato |
|
Ansia
|
[47] |
Età media 17,6 anni |
4*
|
Islanda
1975-2004 |
50 pazienti MenC con sequele |
2007-2008 |
Sierogruppo C |
|
Depressione
|
[47] |
Età media 17,6 anni |
6*
|
Islanda
1975-2004 |
50 pazienti MenC con sequele |
2007-2008 |
Sierogruppo C |
| [46] |
Età media 19.3 anni |
8*
|
UK
1999-2000 |
101 pazienti |
Da 18 a 36 mesi |
56% dovuto a MenB
39% causato da MenC
1% causato da MenY |
BAMBINI E ADOLESCENTI
Nello studio condotto da Judge et al. [50] è stato valutato il rischio di disordini psichiatrici nei bambini sopravvissuti alla malattia meningococcica (sierogruppo non specificato) e nei genitori. Un totale di 29 bambini (età media di 5,7 anni) è stato seguito per un periodo di follow-up di 3-12 mesi e 27 coppie di genitori hanno accettato di essere intervistate. Il 62% dei pazienti ha riportato sintomi da stress dopo la dimissione, i più comuni dei quali erano incubi ed ipereccitazione. Il 10% dei soggetti presentava marcati disordini da stress post-traumatico al follow-up. Il rischio globale di danni psichiatrici era doppio nei pazienti, rispetto alla popolazione generale.
Gottfredsson et al., nello studio di follow-up (gennaio 2007-aprile 2008), hanno osservato che il 4% dei sopravvissuti a malattia meningococcica da MenC soffriva di ansia e il 6% di depressione. La probabilità di avere problemi psichiatrici e psicologici era significativamente più alta rispetto alla popolazione generale [47].
Borg et al. hanno valutato i sintomi depressivi in una coorte di individui di età 15-19 anni, 18-36 mesi dopo la fase acuta della malattia, tramite il test “Beck Depression Inventory II” (BDI-II) e confrontandoli con un gruppo di controllo. I pazienti presentavano segni depressivi in una percentuale maggiore rispetto ai controlli (20 vs 12) [46].
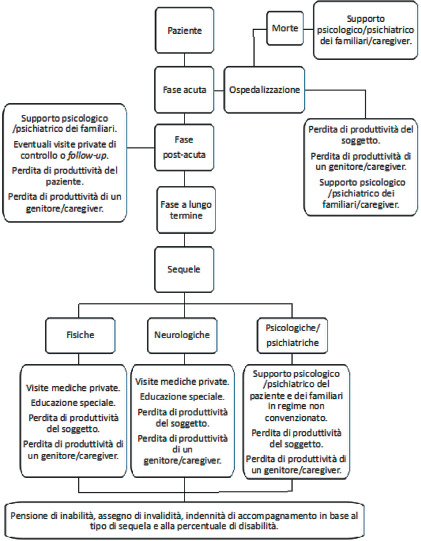
Problemi psico-sociali e qualità di vita dei genitori e dei caregivers
Judge et al. [50] hanno esaminato i disturbi psichiatrici nei genitori di bambini/adolescenti di età compresa tra i 2 e i 15 anni sopravvissuti a malattia meningococcica, che erano stati ricoverati in terapia intensiva. I soggetti sono stati seguiti per un periodo di 3-12 mesi (media 8,9 mesi) dopo la fase acuta. Il disagio psicologico nelle madri è stato valutato utilizzando il “General Health Questionnaire 28” (un punteggio ≥ 4 è indicativo di rischio psichiatrico). I ricercatori hanno riscontrato un incrementato rischio di disturbi psichiatrici nel 40% delle madri; disturbi da stress post-traumatico clinicamente significativi sono stati osservati nel 48% delle intervistate ed il 29% ha dichiarato di necessitare di supporto psicologico. I sintomi da stress nelle madri erano significativamente correlati alla gravità della malattia dei figli [50].
Nello studio di Shears et al. [51] sono stati valutati i problemi psico-sociali dei genitori. Lo studio ha incluso 60 madri, 45 padri e gli insegnanti dei bambini colpiti da IMD. Il disturbo da stress post-traumatico è stato misurato utilizzando l’Impact of Event Stress (IES), mentre il disturbo psichiatrico è stato valutato con il General Health Questionnaire (GHQ-28), strumento validato e ampiamente utilizzato per lo screening dei disturbi psichiatrici negli adulti. I questionari sono stati somministrati durante il ricovero del figlio e tre mesi dopo la dimissione. Nello studio è stato fissato un cut-off ≥ 5. Dalla valutazione dei questionari è emerso che le madri soffrivano di stress mentale sia al ricovero (59%) sia al follow-up (3 mesi dal ricovero) (43%); valori inferiori sono stati osservati nei padri (42% al ricovero e 24% al follow-up). È stato stimato un rischio di disturbo post-traumatico da stress pari a circa il 38% nelle madri e del 19% nei padri. Inoltre, è stata evidenziata una correlazione positiva tra la lunghezza della degenza in terapia intensiva del paziente ed il disturbo post-traumatico da stress dei genitori. Al fine di valutare l’impatto della malattia nel medio termine, è stato eseguito un follow-up a 12 mesi, al termine del quale il 24% delle madri e il 15% dei padri mostravano un rischio per disordine post-traumatico da stress. Inoltre, ai genitori è stato somministrato anche il “Parental Assessment Questionnaire”, che ha evidenziato una variazione del comportamento nei confronti dei figli, con una maggiore propensione ad essere permissivi ed un maggior timore per il loro stato di salute [51].
Lo studio di Ehrlich et al. [52] ha valutato il disagio psicologico nei genitori di bambini sopravvissuti alla malattia da meningococco, dopo la dimissione dall’unità di terapia intensiva. Al momento del ricovero, tutti i bambini sopravvissuti avevano un’età compresa tra 1 e 18 anni. Per individuare la presenza di disturbi psichiatrici è stato utilizzato il “Goldberg General Health Questionnaire-30” (GHQ-30). Punteggi > 5 erano indicativi di stress psicologico. Il punteggio medio GHQ per le madri è risultato pari a: 8,71 dopo 3 mesi dalla fase acuta; 10,7 dopo 6 mesi; 6,96 dopo 12 mesi; 7,17 dopo 2 anni e 4,9 dopo 3 anni. Inoltre, nello studio è riportata la percentuale di madri affette da stress psicologico: il 50% mostrava segni di stress psicologico dopo 3 mesi; il 69% dopo 6 mesi; il 39% dopo 12 mesi; il 33% dopo 2 anni e il 31% dopo 3 anni. Nei padri, il punteggio medio GHQ era pari a: 7,17 dopo 3 mesi; 6,69 dopo 6 mesi; 5,9 dopo 12 mesi; 6,25 dopo 2 anni e 5,43 dopo 3 anni. Le percentuali di padri con stress psicologico erano: il 41% dopo 3 mesi; il 58% dopo 6 mesi; il 45% dopo 12 mesi; il 50% dopo 2 anni e il 29% dopo 3 anni. Dai dati, si evince come la prevalenza del disagio psicologico fosse maggiore rispetto alla popolazione generale dopo 3 e 6 mesi per le madri e dopo 6, 12 e 24 mesi per i padri [52].
Perdita di qualità di vita associata alla malattia meningococcica
La qualità della vita (QoL) nei pazienti sopravvissuti alla malattia meningococcica si riduce in base al tipo e alla gravità delle sequele. Il concetto di “qualità della vita” è stato concepito negli anni ’80 del XX secolo, nel contesto degli studi sulle sequele delle malattie croniche nella popolazione adulta. Solo recentemente la valutazione della qualità di vita è stata applicata ai bambini ed alle malattie infantili in generale.
Nella valutazione della qualità di vita sono considerate le funzioni fisiche, cognitive, sociali ed emotive [12] e con la definizione “Health-related quality of life” (HRQoL) si intende lo specifico impatto della patologia e delle sue conseguenze sulla qualità di vita.
In letteratura sono pochi gli studi che riportano l’impatto a breve, medio e lungo termine delle sequele sulla qualità della vita dei pazienti e dei caregivers.
Nella revisione sistematica di Olbrich et al. [1] è sottolineato l’impatto negativo della malattia sulla qualità di vita di tutti i pazienti, compresi i soggetti senza sequele, e dei familiari per periodi di tempo molto lunghi [1]. Conclusioni simili sono riportate nella revisione pubblicata da Vyse et al. nel 2013, nella quale è riportato un livello di qualità di vita, nei sopravvissuti alla malattia meningococcica, inferiore rispetto alla popolazione generale, con effetti prolungati nel tempo [53].
Nello studio di Buysse et al. [54] è stata valutata la qualità di vita nei bambini sopravvissuti alla malattia meningococcica e nei loro genitori. Sulla base dei dati riportati dai genitori, l’11% dei pazienti mostrava problemi correlati alle abilità fisiche, il 37% difficoltà nella percezione della salute e il 16% disturbi emotivi. Lo studio ha riportato effetti negativi sulla salute e sulla qualità di vita dei bambini, soprattutto sul piano fisico, ad un follow-up di 2 anni. Inoltre, l’HRQoL era negativamente influenzato dalla gravità della malattia e dai disturbi cronici.
Koomen et al. [55], nel 2005 hanno pubblicato i risultati di uno studio con l’obiettivo di valutare la qualità di vita di bambini sopravvissuti a meningite batterica e di osservare la correlazione tra le limitazioni in ambito scolastico e gli aspetti comportamentali. Sono stati inclusi 182 bambini con età media di 9,7 anni (range 5,3-14,2) e comparati con un gruppo di controllo composto da bambini sani. Questi bambini non avevano avuto, nella fase acuta, una malattia “severa” e non riportavano sequele invalidanti gravi. A livello generale, la qualità di vita dei bambini sopravvissuti alla meningite batterica è risultata più bassa se confrontata con la popolazione pediatrica di controllo, in particolare per gli aspetti psicosociali, cognitivi e familiari. Gli effetti negativi sulla qualità di vita non sono risultati significativamente associati all’età, al sesso, al patogeno e alla presenza di sequele neurologiche.
Nello studio olandese di Grootenhuis et al. [56], è stata valutata la qualità di vita in 318 bambini di età compresa tra 8-11 anni con differenti malattie croniche, di cui 38 sopravvissuti ad una forma severa di malattia meningococcica. I bambini sono stati seguiti per 1-7 anni dopo il ricovero in terapia intensiva. Ai fini della valutazione è stato utilizzato il “TNO-AZL Children’s Quality of Life Questionnaire” (TACQoL) e sono state eseguite le analisi della varianza, per indagare le differenze nei punteggi medi dei bambini con condizioni croniche, rispetto al gruppo di controllo (bambini sani). Il questionario contiene sette domini che prendono in considerazione: difficoltà sul piano fisico; problemi di autonomia; difficoltà sul piano motorio; problemi cognitivi; aspetti sociali (ad es. ridotta capacità di giocare, parlare con altri bambini o di sentirsi a proprio agio con i coetanei); emozioni positive (ad es. sentimenti di gioia) ed emozioni negative (ad es. tristezza o aggressività). Dall’analisi dei dati, considerando esclusivamente i bambini sopravvissuti alla malattia meningococcica, è emerso che il 45% dei pazienti soffriva di disturbi motori, il 40% aveva problemi di autosufficienza, il 38% riportava problemi sociali ed il 22% provava emozioni negative. Gli outcomes sono risultati statisticamente significativi, se confrontati con quelli relativi al gruppo di controllo. I bambini con malattia meningococcica presentavano una maggiore dipendenza dai genitori e di conseguenza erano meno propensi a partecipare ad attività ricreative, scolastiche e sociali. Tale impatto negativo influiva negativamente sullo sviluppo cognitivo del paziente, compromettendo e riducendo la qualità di vita [56].
Vermunt et al. [57] hanno stimato il possibile effetto dello shock settico meningococcico sull’autostima di bambini e di adolescenti di età compresa tra 8 e 17 anni, a distanza di almeno 4 anni dalla fase acuta (le cicatrici erano la principale sequela). In funzione dell’età, sono stati utilizzati rispettivamente il questionario “Harter’s Self-Perception Profile for Children” (SPP-C) per i bambini tra gli 8 e gli 11 anni e il “Harter’s Self-Perception Profile for Adolescent” (SPP-A) per gli adolescenti tra i 12 e i 17 anni. Entrambi i questionari valutano ambiti specifici, quali la competenza scolastica, la socialità, la competenza atletica, l’aspetto fisico, il comportamento e l’autostima globale. Punteggi più elevati sono considerati migliori. Dall’analisi dei dati dell’SPP-C (soggetti di età 8-11 anni) è emerso che non vi erano differenze significative tra i bambini sopravvissuti alla malattia meningococcica e il gruppo di controllo. Per quanto riguarda gli adolescenti, è emerso che tra i maschi, i soggetti sopravvissuti alla malattia riportavano punteggi più bassi rispetto ai controlli per competenza scolastica (13,4 vs 14,5), accettazione sociale (13,1 vs 15,3), competenza atletica (12,3 vs 14,8), aspetto fisico (12,7 vs 14,7), socialità (12,1 vs 16,6) e autostima globale (12 vs 16). Le femmine avevano punteggi più bassi relativamente all’accettazione sociale (13,2 vs 15,4), all’amicizia (12,3 vs 17,7) e all’autostima globale (11,6 vs 14,9). È stata inoltre valutata la relazione tra il livello di autostima e la presenza di sequele fisiche gravi, evidenziando il fatto che i bambini con cicatrici cutanee avessero punteggi peggiori riguardo al dominio dell’accettazione sociale, mentre gli adolescenti con cicatrici riportavano punteggi più bassi riguardo la socializzazione. Globalmente, negli adolescenti sono stati osservati punteggi peggiori rispetto ai bambini. Questo risultato è probabilmente dovuto al fatto che essere colpiti da una malattia di tale gravità in fase adolescenziale determina stati di vulnerabilità psicologica ed emotiva, che incidono negativamente sull’autostima [57].
Un successivo studio dello stesso gruppo di ricerca [58] ha valutato i disturbi psicologici a lungo termine in giovani adulti sopravvissuti a shock settico da meningite. L’età dei pazienti era compresa tra 16 e 31 anni al momento del follow-up (età media: 21 anni) e l’intervallo mediano di follow-up era di 13 anni (da 4 a 16 anni). Per valutare le condizioni di vita, il livello d’istruzione, lo stato professionale, lo stato civile e le conseguenze fisiche e sociali legate alla malattia è stata effettuata un’intervista strutturata. Per valutare la funzionalità intellettiva dei pazienti è stato somministrato il “Groninger Intelligence Test 2 (GIT2)”, che consiste in test secondari su comprensione verbale, visualizzazione, ragionamento/deduzione e fluidità delle parole. Dall’elaborazione dei dati, è emerso il fatto che la maggior parte dei pazienti mostrava una buona ripresa delle attività quotidiane, inclusa la frequenza scolastica o lo svolgimento di un’attività lavorativa retribuita. Ciò nonostante, il 5-20% dei sopravvissuti riferiva di avere ancora difficoltà nella funzionalità intellettiva e problemi comportamentali associati agli esiti della malattia.
Borg et al. [46] esaminarono una coorte di adolescenti e giovani colpiti da malattia (età media: 19,3 anni), valutando anche la qualità di vita (Short Form 36 Health Survey – SF-36), la stanchezza quotidiana (11-item Chalder Fatigue Scale), lo stress (Family Inventory of Life Events), il livello scolastico raggiunto (General Certificate of Secondary Education) e le funzioni cognitive, a 18-36 mesi dalla fase acuta. La qualità di vita è stata valutata considerando i punteggi globali della componente fisica (48,4 nei casi vs 51,8 nei controlli) e di quella psicologica (46,6 dei casi vs 53,5 dei controlli); punteggi più elevati indicano un migliore stato di salute. Relativamente al livello di stanchezza, il test misurava variabili quali la stanchezza fisica (punteggio da 0 a 21), la fatica psicologica (punteggio da 0 a 12) e la fatica globale (punteggio da 0 a 33); punteggi più alti indicano una condizione peggiore. Nel gruppo dei pazienti la stanchezza fisica era pari a 9 vs 8,3 dei controlli e la fatica psicologica era 4,6 nei casi vs 4 nei controlli. Relativamente al punteggio assegnato alla fatica globale, il punteggio dei pazienti era 13,6 vs 12,4 nei controlli. Infine, è stato considerato l’ambito educativo e scolastico; è stato osservato il fatto che la percentuale di pazienti che non aveva conseguito un titolo di studio superiore alla scuola secondaria, era più alta (64%) rispetto a quella di controllo (50%).
Nel contesto della ricerca condotta nei Paesi Bassi (1988-2001) da Buysse et al. [59], è stata valutata la qualità di vita in 140 soggetti sopravvissuti alla malattia meningococcica. I pazienti erano stati colpiti dalla malattia in un’età compresa tra 1 mese e 18 anni, ed intervistati dopo 10 anni (54 bambini di 4-11 anni, 38 adolescenti di 12-17 anni e 48 soggetti con età ≥ 18 anni). Gli autori hanno misurato la qualità di vita dei pazienti e dei loro familiari, mediante l’utilizzo del “Child Health Questionnaire” (CHQ) per i soggetti di età < 18 anni e lo Short-Form Health Survey (SF-36) per i soggetti d’età > 18 anni. Il CHQ valuta il profilo di salute globale del soggetto, riferito ai domini fisici e psicosociali, inclusi quelli relativi alle abitudini di vita, all’autostima e agli effetti dello stato di salute sulla famiglia. La struttura è del tutto simile a quella dell’SF-36 utilizzato per gli adulti. Per i soggetti ≥ 18 anni, il questionario SF- 36 era compilato sia dai pazienti che dai familiari. I punteggi dei pazienti sono stati confrontati con quelli di un gruppo di controllo, composto da bambini e adolescenti sani. I punteggi relativi ai soggetti di età compresa tra i 4 e i 17 anni (questionari compilati dai genitori) erano più bassi se confrontati a quelli dei controlli della stessa età, specificamente riguardo ai domini fisici (92/100 vs 99/100), psico-sociali (76/100 vs 79/100) e alla percezione globale dello stato di salute (64/100 vs 83/100). I pazienti tra i 12 e i 17 anni avevano invece punteggi più bassi rispetto ai loro coetanei sani relativamente alla percezione dello stato di salute generale (66/100 vs 74/100). Per i soggetti di età ≥ 18 anni i punteggi erano più bassi relativamente alla vitalità (63/100 vs 71/100) ed allo stato di salute fisica globale (49/100 vs 55/100). Nei soggetti d’età < 18 anni la percezione dello stato di salute globale era più bassa, tenendo conto sia dei punteggi assegnati dai pazienti stessi, sia di quelli attribuiti dai familiari; questo outcome può essere associato, non solo all’esperienza di salute associata alla fase acuta, ma anche alla preoccupazione per lo stato di salute futuro. I risultati dello studio, relativamente ai punteggi assegnati dai genitori, hanno evidenziato valori più elevati rispetto a quelli indicati dai figli. Una probabile motivazione potrebbe essere associata al fatto che, a seguito del grave stress causato dalla fase acuta della malattia, i genitori siano più propensi a sottovalutare l’entità delle sequele, specialmente se di lieve entità. Nel complesso, il livello di qualità di vita era più basso nei pazienti rispetto al gruppo di controllo in ogni fascia di età. Inoltre, gli autori riportarono il fatto che soggetti con gravi sequele fisiche (e.g. amputazioni e cicatrici estese) avevano un maggior rischio di peggioramento della qualità di vita a lungo termine.
Nella ricerca danese condotta da Pickering et al. [60], sono state valutate le conseguenze socio-economiche a lungo termine su 2.902 pazienti affetti da meningite meningococcica. Tra questi, 2.077 soggetti sono stati seguiti fino all’età di 20 anni e, di questi, 1.028 fino a 30 anni. I pazienti erano confrontati con un gruppo di controllo. I parametri osservati erano: il livello d’istruzione, il lavoro svolto e la sicurezza sociale ed economica. Al fine di valutare il livello educativo erano comparate le medie dei voti dell’ultimo anno di scuola primaria. I casi riportavano una votazione media di 5,7 vs 5,9 dei controlli (OR = 1,58, 95% CI = 0,90-0,99). All’età di 20 anni, una percentuale minore dei pazienti (37,5%) aveva completato la scuola secondaria rispetto ai controlli della stessa età (43,8%). All’età di 30 anni, il 33,4% dei pazienti aveva frequentato l’università, rispetto al 36% dei controlli. Relativamente all’ambito professionale, all’età di 20 anni i pazienti avevano maggiormente beneficiato dell’assistenza sociale (OR = 1,39, 95% CI = 1,00-1,93) e una percentuale più elevata di soggetti percepiva la pensione d’invalidità (OR = 2,52, 95% CI = 1,62-3,95). All’età di 30 anni le entrate finanziarie dei pazienti erano significativamente inferiori rispetto a quelle dei controlli.
Conclusioni
Sebbene rara nei Paesi ad elevato tenore socio-economico, a causa della sua gravità la malattia meningococcica determina un elevato impatto sanitario e sociale. L’incidenza della patologia è variabile in base all’età e al tempo.
La fase acuta della malattia è caratterizzata da una rapida evoluzione e, talvolta, difficile da diagnosticare. I sintomi iniziali, come febbre ad esordio improvviso, mal di testa e mal di gola, non sono specifici e possono essere confusi con altre comuni infezioni respiratorie, compresa l’influenza. Le manifestazioni cliniche più comuni sono la meningite e la setticemia e, in alcuni casi, sono presenti entrambi i quadri clinici. La letalità è alta e può raggiungere il 40% in caso di sepsi, determinando morti premature. La gravità della malattia è anche correlata all’alta percentuale di pazienti che sopravvivono con sequele permanenti, singole o multiple, che ne compromettono gravemente la qualità di vita.
Attualmente non sono disponibili dati italiani sulla stima delle sequele da meningococco e, di conseguenza, la valutazione dell’impatto delle complicanze della malattia è stata condotta considerando i dati provenienti da studi condotti in contesti internazionali riferiti a Paesi ad alto tenore socio-economico. Le sequele che impattano maggiormente sulla qualità di vita del paziente sono quelle neurologiche, ed in particolare la sordità (uni o bilaterale) (range: 5,7-35%), i deficit cognitivi (range: 1-32%), i deficit motori (range: 2-19%), i disturbi della vista (range: 10-23%) e l’epilessia (range: 2-9%). Molti sono anche i pazienti che riportano gravi sequele fisiche, come amputazioni singole o multiple (range: 3-36%), cicatrici e danni cutanei (range: 3,7-54,4%), deformazioni degli arti (range: 5-18%) e danni renali (range: 7-23%).
Non di secondaria importanza sono le sequele a carico della sfera psicologica che, spesso sono sottostimate in quando compaiono dopo l’ospedalizzazione. L’ansia e la depressione sono le sequele psichiatriche più comuni nei sopravvissuti, infatti numerosi studi riportano che fino al 60% dei pazienti segnala sintomi da stress post-traumatico a breve e medio termine.
La gravità della malattia determina un rilevante impatto sulla famiglia; numerose ricerche riportano un aumentato rischio di disturbi psichiatrici nei genitori: fino al 60% delle madri e il 40% dei padri segnalano disturbi da stress post-traumatico, di rilevanza tale da necessitare di un supporto specialistico.
Globalmente, il livello di qualità della vita dei pazienti sopravvissuti alla malattia meningococcica è inferiore rispetto a quello della popolazione generale e l’impatto negativo della malattia è evidente anche nei pazienti senza sequele, per periodi di tempo molto lunghi.
Bibliografia
-
[1].Olbrich KJ, Müller D, Schumacher S, Beck E, Meszaros K, Koerber F. Systematic review of invasive meningococcal disease: sequelae and quality of life impact on patients and their caregivers. Infect Dis Ther 2018; 7(4): 421-438. https://doi.org/10.1007/s40121-018-0213-2. 10.1007/s40121-018-0213-2 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[2].McNamara LA, Thomas JD, MacNeil J, Chang HY, Day M, Fisher E, Martin S, Poissant T, Schmink SE, Steward-Clark E, Jenkins LT, Wang X, Acosta A; Oregon Meningococcal Carriage Team. Meningococcal carriage following a vaccination campaign with menB-4C and menB-FHbp in response to a University serogroup B meningococcal disease outbreak-Oregon, 2015-2016. J Infect Dis 2017; 216(9): 1130-1140. https://doi.org/10.1093/infdis/jix446. 10.1093/infdis/jix446 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[3].Peterson ME, Li Y, Shanks H, Mile R, Nair H, Kyaw MH; Meningococcal Carriage Group. Serogroup-specific meningococcal carriage by age group: a systematic review and meta-analysis. BMJ Open. 2019; 9(4): e024343. https://doi.org/10.1136/bmjopen-2018-024343. 10.1136/bmjopen-2018-024343 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[4].Gasparini R, Comanducci M, Amicizia D, Ansaldi F, Canepa P, Orsi A, Icardi G, Rizzitelli E, De Angelis G, Bambini S, Moschioni M, Comandi S, Simmini I, Boccadifuoco G, Brunelli B, Giuliani MM, Pizza M, Panatto D. Molecular and serological diversity of Neisseria meningitidis carrier strains isolated from Italian students aged 14 to 22 years. J Clin Microbiol. 2014; 52(6): 1901-1910. https://doi.org/10.1128/JCM.03584-13 10.1128/JCM.03584-13 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[5].Gasparini R, Amicizia D, Domnich A, Lai PL, Panatto D. Neisseria meningitidis B vaccines: recent advances and possible immunization policies. Expert Rev Vaccines 2014; 13(3): 345-364. https://doi.org/10.1586/14760584.2014.880341. 10.1586/14760584.2014.880341 [DOI] [PubMed] [Google Scholar]
-
[6].Notarangelo LD, Schumaker RF. Vaccinazione antimeningococcica. Area Pediatr. 2003; 4: 38-44. [Google Scholar]
-
[7].Guzzetta G, Manfredi P, Gasparini R, Panatto D, Edmunds WJ. On the relationship between meningococcal transmission dynamics and disease: remarks on humoral immunity. Vaccine. 2009; 27 (25-26): 3429-3434. https://doi.org/10.1016/j.vaccine.2009.01.092. 10.1016/j.vaccine.2009.01.092 [DOI] [PubMed] [Google Scholar]
-
[8].Harrison LH, Trotter CL, Ramsay ME. Global epidemiology of meningococcal disease. Vaccine 2009; 27 (Suppl 2): B51-63. https://doi.org/10.1016/j.vaccine.2009.04.063. 10.1016/j.vaccine.2009.04.063 [DOI] [PubMed] [Google Scholar]
-
[9].Hammerschmidt S, Müller A, Sillmann H, Mühlenhoff M, Borrow R, Fox A, van Putten J, Zollinger WD, Gerardy-Schahn R, Frosch M. Capsule phase variation in Neisseria meningitidis serogroup B by slipped-strand mispairing in the polysialyltransferase gene (siaD): correlation with bacterial invasion and the outbreak of meningococcal disease. Mol Microbiol 1996; 20(6): 1211-20. https://doi.org/10.1111/j.1365-2958.1996.tb02641.x. 10.1111/j.1365-2958.1996.tb02641.x [DOI] [PubMed] [Google Scholar]
-
[10].Panatto D, Amicizia D, Lai PL, Gasparini R. Neisseria meningitidis B vaccines. Expert Rev Vaccines 2011; 10(9): 1337-51. https://doi.org/10.1586/erv.11.103. 10.1586/erv.11.103 [DOI] [PubMed] [Google Scholar]
-
[11].Nguyen N, Ashong D. Neisseria Meningitidis. 2020 Jul 10. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020January–. PMID: 31751039. [Google Scholar]
-
[12].Boccalini S, Landa P, Amicizia D, Bechini A, Innocenti M, Iovine M, Lecini E, Marchini F, Paolini D, Sartor G, Zangrillo F, Lai PL, Bonanni P, Panatto D. Health Technology Assessment (HTA) del vaccino anti-meningococco B (Trumenba®) per gli adolescenti in Italia. J Prev Med Hyg 2019; 60 (suppl.2): E1-E94. https://doi.org/10.15167/2421-4248/jpmh2019.60.3s2. 10.15167/2421-4248/jpmh2019.60.3s2 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[13].Dwilow R, Fanella S. Invasive meningococcal disease in the 21st century-an update for the clinicians. Curr Neurol Neurosci Rep. 2015; 15: 2–9. [DOI] [PubMed] [Google Scholar]
-
[14].Branco R, Tasker R. Meningococcal meningitis. Curr Treat Options Neurol. 2010; 12: 464–474. [DOI] [PubMed] [Google Scholar]
-
[15].Sabatini C, Bosis S, Semino M, Senatore L, Principi N, Esposito S. Clinical presentation of meningococcal disease in childhood. J Prev Med Hyg. 2012; 53: 116–119. [PubMed] [Google Scholar]
-
[16].Dass Hazarika R, Deka NM, Khyriem AB, Lyngdoh WV, Barman H, Duwarah SG, Jain P, Borthakur D. Invasive meningococcal infection: analysis of 110 cases from a tertiary care centre in North East India. Indian J Pediatr. 2013May; 80(5): 359-364. https://doi.org/10.1007/s12098-012-0855-0. 10.1007/s12098-012-0855-0 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[17].ISS-Istituto Superiore di Sanità, MaBI. Disponibile al sito: https://www.iss.it/documents/20126/0/Rapporto+consolidato+MIB+2019.pdf/1faeb457-9859-f800-b9aa-bf8aea405093?t=1612517562338. [ultimo accesso 2 marzo 2021].
-
[18].Sadarangani M, Scheifele DW, Halperin SA, Vaudry W, Le Saux N, Tsang R, Bettinger JA; investigators of the Canadian Immunization Monitoring Program, ACTive (IMPACT). Outcomes of invasive meningococcal disease in adults and children in Canada between 2002 and 2011: a prospective cohort study. Clin Infect Dis 2015; 60(8): e27-35. https://doi.org/10.1093/cid/civ028. 10.1093/cid/civ028 [DOI] [PubMed] [Google Scholar]
-
[19].Kaplan SL, Schutze GE, Leake JA, Barson WJ, Halasa NB, Byington CL, Woods CR, Tan TQ, Hoffman JA, Wald ER, Edwards KM, Mason EO, Jr. Multicenter surveillance of invasive meningococcal infections in children. Pediatrics 2006; 118(4): e979-84. https://doi.org/10.1542/peds.2006-0281. 10.1542/peds.2006-0281 [DOI] [PubMed] [Google Scholar]
-
[20].Elrod J, Mannhard D, Mohr C, Lienert C, Hagemann-Gysling K, Schiestl C. Plastic and Orthopaedic Interventions and Long-Term Sequelae in Children with Meningococcal Septicemia-40 Years of Experience at the University Children’s Hospital Zurich. Eur J Pediatr Surg. 2019; 29(5): 462-469. https://doi.org/10.1055/s-0038-1673705. 10.1055/s-0038-1673705 [DOI] [PubMed] [Google Scholar]
-
[21].Loenenbach AD, Van Der Ende A, De melker HE, Sanders EAM, Knol MJ. The clinical picture and severity of invasive meningococcal disease serogroup W compared with other serogroups in the Netherlands, 2015-2018. Clin Infect Dis 2019. https://doi.org/10.1093/cid/ciz578. 10.1093/cid/ciz578 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[22].Bruce MG, Rosenstein NE, Capparella JM, Shutt KA, Perkins BA, Collins M. Risk factors for meningococcal disease in college students. JAMA 2001; 286(6): 688-693. https://doi.org/10.1001/jama.286.6.688. 10.1001/jama.286.6.688 [DOI] [PubMed] [Google Scholar]
-
[23].Martinón-Torres F. Deciphering the burden of meningococcal disease: conventional and under-recognized elements. J Adolesc Health 2016; 59 (2 Suppl): S12-20. https://doi.org/10.1016/j.jadohealth.2016.03.041. 10.1016/j.jadohealth.2016.03.041 [DOI] [PubMed] [Google Scholar]
-
[24].Panatto D, Amicizia D, Lai PL, Gasparini R. Neisseria meningitidis B vaccines. Expert Rev Vaccines 2011; 10(9): 1337-1351. https://doi.org/10.1586/erv.11.103. 10.1586/erv.11.103 [DOI] [PubMed] [Google Scholar]
-
[25].Gasparini R, Comanducci M, Amicizia D, Ansaldi F, Canepa P, Orsi A, Icardi G, Rizzitelli E, De Angelis G, Bambini S, Moschioni M, Comandi S, Simmini I, Boccadifuoco G, Brunelli B, Giuliani MM, Pizza M, Panatto D. Molecular and serological diversity of Neisseria meningitidis carrier strains isolated from Italian students aged 14 to 22 years. J Clin Microbiol 2014;52(6):1901-10. https://doi.org/10.1128/JCM.03584-13. 10.1128/JCM.03584-13 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[26].Tully J, Viner RM, Coen PG, Stuart JM, Zambon M, Peckham C, Booth C, Klein N, Kaczmarski E, Booy R. Risk and protective factors for meningococcal disease in adolescents: matched cohort study. BMJ 2006; 332(7539): 445-50. https://doi.org/10.1136/bmj.38725.728472.BE. 10.1136/bmj.38725.728472.BE [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[27].European Centre for Disease Prevention and Control (ECDC). Invasive meningococcal disease - Annual Epidemiological Report for 2015. Disponibile al sito: https://ecdc.europa.eu/sites/portal/files/documents/AER_for_2015-meningococcal-disease.pdf. [ultimo accesso del 31 dicembre 2018].
-
[28].Bosis S, Mayer A, Esposito S. Meningococcal disease in childhood: epidemiology, clinical features and prevention. J Prev Med Hyg 2015; 56(3): E121-124. [PMC free article] [PubMed] [Google Scholar]
-
[29].Hill DJ, Griffiths NJ, Borodina E, Virji M. Cellular and molecular biology of Neisseria meningitidis colonization and invasive disease. Clin Sci (Lond). 2010; 118(9): 547-564. https://doi.org/10.1042/CS20090513. 10.1042/CS20090513 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[30].Pizza M, Rappuoli R. Neisseria meningitidis: pathogenesis and immunity. Curr Opin Microbiol. 2015; 23: 68-72. https://doi.org/10.1016/j.mib.2014.11.006. 10.1016/j.mib.2014.11.006 [DOI] [PubMed] [Google Scholar]
-
[31].Ministero della Salute. Piano Nazionale Prevenzione Vaccinale 2017-2019. Disponibile al sito: http://www.salute.gov.it/imgs/C_17_pubblicazioni_2571_allegato.pdf. [ultimo accesso 2 marzo 2021].
-
[32].Takada S, Fujiwara S, Inoue T, Kataoka Y, Hadano Y, Matsumoto K, Morino K, Shimizu T. Meningococcemia in Adults: A Review of the Literature. Intern Med. 2016; 55(6): 567-572. https://doi.org/10.2169/internalmedicine.55.3272. 10.2169/internalmedicine.55.3272 [DOI] [PubMed] [Google Scholar]
-
[33].Harris C M, Wu HM, Li J, Hall HI, Lee A, Zell E, Cohn AC. Meningococcal Disease in Patients With Human Immunodeficiency Virus Infection: A Review of Cases Reported Through Active Surveillance in the United States, 2000–2008. Open Forum Infectious Diseases 2016; 3(4): ofw226. https://doi.org/10.1093/ofid/ofw226. 10.1093/ofid/ofw226 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[34].Simmons RD, Kirwan P, Beebeejaun K, Riordan A, Borrow R, Ramsay ME, Delpech V, Lattimore S, Ladhani S. Risk of invasive meningococcal disease in children and adults with HIV in England: a population-based cohort study. BMC Med. 2015; 13: 297. https://doi.org/10.1186/s12916-015-0538-6. 10.1186/s12916-015-0538-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[35].Tully J, Viner RM, Coen PG, Stuart JM, Zambon M, Peckham C, Booth C, Klein N, Kaczmarski E, Booy R. Risk and protective factors for meningococcal disease in adolescents: matched cohort study. BMJ 2006; 332(7539): 445-450. https://doi.org/10.1136/bmj.38725.728472.BE. 10.1136/bmj.38725.728472.BE [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[36].Watson JM, Nicholas S, James P. Meningococcal infection and influenza: do surveillance data support an association? Options for the control of influenza III. Amsterdam: Elsevier Science; 1996; pp. 82-4. [Google Scholar]
-
[37].Sorveglianza delle Malattie Batteriche Invasive in Italia. RAPPORTO CONSOLIDATO 2019 DIPARTIMENTO MALATTIE INFETTIVE - ISTITUTO SUPERIORE DI SANITA’. Disponibile al sito: https://www.iss.it/documents/20126/0/Rapporto+consolidato+MIB+2019.pdf/1faeb457-9859-f800-b9aa-bf8aea405093?t=1612517562338. [ultimo accesso 2 marzo 2021].
-
[38].Frasca G, Pascucci MG, Gualanduzzi C. Servizio Prevenzione Collettiva e Sanità Pubblica, Regione Emilia-Romagna. Malattie invasive da meningococco in Emilia Romagna. 2017. Disponibile al sito: https://salute.regione.emilia-romagna.it/documentazione/rapporti/rapporto-meningococco-2017/at_download/file/meningococc-aprile-2017.pdf. [ultimo accesso 10 marzo 2021].
-
[39].Lombardi D, Pasqualini C. Malattie batteriche invasive in Piemonte nel 2016. SEREMI, Regione Piemonte. Disponibile al sito: https://www.seremi.it/sites/default/files/Report%20MIB%20Piemonte%202008%202015%20ed%202016.pdf. [ultimo accesso del 15 dicembre 2020]. [Google Scholar]
-
[40].LE MALATTIE BATTERICHE INVASIVE IN PIEMONTE ANNO 2019. Disponibile al sito: https://www.seremi.it/sites/default/files/REPORT%20MIB%202019%20ed%202020.pdf. [ultimo accesso 23 marzo 2021].
-
[41].Baldovin T, Lazzari R, Cocchio S, Furlan P, Bertoncello C, Saia M, Russo F, Baldo V. Invasive meningococcal disease in the Veneto region of Italy: a capture-recapture analysis for assessing the effectiveness of an integrated surveillance system. BMJ Open 2017; 7(4): e012478. https://doi.org/10.1136/bmjopen-2016-012478. 10.1136/bmjopen-2016-012478 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[42].European Centre for Disease Prevention and Control (ECDC). Invasive meningococcal disease - Annual Epidemiological Report for 2017. Disponibile al sito: https://www.ecdc.europa.eu/sites/default/files/documents/AER_for_2017-invasive-meningococcal-disease.pdf [ultimo accesso 11 marzo 2021].
-
[43].Garrido-Estepa M, Leòn-Gòmez I, Herruzo R, Cano R. Changes in meningococcal C epidemiology and vaccine effectiveness after vaccine introduction and schedule modification. Vaccine 2014; 32(22): 2604-2609. https://doi.org/10.1016/j.vaccine.2014.03.010. 10.1016/j.vaccine.2014.03.010 [DOI] [PubMed] [Google Scholar]
-
[44].Stoof SP, Rodenburg GD, Knol MJ, Rümke LW, Bovenkerk S, Berbers GA, Spanjaard L, van der Ende A, Sanders EA. Disease burden of invasive meningococcal disease in the Netherlands between June 1999 and June 2011: a subjective role for serogroup and clonal complex. Clin Infect Dis 2015; 61(8): 1281-1292. https://doi.org/10.1093/cid/civ506. 10.1093/cid/civ506 [DOI] [PubMed] [Google Scholar]
-
[45].Wang B, Santoreneos R, Giles L, HA Afzali, Marshall H. Case fatality rates of invasive meningococcal disease by serogroup and age: A systematic review and meta-analysis. Vaccine, 2019. 37(21): 2768-2782. https://doi.org/10.1016/j.vaccine.2019.04.020. 10.1016/j.vaccine.2019.04.020 [DOI] [PubMed] [Google Scholar]
-
[46].Borg J, Christie D, Coen PG, Booy R, Viner RM. Outcomes of meningococcal disease in adolescence: prospective, matched- cohort study. Pediatrics 2009; 123(3): e502-9. https://doi.org/10.1542/peds.2008-0581. 10.1542/peds.2008-0581 [DOI] [PubMed] [Google Scholar]
-
[47].Gottfredsson M, Reynisson IK, Ingvarsson RF, Kristjansdottir H, Nardini MV, Sigurdsson JF, Miller MA. Comparative Long-term Adverse Effects Elicited by Invasive Group B and C Meningococcal Infections. Clinical Infectious Diseases 2011; 53(9):e117–e124. doi:10.1093/cid/cir500. 10.1093/cid/cir500 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[48].Huang L, Heuer OD, Janben S, Hackl D, Schmedt N. Clinical and economic burden of invasive meningococcal disease: Evidence from a large German claims database. Plos One. 2020; 15(1): e0228020. https://doi.org/10.1371/journal.pone.0228020. eCollection 2020. 10.1371/journal.pone.0228020 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[49].Erickson L, De Wals P. Complications and sequelae of meningococcal disease in Quebec, Canada, 1990-1994. Clin Infect Dis 1998; 26(5): 1159-64. https://doi.org/10.1086/520303. 10.1086/520303 [DOI] [PubMed] [Google Scholar]
-
[50].Judge D, Nadel S, Vergnaud S, Garralda EM. Psychiatric adjustment following meningococcal disease treated on a PICU. Intensive Care Medicine 2002; 28(5):648–650. https://doi.org/10.1007/s00134-002-1237-2. 10.1007/s00134-002-1237-2 [DOI] [PubMed] [Google Scholar]
-
[51].Shears D, Nadel S, Gledhill J, Garralda ME. Short-term psychiatric adjustment of children and their parents following meningococcal disease. Pediatr Crit Care Med 2005;6(1):39-43. https://doi.org/10.1097/01.PCC.0000144705.81825.EE. 10.1097/01.PCC.0000144705.81825.EE [DOI] [PubMed] [Google Scholar]
-
[52].Ehrlich TR, Von Rosenstiel IA, Grootenhuis MA, Gerrits AI, Bos AP. Long-term psychological distress in parents of child survivors of severe meningococcal disease. Pediatr Rehabil 2005; 8(3): 220-224. https://doi.org/10.1080/13638490400022246. 10.1080/13638490400022246 [DOI] [PubMed] [Google Scholar]
-
[53].Vyse A, Anonychuk A, Jäkel A, Wieffer H, Nadel S. The burden and impact of severe and long-term sequelae of meningococcal disease. Expert Rev Anti Infect Ther 2013; 11(6): 597-604. https://doi.org/10.1586/eri.13.42. 10.1586/eri.13.42 [DOI] [PubMed] [Google Scholar]
-
[54].Buysse CM, Raat H, Hazelzet JA, Hop WC, Maliepaard M, Joosten KF. Surviving meningococcal septic shock: health consequences and quality of life in children and their parents up to 2 years after pediatric intensive care unit discharge. Crit Care Med. 2008; 36(2): 596-602. https://doi.org/10.1097/01.CCM.0000299740.65484.CA. 10.1097/01.CCM.0000299740.65484.CA [DOI] [PubMed] [Google Scholar]
-
[55].Koomen I, Raat H, Jennekens-Schinkel A, Grobbee DE, Roord JJ, van Furth M. Academic and behavioral limitations and health-related quality of life in school-age survivors of bacterial meningitis. Qual Life Res 2005; 14(6): 1563-1572. https://doi.org/10.1007/s11136-004-7706-z. 10.1007/s11136-004-7706-z [DOI] [PubMed] [Google Scholar]
-
[56].Grootenhuis MA, Koopman HM, Verrips EGH, Vogels AGC, Last BF. Health-related quality of life problems of children aged 8-11 years with a chronic disease. Dev Neurorehabil 2007; 10(1): 27-33. https://doi.org/10.1080/13682820600691017. 10.1080/13682820600691017 [DOI] [PubMed] [Google Scholar]
-
[57].Vermunt L, Buysse CM, Joosten KF, Oranje AP, Hazelzet JA, Verhulst FC, Utens EM. Self-esteem in children and adolescents after septic shock caused by Neisseria meningitidis: scars do matter. J Adolesc Health 2008; 42(4): 386-393. https://doi.org/10.1016/j.jadohealth.2007.09.026. 10.1016/j.jadohealth.2007.09.026 [DOI] [PubMed] [Google Scholar]
-
[58].Vermunt L, Buysse CM, Joosten KF, Duivenvoorden H, Hazelzet JA, Verhulst FC, Utens EM. Survivors of septic shock caused by Neisseria meningitidis in childhood: psychosocial outcomes in young adulthood. Pediatr Crit Care Med 2011; 12(6): e302-309. https://doi.org/10.1097/PCC.0b013e3182192d7f. 10.1097/PCC.0b013e3182192d7f [DOI] [PubMed] [Google Scholar]
-
[59].Buysse CM, Vermunt LC, Raat H, Hazelzet JA, Hop WC, Utens EM, Joosten KF. Surviving meningococcal septic shock in childhood: long-term overall outcome and the effect on health related quality of life. Crit Care 2010; 14(3): R124. https://doi.org/10.1186/cc9087. 10.1186/cc9087 [DOI] [PMC free article] [PubMed] [Google Scholar]
-
[60].Pickering L, Jennum P, Ibsen R, Kjellberg J. Long-term health and socioeconomic consequences of childhood and adolescent onset of meningococcal meningitis. Eur J Pediatr 2018; 177(9): 1309-1315. https://doi.org/10.1007/s00431-018-3192-0. 10.1007/s00431-018-3192-0 [DOI] [PubMed] [Google Scholar]