Abstract
目的
探讨关节腔注射富血小板血浆(platelet-rich plasma,PRP)治疗后,膝骨关节炎(osteoar-thritis,OA)患者血浆和关节滑液中 IL-17 水平变化。
方法
以 2015 年 1 月—2016 年 1 月接受关节腔 PRP 注射治疗(每周 1 次,连续 3 周)的 30 例膝关节 OA 患者作为研究对象(试验组),以 30 例自愿者正常膝关节作为对照(对照组)。两组研究对象性别、年龄、体质量指数比较,差异均无统计学意义(P>0.05)。试验组治疗前后采用膝关节学会评分系统(KSS)及疼痛视觉模拟评分(VAS)分别评价膝关节功能及疼痛程度。试验组患者注射 PRP 之前及第 3 次注射后 1、3、6 及 12 个月抽取肘前静脉血以及患侧关节滑液,采用 ELISA 法测量 IL-17 含量;对照组抽取肘前静脉血进行相应检测并比较。
结果
PRP 注射治疗过程中,试验组患者均未出现膝关节红肿、发热等局部感染及其他不适症状。患者均获随访,随访时间 12~15 个月,平均 13.5 个月。PRP 注射治疗后各时间点 VAS 评分均较术前显著降低,KSS 评分较术前显著增加,比较差异有统计学意义(P<0.05);治疗后各时间点间比较,差异均无统计学意义(P>0.05)。与对照组比较,试验组 PRP 治疗前后血浆 IL-17 含量均显著增高(P<0.05)。试验组治疗后各时间点血浆及关节滑液 IL-17 含量均较治疗前显著降低(P<0.05),治疗后各时间点间比较差异均无统计学意义(P>0.05)。
结论
关节腔注射 PRP 治疗可显著改善膝关节 OA 患者疼痛症状及关节功能,并在一定程度上降低患者体内 IL-17 水平,但未恢复至正常水平。
Keywords: 富血小板血浆, IL-17, 骨关节炎, 膝关节
Abstract
Objective
To investigate the interleukin-17 (IL-17) levels changes in both synovial fluid and venous plasma of patients with primary knee osteoarthritis (OA) after intra-articular injection of platelet-rich plasma (PRP).
Methods
Between January 2015 and January 2016, 30 patients with primary knee OA were treated by intra-articular injection of PRP once a week for 3 weeks (trial group). Thirty healthy individuals were recruited into the study as control. There was no significant difference in gender, age, and body mass index between 2 groups (P>0.05). Visual analogue scale (VAS) score and Knee Society Score (KSS) were used to evaluate pain level and function of the knee for patients with OA. The IL-17 levels in both venous plasma and synovial fluid were measured before injection and at 1, 3, 6, and 12 months after injection in trial group and the IL-17 levels in venous plasma were measured in control group. The levels were determined using ELISA method.
Results
There was no knee joint swelling, fever, local infection, or other uncomfortable symptoms for all patients in process of PRP injection. All patients were followed up 13.5 months on average (range, 12-15 months). In trial group, the VAS scores at different time points after injection were significantly lower than that before injection (P<0.05). And the KSS scores at different time points after injection were significantly higher than that before injection (P<0.05). There was no significant difference in VAS and KSS scores between different time points after injection (P>0.05). The IL-17 levels in venous plasma before and after injection in trial group were significantly higher than that in control group (P<0.05). The IL-17 levels in venous plasma at each time point after injection were significantly lower than that before injection (P<0.05). There was no significant difference in IL-17 levels in both venous plasma and synovial fluid between different time points after injection (P>0.05).
Conclusion
Intra-articular injection of PRP can significantly release the pain symptoms, improve joint function, and reduce IL-17 levels in both synovial fluid and venous plasma of the patients with knee OA, but IL-17 levels can not reduce to normal level.
Keywords: Platelet-rich plasma, interleukin-17, osteoarthritis, knee
骨关节炎(osteoarthritis,OA)是一种复杂的关节滑膜及关节软骨炎性疾病[1],炎性细胞因子会破坏软骨细胞的合成与分解代谢平衡,在 OA 发生与发展中起重要作用[2-3]。最近研究表明,IL-17 基因多态性与 OA 的易感性相关[4],膝关节 OA 患者血浆及关节滑液中 IL-17 表达水平明显高于健康人群[5-6]。富血小板血浆(platelet-rich plasma,PRP)是全血离心后获得的血小板浓缩物[7-8],富含各种生长因子及生物活性物质[9-10]。自体全血制备的 PRP 无免疫排斥反应,且制备简便快捷。关节腔内注射 PRP 可能修复受损软骨,已逐渐用于临床[9, 11]。2015 年 1 月—2016 年 1 月,我们对 30 例膝关节 OA 行关节腔内注射 PRP 治疗(试验组),观察治疗前后患者血浆和关节滑液 IL-17 变化,同时与 30 例膝关节正常志愿者(对照组)血浆 IL-17 水平进行比较,以期了解这一细胞因子在 PRP 注射治疗后的体内变化情况。
1. 临床资料
1.1. 一般资料
试验组:男 11 例,女 19 例;年龄 50~59 岁,平均 52.5 岁。体质量指数(body mass index,BMI)为(27.3±3.7)kg/m2。均为单膝发病,其中左膝 12 例,右膝 18 例。病程 6~37 个月,平均 21.5 个月。患者主要症状为膝关节疼痛,轻度行走、活动障碍等。术前均摄伸直负重位膝关节 X 线片,并行 Kellgren-Lawrence 分级[12],2 级 19 例,3 级 11 例。患者均根据 1987 年美国风湿病协会 OA 诊断标准[13]确诊为 OA。
对照组:男 13 例,女 17 例;年龄 47~55 岁,平均 51.9 岁。BMI 为(27.7±3.9)kg/m2。均经 X 线检查排除膝关节病变。
两组研究对象性别、年龄、BMI 比较,差异均无统计学意义(P>0.05)。所有研究对象均排除风湿免疫性疾病、血液肿瘤性疾病、内分泌疾病和严重心、肝、肾等脏器功能障碍情况。
1.2. PRP 制备方法
试验组患者肘前静脉取全血 40 mL,采用枸橼酸钠抗凝。采用二次离心法:① 以离心半径 15.5 cm,1 450 r/min 离心 10 min,吸取全部上清液至交界面下 3 mm;② 以离心半径 15.5 cm,3 370 r/min 离心 10 min,弃 3/4 上清液之后剩余摇匀,获得 5 mL PRP。其中,4 mL PRP 在制备 2 h 内进行注射治疗,注射前在 PRP 中加入 1 mL 10% CaCl2 以激活血小板;另外 1 mL PRP 行血小板计数。
1.3. PRP 治疗方案
膝关节注射区常规消毒,取髌下内、外侧或髌骨外上方为穿刺点,采用 5 mL 注射器刺入关节腔,有突破感且注射无阻力后注入 PRP,注射完毕后屈伸活动膝关节,以便 PRP 与关节面充分接触。局部无菌包扎,常规口服头孢类抗生素 2 d 以预防注射部位感染。每周注射 PRP 1 次,连续 3 周。
1.4. 标本采集与观测指标
试验组患者注射 PRP 之前及第 3 次注射后 1、3、6 及 12 个月抽取肘前静脉血 10 mL 以及患侧关节滑液 2 mL。采用 ELISA 检测试剂盒(北京百奥莱博科技有限公司)测量血浆及关节滑液 IL-17 含量。对照组患者抽取肘前静脉血 10 mL,同法检测血浆 IL-17 含量。
治疗期间观察试验组患者膝关节有无红肿、发热等局部感染及其他不适症状发生。治疗前后采用膝关节学会评分系统(KSS)[14]评价膝关节功能,采用疼痛视觉模拟评分(VAS)[15]评价膝关节疼痛程度。
1.5. 统计学方法
采用 SPSS13.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;试验组 PRP 注射治疗前后比较采用重复测量方差分析,两两比较采用配对 t 检验;检验水准取双侧 α=0.05。
2. 结果
PRP 注射治疗过程中,试验组患者均未出现膝关节红肿、发热等局部感染及其他不适症状。患者均获随访,随访时间 12~15 个月,平均 13.5 个月。PRP 注射治疗后各时间点 VAS 评分均较术前显著降低,KSS 评分较术前显著增加,比较差异有统计学意义(P<0.05);治疗后各时间点间比较,差异无统计学意义(P>0.05)。见表 1。
表 1.
Comparison of VAS score and KSS score between at pre- and post-injection in trial group (n=30,
 )
)
试验组治疗前后 VAS 及 KSS 评分比较(n=30,
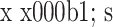 )
)
| 时间
Time |
VAS 评分
VAS score |
KSS 评分
KSS score |
|
#与注射前比较 P<0.05
# Compared with the value before injection, P<0.05 | ||
| 治疗前
Before injection |
6.8±1.6 | 57.4±8.9 |
| 治疗后 1 个月
One month after injection |
3.6±1.4# | 90.2±8.9# |
| 治疗后 3 个月
Three months after injection |
3.8±1.7# | 89.9±8.9# |
| 治疗后 6 个月
Six months after injection |
3.9±1.6# | 89.5±8.7# |
| 治疗后 12 个月
Twelve months after injection |
3.9±1.8# | 88.9±9.0# |
| 统计值
Statistic |
F=19.750
P= 0.000 |
F=74.124
P= 0.000 |
对照组血浆 IL-17 含量为(2.4±1.7)pg/mL。与对照组比较,试验组 PRP 治疗前后血浆 IL-17 含量显著增高,比较差异均有统计学意义(P<0.05)。试验组 PRP 治疗后各时间点血浆及关节滑液 IL-17 含量均较治疗前显著降低(P<0.05);治疗后各时间点血浆及关节滑液 IL-17 比较差异无统计学意义(P>0.05)。见表 2。
表 2.
Comparison of IL-17 levels in venous plasma and synovial fluid between at pre- and post-injection in trial group (n=30, pg/mL,
 )
)
试验组治疗前后血浆及关节滑液 IL-17 含量比较(n=30,pg/mL,
 )
)
| 时间
Time |
血浆
Venous plasma |
关节滑液
Synovial fluid |
|
#与注射前比较 P<0.05
# Compared with the value before injection, P<0.05 | ||
| 治疗前
Before injection |
6.5±1.8 | 7.3±1.5 |
| 治疗后 1 个月
One month after injection |
4.3±1.7# | 5.4±1.8# |
| 治疗后 3 个月
Three months after injection |
4.6±1.6# | 5.6±1.7# |
| 治疗后 6 个月
Six months after injection |
4.8±1.5# | 5.7±1.8# |
| 治疗后 12 个月
Twelve months after injection |
4.8±1.7# | 5.8±1.6# |
| 统计值
Statistic |
F=9.790
P=0.000 |
F=6.458
P=0.000 |
3. 讨论
研究表明,OA 患者 IL-17 水平显著高于健康人群[2, 16-18]。在 OA 发生过程中 IL-17 可针对软骨细胞和滑膜成纤维细胞膜表面的抗原发生直接细胞免疫应答效应[19-20],上调软骨细胞及滑膜成纤维细胞中基质金属蛋白酶的表达,而后者是软骨降解的潜在物质[19]。IL-17 还可增强关节软骨细胞一氧化氮合酶表达,诱导关节软骨的破坏[21]。最近临床研究表明,IL-17 可作为一种生物学标志物反映膝关节 OA 患者的疼痛程度[5]。
以往对于膝关节 OA 采用 PRP 关节腔注射治疗的相关报道多集中于对其临床疗效的评估,基础研究相对较少[9, 11, 22-25],PRP 注射后患者机体内相关炎性细胞因子的水平变化罕见相关报道。本研究中,我们对膝关节 OA 患者PRP 注射前后的血浆和关节滑液中 IL-17 水平变化进行了检测。结果显示,膝关节 OA 患者在接受 PRP 关节腔注射治疗 1 个月后血浆及关节滑液 IL-17 含量较治疗前显著降低(P<0.05),但仍高于正常水平;PRP 治疗后 12 个月以内 IL-17 水平比较,差异无统计学意义(P>0.05)。临床随访发现,患者 PRP 关节腔注射治疗后 1 个月 VAS 评分及 KSS 评分较治疗前显著改善,直至治疗后 12 个月未见疼痛加重及功能丢失情况。表明 PRP 注射治疗可显著改善膝关节 OA 患者的疼痛症状和关节功能,并可在一定程度上降低患者体内 IL-17 水平,但不能使这一细胞因子恢复至正常水平。本研究提示 PRP 注射治疗具有改善 OA 患者机体生物学环境的效果,但不能逆转 OA 的病理过程。因此,下一步需要研究将该治疗方法与其他治疗方法联合,以提升治疗膝关节 OA 效果。
另外,本研究存在一定局限性。首先,本研究为一项单中心研究,样本量少,需大样本、多中心前瞻性随机对照研究验证研究结论可靠性。其次,与 OA 相关的炎性因子很多,本研究仅检测了血浆和关节滑液中的 IL-17 水平,不能完全代表其他因子水平。最后,本研究仅评价了关节腔 PRP 注射 1 个疗程后 1 年的疗效,其多疗程及远期疗效需进一步研究考察。
References
- 1.Cooper BG, Stewart RC, Burstein D, et al A tissue-penetrating double network restores the mechanical properties of degenerated articular cartilage. Angew Chem Int Ed Engl. 2016;55(13):4226–4230. doi: 10.1002/anie.201511767. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Honsawek S, Deepaisarnsakul B, Tanavalee A, et al Association of the IL-6 -174G/C gene polymorphism with knee osteoarthritis in a Thai population. Genet Mol Res. 2011;10(3):1674–1680. doi: 10.4238/vol10-3gmr1161. [DOI] [PubMed] [Google Scholar]
- 3.Hulin-Curtis SL, Bidwell JL, Perry MJ Evaluation of IL18 and IL18R1 polymorphisms: genetic susceptibility to knee osteoar-thritis. Int J Immunogenet. 2012;39(2):106–109. doi: 10.1111/j.1744-313X.2011.01060.x. [DOI] [PubMed] [Google Scholar]
- 4.张海森, 白玉明, 靳胜利, 等 白细胞介素-17 基因多态性与骨关节炎易感性之间的相关性研究. 中华骨科杂志. 2016;36(22):1450–1455. [Google Scholar]
- 5.张海森, 白玉明, 刘畅, 等 血清及滑液白介素-17 水平与膝骨关节炎退变及膝痛程度的相关性研究. 中国医药导报. 2016;13(33):84–87. [Google Scholar]
- 6.Kan J, Mishima S, Kashiwakura J, et al Interleukin-17A expression in human synovial mast cells in rheumatoid arthritis and osteoarthritis. Allergol Int. 2016;65 Suppl:S11–S16. doi: 10.1016/j.alit.2016.04.007. [DOI] [PubMed] [Google Scholar]
- 7.Sadeghi-Ataabadi M, Mostafavi-Pour Z, Vojdani Z, et al Fabrication and characterization of platelet-rich plasma scaffolds for tissue engineering applications. Mater Sci Eng C Mater Biol Appl. 2017;71:372–380. doi: 10.1016/j.msec.2016.10.001. [DOI] [PubMed] [Google Scholar]
- 8.Duymus TM, Mutlu S, Dernek B, et al Choice of intra-articular injection in treatment of knee osteoarthritis: platelet-rich plasma, hyaluronic acid or ozone options. Knee Surg Sports Traumatol Arthrosc. 2017;25(2):485–492. doi: 10.1007/s00167-016-4110-5. [DOI] [PubMed] [Google Scholar]
- 9.Shen L, Yuan T, Chen S, et al The temporal effect of platelet-rich plasma on pain and physical function in the treatment of knee osteoarthritis: systematic review and meta-analysis of randomized controlled trials. J Orthop Surg Res. 2017;12(1):16. doi: 10.1186/s13018-017-0521-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Montañezheredia E, Irízar S, Huertas PJ, et al Intra-articular injections of platelet-rich plasma versus hyaluronic acid in the treatment of osteoarthritic knee pain: A randomized clinical trial in the context of the spanish national health care system. Int J Mol Sci. 2016;17(7):1064. doi: 10.3390/ijms17071064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Repetto I, Biti B, Cerruti P, et al Conservative Treatment of Ankle Osteoarthritis: Can Platelet-Rich Plasma Effectively Postpone Surgery? J Foot Ankle Surg. 2017;56(2):362–365. doi: 10.1053/j.jfas.2016.11.015. [DOI] [PubMed] [Google Scholar]
- 12.van Oudenaarde K, Jobke B, Oostveen AC, et al Predictive value of MRI features for development of radiographic osteoarthritis in a cohort of participants with pre-radiographic knee osteoarthritis-the CHECK study. Rheumatology (Oxford) 2017;56(1):113–120. doi: 10.1093/rheumatology/kew368. [DOI] [PubMed] [Google Scholar]
- 13.Altman RD Criteria for the classification of osteoarthritis of the knee and hip. Scand J Rheumatol Suppl. 1987;65:31–39. doi: 10.3109/03009748709102175. [DOI] [PubMed] [Google Scholar]
- 14.Silva AL, Demange MK, Gobbi RG, et al Translation and Validation of the Knee Society Score-KSS for Brazilian Portuguese. Acta Ortop Bras. 2012;20(1):25–30. doi: 10.1590/S1413-78522012000100005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Karabis A, Nikolakopoulos S, Pandhi S, et al High correlation of VAS pain scores after 2 and 6 weeks of treatment with VAS pain scores at 12 weeks in randomised controlled trials in rheumatoid arthritis and osteoarthritis: meta-analysis and implications. Arthritis Res Ther. 2016;18(1):1–7. doi: 10.1186/s13075-016-0972-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Bondeson J, Wainwright SD, Lauder S, et al The role of synovial macrophages and macrophage-produced cytokines in driving aggrecanases, matrix metalloproteinases, and other destructive and inflammatory responses in osteoarthritis. Arthritis Res Ther. 2006;8(6):R187. doi: 10.1186/ar2099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Wu X, Kondragunta V, Kornman KS, et al IL-1 receptor antagonist gene as a predictive biomarker of progression of knee osteoarthritis in a population cohort. Osteoarthritis Cartilage. 2013;21(7):930–938. doi: 10.1016/j.joca.2013.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Chen L, Li DQ, Zhong J, et al IL-17RA aptamer-mediated repression of IL-6 inhibits synovium inflammation in a murine model of osteoarthritis. Osteoarthritis Cartilage. 2011;19(6):711–718. doi: 10.1016/j.joca.2011.01.018. [DOI] [PubMed] [Google Scholar]
- 19.Wang K, Xu JH, Cai JY, et al Serum levels of interleukin-17 and adiponectin are associated with infrapatellar fat pad volume and signal intensity alteration in patients with knee osteoarthritis. Arthritis Res Ther. 2016;18(1):193. doi: 10.1186/s13075-016-1088-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Deligne C, Casulli S, Pigenet A, et al Differential expression of interleukin-17 and interleukin-22 in inflamed and non-inflamed synovium from osteoarthritis patients. Osteoarthritis Cartilage. 2015;23(11):1843–1852. doi: 10.1016/j.joca.2014.12.007. [DOI] [PubMed] [Google Scholar]
- 21.Wang K, Xu J, Cai J, et al Serum levels of resistin and interleukin-17 are associated with increased cartilage defects and bone marrow lesions in patients with knee osteoarthritis. Mod Rheumatol. 2017;27(2):339–344. doi: 10.1080/14397595.2016.1205777. [DOI] [PubMed] [Google Scholar]
- 22.翟文亮, 周亮, 刘晖, 等 富血小板血浆与透明质酸钠治疗膝关节骨关节炎的临床观察. 中华关节外科杂志(电子版) 2017;11(1):90–93. [Google Scholar]
- 23.刘步云, 孙育良, 何本祥, 等 关节腔注射富血小板血浆与玻璃酸钠治疗膝关节骨关节炎的疗效比较. 实用骨科杂志. 2017;23(1):71–73. [Google Scholar]
- 24.冯晓林, 牟奎, 王建春, 等 富血小板血浆用于膝关节骨关节炎的临床研究. 中华实验外科杂志. 2016;33(12):2792–2793. [Google Scholar]
- 25.丁权威, 吕帅洁, 沈兴潮, 等 富血小板血浆联合透明质酸钠关节内注射治疗膝骨关节炎的前瞻性随机对照研究. 上海医药. 2017;38(5):25–28, 40. [Google Scholar]


