Abstract
目的
通过早期和晚期应用淫羊藿苷(icariin,ICA)治疗小鼠骨关节炎(osteoarthritis,OA),观察 ICA 对小鼠血清骨代谢标志物以及软骨和软骨下骨组织形态学的影响。
方法
取 80 只 8 周龄雄性 C57BL/6J 小鼠,随机分为 8 组,每组 10 只,分别为假手术/早期生理盐水组(A 组)、假手术/早期 ICA 组(B 组)、前交叉韧带切断术(anterior cruciate ligament transaction,ACLT)/早期生理盐水组(C 组)、ACLT/早期 ICA 组(D 组)、假手术/晚期生理盐水组(E 组)、假手术/晚期 ICA 组(F 组)、ACLT/晚期生理盐水组(G 组)、ACLT/晚期 ICA 组(H 组)。各组小鼠对应给予 ACLT 或单纯打开关节囊处理后,B、D 组于术后第 1 天开始,F、H 组于第 4 周开始,每天采用灌胃方式给予小鼠 ICA(10 mg/kg)至第 8 周;A、C 组及 E、G 组于对应相同时间点给予相同体积生理盐水。于术后第 8 周收集小鼠全血制备血清,采用 ELISA 法测定血清中骨代谢标志物及细胞因子的含量,包括Ⅰ型胶原 C 末端肽(C-telopeptide of type Ⅰ collagen,CTX)、骨钙素(osteocalcin,OC)、IL-6、TNF-α、IL-1β。同时切取膝关节组织行阿辛蓝/苏木精-酸性橙 G 染色,观察软骨及软骨下骨形态改变,并进行骨关节炎国际研究学会(OARSI)评分。
结果
早期给药组(A、B、C、D 组)间比较:与 A、B 组相比,C 组 CTX、OC 含量显著降低(P<0.05),IL-6、TNF-α、IL-1β 含量升高(P<0.05),OARSI 评分显著升高(P<0.05);与 C 组相比,D 组 CTX、OC 含量升高(P<0.05),IL-6 含量显著降低(P<0.05),TNF-α、IL-1β 含量差异无统计学意义(P>0.05),OARSI 评分降低(P<0.05),组织学观察显示胫骨软骨缺失程度明显改善。晚期给药组(E、F、G、H 组)间比较:与 E、F 组比较,G 组 CTX、OC 含量显著降低(P<0.05),IL-6、TNF-α、IL-1β 含量升高(P<0.05),OARSI 评分显著升高(P<0.05);与 G 组比较,H 组 CTX含量升高(P<0.05),OC、IL-6、TNF-α、IL-1β 含量差异无统计学意义(P>0.05),OARSI 评分无明显变化(P>0.05),组织学观察显示胫骨软骨缺失程度相似。
结论
ICA 对透明软骨、钙化软骨及软骨下骨均有保护作用,并且能在一定程度上改善 OA 软骨下骨的骨重建,且 ICA 对 OA 早期干预作用更明显。
Keywords: 淫羊藿苷, 骨关节炎, 软骨下骨, 骨重建, 小鼠
Abstract
Objective
To investigate the effects of icariin (ICA) on serum bone turnover markers expressions and histological changes of cartilage and subchondral bone in mouse osteoarthritis (OA) model.
Methods
Eighty 8-week-old male C57BL/6J mouse were randomly divided into 8 groups (n=10). The OA model was established by anterior cruciate ligament transaction (ACLT). Group A: sham operation/early-stage normal saline administration; group B: sham operation/early-stage ICA administration; group C: ACLT/early-stage normal saline administration; group D: ACLT/early-stage ICA administration; group E: sham operation/late-stage normal saline administration; group F: sham operation/late-stage ICA administration; group G: ACLT/late-stage normal saline administration; group H: ACLT/late-stage ICA administration. Each animal received either ACLT or simply opening joint capsule, respectively. For groups B and D, ICA was given by gavage [10 mg/(kg·day)] on the first day after ACLT. For groups F and H, ICA was given with the same volume at 4 weeks after operation. The blood serum of the mouse was collected and prepared at 8 weeks after operation. Serum bone turnover markers and cytokines, including C-telopeptide of type I collagen (CTX), osteocalcin (OC), interleukin 6 (IL-6), tumor necrosis factor α (TNF-α), and IL-1β, were measured by ELISA. Tissue samples from the knee were stained by alcian blue/hematoxylin & orange G (AB/H&OG). Histological changes of cartilage and subchondral bone were observed and evaluated by Osteoarthritis Research Society International (OARSI) scoring system.
Results
Comparison between each group with early-stage administration (groups A, B, C, and D): Compared with groups A and B, the levels of CTX and OC in group C were significantly reduced (P<0.05); the levels of IL-6, TNF-α, and IL-1β and OARSI score was significantly increased (P<0.05). Compared with group C, the levels of CTX and OC in group D were significantly increased (P<0.05); the level of IL-6 was significantly reduced (P<0.05); the levels of TNF-α and IL-1β were not changed (P>0.05), and OARSI score was significantly reduced (P<0.05). Histological observation showed that the tibial cartilage loss was significantly improved. Comparison between each group with late-stage administration (groups E, F, G, and H): Compared with groups E and F, the levels of CTX and OC in group G were significantly reduced (P<0.05); the levels of IL-6, TNF-α, and IL-1β and OARSI score were significantly increased (P<0.05). Compared with group G, the level of CTX in group H were increased (P<0.05); the levels of OC, IL-6, TNF-α, and IL-1β and OARSI score were not changed (P>0.05). Histological observation showed that the tibial cartilage loss had no changes after late-stage ICA administration.
Conclusion
ICA plays protective effects on subchondral bone, hyaline, and calcified cartilage. Meanwhile, ICA can improve bone remodeling in subchondral bone of OA to some extent. The consistent changes of serum bone markers and pathological morphology suggest that early intervention of ICA on OA is more effective.
Keywords: Icariin, osteoarthritis, subchondral bone, bone remodeling, mouse
一般认为,软骨退变是骨关节炎(osteoarthritis,OA)的特征性表现。但近年研究发现,软骨下骨改变也是 OA 病变重要方面[1-3],而且软骨下骨结构与生物力学性能的改变可以促使软骨退变[2-3]。因此,有效控制软骨下骨代谢和骨重塑速度,有望为 OA 提供一种新治疗方法[1-3]。基于以上认识,作用于骨重建过程的中药可以作为 OA 防治的候选药物。中药组分淫羊藿苷(icariin,ICA)能通过改善骨重建达到治疗骨质疏松的目的,本研究将分别于小鼠 OA 早期和晚期给予 ICA 治疗,观察血清中与膝关节 OA 诊断和疗效评价相关的细胞因子、代谢产物表达[4-5]变化,同时观察软骨和软骨下骨组织形态学改变,从而初步探讨 ICA 对 OA 的治疗效果。报告如下。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
80 只 8 周龄雄性 C57BL/6J 小鼠,体质量(21±1)g,购于上海西普尔-必凯动物实验有限公司。ICA(南京泽朗医药科技有限公司),用 DMSO 溶解后制成浓缩储存液,灌胃前采用生理盐水稀释。
BCA 蛋白浓度测定试剂盒(PIERCE 公司,美国);Ⅰ型胶原 C 末端肽(C-telopeptide of typeⅠcollagen,CTX)、骨钙素(osteocalcin,OC)ELISA 试剂盒(Biomedical Technologies 公司,美国);IL-6、TNF-α ELISA 试剂盒(Abcam 公司,英国);IL-1β ELISA 试剂盒(R&D system 公司,美国)。荧光显微镜(Leica 公司,德国)。
1.2. 实验分组及方法
1.2.1 实验分组 将 80 只小鼠随机分为 8 组,每组 10 只,分别为假手术/早期生理盐水组(A 组)、假手术/早期 ICA 组(B 组)、前交叉韧带切断术(anterior cruciate ligament transaction,ACLT)/早期生理盐水组(C 组)、ACLT/早期 ICA 组(D 组)、假手术/晚期生理盐水组(E 组)、假手术/晚期 ICA 组(F 组)、ACLT/晚期生理盐水组(G 组)、ACLT/晚期 ICA 组(H 组)。
1.2.2 动物模型制备 C、D、G、H 组小鼠行 ACLT,制备 OA 模型。具体步骤:采用 10% 水合氯醛(4 mL/kg)腹腔注射麻醉后,小鼠仰卧并固定于手术台上,常规消毒铺巾。沿右膝关节髌骨外侧切口,依次切开皮肤、皮下各层,钝性分离肌肉组织,直至切开关节腔。向侧方牵开髌韧带,屈膝 90°,显露前交叉韧带并切断,止血后生理盐水充分冲洗关节腔,依次缝合各层组织。A、B、E、F 组除术中仅打开小鼠膝关节囊,不切断前交叉韧带外,其余操作与其他组一致。各组术后连续 3 d 肌肉注射青霉素 2 万 U 预防感染,自由进食饮水,不行任何固定,分笼饲养。
1.2.3 给药方法 B、D 组于术后第 1 天开始,每天采用灌胃方式给予 ICA(10 mg/kg)至第 8 周;A、C 组于相同时间点给予相同体积生理盐水。F、H 组于术后第 4 周开始每天采用灌胃方式给予 ICA(10 mg/kg)至第 8 周;E、G 组于相同时间点给予相同体积生理盐水。
1.3. 观测指标
1.3.1 血清学指标测量 术后第 8 周各组小鼠断颈处死,用注射器从心脏取血 1 mL,置于 1.5 mL 离心管(不含抗凝剂),室温静置 30 min,然后室温下以 1 500×g 离心 10 min,取上层血清,采用 ELISA 法测量 CTX、OC、IL-6、TNF-α、IL-1β 含量。
1.3.2 组织学观察 切取小鼠膝关节上、下各 2 cm 区域组织,去除皮肤,置于 4% 多聚甲醛液中,4℃ 固定 24 h 后,剔除周围软组织及韧带,PBS 浸洗,流水冲洗 2 h,10%EDTA 液加微波脱钙 2 周,流水冲洗 24 h,截取胫骨部分并修整组织块后石蜡包埋,作矢状面不连续切片,片厚 5 μm,行阿辛蓝/苏木精-酸性橙 G 染色。具体步骤:将切片依次浸入二甲苯和梯度乙醇脱蜡至水;自来水冲洗;置于 1% 盐酸乙醇 30 s,沥干;置于阿辛蓝/苏木精中和 30 min;去离子水充分清洗;置于 0.5% 氨溶液 15 s;去离子水充分清洗;置于 95% 乙醇 1 min,沥干;置于酸性橙 G 中 1.5 min;95% 乙醇清洗 3 次;脱水,二甲苯透明,中性树脂封片。切片置于显微镜下观察。采用双盲法参照骨关节炎国际研究学会(OARSI)评分标准,从基质染色、软骨组织结构、软骨细胞簇集、潮线完整性四方面评分[6],以评价软骨退变程度。总分 24 分,评分越高,表明关节软骨破坏越严重。
1.4. 统计学方法
采用 SPSS 统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用 Tukey 检验;检验水准 α=0.05。
2. 结果
2.1. 血清学检测指标
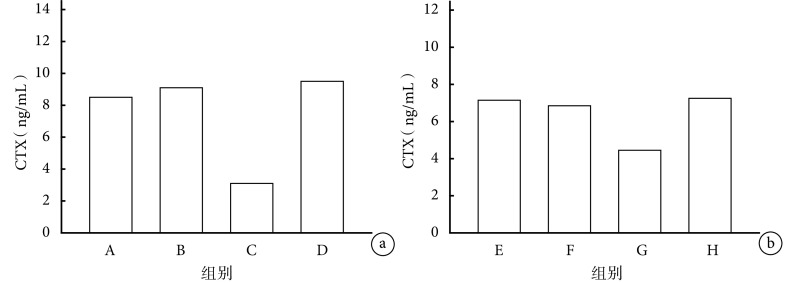
2.1.1 CTX 早期给药各组间比较:C 组与 A、B 组相比,血清 CTX 含量降低(P<0.05);D 组与 C 组相比,血清 CTX 含量升高(P<0.05)。见图 1a。
图 1.
Comparison of serum CTX content in mice between groups
各组小鼠血清 CTX 含量比较
a. 早期给药各组间比较;b. 晚期给药各组间比较
a. Comparison between groups with early-stage administration; b. Comparison between groups with late-stage administration
晚期给药各组间比较:G 组与 E、F 组相比,血清 CTX 含量降低(P<0.05);H 组与 G 组相比,血清 CTX 含量升高(P<0.05)。见图 1b。
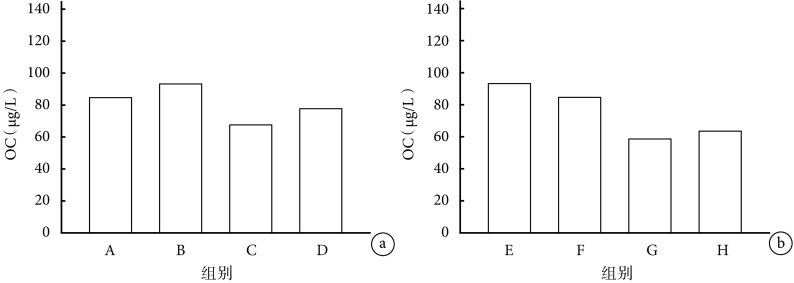
2.1.2 OC 早期给药各组间比较:C 组与 A、B 组相比,血清 OC 含量降低(P<0.05);D 组与 C 组相比,血清 OC 含量升高(P<0.05)。见图 2a。
图 2.
Comparison of serum OC content in mice between groups
各组小鼠血清 OC 含量比较
a. 早期给药各组间比较;b. 晚期给药各组间比较
a. Comparison between groups with early-stage administration; b. Comparison between groups with late-stage administration
晚期给药各组间比较:G 组与 E、F 组相比,血清 OC 含量降低(P<0.05);G、H 组比较差异无统计学意义(P>0.05)。见图 2b。
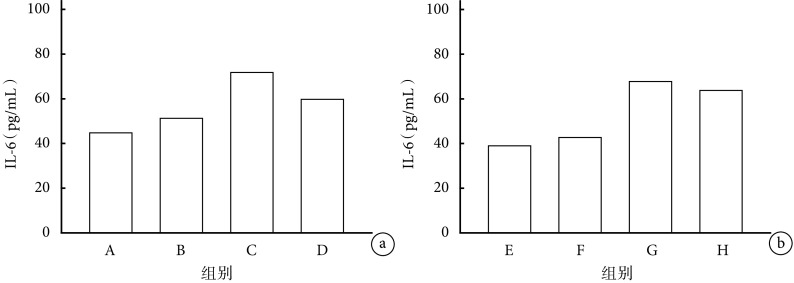
2.1.3 IL-6 早期给药各组间比较:C 组与 A、B 组相比,血清 IL-6 含量升高(P<0.05);D 组与 C 组相比,血清 IL-6 含量降低(P<0.05)。见图 3a。
图 3.
Comparison of serum IL-6 content in mice between groups
各组小鼠血清 IL-6 含量比较
a. 早期给药各组间比较;b. 晚期给药各组间比较
a. Comparison between groups with early-stage administration; b. Comparison between groups with late-stage administration
晚期给药各组间比较:G 组与 E、F 组相比,血清 IL-6 含量升高(P<0.05);G、H 组比较差异无统计学意义(P>0.05)。见图 3b。
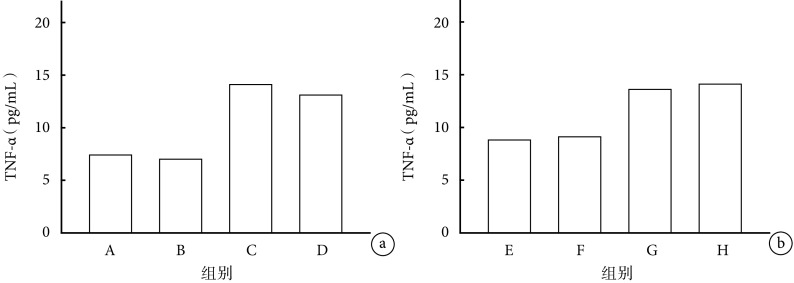
2.1.4 TNF-α 早期给药各组间比较:C 组与 A、B 组相比,血清 TNF-α 含量升高(P<0.05);C、D 组比较差异无统计学意义(P>0.05)。见图 4a。
图 4.
Comparison of serum TNF-α content in mice between groups
各组小鼠血清 TNF-α 含量比较
a. 早期给药各组间比较;b. 晚期给药各组间比较
a. Comparison between groups with early-stage administration; b. Comparison between groups with late-stage administration
晚期给药各组间比较:G 组与 E、F 组相比,TNF-α 含量升高(P<0.05),G、H 组比较差异无统计学意义(P>0.05)。见图 4b。
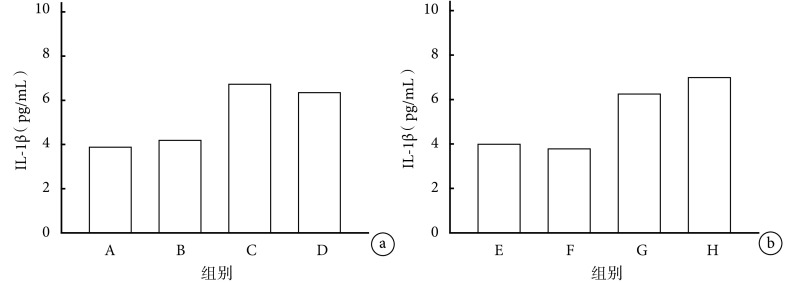
2.1.5 IL-1β 早期给药各组间比较:C 组与 A、B 组相比,IL-1β 含量升高(P<0.05),C、D 组比较差异无统计学意义(P>0.05)。见图 5a。
图 5.
Comparison of serum IL-1β content in mice between groups
各组小鼠血清 IL-1β 含量比较
a. 早期给药各组间比较;b. 晚期给药各组间比较
a. Comparison between groups with early-stage administration; b. Comparison between groups with late-stage administration
晚期给药各组间比较:G 组与 E、F 组相比,IL-1β 含量升高(P<0.05),G、H 组比较差异无统计学意义(P>0.05)。见图 5 b。
2.2. 组织学观察
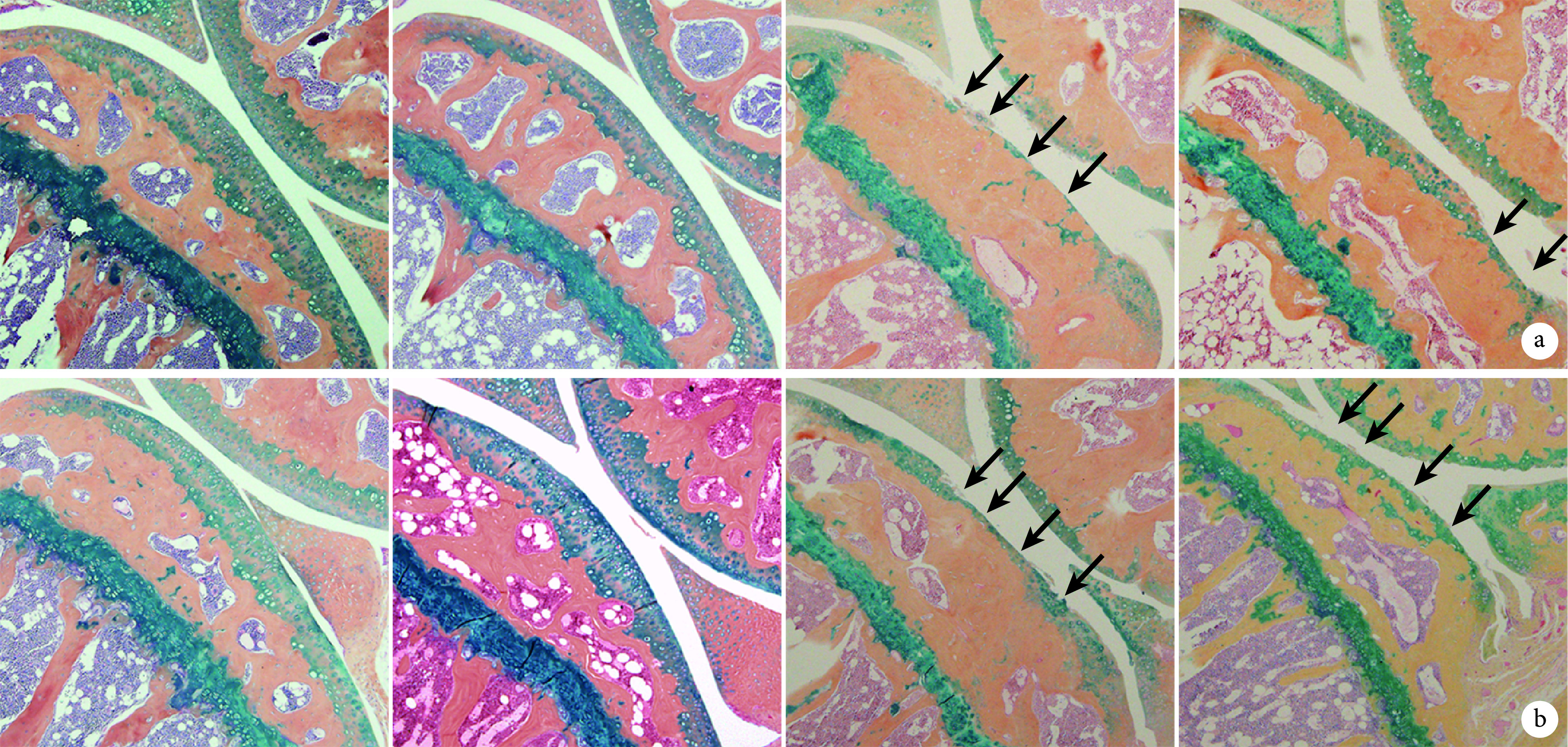
2.2.1 镜下观察 术后第 8 周,C、G 组与对应的 A、B 组及 E、F 组相比,小鼠胫骨软骨缺失明显,小鼠胫骨平台透明软骨变薄甚至消失;钙化软骨层厚度减小甚至全层消失;潮线呈现不规则延伸,模糊甚至消失;软骨下骨广泛裸露,软骨下皮质骨板变厚,骨小梁形状纤细,数量减少,呈现晚期 OA 表现。
与 C 组相比,D 组胫骨软骨缺失明显改善;与 G 组相比,H 组胫骨软骨的缺失程度相仿。见图 6。
图 6.
Histological observation of tibial cartilage in each group (AB/H&OG staining×40)
各组组织学观察(阿辛蓝/苏木精-酸性橙 G 染色×40)
箭头示胫骨软骨缺失 a. 早期给药组 从左至右分别为 A、B、C、D 组;b. 晚期给药组 从左至右分别为 E、F、G、H 组
Arrows indicated tibial cartilage loss a. Groups with early-stage administration From left to right for groups A, B, C, and D, respectively; b. Groups with late-stage administrationFrom left to right for groups E, F, G, and H, respectively
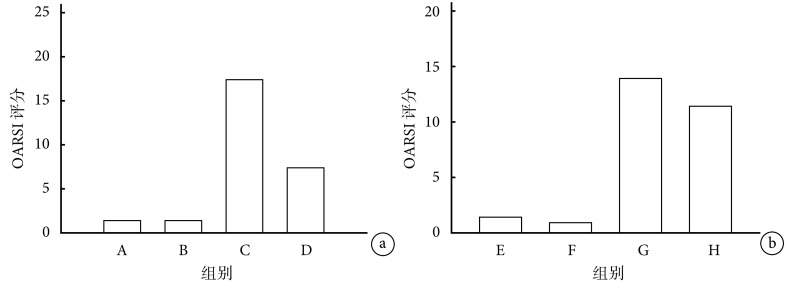
2.2.2 OARSI 评分 早期给药各组间比较:C 组与 A、B 组相比,OARSI 评分显著升高(P<0.05);D 组与 C 组相比,OARSI 评分显著降低(P<0.05)。见图 7a。
图 7.
Comparison of histological changes of tibial cartilage and subchondral bone in each group
各组小鼠胫骨软骨和软骨下骨组织学评分比较
a. 早期给药各组间比较;b. 晚期给药各组间比较
a. Comparison between groups with early-stage administration; b. Comparison between groups with late-stage administration
晚期给药各组间比较:G 组与 E、F 组相比,OARSI 评分显著升高(P<0.05);G、H 组比较差异无统计学意义(P>0.05)。见图 7b。
3. 讨论
近年来,研究证实软骨下骨与 OA 进展紧密关联,软骨下骨异常可以加速软骨退变,而改善软骨下骨异常可减缓软骨退变[2-3]。有研究表明,ICA 具有激素样作用,能促进骨髓干细胞增殖和成骨分化[7],促进成骨细胞矿化[8],抑制破骨细胞功能和分化[9]。ICA 通过改善骨重建防治骨质疏松的作用已经得到公认,但其能否通过调节软骨下骨骨重建治疗 OA 目前尚缺乏相关基础研究。本研究旨在通过观察 OA 早期和晚期给予 ICA 治疗后,血清中多种诊断和评价膝关节 OA 疗效的细胞因子和代谢产物的表达变化,以及软骨和软骨下骨病理形态学的改变,初步探讨 ICA 对 OA 的治疗作用和效果。
小鼠的关节组织结构与人类接近,其 OA 模型软骨生化指标与人类较一致。在形态学方面,鼠软骨细胞的凋亡方式与人类相似,鼠模型关节软骨退变的组织学特征与人类 OA 相似[10]。因此,为研究药物 ICA 防治 OA 的疗效,本实验选用了小鼠模型。
OA 早期骨重建活跃,但晚期骨转换减少,表现为骨吸收与骨形成之间的偶联机制失去平衡,骨吸收减弱而骨形成相对增加,最终软骨下骨板骨质硬化[3]。大量研究发现,OA 患者中存在软骨细胞外基质的合成与降解失衡,其代谢产物可以作为生物标记物用于早期反映关节软骨的新陈代谢改变,并显示疾病活动[11],如 CTX 和 OC。CTX 是Ⅰ型胶原的代谢产物,是反映骨转换特别是骨吸收的特异而灵敏的指标[12]。OC 是成骨细胞的特异性产物,能反映成骨细胞的活性和骨转换水平,并能反映患者对治疗的反应,已成为临床代谢性骨病的重要检测指标[13]。本研究血清学检测结果显示,ACLT 术后第 8 周 C、G 组血清 CTX 和 OC 含量分别与 A、E 组相比显著降低,提示软骨下骨骨转换率下降,符合 OA 晚期的骨重塑病理变化。ICA 早期治疗后,D 组血清 CTX 和 OC 含量与 C 组比较均升高,说明经 ICA 治疗后软骨下骨骨重建活跃,骨转换率升高,提示软骨下骨可能是 ICA 的作用靶点。ICA 晚期治疗后,H 组与 G 组比较,血清骨吸收指标 CTX 含量升高,血清成骨指标 OC 含量无明显变化,提示 ICA 晚期治疗对增强软骨下骨骨转换的能力不如早期治疗。
近年研究认为,炎性反应也是OA重要的病理机制之一。血清中相关促炎和抗炎细胞因子的表达水平与 OA 的严重程度相关,可以作为临床诊断和评价 OA 疗效的参考指标[4-5, 14]。IL-6 是早期 OA 发生发展中重要的促炎因子,系统性抑制 IL-6 可以缓解大鼠 OA 的发生[15]。因此,IL-6 可以作为诊断和判断 OA 预后的新型标志物[16]。本研究血清学检测结果提示,ACLT 术后第 8 周 C、G 组血清 IL-6 含量分别与 A、E 组相比显著升高,提示 OA 的发生以及 OA 造模成功,并符合 OA 中晚期血清 IL-6 含量显著升高的特征[17]。ICA 早期治疗后,与 C 组相比,D 组 IL-6 含量下降,提示 ICA 对软骨具有保护作用。同时有研究表明在 OA 中晚期,关节间隙狭窄,软骨基质受到严重损伤,此时软骨细胞的分解及合成均相应增加。因此软骨细胞的代谢在此时最为活跃,导致血清 IL-6 水平最高[18]。所以,我们分析 ICA 对软骨的这种保护作用可能是通过改善软骨细胞代谢活动而产生的。但是 ICA 晚期治疗后,与 G 组比较,H 组 IL-6 含量变化无显著差异,提示 ICA 晚期治疗效果欠佳,与骨代谢指标结果一致。
在 OA 病变过程中,TNF-α 主要介导炎症对软骨进行直接损害,并可以影响 IL-6 的分泌;而 IL-1β 可以抑制软骨Ⅱ型胶原和蛋白聚糖的合成,并介导其他诸多炎性因子的表达。两者都能导致软骨细胞凋亡,是 OA 病理过程中的关键细胞因子[16, 19-20]。本研究血清学检测结果显示,OA 造模成功后第 8 周 C 组和 G 组血清 TNF-α 和 IL-1β 含量分别与 A、E 组相比显著升高,提示 OA 的发生和进展。但是,无论是早期给药还是晚期给药,D、H 组 TNF-α 和 IL-1β 含量分别与 C、G 组相比,均无显著差异。TNF-α 和 IL-1β 的含量是否与 OA 病情的严重程度成正相关,目前相关研究结果仍然存有很大争议[16]。我们认为,血清 TNF-α 和 IL-1β 的水平与 OA 软骨的破坏程度可能不存在相关性,这可能与血清 TNF-α 和 IL-1β 的来源广泛有关,并不能据此否定 ICA 的软骨保护作用。
软骨基质内蛋白多糖耗尽导致软骨的缺失是 OA 的主要特征。近期研究发现,ICA 通过 MAPK 信号通路可以抑制 SW1353 软骨肉瘤细胞基质金属蛋白酶的表达[21]。ICA 能在体外促进软骨细胞基因表达以及细胞外基质合成,因此对软骨形成可能有促进作用[22]。本研究组织形态学观察发现,早期给予 ICA 治疗后,与 C 组相比,D 组小鼠软骨缺失程度明显好转,提示 ICA 早期治疗能对软骨起到保护作用,并且与血清学改变一致。OARSI 评分系统是基于 OA 病变的病理进程,能在 OA 诊断之前明确关节软骨的改变,并明确 OA 临床治疗的评价终点标准,现已广泛应用于动物模型的评价[6]。本研究评分结果显示,ICA 早期给药后,与 C 组相比,D 组 OARSI 评分显著下降。但是,ICA 晚期给药后,与 G 组相比,H 组 OARSI 评分无显著变化。上述结果说明 ICA 早期治疗对 OA 有一定的防治作用,晚期治疗效果欠佳。
综上所述,我们初步研究发现,ICA 对 OA 的防治是全面的,其无论对透明软骨、钙化软骨还是软骨下骨均有一定程度保护作用,并且能在一定程度上改善 OA 软骨下骨的骨重建,提示 OA 软骨下骨亦是 ICA 的作用靶点。小鼠模型中的血清学和病理形态学的一致性改变提示 ICA 对 OA 早期干预作用更为明显。因此,我们认为 ICA 可能通过多种生长因子介导的信号通路,如 MAPK、Wnt 等信号通路,对小鼠胫骨软骨下骨骨髓基质干细胞或骨髓间充质干细胞成骨分化潜能、矿化能力和合成胶原蛋白能力产生影响[23-25]。但目前对于 ICA 改善 OA 骨重建的作用和机制尚不明确。深入研究 ICA 对 OA 骨重建的作用和机制,将为临床 OA 防治新药的开发提供理论基础,同时也有助于理解 OA 的发生和发展。
Funding Statement
复旦大学新进青年教师科研启动项目(20520131146)
New Young Teacher’s Research Initiative Project of Fudan University (20520131146)
References
- 1.Hügle T, Geurts J. What drives osteoarthritis?-synovial versus subchondral bone pathology. Rheumatology (Oxford), 2016. [Epub ahead of print]
- 2.Henrotin Y, Pesesse L, Sanchez C Subchondrol bone and osteosrthritis: biological and cellur aspects. Osteoporos Int. 2012;23 Suppl 8:S847–851. doi: 10.1007/s00198-012-2162-z. [DOI] [PubMed] [Google Scholar]
- 3.于德刚, 汤亭亭, 朱振安 骨关节炎软骨下骨改变及其作用研究进展. 国际骨科学杂志. 2015;36(3):172–178. [Google Scholar]
- 4.Daghestani HN, Kraus VB Inflammatory biomarkers in osteoarthritis. Osteoarthritis Cartilage. 2015;23(11):1890–1896. doi: 10.1016/j.joca.2015.02.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Imamura M, Ezquerro F, Marcon Alfieri F, et al Serum levels of pro-inflammatory cytokines in painful knee osteoarthritis and sensitization. Int J Inflam. 2015;2015:329792. doi: 10.1155/2015/329792. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Moskowitz RW Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis Cartilage. 2006;14(1):1–2. doi: 10.1016/j.joca.2005.08.015. [DOI] [PubMed] [Google Scholar]
- 7.Fan JJ, Cao LG, Wu T, et al The dose-effect of icariin on the proliferation and osteogenic differentiation of human bone mesenchymal stem cells. Molecules. 2011;16(12):10123–10133. doi: 10.3390/molecules161210123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ma HP, Ming LG, Ge BF, et al Icariin is more potent than genistein in promoting osteoblast differentiation and mineralization in vitro . J Cell Biochem. 2011;112(3):916–923. doi: 10.1002/jcb.23007. [DOI] [PubMed] [Google Scholar]
- 9.Hsieh TP, Sheu SY, Sun JS, et al Icariin inhibits osteoclast differentiation and bone resorption by suppression of MAPKs/NF-κB regulated HIF-1α and PGE (2) synthesis. Phytomedicine. 2011;18(2-3):176–185. doi: 10.1016/j.phymed.2010.04.003. [DOI] [PubMed] [Google Scholar]
- 10.翟吉良, 翁习生, 邱贵兴 骨关节炎动物模型的建立及选择. 中国矫形外科杂志. 2007;15(11):843–845. [Google Scholar]
- 11.Van Spil WE, Welsing PM, Bierma-Zeinstra SM, et al The ability of systemic biochemical markers to reflect presence, incidence, and progression of early-stage radiographic knee and hip osteoarthritis: data from CHECK. Osteoarthritis Cartilage. 2015;23(8):1388–1397. doi: 10.1016/j.joca.2015.03.023. [DOI] [PubMed] [Google Scholar]
- 12.Ishijima M, Kaneko H, Kaneko K The evolving role of biomarkers for osteoarthritis. Therapeutic Advances in Musculoskeletal Disease. 2014;6(4):144–153. doi: 10.1177/1759720X14541175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zoch ML, Clements TL, Riddle RC New insights into the biology of osteocalcin. Bone. 2016;82:42–49. doi: 10.1016/j.bone.2015.05.046. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Papalia R, Vadalà G, Torre G, et al The cytokinome in osteoarthritis, a new paradigm in diagnosis and prognosis of cartilage disease. J Biol Regul Homeost Agents. 2016;30(4 Suppl 1):77–83. [PubMed] [Google Scholar]
- 15.Latourte A, Cherifi C, Maillet J, et al Systemic inhibition of IL-6/Stat3 signalling protects against experimental osteoarthritis. Ann Rheum Dis. 2016;76(4):748–755. doi: 10.1136/annrheumdis-2016-209757. [DOI] [PubMed] [Google Scholar]
- 16.Mabey T, Honsawek S Cytokines as biochemical markers for knee osteoarthritis. World J Orthop. 2015;6(1):95–105. doi: 10.5312/wjo.v6.i1.95. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.石婷, 高戈, 闫祖炜, 等 兔实验性骨关节炎六种血清学生物标志物的变化. 细胞与分子免疫学杂志. 2015;31(12):1620–1623, 1628. [PubMed] [Google Scholar]
- 18.查振刚, 黄良任, 姚平, 等 膝骨关节炎患者血清 TNF-α 与 IL-6 水平及其临床意义. 广东医学. 2005;26(2):191–193. [Google Scholar]
- 19.Charlier E, Relic B, Deroyer C, et al Insights on Molecular Mechanisms of Chondrocytes Death in Osteoarthritis. Int J Mol Sci. 2016;17(12):2146. doi: 10.3390/ijms17122146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Hosseinzadeh A, Kamrava SK, Joghataei MT, et al Apoptosis signaling pathways in osteoarthritis and possible protective role of melatonin. J Pineal Res. 2016;61(4):411–425. doi: 10.1111/jpi.12362. [DOI] [PubMed] [Google Scholar]
- 21.Zeng L, Rong XF, Li RH, Wu XY Icariin inhibits MMP1, MMP3 and MMP13 expression through MAPK pathways in IL1β stimulated SW1353 chondrosarcoma cells. Mol Med Rep. 2017;15(5):2853–2858. doi: 10.3892/mmr.2017.6312. [DOI] [PubMed] [Google Scholar]
- 22.Zhang L, Zhang X, Li KF, et al Icariin promotes extracellular matrix synthesis and gene expression of chondrocytes in vitro. Phytother Res. 2012;26(9):1385–1392. doi: 10.1002/ptr.3733. [DOI] [PubMed] [Google Scholar]
- 23.Fu S, Yang L, Hong H, et al Wnt/β-catenin signaling is involved in the Icariin induced proliferation of bone marrow mesenchymal stem cells. J Tradit Chin Med. 2016;36(3):360–368. doi: 10.1016/s0254-6272(16)30050-4. [DOI] [PubMed] [Google Scholar]
- 24.Qin S, Zhou W, Liu S, et al Icariin stimulates the proliferation of rat bone mesenchymal stem cells via ERK and p38 MAPK signaling. Int J Clin Exp Med. 2015;8(5):7125–7133. [PMC free article] [PubMed] [Google Scholar]
- 25.Wu Y, Xia L, Zhou Y, et al Icariin induces osteogenic differentiation of bone mesenchymal stem cells in a MAPK-dependent manner. Cell Prolif. 2015;48(3):375–384. doi: 10.1111/cpr.12185. [DOI] [PMC free article] [PubMed] [Google Scholar]