Abstract
目的
系统评价艾曲泊帕治疗儿童免疫性血小板减少症(immune thrombocytopenia,ITP)的安全性及有效性。
方法
检索PubMed、Embase、Cochrane Library、维普数据库、中国知网、万方数据库,筛选艾曲泊帕治疗儿童ITP的文献,使用RevMan 5.3及R 3.6软件对所纳入研究进行Meta分析。
结果
共纳入11篇文献,其中随机对照研究2篇,队列研究9篇。9篇队列研究文献的Meta分析显示艾曲泊帕治疗儿童ITP的有效率约70%(95%CI:65%~76%),均未发生严重不良反应。2篇随机对照研究的Meta分析显示,艾曲泊帕组有效率高于安慰剂组(RR=2.64,95%CI:1.58~4.44,P<0.05),而不良事件及严重不良事件发生率与安慰剂组相比差异无统计学意义(P>0.05)。
结论
艾曲泊帕作为二线方案治疗儿童ITP有效,且安全性好。 引用格式:
Keywords: 免疫性血小板减少症, 艾曲泊帕, Meta分析, 有效性, 安全性, 儿童
Abstract
Objective
To systematically assess the efficacy and safety of eltrombopag in the treatment of children with immune thrombocytopenia (ITP).
Methods
PubMed, Embase, Cochrane Library, Weipu Data, CNKI, and Wanfang Data were searched for studies on eltrombopag used for the treatment of children with ITP. RevMan 5.3 and R version 3.6 were used to perform a Meta analysis of included studies.
Results
A total of 11 studies were included, with 2 randomized controlled trials and 9 cohort studies. The Meta analysis of the 9 cohort studies showed that eltrombopag had a response rate of about 70% (95%CI: 65%-76%) in the treatment of children with ITP, with no serious adverse events. The Meta analysis of the randomized controlled trials showed that the eltrombopag group had a higher response rate than the placebo group (RR=2.64, 95%CI: 1.58-4.44, P<0.05), while there was no significant difference in the incidence rates of adverse events and serious adverse events between the two groups (P>0.05).
Conclusions
Eltrombopag has good efficacy and safety as a second-line treatment regimen for children with ITP.
Keywords: Immune thrombocytopenia, Eltrombopag, Meta analysis, Efficacy, Safety, Child
免疫性血小板减少症(immune thrombocytopenia,ITP)是一种获得性自身免疫性疾病,以血小板减少及自发性出血为主要临床特点[1],是儿童时期最常见的出血性疾病之一。儿童ITP的年发病率达(4~5)/10万[2]。儿童ITP多表现为良性自限性,临床仅有约20%的ITP患儿发展为慢性[2-3]。儿童慢性ITP的治疗是当前临床研究的难点之一。目前儿童ITP的一线治疗主要包括静脉用免疫球蛋白和糖皮质激素治疗,均以减少血小板破坏为主,对部分ITP患儿疗效不佳;而传统的二线治疗方案,如脾切除术、大剂量激素、免疫抑制剂治疗等因存在较多不良反应导致其在儿童ITP的临床应用受限。艾曲泊帕作为一种口服的促血小板生成素受体激动剂(thrombopoietin receptor agonist,TPO-RA),主要作用为促进血小板产生,且临床应用方便,因而已作为儿童ITP的二线治疗[2,4-5]。目前,国内应用艾曲泊帕治疗儿童ITP的经验尚少,国外虽有关于艾曲泊帕治疗儿童ITP的相关临床研究,但多为样本量偏小的Ⅲ期临床试验[4-5],可能存在偏倚风险。因此,本文纳入目前已发表的艾曲泊帕治疗儿童ITP的随机对照研究(randomized controlled trial,RCT)及队列研究进行Meta分析,旨在通过循证医学方法评估艾曲泊帕治疗儿童ITP的疗效及安全性,为艾曲泊帕治疗儿童ITP提供临床证据。
1. 资料与方法
1.1. 文献纳入标准及排除标准
纳入标准:(1)研究对象为儿童;(2)使用艾曲泊帕治疗ITP;(3)研究类型为RCT或队列研究;(4)主要评估指标包括:有效率、完全缓解率、部分缓解率、出血事件发生率、不良事件发生率等;(5)已发表的中文及英文文献。
排除标准:(1)无法获取详细的原始资料;(2)治疗方案为艾曲泊帕与其他药物联合。
1.2. 文献检索
系统检索国内外相关文献,检索的数据库包括PubMed、Embase、Cochrane Library、维普数据库、中国知网、万方数据库。检索各数据库建库至2021年1月31日发表的文献。
英文数据库的检索词包括:“purpura,thrombocytopenic,idiopathic”“ITP”“thrombocytopenic purpura”“idiopathic thrombocytopenic purpura”“immune thrombocytopenic purpura”“immune thrombocytopenia”“eltrombopag”“SB497115”“SB-497115”。中文数据库的检索词为:免疫性血小板减少症、免疫性血小板减少性紫癜、特发性血小板减少性紫癜、艾曲泊帕、艾曲波帕。
1.3. 文献的筛选及资料提取
由本文的2位研究员独立进行文献检索和筛选,若筛选结果存在分歧则在本课题组内讨论解决。明确纳入文献后采用预先制定的Excel表格对文献的原始数据进行提取。原始资料的提取包括作者、发表年份、文献来源、样本量、药物剂量、观察时间、结局评估指标等。对于包含重复资料的文献,则纳入其中样本量较大的一篇。
1.4. 文献质量的评价
纳入的RCT质量评估方法参考Cochrane系统评价手册[6],文献质量评估采用RevMan 5.3软件进行。若所有评估标准均为低风险,则该研究发生偏倚风险小、质量高;若有一条及以上的评估标准被判定为高风险,则该研究发生偏倚的风险较大、质量低;否则,文献质量被判定为中等。队列研究的质量评估参考非随机对照试验方法学评价指标,其评价指标共8条,每条记0~2分,最高分为16分[7]。
1.5. 统计学分析
采用RevMan 5.3软件对纳入的RCT进行统计学分析。二分类变量资料分析结果采用相对危险度(relative risk,RR)结合95%可信区间(confidence interval,CI)进行描述。利用卡方检验评估各RCT研究之间的异质性,若I 2>50%、P<0.1,认为各研究之间异质性较高,采用随机效应模型进行Meta分析;相反,则采用固定效应模型进行分析。采用R 3.6软件对纳入的队列研究进行统计学分析。对于原始研究提供了具体人数或者阳性事件数量的结果进行统计学分析,结果以百分率表示,并结合95%CI进行描述。各研究之间的异质性判定标准同RCT研究。以P<0.05作为差异有统计学意义的判定标准。
2. 结果
2.1. 文献筛选结果
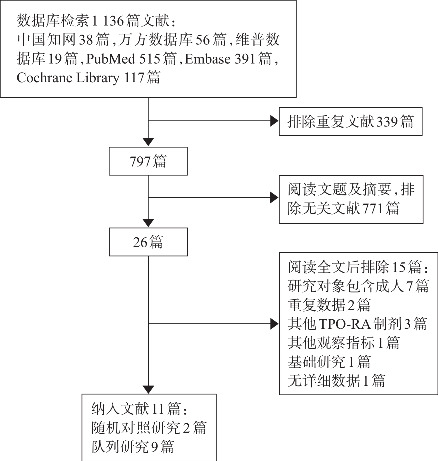
通过检索及筛选(图1),共纳入11篇文献,其中2篇为RCT[4-5],9篇为队列研究[8-16],仅1篇中文文献[16]。
图1. 文献的筛选流程.
2.2. 纳入文献的一般情况
所纳入的2篇RCT文献[4-5]均为多中心研究,均详细描述了随机方法、分配隐藏、盲法(参与者及观察者)、参与者退出的原因,且报道了全部研究结果,因此以上项目均为低风险。但这2项RCT均受到制药公司的资助,不能确定是否有发生其他偏倚的风险,因而2篇文献的整体质量为中等。这2篇RCT文献的主要结局指标均采用有效率进行描述。有效率定义为开始接受治疗后6周内血小板计数升至50×109/L及以上的患者比例。此外,这2篇RCT文献还报道了出血事件、不良事件及严重不良事件发生率及需要其他紧急治疗的ITP患儿人数。所纳入2篇RCT文献的一般情况见表1。
表1.
纳入文献的一般情况
| 研究 | 病例数 (男/女) | 年龄 (岁) | 病程 (年) |
血小板计数 (×109/L) |
艾曲泊帕剂量 (mg/d) | 不良事件 (例) | 研究类型 | 结局指标 | 质量等级/评分 |
|---|---|---|---|---|---|---|---|---|---|
| Grainger 2015[4] | 48/44 | 1~17 | >1 | <30 | 25~75 | 观察组51对照组21 |
随机对照 研究 |
PLT>50×109/L | 中等 |
| Bussel 2015[5] | 27/40 | 1~17 | >0.6 | <30 | 未报道 | 观察组36对照组20 |
随机对照 研究 |
PLT>50×109/L | 中等 |
| Giordano 2020[8] | 31/40 | 1~17 | 1~14 | 1~51 | 12.5~75 | 14 | 队列研究 | CR、PR | 12分 |
| Ramaswamy 2014[9] | 4/8 | 3~19 | 0.25~13 | 4~36 | 25~75 | 3 | 队列研究 | PLT>50×109/L、ORR | 12分 |
| Grace 2019[10] | 8/12 | 4.6~16.7 | 未报道 | 未报道 | 未报道 | 14 | 队列研究 | CR、PR、ORR | 9分 |
| Koca 2020[11] | 56/49 | 1~16 | 未报道 | 2~86 | 25~75 | 未报道 | 队列研究 | PLT>50×109/L、CR、ORR | 9分 |
| Richert-Przygońska 2020[12] | 33/27 | 2~17 | 未报道 | 1~98 | 25~50 | 1 | 队列研究 | CR、PR、ORR | 11分 |
| Leblebisatan 2018[13] | 19# | 3~18 | 0.25~5.5 | 2~20 | 25~50 | 未报道 | 队列研究 | CR、PR、ORR | 10分 |
| Cheng 2019[14] | 14/6 | 1.4~14.6 | 1~13.2 | 1~12 | 50~75* | 1 | 队列研究 | CR、PR、ORR | 12分 |
| Chen 2021[15] | 17/13 | 1~12 | 1~3.5 | 7~26 | 50~75* | 2 | 队列研究 | CR、PR、ORR | 12分 |
| 黄月婷 2019[16] | 11/12 | 2~17 | 未报道 | 2~82 | 12.5~75* | 10 | 队列研究 | CR、PR、ORR | 10分 |
注:结局指标中,CR为完全反应,PR为部分反应,ORR为总体反应率,PLT为血小板。不良事件包括:头痛、咳嗽、咽痛、腹泻、恶心、腹痛、呕吐、发热、鼻衄及转氨酶升高。*为患儿体重≥27 kg的剂量,若体重<27 kg,文献14、15、16的剂量分别为1.2~2.3、1.1~1.8、1.2~2.1 mg/kg。#纳入病例数为19例,男女比例未报道。
纳入了9篇队列研究文献[8-16],均报道了观察者数量、年龄范围、性别及接受治疗前的血小板情况,且失访率较低;但均未估算样本量、未采用盲法,其中多篇文献[10-11,13,16]未区分急性ITP和慢性ITP。9篇队列研究文献质量评分为9~12分。其主要观察指标包括总体反应率(overall response rate,ORR)、完全反应(complete response,CR)率、部分反应(partial response,PR)率、出血事件发生率及不良事件发生率等。其中CR指接受治疗后出血症状消失,且血小板计数升至>100×109/L[15,17]。4篇文献[8,10,12,15]使用了接受治疗第1个月末的CR率(CR1)作为次要评估指标,6篇文献[8-12,14]采用接受治疗第6个月末的CR率(CR6)作为次要结局指标。PR指接受治疗后血小板计数达(30~100)×109/L,且血小板计数为接受治疗前的2倍以上[15,17]。5篇文献[8,10,12-13,15]采用治疗第1个月末PR率(PR1)作为次要观察指标。ORR为PR率与CR率之和,共有8篇文献描述了ORR[9-16]。所纳入9篇队列研究文献的一般情况见表1。
2.3. Meta分析结果
2.3.1. RCT的Meta分析结果
2篇RCT文献[4-5]共纳入研究对象159例,其中艾曲泊帕干预组108例,对照组51例(对照组给予安慰剂)。这2篇文献均报道了开始治疗后血小板计数升至50×109/L及以上的患儿比例。异质性检验(I2=26%,P=0.24)提示两研究之间无明显异质性,采用固定效应模型进行统计学分析。结果显示干预组有效率高于对照组,差异有统计学意义(RR=2.64,95%CI:1.58~4.44,P<0.05)(图2)。两组之间严重不良事件发生率差异无统计学意义(RR=0.71,95%CI:0.27~1.88,P=0.49)(图3)。两组之间临床出血事件发生率差异有统计学意义(RR=0.37,95%CI:0.15~0.93,P=0.04),而需要其他紧急治疗(RR=0.46,95%CI:0.16~1.34,P=0.15)及不良事件发生率(RR=1.00,95%CI:0.85~1.18,P=0.97)差异无统计学意义(表2)。
图2. RCT有效率的Meta分析.
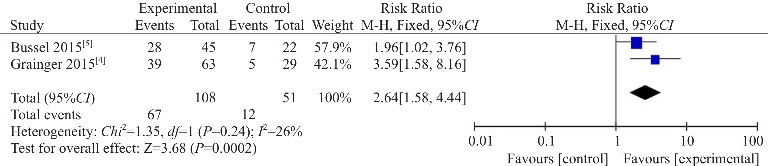
图3. RCT严重不良事件的Meta分析.

表2.
部分观察指标的Meta分析结果
| 结局指标 | 文献 | 异质性检验 | 结果 | 合并模型 | |||
|---|---|---|---|---|---|---|---|
| I2(%) | P | 治疗反应率或RR | 95%CI | P# | |||
| CR | [9,12-16] | 43 | 0.12 | CR率=0.28 | 0.21~0.35 | - | 固定效应模型 |
| PR1 | [8,10,12-13,15] | 85 | 0.01 | PR1=0.49 | 0.31~0.67 | - | 随机效应模型 |
| CR1 | [8,10,12,15] | 59 | 0.06 | CR1=0.22 | 0.12~0.32 | - | 随机效应模型 |
| CR6 | [8-12,14] | 91 | 0.01 | CR6=0.41 | 0.21~0.61 | - | 随机效应模型 |
| 需要其他紧急治疗 | [4-5] | 69 | 0.07 | RR=0.46 | 0.16~1.34 | 0.15 | 随机效应模型 |
| 临床出血事件 | [4-5] | 0 | 0.39 | RR=0.37 | 0.15~0.93 | 0.04 | 固定效应模型 |
| 不良事件 | [4-5] | 58 | 0.12 | RR=1.00 | 0.85~1.18 | 0.97 | 随机效应模型 |
注:[CR]完全反应;[PR1]治疗1个月后的部分反应率;[CR1]治疗1个月后的CR率;[CR6]治疗6个月后的CR率;[RR]相对危险度。#-表示为单个率的统计学合并分析,无P值。
2.3.2. 队列研究的Meta分析结果
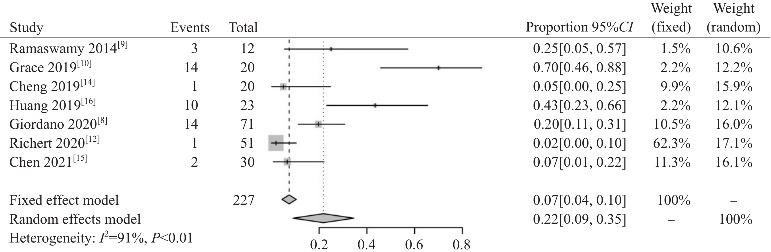
9篇队列研究文献共纳入观察对象360例,其中8篇[9-16]描述了接受艾曲泊帕治疗后的ORR。异质性检验显示各研究间异质性较低(I2=20%,P=0.27),采用固定效应模型进行分析。Meta分析显示ORR为0.70(95%CI:0.65~0.76),见图4。共7篇文献[8-10,12,14-16]描述了接受治疗后不良事件发生情况,纳入观察对象227例,其中有45例发生不良事件,异质性检验提示各研究之间存在显著异质性(I2=91%,P<0.1),采用随机效应模型进行分析。Meta分析显示不良事件发生率为0.22(95%CI:0.09~0.35),见图5。纳入的9篇队列研究文献均未报道有严重不良事件的发生。其他观察指标中,CR率为0.28(95%CI:0.21~0.35),CR6高于CR1(表2)。
图4. 队列研究总体反应率的Meta分析.
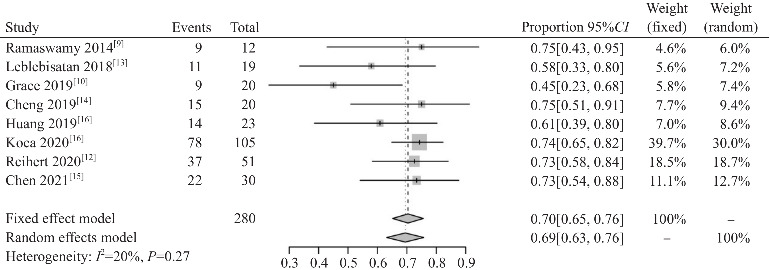
图5. 队列研究不良事件发生率的Meta分析.
3. 讨论
ITP是儿童常见的出血性疾病,主要是由于多种因素导致血小板破坏增加和/或血小板产生减少而引起的血小板计数暂时性或持续性减低[1,4]。艾曲泊帕是一种口服的TPO-RA制剂,其主要作用机制为刺激骨髓巨核细胞成熟从而促进血小板生成[18]。由于艾曲泊帕治疗ITP与传统药物作用机制不同,因而在临床应用逐渐受到重视。目前国外虽有关于艾曲泊帕治疗ITP的Meta分析文献[19-21],但这些文献或者没有评估艾曲泊帕单独应用于儿童ITP的疗效及安全性,或者未评估不同剂型的TPO-RA治疗儿童ITP的疗效及安全性,因而对于艾曲泊帕治疗儿童ITP的临床参考价值有限。
本Meta分析纳入的11篇文献为单独使用艾曲泊帕治疗儿童ITP,排除了艾曲泊帕与其他药物联用的文献。在9篇队列研究文献中,有8篇[9-16]描述了接受艾曲泊帕治疗后的ORR,Meta分析显示ORR为0.70(95%CI:0.65~0.76),提示艾曲泊帕治疗儿童ITP的短期有效率约为70%。5篇文献[8,10,12-13,15]报道了接受艾曲泊帕单独治疗后的PR率,Meta分析显示接受艾曲泊帕治疗后第1个月末的PR率约为49%;4篇文献[8,10,12,15]报道了第1个月末的CR率,Meta分析显示开始接受艾曲泊帕治疗后第1个月末的CR率为22%;6篇文献[8-12,14]报道了接受治疗第6个月末的CR率,Meta分析显示治疗满6个月时CR率为41%。以上结果提示艾曲泊帕治疗在短时间(1个月)内即可使约半数的ITP患儿血小板计数升至安全范围(PLT>30×109/L),且随着临床用药时间的延长,CR率逐渐增加,提示延长临床用药时间可能使更多的ITP患儿血小板升至正常范围。
本Meta分析纳入的2篇RCT文献[4-5]均为多中心、随机、双盲、安慰剂对照研究,但由于这两篇文献均受到制药公司的资助,可能存在报告偏倚的风险,因此文献质量为中等。Meta分析显示,与安慰剂对照组相比,艾曲泊帕治疗儿童ITP能有效升高血小板计数,降低临床出血事件的发生率,符合目前国内外相关指南推荐的关于儿童ITP治疗的基本目的[2-3]。当以需要其他紧急治疗作为结局指标进行Meta分析时,显示艾曲泊帕治疗组与安慰剂对照组需要其他紧急治疗的比例差异无统计学意义(RR=0.46,95%CI:0.16~1.34,P=0.15),这与既往的相关研究结果不一致[19,21],可能与文献的纳入标准不同[19-21]及原始研究[4-5]样本量偏小等因素有关,故艾曲泊帕治疗期间能否有效减少其他紧急治疗率尚需进一步的临床研究。
两篇RCT文献[4-5]关于不良事件发生率的Meta分析显示,艾曲泊帕治疗组与安慰剂对照组不良事件发生率差异无统计学意义,说明艾曲泊帕在儿童ITP的临床应用安全性好。对7篇队列研究[8-10,12,14-16]进行不良事件的Meta分析显示,不良事件发生率为22%,未见严重不良事件的报道,说明在观察期内艾曲泊帕治疗的安全性可靠。
本研究在全面纳入现有的RCT及队列研究的基础上评估了艾曲泊帕治疗儿童ITP的有效性及安全性,文献的纳入较以往的Meta分析[19]更全面。但本研究仍存在以下不足:(1)现有的RCT研究少,且纳入的样本量小,研究者虽严格控制了方法学过程,但仍有偏倚风险;(2)队列研究部分为回顾性研究,未能随机纳入研究对象,且难以全面报告所有阳性及阴性观察结果,因而存在选择偏倚及报告偏倚风险;(3)目前所有的原始研究均无艾曲泊帕与其他二线治疗的对比结果,限制了其与传统二线治疗方案进行有效率的比较;(4)由于艾曲泊帕临床应用时间尚短,暂不能评估其远期的安全性。
综上,本研究显示艾曲泊帕作为二线方案治疗儿童ITP有效,在短期内安全性好。然而需要大样本的RCT进一步评估艾曲泊帕与其他传统二线治疗方案对照的研究结果,以进一步证实其有效性,且其远期安全性有待进一步临床观察。
参考文献
- 1.Zhang HY, Zhang BM, Guo XQ, et al. Blood transcriptome and clonal T-cell correlates of response and non-response to eltrombopag therapy in a cohort of patients with chronic immune thrombocytopenia[J].Haematologica, 2020, 105(3): e129-e132. PMID: . PMCID: . DOI: 10.3324/haematol.2019.226688. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.国家卫生健康委. 儿童原发性免疫性血小板减少症诊疗规范(2019年版)[J].全科医学临床与教育, 2019, 17(12): 1059-1062. DOI: 10.13558/j.cnki.issn1672-3686.2019.012.002. [DOI] [Google Scholar]
- 3.Provan D, Arnold DM, Bussel JB, et al. Updated international consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood Adv, 2019, 3(22): 3780-3817. PMID: . PMCID: . DOI: 10.1182/bloodadvances.2019000812. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Grainger JD, Locatelli F, Chotsampancharoen T, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial[J].Lancet, 2015, 386(10004): 1649-1658. PMID: . DOI: 10.1016/S0140-6736(15)61107-2. [DOI] [PubMed] [Google Scholar]
- 5.Bussel JB, de Miguel PG, Despotovic JM, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study[J].Lancet Haematol, 2015, 2(8): e315-e325. PMID: . DOI: 10.1016/S2352-3026(15)00114-3. [DOI] [PubMed] [Google Scholar]
- 6.Higgins JPT, Churchill R, Chandler J, et al. Cochrane handbook for systematic reviews of interventions version 5.2.0[EB/OL]. [2020-12-10]. https://training.cochrane.org/handbook/archive/v5.2.
- 7.Slim K, Nini E, Forestier D, et al. Methodological index for non- randomized studies (minors): development and validation of a new instrument[J].ANZ J Surg, 2003, 73(9): 712-716. PMID: . DOI: 10.1046/j.1445-2197.2003.02748.x [DOI] [PubMed] [Google Scholar]
- 8.Giordano P, Lassandro G, Barone A, et al. Use of eltrombopag in children with chronic immune thrombocytopenia (ITP): a real life retrospective multicenter experience of the Italian Association of Pediatric Hematology and Oncology (AIEOP)[J].Front Med (Lausanne), 2020, 7: 66. PMID: . PMCID: . DOI: 10.3389/fmed.2020.00066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Ramaswamy K, Hsieh L, Leven E, et al. Thrombopoietic agents for the treatment of persistent and chronic immune thrombocytopenia in children[J].J Pediatr, 2014, 165(3): 600-605.e4. PMID: . DOI: 10.1016/j.jpeds.2014.03.060. [DOI] [PubMed] [Google Scholar]
- 10.Grace RF, Shimano KA, Bhat R, et al. Second-line treatments in children with immune thrombocytopenia: effect on platelet count and patient-centered outcomes[J].Am J Hematol, 2019, 94(7): 741-750. PMID: . PMCID: . DOI: 10.1002/ajh.25479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Koca Yozgat A, Leblebisatan G, Akbayram S, et al. Outcomes of eltrombopag treatment and development of iron deficiency in children with immune thrombocytopenia in Turkey[J].Turk J Haematol, 2020, 37(3): 139-144. PMID: . PMCID: . DOI: 10.4274/tjh.galenos.2020.2019.0380. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Richert-Przygońska M, Demidowicz E, Bartoszewicz N, et al. Eltrombopag use in chronic immune thrombocytopenia of childhood: results from nationwide therapeutic program[J].Acta Haematol Pol, 2020, 51(4): 226-229. DOI: 10.2478/ahp-2020-0039. [DOI] [Google Scholar]
- 13.Leblebisatan G, Kilinc Y, Cil M, et al. Eltrombopag for immune thrombocytopenic children in a single region[J].Indian J Hematol Blood Transfus, 2018, 34(4): 707-710. PMID: . PMCID: . DOI: 10.1007/s12288-018-0928-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Cheng XL, Yan K, Ma JY, et al. Efficacy and safety of eltrombopag in the treatment of severe chronic immune thrombocytopenia in children of China: a single-center observational study[J].Int J Immunopathol Pharmacol, 2019, 33: 2058738419872120. PMID: . PMCID: . DOI: 10.1177/2058738419872120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chen M, Fang JP, Zhou CX, et al. Efficacy and safety of eltrombopag in the treatment of Chinese children with chronic immune thrombocytopenia[J].Hematology, 2021, 26(1): 31-36. PMID: . DOI: 10.1080/16078454.2020.1856511. [DOI] [PubMed] [Google Scholar]
- 16.黄月婷, 刘晓帆, 陈云飞, 等. 艾曲泊帕治疗儿童原发免疫性血小板减少症23例临床观察[J].中华血液学杂志, 2019, 40(12): 1031-1034. PMID: . PMCID: . DOI: 10.3760/cma.j.issn.0253-2727.2019.12.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Liu XG, Bai XC, Chen FP, et al. Chinese guidelines for treatment of adult primary immune thrombocytopenia[J].Int J Hematol, 2018, 107(6): 615-623. PMID: . DOI: 10.1007/s12185-018-2445-z. [DOI] [PubMed] [Google Scholar]
- 18.Hernández-Sánchez JM, Bastida JM, Alonso-López D, et al. Transcriptomic analysis of patients with immune thrombocytopenia treated with eltrombopag[J].Platelets, 2020, 31(8): 993-1000. PMID: . DOI: 10.1080/09537104.2019.1702156. [DOI] [PubMed] [Google Scholar]
- 19.Tumaini Massaro J, Chen YH, Ke ZL. Efficacy and safety of thrombopoietin receptor agonists in children with chronic immune thrombocytopenic purpura: meta-analysis[J].Platelets, 2019, 30(7): 828-835. PMID: . DOI: 10.1080/09537104.2019.1572873. [DOI] [PubMed] [Google Scholar]
- 20.Birocchi S, Podda GM, Manzoni M, et al. Thrombopoietin receptor agonists for the treatment of primary immune thrombocytopenia: a meta-analysis and systematic review[J].Platelets, 2021, 32(2): 216-226. PMID: . DOI: 10.1080/09537104.2020.1745168. [DOI] [PubMed] [Google Scholar]
- 21.Kolanis S, Vasileiou E, Hatzipantelis E, et al. Safety and efficacy of eltrombopag in children and adults with immune thrombocytopenia: a systematic review and meta-analysis[J].Cardiovasc Hematol Agents Med Chem, 2021, 19(1): 83-92. PMID: . DOI: 10.2174/1871525718666200910161540. [DOI] [PubMed] [Google Scholar]


