Différentes atteintes auto-immunes ont été rapportées dans les suites d’une infection à COVID-19, notamment des connectivites [1]. Des manifestations évocatrices de lupus systémique ont été décrites après une infection à COVID-19 [2], [3], [4], cependant sans preuve histologique d’une telle atteinte. Nous rapportons le cas d’un homme de 76 ans suivi pour un syndrome de Gougerot-Sjögren primaire ayant présenté une poussée lupique avec atteinte rénale prouvée histologiquement après une infection à COVID-19.
Un homme de 76 ans, originaire du Cambodge, s’est présenté au service des urgences en décembre 2020 pour dyspnée et asthénie depuis 10 jours. Il était suivi pour un syndrome de Gougerot-Sjögren sans complication systémique, diagnostiqué 6 ans plus tôt devant une sécheresse oculaire associée à une biopsie des glandes salivaires avec score de Chisholm à 4 et des anticorps anti-SSA/Ro et anti-SSB/La positifs. Les anticorps anti-ADN et anti-Sm étaient alors négatifs.
À l’admission, le patient présentait une confusion, des œdèmes des membres inférieurs et une hypertension à 210/105 mmHg. Le test PCR par écouvillon naso-pharyngé était positif au SARS-CoV-2. Les premières analyses sanguines montraient une insuffisance rénale (créatininémie 339 μmol/L), une anémie hémolytique (hémoglobine 7,8 g/dL, haptoglobine < 0,07 g/L) et une thrombopénie (plaquettes 67 g/L). L’analyse des urines retrouvait une hématurie macroscopique ainsi qu’une protéinurie glomérulaire (rapport protéinurie/créatininurie 4 g/g, rapport albuminurie/créatininurie 3,2 g/g). Le scanner thoraco-abdominal identifiait des condensations pulmonaires aux lobes inférieurs et des épanchements pleuraux et péricardique. Les reins étaient de taille normale, sans dilatation des cavités pyélo-calicielles.
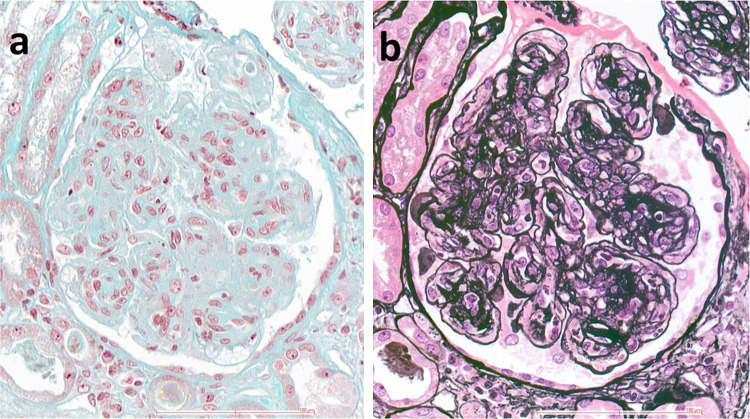
Une corticothérapie à la dose de 1 mg/kg était débutée devant un Coombs direct positif pour les IgG. La suite des explorations montrait des anticorps anti-nucléaires avec aspect homogène (1 :1280), identifiés comme des anticorps anti-ADN avec un titre élevé (343 UI/ml) associés à des anticorps anti-Sm, anti SSA/Ro, anti-SSB et anti-ribosome P. Les protéines du complément étaient abaissées (C3 0,23 g/L, C4 < 0,06 g.L). La biopsie rénale par voie transjugulaire retrouvait 12 glomérules dont 5 en « pain à cacheter ». Les 7 autres glomérules montraient une prolifération mésangiale et endocapillaire (Fig. 1a) avec des doubles contours de la membrane basale glomérulaire sur la coloration argentique (Fig. 1b). Aucun prélèvement à l’état frais n’était disponible pour la réalisation d’une étude en immunofluorescence. Le patient cumulait 33 points suivant la classification EULAR/ACR pour le diagnostic de lupus systémique [5]. Le patient a nécessité une intubation trachéale devant une aggravation de ses symptômes neurologiques. L’IRM cérébrale trouvait des lésions d’encéphalopathie postérieure réversibles motivant la décroissance de la corticothérapie à 0,5 mg/kg. La ponction lombaire était sans particularité.
Fig. 1.
Biopsie rénale. a : Un glomérule montrant une sclérose mésangiale nodulaire associée à une occlusion des lumières capillaires par la prolifération de cellules mésangiales et inflammatoires (Trichrome de Masson, ×400) ; b : Le même glomérule montrant un dédoublement de la membrane basale glomérulaire des capillaires périphériques (coloration argentique, ×400).
Un traitement par cyclophosphamide était introduit. Les traitements immunosuppresseurs n’ont pas permis une amélioration des symptômes. Le patient est décédé après 35 jours d’hospitalisation.
Une poussée lupique chez un homme âgé, même atteint d’un syndrome de Gougerot-Sjögren, est un événement très inhabituel. Des taux sériques élevés de cytokines pro-inflammatoires (TNF-α, IL-1, IL-6) et une diminution des cellules T régulatrices ont été constatés chez les patients atteints d’une infection sévère à COVID-19. L’infection à COVID-19 favorise l’apparition d’anticorps anti-phospholipides qui pourraient participer à la pathogénèse des nombreux événements thrombo-emboliques constatés chez ces patients [6]. Chez notre patient souffrant d’une maladie immunitaire quiescente, l’infection à COVID-19 a pu conduire à une rupture de son équilibre immunitaire, au développement de nouveaux auto-anticorps pathogènes, et ainsi à une modification du phénotype et de la sévérité de sa maladie immunitaire sous-jacente.
Consentement
Les proches du patient ont donné leur consentement écrit pour la publication du cas.
Contribution
GR, AP, IB, SF et XM ont pris en charge le patient, ont écrit l’article et l’ont corrigé.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Financement
Cette recherche n’a bénéficié d’aucun financement spécifique.
Footnotes
Ne pas utiliser, pour citation, la référence française de cet article mais la référence anglaise de Joint Bone Spine avec le DOI ci-dessus.
Références
- 1.Ahmed S., Zimba O., Gasparyan A.Y. COVID-19 and the clinical course of rheumatic manifestations. Clin Rheumatol. 2021:1–9. doi: 10.1007/s10067-021-05691-x. [Epub ahead of print] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Mantovani Cardoso E., Hundal J., Feterman D., et al. Concomitant new diagnosis of systemic lupus erythematosus and COVID-19 with possible antiphospholipid syndrome. Just a coincidence ?. À case report and review of intertwining pathophysiology. Clin Rheumatol. 2020;39:2811–2815. doi: 10.1007/s10067-020-05310-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Slimani Y., Abbassi R., El Fatoiki F.Z., et al. Systemic lupus erythematosus and varicella-like rash following COVID-19 in a previously healthy patient. J Med Virol. 2021;93:1184–1187. doi: 10.1002/jmv.26513. [DOI] [PubMed] [Google Scholar]
- 4.Bonometti R., Sacchi M.C., Stobbione P., et al. The first case of systemic lupus erythematosus (SLE) triggered by COVID-19 infection. Eur Rev Med Pharmacol Sci. 2020;24:9695–9697. doi: 10.26355/eurrev_202009_23060. [DOI] [PubMed] [Google Scholar]
- 5.Aringer M., Costenbader K., Daikh D., et al. 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann Rheum Dis. 2019;78:1151–1159. doi: 10.1136/annrheumdis-2018-214819. [DOI] [PubMed] [Google Scholar]
- 6.Amezcua-Guerra L.M., Rojas-Velasco G., Brianza-Padilla M., et al. Presence of antiphospholipid antibodies in COVID-19: case series study. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-218100. [DOI] [PubMed] [Google Scholar]