Abstract
目的
比较经椎间孔单侧入路双侧减压和双侧棘突旁小切口入路双侧减压并行椎间融合内固定术治疗腰椎管狭窄症的近期疗效,以评估经椎间孔单侧入路双侧减压的临床价值。
方法
2014 年 7 月—2015 年 6 月,将符合选择标准的 48 例拟行椎间融合内固定术的腰椎管狭窄症患者随机分为两组,分别为单侧入路双侧减压组(试验组,24 例)和双侧棘突旁小切口入路双侧减压组(对照组,24 例)。两组患者性别、年龄、病程、疾病类型、累及节段、合并内科疾病及术前肌酸磷酸激酶(creatine phosphokinase,CPK)水平、疼痛视觉模拟评分(VAS)、Oswestry 功能障碍指数(ODI)等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。记录两组患者手术时间、术中出血量、术后引流量、住院时间、并发症发生率;术后 1、3、7 d 检查 CPK 水平;术后 3、6、12 个月定期随访,采用 VAS 评分及 ODI 评价临床疗效;随访期间行腰椎 X 线片或 CT 检查判断椎间是否达骨性融合。
结果
两组患者手术时间、术中出血量及住院时间比较,差异均无统计学意义(P>0.05);但试验组术后引流量明显少于对照组(t=5.547,P=0.000)。术后 1 d 试验组 CPK 水平显著低于对照组(t=3.129,P=0.005),术后 3、7 d 两组 CPK 水平比较差异均无统计学意义(P>0.05)。两组患者均获随访,随访时间 12~24 个月,平均 17 个月。所有患者术后切口均Ⅰ期愈合。试验组术后 1 例发生心脏衰竭;对照组术中 1 例发生脑脊液漏、1 例发生神经根损伤, 术后 1 例发生肺部感染;两组并发症发生率比较差异无统计学意义(χ2=0.273,P=0.602)。试验组和对照组分别有 1 例和 2 例未达椎间骨性融合,椎间融合率分别为 95.8%(23/24)和 91.7%(22/24),比较差异无统计学意义(χ2=0.356,P=0.551)。两组均未出现椎间融合器移位、沉降,未出现断钉、断棒和内固定物松动现象;随访过程中亦未发生邻近节段退变,未出现脊柱侧凸及腰椎矢状曲度改变。术后 3、6、12 个月两组 VAS 评分及 ODI 均较术前显著改善(P<0.05);术后 3、6、12 个月试验组 VAS 评分及 ODI 均显著优于对照组(P<0.05)。
结论
对于腰椎管狭窄症,经椎间孔单侧入路双侧减压或双侧棘突旁小切口入路双侧减压并行椎间融合内固定术治疗均可取得良好近期疗效。但前者具有手术创伤小、对椎旁肌损伤小、最大程度保留脊柱后方结构、术后引流量少、患者恢复快、住院时间短等优点。
Keywords: 腰椎管狭窄症, 单侧入路双侧减压, 椎间融合内固定, 椎旁肌
Abstract
Objective
To assess the clinical application value of tranforaminal unilateral approach for bilateral decompression by comparing the short-term effectiveness of bilateral decompression via unilateral approach of intervertebral foramen with via small surgical incision of bilateral spinous process in lumbar interbody fusion for the treatment of lumbar spinal stenosis.
Methods
Between July 2014 and June 2015, 48 patients with lumbar spinal stenosis underwent decompression and internal fixation by unilateral approach in 24 cases (trial group) and by bilateral small incision approach in 24 cases (control group). There was no significant difference in gender, age, disease duration, disease type, involved segment, combined medical diseases, preoperative level of creatine phosphokinase (CPK), the visual analogue scale (VAS), and Oswestry disability index (ODI) between 2 groups (P>0.05). The operation time, intraoperative blood loss, postoperative drainage, hospitalization time, and the incidence of complications were recorded. The CPK levels were evaluated at 1, 3, and 7 days after operation. VAS score and ODI were used to evaluate the effectiveness, and lumbar X-ray film or CT scanning to determine the intervertebral bony fusion.
Results
There was no significant difference in operation time, intraoperative blood loss, and hospitalization time between 2 groups (P>0.05), but significant difference was found in postoperative drainage (t=5.547, P=0.000). At 1 day after operation, the level of CPK in the trial group was significantly lower than that in the control group (t=3.129, P=0.005), but there was no significant difference at 3 and 7 days after operation between 2 groups (P>0.05). The patients were followed up 12-24 months (mean, 17 months). All the wounds healed primarily. Heart failure occurred in 1 case of the trial group, and cerebrospinal fluid leakage and pulmonary infection, and nerve root injury occurred in 1 case of the control group respectively. There was no significant difference in the incidence of complications between 2 groups (χ2=0.273, P=0.602). The interbody fusion rate was 95.8% (23/24) in the trial group and was 91.7% (22/24) in the control group, showing no significant difference (χ2=0.356, P=0.551). No cage sink, dislocation or plate and screw loosening and breakage was found in 2 groups. No adjacent segment degeneration occurred during the follow-up, and there was no change of scoliosis and lumbar sagittal curvature. At 3, 6, and 12 months after operation, the VAS score and ODI were significantly improved when compared with the preoperative scores in 2 groups (P<0.05), and the VAS score and ODI of the trial group were significantly better than those of control group (P<0.05).
Conclusion
The bilateral decompression via unilateral approach of intervertebral foramen and small surgical incision of bilateral spinous process in lumbar interbody fusion have satisfactory efficacy for the treatment of lumbar spinal stenosis, but the tranforaminal unilateral approach has the advantages of less trauma, avoidance of bilateral muscle stripping and soft paraspinal muscle injury, retention of posterior spinal structure, faster postoperative recovery, shorter hospital stay and good short-term effectiveness.
Keywords: Lumbar spinal stenosis, unilateral approach bilateral decompression, intervertebral fusion and internal fixation, paraspinal muscle
腰椎管狭窄症是指椎管因骨性或纤维结缔组织异常增生导致硬膜囊及神经根受压,引起腰腿痛和间歇性跛行症状[1]。后路腰椎椎体间融合术(posterior lumbar interbody fusion,PLIF)是治疗腰椎管狭窄症的标准术式之一。但传统 PLIF 对椎旁肌剥离、损伤大,导致术后多裂肌萎缩;对脊柱骨性组织破坏多,从而影响术后脊柱稳定性,造成脊柱矢状面失平衡,最终导致腰椎手术失败综合征的发生[2]。随着微创脊柱外科的发展,扩张管通道(X-Tube)辅助下 PLIF 及采用微型椎板拉钩辅助下经腰椎棘突旁双侧小切口入路 PLIF 逐渐用于临床,但部分患者仍存在术后腰背部顽固性疼痛以及邻近节段椎体退变加快等情况[3]。
与传统 PLIF 及微创 PLIF 相比,经椎间孔腰椎椎体间融合术(transforaminal lumbar interbody fusion,TLIF)是通过单侧椎间孔实现一侧椎管减压以及椎体融合,有效避免了对脊柱后方结构的损伤,保证了术后脊柱稳定性,能获得良好临床效果。我们在总结相关病例资料及 TLIF 技术优点的基础上,将 TLIF 及椎管对侧潜行扩大减压技术相结合,用于治疗腰椎中央管狭窄及双侧侧隐窝狭窄患者;并通过与双侧棘突旁小切口入路双侧减压椎间融合内固定术治疗腰椎管狭窄症患者进行比较,进一步评价经椎间孔单侧入路双侧减压椎间融合内固定术的临床应用价值。报告如下。
1. 临床资料
1.1. 患者选择标准
纳入标准:① 存在严重腰腿痛伴间歇性跛行症状者;② 经严格保守治疗 6 个月以上症状未缓解;③ CT 及 MRI 检查提示腰椎双侧侧隐窝伴中央管狭窄,并与临床症状相符。排除标准:① 双侧椎间孔严重狭窄,同时存在明显双下肢症状;② 对侧椎间孔腹侧(对侧椎体后缘)骨化;③ 对侧椎间盘突出伴后纵韧带骨化。
2014 年 7 月—2015 年 6 月共 48 例患者符合选择标准纳入研究,根据住院号单双号将患者随机分为 2 组,每组 24 例。其中试验组患者采用经椎间孔单侧入路双侧减压椎间融合内固定术,对照组行双侧棘突旁小切口入路双侧减压椎体间融合内固定术。本研究经浙江大学医学院附属邵逸夫医院医学伦理委员会批准,患者均知情同意。
1.2. 一般资料
试验组:男 10 例,女 14 例;年龄 43~82 岁,平均 65.6 岁。病程 2~12 年,平均 5.0 年。其中腰椎管狭窄症伴腰椎间盘突出症 9 例,伴腰椎不稳 6 例,伴腰椎滑脱 7 例,伴椎体后缘离断症 2 例。累及节段:单节段 11 例,双节段 13 例;其中,L2、3 2 例,L3、4 10 例,L4、5 16 例,L5、S1 9 例。合并高血压、糖尿病等内科疾病 18 例。
对照组:男 12 例,女 12 例;年龄 45~72 岁,平均 60.4 岁。病程 6 个月~10 年 6 个月,平均 6.1 年。其中腰椎管狭窄症伴腰椎间盘突出症 7 例,伴腰椎不稳 4 例,伴腰椎滑脱 10 例,伴椎体后缘离断症 3 例。累及节段:单节段 10 例,双节段 14 例;其中,L3、4 7 例,L4、5 23 例,L5、S1 8 例。合并高血压、糖尿病等内科疾病 20 例。
两组患者性别、年龄、病程、疾病类型、累及节段、合并内科疾病及术前肌酸磷酸激酶(creatine phosphokinase,CPK)水平、腰背部疼痛视觉模拟评分(VAS)、Oswestry 功能障碍指数(ODI)等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。见表 1~3。
表 1.
Comparison of CPK level between 2 groups at pre-and post-operation (n=24, U/L,
 )
)
两组患者手术前后 CPK 水平比较(n=24,U/L,
 )
)
| 组别
Group |
术前
Preoperative |
术后 1 d
One day after operation |
术后 3 d
Three days after operation |
术后 7 d
Seven days after operation |
| 试验组
Trial group |
90.4±42.0 | 345.5±100.1 | 175.3± 57.2 | 56.0±21.6 |
| 对照组
Control group |
116.7±55.4 | 486.2±176.3 | 247.6±156.4 | 66.5±17.1 |
| 统计值
Statistic |
t=1.895
P=0.070 |
t=3.129
P=0.005 |
t=1.991
P=0.058 |
t=1.719
P=0.099 |
表 3.
Comparison of ODI between 2 groups at pre- and post-operation (n=24,
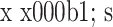 )
)
两组患者手术前后 ODI 比较(n=24,
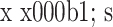 )
)
| 组别
Group |
术前
Preoperative |
术后 3 个月
Three months after operation |
术后 6 个月
Six months after operation |
术后 12 个月
Twelve months after operation |
统计值
Statistic |
|
* 与术前比较 P<0.05,# 与术后 3 个月比较 P<0.05,△ 与术后 6 个月比较 P<0.05
* Compared with preoperative value, P<0.05;# compared with the value at 3 months after operation, P<0.05;△ compared with the value at 6 months after operation, P<0.05 | |||||
| 试验组
Trial group |
36.3±1.1#△ | 11.3±1.4*△ | 3.4±0.6*# | 2.8±0.8*#△ |
F=5 349.821
P= 0.000 |
| 对照组
Control group |
36.8±1.0#△ | 15.5±2.2*△ | 13.2±2.1*# | 9.9±2.2*#△ |
F=926.492
P= 0.000 |
| 统计值
Statistic |
t=1.589
P=0.119 |
t=7.644
P=0.000 |
t=22.039
P= 0.000 |
t=14.792
P= 0.000 |
|
1.3. 手术方法
两组手术均由同一组医生完成,均采用美国美敦力公司的椎弓根钉棒系统和椎间融合器。
试验组:患者于全麻下取俯卧位,垫空腹部,架起腰桥,C 臂 X 线机透视明确腰椎责任节段,体表标出双侧上、下椎弓根位置后,将其连成直线(距离后正中线约 2 cm)。首先,从症状较重侧沿连线作 3~6 cm 长切口(根据手术节段数目而定),纵向切开皮肤、腰背筋膜,紧贴棘突和椎板剥离椎旁肌肉,采用微型椎板拉钩拉开,从而充分暴露椎板及相邻关节突关节,以横突根部与上关节突关节外侧缘交点为进针点,透视明确位置正确后拧入椎弓根螺钉。减压对侧经多裂肌与最长肌间隙钝性分离进入,参照解剖标志拧入椎弓根螺钉,透视确认螺钉位置,安装连接杆,并通过椎弓根螺钉临时撑开椎间隙。然后使用微型椎板拉钩暴露减压侧椎板间隙,以弧形骨刀及椎板咬骨钳去除部分上、下关节突关节,作椎间孔扩大减压,松解神经根,再去除上位椎板骨质达黄韧带起始处及下方椎板骨质达黄韧带止点,分离并切除黄韧带,暴露硬脊膜及神经根。然后,行对侧潜行减压。将手术床向对侧倾斜约 30°,先用神经剥离器仔细分离硬脊膜与棘突中线椎板结合部间隙,再使用枪钳和刮勺去除椎体棘突基底部部分骨质以扩大中央管,用神经剥离子挡开硬膜囊,用刮勺、枪钳及弧形骨刀去除对侧肥厚黄韧带、增生的部分上下椎板里层及关节突内侧骨质,以扩大对侧侧隐窝,使硬脊膜和对侧神经根彻底松解。将所有咬出的骨块制备成颗粒状,作为椎间植骨材料。最后,将手术床转回正常位置。按照 TLIF 标准程序,椎体间选择合适高度的椎间融合器。彻底清除髓核和软骨终板后,椎体前方填充压实自体颗粒状骨并植入椎间融合器,装上连接杆并加压融合间隙,透视下确定内固定物和椎间融合器位置。彻底止血并进行冲洗,放置一侧引流管,逐层缝合切口。
对照组:患者于全麻下取俯卧位,架空腹部,C 臂 X 线机透视下确定腰椎病变节段,体表标记出双侧上、下椎弓根位置,取双侧棘突旁 3~6 cm 长切口(根据手术节段数目而定),切开皮肤及腰背筋膜,紧贴棘突及椎板剥离椎旁肌,并采用微型椎板拉钩拉开。暴露椎板及关节突关节,根据解剖标志攻入椎弓根螺钉,C 臂 X 线机透视下确认位置良好。切除双侧部分上、下椎板,游离并切除黄韧带,潜行去除棘突基底部部分骨质,保留部分棘突及棘间韧带,充分松解硬脊膜,咬除双侧部分关节突关节,扩大椎间孔,确认双侧神经根充分减压后,再处理髓核及终板。椎体前方填充压实减压取出的自体碎骨颗粒并植入椎间融合器,装上连接杆并加压融合间隙,透视下确定内固定物和椎间融合器位置。彻底止血并进行冲洗,在双侧各放置 1 根引流管,逐层缝合切口。
1.4. 术后处理及随访指标
两组患者术后处理方法一致。常规预防性使用抗生素 24~48 h,待 24 h 引流量<50 mL 时拔除引流管。术后 3~4 d 患者佩戴腰围下开始起床活动,术后 3 个月内需佩戴腰围活动,禁止弯腰剧烈活动。
记录两组手术时间、术中出血量、术后引流量、住院时间、并发症发生率。术后 1、3、7 d 检查 CPK 水平。术后 3、6、12 个月定期随访,采用 VAS 评分及 ODI(未行性生活评分)评价临床疗效。影像学检查:术后 2 d 行腰椎 X 线片或 CT 检查,明确内固定物、椎间融合器位置及减压范围。随访期间,参照美国食品药物管理局(FDA)推荐的椎体间融合相关标准[4],在腰椎过伸过屈位 X 线片上观察融合节段上、下椎体间角度变化是否超过 5°,椎间融合器内及其周围是否存在透亮区,椎间融合器有无偏移;若椎间未达骨性融合,于术后 12 个月或 24 个月时行腰椎薄层 CT 平扫及冠状位、矢状位重建,按照本课题组标准[5]评估椎间是否融合。
1.5. 统计学方法
采用 SPSS13.0 统计软件进行分析。计量资料以均数±标准差表示,组内手术前后比较采用重复测量方差分析,两两比较采用配对 t 检验;组间比较采用独立样本 t 检验;计数资料组间比较采用 χ2 检验;检验水准 α=0.05。
2. 结果
两组患者手术时间、术中出血量及住院时间比较,差异均无统计学意义(P>0.05);但试验组术后引流量明显少于对照组,比较差异有统计学意义(t=5.547,P=0.000)。见表 4。术后 1 d 试验组 CPK 水平显著低于对照组,差异有统计学意义(t=3.129,P=0.005);术后 3、7 d 两组 CPK 水平比较差异均无统计学意义(P>0.05)。见表 1。
表 4.
Comparison of surgical index between 2 groups (n=24,
 )
)
两组患者手术观察指标比较(n=24,
 )
)
| 组别
Group |
手术时间(min)
Operation time(min) |
术中出血量(mL)
Intraoperative blood loss(mL) |
术后引流量(mL)
Postoperative drainage(mL) |
住院时间(d)
Hospitalization time(d) |
| 试验组
Trial group |
207.2±30.9 | 355.0±137.0 | 226.8± 95.2 | 11.7±3.7 |
| 对照组
Control group |
224.0±32.5 | 286.7±156.9 | 448.0±151.4 | 11.1±3.1 |
| 统计值
Statistic |
t=1.597
P=0.124 |
t=1.368
P=0.185 |
t=5.547
P=0.000 |
t=0.758
P=0.456 |
两组患者均获随访,随访时间 12~24 个月,平均 17 个月。所有患者术后切口均Ⅰ期愈合。试验组术中无脑脊液漏发生;术后 1 例发生心脏衰竭,给予利尿脱水后好转。对照组术中 1 例出现脑脊液漏,术后给予头低足高位等对症保守治疗后痊愈,术后无头痛、头昏等症状;1 例发生神经根损伤,给予营养神经药物治疗后好转;术后 1 例发生肺部感染,经抗感染等对症治疗后好转。两组均无对侧椎板骨折、术后椎间隙感染、双下肢深静脉血栓形成等并发症发生。试验组及对照组并发症发生率分别为 4.2%(1/24)、12.5%(3/24),两组并发症发生率比较差异无统计学意义(χ2=0.273,P=0.602)。
试验组 1 例椎间融合器位置欠佳,随访 12 个月 CT 检查未达椎间骨性融合,但患者无明显腰背部疼痛症状;对照组 2 例未达椎间骨性融合,但无腰背部持续疼痛,随访 24 个月影像学检查未表现明显不稳;以上 3 例患者均未作特殊处理,继续随访中。两组其余患者均达椎间骨性融合,试验组和对照组椎间融合率分别为 95.8%(23/24)和 91.7% (22/24),比较差异无统计学意义(χ2=0.356,P=0.551)。两组均未出现椎间融合器移位、沉降,未出现断钉、断棒和内固定物松动现象;随访过程中亦未发生邻近节段退变,未出现脊柱侧凸及腰椎矢状曲度改变。见图 1。
图 1.

A 69-year-old female patient with lumbar spinal stenosis and lumbar intervertebral disc herniation at L3, 4 and L4, 5 in trial groupa, b. Anteroposterior and lateral X-ray films of lumbar spine before operation; c, d. MRI axial images of lumbar spine at L3, 4 and L4, 5 before operation; e, f. Axial CT scan at L3, 4 and L4, 5 before operation, showing facet joint hyperplasia, facet joint cohesion, ligamentum flavum hypertrophy, and spinal stenosis; g, h. Axial CT scan at L3, 4 and L4, 5 at 1 day after operation, showing patency of spinal canal; i, j. Anteroposterior and lateral X-ray films of lumbar spine at 3 months after operation, showing good position of internal fixation and fusion device
试验组患者,女,69 岁,L3、4 及 L4、5 腰椎管狭窄症伴腰椎间盘突出 a、b. 术前腰椎正侧位 X 线片;c、d. 术前 L3、4、L4、5 节段 MRI 横断面;e、f. 术前 L3、4、L4、5 节段 CT 横断面示椎板及关节突关节增生,关节突关节内聚,黄韧带肥厚,椎管狭窄;g、h. 术后 1 d L3、4、L4、5 节段 CT 横断面示椎管通畅;i、j. 术后 3 个月正侧位 X 线片示内固定物及椎间融合器位置良好
术后 3、6、12 个月两组 VAS 评分及 ODI 均较术前显著改善,比较差异有统计学意义(P<0.05);术后各时间点间比较差异均有统计学意义(P<0.05)。术后 3、6、12 个月试验组 VAS 评分及 ODI 与对照组比较,差异均有统计学意义(P<0.05)。见表 2、3。
表 2.
Comparison of low back pain VAS score between 2 groups at pre- and post-operation (n=24,
 )
)
两组患者手术前后腰背部 VAS 评分比较(n=24,
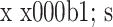 )
)
| 组别
Group |
术前
Preoperative |
术后 3 个月
Three months after operation |
术后 6 个月
Six months after operation |
术后 12 个月
Twelve months after operation |
统计值
Statistic |
|
* 与术前比较 P<0.05,# 与术后 3 个月比较 P<0.05,△ 与术后 6 个月比较 P<0.05
* Compared with preoperative value, P<0.05;# compared with the value at 3 months after operation, P<0.05;△ compared with the value at 6 months after operation, P<0.05 | |||||
| 试验组
Trial group |
7.1±0.8#△ | 3.7±0.8*△ | 2.1±0.5*# | 1.5±0.5*#△ |
F=324.950
P= 0.000 |
| 对照组
Control group |
7.5±0.6#△ | 4.8±1.0*△ | 3.2±1.0*# | 2.2±0.7*#△ |
F=169.576
P= 0.000 |
| 统计值
Statistic |
t=1.775
P=0.082 |
t=4.217
P=0.000 |
t=4.559
P=0.000 |
t=3.789
P=0.000 |
|
3. 讨论
3.1. 单侧入路双侧减压术式的应用背景
腰椎管狭窄症是中老年人最常见的腰椎退行性疾病,其主要病理改变为椎间盘退变、膨出甚至突出,关节突关节、椎板增生,黄韧带肥厚等。这些病理改变导致椎管容积减少,压迫硬脊膜及神经根,引起一系列相应临床症状,严重影响患者生活质量。对于保守治疗无效、腰腿症状逐步加重且影像学检查提示腰椎管狭窄的患者应考虑手术治疗[6]。腰椎管狭窄症手术方案可大致分为单侧椎板开窗减压和椎管减压植骨融合内固定两类。单纯侧隐窝或中央管狭窄而无腰椎不稳倾向时,可考虑单纯开窗减压,甚至可通过内镜进行单侧椎板间入路双侧减压;而复杂的腰椎管狭窄症常合并腰椎不稳、滑移或脊柱畸形,在减压同时需椎间融合内固定来恢复脊柱的正常序列及生物力学。
PLIF 曾是治疗复杂型腰椎管狭窄症的“金标准”,传统 PLIF 首先经腰椎后路进行双侧全椎板及关节突关节骨性减压,以解除神经及硬脊膜后方的机械性压迫,并完全切除椎间盘,以解除化学性及机械性的影响;再通过椎间融合器及椎弓根螺钉来实现脊柱三柱稳定,最终达到椎间融合,重建脊柱稳定性,恢复矢状面及冠状面平衡[7]。但 PLIF 对脊柱破坏大、手术时间长、术中失血多、术后并发症发生率高、手术疗效不理想[8]。脊柱运动及不同姿势的完成需要椎旁肌的支持,其中多裂肌是脊柱动力性稳定结构[9],而腰椎后路手术对多裂肌影响最大。传统 PLIF 术后椎旁肌(主要是多裂肌)存在失神经支配、脂肪化改变、肌肉萎缩,直接影响脊柱动力性稳定结构[10]。此外,PLIF 术中需要咬除棘突,切除棘上、棘间韧带,广泛分离牵拉椎旁肌,过度破坏椎旁组织,直接影响椎旁融合区域血供,导致术后脊柱不稳,影响脊柱生物力学,增加脊柱运动节段负荷,加速邻近节段退变[11],最终出现术后顽固性腰背部疼痛和腰椎手术失败综合征。 Airaksinen 等[12]通过随访 438 例接受全椎板减压治疗的患者,发现手术优良率仅为 62%。
与 PLIF 相比,TLIF 通过单侧椎间孔进行半椎板开窗、关节突关节切除来实现单侧神经周围减压及椎间融合,保留了大部分脊柱后方韧带复合体结构;术中采用微型椎板拉钩暴露手术视野、减压对侧经多裂肌肌束进行植钉,最大程度减少了对多裂肌的损伤及失神经支配。经单侧椎间孔进行手术,避免了术中过度牵拉及干扰神经根及硬脊膜,从而降低了发生神经根损伤及脑脊液漏的风险。但 Yasar 等[13]认为退行性腰椎管狭窄症的手术减压范围不能局限于引起症状的狭窄部位,同时也需要对影像学显示的狭窄解剖部位进行减压,否则将影响远期手术疗效。Guyer 等[14]回顾分析了发生腰椎手术失败综合征患者资料,发现引起腰椎术后残留腰腿痛甚至症状复发的主要原因为减压不彻底或未解除不稳定因素。因此,必须严格掌握手术适应证,如影像学检查表现为双侧侧隐窝及中央管狭窄,需仔细询问患者病史并查体,再制定手术方案,避免腰椎手术失败综合征的发生。
为了减小医源性损伤及对椎管充分减压,Young 等[15]首先提出显微镜辅助下经单侧椎板间入路双侧减压技术,实现了双侧侧隐窝充分减压的目的,同时保留了脊椎后方韧带复合体。Guiot 等[16]通过椎间盘镜下单侧椎板间入路双侧减压治疗退变性腰椎管狭窄症,取得满意临床效果。单侧入路双侧椎管扩大减压能在保证腰椎稳定、微小创伤的基础上,达到充分减压、松解神经、缓解症状的目的[17]。对于退行性腰椎管狭窄(尤其是双侧侧隐窝狭窄)伴腰椎不稳者,为了减少对脊柱后方结构的破坏并达到充分对侧潜行减压及椎间融合,我们将 TLIF 技术结合对侧潜行减压技术进行治疗。
3.2. 经椎间孔单侧入路双侧减压术的优点
经椎间孔单侧入路双侧减压术具有创伤小、术中出血少、术后引流量少,术后患者能尽早起床活动,术后 CPK 水平低、多裂肌损伤小,术后疼痛症状轻、脊柱功能恢复良好等优点。该术式通过单侧椎间孔完成症状较重一侧的减压(包括关节突关节切除、半椎板减压、扩大神经根管及椎管)及椎间植骨融合,避免过多破坏脊柱后方结构,最大程度保留了棘突、棘间及棘上韧带等脊柱后方韧带复合体结构,降低了术后腰背痛发生率,保持了脊椎稳定性[18]。而对侧则行潜行减压、扩大椎管、松解神经根,并采用 Wiltse 入路(多裂肌和最长肌间隙入路)进行植钉,避免对肌肉的剥离损伤,保留了腰神经后支的内侧支神经对多裂肌的支配,减小了肌肉的瘢痕愈合。Kim 等[19]报道微创腰椎手术可以减小椎旁肌损伤,反映肌肉损伤的 CPK 水平较开放手术低。本研究结果也证实了该结论,试验组术后 1 d 的 CPK 水平明显低于对照组,术后 7 d 已基本降至正常。此外,试验组 ODI 及 VAS 评分均明显低于对照组,提示术中保留脊柱后方韧带复合体的重要性。
随着各种脊柱融合技术的广泛开展,邻近节段退行性疾病受到越来越多脊柱外科医师的重视[20]。Lai 等[21]认为过多地破坏脊柱后方结构和进行大范围减压会影响脊柱稳定性,如果减压范围超过融合节段范围,会加速邻近节段退变。尽管本研究随访时间较短,但经椎间孔单侧入路进行双侧减压手术方案,最大程度保留了脊柱后方结构,减少了对椎旁组织损伤,从理论上可以降低邻近节段退变的发生,避免了腰背部疼痛复发和再次手术的风险。同时患者术后引流量也明显减少,术后 2~3 d 拔除引流管后即鼓励患者在腰围保护下起床活动,降低了长时间卧床导致的一系列并发症发生风险。试验组通过单侧椎间孔进行双侧减压手术平均时间约 207 min,较文献报道的微创化经单侧入路双侧减压治疗腰椎管狭窄所需手术时间(约 187 min)[22]无明显延长。
采用椎间盘镜或显微镜下经椎板间隙单侧入路双侧减压技术进行椎管扩大减压具有以下优点:通过内窥镜或显微镜获得清晰手术视野,术者可在直视下进行椎管有限开窗减压,不切除关节突关节,无需进行融合内固定,对脊柱破坏较小,患者术后恢复快,适合不能耐受创伤较大的传统手术的老年腰椎管狭窄症患者。但对于腰椎不稳或腰椎滑移、椎间孔严重狭窄、小关节增生严重者,该术式不能达到彻底减压并获得脊椎稳定的目的,另外术者镜下操作熟练程度也对手术减压效果有一定影响,学习曲线较长。而经椎间孔单侧入路双侧减压融合内固定术可以解决一侧椎间孔、侧隐窝严重狭窄,并通过对侧潜行减压来解除对侧神经根的压迫,同时彻底清除椎间盘组织缓解椎间盘对神经根及马尾神经机械性的压迫以及化学性刺激,最后进行椎间融合及内固定,完成椎体间骨性融合,恢复腰椎前柱的载荷能力、椎间隙高度及脊柱矢状面平衡,更符合脊柱生物力学原理[23],且学习曲线相对较短。
3.3. 手术体会
① 术中单侧椎间孔入路进行精准有效的双侧减压。首先,于症状较重一侧进行半椎管开窗、小关节突全切除,使神经根、硬膜囊完全松解;然后,将手术床向对侧倾斜约 30°,通过弧形骨刀、枪钳、刮勺等进行对侧潜行减压,咬除棘突根部部分骨质、肥厚的黄韧带、对侧椎板内板、内聚增生的关节突内侧骨质,扩大中央管、对侧侧隐窝及神经根管入口区,松解对侧神经根及硬膜囊。采用弧形骨刀进行潜行减压时需注意力道,避免对侧椎板骨折以及对关节突关节过多破坏,影响脊柱稳定。咬除棘突根部时,因椎管狭窄导致硬膜囊与棘突基底部紧贴,必须用神经剥离子分离,可用脑棉片置于硬膜囊上进行隔离和保护。腰椎管狭窄时黄韧带增厚,并与硬膜囊紧密贴附甚至粘连,为了避免对侧潜行减压时出现硬膜囊撕裂或长时间牵拉,减压时无需急于切开黄韧带,可先用刮匙剥离黄韧带与椎板上下缘止点,仔细分离黄韧带与硬膜囊间隙;然后用球探、神经剥离子分离黄韧带及硬脊膜,解除硬膜囊、神经根与周围组织的粘连,再用枪钳咬除黄韧带。进行椎间隙处理时,利用带弯度的刮匙及髓核钳紧贴后纵韧带来清除对侧椎间盘组织,避免在植入椎间融合器时将残余的髓核组织挤压至对侧神经根,导致神经压迫症状。对侧减压标准:探查对侧硬脊膜搏动良好,确保神经根有约 0.5 cm 的移动范围,明确观察到对侧椎弓根和出口根,从而完成对中央管及对侧侧隐窝的减压[16]。
② 术中注意确保手术视野清晰。术前摆放体位时需悬空腹部,降低椎管内静脉丛压力,减少术中出血,进入椎管前必须严密止血,进行潜行减压时避免反复推移牵拉硬膜囊及神经根,以免损伤曲张增粗的静脉丛,出血后可使用双极电凝止血。若渗血过多,可用明胶海棉、脑棉片进行填塞止血。切记视野模糊情况下勿进行潜行减压操作,以免误伤硬膜囊及神经根。本研究对照组 1 例术中发生脑脊液漏,与术中视野不清、未仔细分离黄韧带而误伤硬膜囊有关。对侧减压时,将脑棉片放置于硬膜囊上方并压低硬膜囊,从而扩大对侧操作空间及视野,同时将手术床向对侧倾斜约 30°,在使用头灯辅助下进行减压,可使手术视野更加清晰。
③ 手术禁忌证:对侧椎间孔区严重狭窄,对侧椎间孔腹侧(对侧椎体后缘)骨化,对侧椎间盘突出伴后纵韧带骨化等情况不适合从单侧入路进行对侧减压,不可盲目追求微创而造成不必要的手术创伤。
综上述,采用经椎间孔单侧入路进行双侧减压并椎体间融合内固定术治疗腰椎管狭窄症,在充分有效减压同时保留了脊柱后方大部分结构(脊柱后方韧带复合体),为患者术后快速康复及获得满意临床疗效奠定了基础。单侧入路双侧减压微创术式治疗腰椎管狭窄症可获得良好的早期临床效果,但本研究随访时间较短,未评估远期邻近节段退变情况,且病例数较少,术后未对椎旁肌进行 MRI 对比观察等,有待长期随访观察明确。
References
- 1.Genevay S, Atlas SJ Lumbar spinal stenosis. Best Pract Res Clin Rheumatol. 2010;24(2):253–265. doi: 10.1016/j.berh.2009.11.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.徐文斌, 范顺武, 赵兴 腰椎手术失败综合征的再手术现状. 中华骨科杂志. 2012;32(10):979–981. [Google Scholar]
- 3.Glassman SD, Carreon LY, Dimar JR, et al Clinical outcomes in older patients after posterolateral lumbar fusion. Spine J. 2007;7(5):547–551. doi: 10.1016/j.spinee.2006.11.003. [DOI] [PubMed] [Google Scholar]
- 4.Santos ER, Goss DG, Morcom RK, et al Radiologic assessment of interbody fusion using carbon fiber cages. Spine (Phila Pa 1976) 2003;28(10):997–1001. doi: 10.1097/01.BRS.0000061988.93175.74. [DOI] [PubMed] [Google Scholar]
- 5.方向前, 范顺武, 张峭巍 螺旋 CT 扫描重建在评估腰椎椎间融合术后骨性融合中的价值研究. 中华骨科杂志. 2007;27(10):753–758. [Google Scholar]
- 6.Atlas SJ, Keller RB, Robson D, et al Surgical and nonsurgical management of lumbar spinal stenosis: four-year outcomes from the maine lumbar spine study. Spine (Phila Pa 1976) 2000;25(5):556–562. doi: 10.1097/00007632-200003010-00005. [DOI] [PubMed] [Google Scholar]
- 7.Madan SS, Harley JM, Boeree NR Circumferential and posterolateral fusion for lumbar disc disease. Clin Orthop Relat Res. 2003;(409):114–123. doi: 10.1097/01.blo.0000059581.08469.77. [DOI] [PubMed] [Google Scholar]
- 8.Fu YS, Zeng BF, Xu JG Long-term outcomes of two different decompressive techniques for lumbar spinal stenosis. Spine (Phila Pa 1976) 2008;33(5):514–518. doi: 10.1097/BRS.0b013e3181657dde. [DOI] [PubMed] [Google Scholar]
- 9.Kuriyama N, Ito H Electromyographic functional analysis of the lumbar spinal muscles with low back pain. J Nippon Med Sch. 2005;72(3):165–173. doi: 10.1272/jnms.72.165. [DOI] [PubMed] [Google Scholar]
- 10.Gejo R, Matsui H, Kawaguchi Y, et al Serial changes in trunk muscle performance after posterior lumbar surgery. Spine (Phila Pa 1976) 1999;24(10):1023–1028. doi: 10.1097/00007632-199905150-00017. [DOI] [PubMed] [Google Scholar]
- 11.Bresnahan L, Ogden AT, Natarajan RN, et al A biomechanical evaluation of graded posterior element removal for treatment of lumbar stenosis: comparison of a minimally invasive approach with two standard laminectomy techniques. Spine (Phila Pa 1976) 2009;34(1):17–23. doi: 10.1097/BRS.0b013e318191438b. [DOI] [PubMed] [Google Scholar]
- 12.Airaksinen O, Herno A, Turunen V, et al Surgical outcome of 438 patients treated surgically for lumbar spinal stenosis. Spine (Phila Pa 1976) 1997;22(19):2278–2282. doi: 10.1097/00007632-199710010-00016. [DOI] [PubMed] [Google Scholar]
- 13.Yasar B, Simşek S, Er U, et al Functional and clinical evaluation for the surgical treatment of degenerative stenosis of the lumbar spinal canal. J Neurosurg Spine. 2009;11(3):347–352. doi: 10.3171/2009.3.SPINE08692. [DOI] [PubMed] [Google Scholar]
- 14.Guyer RD, Patterson M, Ohnmeiss DD Failed back surgery syndrome: diagnostic evaluation. J Am Acad Orthop Surg. 2006;14(9):534–543. doi: 10.5435/00124635-200609000-00003. [DOI] [PubMed] [Google Scholar]
- 15.Young S, Veerapen R, O’Laoire SA Relief of lumbar canal stenosis using multilevel subarticular fenestrations as an alternative to wide laminectomy: preliminary report. Neurosurgery. 1988;23(5):628–633. doi: 10.1227/00006123-198811000-00014. [DOI] [PubMed] [Google Scholar]
- 16.Guiot BH, Khoo LT, Fessler RG A minimally invasive technique for decompression of the lumbar spine. Spine (Phila Pa 1976) 2002;27(4):432–438. doi: 10.1097/00007632-200202150-00021. [DOI] [PubMed] [Google Scholar]
- 17.Papavero L, Thiel M, Fritzsche E, et al Lumbar spinal stenosis: prognostic factors for bilateral microsurgical decompression using a unilateral approach. Neurosurgery. 2009;65(6 Suppl):182–187. doi: 10.1227/01.NEU.0000341906.65696.08. [DOI] [PubMed] [Google Scholar]
- 18.Hackenberg L, Halm H, Bullmann V, et al Transforaminal lumbar interbody fusion: a safe technique with satisfactory three to five year results. Eur Spine J. 2005;14(6):551–558. doi: 10.1007/s00586-004-0830-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kim KT, Lee SH, Suk KS, et al The quantitative analysis of tissue injury markers after mini-open lumbar fusion. Spine (Phila Pa 1976) 2006;31(6):712–716. doi: 10.1097/01.brs.0000202533.05906.ea. [DOI] [PubMed] [Google Scholar]
- 20.赵兴, 范顺武 腰椎及腰骶椎融合术后邻近节段的退行性疾病. 中华骨科杂志. 2005;25(10):618–621. [Google Scholar]
- 21.Lai PL, Chen LH, Niu CC, et al Relation between laminectomy and development of adjacent segment instability after lumbar fusion with pedicle fixation. Spine (Phila Pa 1976) 2004;29(22):2527–2532. doi: 10.1097/01.brs.0000144408.02918.20. [DOI] [PubMed] [Google Scholar]
- 22.Kato M, Konishi S, Matsumura A, et al Clinical characteristics of intraspinal facet cysts following microsurgical bilateral decompression via a unilateral approach for treatment of degenerative lumbar disease. Eur Spine J. 2013;22(8):1750–1757. doi: 10.1007/s00586-013-2763-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Suk SI, Lee CK, Kim WJ, et al Adding posterior lumbar interbody fusion to pedicle screw fixation and posterolateral fusion after decompression in spondylolytic spondylolisthesis. Spine (Phila Pa 1976) 1997;22(2):210–220. doi: 10.1097/00007632-199701150-00016. [DOI] [PubMed] [Google Scholar]


