Abstract
目的
初步探讨 BMSCs 条件培养液对小胶质细胞(microglia,MGs)激活及其分泌精氨酸酶 1(arginase 1,Arg1)的影响。
方法
取 4 周龄 SD 大鼠股骨和胫骨骨髓,采用差速贴壁法分离培养原代 BMSCs,行 Vimentin 免疫荧光染色鉴定。取新生 3 日内 SD 大鼠全脑,采用胰蛋白酶消化法分离培养原代 MGs,行 Iba1 免疫荧光染色鉴定。收集对数生长期 BMSCs 培养液制备 BMSCs 条件培养液,取原代 MGs,分别使用含 BMSCs 条件培养液的 DMEM/F12 培养基(实验组)和普通 DMEM/F12 培养基(对照组)培养。培养 48 h 后采用倒置相差显微镜观察 MGs 的形态改变;Iba1 免疫荧光染色观察 MGs 激活状态;Iba1 和 Arg1 免疫荧光双标染色及 Western blot 检测 MGs 中 Arg1 的表达。
结果
倒置相差显微镜观察示 BMSCs 约 14 d 进入对数生长期,Vimentin 免疫荧光染色结果示 98% 以上细胞呈阳性反应;MGs 约 21 d 进入对数生长期,Iba1免疫荧光染色结果示约 80% 细胞呈阳性反应。倒置相差显微镜观察示实验组 MGs 被激活,激活后的 MGs 胞体增大、突起变短、呈阿米巴样变化。免疫荧光染色示实验组 Iba1 阳性细胞显著多于对照组,比较差异有统计学意义(t=0.007,P=0.000);免疫荧光双标染色示实验组 Iba1 和 Arg1 双阳性细胞显著多于对照组,比较差异有统计学意义(t=0.007,P=0.000);Western blot 示实验组 Arg1 蛋白相对表达量显著高于对照组,比较差异有统计学意义(t=0.001,P=0.000)。
结论
BMSCs 条件培养液可激活 MGs,并促进 MGs 表达 Arg1。
Keywords: BMSCs, 小胶质细胞, 精氨酸酶 1, 大鼠
Abstract
Objective
To observe the effect of bone marrow mesenchymal stem cells (BMSCs) conditioned medium on microglia (MGs) and its secretion of arginase 1 (Arg1).
Methods
The BMSCs separated through differential adhesion method from the femur and tibia marrow of 4-week-old Sprague Dawley (SD) rats were cultured and identified by Vimentin immunofluorescence staining; whereas MGs separated through trypsin digestion method from the brain of 3-day-old SD rats were cultured and identified by Iba1 immunofluorescence staining. The primary MGs were cultured with DMEM/F12 medium containing BMSCs conditioned medium (experimental group) and with single DMEM/F12 medium (control group), respectively. After 48 hours of culture, the morphology of MGs was observed by inverted phase contrast microscope, the activated state of MGs was detected by using Iba1 immunofluorescence staining, and Arg1 expression of MGs was assessed by Iba1-Arg1 double-labelling immunofluorescence staining and Western blot method.
Results
Inverted phase contrast microscope observation showed that BMSCs entered logarithmic growth phase at 14 days after culture, and more than 98% cells were positive to Vimentin immunofluorescence staining; whereas MGs entered logarithmic growth phase at 21 days after culture, and around 80% cells were positive to Iba1 immunofluorescence staining. Inverted phase contrast microscope observation displayed that in the experimental group, MGs were activated with increased size of soma, shortened process, and amoeba change. Immunofluorescence staining displayed that the Iba1 positive cells number in the experimental group was significantly higher than that in the control group (t=0.007, P=0.000); double-labelling immunofluorescence staining revealed that the Iba1-Arg1 positive cells number in the experimental group was significantly higher than that in the control group (t=0.007, P=0.000); and Western blot results elucidated that the relative expression of Arg1 protein in the experimental group was significantly higher than that in the control group (t=0.001, P=0.000).
Conclusion
BMSCs conditioned medium can activate MGs and induce MGs to express Arg1.
Keywords: Bone marrow mesenchymal stem cells, microglia, arginase 1, rat
BMSCs 是一种能够自我复制和多向分化的非造血多能干细胞[1]。研究证实 BMSCs 移植治疗神经系统疾病可有效恢复神经功能,其不仅可替代损伤的神经元、分泌多种神经营养和保护因子促进神经功能的康复[2],还可作用于神经胶质细胞,调节胶质细胞的功能[3]。小胶质细胞(microglia,MGs)是中枢重要的免疫调控细胞,参与多种急慢性中枢疾病的损伤和修复过程。BMSCs 移植可能通过调节 MGs 介导的免疫炎性反应发挥神经保护作用[4]。精氨酸酶 1(arginase 1,Arg1)是机体氮代谢的关键酶,参与调控中枢神经系统功能。Arg1 的表达与胶质细胞的激活密切相关,神经损伤应激时胶质细胞活化后,可分泌 Arg1 参与神经保护功能[5-7]。BMSCs 是否可通过调控 MGs 表达 Arg1,从而影响中枢精氨酸代谢和神经功能,目前鲜见报道。因此,本研究拟采用 BMSCs 条件培养液诱导 MGs 分泌 Arg1,观察 BMSCs 对 MGs 的激活及对 Arg1 分泌的影响,为探索 BMSCs 移植治疗神经系统疾病的机制提供参考。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
新生 3 日内清洁级 SD 大鼠 10 只,体质量 6~12 g,雌雄不限;4 周龄清洁级 SD 大鼠 10 只,体质量 90~100 g,雌雄各半;由成都达硕实验动物有限公司提供。
DMEM/F12 培养基、DMEM 培养基、FBS、0.25%Trypsin-EDTA(GIBCO 公司,美国);青链霉素双抗(HyClone 公司,美国);山羊抗大鼠 Iba1(ARG 公司,美国);兔抗大鼠 Arg1、兔抗大鼠 Vimentin、小鼠抗羊二抗、羊抗兔二抗、Alexa Fluor 488 小鼠抗兔二抗、Cy3 兔抗山羊二抗(北京博奥森生物技术有限公司);兔抗 β-actin 多克隆抗体(北京中杉金桥生物技术有限公司);裂解液、蛋白酶抑制剂、Acr、Tris、EDTA、TEMED、SDS(碧云天生物技术研究所)。
0.2 mm 聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜、电泳仪、半干转膜器、凝胶成像系统(Bio-Rad 公司,美国);T-75 细胞培养瓶、6 孔或 96 孔培养板、移液枪(Eppendorf 公司,德国);倒置荧光显微镜、倒置相差显微镜(Leica 公司,德国);解剖显微镜(Olympus 公司,日本);LAS-3000 化学发光成像系统(FUJIFILM 公司,日本);Image Pro Plus 6.0 图像分析软件(Media Cybernetics 公司,美国)。
1.2. BMSCs 分离培养及鉴定
取 4 周龄 SD 大鼠 10 只,10% 水合氯醛麻醉,断颈处死,75% 乙醇浸泡 15~20 min,迅速剪开两侧后肢皮肤及肌肉,取出股骨及胫骨,PBS 冲洗 3 遍;移入含 DMEM 培养液的培养皿中,移除两端骨骺,暴露骨髓腔,1 000 μL 移液枪冲洗,将骨髓冲入培养皿;将培养液移入离心管,以离心半径 5 cm、1 000 r/min 离心 10 min。弃去上清液,加入含 10%FBS 的 DMEM 培养基重悬细胞,以 100 个/mL 密度接种于 96 孔培养板(每孔 100 μL)和 75 cm2 培养瓶(每瓶 10 mL),37℃、5%CO2 及饱和湿度培养箱培养,每 5~7 天更换 1 次培养基。倒置相差显微镜下观察细胞形态和密度,当细胞密度达 1×106个/mL 时,取 96 孔培养板培养细胞,参照文献[8]方法,采用 Vimentin 免疫荧光染色法鉴定。收集培养瓶内 BMSCs 培养液待用。
1.3. MGs 分离培养及鉴定
取新生 3 日内 SD 大鼠 10 只,75% 乙醇浸泡 15~20 min,断颈取头,取出全脑,解剖显微镜下将脑膜及血管剥离干净,在培养皿内用细胞剪将大脑皮质剪碎至 1 mm×1 mm×1 mm 大小,加入 10 mL 0.25% 胰蛋白酶,放入 37℃ 孵箱,消化 15 min;300 目筛网过滤,收集细胞滤液,以离心半径 5 cm、1 000 r/min 离心 10 min。弃去上清液,加入含 10%FBS 的 DMEM 培养基重悬细胞,以 100 个/mL 密度接种于预先涂布多聚赖氨酸的 75 cm2 培养瓶中,37℃、5%CO2 及饱和湿度培养箱培养。每 2~3 天换液 1 次,培养 10~14 d倒置相差显微镜观察细胞出现明显分层后,将培养瓶置于 200 r/min 摇床上振摇 4 h。收集含 MGs 的培养液,同上法离心 10 min;弃上清,沉淀加入 DMEM/F12 培养液,以 100 个/mL 密度接种于预先涂布多聚赖氨酸的 96 孔或 6 孔培养板,37℃、5% CO2 及饱和湿度培养箱培养。倒置相差显微镜观察细胞形态和密度,当细胞密度达 1×106 个/mL 时,采用 BMSCs 培养液干预 MGs 48 h。取 96 孔培养板培养 MGs,参照文献[9]方法,采用 Iba1 免疫荧光染色法鉴定。
1.4. BMSCs 条件培养液的制备及实验分组
选取对数生长期的 BMSCs,待融合度达 80%~90% 时,血清饥饿 24 h。采用胰蛋白酶消化制成单细胞悬液,以 1×106 个/mL 密度接种于 75 cm2 培养瓶中,加入 10 mL 无血清 DMEM/F12 培养液培养 24 h 后收集上清,用 0.22 μm 滤膜过滤,即得 BMSCs 条件培养液,–20℃ 保存。
取细胞融合率为 85% 的原代 MGs 分为两组,实验组使用含 1×105 U/L 青霉素、100 mg/L 链霉素和 10 μg/L BMSCs 条件培养液的 DMEM/F12 培养基培养,对照组使用不含血清的普通培养基(含 1×105 U/L 青霉素、100 mg/L 链霉素的 DMEM/F12 培养基)培养。取密度为100 个/mL的原代MGs悬液,以2 mL/孔接种于 6 孔培养板,按分组添加相应培养基后,置于 37℃、5%CO2 及饱和湿度细胞培养箱中培养 48 h 后,收集培养 MGs 行以下观测。
1.5. 观测指标
1.5.1. 倒置相差显微镜下观察 MGs 生长情况及形态
倒置相差显微镜下观察并比较两组 MGs 的生长情况及形态。
1.5.2. 免疫荧光染色检测 MGs 中 Iba1 蛋白表达
弃培养液,室温 PBS 清洗 3 次,10 min/次;37℃、4% 多聚甲醛固定 30 min,PBS 清洗 3 次,10 min/次;3% H2O2 37℃ 下透膜 15 min,PBS 清洗 3 次,10 min/次;5% 牛血清白蛋白 37℃ 下封闭 30 min,甩干不清洗;加入山羊抗大鼠 Iba1,4℃ 冰箱内孵育过夜;PBS 清洗 3 次,10 min/次;滴加 Cy3 兔抗山羊二抗 100 μL,37℃ 下避光孵育 1 h;PBS 清洗 3 次,10 min/次;DAPI 染液复染细胞核 10 min,PBS 清洗 3 次,10 min/次;抗荧光淬灭剂封片处理后,倒置荧光显微镜观察 MGs 中 Iba1 的表达,并在 10×10 倍显微镜下随机选取 5 个视野,计数 Iba1 阳性细胞,取均值。实验重复 3 次。
1.5.3. 免疫荧光染色观测 MGs 中 Iab1 和 Arg1 双阳性细胞的表达
弃培养液,方法同前进行封闭后,加入一抗山羊抗大鼠 Iba1、兔抗大鼠 Arg1 100 μL,4℃ 冰箱内孵育过夜;PBS 清洗 3 次,10 min/次;滴加 FITC 标记的 Alexa Fluor 488 小鼠抗兔二抗、Cy3 兔抗山羊二抗 100 μL,37℃ 下避光孵育 1 h;PBS 清洗 3 次,10 min/次;DAPI 染液复染细胞核 10 min,PBS 清洗 3 次,10 min/次;抗荧光淬灭剂封片处理后,倒置荧光显微镜观察 Iba1 与 Arg1 两种蛋白在细胞中的表达情况。其中红色荧光为 Iba1 阳性细胞(MGs),绿色荧光为 Arg1 阳性细胞,若细胞同时表达红色和绿色荧光则提示为 Arg1 阳性的 MGs。并在 10 ×10 倍显微镜下随机选取 5 个视野,计数 Iba1 和 Arg1 双阳性细胞,取均值。实验重复 3 次。
1.5.4. Western blot 检测 MGs 中 Arg1 蛋白表达
弃培养液,预冷 PBS 清洗 2 次;加入含蛋白酶抑制剂裂解液(50 μL/孔)冰上裂解 30 min,细胞刷挂取细胞;收集细胞裂解液于 1 mL 离心管,冰浴 30 min,4℃ 以离心半径 5 cm、15 000 r/min 离心 10 min,回收上清蛋白溶液。行 BCA 法蛋白质定量检测。以 15 μL/孔对蛋白质行 SDS-PAGE 电泳分离,25 V、20 min 半干转至 PVDF 膜,37℃、5% 脱脂牛奶封闭 1 h,加入一抗兔抗 β-actin、兔抗大鼠 Arg1 300 μL,4℃ 冰箱内孵育过夜;TBST 清洗 3 次,10 min/次;加入羊抗兔二抗 300 μL,室温孵育 2 h,TBST 清洗 3 次,10 min/次;ECL 反应液孵育 4 min,透明薄膜密封,以 LAS-3000 化学发光成像系统进行曝光检测。Image Lab 软件分析吸光度(A)值。实验重复 3 次。
1.6. 统计学方法
采用 SPSS20.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. BMSCs 形态学观察及鉴定
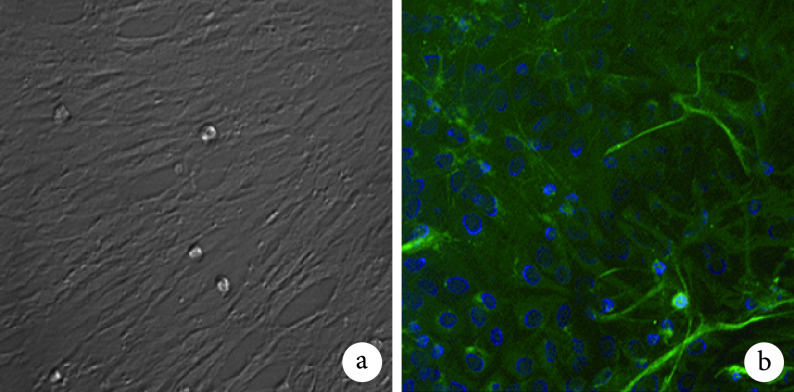
倒置相差显微镜观察示,原代 BMSCs 培养 1~3 d 呈圆形,细胞排列疏松;3 d 后细胞呈长梭形,胞体狭窄,胞核区略透光;7 d 后细胞伸出单个或多个细长突起;约 14 d 进入对数生长期。见图 1a。Vimentin 免疫荧光染色示,98% 以上细胞呈阳性反应,绿色荧光表达于细胞内。见图 1b。
图 1.
Morphology observation and identification of primary BMSCs
原代 BMSCs 形态学观察及鉴定
a. 培养 14 d 形态学观察(倒置相差显微镜×400);b. Vimentin 免疫荧光染色鉴定(倒置荧光显微镜×400)
a. Morphology observation after 14 days of culture (Inverted phase contrast microscope×400); b. Identification of Vimentin immunofluorescence staining (Inverted fluorescence microscope×400)
2.2. MGs 形态学观察及鉴定
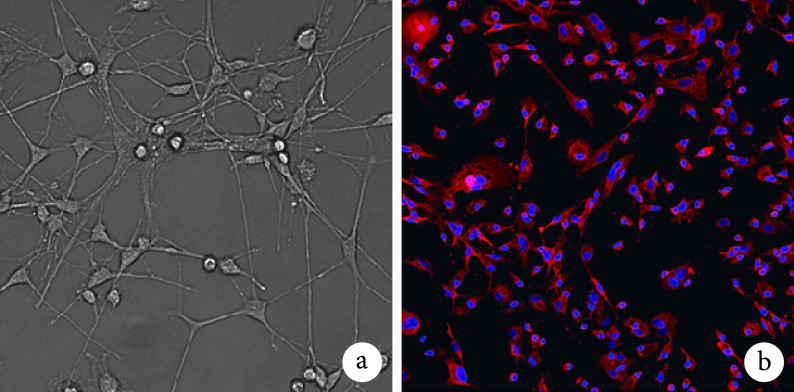
倒置相差显微镜观察示,原代 MGs 培养 14 d 时呈明显分层生长状态。经摇床机械分离后,收集含 MGs 的培养液再接种,培养 1~2 d 后,细胞体积较小,呈圆形;3 d 后细胞体积明显增大,呈圆形,胞核区略透光;7 d 后细胞伸出单个或多个细长突起;约 21 d 进入对数生长期。见图 2a。Iba1 免疫荧光染色示,约 80% 细胞呈阳性反应,红色荧光表达于细胞内。见图 2b。
图 2.
Morphology observation and identification of primary MGs
原代 MGs 形态学观察及鉴定
a. 培养 21 d 形态学观察(倒置相差显微镜×400);b. Iba1 免疫荧光染色鉴定(倒置荧光显微镜×400)
a. Morphology observation after 21 days of culture (Inverted phase contrast microscope×400); b. Identification of Iba1 immunofluorescence staining (Inverted fluorescence microscope×400)
2.3. BMSCs 条件培养液刺激后 MGs 激活的观察
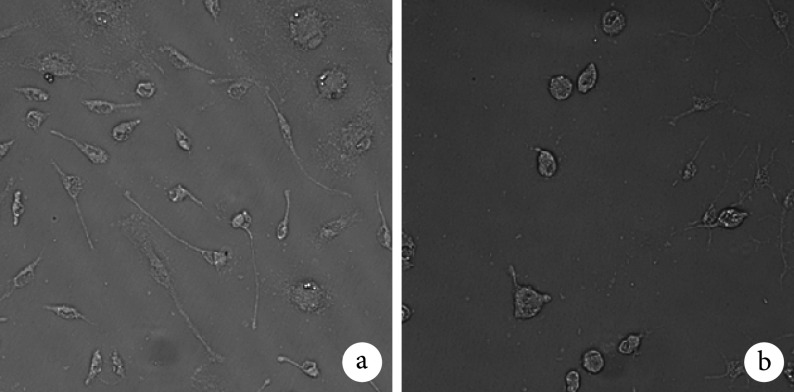
倒置相差显微镜观察示,实验组 MGs 较对照组胞体增大、突起变短、呈阿米巴样变化,提示 BMSCs 可激活 MGs。见图 3。
图 3.
Morphology observation of MGs activated by BMSCs conditioned medium (Inverted phase contrast microscope×100)
BMSCs 条件培养液激活 MGs 形态学观察(倒置相差显微镜×100)
a. 对照组;b. 实验组
a. Control group; b. Experimental group
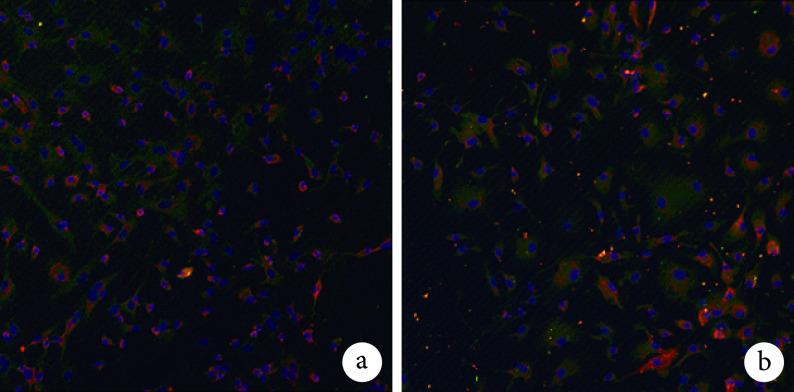
2.4. 免疫荧光染色检测 MGs 中 Iba1 和 Arg1 蛋白表达
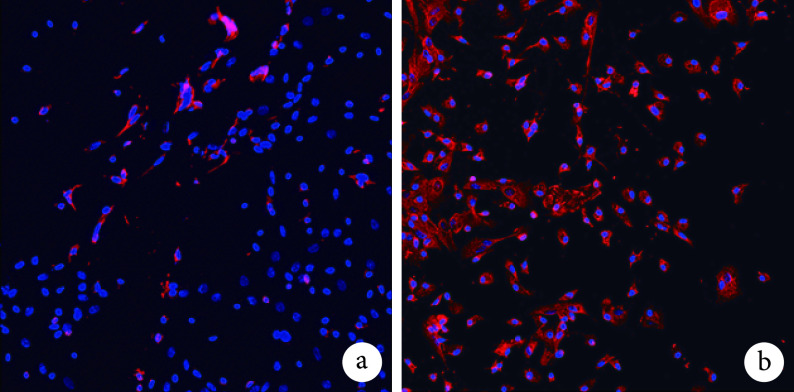
Iba1 免疫荧光染色示,对照组约 60% 细胞呈 Iba1 染色阳性,实验组约 99% 以上细胞呈 Iba1 反应阳性。见图 4。实验组 Iba1 阳性细胞数为(125.778±7.633)个/视野,显著高于对照组的(42.444±5.337)个/视野,比较差异有统计学意义(t=0.007,P=0.000)。
图 4.
Ibal immunofluorescence staining observation of MGs activated by BMSCs conditioned medium (Inverted fluorescence microscope×100)
BMSCs 条件培养液激活 MGs 后 Iba1 免疫荧光染色观察(倒置荧光显微镜×100)
a. 对照组;b. 实验组
a. Control group; b. Experimental group
免疫荧光双标染色示,Iba1 和 Arg1 均表达于细胞质中。见图 5。实验组 Iba1 和 Arg1 双阳性细胞数为(72.000±1.764)个/视野,显著高于对照组的(24.111±1.900)个/视野,比较差异有统计学意义(t=0.007,P=0.000)。
图 5.
Ibal and Arg1 double-labelling immunofluorescence staining observation of MGs activated by BMSCs conditioned medium (Inverted fluorescence microscope×100)
BMSCs 条件培养液激活 MGs 后 Iba1 与 Arg1 免疫荧光双标染色观察(倒置荧光显微镜×100)
a. 对照组;b. 实验组
a. Control group; b. Experimental group
2.5. Western blot 检测 MGs 中 Arg1 蛋白表达
Western blot 检测示,实验组 Arg1 蛋白相对表达量为 1.015±0.048,显著高于对照组的 0.569±0.061,比较差异有统计学意义(t=0.001,P=0.000)。见图 6。
图 6.
Arg1 protein expression of MGs activated by BMSCs conditioned medium detected by Western blot
Western blot 检测 BMSCs 条件培养液激活 MGs 表达 Arg1 蛋白
1:对照组;2:实验组
1: Control group; 2: Experimental group
3. 讨论
干细胞具有自我更新和分化的特性,可用于修复多种损伤性疾病,临床运用前景广泛。BMSCs 是较早研究并应用于临床的干细胞,其具有来源广泛、取材容易、体外易于培养并能长期保持多向分化的能力[10]。目前,研究已证实 BMSCs 除可直接影响神经元的存活和功能外,对胶质细胞也有一定调控作用。Gao 等[11]发现 BMSCs 可降低缺血缺氧性损伤后星形胶质细胞的损伤和凋亡,可释放 BDNF、VEGF、FGF 等激活 MAPK 信号通路,促进星形胶质细胞的存活和增殖。Shen 等[12]研究表明 BMSCs 在脑损伤局部可激活星形胶质细胞,活化的星形胶质细胞可促进大脑的可塑性和神经元的修复。提示 BMSCs 多方面调控胶质细胞,既可降低星形胶质细胞的损伤,又可增强星形胶质细胞对脑损伤的保护。
MGs 是神经胶质细胞的一种,是中枢神经系统中的第一道也是最主要的一道免疫防线,数量约占中枢细胞的 10%,参与调控多种神经功能。当脑组织发生损伤时,MGs 可向损伤部位募集,突起伸向损伤部位,对损伤部位发挥吞噬作用。激活的 MGs 发生形态改变,呈阿米巴样变形,胞体增大、突起变短,突起涉及范围更小,能更好地吞噬清除炎性损伤物质及释放抗炎因子[13],并通过清道夫作用及分泌功能消除与重塑神经突触[14]。Shinozaki 等[15]发现采用 MGs 激活抑制剂,可明显降低 MGs 促进星形胶质细胞激活的功能,提示 MGs 的激活是其发挥免疫调控和中枢保护作用的重要前提。我们的研究发现,与对照组相比,BMSCs 条件培养液可明显促进 MGs 的激活,其胞体增大、突起变短、呈阿米巴样变化,Iba1 阳性细胞数显著增加,表明激活 MGs 可能是 BMSCs 移植治疗脑损伤等中枢神经系统疾病的机制之一。其作用机制与 BMSCs 条件培养液内含细胞因子、趋化因子、神经营养因子、神经迁移因子等相关,这些物质不仅可直接保护神经元,还可通过激活胶质细胞间接支持神经元的活性和功能[16]。
Arg1 存在于细胞质中,是尿素循环的重要参与者,主要在肝组织中表达,也在脑组织中表达。在细胞因子和抗原的刺激下,Arg1 可在多种组织或细胞类型中表达。研究发现 Arg1 参与中枢神经系统多种神经保护作用,分解精氨酸,促进氨等氧化应激产物的分解和排泄;参与环磷酸腺苷(cyclic adenosine monophosphate,cAMP)调控 BDNF、神经营养因子 3 等神经营养因子表达,影响神经损伤后髓鞘的再生;增强 cAMP/环磷腺苷效应元件结合蛋白复合体诱导的神经轴突延长[17]。Arg1 也参与中枢多种疾病的发生、发展和转归。脑缺血性损伤时,L-精氨酸的减少可代偿性地导致损伤局部 Arg1 和一氧化碳合成酶的分泌,大量星形胶质细胞和巨噬细胞在损伤局部聚集并分泌 Arg1,而损伤局部 Arg1 的增加是 cAMP 信号环路促进神经再生的重要途径[7]。MGs 是中枢 Arg1 的重要来源,活化的 MGs 可表达 Arg1,表达 Arg1 的 MGs 在老年痴呆病理性 Aβ 斑块附近聚集并表达 BDNF、IGF-1 等神经营养因子,促进受损神经元的修复[18]。我们的研究发现,BMSCs 条件培养液可促进活化后的 MGs 表达 Arg1。其作用机制可能与激活的 MGs 在不同刺激因子作用下表现为不同极化状态有关,激活的 MGs 在 IL-4、IL-10 等细胞因子作用下,通过 TLr4 信号通路向 M2 方向极化而表达 Arg1,发挥神经免疫调控和神经保护作用[19]。
综上述,本研究对 BMSCs 条件培养液影响 MGs 的活化及活化后 MGs 表达 Arg1 的功能进行了初步探索。提示 BMSCs 移植除了直接分化补偿损伤的神经元和神经胶质细胞外,还可与 MGs 等神经胶质细胞进行互通,影响 MGs 的功能。但不同浓度梯度的 BMSCs 条件培养液对 MGs 的活化及活化后 MGs 表达 Arg1 的作用效果,有待进一步实验研究明确。
Funding Statement
国家自然科学基金资助项目(81603537、81704160);中国博士后科学基金(2017M612928);四川省科技厅国际科技合作与交流项目(2017HH0004);四川省教育厅项目(17ZA0163)
National Natural Science Foundation of China (81603537, 81704160); Postdoctoral Science Foundation of China (2017M612928); International Cooperation and Exchange Project of Sichuan Provincial Science and Technology Department (2017HH0004); Key Project of Sichuan Provincial Education Department (17ZA0163)
References
- 1.Pittenger MF, Mackay AM, Beck SC, et al Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284(5411):143–147. doi: 10.1126/science.284.5411.143. [DOI] [PubMed] [Google Scholar]
- 2.Shen Q, Yin Y, Xia QJ, et al Bone Marrow Stromal Cells Promote Neuronal Restoration in Rats with Traumatic Brain Injury: Involvement of GDNF Regulating BAD and BAX Signaling. Cell Physiol Biochem. 2016;38(2):748–762. doi: 10.1159/000443031. [DOI] [PubMed] [Google Scholar]
- 3.Vaquero J, Zurita M Functional recovery after severe CNS trauma: current perspectives for cell therapy with bone marrow stromal cells. Prog Neurobiol. 2011;93(3):341–349. doi: 10.1016/j.pneurobio.2010.12.002. [DOI] [PubMed] [Google Scholar]
- 4.Ohtaki H,Ylostalo JH, Foraker JE, et al Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses. Proc Natl Acad Sci U S A. 2008;105(38):14638–14643. doi: 10.1073/pnas.0803670105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Vaquero J, Zurita M Functional recovery after severe CNS trauma: current perspectives for cell therapy with bone marrow stromal cells. Prog Neurobiol. 2011;93(3):341–349. doi: 10.1016/j.pneurobio.2010.12.002. [DOI] [PubMed] [Google Scholar]
- 6.Liu P, Fleete MS, Jing Y, et al Altered arginine metabolism in Alzheimer's disease brains. Neurobiol Aging. 2014;35(9):1992–2003. doi: 10.1016/j.neurobiolaging.2014.03.013. [DOI] [PubMed] [Google Scholar]
- 7.Quirie A, Demougeot C, Bertrand N, et al Effect of stroke on arginase expression and localization in the rat brain. Eur J Neurosci. 2013;37(7):1193–1202. doi: 10.1111/ejn.12111. [DOI] [PubMed] [Google Scholar]
- 8.Bohrnsen F, Godek F, Kiesel J, et al Influence of TGF-beta1 on tumor transition in oral cancer cell and BMSC co-cultures. J Craniomaxillofac Surg. 2017;45(5):731–740. doi: 10.1016/j.jcms.2017.02.009. [DOI] [PubMed] [Google Scholar]
- 9.Shinozaki Y, Shibata K, Yoshida K, et al Transformation of Astrocytes to a Neuroprotective Phenotype by Microglia via P2Y1 Receptor Downregulation. Cell Rep. 2017;19(6):1151–1164. doi: 10.1016/j.celrep.2017.04.047. [DOI] [PubMed] [Google Scholar]
- 10.陈少强, 林建华 骨髓间充质干细胞移植治疗脊髓损伤的研究现状. 中国修复重建外科杂志. 2007;21(5):507–511. [PubMed] [Google Scholar]
- 11.Gao Q, Li Y, Chopp M Bone marrow stromal cells increase astrocyte survival via upregulation of phosphoinositide 3-kinase/threonine protein kinase and mitogen-activated protein kinase kinase/extracellular signal-regulated kinase pathways and stimulate astrocyte trophic factor gene expression after anaerobic insult. Neuroscience. 2005;136(1):123–134. doi: 10.1016/j.neuroscience.2005.06.091. [DOI] [PubMed] [Google Scholar]
- 12.Shen LH, Li Y, Chopp M Astrocytic endogenous glial cell derived neurotrophic factor production is enhanced by bone marrow stromal cell transplantation in the ischemic boundary zone after stroke in adult rats. Glia. 2010;58(9):1074–1081. doi: 10.1002/glia.20988. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Davalos D, Grutzendler J, Yang G, et al ATP mediates rapid microglial response to local brain injury in vivo . Nat Neurosci. 2005;8(6):752–758. doi: 10.1038/nn1472. [DOI] [PubMed] [Google Scholar]
- 14.Colonna M, Butovsky O Microglia Function in the Central Nervous System During Health and Neurodegeneration. Annu Rev Immunol. 2017;35:441–468. doi: 10.1146/annurev-immunol-051116-052358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Shinozaki Y, Shibata K, Yoshida K, et al Transformation of Astrocytes to a Neuroprotective Phenotype by Microglia via P2Y1 Receptor Downregulation. Cell Rep. 2017;19(6):1151–1164. doi: 10.1016/j.celrep.2017.04.047. [DOI] [PubMed] [Google Scholar]
- 16.Cizkova D, Devaux S, Le Marrec-Croq F, et al Modulation properties of factors released by bone marrow stromal cells on activated microglia: an in vitro study . Sci Rep. 2014;4:7514. doi: 10.1038/srep07514. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ma TC, Barco A, Ratan RR, et al cAMP-responsive element-binding protein (CREB) and cAMP co-regulate activator protein 1 (AP1)-dependent regeneration-associated gene expression and neurite growth. J Biol Chem. 2014;289(47):32914–32925. doi: 10.1074/jbc.M114.582460. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Cherry JD, Olschowka JA, O’Banion MK Arginase 1+ microglia reduce Abeta plaque deposition during IL-1beta-dependent neuroinflammation. J Neuroinflammation. 2015;12:203. doi: 10.1186/s12974-015-0411-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Orihuela R, Mcpherson CA, Harry GJ Microglial M1/M2 polarization and metabolic states. Br J Pharmacol. 2016;173(4):649–665. doi: 10.1111/bph.13139. [DOI] [PMC free article] [PubMed] [Google Scholar]