Abstract
目的
探讨多孔磷酸钙/骨基质明胶复合骨水泥(以下简称多孔复合骨水泥)修复兔腰椎骨缺损的效果。
方法
采用 Urist 等的方法制备成年新西兰兔骨基质明胶(bone matrix gelatin,BMG),参考 W/O/W 复乳法制作聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic)acid,PLGA]空白微球,将 PLGA 空白微球和 BMG 与磷酸钙骨水泥(calcium phosphate cement,CPC)复合,构建多孔复合骨水泥。通过体外抗溃散观察、孔隙率测定及生物力学试验,观察其理化特性;并以 CPC 作对照。取 30 只 2 月龄新西兰兔,制备 L3 椎体大小为 4 mm×3 mm×3 mm 的骨缺损后,分别填入多孔复合骨水泥(实验组,n=15)和 CPC(对照组,n=15)。术后第 4、8、12 周, X 线片观察骨融合情况,micro-CT 分析骨密度(bone mineral density,BMD)、骨体积分数(bone volume fraction,BVF)、骨小梁厚度(trabecular thickness,Tb. Th.)、骨小梁数量(trabecular number,Tb.N.)和骨小梁分离度(trabecular spacing,Tb. Sp.),组织学观察新生骨形成情况。
结果
两种骨水泥均有较好抗溃散性,多孔复合骨水泥孔隙率为 55.06%±1.18%,抗压强度为(51.63±6.73)MPa,与 CPC的孔隙率(49.38%±1.75%)以及抗压强度(63.34±3.27)MPa 相比,差异有统计学意义(t=4.254,P=0.006;t=2.476,P=0.034)。X 线片观察示,随时间延长,两组材料与宿主之间的边界逐步模糊,且实验组第 12 周时边界已消失、对照组仍可见。micro-CT 检测各时间点实验组 BMD、BVF、Tb. Th.、Tb. N.以及 Tb. Sp.与对照组相比,差异均有统计学意义(P<0.05)。组织学观察示,随时间延长,两组植入材料中均见新骨生长,其中实验组新生骨与宿主骨形成骨性连接,优于对照组。
结论
多孔复合骨水泥具有骨诱导活性和骨传导双重作用,可以有效促进兔腰椎骨缺损修复重建。
Keywords: 磷酸钙骨水泥, 骨基质明胶, 聚乳酸-羟基乙酸共聚物, 复合骨水泥, 兔
Abstract
Objective
To investigate the effect of a porous calcium phosphate/bone matrix gelatin (BMG) composite cement (hereinafter referred to as the “porous composite cement”) for repairing lumbar vertebral bone defect in a rabbit model.
Methods
BMG was extracted from adult New Zealand rabbits according to the Urist’s method. Poly (lactic-co-glycolic) acid (PLGA) microsphere was prepared by W/O/W double emulsion method. The porous composite cement was developed by using calcium phosphate cement (CPC) composited with BMG and PLGA microsphere. The physicochemical characterizations of the porous composite cement were assessed by anti-washout property, porosity, and biomechanical experiment, also compared with the CPC. Thirty 2-month-old New Zealand rabbits were used to construct vertebral bone defect at L3 in size of 4 mm×3 mm×3 mm. Then, the bone defect was repaired with porous composite cement (experimental group, n=15) or CPC (control group, n=15). At 4, 8, and 12 weeks after implantation, each bone specimen was assessed by X-ray films for bone fusion, micro-CT for bone mineral density (BMD), bone volume fraction (BVF), trabecular thickness (Tb. Th.), trabecular number (Tb.N.), and trabecular spacing (Tb. Sp.), and histological section with toluidine blue staining for new-born bone formation.
Results
The study demonstrated well anti-washout property in 2 groups. The porous composite cement has 55.06%±1.18% of porosity and (51.63±6.73) MPa of compressive strength. The CPC has 49.38%±1.75% of porosity and (63.34±3.27) MPa of compressive strength. There were significant differences in porosity and compressive strength between different cements (t=4.254, P=0.006; t=2.476, P=0.034). X-ray films revealed that the zone between the cement and host bone gradually blurred with the time extending. At 12 weeks after implantation, the zone was disappeared in the experimental group, but clear in the control group. There were significant differences in BMD, BVF, Tb. Th., Tb. N., and Tb. Sp. between 2 groups at each time point (P<0.05). Histological observation revealed that there was new-born bone in the cement with the time extending in 2 groups. Among them, bony connection was observed between the new-born bone and the host in the experimental group, which was prior to the control group.
Conclusion
The porous composite cement has dual bioactivity of osteoinductivity and osteoconductivity, which are effective to promote bone defect healing and reconstruction.
Keywords: Calcium phosphate cement, bone matrix gelatin, poly (lactic-co-glycolic) acid, composite cement, rabbit
磷酸钙骨水泥(calcium phosphate cement,CPC)是由磷酸四钙和无水磷酸氢钙配制而成,也称为羟基磷灰石骨水泥[1]。CPC 具有良好的生物相容性和骨传导性、可降解性并可以任意塑形,能满足临床上骨缺损修复的要求[2-3]。但是,单一的 CPC 脆性大,不具有骨诱导活性,而且骨水泥凝固后孔隙率较小,组织难以长入,生物活性差[4-5]。本研究选取 CPC 作为基体材料,与具有强诱导成骨活性的骨基质明胶(bone matrix gelatin,BMG)复合,并加入聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic)acid,PLGA]空白微球,制备多孔磷酸钙/骨基质明胶复合骨水泥(以下简称多孔复合骨水泥)。然后将此复合材料用于修复兔椎体骨缺损模型,探讨其对椎体骨缺损修复重建作用,为下一步临床试验奠定基础。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
成年新西兰兔 4 只,雌雄不限,体质量 2.5~3.5 kg; 2 月龄新西兰兔 30 只,雌雄各半,体质量 1.8~2.2 kg;均由西南医科大学动物实验中心提供。
PLGA (聚乳酸∶羟基乙酸=75∶25,特性黏度 0.65~0.75 dL/g,分子量 87 000~106 000;济南岱罡生物工程有限公司);异丙醇(天津市科密欧科技有限公司);CPC(上海瑞邦生物材料有限公司)。高速乳化机(巩义市予华仪器有限责任公司);硬组织切片机(Leica 公司,德国);micro-CT(Siemens 公司,德国);INSTRON 8874 生物力学试验机(INSTRON 公司,美国)。
1.2. 多孔复合骨水泥制备及检测
1.2.1. BMG 的制备
参考 Urist 等[6]方法,取 4 只成年新西兰兔长管状骨骨干,剔除软组织、骨膜、干骺端,制成直径 2~3 mm 骨颗粒,流水冲洗 2 h;液氮冷冻,粉碎机粉碎,经 60~80 目标准分样筛筛取,得到直径约 200 μm 的骨粉。24℃,分别加入 1∶1 氯仿甲醇溶液脱脂,0.6 mol/L HCl 溶液脱钙,再加入氯仿甲醇溶液脱脂后,依次经 2 mol/L CaCl2 溶液、0.5 mol/L EDTA 溶液、8 mol/L LiCl 溶液处理;置于 55℃ 水浴 24 h 后,冻干,环氧已烷灭菌备用。
1.2.2. PLGA 空白微球制备
参考 W/O/W 复乳法[7],将 1.0 g PLGA 溶于 4 mL 二氯甲烷中;注入 500 μL ddH2O,以 9 000 r/min 高速剪切 1 min 形成初乳;将初乳液快速加入至 20 mL 4% 聚乙烯醇中,在冰浴下以 9 000 r/min 高速剪切 2 min;转移至装有 400 mL 2% 异丙醇及 400 mL 0.3% 聚乙烯醇的 1 000 mL 烧杯中,24℃ 低速搅拌 5 h,使有机溶剂挥发;静置 20 min,弃上清,以离心半径 13.5 cm,2 000 r/min 离心 5 min;加 5 mL ddH2O 漂洗,弃上清,同上法再次离心 5 min,反复漂洗,收集微球,冷冻干燥。
1.2.3. 多孔复合骨水泥制备
根据前期研究结果[8],将 CPC 与 BMG 以质量比 5∶1 混合制成 CPC/BMG 固相粉末。CPC/BMG 粉末与 PLGA 空白微球混合,微球所占质量百分比为 5%;然后以 1 mol/L PBS 作为液相,按照固液比 1 g∶0.6 mL 添加至固相混合粉末,获得多孔复合骨水泥。
1.2.4. 理化特性测试
将多孔复合骨水泥固相和液相在室温下混合,搅拌均匀成浆体,注入装有 37℃PBS 溶液的培养皿中,静置 30 min 后震荡液体观察样本溃散情况。将骨水泥浆体注入直径 6 mm、长 12 mm 标准模具(模具由聚四氟乙烯塑料管制成),室温下干燥后,37℃ 水浴 24 h,再置于 37℃ 烤箱中干燥至恒重,脱模、取样。取样本采用阿基米德排水法测量其孔隙率(n=10);另于生物力学试验机上行抗压测试,加载速度为 1 mm/min,测算抗压强度(n=10)。以上各项检测均以 CPC 作为对照。
1.3. 实验分组及方法
将 30 只 2 月龄新西兰兔随机分为实验组及对照组(n=15)。两组动物经耳缘静脉注射 3% 戊巴比妥钠(1 mL/kg)麻醉后,以 L3 棘突为中心,作腰背部脊柱后正中切口,由右侧骨膜下剥离椎旁肌,暴露 L3 椎板和上、下关节突关节,暴露 L3 横突、L3 椎头侧右侧前方约 1 cm 可操作区域。以 L3 横突基底为标志,在椎体右前方用薄椎板咬骨钳制备 4 mm×3 mm×3 mm(长×宽×高)骨缺损。根据分组分别在骨缺损中填入多孔复合骨水泥(实验组)和 CPC(对照组),植入量以材料填充满缺损为宜。间断缝合切口。手术当天及术后第 1 天各肌肉注射青霉素 20 万 U 预防感染。术后第 4、8、12 周,每组各取 5 只动物,采用空气栓塞法处死,切取标本(包括骨水泥填充椎体及远、近端正常椎体),剔除周围韧带及肌肉,修剪成 4 cm 长标准样本进行观测。
1.4. 观测指标
1.4.1. 一般情况
观察手术情况和术后动物饮食、活动、切口愈合情况。
1.4.2. X 线片观察
取标本摄正侧位X线片,观察植入材料与宿主骨融合情况。曝光条件:电压80 kV、电流125 mA、曝光时间40 ms、投照距离100 cm。
1.4.3. Micro-CT 检测
取标本行 micro-CT 扫描,所得图像经三维可视化重建及自带骨骼分析软件后处理,选取椎体内复合材料植入感兴趣区域,测算骨密度(bone mineral density,BMD)、骨体积分数(bone volume fraction,BVF)、骨小梁厚度(trabecular thickness,Tb. Th.)、骨小梁数量(trabecular number,Tb.N.)和骨小梁分离度(trabecular spacing,Tb. Sp.)。
1.4.4. 组织学观察
将标本置于 4% 多聚甲醛固定,乙醇梯度脱水,过滤及包埋,硬组织切片,片厚 60 μm,甲苯胺蓝染色。镜下观察植入材料周围及内部新生骨形成情况。椎体骨为浅蓝色,新生骨为深蓝色,材料为灰色。
1.5. 统计学方法
采用 SPSS16.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. 理化特性观察
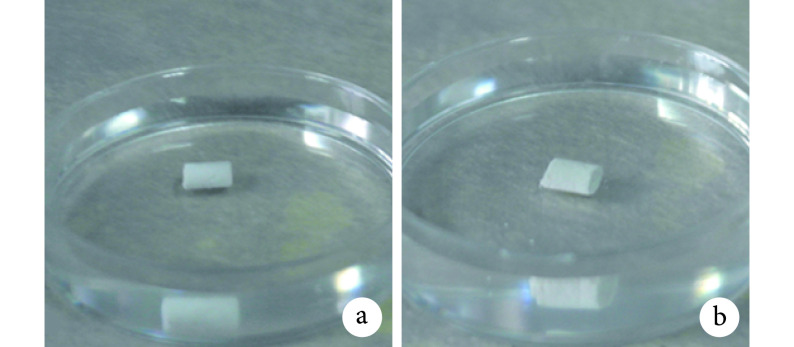
静置后两种骨水泥在 PBS 液体中大体形状完整,无明显溃散,提示均有较好抗溃散性。见图 1。多孔复合骨水泥孔隙率为 55.06%±1.18%,抗压强度为(51.63±6.73) MPa,与 CPC 的孔隙率 49.38%±1.75% 及抗压强度(63.34±3.27)MPa 相比,差异有统计学意义(t=4.254,P=0.006;t=2.476,P=0.034)。
图 1.
Anti-washout observation of the cements
骨水泥抗溃散性观察
a. CPC;b. 多孔复合骨水泥
a. CPC; b. Porous composite cement
2.2. 一般情况
两组动物手术顺利完成,手术时间约 60 min,无神经、血管损伤等并发症。术后无切口感染发生,对照组 2 只动物出现切口裂开再次缝合后愈合。所有动物均存活至实验完成。
2.3. X 线片观察
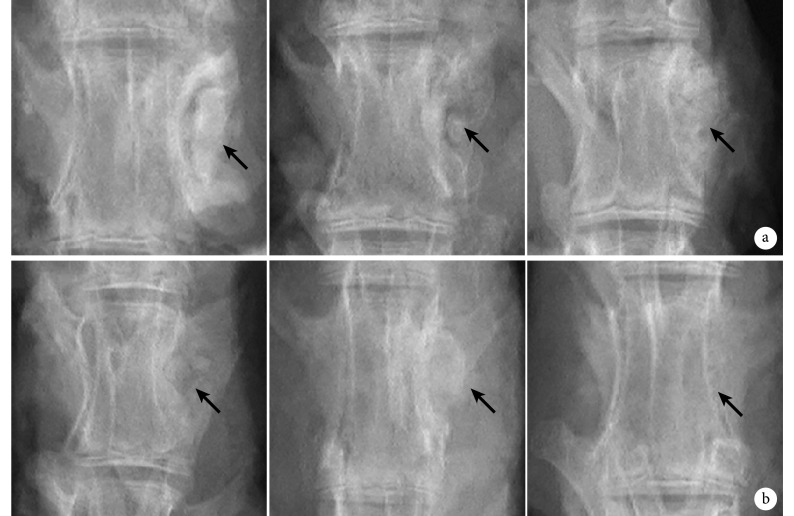
随时间延长,两组材料与宿主之间的边界逐步模糊。对照组第 4、8 周可见材料与椎体有明显边界,第 12 周边界模糊但仍然可见; 实验组第 4 周材料与椎体边界变模糊,第 8、12 周材料与宿主边界逐步消失并融合为一体。见图 2。
图 2.
X-ray films at different time points in 2 groups
两组各时间点 X 线片观察
箭头示骨水泥植入部位 从左至右分别为第 4、8、12 周 a. 对照组;b. 实验组
Arrow indicated cement implanting area From left to right for 4, 8, and 12 weeksa. Control group; b. Experimental group
2.4. micro-CT 检测
随着时间延长,两组 BMD、BVF、Tb. Th.和 Tb. N.逐步增大,Tb. Sp.逐步减小。各时间点实验组以上指标与对照组相比,差异均有统计学意义(P<0.05)。见表 1。
表 1.
Comparison of assessment of new-born bone in 2 groups (n=5,
 )
)
两组新生骨检测指标比较(n=5,
 )
)
| 组别
Group |
BMD (mg/cm3) | BVF (%) | Tb. Th.(mm) | ||||||||
| 第 4 周
Four weeks |
第 8 周
Eight weeks |
第 12 周
Twelve weeks |
第 4 周
Four weeks |
第 8 周
Eight weeks |
第 12 周
Twelve weeks |
第 4 周
Four weeks |
第 8 周
Eight weeks |
第 12 周
Twelve weeks |
|||
| 对照组
Control group |
125.8±6.5 | 136.2±8.9 | 149.9±12.9 | 0.725±0.055 | 0.778±0.043 | 0.876±0.040 | 0.180±0.031 | 0.233±0.021 | 0.261±0.017 | ||
| 实验组
Experimental group |
133.4±8.6 | 145.7±6.2 | 161.8± 8.8 | 0.875±0.028 | 0.918±0.015 | 0.957±0.035 | 0.203±0.013 | 0.257±0.041 | 0.311±0.046 | ||
| 统计值
Statistic |
t=2.430
P=0.041 |
t=2.893
P=0.020 |
t=2.761
P=0.025 |
t=5.442
P=0.001 |
t=6.842
P=0.000 |
t=3.379
P=0.010 |
t=3.985
P=0.004 |
t=2.392
P=0.044 |
t=2.640
P=0.030 |
||
2.5. 组织学观察
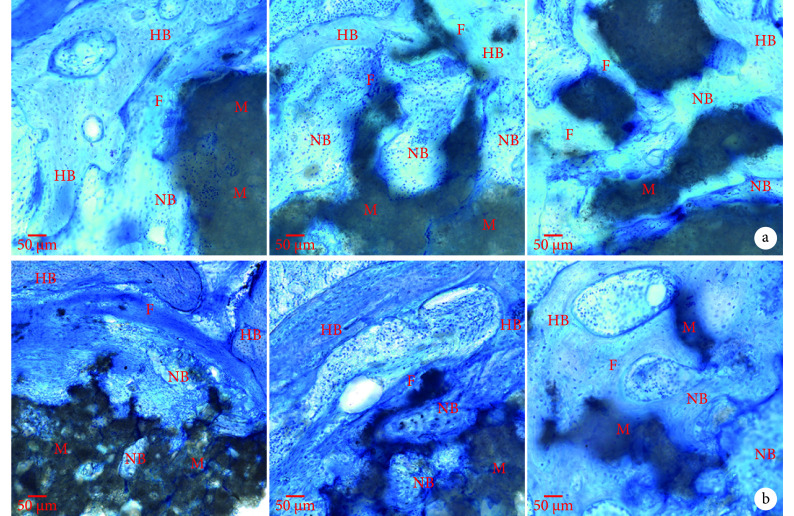
对照组:第 4 周骨缺损边缘有极少量新骨生长;第 8 周见新生骨由周围向中部生长,材料中部无新骨形成;第 12 周新生骨逐步长入至材料中部,并有少量骨桥形成。实验组:第 4 周材料开始降解吸收,逐步有新生骨长入;第 8 周材料边缘及中部骨细胞增生活跃,形成颗粒状或散在骨岛;第 12 周,新生骨增多,部分相互连接,由编织骨重塑为板层骨,材料周围新生骨与宿主骨形成骨性连接,无论是材料与宿主接触周围还是材料中部均有大量新生骨。见图 3。
图 3.
Histological observation at different time points in 2 groups (Toluidine blue × 200)
两组各时间点组织学观察(甲苯胺蓝×200)
NB:新生骨,HB:宿主骨,M:骨水泥,F:成纤维细胞 从左至右分别为第 4、8、12 周 a. 对照组;b. 实验组
NB: New-born bone, HB: Host bone, M: Cements, F: Fibroblasts From left to right for 4, 8, and 12 weeks a. Control group; b. Experimental group
3. 讨论
3.1. 多孔复合骨水泥理化性质分析
研究表明,BMG 具有强诱导成骨活性,其成骨能力与自体骨相似[9]。PLGA 空白微球在体内可快速降解,降解产物无毒无害,微球降解后留下的孔隙有利于骨组织和血管长入[10]。同时,PLGA 降解的酸性产物和孔隙中组织液渗入也有助于材料降解[11]。因此,本研究选择将 BMG 和 PLGA 加入 CPC 固相中,探讨制备具有传导成骨和诱导成骨活性的多孔复合骨水泥的可行性。
结果显示,本研究构建的多孔复合骨水泥抗溃散较好。与 CPC 相比,材料孔隙率增至 55.06%±1.18%,这有助于体液渗入和新生骨组织长入[10];但 PLGA 空白微球的加入也使多孔复合骨水泥的抗压强度明显降低。文献报道,人体松质骨的抗压强度为 4~12 MPa,皮质骨强度为 130~180 MPa[12]。本研究制备的多孔复合骨水泥的抗压强度为(51.63±6.73)MPa,超过松质骨的强度,可以达到皮质骨 1/4~1/2 强度,提示有望用于承重部位的骨缺损修复[13]。
3.2. 动物体内实验分析
3.2.1. 动物模型选择
脊柱是重要的承重部位,兔腰椎在椎体两端邻近椎间盘部位膨大,便于制作骨缺损模型。另外,兔前肢欠发达,生活体位以半直立屈曲位为主,脊柱在此体位处于负重状态,用腰椎椎体骨缺损模型能模拟人椎体骨折愈合过程[14]。本研究采用兔腰椎椎体作骨缺损模型,手术经后路从 L3 横突基底剥离至椎体侧前方,用统一规格椎板咬骨钳,制作一致性较好的可重复骨缺损模型,术中未发生神经血管损伤及动物死亡等并发症。
3.2.2. 观测结果分析
多孔复合骨水泥修复兔腰椎椎体骨缺损模型术后,未出现异物排斥反应。micro-CT 和组织学观察显示,材料植入区周围无组织变性、坏死出现。植入第 4 周,材料与周围骨组织之间有缝隙,随着时间延长,在第 8 周时缝隙模糊或消失,在第 12 周时复合材料与周围骨组织之间形成骨性连接、融合或骨组织已长入材料内部,这表明多孔复合骨水泥与兔椎体骨组织之间有良好的组织相容性。大量 CPC、BMG 与 PLGA 相关研究显示,单纯使用以上材料均具有良好生物相容性[15-18]。本研究结果显示 CPC、BMG 与 PLGA 复合后,仍具有良好的生物相容性。
骨移植替代材料修复骨缺损的主要机制包括骨传导和骨诱导。骨传导是以材料为支架,新生血管、新生骨沿着孔隙长入材料内部,破骨细胞导致材料的逐步降解吸收,成骨细胞形成新骨不断修复骨缺损,最终完成材料的降解和骨缺损的重建[19-20]。骨诱导是通过人工复合材料携带的生长因子对 MSCs 趋化、诱导,使其分化为成软骨细胞和成骨细胞,从而完成骨组织的再生与修复[21-22]。BMP、MSCs、骨生长环境是诱导成骨的关键要素,BMP 作为诱导刺激物作用于 MSCs,在有利于骨生长的血液环境中,诱导刺激骨形成[23-25]。异种骨或同种异体骨经过脱脂、脱钙、脱蛋白处理后制成 BMG,去掉了除 BMP 以外 95% 的非胶原蛋白和具有阻滞作用的脂质成分。因此,BMG 具有一定强度和孔隙,免疫原性低,生物相容性好,在体内可诱导成骨前体细胞,产生骨原细胞,经成骨细胞形成新骨,并逐渐吸收,被新骨所替代[6]。
本研究发现,CPC 植入后,新生骨自周围长入,随着时间延长,逐步向材料中部生长,CPC 材料在兔椎体骨缺损部位起骨传导作用,CPC 降解的同时,新生骨逐步长入,与文献报道一致[26-27];加入 PLGA 空白微球的多孔复合骨水泥显示了优越的生物活性,材料周围及中部均有大量新生骨长入。结果表明,多孔材料同时具有骨传导和骨诱导活性。早期以 CPC 材料为支架,周围新生血管、新生骨长入[28];随着 PLGA 空白微球的迅速降解,降解后留下的大孔有助于组织液的渗入、血管与新生骨长入,材料内部的 BMG 与之充分接触,BMG 内的 BMP 发挥作用,诱导 MSCs 分化为成软骨细胞和成骨细胞[24-25, 29]。本研究结果显示,多孔复合骨水泥材料植入后,可在椎体骨缺损周围及中部发现有成骨细胞,提示材料周围及中央新骨同步形成,多孔复合骨水泥兼具骨诱导活性和骨传导作用,可以有效修复兔椎体骨缺损,为临床应用该骨水泥提供了实验依据。
Funding Statement
四川省医学会科研课题(2015GK005);泸州-川医大联合课题(2015LZCYD-S05)
Sichuan Medical Association Science Funds (2015GK005); Joint Research Funds of Luzhou and Sichuan Medical University (2015LZCYD-S05)
References
- 1.Brown WE, Chow LC A new calcium phosphate setting cement. J Dent Res. 1983;62:672–679. [Google Scholar]
- 2.Stiller M, Kluk E, Bohner M, et al Performance of β-tricalcium phosphate granules and putty, bone grafting materials after bilateral sinus flooraugmentation in humans. Biomaterials. 2014;35(10):3154–3163. doi: 10.1016/j.biomaterials.2013.12.068. [DOI] [PubMed] [Google Scholar]
- 3.Bohner M Physical and chemical aspects of calcium phosphates used in spinal surgery. Eur Spine J. 2001;10 Suppl 2:S114–121. doi: 10.1007/s005860100276. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.O’Neill R, McCarthy HO, Montufar EB, et al Critical review: Injectability of calcium phosphate pastes and cements. Acta Biomater. 2017;50:1–19. doi: 10.1016/j.actbio.2016.11.019. [DOI] [PubMed] [Google Scholar]
- 5.Niu LN, Jiao K, Wang TD, et al A review of the bioactivity of hydraulic calcium silicate cements. J Dent. 2014;42(5):517–533. doi: 10.1016/j.jdent.2013.12.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Urist MR, DeLange RJ, Finerman GA Bone cell differentiation and growth factors. Science. 1983;220(4598):680–686. doi: 10.1126/science.6403986. [DOI] [PubMed] [Google Scholar]
- 7.袁清霞, 赵龙岩, 程杰, 等 W/O/W 复乳溶剂蒸发法制备水溶性药物微球研究进展. 中国生化药物杂志. 2012;33(6):920–923. [Google Scholar]
- 8.丁裕明. 新型磷酸钙复合骨水泥的制备及性能研究. 泸州: 西南医科大学, 2016.
- 9.Lee DJ, Padilla R, Zhang H, et al Biological assessment of a calcium silicate incorporated hydroxyapatite-gelatin nanocomposite: a comparison to decellularized bone matrix. Biomed Res Int. 2014;2014:837524. doi: 10.1155/2014/837524. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Roy A, Jhunjhunwala S, Bayer E, et al Porous calcium phosphate-poly (lactic-co-glycolic) acid composite bone cement: A viable tunable drug delivery system. Mater Sci Eng C Mater Biol Appl. 2016;59:92–101. doi: 10.1016/j.msec.2015.09.081. [DOI] [PubMed] [Google Scholar]
- 11.Habraken WJ, Wolke JG, Mikos AG, et al PLGA microsphere/calcium phosphate cement composites for tissue engineering: in vitro release and degradation characteristics . J Biomater Sci Polym Ed. 2008;19(9):1171–1188. doi: 10.1163/156856208785540136. [DOI] [PubMed] [Google Scholar]
- 12.Wagoner-Johnson AJ, Herschler BA A review of the mechanical behavior of CaP and CaP/polymer composites for applications in bone replacement and repair. Acta Biomater. 2011;7(1):16–30. doi: 10.1016/j.actbio.2010.07.012. [DOI] [PubMed] [Google Scholar]
- 13.Fernández E, Sarda S, Hamcerencu M, et al High-strength apatitic cement by modification with superplasticizers. Biomaterials. 2005;26(15):2289–2296. doi: 10.1016/j.biomaterials.2004.07.043. [DOI] [PubMed] [Google Scholar]
- 14.张淑娴, 郭新全, 邱玉金, 等 兔椎体骨折动物模型制备的初步探讨. 动物医学进展. 2013;34(7):131–134. [Google Scholar]
- 15.Maenz S, Brinkmann O, Kunisch E, et al Enhanced bone formation in sheep vertebral bodies after minimally invasive treatment with a novel, PLGA fiber-reinforced brushite cement. Spine J. 2016;17(5):709–719. doi: 10.1016/j.spinee.2016.11.006. [DOI] [PubMed] [Google Scholar]
- 16.Palmer I, Nelson J, Schatton W, et al Biocompatibility of calcium phosphate bone cement with optimised mechanical properties: an in vivo study . J Mater Sci Mater Med. 2016;27(12):91. doi: 10.1007/s10856-016-5806-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Wang ZH, Zhang J, Zhang Q, et al Evaluation of bone matrix gelatin/fibrin glue and chitosan/gelatin composite scaffolds for cartilage tissue engineering. Genet Mol Res. 2016;15(3):1–8. doi: 10.4238/gmr.15038431. [DOI] [PubMed] [Google Scholar]
- 18.张育敏, 李晶, 牛晓军, 等 聚乳酸/骨基质明胶多孔复合材料的生物相容性研究. 中国修复重建外科杂志. 2016;30(2):251–257. [Google Scholar]
- 19.Lamghari M, Berland S, Laurent A, et al Bone reactions to nacre injected percutaneously into the vertebrae of sheep. Biomaterials. 2001;22(6):555–562. doi: 10.1016/s0142-9612(00)00213-1. [DOI] [PubMed] [Google Scholar]
- 20.Lamghari M, Antonietti P, Berland S, et al Arthrodesis of lumbar spine transverse processes using nacre in rabbit. J Bone Miner Res. 2001;16(12):2232–2237. doi: 10.1359/jbmr.2001.16.12.2232. [DOI] [PubMed] [Google Scholar]
- 21.Parker RM, Malham GM Comparison of a calcium phosphate bone substitute with recombinant human bone morphogenetic protein-2: a prospective study of fusion rates, clinical outcomes and complications with 24-month follow-up. Eur Spine J. 2017;26(3):754–763. doi: 10.1007/s00586-016-4927-0. [DOI] [PubMed] [Google Scholar]
- 22.Zheng YX, Wang J, Lin HT, et al Reconstruction of orbital defect in rabbits with composite of calcium phosphate cement and recombinant human bone morphogenetic protein-2. Chin Med J (Engl) 2010;123(24):3658–3662. [PubMed] [Google Scholar]
- 23.Perrier M, Lu Y, Nemke B, et al Acceleration of second and fourth metatarsal fracture healing with recombinant human bone morphogenetic protein-2/calcium phosphate cement in horses. Vet Surg. 2008;37(7):648–655. doi: 10.1111/j.1532-950X.2008.00431.x. [DOI] [PubMed] [Google Scholar]
- 24.Lovasik BP, Holland CM, Howard BM, et al Anterior Cervical Discectomy and Fusion: Comparison of Fusion, Dysphagia, and Complication Rates Between Recombinant Human Bone Morphogenetic Protein-2 and Beta-Tricalcium Phosphate. World Neurosurg. 2017;97:674–683.e1. doi: 10.1016/j.wneu.2016.10.088. [DOI] [PubMed] [Google Scholar]
- 25.Villavicencio AT, Burneikiene S RhBMP-2-induced radiculitis in patients undergoing transforaminal lumbar interbody fusion: relationship to dose. Spine J. 2016;16(10):1208–1213. doi: 10.1016/j.spinee.2016.06.007. [DOI] [PubMed] [Google Scholar]
- 26.Yu T, Dong C, Shen Z, et al Vascularization of plastic calcium phosphate cement in vivo induced by in-situ-generated hollow channels . Mater Sci Eng C Mater Biol Appl. 2016;68:153–162. doi: 10.1016/j.msec.2016.05.106. [DOI] [PubMed] [Google Scholar]
- 27.Kasuya A, Sobajima S, Kinoshita M In vivo degradation and new bone formation of calcium phosphate cement-gelatin powder composite related to macroporosity after in situ gelatin degradation . J Orthop Res. 2012;30(7):1103–1111. doi: 10.1002/jor.22044. [DOI] [PubMed] [Google Scholar]
- 28.Palmer I, Nelson J, Schatton W, et al Biocompatibility of calcium phosphate bone cement with optimised mechanical properties: an in vivo study . J Mater Sci Mater Med. 2016;27(12):191. doi: 10.1007/s10856-016-5806-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Toth JM, Wang M, Lawson J, et al Radiographic, biomechanical, and histological evaluation of rhBMP-2 in a 3-level intertransverse process spine fusion: an ovine study. J Neurosurg Spine. 2016;25(6):733–739. doi: 10.3171/2016.4.SPINE151316. [DOI] [PubMed] [Google Scholar]