Abstract
目的
制备复合透明质酸钠的硫酸钙可注射材料,观察其促进骨再生作用,为骨缺损修复提供一种可注射材料。
方法
将硫酸钙分别与透明质酸钠溶液、交联透明质酸钠溶液、PBS 溶液,按照 2∶1(W/V)比例混合,制备 3 种复合材料(记作 CA+HA、CA+HAC 以及 CA)。通过将 3 种复合材料浸泡于 PBS 溶液中观察其形变并进行 X 线衍射分析,观察材料稳定性。参照 ISO10993-5 制备 3 种复合材料浸提液,用于培养小鼠前成骨细胞(MC3T3-E1),并采用细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8)方法检测材料的生物相容性和不同浓度浸提液促进细胞增殖的能力,以单纯培养基培养细胞作为对照组。采用成骨分化培养基制作促进细胞增殖的最佳浓度浸提液,用于培养 MC3T3-E1 细胞,ELISA 法检测成骨分化相关蛋白 ALP、Ⅰ型胶原(collagen typeⅠ,COL-Ⅰ)及骨钙蛋白(osteocalcin,OCN)浓度。取新西兰大白兔制作股骨髁骨缺损模型,分别植入 CA+HA、CA+HAC 以及 CA 材料,于 6、12 周取标本行 Micro-CT 扫描并计算骨组织占组织体积百分比(bone volume/tissue volume,BV/TV),然后标本切片行HE染色,观察缺损区新骨形成情况。
结果
复合材料稳定性检测示,CA+HA 及 CA+HAC 具有良好可注射性,在 PBS 溶液中不易溃散,优于 CA。生物相容性实验显示,培养 6、12、24 h,CA 组吸光度(A)值均低于对照组(P<0.05);CA+HA 组、CA+HAC 组A 值与对照组比较,差异无统计学意义(P>0.05)。细胞增殖实验显示,25%、50% 浓度浸提液培养 5 d 时 CA 组、CA+HA 组和 CA+HAC 组A 值均显著高于对照组(P<0.05);75%、100% 浓度浸提液培养后,仅 CA+HA 组A 值高于对照组(P<0.05)。选择 50% 浓度浸提液进行成骨分化实验。ELISA 检测示,培养 14、21 d 时 CA+HA 组和 CA+HAC 组 ALP、COL-Ⅰ、OCN 浓度均显著高于对照组、CA 组(P<0.05)。Micro-CT 检查示,6、12 周时 CA+HA 组、CA+HAC 组间 BV/TV 差异无统计学意义(P>0.05),但均显著高于 CA 组(P<0.05);HE 染色示,6 周时 CA 组缺损处无成形骨组织,CA+HA 组和 CA+HAC 组可见少量骨组织;12 周时,CA 组可见到少量细条索状骨组织形成,CA+HA 组和 CA+HAC 组均见较多条索状骨组织,明显优于 CA 组,但两组间无显著差异。
结论
硫酸钙与透明质酸钠溶液及其交联产品按照 2∶1(W/V)比例混合制备的复合材料具有稳定性和可注射性,体外能促进小鼠 MC3T3-E1 细胞增殖和分化,植入新西兰大白兔体内后具有良好成骨能力,有望作为一种可注射材料用于骨缺损微创治疗。
Keywords: 骨替代材料, 可注射性, 透明质酸钠, 硫酸钙, 交联
Abstract
Objective
To fabricate an injectable composite bone substitute with hyaluronic acid (HA) and calcium sulfate and to evaluate the biocompatibility and effect of the composite on cell proliferation, osteogenic differentiation in vitro and osteogenic capability in vivo.
Methods
Calcium sulfate powder was mixed with HA solution, cross-linked HA solution, and phosphate buffer solution (PBS) in a ratio of 2∶1 (W/V) to get composites of CA+HA, CA+HAC, and CA. The standard extracts from above 3 materials were prepared according to ISO10993-5, and were used to culture mouse MC3T3-E1 cells. The composite biocompatibility and cell proliferation in different concentrations of extract were tested with cell counting kit-8 (CCK-8). The cells were cultured with standard medium as a control. The optimal concentration was selected for osteogenic differentiation test, and ELISA Kit was used to determine the alkaline phosphatase (ALP), collagen type I (COL-I), and osteocalcin (OCN). The femoral condylar bone defect was made on New Zealand white rabbits and repaired with CA+HA, CA+HAC, and CA. Micro-CT was done to evaluate new bone formation with bone volume/tissue volume (BV/TV) ratio at 6 and 12 weeks. HE staining was used to observe bone formation.
Results
CA+HA and CA+HAC were better in injectability and stability in PBS than CA. The biocompatibility test showed that absorbance (A) value of CA group was significantly lower than that of control group (P<0.05) at 6, 12, and 24 hours after culture, but no significant difference was found inA values between CA+HA group or CA+HAC group and control group (P>0.05). The proliferation test showed 25% and 50% extract of all 3 materials had significantly higherA value than control group (P<0.05). For 75% and 100% extract, only CA+HA group had significantly higherA value than control group (P<0.05). And 50% extract was selected for osteogenic differentiation test. At 14 and 21 days, ALP, COL-I and OCN concentrations of CA+HA group and CA+HAC group were significantly higher than those of CA group and control group (P<0.05). Micro-CT results showed higher BV/TV in CA+HA group and CA+HAC group than CA group at 6 and 12 weeks (P<0.05), but no significant difference was found between CA+HA group and CA+HAC group (P>0.05). HE staining revealed that a little bone tissue was seen in CA+HA group and CA+HAC group, but there was no bone formation in CA group at 6 weeks; more streak bone tissue in CA+HA group and CA+HAC group than CA group at 12 weeks.
Conclusion
Composites prepared with calcium sulfate and HA or with cross-linked HA are stable, injectable, and biocompatible. The materials have excellent effect on proliferation and differentiation of mouse MC3T3-E1 cells. They also show good osteogenic capability in vivo. So it is a potential bone substitutes for bone defective diseases.
Keywords: Bone substitute, injectable, hyaluronic acid, calcium sulfate, cross-linking
骨缺损的治疗一直是困扰骨科医生的难题。自体骨和同种异体骨的临床应用受到取骨量和相关并发症的限制[1-2]。理想的骨替代材料需要具备生物相容性、骨传导性、骨诱导性、可降解性和(或)机械支撑作用[1]。研究表明,天然或人工合成的有机聚合物作为骨替代材料,具有较理想的机械性能和成骨性能[3-5]。此外,天然材料还具有良好生物相容性,常用的天然材料有胶原、壳聚糖、丝素蛋白、藻酸盐和透明质酸等。其中,透明质酸参与并影响了细胞增殖、分化和黏附等多种功能,并在骨与软骨发育过程中起到重要作用[6]。采用透明质酸钠制备骨替代材料已获得广泛研究[3, 5, 7]。目前,硫酸钙已用于临床修复骨缺损[8-9],但硫酸钙材料存在降解速度过快和成骨相对延后造成新缺损的风险[10-11]。我们设想将透明质酸钠溶液和硫酸钙混合制备成可注射材料,在提高材料成骨性能同时达到微创修复骨缺损的目的。为此,我们进行了本研究,旨在探索硫酸钙和透明质酸钠溶液最适混合比例,并进行体内外实验进行验证。报告如下。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
小鼠前成骨细胞株(MC3T3-E1)购自中国医学科学院基础医学研究所细胞中心。5 月龄新西兰大白兔 12 只,体质量 3.0~3.5 kg,雌雄不限,由中国医学科学院北京协和医院实验动物中心提供;实验前适应性饲养 1 个月。
0.1% 透明质酸钠溶液、0.1% 交联透明质酸钠溶液(Sakigaku 公司,日本);硫酸钙(Sigma-Aldrich 公司,美国);α-MEM 培养基、双抗溶液(1% 青霉素/链霉素)、FBS、0.05% 胰酶-EDTA、4% 多聚甲醛(GIBCO 公司,美国);ELISA 试剂盒(Cloud-Clone 公司,美国);细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8;日本同仁化学研究所)。酶标仪(Thermo 公司,美国);24 孔离心机(Ependorf 公司,德国);TE2000-U 倒置相差显微镜(Nikon 公司,日本)。
1.2. 复合材料制备及稳定性检测
1.2.1 复合材料制备 参考文献[12]及实验前反复调试,确定硫酸钙粉末和透明质酸钠溶液比例为 2∶1(W/V)时,所得膏状物具有良好可注射性以及在液体中的稳定性。因此,本研究选择该比例进行实验。于超净工作台,将硫酸钙分别与透明质酸钠溶液、交联透明质酸钠溶液、PBS 溶液,按照 2∶1 比例混合,充分机械搅拌至均匀膏状,制备 3 种复合材料,分别记作 CA+HA、CA+HAC 以及 CA。全程无菌操作,将获得的样本置于密闭无菌容器中备用。
1.2.2 复合材料稳定性检测 ① 将 3 种复合材料完全浸泡于 PBS 溶液,于 0、24 h 以及 3、7 d 时,肉眼观察材料形状变化。② 对 3 种复合材料进行 X 线衍射分析。
1.3. 复合材料浸提液制备
取 3 种复合材料,参照 ISO10993-5 中检测方法[13],制作浸提液。CA 组:将硫酸钙和 PBS 溶液混合所得的复合材料浸泡于含 10%FBS 和 1% 双抗的 α-MEM 培养基中,置于 37℃ 细胞培养箱中 72 h,吸出液体并用直径为 0.22 μm 的过滤器过滤;取过滤液以离心半径 14 cm,2 000 r/min 离心 10 min,吸取上清液,置于 4℃ 冰箱中备用。同法制作 CA+HA 组和 CA+HAC 组浸提液,备用。
1.4. 小鼠 MC3T3-E1 细胞培养
取小鼠 MC3T3-E1 细胞,用含 10%FBS 和 1% 双抗的 α-MEM 培养基培养,置于 37℃、5% CO2 细胞培养箱中,每 3 天换液 1 次;待细胞融合至 90% 左右时进行传代培养。取第 5 代细胞,以 2.5 mL 0.05% 胰酶-EDTA 溶液消化 5 min,吹打成细胞悬液,以离心半径 14 cm,1 200 r/min 离心 5 min,弃上清,用培养基吹打细胞制成不同浓度细胞悬液进行以下实验。
1.5. 浸提液对 MC3T3-E1 细胞活力的影响
取制备的 3 种复合材料浸提液,紫外线照射 30 min 再次灭菌。取 MC3T3-E1 细胞悬液计数后接种至 96 孔板,每孔 1×104 个细胞;分别加入 3 种复合材料浸提液进行培养,以单纯培养基(含 10%FBS 和 1% 双抗的 α-MEM 培养基)培养作为对照组。于培养后 6、12、24 h,各组取 3 孔用 CCK-8 试剂盒检测细胞活性。各孔分别加入 100 μL CCK-8 溶液,30 min 后取上清用酶标仪测量 450 nm 波长处吸光度(A)值,代表细胞活性。
1.6. 浸提液对 MC3T3-E1 细胞成骨分化的影响
1.6.1 细胞增殖实验及浸提液浓度选择 取含 10%FBS 和 1% 双抗的 α-MEM 培养基分别与 3 种复合材料浸提液,按照 3∶1、1∶1、1∶3 比例混合,获得浓度为 25%、50%、75% 的浸提液。取 MC3T3-E1 细胞悬液,计数后接种至 96 孔板,每孔 5×103 个细胞,分别以浓度为 25%、50%、75% 以及 100%(不稀释)的 3 种复合材料浸提液进行培养,以单纯培养基培养作为对照组。置于 37℃、5%CO2 细胞培养箱中培养,培养 1、3、5 d 各组取 3 孔采用 CCK-8 法检测细胞活性,操作步骤同 1.5。比较不同浓度浸提液对 MC3T3-E1 细胞促增殖作用差异,选择最佳浓度进行细胞成骨分化实验。
1.6.2 MC3T3-E1 细胞成骨分化检测 取 3 种复合材料,参照 1.3 浸提液制备方法,采用成骨分化培养基(含 50 μg/mL L-抗坏血酸、10 mmol/L β-磷酸甘油、100 nmol/L 地塞米松、10%FBS 和 1% 双抗的 α-MEM 培养基)配置最佳浓度浸提液。取 MC3T3-E1 细胞悬液,计数后接种至 96 孔板,每孔 1×104 个细胞,采用 3 种复合材料最佳浓度浸提液进行培养,以单纯成骨分化培养基培养作为对照组。置于 37℃、5%CO2 细胞培养箱中培养,每 2 天更换 1 次培养基。于培养 1、7、14、21 d 吸取上清培养液,用 ELISA 试剂盒检测培养液中 ALP、Ⅰ型胶原(colla-gen typeⅠ,COL-Ⅰ)及骨钙蛋白(osteocalcin,OCN)浓度。
1.7. 复合材料体内成骨作用观察
取 12 只新西兰大白兔,参照文献[14]方法制作股骨髁骨缺损模型。首先,耳缘静脉注射 10% 水合氯醛(3 mL/kg)麻醉后,于双膝关节外侧作切口,逐层切开,显露股骨髁外髁并钻孔(直径 6 mm、深 10 mm)。然后,随机取 6 只动物,一侧下肢骨缺损处注入 CA;另一侧不作处理,作为空白对照;另 6 只动物一侧下肢骨缺损处注入 CA+HA,另一侧注入 CA+HAC。
植入后 6、12 周各取 6 只动物,各组3个样本。采用过量麻醉法处死后,取出股骨下段标本。首先行 Micro-CT 扫描,观察骨缺损区成骨情况,选择感兴趣区域计算骨组织占组织体积的百分比(bone volume/tissue volume,BV/TV);然后将标本浸泡于 4% 多聚甲醛溶液中,脱钙,制备石蜡切片,常规行 HE 染色,光镜下观察缺损区骨组织形成情况。
1.8. 统计学方法
采用 GraphPad Prism 软件进行统计分析。数据以均数±标准差表示;组间比较采用单因素方差分析,两两比较采用 Bonforroni 检验;检验水准 α=0.05。
2. 结果
2.1. 复合材料稳定性检测
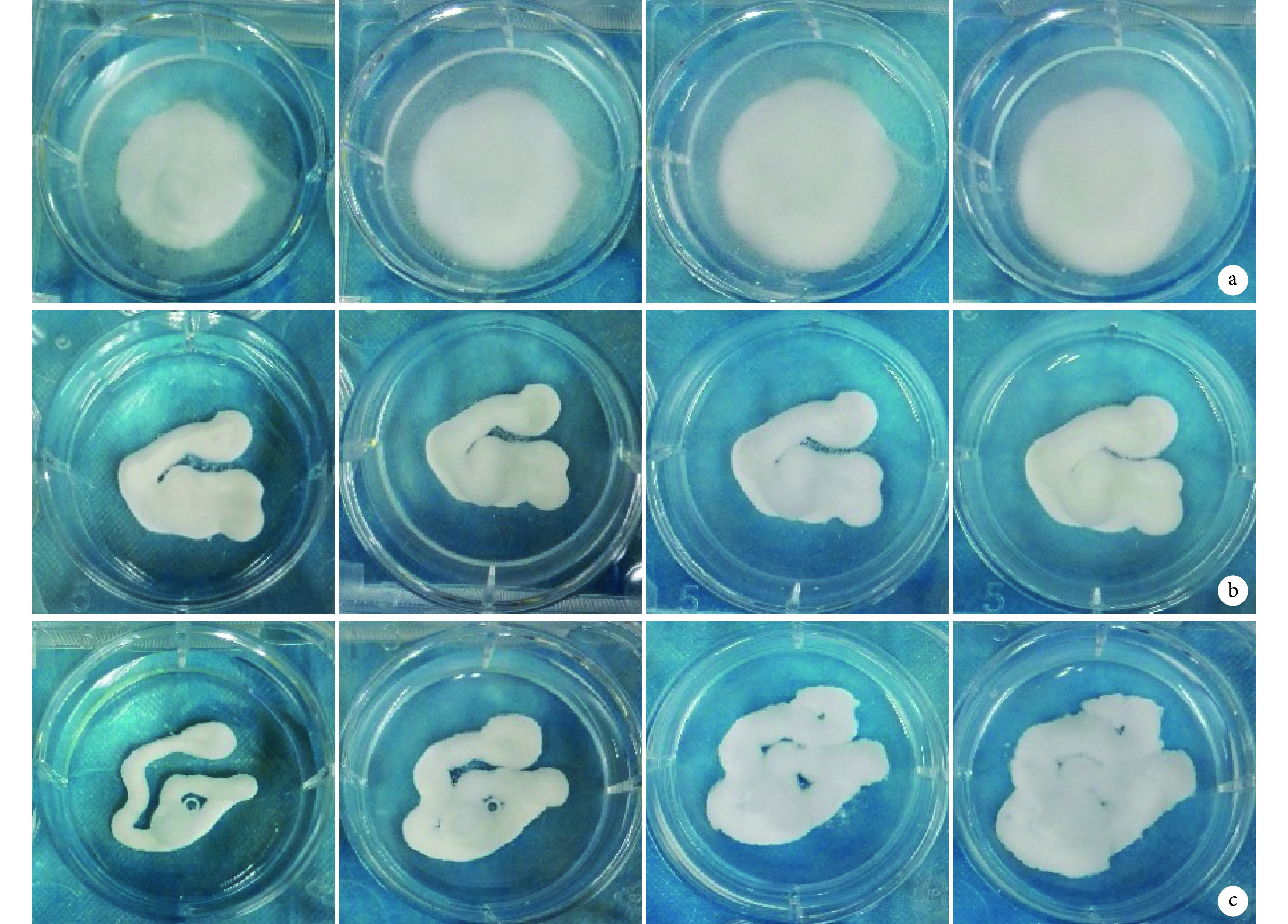
将 3 种复合材料浸泡至 PBS 溶液后,CA 立即发生溃散;CA+HA 及 CA+HAC 浸泡至 7 d 时仅发生膨胀,均无明显溃散,保持稳定性。见图 1。
图 1.
Stability of materials in PBS
各组复合材料浸泡于 PBS 溶液后形态观察
从左至右分别为 0、24 h 及 3、7 d a. CA;b. CA+HA;c. CA+HAC
From left to right for 0 hour, 24 hours, 3 days, and 7 days a. CA; b. CA+HA; c. CA+HAC
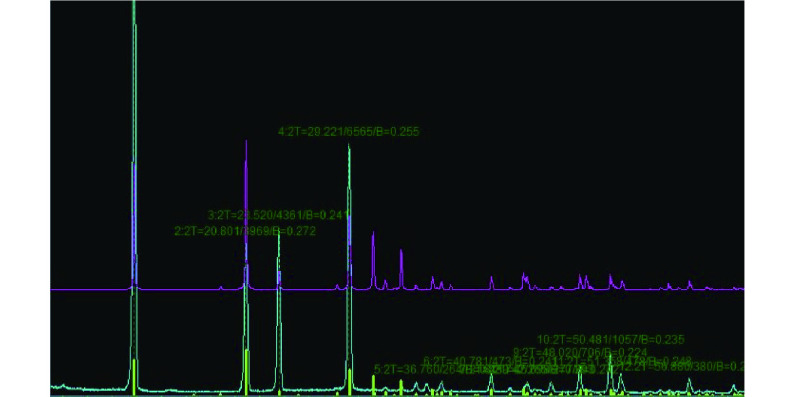
X 线衍射分析显示,3 种复合材料衍射光谱均与 CaSO4·2H2O 保持一致,提示硫酸钙和透明质酸钠或者交联透明质酸钠混合后,未发生化学反应生成新的物质。见图 2。
图 2.
X-ray diffraction analysis result of CA+HA
CA+HA X 线衍射分析比对结果
上:CA+HA;下:CaSO4·2H2O
Upper for CA+HA; lower for CaSO4·2H2O
2.2. 浸提液对 MC3T3-E1 细胞活力的影响
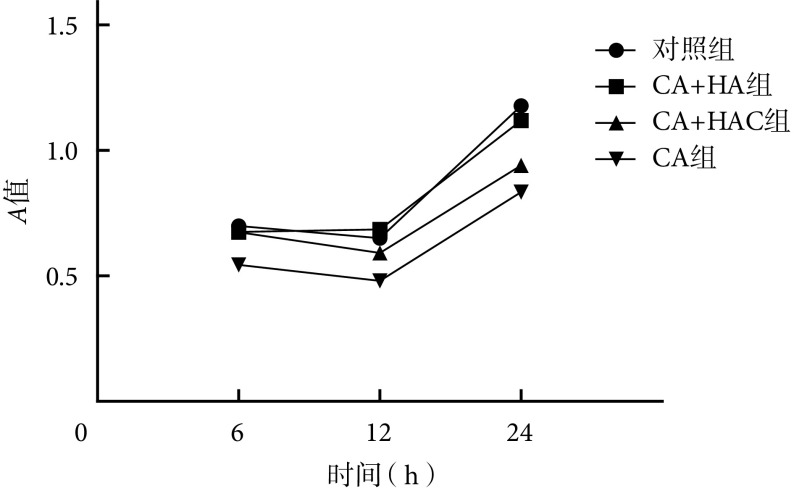
培养 6、12、24 h,CA 组 A 值均低于对照组,比较差异有统计学意义(P<0.05);CA+HA 组、CA+HAC 组A 值与对照组比较,差异无统计学意义(P>0.05);CA+HA 组A 值高于 CA 组,比较差异有统计学意义(P<0.05);CA+HAC 组与 CA 组间比较,差异无统计学意义(P>0.05)。见图 3。
图 3.
CCK-8 results for biocompatibility
CCK-8 法检测各组细胞活性
2.3. 浸提液对 MC3T3-E1 细胞增殖的影响
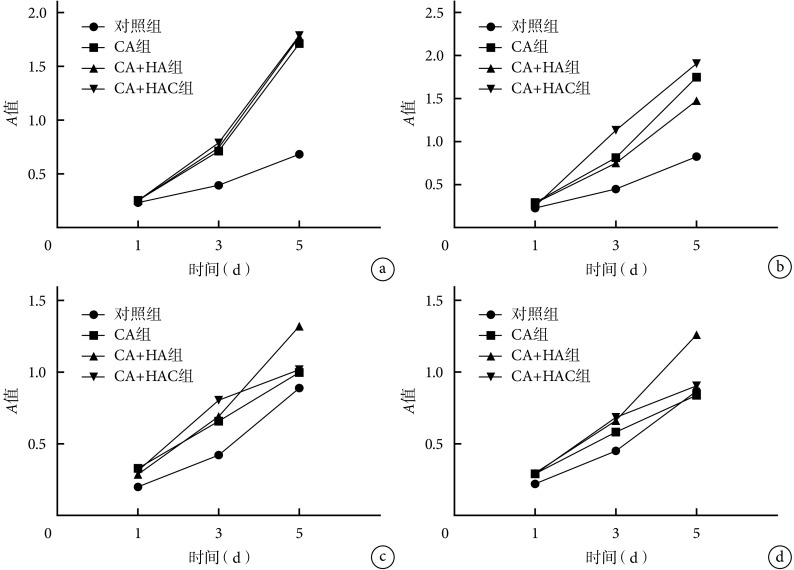
3 种复合材料相同浓度的浸提液培养细胞后,细胞增殖变化趋势一致。见图 4。取培养 5 d 时各组检测数据进行比较分析。其中,25%、50% 浓度浸提液培养 5 d 时 CA 组、CA+HA 组和 CA+HAC 组 A 值均显著高于对照组,比较差异有统计学意义(P<0.05)。75%、100% 浓度浸提液培养 5 d 时 CA+HA 组A 值高于对照组,比较差异有统计学意义(P<0.05);CA+HAC 组和 CA 组A 值虽高于对照组,但差异无统计学意义(P>0.05)。综合检测结果,选择 50% 浓度浸提液进行后续实验。
图 4.
Effects of extracts with different concentrations on proliferation of MC3T3-E1 cells by CCK-8
CCK-8 法检测不同浓度复合材料浸提液对细胞增殖活性的影响
a. 25% 浓度组;b. 50% 浓度组;c. 75% 浓度组;d. 100% 浓度组
a. 25% extracts; b. 50% extracts; c. 75% extracts; d. 100% extracts
2.4. MC3T3-E1 细胞成骨分化检测
CA 组 ALP 浓度于 14 d 达峰值,21 d 略降低;其余各组 ALP 浓度均呈逐渐增加趋势。培养 14、21 d 时,CA+HA 组、CA+HAC 组 ALP 浓度均显著高于对照组、CA 组,比较差异有统计学意义(P<0.05);其余各时间点各组间比较,差异均无统计学意义(P>0.05)。见图 5a。
图 5.
Osteogenic biomarker concentrations at different time points by ELISA
ELISA 检测各组成骨标志物浓度
a. ALP;b. COL-Ⅰ;c. OCN
a. ALP; b. COL-I; c. OCN
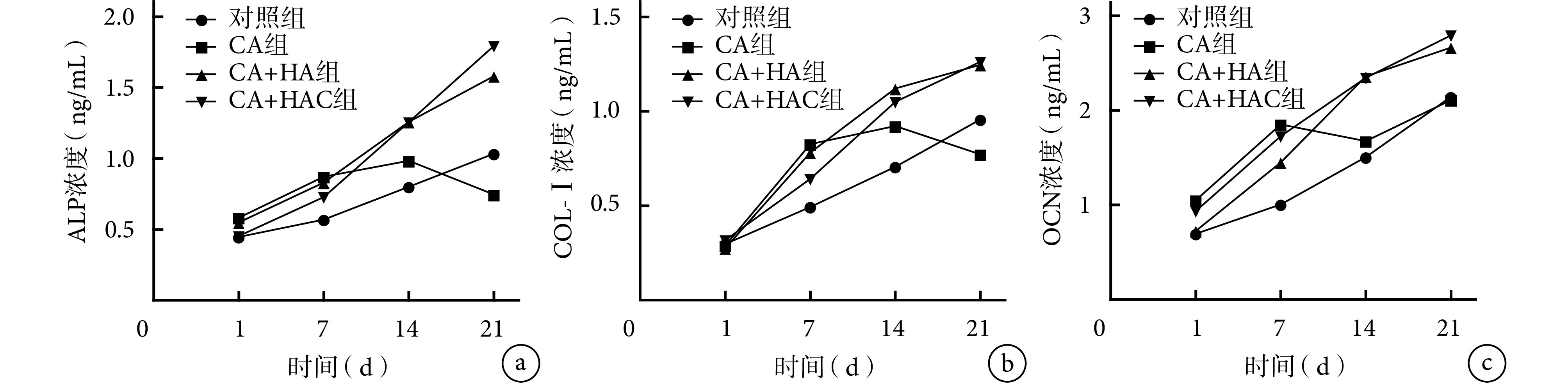
CA 组 COL-Ⅰ浓度于 14 d 达峰值,21 d 略降低;其余各组 COL-Ⅰ浓度均呈逐渐增加趋势。培养 14 d 时,CA 组、CA+HA 组、CA+HAC 组 COL-Ⅰ浓度均显著高于对照组,21 d 时 CA+HA 组、CA+HAC 组 COL-Ⅰ浓度亦显著高于对照组、CA 组,比较差异有统计学意义(P<0.05);其余各时间点各组间比较,差异均无统计学意义(P>0.05)。见图 5b。
除 CA 组外,其余各组 OCN 浓度均呈逐渐增加趋势。14、21 d 时 CA+HA 组、CA+HAC 组 OCN 浓度均显著高于对照组和 CA 组,比较差异有统计学意义(P<0.05);其余各时间点各组间比较,差异均无统计学意义(P>0.05)。见图 5c。
2.5. 材料体内成骨作用观察
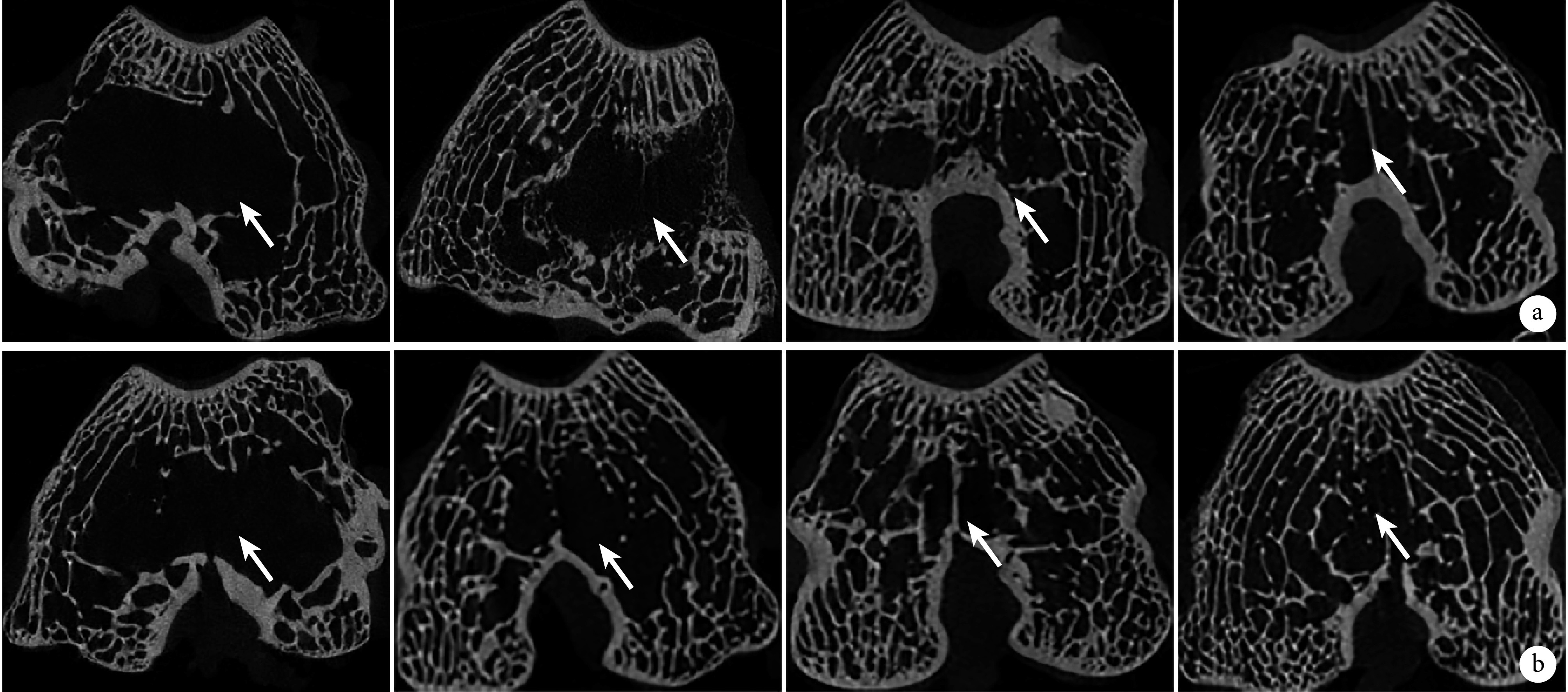
2.5.1 Micro-CT 观察 6、12 周,空白对照组无明显成骨,其余各组新生骨小梁均逐渐增加,其中 CA 组新生骨小梁明显少于 CA+HA 组和 CA+HAC 组。见图 6。 6 周时,CA 组、CA+HA 组和 CA+HAC 组 BV/TV 分别为 0.47%±0.07%、2.85%±0.59%、4.65%±1.56%;12 周时分别为 15.33%±2.81%、19.70%±3.22%、22.46%±3.17%。组内比较,各组 12 周时 BV/TV 均较 6 周时提高,比较差异有统计学意义(P<0.05)。组间比较,6、12 周时 CA+HA 组、CA+HAC 组均高于 CA 组,比较差异有统计学意义(P<0.05);CA+HA 组和 CA+HAC 组间差异无统计学意义(P>0.05)。
图 6.
Micro-CT results in each group at 6 and 12 weeks
植入后 6、12 周各组 Mirco-CT 观察
从左至右分别为空白对照组、CA 组、CA+HA 组和 CA+HAC 组 箭头示植入材料区域 a. 植入 6 周;b. 植入 12 周
From left to right for control, CA, CA+HA, and CA+HAC groups Arrow indicated implants a. At 6 weeks; b. At 12 weeks
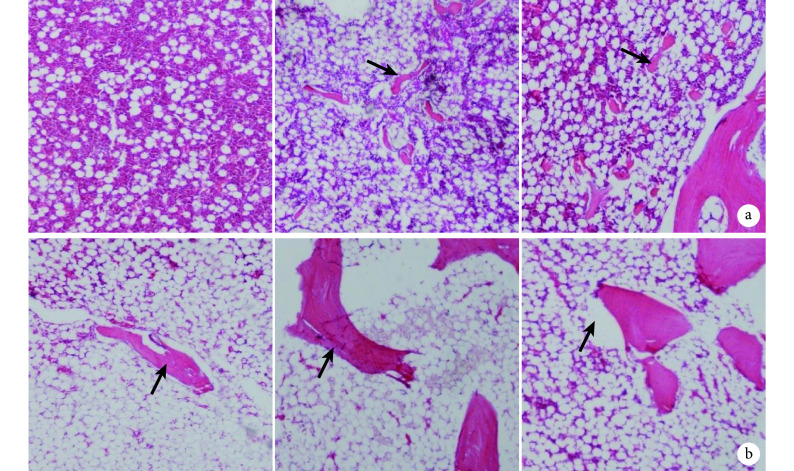
2.5.2 HE 染色观察 6 周时,CA 组缺损处无成形骨组织,CA+HA 组、CA+HAC 组可见少量新生类骨小梁组织;12 周时,CA 组可见到细条索状骨组织形成,CA+HA 组和 CA+HAC 组均见条索状骨组织,明显优于 CA 组,但两组间无显著差异(图 7)。
图 7.
HE staining observation in each group at 6 and 12 weeks (×40)
植入后 6、12 周各组 HE 染色观察(×40)
从左至右分别为 CA 组、CA+HA 组、CA+HAC 组 箭头示条索状新生骨 a. 植入 6 周;b. 植入 12 周
From left to right for CA, CA+HA, and CA+HAC groups Arrow indicated streak new bone a. At 6 weeks; b. At 12 weeks
3. 讨论
理想的骨替代材料应具有良好生物相容性、骨传导性、骨诱导性和生物降解能力[1, 15]。骨骼由有机物和无机物组成,所以人工骨替代材料往往为无机材料和有机材料的混合物[3-5, 16-17],可以制备成颗粒、块状固体和软膏状等。可注射材料由于可以微创操作,缩短了手术时间、减少创伤和医疗费用[18],日益受到研究者的重视。
本研究选择已用于临床的硫酸钙粉剂和透明质酸钠溶液,按照 2∶1(W/V)比例混合,成功制备可注射骨替代材料。本研究选择该比例是基于保持材料可注射性基础上尽可能增加固体比例考虑,与文献报道的比例[14, 18]一致。我们认为本研究采用的复合材料制备方法其优点是取材便捷、经济、制作简便。经 X 线衍射分析证实,制备的复合材料无新物质生成,提示材料组分安全。
因制备的复合材料为膏状,无法在培养板底部形成一个均匀形态供细胞附着;另外材料组分可以与 CCK-8 显色试剂反应,会影响 A 值检测结果,所以我们选择材料浸提液进行生物相容性以及促成骨分化相关研究。检测结果显示,本研究制作的复合材料具有良好生物相容性和促进小鼠 MC3T3-E1 细胞增殖和成骨分化的能力。分析其机制可能有以下 3 点:① 硫酸钙成骨作用。医用硫酸钙特殊的晶体结构可以阻止软组织长入,为血管和成骨细胞的长入提供基质。有学者认为硫酸钙在周围有骨或骨膜存在的情况下,具有刺激骨再生的作用[6, 19]。成骨细胞可以附着于硫酸钙,并在此基础上成骨;而破骨细胞会吸收硫酸钙,形成生物降解。硫酸钙加速骨形成可能与局部溶解后钙离子浓度提高有关[20]。如果有钙盐存在,磷酸酶就能促使局部聚集的钙离子增加,在适宜生物基础条件下,如存在生长因子和成骨细胞,就能加速骨形成。有学者在硫酸钙的基础上加入锂镁金属[21],来防止硫酸钙降解过程中周围环境 pH 值下降,复合材料具有良好的成血管效应和成骨分化作用。
② 透明质酸的支架效应。透明质酸具有三维多孔结构,有利于植入短期内实现丰富的血管再生,使支架材料形成充足的支持结构,可作为一种良好的骨诱导支架材料[22]。透明质酸交联后形成的网状结构,为细胞提供了类似细胞外基质的微环境,有利于细胞的黏附和生长,也有利于细胞间信号的传导[23-24]。
③ 透明质酸的分子信号效应。透明质酸可以和多种分子相互作用,如蛋白聚糖、神经聚糖和多能聚糖等;还可作用于多种受体,如 CD44(细胞表面糖蛋白)、透明质酸介导的运动受体(receptor for hyaluronan-mediated motility,RHAMM)、toll样受体(toll-like receptor,TLRs)、透明质酸胞吞受体、细胞间黏附分子 1 和淋巴内皮透明质酸受体。其中 CD44、RHAMM 和 TLRs 由间充质细胞表达。CD44 是 HA 的主要受体[25-26],参与细胞增殖、分化和运动等多种功能,在骨与软骨代谢、炎性反应和肿瘤生成等过程中发挥重要作用。RHAMM 是 HA 的另一重要受体[27],影响细胞运动并在细胞和生长因子相互作用的过程中发挥关键调节作用。敲除 CD44 基因后,RHAMM 基因可起到代偿作用。TLRs 参与 HA 对于 BMSCs 的信号调节[28]。HA 作用于 CD44 与 RHAMM 受体,促进间充质细胞向骨与软骨细胞分化。HA 能早期诱导 ALP 分泌,上调骨钙素基因表达水平,且可与 DEX、hBMP-2 相互作用影响细胞增殖与分化。本研究结果显示,透明质酸钠复合硫酸钙后可以加速骨形成,其促进成骨的分子机制,可能和钙离子的协同作用有关,仍需进一步研究来证实。
综上述,本研究通过将硫酸钙和透明质酸钠(或其交联产品)溶液以 2∶1(W/V)比例混合后,成功制备可注射性骨替代材料。该复合材料具有良好生物相容性,具有促进小鼠前成骨细胞增殖以及分化的作用;将其植入新西兰大白兔体内后,具有优于单纯硫酸钙的成骨能力。作为一种潜在的骨替代材料,有望应用于骨缺损性疾病的治疗。
Funding Statement
中国医学科学院北京协和医学院2015博士生创新基金项目(B2015001059)
Doctoral Innovation Foundation 2015, Chinese Academy of Medical Sciences & Peking Union Medical College (B2015001059)
References
- 1.Fillingham Y, Jacobs J Bone grafts and their substitutes. Bone Joint J. 2016;98-B(1 Suppl A):6–9. doi: 10.1302/0301-620X.98B.36350. [DOI] [PubMed] [Google Scholar]
- 2.Fillingham YA, Cvetanovich GL, Haughom BD, et al Bioceramic bone graft substitute for treatment of unicameral bone cysts. J Orthop Surg (Hong Kong) 2016;24(2):222–227. doi: 10.1177/1602400220. [DOI] [PubMed] [Google Scholar]
- 3.Nguyen TB, Lee BT A combination of biphasic calcium phosphate scaffold with hyaluronic acid-gelatin hydrogel as a new tool for bone regeneration. Tissue Eng Part A. 2014;20(13):1993–2004. doi: 10.1089/ten.tea.2013.0352. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Orellanaa BR, Thomasb MV, Dziublac TD, et al Bioerodible calcium sulfate/poly (β-amino ester) hydrogel composites. J Mech Behav Biomed Mater. 2013;26(10):43–53. doi: 10.1016/j.jmbbm.2013.05.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Sawatjui N, Damrongrungruang T, Leeanansaksiri W, et al Silk fibroin/gelatin-chondroitin sulfate-hyaluronic acid effectively enhances in vitro chondrogenesis of bone marrow mesenchymal stem cells. Mater Sci Eng C Mater Biol Appl. 2015;52:90–96. doi: 10.1016/j.msec.2015.03.043. [DOI] [PubMed] [Google Scholar]
- 6.Solis MA, Chen YH, Wong TY, et al Hyaluronan regulates cell behavior: a potential niche matrix for stem cells. Biochem Res Int. 2012;(2012):346972. doi: 10.1155/2012/346972. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Wu AT, Aoki T, Sakoda M, et al Enhancing osteogenic differentiation of MC3T3-E1 cells by immobilizing inorganic polyphosphate onto hyaluronic acid hydrogel. Biomacromolecules. 2015;16(11):166–173. doi: 10.1021/bm501356c. [DOI] [PubMed] [Google Scholar]
- 8.Kumar CY, K B N, Menon J, et al Calcium sulfate as bone graft substitute in the treatment of osseous bone defects, a prospective study. J Clin Diagn Res. 2013;7(12):2926–2928. doi: 10.7860/JCDR/2013/6404.3791. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Zhang C, Li Z, Li Q, et al Properties and Osteogenicity of Two Calcium Sulfate Materials with Micro or Nano Morphology. J Nanosci Nanotechnology. 2016;16(3):2277–2282. doi: 10.1166/jnn.2016.10959. [DOI] [PubMed] [Google Scholar]
- 10.Fillingham YA, Cvetanovich GL, Haughom BD, et al Bioceramic bone graft substitute for treatment of unicameral bone cysts. J Orthop Surg (Hong Kong) 2016;24(2):222–227. doi: 10.1177/1602400220. [DOI] [PubMed] [Google Scholar]
- 11.Mao K, Zhou F, Cui F, et al Preparation and properties of α-calcium sulphate hemihydrate and β-tricalcium phosphate bone substitute. Biomed Mater Eng. 2013;23(3):197–210. doi: 10.3233/BME-130744. [DOI] [PubMed] [Google Scholar]
- 12.Brown ME, Zou Y, Dziubla TD, et al Effects of composition and setting environment on mechanical properties of a composite bone filler. J Biomed Mater Res Part A. 2013;101(4):973–980. doi: 10.1002/jbm.a.34399. [DOI] [PubMed] [Google Scholar]
- 13.Cheng P, Han P, Zhao C, et al High-purity magnesium interference screws promote fibrocartilaginous entheses regeneration in the anterior cruciate ligament reconstruction rabbit model via accumulation of BMP-2 and VEGF. Biomaterials. 2016;81:14–26. doi: 10.1016/j.biomaterials.2015.12.005. [DOI] [PubMed] [Google Scholar]
- 14.李阳, 雷伟, 王征, 等 生物玻璃和壳聚糖改性的多孔活性骨水泥体内实验研究. 中国修复重建外科杂志. 2013;27(3):320–325. [PubMed] [Google Scholar]
- 15.Zhao N, Wang X, Qin L, et al Effect of hyaluronic acid in bone formation and its applications in dentistry. J Biomed Mater Res A. 2016;104(6):1560–1569. doi: 10.1002/jbm.a.35681. [DOI] [PubMed] [Google Scholar]
- 16.Hulsart-Billström G, Yuen PK, Marsell R, et al Bisphosphonate-linked hyaluronic acid hydrogel sequesters and enzymatically releases active bone morphogenetic protein-2 for induction of osteogenic differentiation. Biomacromolecules. 2013;14(9):3055–3363. doi: 10.1021/bm400639e. [DOI] [PubMed] [Google Scholar]
- 17.Bae MS, Kim JE, Lee JB, et al ZrO2 surface chemically coated with hyaluronic acid hydrogel loading GDF-5 for osteogenesis in dentistry . Carbohydr Polym. 2013;92(1):167–175. doi: 10.1016/j.carbpol.2012.09.044. [DOI] [PubMed] [Google Scholar]
- 18.Qi X, Li H, Qiao B, et al Development and characterization of an injectable cement of nano calcium-deficient hydroxyapatite/multi (amino acid) copolymer/calcium sulfate hemihydrate for bone repair. Int J Nanomedicine. 2013;8:4441–4452. doi: 10.2147/IJN.S54289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kim YK, Lee JY, Kim SG, et al Guided bone regeneration using demineralized allogenic bone matrix with calcium sulfate: case series. J Adv Prosthodont. 2013;5(2):167–171. doi: 10.4047/jap.2013.5.2.167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Yang X, Li Y, Huang Q, et al Evaluation of a biodegradable graft substitute in rabbit bone defect model. Indian J Orthop. 2012;46(3):266–273. doi: 10.4103/0019-5413.96371. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Cao L, Weng W, Chen X, et al Promotion of in vivo degradability, vascularization and osteogenesis of calcium sulfate-based bone cements containing nanoporous lithium doping magnesium silicate . Int J Nanomedicine. 2017;12:1341–1352. doi: 10.2147/IJN.S124965. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Komorowicz E, Balázs N, Varga Z, et al. Hyaluronic acid decreases the mechanical stability, but increases the lytic resistance of fibrin matrices. Matrix Biol, 2016. [Epub ahead of print]
- 23.Gómez-Aristizábal A, Kim KP, Viswanathan S A Systematic Study of the Effect of Different Molecular Weights of Hyaluronic Acid on Mesenchymal Stromal Cell-Mediated Immunomodulation. PLoS One. 2016;11(1):e0147868. doi: 10.1371/journal.pone.0147868. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kwon TR, Seok J, Jang JH, et al Needle-free jet injection of hyaluronic acid improves skin remodeling in a mouse model. Eur J Pharm Biopharm. 2016;105(8):69–74. doi: 10.1016/j.ejpb.2016.05.014. [DOI] [PubMed] [Google Scholar]
- 25.Wu PT, Kuo LC, Su FC, et al High-molecular-weight hyaluronic acid attenuated matrix metalloproteinase-1 and -3 expression via CD44 in tendinopathy. Sci Rep. 2017;7(1):40840. doi: 10.1038/srep40840. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Lin WJ, Lee WC, Shieh MJ Hyaluronic acid conjugated micelles possessing CD44 targeting potential for gene delivery. Carbohydr Polym. 2017;155(1):101–108. doi: 10.1016/j.carbpol.2016.08.021. [DOI] [PubMed] [Google Scholar]
- 27.Esguerra KV, Tolg C, Akentieva N, et al Identification, design and synthesis of tubulin-derived peptides as novel hyaluronan mimetic ligands for the receptor for hyaluronan-mediated motility (RHAMM/HMMR) Integr Biol (Camb) 2015;7(12):1547–1560. doi: 10.1039/c5ib00222b. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Savage JR, Pulsipher A, Rao NV, et al A Modified Glycosaminoglycan, GM-0111, Inhibits Molecular Signaling Involved in Periodontitis. PLoS One. 2016;11(6):e0157310. doi: 10.1371/journal.pone.0157310. [DOI] [PMC free article] [PubMed] [Google Scholar]