Abstract
Hintergrund
Sauerstoff (O2) ist ein Arzneimittel mit spezifischen Eigenschaften, einem definierten Dosis-Wirkungs-Bereich und O2 hat unerwünschte Wirkungen. Im Jahr 2015 wurden 14 % einer Stichprobe von britischen Krankenhauspatienten mit Sauerstoff behandelt, davon hatten nur 42 % eine Verordnung. Gesundheitspersonal ist häufig unsicher über die Relevanz einer Hypoxämie und es besteht ein eingeschränktes Bewusstsein für die Risiken einer Hyperoxämie. In den letzten Jahren wurden zahlreiche randomisierte, kontrollierte Studien zur Sauerstofftherapie veröffentlicht.
Methoden
Im Rahmen des Leitlinienprogramms der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) wurde unter Beteiligung von 10 Fachgesellschaften diese S3-Leitlinie auf Basis einer Literaturrecherche bis zum 01.02.2021 entwickelt. Zur Literaturbewertung wurde das System des Oxford Centre for Evidence-Based Medicine (CEBM; „The Oxford 2011 Levels of Evidence“) verwendet. Die Bewertung der Evidenzqualität erfolgte anhand des Grading of Recommendations Assessment, Development and Evaluation (GRADE) und die Leitlinienempfehlungen wurden formal konsentiert.
Ergebnisse
Die Leitlinie enthält 34 evidenzbasierte Empfehlungen zu Indikation, Verordnung, Überwachung und Abbruch der Sauerstofftherapie in der Akutversorgung. Die Indikation für Sauerstoff ist hauptsächlich die Hypoxämie. Hypoxämie und Hyperoxämie sollten aufgrund der Assoziation mit einer erhöhten Sterblichkeit vermieden werden. Die Leitlinie empfiehlt Zielbereiche der Sauerstoffsättigung für die Sauerstoff-Akuttherapie ohne Differenzierung zwischen verschiedenen Diagnosen. Zielbereiche sind abhängig vom Hyperkapnierisiko und Beatmungsstatus. Die Leitlinie bietet einen Überblick über verfügbare Sauerstoffzufuhrsysteme und enthält Empfehlungen für deren Auswahl basierend auf Patientensicherheit und -komfort.
Fazit
Dies ist die erste nationale Leitlinie zum Einsatz von Sauerstoff in der Akutmedizin. Sie richtet sich an medizinisches Fachpersonal, das Sauerstoff außerklinisch und stationär anwendet, und ist bis zum 30.06.2024 gültig.
Schlüsselwörter: Sauerstofftherapie, High-flow-Sauerstoff, Pulsoxymetrie, Hypoxämie, Hyperoxämie
Abstract
Background
Oxygen is a drug with specific properties, a defined dose–effect range and side effects. In 2015, in a sample of UK hospital patients, 14% were treated with oxygen, of which only 42% had a prescription. Health care workers are often uncertain about the relevance of hypoxemia, and there is limited awareness of the risks of hyperoxemia. Numerous randomized controlled trials on oxygen therapy have recently been published.
Methods
As part of the guideline program of the Working Group of Scientific Medical Societies e. V. (AWMF), this S3 guideline was developed with the participation of 10 medical societies on the basis of a literature search up to 02/01/2021. The system of the Oxford Centre for Evidence-Based Medicine (CEBM) (The Oxford 2011 Levels of Evidence) was used to evaluate the literature. The quality of evidence was assessed using the Grading of Recommendations Assessment, Development and Evaluation (GRADE), and a formal consensus process of recommendations was performed.
Results
The guideline contains 34 evidence-based recommendations on the indication, prescription, monitoring, and discontinuation of oxygen therapy in acute care. The indication for oxygen is mainly hypoxemia. Hypoxemia and hyperoxemia should be avoided, since both increase mortality. The guideline recommends target ranges of oxygen saturation for acute oxygen therapy without differentiating between different diagnoses. Target areas depend on the risk for hypercapnia and ventilation status. The guideline provides an overview of available oxygen delivery systems and contains recommendations for their selection based on patient safety and comfort.
Conclusion
This is the first German guideline on the use of oxygen in acute care. It is aimed at medical professionals who use oxygen in and outside hospitals and is valid until June 30th, 2024.
Keywords: Oxygen therapy, High-flow oxygen, Pulse oximetry, Hypoxemia, Hyperoxemia
Einleitung
Sauerstoff (O2) wird in den Körperzellen benötigt, um aus den Nährstoffen Energie zu gewinnen. Im Blut wird O2 überwiegend an Hämoglobin (Hb) des Erythrozyten gebunden. Die Menge von O2 im Blut kann als Messung der Sauerstoffsättigung des Hämoglobins oder durch Messung des O2-Partialdrucks (paO2) ausgedrückt werden.
Die Sauerstoffsättigung als zentraler Zielparameter hat den Vorteil eines gemeinsamen Zielparameters in Pulsoxymetrie (SpO2) und Blutgasanalysen (SaO2). In einer großen britischen Studie an 37.000 Patienten lag die pulsoxymetrisch gemessene O2-Sättigung (SpO2) im Median bei 98 % für Erwachsene im Alter von 18 bis 64 Jahre, für Ältere bei 96 % [1].
Die Pulsoxymetrie hat eine hohe Sensitivität, aber nur eine geringe Spezifität zur Erfassung von Hypoxämien. Bei kritisch kranken Patienten liegt das 95 %-Konfidenzintervall der Abweichung von pulsoxymetrischer zu arterieller Sättigung bei ±4 % [2].
Bei einer Hypoxämie ist der Sauerstoffpartialdruck oder der Sauerstoffgehalt im arteriellen Blut erniedrigt. Eine Hypoxie bezeichnet dagegen die Unterversorgung von Organen und Gewebe mit Sauerstoff.
Eine hypoxämische Hypoxie liegt vor, wenn der Sauerstoffpartialdruck im Blut vermindert ist.
Es gibt derzeit keine genaue wissenschaftliche Evidenz, wann und wie viel Sauerstoff in der Behandlung der Hypoxämie notwendig ist. An großen Kollektiven von Krankenhauspatienten und Patienten im Rettungseinsatz wurde die Assoziation einer Hypoxämie mit erhöhter Sterblichkeit beschrieben [3, 4].
Permissive Hypoxämie setzt ausreichende Hämoglobinwerte (üblicherweise >10 g/dl) und einen supranormalen Herzindex (größer 4,5 l/min/m2) voraus, um eine adäquate Sauerstoffversorgung (DO2) aufrechtzuerhalten. Permissive Hypoxämie wurde bisher nicht in randomisierten Studien bei Erwachsenen gegenüber Normoxämie untersucht.
Es gibt Patienten mit chronischer Hypoxämie (z. B. der Fetus, Patienten mit Mischzyanose, Bevölkerungsgruppen, die in großer Höhe leben, oder solche mit chronischer Hypoventilation), die trotz Hypoxämie nicht akut gefährdet sind. Aus historischen Veröffentlichungen der Höhenmedizin und Flugmedizin [5] ist bekannt, dass Sättigungswerte von unter 70 % innerhalb kurzer Zeit zu Bewusstseinsverlust führen. Selbst gesunde Probanden haben bei Hypoxämien unter 80 % kognitive Einschränkungen [6].
Es ist unklar, welchen Einfluss die Sauerstofftherapie auf das Überleben und andere patientenrelevante Endpunkte hat.
Es gibt zahlreiche Argumente gegen Hyperoxie und Hyperoxämie als Therapieziel: Bei Hyperoxämie unter O2 sind eine Reihe von Nebenwirkungen beschrieben [7]. Eine Metaanalyse von 25 randomisierten, kontrollierten Studien an 16.037 Patienten mit verschiedenen akuten Erkrankungen wie Sepsis, Schlaganfall, Trauma, Herzinfarkt und Herzstillstand zeigte mit hoher Evidenz ein erhöhtes relatives Risiko der Sterblichkeit im Krankenhaus unter Hyperoxämie [8]. Hohe O2-Konzentrationen verursachen bei Gesunden direkte Lungentoxizität und Resorptionsatelektasen [9, 10]. Hyperoxämie kann zu fälschlich beruhigenden SpO2-Werten führen und die Erkennung der Verschlechterung von Patienten mit Hypoxämie verzögern [11, 12]. Bei COPD-Patienten war eine prästationäre Hyperoxämie mit erhöhter Krankenhaussterblichkeit verbunden [13]. In 21 Studien an 7597 Patienten verbesserte Hyperoxie intra- und postoperativ die Wundheilung nicht [14].
Methoden
Federführende Fachgesellschaft ist die Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Die Leitlinie wurde von der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin (DGP) im Rahmen des Leitlinienprogramms gefördert.
Bei der Anmeldung der Leitlinie war die Beteiligung folgender Fachgesellschaften vorgesehen: Deutsche Gesellschaft für Innere Medizin (DGIM), Deutsche Gesellschaft für Chirurgie (DGCH), Deutsche Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN), Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI), Deutsche Gesellschaft für Neurointensiv- und Notfallmedizin (DGNI), Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI), Deutsche Gesellschaft für Kardiologie (DGK), Deutsche Gesellschaft für Pflegewissenschaften (DGP), Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Aufgrund mangelnder Ressourcen hat die DEGAM keinen Mandatsträger entsandt, alle anderen Fachgesellschaften waren durch Mandatsträger vertreten. Beratend war der Deutsche Berufsverband Rettungsdienst (DBRD) e. V. eingebunden und als Patientenvertreter Wolfgang Veit vom Bundesverband der Organtransplantierten (BDO e. V.) beteiligt. Patientenvertreter und ein Vertreter des DBRD nahmen an den Konsensuskonferenzen teil.
Die Leitlinienentwicklung wurde methodisch begleitet von Monika Nothacker, MPH (AWMF), Berlin, die Evidenzaufarbeitung erfolgte durch Susanne Unverzagt, Abteilung Allgemeinmedizin, Universitätsklinikum Leipzig.
Die Leitlinie soll für die Behandlung von Sauerstoff akut kranker Erwachsener im stationären und präklinischen Bereich gelten. Diese Leitlinie soll auch Empfehlungen für kritisch kranke Patienten (z. B. solche auf Intensivstationen inklusive Patienten an invasiver Beatmung und extrakorporalen Verfahren) einschließen. Ebenso sollen Empfehlungen zur Sauerstoffbehandlung bei Eingriffen mit dem Ziel der erhaltenen Spontanatmung z. B. in der Endoskopie enthalten sein. Ausgeschlossen im Geltungsbereich dieser Leitlinie sind die Anwendung von Sauerstoff in der Tauch- und Höhenmedizin, die Langzeit-Sauerstofftherapie im häuslichen Bereich und die Gabe von Sauerstoff im Rahmen der Allgemeinanästhesie und in der Veterinärmedizin.
Die Leitliniengruppe legte bei ihrer konstitutionellen Sitzung 10 Schlüsselfragen für die Literaturrecherche fest.
Im vorliegenden Dokument handelt es sich um die Kurzversion der Leitlinie mit den wichtigsten 28 Empfehlungen. Eine ausführliche Langversion ist veröffentlicht [15, 51]. Unter http://www.awmf.org/leitlinien/detail/ll/020-021.html sind Interessenkonflikte, Evidenzberichte und Leitlinienberichte abrufbar.
Das methodische Vorgehen richtete sich nach dem AWMF-Regelwerk (http://www.awmf-leitlinien.de). Das Schema der Evidenzgraduierung erfolgte nach dem System des Oxford Centre for Evidence-Based Medicine (CEBM) in der Version von 2011. Die Formulierung von Empfehlungen erfolgte in 3 Graden: Empfehlung Grad A (starke Empfehlung) soll/soll nicht, Empfehlung Grad B (Empfehlung) sollte/sollte nicht, Empfehlung Grad 0 (offene Empfehlung) kann/kann verzichtet werden.
Grading of Recommendations Assessment, Development and Evaluation (GRADE) wurde verwendet, um die Qualität der Evidenz in Leitlinien einzuschätzen Sterblichkeit und Lebensqualität wurden a priori als kritische Endpunkte von der Leitliniengruppe konsentiert.
Empfehlungen wurden im Expertenkonsens formuliert, wenn die systematische Recherche keine geeigneten Studien erbrachte. Bei der Bewertung der Interessenkonflikte wurden bei keinem Leitliniengruppenmitglied geringe, bei dreien moderate und kein hoher Interessenkonflikt festgestellt. Moderate Interessenkonflikte hatten eine Enthaltung bei der Abstimmung themenbezogener Empfehlungen zur Folge.
Empfehlungen
Diagnostik
Empfehlung 1.1
Die zugrunde liegenden Ursachen einer Hypoxämie sollen festgestellt und behandelt werden. Sauerstoff soll verabreicht werden, um eine Hypoxämie und nicht um Atemnot zu behandeln.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Lebensqualität: hoch ⊕⊕⊕⊕
Literatur: Uronis 2007 [16], Uronis 2011 [17], Cranston 2008 [18]
Empfehlung 2.2
Bei der Einschätzung von Patienten mit Atemnot sollen neben der Sauerstoffsättigung auch Atemfrequenz, Pulsfrequenz, Blutdruck, Temperatur und Bewusstseinslage bestimmt werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Expertenmeinung
Empfehlung 2.1
Die Pulsoxymetrie soll in allen klinischen Situationen verfügbar sein, in denen Sauerstoff medizinisch verwendet wird, und zur Überwachung der Sauerstofftherapie regelmäßig eingesetzt werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Sterblichkeit: niedrig ⊕⊕⊝⊝, Hypoxämien: moderat ⊕⊕⊕⊝, kardiovaskuläre Ereignisse: moderat ⊕⊕⊕⊝
Literatur: Pedersen 2014 [19]
Empfehlung 6.2
Blutgasanalysen zur Überwachung einer Sauerstofftherapie sollten unter stationären Bedingungen bei den folgenden Patientengruppen durchgeführt werden:
Kritisch kranke Patienten, z. B. im Schock oder mit metabolischen Störungen
Beatmete Patienten
Patienten mit schwerer Hypoxämie (über 6 l O2/min, bzw. FiO2 über 0,4)
Patienten mit Hyperkapnierisiko (z. B. COPD, schweres Asthma, Adipositas mit BMI >40 kg/m2)
Patienten ohne zuverlässiges Pulsoxymetriesignal
Für stabile Patienten außerhalb der genannten Indikationen sollte keine routinemäßige Bestimmung der Blutgase erfolgen.
Zustimmung: 92 %
Empfehlungsgrad: B
Expertenmeinung
Empfehlung 2.3
Blutgasanalysen aus arterialisiertem Kapillarblut am Ohrläppchen können im stationären Bereich zur Patienteneinschätzung außerhalb der Intensivstationen eingesetzt werden.
Zustimmung: 100 %
Empfehlungsgrad: 0
Evidenzqualität: Hypoxämie: niedrig ⊕⊕⊝⊝, Lebensqualität: sehr niedrig ⊕⊝⊝⊝
Literatur: Zavorsky 2007 [20], Magnet 2017 [21], Ekkernkamp 2015 [22]
Empfehlung 2.4
Venöse Blutgasanalysen sollen für die Überwachung der Sauerstofftherapie nicht verwendet werden. Venöse Blutgasanalysen können lediglich bei einem pvCO2 <45 mm Hg eine Hyperkapnie ausschließen.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Hypoxämie: moderat ⊕⊕⊕⊝
Literatur: Lim 2010 [23], Byrne 2014 [24], Bingheng 2019 [25], Bloom 2014 [26]
Sauerstoffsysteme und Verordnung
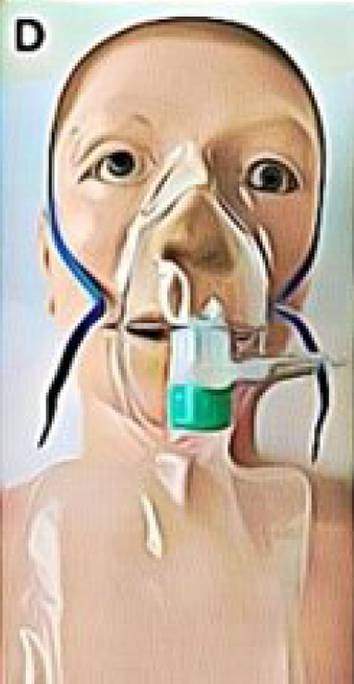
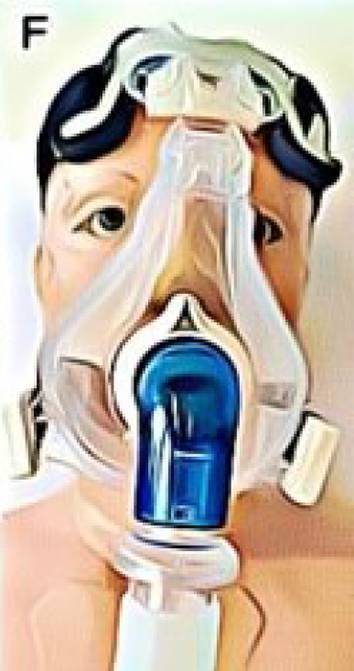
Sauerstoffzufuhrsysteme bestehen aus zwei Komponenten, zum einen die O2-Quelle zur Bereitstellung von Sauerstoff (z. B. Flaschen) und zum zweiten das Hilfsmittel zur Abgabe an den Patienten (z. B. Brille oder Maske, s. Tab. 1). Die Auswahl beider Komponenten richtet sich nach den klinischen Gegebenheiten und den Bedürfnissen des Patienten.
| Abbildung | Vorteile | Nachteile | |
|---|---|---|---|
|
Nasenbrillen (FiO2 0,26–0,54) |
|
Hoher Patientenkomfort Geringe Kosten Keine Beeinträchtigung Essen & Trinken |
FiO2 begrenzt FiO2 abhängig von Mundöffnung und Atemfrequenz |
|
Nasensonden (FiO2 0,2–0,4) |
|
Belegen nur ein Nasenostium Geringe Kosten |
Schleimhautirritation |
|
Einfache Gesichtsmasken (FiO2 0,35–0,60) |
Ohne Abbildung |
FiO2 unabhängig von Mundöffnung geringe Kosten |
Niedriger Patientenkomfort Hyperkapnierisiko bei Fluss <5 l/min Beeinträchtigung Essen & Trinken |
|
Venturi-Masken (FiO2 0,24–0,60) |
|
Geringeres Risiko von Hyperoxie und Hyperkapnie Geringe Aerosolbildung |
Niedriger Patientenkomfort Erfahrung beim Personal notwendig Beeinträchtigung Essen & Trinken |
|
Reservoirmasken (FiO2 0,6–0,9) |
|
Hohe FiO2 Geeignet für Notfallsituation |
Niedriger Patientenkomfort Hyperkapnierisiko bei Fluss <5 l/min Beeinträchtigung Essen & Trinken |
|
High-flow-Kanülen (FiO2 0,3–1,0) |
|
Hohe FiO2 Gute FiO2-Kontrolle Hoher Patientenkomfort und akzeptable Aerosolbildung bei guter Anpassung Befeuchtung Akzeptable Aerosolbildung Moderater PEEP CO2-Auswaschung im Totraum |
Höherer Personalaufwand und Kosten Erfahrung beim Personal notwendig |
|
Beatmungsmasken (FiO2 0,25–1,0) |
|
Hohe FiO2 Geringe Aerosolbildung (bei Einsatz von Zwei-Schlauchsystemen und Filtern) |
Niedriger Patientenkomfort (u. a. Druckstellen, Klaustrophobie) Höherer Personalaufwand und Kosten |
Abbildungen aus: https://www.awmf.org/leitlinien/detail/ll/020-021.html [51]
CPAP kontinuierlich positiver Atemwegsdruck, NIV nichtinvasive Beatmung, FiO2 inspiratorische Sauerstoffkonzentration, PEEP positiver endexspiratorischer Druck
Empfehlung 3.2
Sauerstoff soll nicht oder nur kurzzeitig (Richtwert unter 10 min, wenn keine Druckluft vorhanden ist) für eine Vernebelung z. B. von Medikamenten bei Patienten mit Hyperkapnierisiko verwendet werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Expertenmeinung
Empfehlung 3.3
Sauerstoff soll von geschultem Personal auf dem Gebiet der Sauerstofftherapie angewendet, überwacht und gesteuert werden. Patienten sollen über die Sauerstofftherapie informiert werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Expertenmeinung
Empfehlung 3.1
Nasenbrillen sollten bei niedrigen O2-Flussraten (d. h. <6 l/min) primär verwendet werden, alternativ Venturi-Masken mit niedriger Sauerstoffabgabe.
Zustimmung: 100 %
Empfehlungsgrad: B
Evidenzqualität: Lebensqualität/unerwünschte Arzneimittelwirkungen: moderat ⊕⊕⊕⊝
Literatur: Costello RW 1995 [27]; Nolan KM 1993 [28], Eastwood GM 2008 [29], Stausholm 1995 [30], Ayhan 2009 [31]
Empfehlung 3.4
Sauerstoff soll für jeden stationären Patienten unter Angabe eines Zielbereichs der Sauerstoffsättigung ärztlich verordnet werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Expertenmeinung
Ein Vorschlag der Leitliniengruppe zur Verordnung findet sich in Abb. 1.
Anwendung von Sauerstoff und Zielbereiche der O2-Sättigung
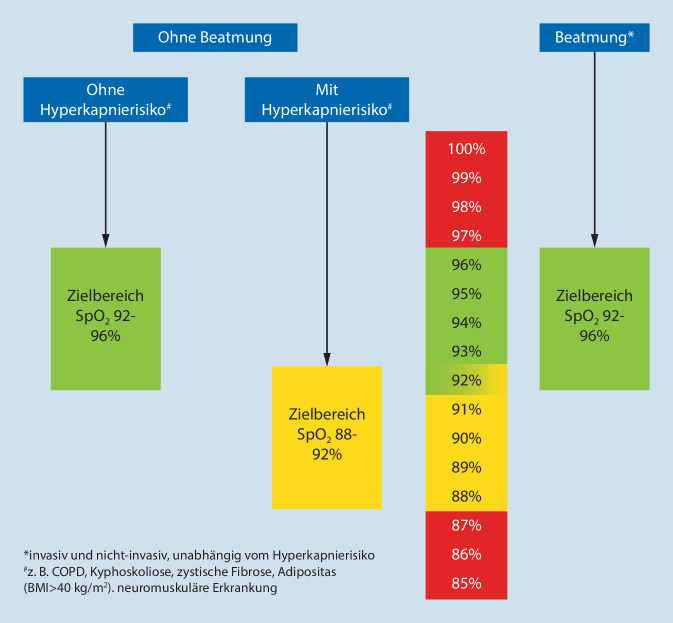
Zur Festlegung von Zielbereichen ist von Bedeutung, wann Hypoxämie und Hyperoxämie für akut Erkrankte wahrscheinlich gefährdend sind und in welchem Bereich die Sauerstofftherapie nicht schädlich und damit sicher ist. Dabei spielt eine Rolle, ob der Patient beatmet ist und ob er ein Hyperkapnierisiko hat oder nicht. Für diese 3 Patientengruppen sollen die in Abb. 2 genannten Zielbereiche der Sauerstofftherapie gelten. Ausnahmen einer Sauerstofftherapie ohne Zielbereich der Sauerstoffsättigung sind Clusterkopfschmerz, Kohlenmonoxidintoxikation sowie kritisch kranke Patienten, bei denen keine Pulsoxymetrie abgeleitet werden kann.
Empfehlung 4.1
Der Zielbereich der akuten Sauerstofftherapie für nicht beatmete Patienten ohne Hyperkapnierisiko soll bei einer pulsoxymetrischen Sättigung zwischen 92 und 96 % liegen.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Sterblichkeit: moderat ⊕⊕⊕⊝, funktionelles Ergebnis: moderat ⊕⊕⊕⊝
Literatur: Siemieniuk 2018 [32], Chu 2018 [8, 14], Wetterslev 2015 [14]
Empfehlung 4.3
Eine Sauerstofftherapie für akut kranke, nicht beatmete Patienten mit Hyperkapnierisiko (z. B. COPD) soll mit einer pulsoxymetrischen Zielsättigung von 88 bis 92 % erfolgen. Eine Sauerstofftherapie soll in dieser Situation bei einer Sättigung von über 92 % nicht durchgeführt bzw. reduziert werden und erst bei unter 88 % begonnen werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Sterblichkeit: moderat ⊕⊕⊕⊝, Intubation: niedrig ⊕⊕⊝⊝
Empfehlung 4.2
Bei beatmeten Patienten soll eine arterielle Sauerstoffsättigung von 92 bis 96 % angestrebt werden. Neben arteriellen Blutgasmessungen soll bei akzeptabler Übereinstimmung (Abweichung bis 2 %) und im präklinischen Bereich die pulsoxymetrische Messung der Sauerstoffsättigung zur Steuerung der Sauerstoffzufuhr verwendet werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Sterblichkeit: moderat ⊕⊕⊕⊝, unerwünschte Ereignisse: niedrig ⊕⊕⊝⊝
Literatur: Girardis 2016 [34]; Panwar 2016 [35], Asfar 2016 [36], Barrot 2020 [37], Barbateskovic 2019, ICU-ROX [38]
In den 6 randomisierten Studien (s. Tab. 2) wurde für überwiegend invasiv beatmete Patienten auf Intensivstationen die liberale gegen eine konservative Sauerstofftherapie verglichen. Die Zielbereiche der Sauerstoffsättigung waren in den Studien nicht einheitlich und die eingeschlossenen Patientenkollektive waren heterogen.
| Studie, Jahr | n | Medianes Alter, Jahre | Anteil invasive Beatmung (%) | Maximale Interventionsdauer | pO2/FiO2, mm Hg | Ziel liberal | Ziel konservativ | Sterblichkeit liberal vs. konservativ |
|---|---|---|---|---|---|---|---|---|
| CLOSE, 2016 [35] | 103 | 62 | 100 | 7 Tage | 248 | SpO2 ≥96 % | SpO2 88–92 % | 90 Tage: 37 vs. 40 %a |
| OXYGEN-ICU, 2016 [34] | 434 | 64 | 67 | n. a. | n. a. | Minimale FiO2 0,4, pO2 ≤150 mm Hg | pO2 71–99 mm Hg | ICU: 11.6 vs. 20,2 % |
| HYPER2S, 2017 [36] | 442 | 68 | 100 | 24 h | 224 | FiO2 1,0 | SaO2 88–100 % | 28 Tage: 42,8 vs. 35,5 % |
| ICU-ROX, 2020 [38] | 965 | 58 | 100 | 28 Tage | 252 | SpO2 ≥91 % | SpO2 91–96 % | 90 Tage 32,5 vs. 34,7 %a |
| LOCO2, 2020 [37] | 205 | 63 | 100 | 7 Tage (am Beatmungsgerät) | 118 | pO2 90–105 mm Hg | pO2 55–70 mm Hg | 28 Tage: 26,5 vs. 34,3 % |
| HOT-ICU, 2021 [39] | 2928 | 70 | 58 | 90 Tage | 125 | pO2 82,5–97,5 mm Hg | pO2 52,5–67,5 mm Hg | 90 Tage: 42,9 vs. 42,4 % |
SpO2 pulsoxymetrische Sauerstoffsättigung, SaO2 arterielle Sauerstoffsättigung, pO2 Sauerstoffpartialdruck, FiO2 inspiratorische Sauerstoffkonzentrationen, ICU Intensivstation, n. v. nicht verfügbar
aSterblichkeit nicht primär Endpunkt
Empfehlung 4.7
Patienten, die trotz Flussraten von mehr als 6 Litern Sauerstoff/min eine SpO2 von 92 % nicht erreichen, sollen unverzüglich durch einen erfahrenen Arzt in der Diagnostik und Behandlung von Patienten mit akutem Atemversagen oder kritisch kranker Patienten eingeschätzt werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Expertenmeinung
Empfehlung 4.9
Eine nichtinvasive Beatmung soll primär bei Patienten mit hyperkapnischem Atemversagen mit konsekutiver Hypoxämie, besonders bei COPD mit Exazerbation und kardialem Lungenödem eingesetzt werden, bei denen der pH-Wert <7,35 beträgt. Bei hypoxämischen und moderat hyperkapnischen Patienten kann HFNC alternativ eingesetzt werden.
Zustimmung: 93 %
Empfehlungsgrad: A
Evidenzqualität: Sterblichkeit: moderat ⊕⊕⊕⊝, Intubation: moderat ⊕⊕⊕⊝
Sauerstofftherapie bei besonderen Patientengruppen
Nach Expertenmeinung ergeben sich keine anderen Zielbereiche der Sauerstofftherapie für Patienten mit akutem Koronarsyndrom. In zwei Cochrane-Metaanalysen ergab sich keine Evidenz für die routinemäßige Sauerstoffgabe beim akuten Myokardinfarkt, unerwünschte Effekte waren nicht ausgeschlossen [42, 43].
Auch bei Patienten mit neurologischen Erkrankungen ergeben sich keine anderen Zielbereiche der Sauerstofftherapie. Insbesondere eine Hyperoxämie sollte bei diesen Patienten vermieden werden.
Die Behandlung von Schwangeren inkl. solchen mit Asthma sollte deshalb nach Ansicht der Autoren auf den Sauerstoffzielwerten basieren, von denen angenommen wird, dass sie bei anderen erwachsenen Patientengruppen angemessen sind.
Empfehlung 5.3
Bei einer Kohlenmonoxidvergiftung soll unabhängig von der Sauerstoffsättigung (SpO2) eine 100 % Sauerstoffgabe oder Beatmung mit 100 % O2 unverzüglich und für die Dauer von bis zu 6 h erfolgen. Bei schwerer Kohlenmonoxidvergiftung (z. B. mit anhaltender Bewusstseinsstörung) kann eine hyperbare Sauerstofftherapie durchgeführt werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Expertenmeinung
Empfehlung 5.1
Während der kardiopulmonalen Wiederbelebung soll der höchstmögliche Sauerstofffluss verwendet werden. Bei Wiedereintritt der spontanen Zirkulation und wenn die Sauerstoffsättigung zuverlässig überwacht werden kann, sollte ein Zielsättigungsbereich von 92 bis 96 % angestrebt werden.
Zustimmung: 100 %
Empfehlungsgrad: B
Evidenzqualität: Sterblichkeit: niedrig ⊕⊕⊝⊝, funktionelles Ergebnis: niedrig ⊕⊕⊝⊝
Empfehlung 5.5
Die Sauerstoffbehandlung von erwachsenen Patienten mit infektiösen Erkrankungen, die durch Aerosole übertragbar sind (z. B. SARS-CoV-2), soll nach den gleichen Prinzipien und Zielbereichen wie bei anderen Patienten mit Hypoxämie erfolgen.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Sterblichkeit: moderat ⊕⊕⊕⊝
Literatur: Alhazzani 2020 [46]
Empfehlung 5.4
Bei Patienten mit Clusterkopfschmerz soll Sauerstoff mit einer Flussrate von mindestens 12 l/min über mindestens 15 min über eine Reservoirmaske verabreicht werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: funktionelles Ergebnis: hoch ⊕⊕⊕⊕
Empfehlung 4.12
Bei allen Verfahren mit Sedierung mit dem Ziel der erhaltenen Spontanatmung soll vor und während des Eingriffs und in der Aufwachphase die Sauerstoffsättigung kontinuierlich pulsoxymetrisch überwacht werden.
Zustimmung: 93 %
Empfehlungsgrad: A
Expertenmeinung
Empfehlung 4.13
Bei allen Verfahren mit Sedierung und dem Ziel der erhaltenen Spontanatmung sollte bei Auftreten einer Hypoxämie (SpO2 <92 % bzw. 88 % bei Risiko eines hyperkapnischen Atemversagens) das Vorliegen einer Hypoventilation geprüft werden und Sauerstoff als Bestandteil eines multimodalen Konzepts verabreicht werden.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
High-flow-Sauerstoff
Empfehlung 5.6
Bei stationären Patienten mit einem akuten hypoxischen Lungenversagen ohne Hyperkapnie sollte bei 6 l O2/min über Nasenbrille/Maske und einer Sauerstoffsättigung von <92 % eine Sauerstofftherapie über High-flow-Sauerstoff eingeleitet werden.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
Empfehlung 5.7
Patienten unter High-flow-Sauerstoff-Therapie sollten engmaschig reevaluiert werden und Abbruchkriterien der HFNC festgelegt werden.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
Befeuchtung von Sauerstoff
Empfehlung 6.6
Bei der Verabreichung von Sauerstoff mit geringem Durchfluss (Maske oder Nasenkanülen) oder kurzfristiger Verabreichung von Sauerstoff mit hohem Durchfluss soll keine Befeuchtung verwendet werden.
Zustimmung: 100 %
Empfehlungsgrad: A
Evidenzqualität: Lebensqualität: moderat ⊕⊕⊕⊝
Überwachung und Dokumentation der Sauerstofftherapie
Empfehlung 6.4
Patienten sollten nach Beginn, Veränderung oder Beendigung der Sauerstofftherapie klinisch und pulsoxymetrisch für mindestens 5 min kontinuierlich überwacht werden.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
Eine schriftliche Dokumentation der Sauerstofftherapie soll Standard sein (Muster Tab. 3). Unter Sauerstofftherapie ist regelmäßig (z. B. 6‑stündlich) die vollständige Erhebung und Dokumentation der Vitalzeichen erforderlich.
| Datum | 07.01.2020 | 07.01.2020 | 07.01.2020 | 07.01.2020 |
| Uhrzeit | 8:05 | 11:45 | 16:32 | 23:15 |
| O2, l/min/FiO2 | 1 | – | 28 % | 6 |
| O2-Art | N | – | VM | RM |
| SpO2, % | 92 | 88 | 91 | 92 |
| Atemfrequenz, /min | 22 | 28 | 30 | 28 |
| Bewusstsein | A | A | A | C |
Aus: https://www.awmf.org/leitlinien/detail/ll/020-021.html [51]
N Nasenbrille, VM Venturi-Maske, RM Reservoirmaske, A („alert“) Aufmerksam, C („confusion“)
Beendigung der Sauerstofftherapie
Empfehlung 7.1
Die Sauerstoffzufuhr sollte verringert werden, wenn ein Patient klinisch stabil ist und die Sauerstoffsättigung über dem Zielbereich liegt oder wenn er sich über mehrere Stunden im Zielbereich befindet.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
Empfehlung 7.2
Bei Patienten ohne Hyperkapnierisiko, die klinisch stabil sind und unter 2 l O2/min mit der Sauerstoffsättigung über mehrere Stunden im Zielbereich liegen, sollte die Sauerstofftherapie beendet werden. Bei Patienten, bei denen das Risiko eines hyperkapnischen Atemversagens besteht, sollte als niedrigste Menge vor Beendigung 1 l/min (ggf. auch 0,5 l/min) gewählt werden.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
Empfehlung 7.5
Wenn eine Sauerstofftherapie nicht beendet werden kann, sollte die Sauerstofftherapie auch nach Entlassung aus dem Krankenhaus fortgesetzt werden. Eine Reevaluation dieser Patienten sollte wenige Wochen nach Beginn der Sauerstofftherapie erfolgen, um zu prüfen, ob die Indikation für eine Langzeit-Sauerstofftherapie besteht.
Zustimmung: 100 %
Empfehlungsgrad: B
Expertenmeinung
Acknowledgments
Danksagung
Bernd Schönhofer, Hannover; Terence Krauß, Hannover; Björn Jüttner, Hannover; Michael Westhoff, Hemer; Peter Haidl, Schmallenberg; Carsten Hermes, Bonn; Guido Michels, Eschweiler; Jan-Christopher Kamp, Hannover; Susanne Hoyer, Hannover; Christina Valtin, Hannover.
Einhaltung ethischer Richtlinien
Interessenkonflikt
Angaben zum Interessenkonflikt sind bei der AWMF unter http://www.awmf.org/leitlinien/detail/ll/020-021.html abrufbar.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Smith GB, Prytherch DR, Watson D, Forde V, Windsor A, Schmidt PE, et al. S(p)O(2) values in acute medical admissions breathing air—implications for the British Thoracic Society guideline for emergency oxygen use in adult patients? Resuscitation. 2012;83(10):1201–1205. doi: 10.1016/j.resuscitation.2012.06.002. [DOI] [PubMed] [Google Scholar]
- 2.Ebmeier SJ, Barker M, Bacon M, Beasley RC, Bellomo R, Knee Chong C, et al. A two centre observational study of simultaneous pulse oximetry and arterial oxygen saturation recordings in intensive care unit patients. Anaesth Intensive Care. 2018;46(3):297–303. doi: 10.1177/0310057X1804600307. [DOI] [PubMed] [Google Scholar]
- 3.Bleyer AJ, Vidya S, Russell GB, Jones CM, Sujata L, Daeihagh P, et al. Longitudinal analysis of one million vital signs in patients in an academic medical center. Resuscitation. 2011;82(11):1387–1392. doi: 10.1016/j.resuscitation.2011.06.033. [DOI] [PubMed] [Google Scholar]
- 4.Goodacre S, Turner J, Nicholl J. Prediction of mortality among emergency medical admissions. Emerg Med J. 2006;23(5):372–375. doi: 10.1136/emj.2005.028522. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Wyss-Dunant E. Acclimatization shock; studies in the Himalaya mountains. Minerva Med. 1955;46(21):675–685. [PubMed] [Google Scholar]
- 6.van der Post J, Noordzij LA, de Kam ML, Blauw GJ, Cohen AF, van Gerven JM. Evaluation of tests of central nervous system performance after hypoxemia for a model for cognitive impairment. J Psychopharmacol. 2002;16(4):337–343. doi: 10.1177/026988110201600408. [DOI] [PubMed] [Google Scholar]
- 7.Hafner S, Beloncle F, Koch A, Radermacher P, Asfar P. Hyperoxia in intensive care, emergency, and peri-operative medicine: Dr. Jekyll or Mr. Hyde? A 2015 update. Ann Intensive Care. 2015;5(1):42. doi: 10.1186/s13613-015-0084-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Chu DK, Kim LHY, Young PJ, Zamiri N, Almenawer SA, Jaeschke R, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta-analysis. Lancet. 2018;391(10131):1693–1705. doi: 10.1016/S0140-6736(18)30479-3. [DOI] [PubMed] [Google Scholar]
- 9.Edmark L, Kostova-Aherdan K, Enlund M, Hedenstierna G. Optimal oxygen concentration during induction of general anesthesia. Anesthesiology. 2003;98(1):28–33. doi: 10.1097/00000542-200301000-00008. [DOI] [PubMed] [Google Scholar]
- 10.Sackner MA, Landa J, Hirsch J, Zapata A. Pulmonary effects of oxygen breathing. A 6-hour study in normal men. Ann Intern Med. 1975;82(1):40–43. doi: 10.7326/0003-4819-82-1-40. [DOI] [PubMed] [Google Scholar]
- 11.Downs JB, Smith RA. Increased inspired oxygen concentration may delay diagnosis and treatment of significant deterioration in pulmonary function. Crit Care Med. 1999;27(12):2844–2846. doi: 10.1097/00003246-199912000-00050. [DOI] [PubMed] [Google Scholar]
- 12.Beasley R, Aldington S, Robinson G. Is it time to change the approach to oxygen therapy in the breathless patient? Thorax. 2007;62(10):840–841. doi: 10.1136/thx.2006.068866. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Austin MA, Wills KE, Blizzard L, Walters EH, Wood-Baker R. Effect of high flow oxygen on mortality in chronic obstructive pulmonary disease patients in prehospital setting: randomised controlled trial. BMJ. 2010;341:c5462. doi: 10.1136/bmj.c5462. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Wetterslev J, Meyhoff CS, Jorgensen LN, Gluud C, Lindschou J, Rasmussen LS. The effects of high perioperative inspiratory oxygen fraction for adult surgical patients. Cochrane Database Syst Rev. 2015 doi: 10.1002/14651858.CD012631.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Gottlieb J, Capetian P, Hamsen U, Janssens U, Karagiannidis C, Kluge S, König M, Nothacker M, Roiter S, Veit W, Volk T, Worth H, Fühner T. German S3 guideline—oxygen therapy in the acute care of adult patients. Pneumologie. 2021;75:1–59. [Google Scholar]
- 16.Uronis HE, Currow DC, McCrory DC, Samsa GP, Abernethy AP. Oxygen for relief of dyspnoea in mildly- or non-hypoxaemic patients with cancer: a systematic review and meta-analysis. Br J Cancer. 2008;98(2):294–299. doi: 10.1038/sj.bjc.6604161. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Uronis H, McCrory DC, Samsa G, Currow D, Abernethy A. Symptomatic oxygen for non-hypoxaemic chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2011;6:CD006429. doi: 10.1002/14651858.CD006429.pub2. [DOI] [PubMed] [Google Scholar]
- 18.Cranston JM, Crockett A, Currow D. Oxygen therapy for dyspnoea in adults. Cochrane Database Syst Rev. 2008 doi: 10.1002/14651858.CD004769.pub2.. [DOI] [PubMed] [Google Scholar]
- 19.Pedersen T, Nicholson A, Hovhannisyan K, Moller AM, Smith AF, Lewis SR. Pulse oximetry for perioperative monitoring. Cochrane Database Syst Rev. 2014;3:CD002013. doi: 10.1002/14651858.CD002013.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Zavorsky GS, Cao J, Mayo NE, Gabbay R, Murias JM. Arterial versus capillary blood gases: a meta-analysis. Respir Physiol Neurobiol. 2007;155(3):268–279. doi: 10.1016/j.resp.2006.07.002. [DOI] [PubMed] [Google Scholar]
- 21.Magnet FS, Majorski DS, Callegari J, Schwarz SB, Schmoor C, Windisch W, et al. Capillary PO2 does not adequately reflect arterial PO2 in hypoxemic COPD patients. Int J Chron Obstruct Pulmon Dis. 2017;12:2647–2653. doi: 10.2147/COPD.S140843. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ekkernkamp E, Welte L, Schmoor C, Huttmann SE, Dreher M, Windisch W, et al. Spot check analysis of gas exchange: invasive versus noninvasive methods. Respiration. 2015;89(4):294–303. doi: 10.1159/000371769. [DOI] [PubMed] [Google Scholar]
- 23.Lim BL, Kelly AM. A meta-analysis on the utility of peripheral venous blood gas analyses in exacerbations of chronic obstructive pulmonary disease in the emergency department. Eur J Emerg Med. 2010;17(5):246–248. doi: 10.1097/MEJ.0b013e328335622a. [DOI] [PubMed] [Google Scholar]
- 24.Byrne AL, Bennett M, Chatterji R, Symons R, Pace NL, Thomas PS. Peripheral venous and arterial blood gas analysis in adults: are they comparable? A systematic review and meta-analysis. Respirology. 2014;19(2):168–175. doi: 10.1111/resp.12225. [DOI] [PubMed] [Google Scholar]
- 25.Bingheng LJC, Yu C, Yijuan Y. Comparison of peripheral venous and arterial blood gas in patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD): a metaanalysis. Notfall Rettungsmed. 2019;22:620–627. [Google Scholar]
- 26.Bloom BM, Grundlingh J, Bestwick JP, Harris T. The role of venous blood gas in the emergency department: a systematic review and meta-analysis. Eur J Emerg Med. 2014;21(2):81–88. doi: 10.1097/MEJ.0b013e32836437cf. [DOI] [PubMed] [Google Scholar]
- 27.Costello RW, Liston R, McNicholas WT. Compliance at night with low flow oxygen therapy: a comparison of nasal cannulae and Venturi face masks. Thorax. 1995;50(4):405–406. doi: 10.1136/thx.50.4.405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Nolan KM, Winyard JA, Goldhill DR. Comparison of nasal cannulae with face mask for oxygen administration to postoperative patients. Br J Anaesth. 1993;70(4):440–442. doi: 10.1093/bja/70.4.440. [DOI] [PubMed] [Google Scholar]
- 29.Eastwood GM, O’Connell B, Gardner A, Considine J. Evaluation of nasopharyngeal oxygen, nasal prongs and facemask oxygen therapy devices in adult patients: a randomised crossover trial. Anaesth Intensive Care. 2008;36(5):691–694. doi: 10.1177/0310057X0803600510. [DOI] [PubMed] [Google Scholar]
- 30.Stausholm K, Rosenberg-Adamsen S, Skriver M, Kehlet H, Rosenberg J. Comparison of three devices for oxygen administration in the late postoperative period. Br J Anaesth. 1995;74(5):607–609. doi: 10.1093/bja/74.5.607. [DOI] [PubMed] [Google Scholar]
- 31.Ayhan H, Iyigun E, Tastan S, Orhan ME, Ozturk E. Comparison of two different oxygen delivery methods in the early postoperative period: randomized trial. J Adv Nurs. 2009;65(6):1237–1247. doi: 10.1111/j.1365-2648.2009.04984.x. [DOI] [PubMed] [Google Scholar]
- 32.Siemieniuk RAC, Chu DK, Kim LH, Guell-Rous MR, Alhazzani W, Soccal PM, et al. Oxygen therapy for acutely ill medical patients: a clinical practice guideline. BMJ. 2018;363:k4169. doi: 10.1136/bmj.k4169. [DOI] [PubMed] [Google Scholar]
- 33.Kopsaftis Z, Carson-Chahhoud KV, Austin MA, Wood-Baker R. Oxygen therapy in the pre-hospital setting for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2020;1:CD005534. doi: 10.1002/14651858.CD005534.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Girardis M, Busani S, Damiani E, Donati A, Rinaldi L, Marudi A, et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: the oxygen-ICU randomized clinical trial. JAMA. 2016;316(15):1583–1589. doi: 10.1001/jama.2016.11993. [DOI] [PubMed] [Google Scholar]
- 35.Panwar R, Hardie M, Bellomo R, Barrot L, Eastwood GM, Young PJ, et al. Conservative versus liberal oxygenation targets for mechanically ventilated patients. A pilot multicenter randomized controlled trial. Am J Respir Crit Care Med. 2016;193(1):43–51. doi: 10.1164/rccm.201505-1019OC. [DOI] [PubMed] [Google Scholar]
- 36.Asfar P, Schortgen F, Boisrame-Helms J, Charpentier J, Guerot E, Megarbane B, et al. Hyperoxia and hypertonic saline in patients with septic shock (HYPERS2S): a two-by-two factorial, multicentre, randomised, clinical trial. Lancet Respir Med. 2017;5(3):180–190. doi: 10.1016/S2213-2600(17)30046-2. [DOI] [PubMed] [Google Scholar]
- 37.Barrot L, Asfar P, Mauny F, Winiszewski H, Montini F, Badie J, et al. Liberal or conservative oxygen therapy for acute respiratory distress syndrome. N Engl J Med. 2020;382(11):999–1008. doi: 10.1056/NEJMoa1916431. [DOI] [PubMed] [Google Scholar]
- 38.ICU-ROX Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group. Mackle D, Bellomo R, Bailey M, et al. Conservative oxygen therapy during mechanical ventilation in the ICU. N Engl J Med. 2020;382(11):989–998. doi: 10.1056/NEJMoa1903297. [DOI] [PubMed] [Google Scholar]
- 39.Schjorring OL, Klitgaard TL, Perner A, Wetterslev J, Lange T, Siegemund M, et al. Lower or higher oxygenation targets for acute hypoxemic respiratory failure. N Engl J Med. 2021;384(14):1301–1311. doi: 10.1056/NEJMoa2032510. [DOI] [PubMed] [Google Scholar]
- 40.Berbenetz N, Wang Y, Brown J, Godfrey C, Ahmad M, Vital FM, et al. Non-invasive positive pressure ventilation (CPAP or bilevel NPPV) for cardiogenic pulmonary oedema. Cochrane Database Syst Rev. 2019;4:CD005351. doi: 10.1002/14651858.CD005351.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Osadnik CR, Tee VS, Carson-Chahhoud KV, Picot J, Wedzicha JA, Smith BJ. Non-invasive ventilation for the management of acute hypercapnic respiratory failure due to exacerbation of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017;7:CD004104. doi: 10.1002/14651858.CD004104.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Cabello JB, Burls A, Emparanza JI, Bayliss SE, Quinn T. Oxygen therapy for acute myocardial infarction. Cochrane Database Syst Rev. 2016;12:CD007160. doi: 10.1002/14651858.CD007160.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Burls A, Emparanza JI, Quinn T, Cabello JB. Oxygen use in acute myocardial infarction: an online survey of health professionals’ practice and beliefs. Emerg Med J. 2010;27(4):283–286. doi: 10.1136/emj.2009.077370. [DOI] [PubMed] [Google Scholar]
- 44.Holmberg MJ, Nicholson T, Nolan JP, Schexnayder S, Reynolds J, Nation K, et al. Oxygenation and ventilation targets after cardiac arrest: a systematic review and meta-analysis. Resuscitation. 2020;152:107–115. doi: 10.1016/j.resuscitation.2020.04.031. [DOI] [PubMed] [Google Scholar]
- 45.Wang CH, Chang WT, Huang CH, Tsai MS, Yu PH, Wang AY, et al. The effect of hyperoxia on survival following adult cardiac arrest: a systematic review and meta-analysis of observational studies. Resuscitation. 2014;85(9):1142–1148. doi: 10.1016/j.resuscitation.2014.05.021. [DOI] [PubMed] [Google Scholar]
- 46.Alhazzani W, Moller MH, Arabi YM, Loeb M, Gong MN, Fan E, et al. Surviving sepsis campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19) Intensive Care Med. 2020;46(5):854–887. doi: 10.1007/s00134-020-06022-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Cohen AS, Burns B, Goadsby PJ. High-flow oxygen for treatment of cluster headache: a randomized trial. JAMA. 2009;302(22):2451–2457. doi: 10.1001/jama.2009.1855. [DOI] [PubMed] [Google Scholar]
- 48.Bennett MH, French C, Schnabel A, Wasiak J, Kranke P, Weibel S. Normobaric and hyperbaric oxygen therapy for the treatment and prevention of migraine and cluster headache. Cochrane Database Syst Rev. 2015;12:CD005219. doi: 10.1002/14651858.CD005219.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Wen Z, Wang W, Zhang H, Wu C, Ding J, Shen M. Is humidified better than non-humidified low-flow oxygen therapy? A systematic review and meta-analysis. J Adv Nurs. 2017;73(11):2522–2533. doi: 10.1111/jan.13323. [DOI] [PubMed] [Google Scholar]
- 50.Poiroux L, Piquilloud L, Seegers V, Le Roy C, Colonval K, Agasse C, et al. Effect on comfort of administering bubble-humidified or dry oxygen: the Oxyrea non-inferiority randomized study. Ann Intensive Care. 2018;8(1):126. doi: 10.1186/s13613-018-0472-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Gottlieb J et al (2021) S3-Leitlinie: Sauerstoff in der Akuttherapie beim Erwachsenen. https://www.awmf.org/leitlinien/detail/ll/020-021.html. Zugegriffen: 05.10.