Abstract
目的
基于网络药理学和分子对接研究槲皮素治疗心力衰竭(HF)的分子机制。
方法
利用TCMSP、PharmMapper、CTD和GeneCards数据库得到槲皮素和HF相关靶点,通过在线Venn网站得到槲皮素-HF交集靶点,构建蛋白质相互作用网络后导入Cytoscape3.7.2得到槲皮素治疗HF的核心靶点。通过R包进行GO、KEGG通路富集分析,利用Auto Dock Vina进行分子对接。通过蛋白质免疫印迹检测槲皮素处理HF细胞模型的AKT1、Phospho-AKT(Ser473)、eNOS、MMP9和Caspase-3的蛋白水平。
结果
分析得到80个槲皮素-HF交集靶点,槲皮素治疗HF核心靶点5个:AKT1、CASP3、MAPK1、MMP9和MAPK8。GO分析中,生物过程集中在对肽类激素的反应、磷脂酰肌醇介导的信号传导、脂多糖的反应、对细菌来源分子的反应和炎症反应的调节等。KEGG通路富集分析表明富集最显著的信号通路为:脂质与动脉粥样硬化通路、癌症中的蛋白多糖、PI3K-AKT信号通路、糖尿病心肌病和MAPK信号通路。分子对接显示槲皮素对5个核心靶点具有良好的结合活性。蛋白质免疫印迹结果显示,100 μmol/L槲皮素可明显降低心力衰竭细胞AKT1、Phospho-AKT(Ser473)、eNOS、MMP9和Caspase-3水平(P < 0.01)。
结论
槲皮素可能通过调节AKT1-eNOS-MMP9通路抗凋亡从而改善心力衰竭的病理变化。
Keywords: 槲皮素, 心力衰竭, 分子对接, 网络药理学
Abstract
Objective
To investigate the molecular mechanism of quercetin in the treatment of heart failure (HF) based on network pharmacology and molecular docking.
Methods
Quercetin and HF-related targets were obtained using TCMSP, PharmMapper, CTD and GeneCards databases, and quercetin-HF intersection targets were obtained through the online website Venn; the protein interaction network was constructed and imported into Cytoscape 3.7.2 to identify the core targets of quercetin in the treatment of HF.GO and KEGG pathway enrichment analyses were performed using R package, and molecular docking was performed using Auto Dock Vina.The protein levels of AKT1, phospho-AKT(Ser473), eNOS, MMP9, and caspase-3 in quercetin-treated HF cell models were detected using protein immunoblotting.
Results
We identified 80 quercetin-HF intersectional targets (AKT1, CASP3, MAPK1, MMP9, and MAPK8) and 5 core targets of quercetin for treatment of HF.GO analysis suggested that the therapeutic effect of quercetin for HF was mediated mainly by such biological processes as responses to peptide hormones, phosphatidylinositol-mediated signalling, responses to lipopolysaccharides, responses to molecules of bacterial origin and regulation of inflammatory responses.KEGG pathway enrichment analysis identified lipid and atherosclerosis pathway, proteoglycans in cancer, PI3K-AKT signaling pathway, diabetic cardiomyopathy and MAPK signaling pathway as the most significantly enriched signaling pathways.Molecular docking showed a good binding activity of quercetin to the 5 core targets.The results of protein immunoblotting showed that 100 μmol/L quercetin significantly reduced AKT1, phospho-AKT (Ser473), eNOS, MMP9 and caspase-3 levels in the cell models of HF (P < 0.01).
Conclusion
Quercetin improves the pathological changes in HF possibly by regulating the AKT1-eNOS-MMP9 pathway to inhibit cell apoptosis.
Keywords: quercetin, heart failure, molecular docking, network pharmacology
心力衰竭(HF)为临床上严重的心血管疾病之一, 与冠状动脉粥样硬化、高血压、糖尿病和心肌梗死等疾病相关[1-2]。最新的国内HF指南提出, 目前治疗HF药物主要以β受体阻滞剂、血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂和螺内酯为主[3]。上述治疗HF的口服药物虽然均有一定的治疗作用, 但是也存在一定的副作用。因此, 寻找直接针对HF病理生理改变的药物并研究其深一层次的作用机制, 具有重要意义。所以近年来在新药的研发中, 天然药物化学成分治疗相关疾病引起了越来越多的学者重视[4]。
槲皮素在自然界蔬菜水果中存在及其广泛, 并且多种中药包含槲皮素。由于槲皮素具有抑制低密度脂蛋白氧化、减少粘附分子和其他炎症标志物、预防神经元氧化和炎症损伤以及血小板抗聚集作用, 槲皮素治疗潜力被广泛报道研究。据报道, 槲皮素在HF、冠心病、心肌缺血再灌注、高血压和心肌炎动物模型上均显示出明显的治疗效果, 但是槲皮素治疗HF仍缺乏体外以及临床研究, 因此有必要系统的深入研究槲皮素治疗HF的分子机制[5, 6]。网络药理学作为一种新型的药物疾病研究方法, 为药物和疾病之间的具体分子机制提供充足的证据[7]。因此本研究基于网络药理学筛选出槲皮素治疗HF的靶点, 并对交集靶点进行GO和KEGG分析, 明确槲皮素治疗HF核心靶点以及潜在的分子机制, 并在HF细胞模型上面进行了初步验证, 为未来的临床应用和基础研究提供新的见解及依据。
1. 材料和方法
1.1. 槲皮素靶点的获取
利用中药系统药理学分析平台(TCMSP)(<a href="http://tcmspw.com/" target="_blank">http://tcmspw.com/</a>), 以“quercetin”为关键词检索槲皮素中的作用靶点, 下载其mol2格式并上传到PharmMapper(<a href="http://www.lilab-ecust.cn/pharmmapper/" target="_blank">http://www.lilab-ecust.cn/pharmmapper/</a>)网站, 靶点种类设定为HumanProtein Targets Only, 其他默认<sup>[<xref ref-type="bibr" rid="b8">8</xref>, <xref ref-type="bibr" rid="b9">9</xref>]</sup>。(检索日期: 2021.4.1)
1.2. HF相关靶点的获取
通过CTD(<a href="http://ctdbase.org" target="_blank">http://ctdbase.org</a>)、GeneCards(<a href="https://www.genecards.org/" target="_blank">https://www.genecards.org/</a>)数据库, 以“Heart Failure”为关键词检索相关的基因<sup>[<xref ref-type="bibr" rid="b10">10</xref>, <xref ref-type="bibr" rid="b11">11</xref>]</sup>。将搜集到的靶点合并剔除重复项, 获得疾病靶点。
1.3. 槲皮素和HF交集靶点蛋白质互作(PPI)网络的构建
将筛选过的靶点上传至在线韦恩图(<a href="http://bioinformatics.psb.ugent.be/webtools/Venn/" target="_blank">http://bioinformatics.psb.ugent.be/webtools/Venn/</a>), 得到槲皮素与HF的交集基因。将交集基因导入String数据库<sup>[<xref ref-type="bibr" rid="b12">12</xref>]</sup>(<a href="https://string-db.org/cgi/input.pl" target="_blank">https://string-db.org/cgi/input.pl</a>)构建蛋白质之间的PPI, 将PPI网络导入Cytoscape3.7.2软件(<a href="http://www.cytoscape.org/" target="_blank">http://www.cytoscape.org/</a>)进行调整以及利用cytoHubba插件得到关键靶点。
1.4. GO分析和KEGG通路和槲皮素-主要通路-心力衰竭网络构建
进一步了解交集基因的功能与信号通路中作用, 将基因简写(Symbol)转化为基因ID(EntrezID), 通过R语言包对结果进行可视化分析, 以及对上述交集基因进行基因本位(GO), GO分析可以进一步解释交集基因在分子功能, 生物过程和细胞组成抗HF的过程。京都基因与基因组百科全书(KEGG), KEGG富集分析则是研究交集基因涉及的主要抗HF信号通路。同时构建“槲皮素-主要通路-心力衰竭”核心靶点网络。
1.5. 槲皮素与HF分子对接
将已知的关键靶点与槲皮素进行分子对接, 得到对接亲和力反映其稳定性。PDB数据库下载核心蛋白分子结构, PUBCHEM下载槲皮素的结构, 将蛋白和槲皮素结构导入PyMol 2.4.0和Auto Dock Tools软件进行处理后进行分子对接, PyMol 2.4.0进行可视化[13, 14]。
1.6. 药品及试剂
槲皮素(Sigma), 戊巴比妥钠(中国西亚试剂), CCK8试剂盒(Biosharp), DMEM高糖培养基(GIBICO), 二甲基亚砜(DMSO), BSA(Biofroxx)。AKT1(Abcam), Phospho-AKT(Ser473)(CST), eNOS(CST), MMP9(Abcam), Caspase-3(CST), β-actin(Biosharp), 羊抗兔(Biosharp), 羊抗鼠(Biosharp)。
1.7. H9C2心肌细胞培养
本研究选用大鼠H9C2心肌细胞(FUBIO细胞株), 细胞培养使用10%胎牛血清培养基, 将心肌细胞均匀种于96孔板上(每孔约5000个), 给予槲皮素0、25、50、75、100、125、150、200 μmol/L干预4 h后加入CCK8, 从而获得槲皮素最佳用药浓度。将H9C2心肌细胞分为正常组(N)、正常组+槲皮素组(N+Q)、心力衰竭组(HF)和心力衰竭+槲皮素组(HF+Q), 放于37 ℃、5%CO2培养箱中。槲皮素溶解于DMSO中, 最终浓度为100 mmol/L待用。培养24 h后换液加入无血清DMEM同步化处理12 h后, N组和HF组换液为无血清培养基, N+Q组和HF+Q组加入无血清培养基配制的槲皮素, 在培养箱中培养4 h后进行HF细胞模型造模[15]。
1.8. 戊巴比妥钠诱导H9C2细胞心衰模型
已有研究证实细胞模型可作为研究HF的模型之一[16], 将戊巴比妥钠溶于无血清高糖培养基(现用现配), 配置成0.1%备用。将干预好的细胞用PBS冲洗2次, 清除残留槲皮素, 除N组和N+Q组外将HF组和HF+Q组加入等体积无血清0.1%戊巴比妥钠培养基, 放于培养箱干预0.5 h后, 观察梭形心肌细胞变细并有部分细胞变成圆形, 少部分细胞已漂浮, 则心衰细胞模型建立成功。
1.9. CCK-8活性检测
将H9C2心肌细胞按照细胞5000/孔均匀种于96孔板中, 按照上述条件进行分组干预培养后, 依据试剂盒说明书进行操作, 利用Biotok酶标仪检测吸光度A450 nm。
1.10. 蛋白免疫印迹检测
将各组心衰细胞蛋白提出后进行定量、变性并计算上样量, 电泳、转膜后5%脱脂牛奶室温封闭2 h, 其中Phospho-AKT使用5%BSA封闭2 h, 依次加入AKT1、Phospho-AKT、eNOS、MMP9、Caspase-3、β-actin等抗体4 ℃摇床孵育12 h, 第2天将膜取出在摇床上给予TBS-Tween洗膜, 5 min 3次后给予室温孵育二抗2 h, 然后TBS-Tween洗膜10 min 3次后曝光(VIVILBER机器), 利用Image J统计分析条带灰度值。
1.11. 统计学方法
数据采用GraphPad Prism 9.0统计学处理, 所有数据均以均数±标准差表示。各组间采用单因素方差分析, 两两比较采用t检验, P < 0.05为差异具有统计学意义。
2. 结果
2.1. 槲皮素潜在靶点信息
通过TCMSP、PharmMapper数据库最终得到槲皮素的潜在靶点共380个, 将靶点名称上传到UniProt数据库(<a href="http://www.uniprot.org/" target="_blank">http://www.uniprot.org/</a>), 限定物种为“Homosapiens”, 校正靶点名称并剔除得分较低的靶点, 最终得到316个靶点。
2.2. HF相关靶点获取
在CTD、GeneCards数据库共筛选出84117(70494+13623)个基因, 通过筛查剔除CTD和GeneCards中关联得分较小的基因, 分别筛选出555、425个相关度得分较高的基因, 将其合并剔除重复基因, 得到821个高分靶点。
2.3. 槲皮素-心力衰竭的共同靶点
将槲皮素潜在靶点信息与HF高分靶点取交集得到槲皮素中与HF相关发病机制的80个作用靶点基因, 包括AKT1、EGFR、TTR、MAPK等。交集靶点韦恩图见图 1。
1.
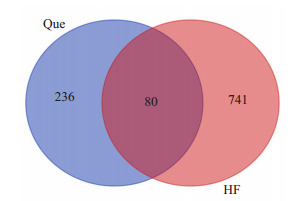
Venn diagram of Que and HF.
槲皮素与HF韦恩图
2.4. PPI网络及槲皮素治疗HF的关键靶点
将槲皮素与HF交集靶点导入String数据库, 物种限定为人, 得到蛋白互作网络, 将其进一步导入Cytoscape进行可视化分析(图 2), 网络中共有80个节点, 715条边, 利用cytoHubba插件得到Degree排名前5治疗HF的关键靶点AKT1、CASP3、MAPK1、MMP9、MAPK8, 关键靶点详情信息见表 1。
2.
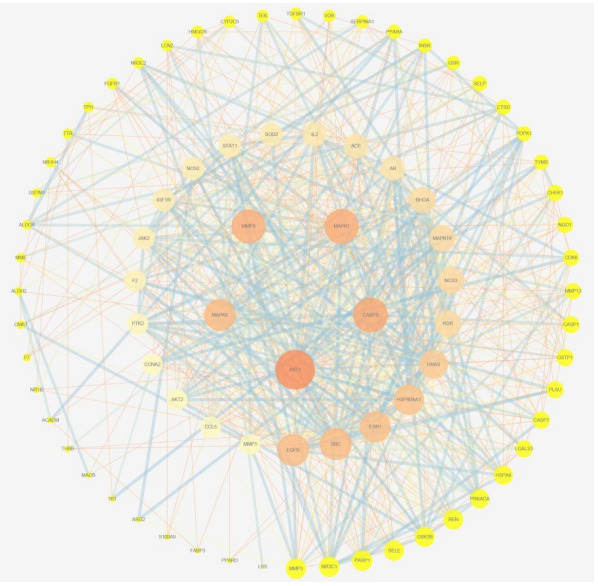
Core protein-protein interaction network.
核心PPI网络
1.
Key target information table of QUE in the treatment of HF
槲皮素治疗HF的关键靶点信息表
| Key targets | Protein description | Degree |
| AKT1 | RAC-alpha serine/threonine-protein kinase 1 | 57 |
| CASP3 | Caspase-3 | 48 |
| MAPK1 | Mitogen-activated protein kinase 1 | 47 |
| MMP9 | Matrix metalloproteinase-9 | 46 |
| MAPK8 | Mitogen-activated protein kinase 8 | 42 |
2.5. GO功能分析结果
槲皮素治疗HF的GO功能结果提示(图 3), 生物过程主要集中在: 对脂多糖的反应、对细菌来源分子的反应、炎症反应的调节、对肽类激素的反应、磷脂酰肌醇介导的信号传导; 细胞组成主要集中在: 膜筏、膜微区、膜区、囊腔、分泌颗粒腔; 分子功能主要集中在: 内肽酶活性、羧酸结合、有机酸结合、RNA聚合酶II特异性DNA结合转录因子结合、核受体活性。
3.
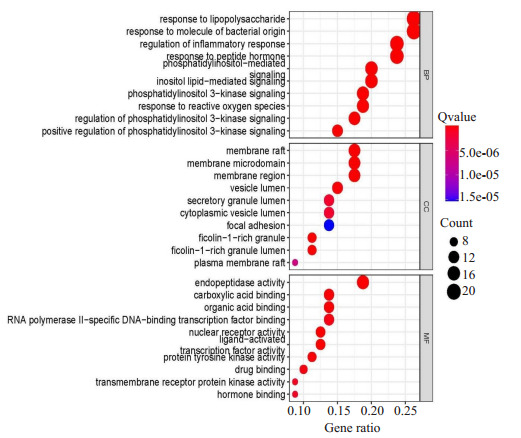
Results of GO function analysis.
GO功能分析结果
2.6. KEGG通路富集分析结果
KEGG通路富集筛选结果共有154个富集项, 其中前30是最具有显著性的通路(图 4), 其中脂质与动脉粥样硬化通路、癌症中的蛋白多糖、PI3K-AKT信号通路、糖尿病心肌病、MAPK信号通路等可能为重要的通路。“槲皮素靶点-主要通路-心力衰竭”网络见图 5, 其中槲皮素治疗HF可能的重要通路PI3K-AKT详细信号通路见图 6, 其中通路图中红色区域为信号上调。
4.
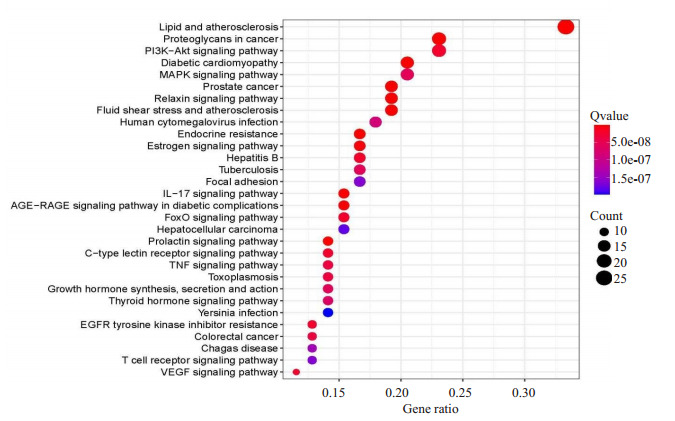
Results of KEGG pathway enrichment analysis.
KEGG通路富集分析结果
5.
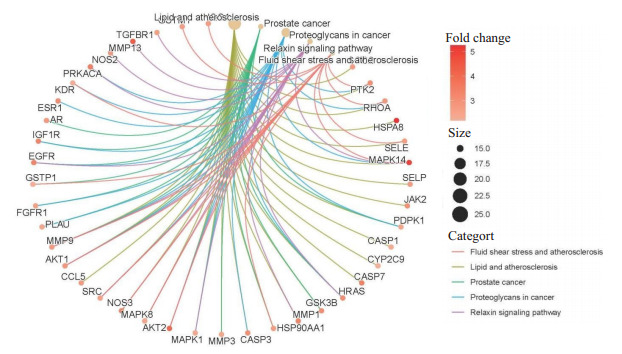
Quercetin target-major pathway-heart failure.
槲皮素靶点-主要通路-心力衰竭
6.
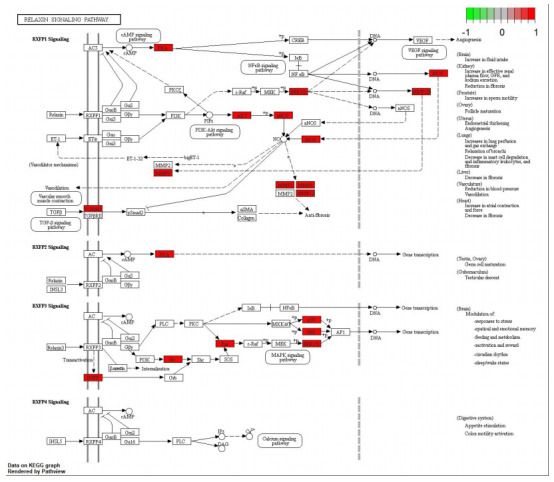
Targets of quercetin in the treatment of heart failure.
槲皮素治疗心力衰竭的信号通路靶点
2.7. 分子对接分析
将槲皮素与上述关键靶点进行分子对接, 平均对接亲和力为6.58 kcal/moL(表 2), 与各关键靶点对接详细图见图 7。
2.
Molecular docking results
分子对接结果
| Compound | Target | PDB | Energy (kcal/mol) |
| Quercetin | AKT1 | 2UZS | -6 |
| Quercetin | CASP3 | 1QX3 | -5.3 |
| Quercetin | MAPK1 | 4S31 | -7.2 |
| Quercetin | MMP9 | 5TH6 | -7.2 |
| Quercetin | MAPK8 | 4G1W | -7.2 |
7.
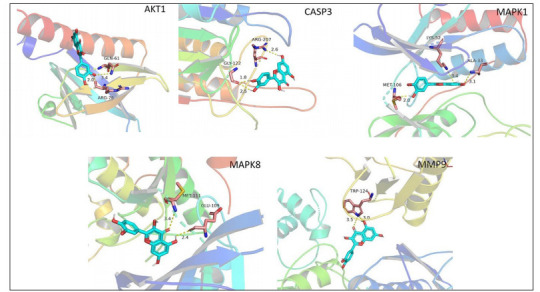
Docking pattern of quercetin with the key target molecules.
槲皮素与关键靶点分子对接模式图
2.8. 不同槲皮素浓度对H9C2细胞的影响
为了进一步明确槲皮素治疗心衰细胞的最佳浓度, 给予0、25、50、75、100、125、150、200 μmol/L槲皮素处理H9C2细胞4 h。CCK-8结果显示, 125、150、200会显著降低细胞活性, 即100 μmol/L为最佳用药浓度(图 8), HF细胞模型造模成功(图 9)。
8.
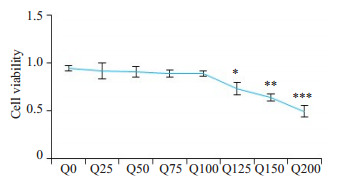
Survival rate of H9c2 cells treated with different concentrations of quercetin for 4 h determined with cell counting kit-8(n=3, Mean±SD).*P < 0.05, **P < 0.01, ***P < 0.001 vs 0 μmol/L.
不同槲皮素浓度对H9C2细胞的影响
9.
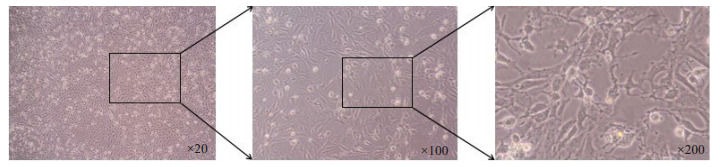
Establishment of a heart failure model in H9c2 cardiomyocytes.
H9C2心肌细胞心衰模型的建立
2.9. CCK-8检测各组心肌细胞活力变化
与正常组N组比较, N+Q组细胞活力无明显变化, 而HF模型组细胞活力明显下降。与HF模型组比较, HF+Q组细胞活力明显升高(图 10)。
10.
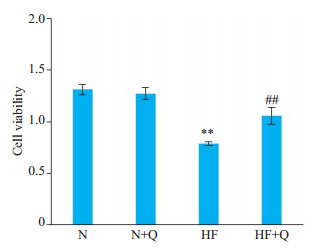
Changes in cardiomyocyte viability in each group.**P < 0.01 vs N group, ##P < 0.01 vs HF group.
各组心肌细胞活力变化
2.10. 槲皮素通过AKT1-eNOS-MMP9通路调控心衰细胞的凋亡
根据关键通路的调控靶点, 100 μmol/L槲皮素干预后, 检测各组关键通路蛋白AKT1、Phospho-AKT、eNOS、MMP9, 同时检测各组Caspase-3凋亡蛋白活性。免疫印迹分析结果提示, 槲皮素可明显降低HF组中AKT1、Phospho-AKT、eNOS、MMP9水平(图 11A), 并明显降低HF细胞的Caspase-3活性(图 11B)。
11.
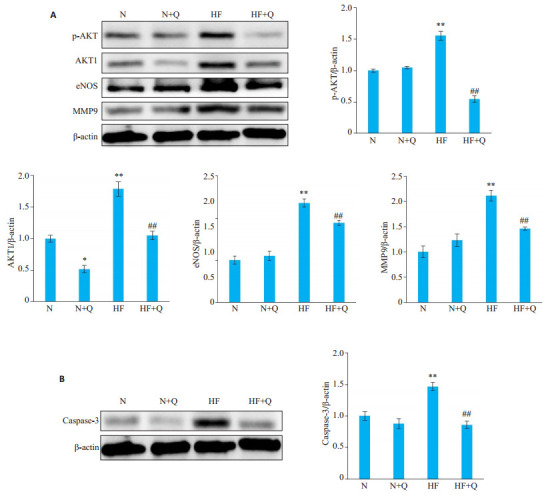
Quercetin decreases the expression of P-AKT, AKT1, eNOS, MMP9(A)and caspase-3(B)in heart failure cell models detected by Western blotting(n=3, Mean±SD).*P < 0.05, **P < 0.01 vs N group; #P < 0.05, ##P < 0.01 vs HF group.
槲皮素降低心衰细胞P-AKT、AKT1、eNOS、MMP9表达水平并降低Caspase-3蛋白表达
3. 讨论
HF中医发病机制是以心肾为本, 五脏相因, 水饮瘀血, 相兼为患, 心衰患者常见数脏同病, 虚实错杂, 但以心肾气虚、阴阳俱虚为主。槲皮素是黄酮类化合物的6个亚类之一, 摄入较多的槲皮素可以降低心血管疾病的发病率和死亡率, 槲皮素具有抗氧化、抗凋亡、抗炎和免疫调节等功能[17-23], 体内实验具有抗HF作用[5]。本研究共获得80个槲皮素治疗HF的靶点, 其中AKT1、CASP3、MAPK1、MMP9和MAPK8为治疗的核心靶点。已有研究证明, 氯沙坦通过调节HF患者外周血内皮祖细胞中的PI3K/AKT/eNOS通路可促进内皮祖细胞的增殖和迁移, 并减少内皮祖细胞的凋亡[24]。本研究在HF心肌细胞模型中发现, 槲皮素可通过调节AKT1/eNOS/MMP9通路抗HF心肌细胞的凋亡。
GO分析显示, 槲皮素治疗HF生物过程集中在对脂多糖的反应, 其中还涉及对肽类激素的反应、磷脂酰肌醇介导的信号传导、对细菌来源分子的反应和炎症反应的调节等。KEGG结果表明, 槲皮素治疗HF主要通路富集在PI3K-AKT信号通路、脂质与动脉粥样硬化通路、癌症中的蛋白多糖、糖尿病心肌病、MAPK信号通路、前列腺癌、松弛素信号通路、流体抗剪应力和动脉粥样硬化等。研究表明槲皮素具有抗凋亡和抗氧化等功能, 对HF中的心室重构具有一定的保护作用[5, 22], PI3KAKT信号通路能调节细胞生长、代谢、凋亡等活动, 具有广泛生物学功能[25]。在糖尿病心肌病导致HF中发现降低PI3K/AKT和ERK1/2活化, 可增加心肌氧化应激和抗凋亡能力, 进一步减缓HF的疾病进展[26]。我们通过筛选PI3K-AKT关键通路中的上调靶点, 发现通路中的AKT1-eNOS-MMP9在槲皮素治疗HF中起到关键作用。
本研究得出槲皮素治疗HF有80个靶点, 核心靶点如前所述。有研究表明抑制AKT1信号通路表达可以改善HF心肌细胞自噬和凋亡[27, 28]。MMP9是基质金属蛋白酶(MMPs)中的一种, MMPs影响细胞炎症过程、凋亡、新生血管生成、分化和生长等功能, 抑制其表达可以改善HF心脏功能障碍和重塑[28, 29]。CASP3主要参与凋亡半胱氨酸蛋白酶的激活级联反应, 在凋亡过程中起重要的作用, 多项研究证实通过降低CASP3活性可减少活性氧的产生并抑制凋亡来预防HF[30, 31]。血管内皮一氧化氮是由L-精氨酸在血管内皮一氧化氮合成酶的催化下合成的, 对维持循环平衡和调节血管张力具有重要作用[32], 内皮一氧化氮的产生主要取决于一氧化氮合成酶的活性, 其活性与PI3K/AKT通路密切相关[33]。本研究在HF细胞模型中使用100 μmol/L槲皮素进行干预, 发现可明显降低核心靶点中AKT1、MMP9和CASP3的蛋白表达, 分子对接提示槲皮素与核心靶点具有较好的结合作用。关键通路中的eNOS经槲皮素干预后表达降低。以上结果表明, 槲皮素可通过调控AKT1-eNOS-MMP9通路减少HF细胞模型凋亡蛋白的表达。
综上所述, 通过网络药理学系统的分析明确槲皮素治疗HF的关键靶点, GO和KEGG分析以及筛选得到了核心信号通路及分子机制。利用分子对接技术进行槲皮素与关键靶点的结合验证, 并通过在HF细胞模型上验证, 发现槲皮素可能通过调控AKT1-eNOS-MMP9通路抗凋亡进一步改善HF的病理生理改变。因此本研究可为基础临床深一步的研究提供依据, 以及药物研发提供新的思路和方法。
Biography
谭鑫,硕士,E-mail: 345383010@qq.com
Funding Statement
国家自然科学基金(81970313);安徽省高校省级自然科学研究重点项目(KJ2020A0560);蚌埠医学院优秀人才基金(2019byyfyyq004);蚌埠医学院研究生创新计划(Byycx20025)
Supported by National Natural Science Foundation of China (81970313)
Contributor Information
谭 鑫 (Xin TAN), Email: 345383010@qq.com.
康 品方 (Pinfang KANG), Email: Kangpinfang.1016@163.com.
王 洪巨 (Hongju WANG), Email: docwhj1101@163.com.
References
- 1.Gencer B, Bonomi M, Adorni MP, et al Cardiovascular risk and testosterone-from subclinical atherosclerosis to lipoprotein function to heart failure. Rev Endocr Metab Disord. 2021;22(2):257–74. doi: 10.1007/s11154-021-09628-2. [Gencer B, Bonomi M, Adorni MP, et al. Cardiovascular risk and testosterone-from subclinical atherosclerosis to lipoprotein function to heart failure[J]. Rev Endocr Metab Disord, 2021, 22(2): 257-74.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Nandi SS, Katsurada K, Sharma NM, et al MMP9 inhibition increases autophagic flux in chronic heart failure. Am J Physiol Heart Circ Physiol. 2020;319(6):H1414–37. doi: 10.1152/ajpheart.00032.2020. [Nandi SS, Katsurada K, Sharma NM, et al. MMP9 inhibition increases autophagic flux in chronic heart failure[J]. Am J Physiol Heart Circ Physiol, 2020, 319(6): H1414-37.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.中国心力衰竭诊断与治疗质量评价和控制指标专家共识[J]. 中国医学前沿杂志: 电子版, 2021, 13(3): 52-62.
- 4.赵雨靓, 李丰, 石彬彬, 等 中药系统药理学Ⅱ: 在药物开发和复方研究领域的应用进展. https://www.cnki.com.cn/Article/CJFDTOTAL-LNZY202003065.htm. 辽宁中医杂志. 2020;47(3):213–20. [赵雨靓, 李丰, 石彬彬, 等. 中药系统药理学Ⅱ: 在药物开发和复方研究领域的应用进展[J]. 辽宁中医杂志, 2020, 47(3): 213-20.] [Google Scholar]
- 5.Sharma A, Parikh M, Shah H, et al Modulation of Nrf2 by quercetin in doxorubicin-treated rats. Heliyon. 2020;6(4):e03803. doi: 10.1016/j.heliyon.2020.e03803. [Sharma A, Parikh M, Shah H, et al. Modulation of Nrf2 by quercetin in doxorubicin-treated rats[J]. Heliyon, 2020, 6(4): e03803.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Patel RV, Mistry BM, Shinde SK, et al Therapeutic potential of quercetin as a cardiovascular agent. Eur J Med Chem. 2018;155:889–904. doi: 10.1016/j.ejmech.2018.06.053. [Patel RV, Mistry BM, Shinde SK, et al. Therapeutic potential of quercetin as a cardiovascular agent[J]. Eur J Med Chem, 2018, 155: 889-904.] [DOI] [PubMed] [Google Scholar]
- 7.Hopkins AL Network pharmacology: the next paradigm in drug discovery. Nat Chem Biol. 2008;4(11):682–90. doi: 10.1038/nchembio.118. [Hopkins AL. Network pharmacology: the next paradigm in drug discovery[J]. Nat Chem Biol, 2008, 4(11): 682-90.] [DOI] [PubMed] [Google Scholar]
- 8.Ru JL, Li P, Wang JN, et al TCMSP: a database of systems pharmacology for drug discovery from herbal medicines. J Cheminform. 2014;6:13. doi: 10.1186/1758-2946-6-13. [Ru JL, Li P, Wang JN, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Wang X, Shen YH, Wang SW, et al PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database. Nucleic Acids Res. 2017;45(W1):W356–60. doi: 10.1093/nar/gkx374. [Wang X, Shen YH, Wang SW, et al. PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Res, 2017, 45(W1): W356-60.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Davis AP, Grondin CJ, Johnson RJ, et al The comparative toxicogenomics database: update 2017. Nucleic Acids Res. 2017;45(d1):D972–8. doi: 10.1093/nar/gkw838. [Davis AP, Grondin CJ, Johnson RJ, et al. The comparative toxicogenomics database: update 2017[J]. Nucleic Acids Res, 2017, 45(d1): D972-8.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Rebhan M GeneCards: integrating information about genes, proteins and diseases. Trends Genet. 1997;13(4):163. doi: 10.1016/S0168-9525(97)01103-7. [Rebhan M. GeneCards: integrating information about genes, proteins and diseases[J]. Trends Genet, 1997, 13(4): 163.] [DOI] [PubMed] [Google Scholar]
- 12.Szklarczyk D, Franceschini A, Wyder S, et al STRING v10: proteinprotein interaction networks, integrated over the tree of life. http://europepmc.org/articles/PMC4383874/pdf/gku1003.pdf. NucleicAcids Res. 2015;43(Database issue):D447–52. doi: 10.1093/nar/gku1003. [Szklarczyk D, Franceschini A, Wyder S, et al. STRING v10: proteinprotein interaction networks, integrated over the tree of life[J]. NucleicAcids Res, 2015, 43(Database issue): D447-52.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Morris GM, Huey R, Lindstrom W, et al AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility. J Comput Chem. 2009;30(16):2785–91. doi: 10.1002/jcc.21256. [Morris GM, Huey R, Lindstrom W, et al. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility[J]. J Comput Chem, 2009, 30(16): 2785-91.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Seeliger D, de Groot BL Ligand docking and binding site analysis with PyMOL and Autodock/Vina. J Comput Aided Mol Des. 2010;24(5):417–22. doi: 10.1007/s10822-010-9352-6. [Seeliger D, de Groot BL. Ligand docking and binding site analysis with PyMOL and Autodock/Vina[J]. J Comput Aided Mol Des, 2010, 24(5): 417-22.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.李硕, 苏萍, 张广平, 等 人参四逆汤及其有效成分对戊巴比妥钠所致心肌细胞损伤模型的保护作用. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201901012.htm. 中国实验方剂学杂志. 2019;25(1):90–5. [李硕, 苏萍, 张广平, 等. 人参四逆汤及其有效成分对戊巴比妥钠所致心肌细胞损伤模型的保护作用[J]. 中国实验方剂学杂志, 2019, 25(1): 90-5.] [Google Scholar]
- 16.谢晓芳, 彭成, 徐菲飞, 等 人参皂苷类成分对戊巴比妥钠损伤心肌细胞ATP酶及相关离子的影响. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYL201405020.htm. 中药药理与临床. 2014;30(5):61–4. [谢晓芳, 彭成, 徐菲飞, 等. 人参皂苷类成分对戊巴比妥钠损伤心肌细胞ATP酶及相关离子的影响[J]. 中药药理与临床, 2014, 30(5): 61-4.] [Google Scholar]
- 17.Anand David AV, Arulmoli R, Parasuraman S Overviews of biological importance of quercetin: a bioactive flavonoid. Pharmacogn Rev. 2016;10(20):84–9. doi: 10.4103/0973-7847.194044. [Anand David AV, Arulmoli R, Parasuraman S. Overviews of biological importance of quercetin: a bioactive flavonoid[J]. Pharmacogn Rev, 2016, 10(20): 84-9.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Nachvak SM, Moradi S, Anjom-Shoae J, et al Soy, soy isoflavones, and protein intake in relation to mortality from all causes, cancers, and cardiovascular diseases: a systematic review and dose-response meta- analysis of prospective cohort studies. J Acad Nutr Diet. 2019;119(9):1483–500.e17. doi: 10.1016/j.jand.2019.04.011. [Nachvak SM, Moradi S, Anjom-Shoae J, et al. Soy, soy isoflavones, and protein intake in relation to mortality from all causes, cancers, and cardiovascular diseases: a systematic review and dose-response meta- analysis of prospective cohort studies[J]. J Acad Nutr Diet, 2019, 119(9): 1483-500. e17.] [DOI] [PubMed] [Google Scholar]
- 19.Rauf A, Imran M, Khan IA, et al Anticancer potential of quercetin: a comprehensive review. http://smartsearch.nstl.gov.cn/paper_detail.html?id=135e061bfcffe4ae53c4f2921ef86511. Phytother Res. 2018;32(11):2109–30. doi: 10.1002/ptr.6155. [Rauf A, Imran M, Khan IA, et al. Anticancer potential of quercetin: a comprehensive review[J]. Phytother Res, 2018, 32(11): 2109-30.] [DOI] [PubMed] [Google Scholar]
- 20.Larson AJ, Symons JD, Jalili T Therapeutic potential of quercetin to decrease blood pressure: review of efficacy and mechanisms. Adv Nutr. 2012;3(1):39–46. doi: 10.3945/an.111.001271. [Larson AJ, Symons JD, Jalili T. Therapeutic potential of quercetin to decrease blood pressure: review of efficacy and mechanisms[J]. Adv Nutr, 2012, 3(1): 39-46.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Ertuğ PU, Aydinoglu F, Goruroglu Ozturk O, et al Comparative study of the quercetin, ascorbic acid, glutathione and superoxide dismutase for nitric oxide protecting effects in mouse gastric fundus. http://www.ncbi.nlm.nih.gov/pubmed/23085029. Eur J Pharmacol. 2013;698(1/2/3):379–87. doi: 10.1016/j.ejphar.2012.10.009. [Ertuğ PU, Aydinoglu F, Goruroglu Ozturk O, et al. Comparative study of the quercetin, ascorbic acid, glutathione and superoxide dismutase for nitric oxide protecting effects in mouse gastric fundus[J]. Eur J Pharmacol, 2013, 698(1/2/3): 379-87.] [DOI] [PubMed] [Google Scholar]
- 22.Mirsafaei L, Reiner Ž, Shafabakhsh R, et al Molecular and biological functions of quercetin as a natural solution for cardiovascular disease prevention and treatment. Plant Foods Hum Nutr. 2020;75(3):307–15. doi: 10.1007/s11130-020-00832-0. [Mirsafaei L, Reiner Ž, Shafabakhsh R, et al. Molecular and biological functions of quercetin as a natural solution for cardiovascular disease prevention and treatment[J]. Plant Foods Hum Nutr, 2020, 75(3): 307-15.] [DOI] [PubMed] [Google Scholar]
- 23.Batiha GE, Beshbishy AM, Ikram M, et al The pharmacological activity, biochemical properties, and pharmacokinetics of the major natural polyphenolic flavonoid: quercetin. Foods. 2020;9(3):E374. doi: 10.3390/foods9030374. [Batiha GE, Beshbishy AM, Ikram M, et al. The pharmacological activity, biochemical properties, and pharmacokinetics of the major natural polyphenolic flavonoid: quercetin[J]. Foods, 2020, 9(3): E374.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.余信强, 张苏川, 蒋伟 氯沙坦对心力衰竭患者外周血内皮祖细胞的影响及对PI3K/Akt/eNOS通路的干预研究. https://www.cnki.com.cn/Article/CJFDTOTAL-GWHH201704008.htm. 世界临床药物. 2017;38(4):242–7. [余信强, 张苏川, 蒋伟. 氯沙坦对心力衰竭患者外周血内皮祖细胞的影响及对PI3K/Akt/eNOS通路的干预研究[J]. 世界临床药物, 2017, 38(4): 242-7.] [Google Scholar]
- 25.Wang PW, Gao S, Xu YL, et al Research progress on intervention of traditional Chinese medicine on coronary heart disease through mTOR signaling pathway. http://www.researchgate.net/publication/332867722_Research_progress_on_intervention_of_traditional_Chinese_medicine_on_coronary_heart_disease_through_mTOR_signaling_pathway. Chin Tradit Herb Drugs. 2018;49(21):5191–6. [Wang PW, Gao S, Xu YL, et al. Research progress on intervention of traditional Chinese medicine on coronary heart disease through mTOR signaling pathway[J]. Chin Tradit Herb Drugs, 2018, 49(21): 5191-6.] [Google Scholar]
- 26.Wingard MC, Frasier CR, Singh M, et al Heart failure and diabetes: role ofATM. Curr Opin Pharmacol. 2020;54:27–35. doi: 10.1016/j.coph.2020.06.007. [Wingard MC, Frasier CR, Singh M, et al. Heart failure and diabetes: role ofATM[J]. Curr Opin Pharmacol, 2020, 54: 27-35.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.王晶晶, 田晨光, 张金盈, 等 千层纸素A改善大鼠慢性心力衰竭的作用及其分子机制. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYD201806020.htm. 中国药科大学学报. 2018;49(6):731–8. [王晶晶, 田晨光, 张金盈, 等. 千层纸素A改善大鼠慢性心力衰竭的作用及其分子机制[J]. 中国药科大学学报, 2018, 49(6): 731-8.] [Google Scholar]
- 28.Wang J, Wu ML, Cao SP, et al Cycloastragenol ameliorates experimental heart damage in rats by promoting myocardial autophagy via inhibition of AKT1-RPS6KB1 signaling. http://www.ncbi.nlm.nih.gov/pubmed/30257319. Biomed Pharmacother. 2018;107(12):1074–81. doi: 10.1016/j.biopha.2018.08.016. [Wang J, Wu ML, Cao SP, et al. Cycloastragenol ameliorates experimental heart damage in rats by promoting myocardial autophagy via inhibition of AKT1-RPS6KB1 signaling[J]. Biomed Pharmacother, 2018, 107(12): 1074-81.] [DOI] [PubMed] [Google Scholar]
- 29.Wetzl V, Tiede SL, Faerber L, et al Plasma MMP2/TIMP4 ratio at follow-up assessment predicts disease progression of idiopathic pulmonary arterial hypertension. http://d.wanfangdata.com.cn/periodical/7995421a4de69b000f419ce05421fc6a. Lung. 2017;195(4):489–96. doi: 10.1007/s00408-017-0014-5. [Wetzl V, Tiede SL, Faerber L, et al. Plasma MMP2/TIMP4 ratio at follow-up assessment predicts disease progression of idiopathic pulmonary arterial hypertension[J]. Lung, 2017, 195(4): 489-96.] [DOI] [PubMed] [Google Scholar]
- 30.Xu S, Wang Y, Yu MY, et al LongShengZhi capsule inhibits doxorubicin-induced heart failure by anti-oxidative stress. http://www.sciencedirect.com/science/article/pii/S0753332219354253. Biomedecine Pharmacother. 2020;123(7):109803. doi: 10.1016/j.biopha.2019.109803. [Xu S, Wang Y, Yu MY, et al. LongShengZhi capsule inhibits doxorubicin-induced heart failure by anti-oxidative stress[J]. Biomedecine Pharmacother, 2020, 123(7): 109803.] [DOI] [PubMed] [Google Scholar]
- 31.Chen L, Yan KP, Liu XC, et al Valsartan regulates TGF-β/Smads and TGF-β/p38 pathways through lncRNA CHRF to improve doxorubicin-induced heart failure. http://www.onacademic.com/detail/journal_1000040117897210_3867.html. Arch Pharm Res. 2018;41(1):101–9. doi: 10.1007/s12272-017-0980-4. [Chen L, Yan KP, Liu XC, et al. Valsartan regulates TGF-β/Smads and TGF-β/p38 pathways through lncRNA CHRF to improve doxorubicin-induced heart failure[J]. Arch Pharm Res, 2018, 41(1): 101-9.] [DOI] [PubMed] [Google Scholar]
- 32.Yao L, Lu P, Li YM, et al Osthole relaxes pulmonary arteries through endothelial phosphatidylinositol 3-kinase/Akt-ENOS-NO signaling pathway in rats. Eur J Pharmacol. 2013;699(1/2/3):23–32. doi: 10.1016/j.ejphar.2012.11.056. [Yao L, Lu P, Li YM, et al. Osthole relaxes pulmonary arteries through endothelial phosphatidylinositol 3-kinase/Akt-ENOS-NO signaling pathway in rats[J]. Eur J Pharmacol, 2013, 699(1/2/3): 23-32.] [DOI] [PubMed] [Google Scholar]
- 33.Ohkita M, Tawa M, Kitada K, et al Pathophysiological roles of endothelin receptors in cardiovascular diseases. http://www.onacademic.com/detail/journal_1000039718225210_bca5.html. J Pharmacol Sci. 2012;119(4):302–13. doi: 10.1254/jphs.12r01cr. [Ohkita M, Tawa M, Kitada K, et al. Pathophysiological roles of endothelin receptors in cardiovascular diseases[J]. J Pharmacol Sci, 2012, 119(4): 302-13.] [DOI] [PubMed] [Google Scholar]


