Abstract
Bei Kindern und Jugendlichen nimmt die „coronavirus disease 2019“ (COVID‑19) meist einen milden Verlauf. Der Anteil asymptomatischer Infektionen ist hoch. Die geschätzte Seroprävalenz betrug in Deutschland vor Beginn der Impfungen in dieser Altersgruppe > 10 %. Es sind einzelne Risikofaktoren für einen schweren Verlauf bekannt. Das COVID‑19-assoziierte „pediatric inflammatory multisystem syndrome“ (PIMS) ist eine sehr seltene, schwere Erkrankung, die bei früher Diagnose und adäquater Therapie eine günstige Prognose hat. Die Datenlage zu Long-COVID in dieser Altersgruppe ist noch unzureichend. Die primäre Quelle von Infektionen bei Kindern und Jugendlichen sind Haushaltskontakte. Übertragungen in Schulen und anderen Betreuungseinrichtungen spielen eine untergeordnete Rolle.
Zur Prävention von COVID‑19 bei Kindern und Jugendlichen sind derzeit in Europa 2 mRNA-Impfstoffe ab dem Alter von 12 Jahren zugelassenen. Bis auf das sehr seltene Auftreten von Peri‑/Myokarditiden in zeitlichem Zusammenhang mit der Impfung, insbesondere bei jungen Männern, sind die COVID‑19-Impfstoffe in der Altersgruppe 12 bis 17 Jahre wirksam und sicher. Die Ständige Impfkommission (STIKO) hat am 19.08.2021 eine Impfempfehlung für alle 12- bis 17-Jährigen ausgesprochen.
Schlüsselwörter: SARS-CoV‑2-Infektion; Myokarditis; „Pediatric multisystem inflammatory disease, COVID‑19 related“; Long-COVID; COVID-19-Impfung
Abstract
The coronavirus disease 2019 (COVID‑19) mostly occurs in children and adolescents as an asymptomatic infection. The course of the disease is usually mild or moderate. The estimated seroprevalence in Germany before the start of the vaccination program in children and adolescents was > 10%. Individual risk factors for a severe course are known. The COVID‑19-associated pediatric inflammatory multisystem syndrome (PIMS) is a very rare and severe disease with a favorable prognosis if diagnosed early and treated appropriately. The data situation on long-COVID syndrome in children and adolescents is still insufficiently defined and the incidence is not known. The primary source of infections in children and adolescents are household contacts. Transmission in school settings and other day care facilities play a subordinate role, at least in Germany.
Two mRNA vaccines are currently approved in Europe for the prevention of COVID‑19 in children and adolescents above the age of 12 years. Except for the very rare occurrence of pericarditis/myocarditis in temporal association with the vaccination, especially in young men, the COVID‑19 vaccines are considered effective and safe in the age group 12–17 years. The Standing Vaccination Commission (STIKO) issued a vaccination recommendation for all 12–17-year-olds on 19 August 2021.
Keywords: SARS-CoV‑2 infection; Myocarditis; Pediatric multisystem inflammatory disease, COVID‑19 related; Long-COVID; COVID-19-Vaccination
Die Geschäftsstelle der Ständigen Impfkommission (STIKO) beim Robert Koch-Institut (RKI) und die STIKO haben zum Thema „Epidemiologie von COVID‑19 bei Kindern und Jugendlichen und Entwicklung der STIKO-Impfempfehlung“ eine ausführliche wissenschaftliche Begründung [1] unter Federführung von J. Koch und S. Vygen-Bonnet veröffentlicht. Dieser Leitthemenbeitrag fasst wesentliche Inhalte und Argumente dieser Publikation zusammen und erläutert die aktuelle „Coronavirus-disease-2019“(COVID‑19)-Epidemiologie und die allgemeine Impfempfehlung für Kinder und Jugendliche.
SARS-CoV‑2 und COVID‑19
Steckbrief zum Virus und zur Erkrankung
Im Dezember 2019 wurde in Wuhan, China, erstmals über die Häufung von Pneumonien unklarer Genese berichtet [2]. Am 07.01.2020 konnte das verantwortliche Virus, ein neues β‑Coronavirus, das als „severe acute respiratory syndrome coronavirus type 2“ (SARS-CoV‑2) bezeichnet wird, aus dem Rachenabstrich eines Patienten isoliert werden [3]. Am 11.03.2020 erklärte die WHO COVID‑19, die durch das SARS-CoV‑2 ausgelöste Erkrankung, zur Pandemie. Zu diesem Zeitpunkt hatte sich SARS-CoV‑2 bereits auf 114 Länder ausgebreitet, mit über 118.000 bestätigten COVID‑19- und mehr als 4291 Todesfällen [4]. Seit Dezember 2019 sind weltweit mehr als 209 Mio. Menschen (Stand 17.08.2021) an COVID‑19 erkrankt (https://covid19.who.int/).
Das neue SARS-CoV‑2 gehört zur Subfamilie der Orthocoronavirinae [5]. Es handelt sich um ein einsträngiges RNA-Virus. Das helikale Nukleokapsid wird von einer Lipidmembran umhüllt, in der die Strukturproteine E, S und M eingelagert sind. Von besonderer Bedeutung ist das S‑Protein, das wegen seiner Struktur als „Spike“-Protein („Zacken“) bezeichnet wird. Das Spike-Protein ist für die Bindung an Angiotensinkonversionsenzymhemmer(ACE)-2-Rezeptoren der Wirtszellen und den Viruseintritt in die Zielzellen verantwortlich. Das Spike-Protein stellt eine relevante Zielstruktur für die Entwicklung von Impfstoffen dar.
Das klinische Spektrum einer SARS-CoV‑2-Infektionen reicht von asymptomatischen Verläufen über milde oder moderate respiratorische Erkrankungen (COVID‑19) bis zum schweren Lungenversagen. Charakteristische Symptome von COVID‑19 sind Fieber, Schnupfen, trockener anhaltender Husten, Atemnot, Müdigkeit sowie eine Störung des Geruchs- und/oder Geschmackssinns. Weitere Symptome wie Kopf- und Muskelschmerzen, Gewichtsverlust, Übelkeit, Erbrechen, Bauchschmerzen, Diarrhö, Thromboembolien oder ein akutes Koronarsyndrom können auftreten [6].
Patienten haben nach überstandener Infektion spezifische IgM- und IgG-Antikörper, insbesondere gegen das nukleäre (N-)Protein und das Spike-Protein [7]. Es ist nicht abschließend geklärt, welche Antikörperspezifität ein Korrelat für die Protektion gegenüber SARS-CoV‑2 darstellt. Ergebnisse aus der Impfstoffforschung weisen darauf hin, dass virusneutralisierende Antikörper gegen das Spike-Protein und auch eine virusspezifische Antwort der T‑Helferzellen vom TH1-Typ für den Infektionsschutz von Bedeutung sind.
Besonderheiten bei Kindern und Jugendlichen
Infektion und Erkrankung
Die Übertragung von SARS-CoV‑2 erfolgt hauptsächlich über Tröpfchen oder Aerosole, die beim Atmen, beim Sprechen, beim Niesen oder beim Husten entstehen. Kinder und Jugendliche können sich wie Erwachsene mit dem Virus infizieren und nehmen grundsätzlich gleichermaßen am allgemeinen Infektionsgeschehen teil. Nach einer Inkubationszeit von 4 bis 5 Tagen, selten bis zu 14 Tagen, kann sich die Erkrankung zunächst als Infektion der oberen Atemwege manifestieren. Im Unterschied zu Erwachsenen zeigen Kinder und Jugendliche meist einen asymptomatischen oder milden bis moderaten Infektionsverlauf. Liguoro et al. [8] haben in einem systematischen Review den klinischen Verlauf von 7480 an COVID-19 erkrankten Kindern mit einem Durchschnittsalter von 7,6 Jahre ausgewertet. Die Patienten zeigten überwiegend leichte (42,5 %) und moderate (39,6 %) Infektionsverläufe mit meist unauffälligen Laborbefunden. Nur 2 % der Kinder mussten intensivmedizinisch behandelt werden. Die häufigsten dokumentierten Symptome waren Fieber (51,6 %) und Husten (47,3 %). In 73,9 % der Fälle wurde eine Thorax-CT-Untersuchung durchgeführt, davon ergab sich bei 32,7 % der Patienten ein Normalbefund. In der Studie wurde die Mortalität auf 0,08 % geschätzt. Neugeborene waren mit einem Anteil von 12 % häufiger schwerer erkrankt, und in dieser Altersgruppe war Dyspnoe das führende klinische Symptom (40 %). Die Autoren kommen zu der Schlussfolgerung, dass SARS-CoV‑2 Kinder weniger stark betrifft als Erwachsene, und dass Labor- und Röntgenbefunde überwiegend unspezifisch bleiben.
Die Beobachtung wird durch einen Review von Viner et al. [9] zur Prävalenz klinischer Symptome von COVID‑19 bei unter 20-Jährigen bestätigt. Auf Basis von 18 Studien aus China, Italien, Spanien, Südkorea, Malaysia, Singapur, Vietnam, dem Iran und den USA wurde der klinische Verlauf von > 34.000 Kindern und Jugendlichen mit laborbestätigter SARS-CoV‑2-Infektion analysiert. Der Anteil von Kindern und Jugendlichen mit symptomatisch verlaufenden SARS-CoV-2-Infektionen betrug in den Studien 14,6–42 %. Fieber und Husten waren die häufigsten Symptome, mit 46–64,2 % Fieber und 32–55,9 % Husten. Kopfschmerzen, Abgeschlagenheit, Muskelschmerzen und gastrointestinale Symptome traten infrequent bei weniger als 10–20 % der Erkrankten auf.
Eine von Molteni et al. [10] publizierte prospektive Kohortenstudie aus dem Vereinigten Königreich untersuchte den Verlauf von COVID‑19 bei 5‑ bis 17-jährigen Kindern und Jugendlichen. Aus einer Gruppe von 75.529 Kindern und Jugendlichen mit einem positiven SARS-CoV‑2-Nachweis im Zeitraum vom 24.03.2020 bis zum 22.02.2021 konnten bei 1734 Studienteilnehmenden Verlauf und Dauer der Erkrankung ausgewertet werden. Die häufigsten Symptome waren Kopfschmerzen (62,2 %) und Müdigkeit (55,0 %). Die mediane Krankheitsdauer war bei älteren Kindern länger (7 Tage, „interquartile range“ [IQR] 3 bis 12 Tage) als bei jüngeren Kindern (5 Tage, IQR 2 bis 9 Tage). Bei 4,4 % der Kinder persistierten Symptome über 28 Tage, ebenfalls häufiger bei älteren Kindern. Die häufigsten in dieser Gruppe beklagten Symptome waren Müdigkeit (84 %), Kopfschmerzen (78 %) und Anosmie (78 %). Nahezu alle Kinder waren nach 8 Wochen beschwerdefrei; lediglich 1,8 % beklagten zu diesem Zeitpunkt noch Symptome. Die Ergebnisse der Untersuchung von Kindern und Jugendlichen belegen, dass COVID‑19 bei Kindern und Jugendlichen meist mit kurzer Dauer und geringer Symptombelastung verläuft. Wenige Kinder haben einen prolongierten Krankheitsverlauf, die meisten sind jedoch nach 4 Wochen vollständig genesen.
Bei Kindern und Jugendlichen verläuft COVID‑19 meist mit kurzer Dauer und geringer Symptombelastung
Angesichts der Diskussion um das Auftreten von Myokarditiden nach mRNA-Impfungen (s. Abschn. „Peri- oder Myokarditis nach COVID‑19-Impfung“) ist von besonderem Interesse, in welchem Umfang SARS-CoV‑2-Infektionen mit einer kardialen Manifestation einhergehen. Ein im Juli 2021 veröffentlichter Review [11] fasst 14 Publikationen, die kardiale Ereignisse bei 515 jugendlichen COVID‑19 Patienten dokumentieren, zusammen. Die Inzidenz kardiovaskulärer Komplikationen bei COVID‑19 variiert zwischen Patientenkollektiven und kann mit Myokardischämie, Arrhythmie, Herzinsuffizienz, Myokarditis meist im Rahmen eines Multisystementzündungssyndroms bei Kindern einhergehen.
Eine Studie aus den USA, die retrospektiv Versichertendaten analysierte, ermittelte 9 Myokarditiden unter 14.207 COVID‑19-Fällen bei 12- bis 17-Jährigen [12]. Das Risiko war bei männlichen Individuen doppelt so hoch wie bei weiblichen. Unter Berücksichtigung der Dunkelziffer für SARS-CoV‑2-Infektionen und Myokarditiden wurde die Inzidenz bei 12- bis 17-Jährigen auf 32,8 Myokarditiden/100.000 SARS-CoV‑2-Infektionen) geschätzt; bei Jungen auf 45,0/100.000 und bei Mädchen auf 21,3/100.000). Es traten 40 % der beobachteten Myokarditiden innerhalb von 5 Tagen nach der COVID‑19-Diagnose auf. Todesfälle aufgrund von Myokarditis wurden nicht berichtet.
Immunantwort
Wie vorangehend erwähnt, entwickeln Patienten nach einer SARS-CoV‑2-Infektion eine B- und T‑Zell-Immunantwort, die sowohl SARS-CoV‑2-spezifische neutralisierende Antikörper als auch Helfer‑, Effektor- und Gedächtnis-T-Zellen umfasst. Die virusspezifische Immunantwort ist insbesondere gegen das Spike- und Nukleokapsidprotein des Virus gerichtet [13]. Nach den bislang publizierten Untersuchungen [14, 15] ist zu erwarten, dass die spezifische schützende Immunantwort für mindestens 6 bis 10 Monate persistiert.
In einer prospektiven multizentrischen Beobachtungsstudie [16] wurde in 328 Haushalten mit 548 Kindern und 717 Erwachsenen, in denen mindestens ein Fall einer laborbestätigten SARS-CoV‑2-Infektion aufgetreten war, die humorale SARS-CoV‑2-Immunantwort nach 3 bis 4 Monaten sowie 11 bis 12 Monaten überprüft. Insgesamt waren 33,76 % der SARS-CoV‑2-exponierten Kinder und 57,88 % der Erwachsenen seropositiv. Bei Kindern war die Wahrscheinlichkeit einer Serokonversion ohne Symptome 5‑mal höher als bei Erwachsenen. Trotz des häufig asymptomatischen Infektionsverlaufs wiesen Kinder höhere spezifische Antikörperspiegel auf, und ihre Antikörper persistierten länger als bei Erwachsenen (96,22 % vs. 82,89 % waren noch 11 bis 12 Monate nach der Infektion seropositiv). Symptomatische und asymptomatische Infektionen induzierten in allen Altersgruppen vergleichbare humorale Immunantworten. Die Studie weist darauf hin, dass Kinder auch nach asymptomatischer Infektion eine SARS-CoV‑2-spezifische humorale Immunantwort entwickeln, die über viele Monate persistiert.
Transmission
Ein umfassende Übersichtarbeit und Metaanalyse zur Empfänglichkeit für und Transmission von SARS-CoV‑2 unter Kindern und Jugendlichen im Vergleich zu Erwachsenen haben Viner et al. publiziert [17]. Insgesamt wurden 32 Studien, einschließlich 18 Kontaktverfolgungsstudien und 14 Populationsscreeningstudien, mit insgesamt 41.640 Kindern und Jugendlichen sowie 268.945 Erwachsenen in die Analyse aufgenommen. Das relative Risiko („odds ratio“, OR), eine Infektion nach einem Kontakt zu entwickeln, betrug bei Kindern im Vergleich zu Erwachsenen 0,56 (95 %-Konfidenzintervall [95 %-KI] 0,37–0,85). Drei schulbasierte Kontaktverfolgungsstudien zeigten eine minimale Übertragung durch Indexfälle von Kindern oder Lehrern. Die meisten Studien belegen eine geringere Seroprävalenz bei Kindern im Vergleich zu Erwachsenen, wobei die Seroprävalenz von Jugendlichen ähnlich der von Erwachsenen war. Aus Sicht der Autoren zeigen die verfügbaren Studien, dass Kinder und Jugendliche eine untergeordnete Rolle bei der Ausbreitung von SARS-CoV‑2 spielen.
Diese Einschätzung wird durch eine Seroprävalenzstudie aus Sachsen [18] gestützt, in die 150 Haushalte eingeschlossen waren. Die Studie ist Teil der FamilyCoviDD19-Studie (ID im Deutschen Register Klinischer Studien: DRKS00022564). Bei 414 (88 %) von 470 Haushaltsmitgliedern wurde der Serostatus erhoben, der bei 211 der 414 Individuen positiv war. Die ermittelte Seropositivitätsrate von erwachsenen Indexfällen unterschied sich nicht von der von Kindern und Jugendlichen (98/125 [78 %] vs. 9/12 [69 %]). Die sekundäre Infektionsrate der 17 Indexfälle < 18 Jahre (41 Kontakte/6 seropositiv) war signifikant niedriger als die von 126 erwachsenen Indexfällen (207 Kontakte/79 seropositiv). In dieser Studie wurden keine Übertragungen von Indexpersonen im Alter < 18 Jahren auf andere Kinder und Jugendliche beobachtet, aber 26 Transmissionen von erwachsenen Indexfällen auf Haushaltskontakte im Alter unter 18 Jahren.
Eine Studie aus Rheinland-Pfalz [19] untersuchte das Übertragungsrisiko von COVID‑19 in Kitas und Schulen im Zeitraum zwischen August und Dezember 2020. Das Übertragungsrisiko in den untersuchten Bildungseinrichtungen war niedrig, und die sekundäre Erkrankungsrate betrug lediglich 1,3 %. Die Übertragung ging häufiger vom Lehrpersonal als von Schülern/Kindern aus (Inzidenzrisikoverhältnis [IRR] 3,17). In 748 Indexfällen verursachten Lehrer 4‑mal mehr sekundäre Fälle als Kinder (1,08 vs. 0,25 sekundäre Fälle/Index, IRR 4,39). Indexfälle in Kindertagesstätten (IRR 3,23) führten insgesamt häufiger zu Übertragungen als Indexfälle in Sekundarschulen. Die Autoren schließen aus den Ergebnissen, dass das Ansteckungsrisiko bei Kontakten zu einem bestätigten COVID‑19-Fall in Bildungseinrichtungen, insbesondere wenn die Hygieneregeln strikt eingehalten werden, niedrig ist und 1 % beträgt.
Risikofaktoren für einen schweren Verlauf
Götzinger et al. [20] haben in einer Kohortenstudie erste Erkenntnisse zu Risikofaktoren für schwere COVID‑19-Verläufe bei Kindern und Jugendlichen für Europa vorgelegt. An der multizentrischen Kohortenstudie nahmen 82 Kliniken in 25 europäischen Ländern teil. Insgesamt wurden 582 Patienten mit „Polymerase-chain-reaction“(PCR)-bestätigter SARS-CoV‑2-Infektion (medianes Alter 5,0 Jahre, IQR 0,5 bis 12,0 Jahre) im Monat April 2020 in die Studie aufgenommen. Es hatten 145 (25 %) der COVID‑19-Patienten Vorerkrankungen: 29 eine chronische Lungenerkrankung, 27 eine Tumorerkrankung, 26 eine neurologische Erkrankung, 25 ein Vitium cordis, 10 eine chromosomale Anomalie und 9 eine chronische Nierenerkrankung. Insgesamt 363 Patienten (62 %) mussten stationär behandelt werden, 48 Personen (8 %) benötigten eine intensivmedizinische Betreuung. Signifikante Risikofaktoren für die Aufnahme auf die Intensivstation waren Alter unter einem Monat (OR 5,06, 95 %-KI 1,72–14,87; p = 0,0035), männliches Geschlecht (OR 2,12, 95 %-KI 1,06–4,21; p = 0,033), Vorerkrankungen (OR 3,27, 95 %-KI 1,67–6,42; p = 0,0015) und Anzeichen einer Infektion der unteren Atemwege bei Erstvorstellung (OR 10,46, 95 %-KI 5,16–21,23; p < 0,0001). Die Studie zeigt, dass die Mehrzahl der SARS-CoV‑2-Infektionen im Kindes- und Jugendalter unkompliziert oder asymptomatisch verläuft. Nur wenige Patienten mit Risikofaktoren entwickeln schwerwiegende Verläufe, die selten eine intensivmedizinische Versorgung erforderlich machen.
Eine unizentrische retrospektive Kohortenstudie [21] aus Colorado, USA, untersuchte Risikofaktoren für schwere COVID‑19-Verläufe bei Kindern im Zeitraum März bis Juli 2020. Die multivariable Auswertung von 454 PatientInnen im Alter unter 21 Jahren (medianes Alter: 11 Jahre) identifizierte ein Alter von 0 bis 3 Monaten (OR 7,9; 95 %-KI 3,0–20,4) und junges Erwachsenenalter > 20 Jahre (OR 5,1; 95 %-KI 1,2–20,7) sowie das Vorliegen von Asthma bronchiale (OR 2,2; 95 %-KI 1,4–4,5), chronischen gastrointestinalen Erkrankungen (OR 2,7; 95 %-KI 1,3–5,2), Diabetes mellitus (OR 6,6; 95 %-KI 1,1–39,8), Immunsuppression (OR 3,5; 95 %-KI 1,5–8,1), Adipositas (> 95 %-Perzentile; OR 2,5; 95 %-KI 1,2–5,1), schwerer Adipositas (> 120 %-Perzentile; OR 4,8; 95 %-KI 1,9–12,1) und Frühgeburtlichkeit (OR 3,8; 95 %-KI 2,0–7,4) als relevante Risikofaktoren. Weitere retrospektive Kohortenstudien [22, 23] bestätigen wie für das Erwachsenenalter ein erhöhtes Risiko für einen schweren COVID‑19-Verlauf bei Patienten mit Trisomie 21.
Die Sterblichkeit von COVID‑19 bei Kindern und Jugendlichen wird seit Beginn der Pandemie von einer englischen Forschergruppe [24] in 7 Ländern (USA, UK, Italien, Deutschland, Spanien, Frankreich und Südkorea) kontinuierlich erfasst und ausgewertet. Bis Februar 2021 lag die Mortalität von Covid‑19 bei 0–19-Jährigen bei 0,17/100.000, was 0,48 % der geschätzten jährlichen Gesamtsterblichkeit in dieser Altersgruppe entspricht. Todesfälle durch COVID‑19 sind relativ häufiger bei älteren Kinder und Jugendlichen. Die Autoren haben im Zeitverlauf bisher keine Zunahme der Mortalität und des Schweregrads der Erkrankungen festgestellt.
In Deutschland werden Risikofaktoren für schwere COVID‑19-Verläufe im Rahmen des COVID‑19-Survey [25] durch die Deutsche Gesellschaft für Pädiatrische Infektiologie (DGPI) erfasst. Ein signifikant erhöhtes relatives Risiko (RR) für eine intensivmedizinische Behandlung hatten PatientInnen mit Trisomie 21 (RR: 4,2; 95%-KI: 1,4–12,6), Menschen, die zu der SARS-CoV‑2-Infektion eine weitere Koinfektion aufwiesen (RR: 4,2; 95%-KI: 2,0–8,5) sowie PatientInnen mit primärem Immundefekt (RR: 2,7; 95%-KI: 1,2–6,2). In der bivariaten Analyse fielen Fettleber (RR: 8,0; 95%-KI: 4,1–15,6), pulmonale Hypertonie (RR: 7,8; 95%-KI: 4,2–14,4), Zustand nach Herzoperation (RR: 7,8; 95%-KI: 4,2–14,4), zyanotische Herzerkrankungen (RR: 6,2; 95%-KI: 2,9–13,2), psychomotorische Retardierungen (RR: 4,8; 95%-KI: 2,9–7,9) und Epilepsie (RR: 2,3; 95%-KI: 1,1–4,9) als weitere Risikofaktoren auf.
Risikofaktoren für schwere Verläufe entsprechen bei Kindern und Jugendlichen im Wesentlichen denen Erwachsener
In der Gesamtschau entsprechen die bisher bei Kindern und Jugendlichen identifizierten Risikofaktoren für schwere COVID‑19-Verläufe denen im Erwachsenenalter.
Pediatric Inflammatory Multisystem Syndrome
Das Pediatric Inflammatory Multisystem Syndrome (PIMS) ist eine systemische Inflammationserkrankung, die Kinder und Jugendliche betrifft. In der amerikanischen Fachliteratur wird der Begriff „multisystem inflammatory syndrome-COVID-19“ (MIS‑C) synonym verwendet. Die Ätiologie von PIMS ist bislang unklar; die Erkrankung steht im Verdacht, als Spätfolge einer SARS-CoV‑2-Infektion bei Kindern und Jugendlichen aufzutreten. Die Beschwerden manifestieren sich meist 3 bis 4 Wochen nach einer symptomatischen oder asymptomatischen SARS-CoV‑2-Infektion [26]. Entsprechend der Falldefinition im PIMS-Survey der DGPI [27] wird PIMS als ein systemisches Inflammationsereignis beschrieben, bei dem neben Fieber und erhöhten Inflammationsparametern (C-reaktives Protein, Prokalzitonin) mindestens 2 Organbeteiligungen vorliegen und eine aktuelle oder durchgemachte SARS-CoV‑2-Infektion bzw. ein SARS-CoV‑2-Kontakt nachgewiesen wurde. Alternative infektiologische Ursachen müssen ausgeschlossen sein.
Klinisch ähnelt das PIMS dem Kawasaki-Syndrom (KS) und dem toxischen Schocksyndrom (TSS). Allerdings ist das Inflammationsgeschehen beim PIMS in der Mehrzahl der Fälle ausgeprägter als bei KS und TSS, die PatientInnen sind meist älter, und Schock, Erbrechen, Durchfall und Bauchschmerzen sind häufiger. Das Krankheitsbild ist in den meisten Fällen gut behandelbar, neben einer supportiven Therapie werden Immunglobuline und immunmodulatorische Medikamente eingesetzt [28].
Ahmed et al. [29] haben in einem Review, der 39 Studien mit 662 Patienten mit PIMS umfasste, epidemiologische und klinische Charakteristika des Krankheitsbildes beschrieben. Das mittlere Alter der Patienten betrug 9,3 ± 0,5 Jahre; es waren 52,3 % der Kinder und Jugendlichen männlich. Bei 50 % der Patienten lagen Vorerkrankungen oder eine Adipositas vor. Fieber (100 %), Bauchschmerzen/Diarrhö (74 %), Erbrechen (68 %), Konjunktivitiden (52 %) und Exantheme (56 %) waren die häufigsten Symptome. Von den erkrankten Kindern mussten 470 (71 %) intensivmedizinisch versorgt werden, 22 % benötigten eine Beatmungstherapie und 4,4 % eine extrakorporale Membranoxygenierung. Bei 54 % der Patienten wurde ein pathologischer Echokardiographiebefund erhoben, meist mit eingeschränkter linksventrikulärer Funktion; auch Koronaraneurysmen wurden berichtet. Eine akute Nierenbeteiligung trat in 16 % der Fälle auf. Labordiagnostisch waren erhöhte Konzentrationen der Entzündungs- und kardialen Marker auffällig. Die durchschnittliche Verweildauer im Krankenhaus betrug 7,9 ± 0,6 Tage. Im untersuchten Kollektiv wurden 11 Todesfälle (1,7 %) gemeldet.
In Deutschland wurden im Rahmen einer Erhebung der DGPI 412 Fälle von PIMS seit Beginn der Pandemie bis 22.08.2021 erfasst. Häufigste Organbeteiligungen waren Herz und Kreislauf (76 %), Gastrointestinaltrakt (75 %), Haut (73 %) und Schleimhaut (69 %). Es waren 42 % der PIMS-Betroffenen jünger als 7 Jahre, 30 % gehörten der Altersgruppe 7 bis 10 Jahre an, und 28 % hatten ein Alter von 11 bis 21 Jahren. Die PIMS-Fälle treten etwas häufiger (64 %) als COVID‑19-Fälle (52 %) bei männlichen Individuen auf. Vorerkrankungen werden bei Kindern mit PIMS seltener als bei COVID‑19-Fällen (17 % vs. 29 %) gefunden. Etwas mehr als die Hälfte (53 %) der bei der DGPI registrierten 392 PIMS-Fälle wurde intensivmedizinisch behandelt. Der Verlauf der Erkrankung war insgesamt günstig; anhaltende Beschwerden wurden nur in 5,8 % der Fälle bei Entlassung berichtet. Tödliche Verläufe sind bisher in Deutschland nicht gemeldet (Stand 18.07.2021).
Berichte von PIMS nach COVID‑19-Impfung liegen bisher nicht vor. Es liegen lediglich Einzelfallberichte über ein dem PIMS vergleichbares „multisystem inflammatory syndrome“ bei Erwachsenen nach COVID‑19-Impfung vor [30, 31].
Long-COVID-Syndrom
Das Post-COVID‑19-Syndrom oder Long-COVID-Syndrom nach einer SARS-CoV‑2-Infektion ist als Multisystemerkrankung unklarer Genese bei Erwachsenen gut dokumentiert [32]. Definitionsgemäß können die Beschwerden nicht durch eine alternative Diagnose erklärt werden. Sie treten entweder schon während der akuten COVID-19-Erkrankung auf und dauern länger als 12 Wochen an oder manifestieren sich im Verlauf von Wochen nach der Infektion. Die klinischen Zeichens des Long-COVID-Syndroms sind sehr variabel. Es werden Erschöpfungszustände, Atembeschwerden, Geruchs- und Geschmacksstörungen, Konzentrations- und Schlafstörungen, Kopfschmerzen, depressive Verstimmung und Herzrhythmusstörungen berichtet. Eine akzeptierte einheitliche Definition von Long-COVID gibt es bislang nicht. Auch wurde bisher keine Korrelation zwischen der Schwere der Erkrankung bei Primärinfektion und dem postakuten Long-COVID-Syndrom identifiziert.
Symptome des Long-COVID-Syndroms werden auch bei Kindern und Jugendlichen berichtet. Erste Publikationen beschreiben das Auftreten von Long-COVID-Symptomen bei Kindern mit bestätigter SARS-CoV‑2-Infektion, ohne jedoch klinische Auffälligkeiten mit einer nicht an COVID‑19 erkrankten Kontrollgruppe zu vergleichen [33]. Solche Studien erlauben es nicht zwischen der direkten Krankheitslast durch die Infektion und psychosomatischen Manifestationen, die infolge der generellen pandemischen Belastungssituation aufgetreten sind, zu unterscheiden. Aussagekräftiger sind Studien, die die Häufigkeit von dem Long-COVID-Syndrom zugeschriebenen Symptomen bei Kindern und Jugendlichen mit und ohne SARS-CoV‑2-Infektion vergleichen. Aufgrund der insgesamt niedrigen Zahl der an den Studien teilnehmenden Kinder und Jugendlichen sowie der hohen Hintergrundaktivität der pandemiebedingten psychosomatischen Beschwerden lässt sich Long-COVID allerdings auch mit diesem Ansatz bei Kindern bisher nicht zuverlässig beurteilen.
In einer Längsschnittstudie [34] an 14 ostsächsischen Gymnasien wurden seit Mai 2020 Schülerinnen und Schüler der Klassenstufen 8–12 in die SchoolCOVID19-Studie eingeschrieben. Bei allen Teilnehmern wurde die SARS-CoV‑2-Seroprävalenz durch serielle Antikörpertestung ermittelt. Im März/April 2021 wurden alle Teilnehmer gebeten, einen Long-COVID19-Fragebogen zum Auftreten und zur Häufigkeit von Konzentrationsschwierigkeiten, Gedächtnisverlust, Antriebslosigkeit, Kopfschmerzen, Bauchschmerzen, Myalgie/Arthralgie, Müdigkeit, Schlaflosigkeit und Stimmungsschwankungen (Traurigkeit, Wut, Freude und Anspannung) auszufüllen. An der Studie nahmen 1560 Schüler (Durchschnittsalter 15 Jahre) teil, 1365 (88 %) waren seronegativ, 188 (12 %) seropositiv. Jedes der abgefragten Symptome wurde von mindestens 35 % der Schüler innerhalb der letzten 7 Tage vor der Befragung berichtet. Es gab keinen statistischen Unterschied zwischen seropositiven und seronegativen Schülern. Auch hatte das Wissen, ob eine SARS-CoV‑2-Infektion vorlag, keinen Einfluss auf die Prävalenz der Beschwerden.
In der Schweizer „Ciao Corona-Study“ wurden im Kanton Zürich seit Juni 2020 2500 Kinder und Jugendliche aus 55 Schulen fortlaufend untersucht [35]. In 3 Testphasen (Juni 2020, Oktober 2020 und März 2021) wurden die SARS-CoV‑2-Seroprävalenz erhoben und eine Onlinebefragung zu andauernden Beschwerden durchgeführt. Die Befunde der Kinder und Jugendlichen, die im Herbst 2020 SARS-CoV‑2-positiv getestet worden waren, wurden mit denen der Seronegativen verglichen. Im März bis Mai 2021 wurden Symptome, die seit Oktober 2020 aufgetreten waren und ≥ 4 Wochen oder > 12 Wochen persistierten, reevaluiert. In der Auswertung wurden 1355/2503 Teilnehmer berücksichtigt, für die ein serologisches Testergebnis aus dem Herbst 2020 vorlag. Von den seropositiven und seronegativen 6‑ bis 16-Jährigen berichteten 9 % gegenüber 10 % über mindestens ein Symptom, das über 4 Wochen anhielt, und 4 % gegenüber 2 % über mindestens ein Symptom, das über 12 Wochen dauerte. Keines der seropositiven Kinder musste nach Oktober 2020 stationär behandelt werden. In der Studie war die Prävalenz von Long-COVID sehr niedrig; das Beschwerdebild trat bei seropositiven Kindern nicht häufiger auf als bei seronegativen Kontrollen.
Epidemiologie
Seit Dezember 2019 sind weltweit mehr als 217 Mio. Menschen (Stand 31.08.2021) an COVID‑19 erkrankt. In Deutschland werden Daten zur SARS-CoV‑2-Infektionen und COVID‑19-Epidemiologie nach dem Infektionsschutzgesetz (IfSG) erhoben und an das RKI gemeldet. Das Institut informiert in täglichen und wöchentlichen Lageberichten über das aktuelle Infektionsgeschehen in Deutschland [36]. Als COVID‑19-Fälle werden in der Auswertung des RKI alle positiven PCR-Nachweise von SARS-CoV‑2, unabhängig vom Vorhandensein einer klinischen Symptomatik, gewertet. Die Erkenntnisse des RKI zur Epidemiologie von SARS-CoV‑1 fließen in die Beratungen der STIKO ein. In der wissenschaftlichen Begründung zur allgemeinen COVID‑19-Impfempfehlung für Kinder und Jugendliche [1] sind die für diese Altersgruppe relevanten aktuellen epidemiologischen Daten dargestellt und werden im Folgenden auszugsweise zitiert.
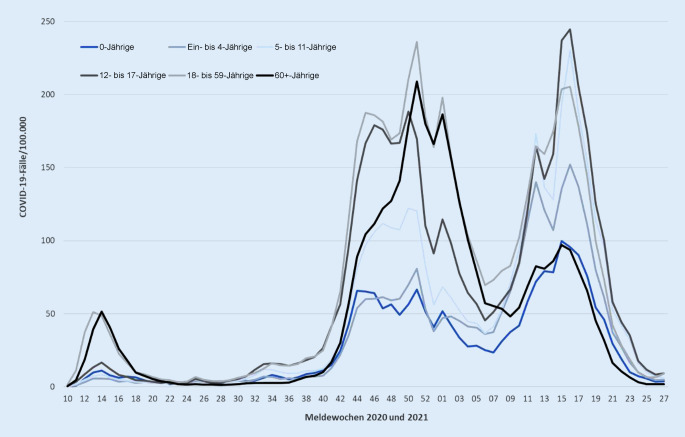
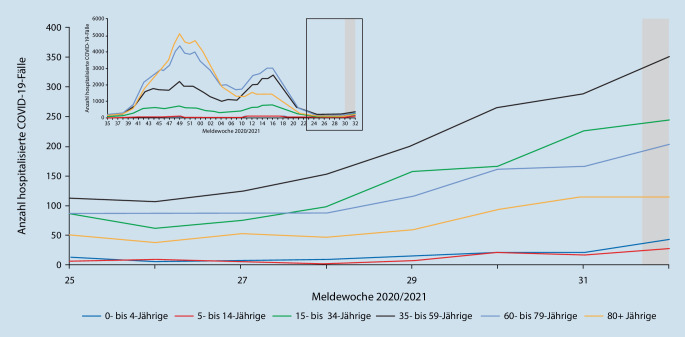
Den Verlauf der gemeldeten SARS-CoV‑2-Infektionen (gekennzeichnet als COVID‑19-Fälle) während der Pandemie seit März 2020 bis Anfang Juli 2021 zeigt Abb. 1. Es ist deutlich zu erkennen, dass das Infektionsgeschehen bei Kindern und Jugendlichen grundsätzlich dem Verlauf der Infektionsinzidenz der Erwachsenen folgt. Allerdings liegen die Infektionszahlen von Kindern und Jugendlichen insbesondere im frühen Verlauf der Pandemie deutlich unter denen der 18- bis 59-jährigen Erwachsenen. Bei 12- bis 17-Jährigen (Abb. 1dunkelgraue Kurve) fällt in der 2. und 3. Pandemiewelle eine Zunahme der Inzidenzwerte von SARS-CoV‑2-Infektionen im Vergleich zu jüngeren Kindern auf. Es bleibt unklar, ob die Zunahme der erfassten Infektionen tatsächlich durch eine echte Zunahme von Infektionen oder lediglich eine intensivierte Erfassung verursacht wurde. Mehrere Bundesländer haben ab März 2021 routinemäßig die anlasslose SARS-CoV‑2-Antigentestung in Schulen eingeführt und dadurch viele, zuvor unerkannte, asymptomatische SARS-CoV‑2-Infektionen detektiert. Interessant ist in diesem Zusammenhang, dass die Steigerung der positiven Virusnachweise bei Kindern und Jugendlichen im zeitlichen Verlauf bisher nicht zu einer relevanten Zunahme von Hospitalisierungen in dieser Altersgruppe geführt hat, wie Abb. 2 aus dem täglichen Lagebricht des RKI vom 19.08.2021 illustriert.
Gesteigerte Virusnachweise haben nicht zu relevanter Hospitalisierungszunahme von Kindern geführt
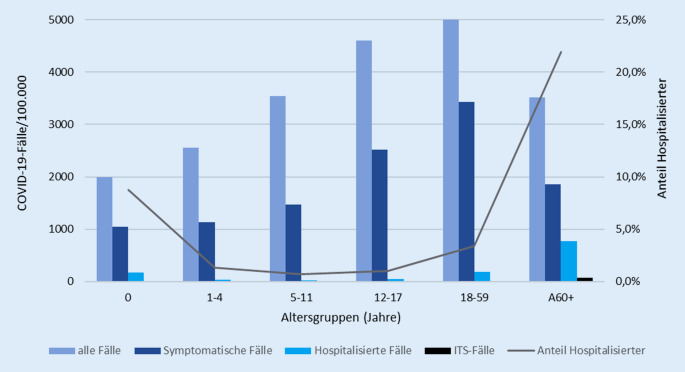
Die der wissenschaftlichen Begründung der Impfempfehlung für Kinder und Jugendliche entnommene Tab. 1 [1] illustriert, dass die Inzidenz von COVID‑19, einschließlich asymptomatischen SARS-CoV‑2-Infektionen, mit steigendem Alter zunimmt. In der Gruppe der < Einjährigen beträgt die Inzidenz knapp 1994/100.000, während mit 5300/100.000 bei den 18- bis 59-Jährigen der bisher höchste Wert erfasst wurde [1]. Die vergleichsweise niedrigere Inzidenz von 3512/100.000 bei den ≥ 60-Jährigen ist v. a. auf das erfolgreiche Impfprogramm zurückzuführen. Der Anteil von SARS-CoV‑2-Infektionen/COVID‑19-Fällen im Kindes- und Jugendalter beträgt 13,1 % aller gemeldeten Fälle, der Anteil der 12- bis 17-Jährigen 5,5 %. Innerhalb der Altersgruppe bis 18 Jahre entsprechen die Fälle bei 12- bis 17-Jährigen einem Anteil von 42,5 %. In dieser Altersgruppe wurde in der 3. Welle, insbesondere nach Einführung des anlasslosen Testens in Schulen, mit 4608 Fällen/100.000 die zweithöchste Inzidenz über alle Altersgruppen ermittelt. Bis zum Alter von 11 Jahren erkranken Jungen häufiger an COVID‑19; in den Altersgruppen darüber sind Mädchen/Frauen etwas häufiger betroffen.
| Geschlecht | Altersgruppe (Jahre) | Gesamt | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| < 1 | 1–4 | 5–11 | 12–17 | 18–59 | ≥ 60 | |||||||||
| n | n/100.000 | n | n/100.000 | n | n/100.000 | n | n/100.000 | n | n/100.000 | n | n/100.000 | n | n/100.000 | |
| Männlich | 7996 | 2011 | 41.788 | 2557 | 95.968 | 3584 | 104.777 | 4514 | 1.183.190 | 5078 | 368.399 | 3441 | 1.802.192 | 4391 |
| Weiblich | 7269 | 1927 | 38.938 | 2508 | 87.142 | 3440 | 101.384 | 4641 | 1.215.297 | 5413 | 462.777 | 3551 | 1.912.862 | 4540 |
| Gesamt | 15.265 | 1994 | 80.726 | 2560 | 183.110 | 3547 | 206.161 | 4608 | 2.398.487 | 5270 | 831.176 | 3512 | 3.715.054 | 4490 |
SARS-CoV‑2 „severe acute respiratory syndrome coronavirus type 2“
Den Anteil der im Verlauf der Pandemie hospitalisierten COVID‑19-Fälle stellt Abb. 3 dar. Insgesamt beträgt die Hospitalisierungsrate über alle Altersgruppen etwa 7,3 % aller erfassten SARS-CoV‑2 Infektionen. Der höchste Wert ergibt sich mit 21,9 % erwartungsgemäß für Menschen ≥ 60 Jahre. Neugeborene und Säuglinge im ersten Lebensjahr weisen mit 8,8 % die zweithöchste Hospitalisierungsrate auf. Allerdings sind in dieser Altersgruppe nur 1345 Hospitalisierungen erfasst worden, sodass die Krankheitslast im Vergleich zu Menschen über 60 Jahre (insgesamt 182.575 Hospitalisierungen) unverändert niedrig ist. Zudem wurden viele Neugeborene und Säuglinge lediglich zur stationären Überwachung bei manifester COVID‑19 eines Elternteils aufgenommen. In den übrigen Altersgruppen ist der Anteil der stationären Betreuungen niedrig (1,3 % bei den Ein- bis 4‑Jährigen, 0,7 % bei den 5‑ bis 11-Jährigen, 1,0 % bei den 12- bis 17-Jährigen und 3,4 % bei den 18- bis 59-Jährigen). Der Anteil der intensivmedizinisch versorgten Personen beträgt bei Säuglingen 2 %, bei Ein- bis 11-Jährigen 1 %, bei 12- bis 17-Jährigen 2 %, bei 18- bis 59-Jährigen 7 % und ≥ 60-Jährigen 10 %.
Die Infektionsstatistiken des RKI belegen, dass die Krankheitsschwere von COVID‑19/SARS-CoV‑2-Infektionen bei Kindern und Jugendlichen im Hinblick auf manifeste und schwere Krankheitsverläufe deutliche geringer als in der Altersgruppe der Erwachsenen ist. Bei der Interpretation der Daten ist zudem zu berücksichtigen, dass ein Teil der stationär behandelten SARS-CoV‑2-positiv getesteten Kinder und Jugendlichen primär wegen anderer Krankheiten aufgenommen und lediglich im COVID‑19-Screening als asymptomatisch infiziert detektiert wurde. Es ist davon auszugehen, dass die Zahl der in den Meldestatistiken dargestellten COVID‑19-bedingten Hospitalisierungen von Kindern und Jugendlichen insgesamt eher überschätzt wird.
Die niedrige Krankheitslast von COVID‑19 bei Kindern und Jugendlichen wird auch durch die niedrige Zahl an COVID‑19-verursachten Todesfällen belegt. Die beim RKI erfassten COVID‑19-bedingten Todesfälle für verschiedene Altersgruppen zeigt Tab. 2 [1]. Die höchste Zahl der Todesfälle findet sich mit 73.010 (Stand 13.06.2021) bei den ≥ 60-Jährigen. Dies entspricht 8,8 % aller Todesfälle. Über alle Altersgruppen beträgt der Anteil der Todesfälle in Bezug auf alle erfassten COVID‑19 Fälle 2,1 %. Der niedrigste Anteil wurde für die 12- bis 17-Jährigen (0,001 %) ermittelt.
| Geschlecht | Altersgruppe (Jahre) | ||||||
|---|---|---|---|---|---|---|---|
| < 1 | 1–4 | 5–11 | 12–17 | 18–59 | ≥ 60 | Gesamt | |
| Männlich | 2 | 1 | 1 | 2 | 2447 | 38.269 | 40.722 |
| Weiblich | 2 | 3 | 3 | 0 | 985 | 34.741 | 35.734 |
| Gesamt | 4 | 4 | 4 | 2 | 3432 | 73.010 | 76.456 |
| Anteil COVID‑19-bedingter Todesfälle an allen übermittelten Fällen (%) | 0,026 | 0,005 | 0,002 | 0,001 | 0,14 | 8,8 | 2,1 |
COVID‑19 „coronavirus disease 2019“
Insgesamt sind COVID‑19-bedingte Todesfälle im Kindes- und Jugendalter in Deutschland sehr selten. In der Altersgruppe von 12 bis 17 Jahren wurden 2 Jugendliche als an COVID‑19 verstorben übermittelt. Beide Patienten litten an schweren Vorerkrankungen (Mehrfachbehinderung, neuromuskuläre Erkrankung, immunsuppressive Therapie). In den Altersgruppen unter 12 Jahren wurden 12 Todesfälle dokumentiert, wovon bei 8 der PatientInnen ebenfalls schwerwiegende Vorerkrankungen bestanden.
Die im COVID‑19-Register der DGPI [38] erfassten Daten zu hospitalisierten Kindern und Jugendlichen geben grundsätzlich einen den RKI-Statistiken entsprechenden Informationsstand wieder. Zurzeit melden 179 von 351 Kliniken in Deutschland COVID‑19-Fälle bei Kindern und Jugendlichen an das Register. Mit Stand 22.08.2021 wurden 1708 COVID‑19-assoziierte Hospitalisierungen registriert. Kinder im Alter unter 5 Jahren stellen mit 58 % die größte Gruppe der COVID-Fälle dar. Der Anteil der 5‑ bis 11-Jährigen betrug 15 %, der Anteil der 12- bis 15-Jährigen 16 % und der Anteil der 16- bis 17-Jährigen 11 % (58 %). Es waren 52 % der hospitalisierten Patienten männlich und 48 % weiblich. Intensivmedizinisch betreut werden mussten 84 Patienten, entsprechend 5 %. Typische Symptome der COVID‑19 präsentierten 71 % der hospitalisierten Kinder und Jugendlichen, bei 10 % war dies unklar, und 19 % wiesen keine klinischen Befunde der COVID‑19 auf.
„Variants of concern“
Im Verlauf der Pandemie sind Varianten des ursprünglichen Virusstamms aufgetreten, die als „besorgniserregende Virusvarianten“ („variants of concern“, VOC) bezeichnet werden. Dabei handelt es sich um Virusvarianten, die sich aufgrund von Mutationen hinsichtlich ihrer biologischen Eigenschaften, wie Übertragbarkeit oder Virulenz, von den ursprünglichen Virusvarianten unterscheiden. Diese Entwicklung ist grundsätzlich nicht überraschend, da die kontinuierliche Anpassung des Coronavirus an einen „neuen Wirt“, wie den Menschen, einen biologisch regelhaften Optimierungsprozess darstellt. Bedeutsam sind solche Varianten dann, wenn durch die genetische Veränderung die Infektiosität zunimmt oder das Virus zu schwereren Krankheitsverläufen führt. Im ungünstigsten Fall könnte die nach überstandener Infektion oder nach Impfung erworbene Immunität gegenüber einer neuen Virusvariante sogar unzureichend sein.
Mehr als 75 % der an der Delta-Variante erkrankten, hospitalisierten Menschen waren ungeimpft
Auf Vorschlag der WHO werden neue Varianten des SARS-CoV‑2 mit Buchstaben des griechischen Alphabets benannt. Gegenwärtig zirkuliert in Europa und den Vereinigten Staaten bevorzugt die Delta-Variante, die aufgrund einer höheren Transmissionsrate zwischenzeitlich die zuvor dominierende Alpha-Variante nahezu vollständig abgelöst hat. Es ist bisher nicht eindeutig geklärt, ob Infektionen mit der Delta-Variante auch mit einer höheren Morbidität belastet sind. Aus den USA wird eine deutliche Zunahme der Infektions‑, Erkrankungs- und Hospitalisierungsrate infolge der Verbreitung der Delta-Variante berichtet. Diese Entwicklung ist in Europa im Hinblick auf schwere Krankheitsverläufe bisher nicht eindeutig identifizierbar. Aktuell wurde auch im Vereinigten Königreich eine deutliche Zunahme der Hospitalisierungsrate von nichtgeimpften Erwachsenen beobachtet [39]. Die Untersuchungen in Schottland und England an 8682 Patienten mit einer Delta-Variante-Infektion und 34.656 Patienten mit einer Alpha-Variante-Infektion weisen darauf hin, dass Patienten, die durch die Delta-Variante an COVID‑19 erkranken, ein doppelt so hohes Risiko haben, in ein Krankenhaus eingewiesen zu werden. Die Beobachtung, dass mehr als 75 % der erkrankten, hospitalisierten Menschen ungeimpft waren, zeigt, dass die aktuell verfügbaren Impfstoffe auch vor der Delta-Variante schützen. Es ist unklar, warum in den USA die Krankheitslast von COVID‑19 bei Kindern und Jugendlichen, insbesondere mit der Delta-Variante, deutlich höher ist als in Europa. Möglicherwiese spielen gesundheitliche Risikofaktoren, wie das vermehrte Vorkommen von Adipositas und des metabolischen Syndroms, oder ein zumindest teilweise eingeschränkter Zugang zu medizinischen Versorgungseinrichtungen eine Rolle. Das präferenzielle Auftreten der Delta-Variante hat in Deutschland noch nicht zu einer Zunahme der Krankheitslast und damit verbunden stationären Betreuungen von Kindern und Jugendlichen geführt [38].
COVID‑19-Impfung
Für die Impfung von Kindern und Jugendlichen gegen COVID‑19 sind aktuell in der Europäischen Union 2 mRNA-Impfstoffe (Comirnaty, Fa. BioNTech/Pfizer, USA/Deutschland und Spikevax, Fa. Moderna, USA) ab dem Alter ≥ 12 Jahre zugelassen. Für eine vollständige Impfserie sind 2 Impfstoffdosen im Abstand von 3 bis 6 Wochen notwendig. Im Folgenden werden die wesentlichen Ergebnisse der pädiatrischen Zulassungsstudien für die beiden Impfstoffe dargestellt.
Impfstoffe
Kinder und Jugendliche ab 12 Jahren
Comirnaty (Fa. BioNTech/Pfizer).
In einer placebokontrollierten, beobachterverblindeten Phase-2/3-Studie (ClinicalTrials.gov Identifier: NCT04368728) wurden die Immunogenität, Sicherheit und Wirksamkeit von Comirnaty (BNT162b, Fa. BioNTech/Pfizer) bei insgesamt 2260 Probanden im Alter von 12 bis 15 Jahren untersucht [40]. Die Studienteilnehmer wurden 1:1 randomisiert und erhielten im Zeitraum vom 15.10.2020 bis zum 13.03.2021 entweder 2 Dosen Comirnaty (30 µg; n = 1131) oder Placebo (NaCl-Lösung; n = 1129) im Abstand ≥ 21 Tage. Ziel der Studie war der Nachweis der Nichtunterlegenheit im Vergleich zu den Impfantworten, die bei 16 bis 25 Jahre alten Studienteilnehmern in der primären Zulassungsstudie erzielt wurden. Die demografischen Daten der Studienteilnehmer zeigt Tab. 3.
| Charakteristika | 12–15 Jahre | 16–25 Jahre | 12–15 Jahre | 16–25 Jahre |
|---|---|---|---|---|
| Comirnaty | Comirnaty | Placebo | Placebo | |
| n = 1131 | n = 537 | n = 1129 | n = 561 | |
| n (%) | n (%) | n (%) | n (%) | |
| Männlich | 567 (50,1) | 255 (47,7) | 585 (51,8) | 269 (48,0) |
| Alter: Mittel (Median) | 13,6 (14,0) | 19,4 (18,0) | 13,6 (14,0) | 19,6 (19,0) |
| SARS-CoV‑2-Status negativ bei Beginn | 1028 (90,9) | 497 (92,6) | 1023 (90,6) | 522 (93,0) |
| Adipositas (ja) | 143 (12,6) | 80 (14,9) | 128 (11,3) | 101 (18,0) |
| Komorbiditäten (ja) | 248 (21,09) | 126 (23,5) | 240 (21,3) | 144 (25,7) |
SARS-CoV‑2 „severe acute respiratory syndrome coronavirus type 2“
Die Immunogenität des Impfstoffs bei 12- bis 15-Jährigen wurde mithilfe des „immunobridging“ ermittelt. Hierzu wurden 4 Wochen nach der 2. Impfstoffdosis die Titer der SARS-CoV‑2-spezifischen (50 %) neutralisierenden Antikörper von 12- bis 15-jährigen Geimpften gemessen und die Ergebnisse mit den Titern junger Erwachsener aus der Kontrollstudie verglichen. Die Immunobridging-Analyse wurde an einer randomisiert ausgewählten Teilgruppe (12- bis 15-Jährige: n = 245; 16- bis 25-Jährige: n = 218) durchgeführt. In Tab. 4 wird gezeigt, dass der mittlere geometrische Wert für SARS-CoV‑2 50 % neutralisierende Antikörpertiter bei 12- bis 15-Jährigen mit 1238,5 den Wert von 16–25-Jährigen (707,1) deutlich übertraf. Damit war das Kriterium der Nichtunterlegenheit erfüllt.
| Comirnaty (30 µg) | |||||
|---|---|---|---|---|---|
| 12–15 Jahre | 16–25 Jahre | 12–15/16–25 Jahre | |||
| n | GMT (95 %-KI) | n | GMT (95 %-KI) | GMR (95 %-KI) | Noninferior |
| 190 | 1239,5 (1095,5–1402,5) | 170 | 705,1 (621,4–800,2) | 1,76 (1,47–2,10) | Ja |
GMR 50 % Neutralization Titer-GMT-Ratio, GMT „geometric mean 50% neutralizing titer“, 95 %-KI 95 %-Konfidenzintervall
Die Wirksamkeit der Vakzine wurde durch Erfassung labordiagnostisch bestätigter COVID‑19 ab dem 7. Tag nach der 2. Impfstoffdosis für die Verum- und Placebogruppe geprüft. In der Studie (Datenstand 13.03.2021) sind bei 12- bis 15-Jährigen (ohne vorangegangene SARS-CoV‑2-Infektion), die 2 Impfstoffdosen erhalten hatten, ab 7 Tage nach der 2. Dosis in der Verumgruppe (n = 1005) keine und in der Placebogruppe (n = 978) 16 COVID‑19-Fälle identifiziert worden. Daraus ergibt sich rechnerisch eine Vakzineeffektivität von 100 % (95 %-KI 75,3–100,0) bei 12- bis 15-Jährigen. Schwere COVID‑19-Verläufe und Hospitalisierungen wurden weder in der Impfstoff- noch in der Placebogruppe beobachtet.
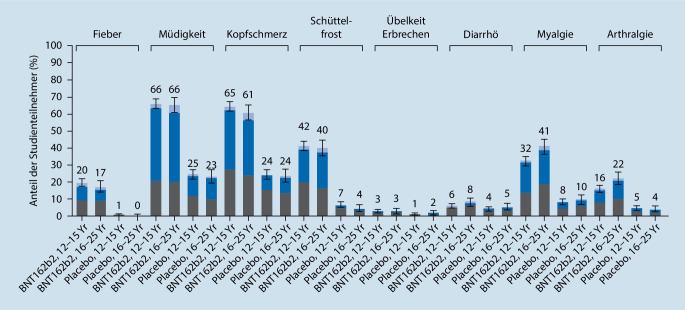
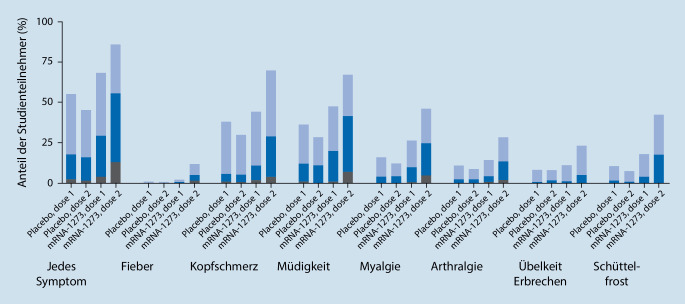
Die Verträglichkeit der mRNA-Vakzine war bei Jugendlichen vergleichbar mit den Befunden aus der Zulassungsstudie von 16- bis 25-jährigen jungen Erwachsenen (Abb. 4). Lokalreaktionen (Schmerzen an der Einstichstelle, Rötung, Schwellung) wurden nach der 1. Impfdosis als ausgeprägter beschrieben als nach der 2. Dosis, während systemische Impfreaktionen (Abgeschlagenheit, Fieber, Kopfschmerz, Schüttelfrost, Übelkeit, Durchfall, Gelenk- und Muskelschmerzen) nach der 2. Dosis häufiger angegeben wurden. Es berichteten 36,6 % der 12- bis 15-Jährigen, nach der 1. Impfdosis, und 50,8 %, nach der 2. Impfdosis Antipyretika eingenommen zu haben. Bis 30 Tage nach der Applikation der 2. Impfstoffdosis wurden im Verlauf der Studie keine schwerwiegenden unerwünschten Ereignisse („serious adverse event“, SAE), für die ein Zusammenhang mit dem Impfstoff angenommen wurde, beobachtet.
Spikevax (Fa. Moderna).
In einer verblindeten, placebokontrollierten Phase-2/3-Studie (ClinicalTrials.gov Identifier: NCT04649151) wurden bei 3726 Teilnehmern im Alter von 12 bis 17 Jahren die Immunogenität, Sicherheit und Wirksamkeit von Spikevax (mRNA-1273) geprüft [41].
Die Studienteilnehmer wurden 2:1 randomisiert und erhielten zwischen dem 09.12.2020 und dem 30.06.2021 jeweils 2 Dosen Spikevax (100 µg mRNA-1273; n = 2486) oder Placebo (Kochsalzlösung; n = 1240) im Abstand von 28 Tagen. Die Charakteristik der Studienteilnehmer ist Tab. 5 zu entnehmen. Außer Adipositas wurden keine weiteren Komorbiditäten bei den Probanden berichtet. Auch für diese Studie wurden die historischen Ergebnisse von 18- bis 25-Jährigen aus der primären Zulassungsstudie als Vergleichsgruppe genutzt.
| Charakteristika | Spikevax | Placebo |
|---|---|---|
| n = 2486) | n = 1240 | |
| n (%) | n (%) | |
| Weiblich | 1203 (48,4) | 608 (49,0) |
| Männlich | 1283 (51,6) | 632 (51,0) |
| Alter: Mittelwert ± SD | 14,3 ± 1,6 | 14,2 ± 1,6 |
| SARS-CoV‑2-Status negativ bei Beginn | 2167 (87,2) | 1075 (86,7) |
| Adipositas (BMI ≥30 kg/m2; ja) | 170 (6,8) | 94 (7,6) |
BMI Body-Mass-Index, SARS-CoV‑2 „severe acute respiratory syndrome coronavirus type 2“, SD Standardabweichung
Der Bewertung der Immunogenität der Impfung erfolgte ebenfalls durch Immunobridging mit den Ergebnissen der Vergleichsgruppe und Nachweis der Nichtunterlegenheit. Die Titer der SARS-CoV‑2 50 % neutralisierenden Antikörper wurden 28 Tage nach der 2. Impfdosis bestimmt (Tab. 6). Die Immunantwort der 12- bis 17-Jährigen gegenüber Spikevax war mit einem GMT von 1402 im Vergleich zum GMT von 1301 bei 18- bis 25-Jährigen nicht unterlegen. Das Verhältnis der GMT zwischen Kindern/Jugendlichen und jungen Erwachsenen betrug 1,08 und erfüllte damit das Kriterium der Nichtunterlegenheit.
| Spikevax (100 µg) | |||||
|---|---|---|---|---|---|
| 12–17 Jahre | 18–25 Jahre | 12–17/18–25 Jahre | |||
| n | GMT (95 %-KI) | n | GMT (95 %-KI) | GMR (95 %-KI) | Noninferior |
| 340 | 1401,7 (1276,3–1539,4) | 296 | 1301,3 (1177,0–1438,8) | 1,08 (0,94–1,24) | Ja |
GMR 50 % Neutralization Titer-GMT-Ratio, GMT „geometric mean 50% neutralizing titer“, 95 %-KI 95 %-Konfidenzintervall
In der Gruppe der vollständig geimpften 12- bis 17-Jährigen wurden ab 14 Tage nach der 2. Impfdosis keine und in der Placebogruppe 4 PCR-bestätigte symptomatische COVID‑19-Fälle detektiert. Daraus errechnet sich eine Vakzineeffektivität von 100 % für die Verhinderung von COVID‑19 in der untersuchten Altersgruppe.
Impfreaktionen wurden bei 12- bis 17-Jährigen etwas häufiger berichtet als bei den 18- bis 25-Jährigen der Vergleichsgruppe. Lokalreaktionen traten nach beiden Impfdosen etwa gleichhäufig auf, während systemische Impfreaktionen nach der 2. Impfdosis häufiger beklagt wurden (Abb. 5).
Den Gebrauch von Antipyretika als Indikator für den Schweregrad der Nebenwirkungen gaben 30,1 % der 12- bis 17-Jährigen nach der 1. Impfdosis und 50,1 % nach der 2. Impfdosis an. Anaphylaktische Reaktionen und dem Impfstoff ursächlich zugeschriebene schwerwiegende unerwünschte Ereignisse oder Todesfälle wurden nicht berichtet.
Der Impfstoff Comirnaty wurde am 31.05.2021 von der Europäischen Arzneimittel-Agentur (EMA) für den Einsatz bei 12- bis 15-Jährigen zugelassen. Die Zulassung von Spikevax für 12- bis 17-Jährigte erfolgte am 23.07.2021.
Die Zulassungsstudien belegen, dass beide mRNA-Impfstoffe eine hohe klinische Wirksamkeit haben und die Antiköperantwort nach der Impfung bei Jugendlichen im Alter von 12 bis 15 bzw. 12 bis 17 Jahren der von jungen Erwachsenen (Alter 18 bis 25 Jahre) nicht unterlegen ist. Beide Impfstoffe sind gut verträglich; das Reaktogenitätsprofil entspricht dem von Impfungen bei Erwachsenen. Erst nach der breiten Anwendung der mRNA-Impfstoffe sind Peri- und Myokarditiden als sehr seltene Nebenwirkung der Impfung aufgefallen (s. Abschn. „Peri- oder Myokarditis nach COVID‑19-Impfung“). Sie traten meistens 3 bis 5 Tage nach der 2. Impfstoffdosis bevorzugt bei Jungen und jungen Männern auf. Die Verläufe sind zumeist gutartig, es liegen jedoch keine Daten zum Langzeitverlauf vor. Bis auf das Auftreten postvakzinaler Peri- oder Myokarditiden wurden bisher weder in den Zulassungsstudien noch in den Postmarketingerhebungen schwerwiegende unerwünschte Ereignisse im Zusammenhang mit der Impfung beobachtet.
Kinder unter 12 Jahren
Zwischenzeitlich haben beide Hersteller Dosisdeeskalationsstudien für die Altersgruppe 5 bis 11 Jahre geplant und durchgeführt. In der Zulassungsstudie des Herstellers Pfizer/BioNtech wurden reduzierte Impfdosen (10 und 20 µg) im Vergleich zur Standarddosis (30 µg) geprüft. Die Impfstudie ist zwischenzeitlich abgeschlossen und befindet sich in der Auswertung. Publikationen zu den Ergebnissen liegen noch nicht vor. Nach Pressemeldungen will der Hersteller die Zulassung für die Kinder ab 5 Jahren im 4. Quartal 2021 bzw. spätestens im 1. Quartal 2022 beantragen. Die Kinderstudie des Herstellers Moderna ist noch nicht abgeschlossen. Auf Wunsch der amerikanischen Zulassungsbehörde U.S. Food and Drug Administration (FDA) soll die Teilnehmerzahl der Studie verdoppelt werden, um zusätzliche Sicherheitsdaten in der jungen Altersgruppe zu erheben. Es wird erwartet, dass der Impfstoffhersteller ebenfalls spätestens Anfang 2022 eine Zulassung beantragen wird.
Peri- oder Myokarditis nach COVID‑19-Impfung
Im Frühjahr 2021 wurde erstmals aus Israel über das Auftreten von Peri- und Myokarditiden bei jungen Männern nach der Impfung mit Comirnaty berichtet. Ende April registrierte die norwegische Arzneimittelbehörde [42] 7 Fälle von Perikarditis, die in engem zeitlichen Zusammenhang nach einer Comirnaty-Impfung diagnostiziert wurden. Im Mai und Juni folgten weitere Fallserien aus Israel, Italien und den USA über insgesamt 21 Fälle von Myokarditis, die nach einer Impfung mit mRNA-Impfstoffen [43–45] auftraten. Das Altersspektrum der Patienten umfasste 16 bis 56 Jahre, wobei junge Männer (14/21 im Alter < 30 Jahre) bevorzugt betroffen waren. In der Mehrzahl manifestierten sich die Myokarditiden wenige Tage nach der 2. Dosis von Comirnaty oder Spikevax. In einem Fall wurde eine Myokarditis nach Gabe der Vektorvakzine von Johnson & Johnson beobachtet. Klinisch imponierten Brustschmerzen, Dyspnoe, Leistungsschwäche und körperliche Abgeschlagenheit. Laborchemisch fielen erhöhte Troponin-, „Brain-natriuretic-peptide“- und C‑reaktives-Protein(CRP)-Werte auf. Elektroenzephalographie, Echokardiographie und Kardio-MRT zeigten mit einer Peri‑/Myokarditis kompatible Befunde. Etwa 80 % der betroffenen Personen wurden initial stationär betreut, konnten aber in den meisten Fällen nach wenigen Tagen das Krankenhaus gebessert wieder verlassen. Langzeitfolgen der kardialen Impfnebenwirkung sind bisher nicht beobachtet worden, allerdings ist der Nachbeobachtungszeitraum für diese Fragestellung mit durchschnittlich 3 Monaten noch sehr kurz.
Nachdem das Auftreten von Peri- und Myokarditiden nach einer Impfung mit mRNA-COVID‑19-Vakzinen als seltene Impfstoffnebenwirkung identifiziert war, wurde weltweit die Überwachung des Sicherheitssignals intensiviert. Die Zulassungsbehörde EMA hat nach Beratung im Ausschuss für Risikobewertung (Pharmacovigilance Risk Assessment Committee, PRAC) entschieden, einen Warnhinweis zu Myokarditis und Perikarditis in die Fach- und Gebrauchsinformationen beider mRNA-Impfstoffe aufzunehmen [46].
Im passiven Impfstoffsicherheitsmonitoring der USA (Vaccine Adverse Event Reporting System, VAERS) wurden bis 11.06.2021 nach einer mRNA-Impfung mit Comirnaty oder Spikevax 1226 Myokarditisfälle gemeldet [47]. Es wurden 267 Fälle nach der ersten Impfdosis und 827 Fälle nach der 2. Impfdosis erfasst. Bei 132 Meldungen war die zugehörige Impfdosis nicht bekannt. Bis zu diesem Datum waren in den USA insgesamt 296 Mio. Dosen von mRNA-COVID‑19-Impfstoffe verimpft worden. In der Altersgruppe zwischen 12 bis 29 Jahren waren 52 Mio. Impfdosen, 30 Mio. Dosen als Erstimpfung und 22 Mio. als Zweitimpfung, verabreicht worden.
Das mittlere Alter der 1226 Betroffenen betrug 26 Jahre, mit einer Spanne von 12 bis 94 Jahren. Die meisten Myokarditiden hatten sich 3 Tage nach der Impfung (Spanne: 0 bis 179 Tage) manifestiert. Bei 76 % der Betroffenen war die Myokarditis nach der 2. Impfdosis aufgetreten. Knapp 60 % der Myokarditispatienten waren jünger als 30 Jahre (n = 687), und in 76 % der Fälle betraf die Impfnebenwirkung Männer. Innerhalb der Gruppe betroffener Menschen unter 30 Jahren erfüllten 323 die von den amerikanischen Centers for Disease Control and Prevention (CDC) festgelegte Falldefinition für Peri- und/oder Myokarditis. 90 % der Fälle betrafen männlich Geimpfte; 96 % der Erkrankten wurden hospitalisiert. Der klinische Akutverlauf der Peri-/Myokarditiden war überwiegend unkompliziert, 95 % der Patienten konnten nach kurzer Zeit aus dem Krankenhaus entlassen werden, Todesfälle wurden nicht berichtet.
Entsprechend den im VAERS erfassten Daten betrug die Melderate für Peri- und Myokarditiden nach der 2. mRNA-Impfstoffdosis für männliche Personen (Alter 12 bis 29 Jahre) 41 Fälle/1 Mio. Impfstoffdosen. Für Mädchen und Frauen ergab sich in der gleichen Altersgruppe eine deutlich niedrigere Melderate von 4,2 Fällen/1 Mio. Impfstoffdosen. In der Altersgruppe unter 18 Jahren wurde mit 67 Fällen/1 Mio. Impfungen die höchste Melderate für eine Myokarditis ermittelt. Daraus errechnet sich durchschnittlich ein Fall einer Peri- oder Myokarditis auf 15.873 Impfungen [47]. Für die Bewertung eines impfstoffassoziierten Nebenwirkungsrisikos ist der Vergleich („observed versus expected“) zwischen der für den Impfstoff ermittelten Ereignisrate mit den in der Population resp. Altersgruppe normalerweise erwarteten Ereignisinzidenzen relevant. Die in den USA ermittelte Zahl der Peri‑/Myokarditiden (1 Fall auf etwa 16.000 Impfungen bei jungen Männern) liegt um das 10-Fache über der in der Gesamtpopulation für diese Altersgruppe erwarteten Inzidenz an Myokarditiden [47]. Da das amerikanische Überwachungssystem für Impfnebenwirkungen VAERS lediglich ein passives Meldesystem darstellt, ist darüber hinaus eher mit einer Untererfassung der Komplikationen zu rechnen [48].
Zahl der gemeldeter Peri‑/Myokarditiden nach Impfung mit mRNA-COVID-19 Vakzinen übersteigt statistisch erwartete Zahl
Die amerikanische Impfkommission (Advisory Committee on Immunization Practices, ACIP) empfiehlt seit dem 12.05.2021 die Impfung für 12- bis 15-Jährige. Grundlage für diese Entscheidung ist u. a. die im Vergleich zu Deutschland deutlich höhere COVID‑19-Krankheitslast von Kindern und Jugendlichen in den USA [49]. Die ACIP hat die Myokarditismelderate der Krankheitslast von COVID‑19 (Hospitalisierung, Aufnahme auf eine Intensivstation und Tod aufgrund von COVID‑19) bei Kindern und Jugendlichen gegenübergestellt. Am 23.06.2021 hat sie nach erneuter Evaluation und trotz des Sicherheitssignals ihre COVID‑19-Impfempfehlung für alle Personen ab dem Alter von 12 Jahren bestätigt [50].
Bis zum 31.08.2021 wurden in Deutschland 58 Fälle von Peri‑/Myokarditiden im Alter von 12 bis 17 Jahren innerhalb von 14 Tagen nach einer Comirnaty-Impfung an das Paul-Ehrlich-Institut (PEI, [51]) gemeldet. Es handelte sich um 54 Jungen und 4 Mädchen. Die gemeldeten Myokarditiden ereigneten sich überwiegend (66 %) nach der 2. Impfstoffdosis. Bis zum 31.07.2021 betrug die Melderate einer Peri‑/Myokarditis bei einer vom RKI angegebenen Impfquote von 20,5 % einfach und 9,9 % vollständig geimpfter Kinder 1,77/100.000 Dosen Comirnaty. Für männliche Jugendliche war die Melderate mit 3,18/100.000 Impfdosen höher. Rechnerisch ergibt sich für geimpfte männliche Jugendliche eine Rate von 1,84 Peri‑/Myokarditiden/100.000 verimpfte Dosen Comirnaty (95 %-KI: 1,14–2,64). Dies entspricht den Angaben aus den USA [48]. Auch in Deutschland liegt die Zahl der gemeldeten Peri‑/Myokarditiden über der vom PEI für die Alterskohorte üblicherweise statistisch erwarteten Zahl. Innerhalb von 14 Tagen wären 5 Fälle einer Myokarditis in der Impfkohorte erwartet worden; tatsächlich gemeldet wurden 15 Fälle; innerhalb von 30 Tagen wären 10 Fälle erwartet worden, gemeldet wurden 24 (bis 31.07.2021).
Impfempfehlung für Kinder und Jugendliche im Alter von 12 bis 17 Jahren
Beide mRNA-Impfstoffe sind in der Altersgruppe der 12- bis 17-Jährigen grundsätzlich wirksam und sicher. Für den Impfstoff Comirnaty liegen aufgrund des häufigeren Einsatzes aktuell deutlich mehr Sicherheitsdaten vor als für Spikevax. Seltene schwere Nebenwirkungen waren für beide Impfstoffe in den Zulassungsstudien nicht aufgefallen, allerdings haben auch nur 1131 Kinder und Jugendliche in der Comirnaty-Studie und 2486 in der Spikevax-Studie den Impfstoff erhalten. Angesichts einer kurzen, im Durchschnitt 3 Monate umfassenden Nachbeobachtungszeit und kleinen Studienpopulationen konnten (sehr) seltene Nebenwirkungen in den Zulassungsstudien nicht zuverlässig erkannt werden. Tatsächlich sind Peri- und Myokarditiden als Impfnebenwirkung erst im Kontext der breiten Anwendung der mRNA-Impfstoffe aufgefallen. Die klinischen Verläufe der besonders bei jungen Männern auftretenden Myo- und Perikarditiden sind bisher unkompliziert gewesen; Todesfälle wurden nicht berichtet [52]. Es fehlen allerdings Daten zum Langzeitverlauf, z. B. im Hinblick auf das Risiko, Rhythmusstörungen oder Myokardfibrosen zu entwickeln.
Bei der Entwicklung einer Impfempfehlung muss zunächst geprüft werden, welche Ziele durch ein Impfprogramm erreicht werden können. Impfziele können der Individualschutz vor Infektion, Erkrankung, Komplikation oder gar Tod sein. Dieser Aspekt ist besonders wichtig, wenn es um den Schutz Gefährdeter wie Hochbetagter, Menschen mit Vorerkrankungen oder immunologischen Funktionsstörungen oder beruflich exponierter Menschen geht. Impfungen können auch genutzt werden, um populationsbezogenen Schutz zu erzeugen, also die Herdenprotektion zu fördern. Abhängig von der Transmissionsrate eines Infektionserregers kann bei Erreichen eines bestimmten Anteils geschützter Individuen (Geimpfte und Genesene) die weitere Übertragung eingeschränkt oder ganz unterbunden werden. Schließlich können Impfungen auch eingesetzt werden, um Personen, die selbst nicht aktiv geimpft werden können, im Sinne einer Kokonstrategie zu schützen. Auf der anderen Seite gilt es zu bewerten, ob die verfügbaren Impfstoffe wirksam und sicher sind, d. h., ob sie geeignet sind, die gewünschten Impfziele ohne impfstoffbedingte Risiken zu erreichen. Diese Überlegungen haben auch bei der Entwicklung von COVID‑19-Impfempfehlungen eine entscheidende Rolle gespielt.
Wie die epidemiologischen Erhebungen des RKI und der pädiatrischen Fachgesellschaften zeigen, verlaufen SARS-CoV‑2-Infektionen bei vielen Kindern und Jugendlichen asymptomatisch, und wenn ansonsten gesunde Kinder erkranken, ist der COVID‑19-Krankheitsverlauf meist mild. Hospitalisierungen und intensivmedizinische Behandlungen aufgrund von COVID‑19 sind selten, und bisher traten lediglich einzelne Todesfälle bei schwer Vorerkrankten auf. Zum jetzigen Zeitpunkt ist die Krankheitslast von COVID‑19 bei Kindern und Jugendlichen mit der (historischen) Krankheitslast von Influenza vergleichbar. Betrachtet man nur die 12- bis 17-jährigen Jugendlichen, für die aktuell Impfstoffe zugelassen sind, müssten etwa 100.000 Individuen geimpft werden, um einen einzigen COVID‑19-bedingten Todesfall in dieser Altersgruppe zu verhindern („number needed to vaccinate“: 1/[Inzidenz • Vakzineeffektivität]). Insofern ist das Ziel, einen Individualschutz in dieser Altersgruppe sicherzustellen, nur bedingt tauglich. Das Auftreten seltener unerwünschter Wirkungen der Impfung muss gerade aufgrund der milden und häufig asymptomatischen COVID‑19-Verläufe in der Risiko-Nutzen-Abwägung sorgfältig beobachtet werden.
Nach Prüfung der Daten zu Sicherheit und Wirksamkeit des mRNA-Impfstoffs Comirnaty bei Kindern und Jugendlichen und einer sorgfältigen Nutzen/Risiko-Abwägung hat die STIKO [53] am 10.06.2021 entschieden, zunächst keine allgemeine COVID‑19-Impfempfehlung für 12- bis 17-Jährige auszusprechen. Hintergründe waren der nur geringe Vorteil hinsichtlich des erreichbaren Individualschutzes und die zunehmende Häufung von Berichten über impfstoffassoziierte Peri- und Myokarditiden gerade in den jüngeren Altersgruppen. Aufgrund eines medizinisch zu erwartenden erhöhten Risikos für schwere Verläufe von COVID‑19 bei Kindern und Jugendlichen mit Vorerkrankungen empfahl die STIKO die Impfung mit dem zugelassenen mRNA-Impfstoff für diese besonders gefährdete Population. Die für Kinder- und Jugendliche definierten Risikogruppen (Infobox 1) orientierten sich an den Erkenntnissen des COVID‑19-Survey der DGPI und weiteren wissenschaftlichen Erhebungen.
Infobox 1. Kinder und Jugendliche im Alter von 12 bis 17 Jahren mit Grunderkrankungen, die ein erhöhtes Risiko für schwere Verläufe der „coronavirus disease 2019“ haben. (Nach Vygen-Bonnet et al. [1])
Adipositas (> 97. Perzentile des Body-Mass-Index)
Angeborene oder erworbene Immundefizienz oder relevante Immunsuppression
Angeborene zyanotische Herzfehler (O2-Ruhesättigung < 80 %) und Einkammerherzen nach Fontan-Operation
Chronische Lungenerkrankungen mit einer anhaltenden Einschränkung der Lungenfunktion unterhalb der 5. Perzentile (Score-Wert < −1,64 für die forcierte Einsekundenkapazität [FEV1] oder Vitalkapazität [FVC])
Chronische Nierenerkrankungen
Chronische neurologische oder neuromuskuläre Erkrankungen
Diabetes mellitus, wenn nicht gut eingestellt bzw. mit HbA1c-Wert > 9,0 %
Schwere Herzinsuffizienz
Schwere pulmonale Hypertonie
Syndromale Erkrankungen mit schwerer Beeinträchtigung
Trisomie 21
Tumorerkrankungen und maligne hämatologische Erkrankungen
Darüber hinaus wurde für Kinder und Jugendliche (ab 12 Jahren), die im Umfeld von Personen mit hoher COVID‑19-Gefährdung leben, falls die Kontaktpersonen nicht selbst ausreichend durch eine Impfung geschützt werden können, eine Kokonstrategie empfohlen. Die EMA hatte den mRNA-Impfstoff zu diesem Zeitpunkt schon für den Einsatz ab 12 Jahren zugelassen. Daher war es grundsätzlich möglich, auch Kinder und Jugendliche ohne Vorerkrankungen nach ärztlicher Aufklärung und bei individuellem Wunsch und Risikoakzeptanz des Kindes oder Jugendlichen bzw. der Sorgeberechtigten zu impfen.
In Gesundheitspolitik und Öffentlichkeit ist die Indikations-Impfempfehlung kontrovers diskutiert worden. Insbesondere wurde darauf hingewiesen, dass die ACIP seit dem 14.05.2021 die Impfung für alle 12- bis 15-Jährigen empfohlen hatte. Wie schon im Abschnitt „Peri- oder Myokarditis nach COVID‑19-Impfung“ dargestellt, tragen Kinder und Jugendliche in den USA im Vergleich zur Situation in Deutschland eine deutlich höhere COVID‑19-Krankheitslast [49]. Oliver et al. [54] berichteten am 12.05.2021 auf der Sitzung der ACIP, dass allein bis zum 30.04.2021 schon 127 COVID‑19-bedingte Todesfälle bei Jugendlichen im Alter von 12 bis 17 Jahren in den USA zu beklagen waren. Die ACIP hat die mit der Impfung assoziierte Myokarditismelderate der Krankheitslast [55] von COVID‑19 (Hospitalisierung, Aufnahme auf eine Intensivstation und Tod aufgrund von COVID‑19) bei Kindern und Jugendlichen gegenübergestellt und am 09.07.2021 trotz des Sicherheitssignals ihre COVID‑19-Impfempfehlung für alle Jugendlichen ab dem Alter von 12 Jahren bestätigt [50]. Die von den amerikanischen Behörden veröffentlichten Infektionserkrankungszahlen bei Jugendlichen verdeutlichen, dass die Entscheidungsgrundlagen der ACIP sich von den epidemiologischen Bedingungen in Deutschland wesentlich unterscheiden.
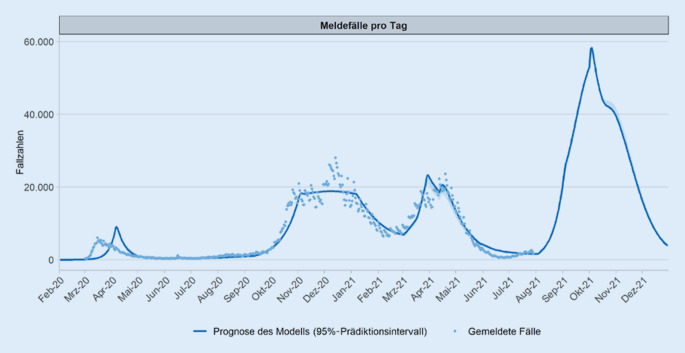
Im August 2021 wurden die Surveillance-Daten [48] von über 8 Mio. geimpften Jugendlichen aus den USA veröffentlicht. Die Ergebnisse belegen, zumindest für die Vereinigten Staaten, dass das akute Peri‑/Myokarditis-Risiko infolge einer mRNA-Impfung geringer ist als das Erkrankungsrisiko an COVID‑19. In der Untersuchung wurde zudem gezeigt, dass das direkt mit COVID‑19 assoziierte Risiko, eine kardiale Komplikation zu entwickeln, ebenfalls höher als die mit der Impfung assoziierten Risiken erscheint. Angesichts des wachsenden Kenntnisstands zur Impfstoffsicherheit und der grundsätzlich positiven Einschätzung des Nebenwirkungsprofils für Jugendliche hat die STIKO erneut das Nutzen-Risiko-Verhältnis einer allgemeinen Impfempfehlung für Kinder und Jugendliche überprüft. Um die Infektionsdynamik von SARS-CoV‑2 in der pädiatrischen Altersgruppe in Deutschland einzuschätzen, wurden Ergebnisse einer Modellierung der prognostizierten Krankheitslast in der erwarteten 4. Infektionswelle berücksichtigt (Abb. 6). Die Ergebnisse der Modellierung sind bisher nur im Rahmen der wissenschaftlichen Begründung zur Impfung von Kindern und Jugendlichen [1] und einem zugehörigen Anhang publiziert [56].
Die Kernaussagen der Modellierung basieren auf folgenden Annahmen: Prospektiv wird angenommen, dass täglich 500.000 Impfstoffdosen an 18- bis 59-Jährige und 200.000 Dosen an 12- bis 17-Jährige ohne Vorerkrankung verimpft werden. Um die direkten und indirekten Effekte der Impfung von 12- bis 17-Jährigen zu analysieren, werden verschiedene Impfraten bei 12- bis 17-Jährigen berücksichtigt, während die Impfquoten der ≥ 60-Jährigen sowie der 12- bis 17-Jährigen mit Vorerkrankung bei 90 % vorausgesetzt werden. Für 18- bis 59-Jährige wurde eine stabile Impfquote von 75 % angenommen. Darüber hinaus gehen die Modellierer davon aus, dass keine neuen Maßnahmen zur Kontaktreduktion eingeführt werden, da erwartet wird, dass gefährdete Menschen zum Zeitpunkt der 4. Welle über einen Impfschutz verfügen und alle impfbereiten Personen ein Impfangebot wahrgenommen haben. Unter diesen Annahmen prognostiziert die statistische Modellierung, dass in der 4. Infektionswelle die Anzahl der täglich gemeldeten Fälle auf bis zu 60.000 ansteigt (Abb. 6). Da Altersgruppen über 60 Jahre mittlerweile zum größten Teil über einen vollständigen Impfschutz verfügen, ist mit einer höheren Zahl der Infizierten jüngeren Alters zu rechnen. Unter der Annahme der Steigerung der Impfquote unter 12- bis 17-Jährigen von 20 % auf 50 % könnten aus der Perspektive der Modellierung etwa 37 % der erwarteten symptomatischen und asymptomatischen Meldefälle, 36 % der Hospitalisierungen und 36 % der intensivmedizinisch versorgten Fälle in der Altersgruppe 12 bis 17 Jahre im Zeitraum vom August bis Dezember 2021 zusätzlich verhindert werden (Tab. 7). Einschränkend ist bei dieser Prognose zu berücksichtigen, dass die Zahl der COVID‑19-bedingten Hospitalisierungen von Kindern und Jugendlichen in der Modellierung wahrscheinlich überschätzt wird, da die verwendeten Meldezahlen nicht zwischen einer stationären Aufnahme aufgrund von COVID‑19 oder lediglich mit SARS-CoV‑2-Nachweis differenzieren.
| Zeitraum | Impfungen | Betrachtete Altersgruppe | SARS-CoV‑2-Meldefälle (n) | Hospitalisierung (n) | ITS (n) | PIMS (n) | Myokarditis nach Impfung (n) |
|---|---|---|---|---|---|---|---|
| Bisherige Pandemie (16 Monate) | Bis 10.06.2021: keine | 12–17 Jahre | 206.161 | 2110 | 36 | 86 | – |
| Ab 10.06.2021: Kinder und Jugendliche > 12 Jahre mit Vorerkrankungen | |||||||
| Erwartungen 4. Welle laut Modell |
90 %ige Impfquote bei Kindern und Jugendlichen > 12 Jahre mit Vorerkrankungen 20 %ige Impfquote bei gesunden Kindern und Jugendlichen > 12 Jahre |
12–17 Jahre | 449.477 | 5466 | 101 | 187 | – |
|
90 %ige Impfquote bei Kindern und Jugendlichen > 12 Jahre mit Vorerkrankungen 50 %ige Impfquote bei gesunden Kindern und Jugendlichen > 12 Jahre |
12 bis 17 Jahre (direkte Effekte) | −164.119 | −1966 | −36 | −68 | 82 | |
| 0 bis 11 Jahre (indirekte Effekte) | −65.915 | −811 | −15 | −71 | – |
ITS Intensivstation, PIMS „pediatric inflammatory multisystem syndrome“, SARS-CoV‑2 „severe acute respiratory syndrome coronavirus type 2“
Zusätzlich könnte die Impfung der 12- bis 17-Jährigen sekundär durch Effekte der Herdenprotektion zu einer Reduktion der Fallzahlen bei Kindern unter 12 Jahren führen. Interessant ist, dass ohne eine Steigerung der Impfquoten in der Altersgruppe der 18- bis 59-Jährigen in der Modellierung kein wesentlicher Effekt der Impfung von gesunden 12- bis 17-Jährigen auf den Gesamtverlauf der bevorstehenden 4. Welle erkannt wird.
Für die Risiko-Nutzen-Abwägung ergibt sich aus dieser Modellierung rechnerisch ein Risiko von 82 impfstoffassoziierten Myokarditiden unter 4 Mio. Jugendlichen in der Altersgruppe 12 bis 17 Jahre bei einer Impfrate von 50 %. Demgegenüber wird erwartet, durch das Impfprogramm knapp 2800 Hospitalisierungen, 50 Intensivbehandlungen und etwa 150 Fälle von PIMS verhindern zu können. Unter Berücksichtigung des besseren Kenntnisstandes zur Impfstoffsicherheit und einer (nach Modellierung) erwarteten deutlich höheren Krankheitslast bei Kindern und Jugendlichen hat sich die STIKO am 19.08.2021 für eine allgemeine Impfempfehlung von Kindern und Jugendlichen ab 12 Jahren ausgesprochen [1]. Primäres Ziel dieser Empfehlung ist das Sicherstellen eines Individualschutzes in der Altersgruppe. Sekundäre Effekte können sich durch die erwartete Reduktion der Transmission und Verringerung der Krankheitslast bei Kindern unter 12 Jahren ergeben. Wenige Wochen später, am 04.09.2021, hat die britische Impfkommission (Joint Committtee on Vaccination and Immunization – JCVI) sich lediglich für eine auf das Alter von 16–17 Jahren begrenzte allgemeine COVID‑19 Impfempfehlungen ausgesprochen (https://www.gov.uk/government/news/jcvi-issues-updated-advice-on-covid-19-vaccination-of-young-people-aged-16-to-17, Zugegriffen am 08.10.2021). Für die Altersgruppe 12–15 Jahre erweitert die englische Kommission die Impfempfehlung primär nur für an Herz, Lungen und Leber erkrankte Kinder und Jugendliche. Die Kommission begründete die Entscheidung mit dem aus ihrer Sicht nur geringen Vorteilen der Impfung gegenüber dem Risiko einer post-vakzinalen Myokarditis bei 12 bis 15‑Jährigen. Die differenten Beurteilungen der COVID-19-Impfung von Kindern und Jugendlichen durch nationale und internationale Impfkommissionen unterstreichen die Komplexität der Fragestellung und die intensiven Bemühungen der Fachleute um die beste Empfehlung für diese Altersgruppe. Auch in Zukunft wird es dringend erforderlich sein, die Epidemiologie von SARS-CoV‑2 und die Krankheitslast von COVID‑19 im Kindes- und Jugendalter strukturiert zu erfassen, um Interventionen wie Impfungen oder Maßnahmen der Kontaktreduktion ohne Nachteile für die physische und psychische Gesundheit dieser Altersgruppe zu entwickeln.
Fazit für die Praxis
Bei 12- bis 17-jährigen Kindern und Jugendlichen hat die „coronavirus disease 2019“ (COVID‑19) bisher meist einen milden Verlauf mit einem hohen Anteil asymptomatischer Infektionen.
Die Hospitalisierungsrate der gemeldeten Fälle beträgt 1 % und reduziert sich bei Berücksichtigung asymptomatischer Fälle und bei Fällen, die nicht wegen COVID‑19 hospitalisiert sind, auf 0,1 %, mit einer Letalität von 0,001 %.
Das COVID‑19-assoziierte „pediatric inflammatory multisystem syndrome“ (PIMS) ist eine sehr seltene, schwere Erkrankung, deren Verlauf bei früher Diagnose und adäquater Therapie günstig ist.
Die allgemeine Impfempfehlung für Kinder und Jugendliche ab 12 Jahren hat primär deren direkten Schutz vor COVID‑19 und assoziierten Komplikationen zum Ziel.
Beide mRNA-Impfstoffe sind in der Altersgruppe der 12- bis 17-Jährigen grundsätzlich sehr wirksam und im Zeitrahmen der Applikation sicher.
Die wesentlichen Risiken der Impfung von 12- bis 17-Jährigen mit mRNA-Impfstoffen bestehen im seltenen Auftreten von Peri- oder Myokarditiden, bevorzugt bei Jungen, mit meist unkompliziertem Akutverlauf.
Untersuchungen aus dem Ausland weisen darauf hin, dass eine Beteiligung des Herzens auch bei klinisch manifester COVID‑19 auftreten kann.
Vor dem Hintergrund der in Modellierungen prognostizierten gesteigerten COVID‑19-Krankheitslast von Jugendlichen überwiegen nach gegenwärtigem Wissensstand die Vorteile der Impfung deutlich die möglichen, sehr seltenen Impfnebenwirkungen.
Aufgrund des begrenzten Beobachtungszeitraums für den Verlauf der aufgetretenen Myokarditiden können mögliche mittel- und langfristige Folgen aktuell nicht bewertet werden. Vor jeder Impfung von 12- bis 17-Jährigen sollte über diesen Sachverhalt aufgeklärt werden.
Acknowledgments
Danksagung
Der Geschäftsstelle der STIKO beim RKI, insbesondere Frau Dr. J. Koch und Frau Dr. S. Vygen-Bonnet, gebührt Dank für die exzellente Aufarbeitung der aktuellen Literatur zu COVID‑19 bei Kindern und Jugendlichen, die eine wertvolle Grundlage für den vorliegenden Leitthemenbeitrag war. Dank gilt auch den Mitgliedern der STIKO-Arbeitsgruppe COVID‑19-Kinder, R. Berner, U. Heininger, E. Hummers-Pradier, R. v. Kries, J. Meerpohl, M. Terhardt, G. Widders und V. Wild, deren Engagement und intensive Diskussion die Entwicklung der Impfempfehlung für Kinder- und Jugendliche konstruktiv begleitet hat.
Einhaltung ethischer Richtlinien
Interessenkonflikt
M. Knuf gibt an, dass kein Interessenkonflikt besteht. F. Zepp ist Mitglied des Data Safety Monitoring Board für die COVID-A9-Impfstoff-Entwicklung von CureVac und Icosavax.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Vygen-Bonnet S, Koch J, Armann J, Berner R, Bogdan C, Harder T, et al. Beschluss der STIKO zur 9. Aktualisierung der COVID‑19-Impfempfehlung und die dazugehörige wissenschaftliche Begründung. Epidemiol Bull. 2021;33:3–46. doi: 10.25646/8942.2. [DOI] [Google Scholar]
- 2.Lu H, Stratton CW, Tang YW. Outbreak of pneumonia of unknown etiology in Wuhan, China: the mystery and the miracle. J Med Virol. 2020;92:401–402. doi: 10.1002/jmv.25678. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Hui DS, Azhar EI, Madani TA, et al. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health—the latest 2019 novel coronavirus outbreak in Wuhan, China. Int J Infect Dis. 2020;91:264–266. doi: 10.1016/j.ijid.2020.01.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.WHO (2020) WHO director-general’s opening remarks at the media briefing on COVID‑19. https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19-11-march-2020. Zugegriffen: 20. März 2020
- 5.Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382:727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kellam P, Barclay W. The dynamics of humoral immune responses following SARS-CoV‑2 infection and the potential for reinfection. J Gen Virol. 2020;101:791–797. doi: 10.1099/jgv.0.001439. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Liguoro I, Pilotto C, Bonanni M, Ferrari ME, Pusiol A, Nocerino A, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur J Pediatr. 2020;179:1029–1046. doi: 10.1007/s00431-020-03684-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Viner RM, Ward JL, Hudson LD, Ashe M, Patel SV, Hargreaves D, et al. Systematic review of reviews of symptoms and signs of COVID‑19 in children and adolescents. Arch Dis Child. 2020 doi: 10.1136/archdischild-2020-320972. [DOI] [PubMed] [Google Scholar]
- 10.Molteni E, Sudre C, Canas L, Bhopal S, Hughes R, Antonelli M, et al. Illness duration and symptom profile in symptomatic UK school-aged children tested for SARS-CoV‑2. Lancet Child Adolesc Health. 2021 doi: 10.1016/S2352-4642(21)00198-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Abi Nassif T, Fakhri G, Younis NK, Zareef R, Al Amin F, Bitar F, et al. Cardiac manifestations in COVID‑19 patients: a focus on the pediatric population. Can J Infect Dis Med Microbiol. 2021 doi: 10.1155/2021/5518979. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Singer ME, Taub IB, Kaelber DC (2021) Risk of myocarditis from COVID‑19 infection in people under age 20: a population-based analysis. https://www.medrxiv.org/content/10.1101/2021.07.23.21260998v1. Zugegriffen: 1. Sept. 2021
- 13.Bilich T, Nelde A, Heitmann JS, Maringer Y, Roerden M, Bauer J, et al. T cell and antibody kinetics delineate SARS-CoV‑2 peptides mediating long-term immune responses in COVID‑19 convalescent individuals. Sci Transl Med. 2021;13:590. doi: 10.1126/scitranslmed.abf7517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Jung JH, Rha M-S, Sa M, Choi HK, Jeon JH, Seok H, et al. SARS-CoV‑2-specific T cell memory is sustained in COVID‑19 convalescent patients for 10 months with successful development of stem cell-like memory T cells. Nat Commun. 2021;12(1):4043. doi: 10.1038/s41467-021-24377-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Yao L, Wang G-L, Shen Y, Wang Z-Y, Zhan B-D, Duan L-J, et al. Persistence of antibody and cellular immune responses in COVID‑19 patients over nine months after infection. J Infect Dis. 2021 doi: 10.1093/infdis/jiab255. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Renk H, Dulovic A, Becker M, Fabricius D, Zernickel M, Junker D et al (2021) Typically asymptomatic but with robust antibody formation: children’s unique humoral immune response to SARS-coV‑2. https://www.medrxiv.org/content/10.1101/2021.07.20.21260863v1. Zugegriffen: 1. Sept. 2021
- 17.Viner RM, Mytton OT, Bonell C, Melendez-Torres G, Ward J, Hudson L, et al. Susceptibility to SARS-CoV‑2 infection among children and adolescents compared with adults: a systematic review and meta-analysis. JAMA Pediatr. 2021;175(2):143–156. doi: 10.1001/jamapediatrics.2020.4573. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Galow L, Haag L, Kahre E, Blankenburg J, Dalpke AH, Luck C, et al. Lower household transmission rates of SARS-CoV‑2 from children compared to adults. J Infect. 2021;83(1):e34–e6. doi: 10.1016/j.jinf.2021.04.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Schoeps A, Hoffmann D, Tamm C, Vollmer B, Haag S, Kaffenberger T et al (2021) COVID‑19 transmission in educational institutions august to december 2020 in Germany: a study of index cases and close contact cohorts. https://www.medrxiv.org/content/10.1101/2021.02.04.21250670v2.full. Zugegriffen: 1. Sept. 2021
- 20.Götzinger F, Santiago-García B, Noguera-Julián A, Lanaspa M, Lancella L, Carducci FIC, et al. COVID‑19 in children and adolescents in Europe: a multinational, multicentre cohort study. Lancet Child Adolesc. Health. 2020;4(9):653–661. doi: 10.1016/S2352-4642(20)30177-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Graff K, Smith C, Silveira L, Jung S, Curran-Hays S, Jarjour J, et al. Risk factors for severe COVID‑19 in children. Pediatr Infect Dis J. 2021;40(4):e137–e45. doi: 10.1097/INF.0000000000003043. [DOI] [PubMed] [Google Scholar]
- 22.Clift AK, Coupland CAC, Keogh RH, Hemingway H, Hippisley-Cox J. COVID‑19 mortality risk in down syndrome: results from a cohort study of 8 million adults. Ann Intern Med. 2021;174(4):572–576. doi: 10.7326/M20-4986. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Malle L, Gao C, Hur C, Truong HQ, Bouvier NM, Percha B, et al. Individuals with down syndrome hospitalized with COVID‑19 have more severe disease. Genet Med. 2021;23(3):576–580. doi: 10.1038/s41436-020-01004-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Bhopal SS, Bagaria J, Olabi B, Bhopal R. Children and young people remain at low risk of COVID‑19 mortality. Lancet Child Adolesc Health. 2021;5(5):e12–e3. doi: 10.1016/S2352-4642(21)00066-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Armann J, Doenhardt M, Hufnagel M, Diffloth N, Reichert F, Haas W et al (2021) Risk factors for hospitalization, disease severity and mortality in children and adolescents with COVID‑19: results from a nationwide German registry. https://www.medrxiv.org/content/10.1101/2021.06.07.21258488v1. Zugegriffen: 1. Sept. 2021
- 26.Ahmed H, Patel K, Greenwood D, Halpin S, Lewthwaite P, Salawu A et al (2021) Long-term clinical outcomes in survivors of coronavirus outbreaks after hospitalisation or ICU admission: a systematic review and meta-analysis of follow-up studies. https://www.medrxiv.org/content/10.1101/2020.04.16.20067975v1. Zugegriffen: 1. Sept. 2021 [DOI] [PubMed]
- 27.Deutsche Gesellschaft für pädiatrische Infektiologie (DGPI) (2021) Aktuelle Ergebnisse der Datensammlung von Pediatric Inflammatory Multisystem Syndrome (PIMS) Fällen bei Kindern und Jugendlichen in Deutschland. https://dgpi.de/pims-survey-update/. Zugegriffen: 28. Aug. 2021
- 28.McArdle AJ, Vito O, Patel H, Seaby EG, Shah P, Wilson C, et al. Treatment of multisystem inflammatory syndrome in children. N Engl J Med. 2021;385(1):11–22. doi: 10.1056/NEJMoa2102968. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Ahmed M, Advani S, Moreira A, Zoretic S, Martinez J, Chorath K, et al. Multisystem inflammatory syndrome in children: a systematic review. EClinicalMedicine. 2020;26:100527. doi: 10.1016/j.eclinm.2020.100527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Salzman MB, Huang C-W, O’Brien CM, Castillo RD. Multisystem inflammatory syndrome after SARS-coV-2 infection and COVID‑19 vaccination. Emerg Infect Dis. 2021;27(7):1944. doi: 10.3201/eid2707.210594. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Uwaydah AK, Hassan NM, Ghoush MSA, Shahin KMM. Adult multisystem inflammatory syndrome in a patient who recovered from COVID‑19 postvaccination. BMJ Case Rep. 2021;14(4):e242060. doi: 10.1136/bcr-2021-242060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Nittas V, Puhan M. Literature screening report: long COVID: evolving definitions, burden of disease and socio-economic consequences. 2021. [Google Scholar]
- 33.Brackel CLH, Lap CR, Buddingh EP, van Houten MA, van der Sande L, Langereis EJ, et al. Pediatric long-COVID: an overlooked phenomenon? Pediatr Pulmonol. 2021 doi: 10.1002/ppul.25521. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Blankenburg J, Wekenborg MK, Reichert J, Kirsten C, Kahre E, Haag L et al (2021) Mental health of adolescents in the pandemic: long-COVID19 or long-pandemic syndrome? https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3844826. Zugegriffen: 1. Sept. 2021
- 35.Radtke T, Ulyte A, Puhan MA, Kriemler S (2021) Long-term symptoms after SARS-CoV‑2 infection in school children: population-based cohort with 6‑months follow-up. https://www.medrxiv.org/content/10.1101/2021.05.16.21257255v2. Zugegriffen: 1. Sept. 2021
- 36.RKI (2021) RKI Lagebericht über das aktuelle Infektionsgeschehen in Deutschland. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/Gesamt.html. Zugegriffen: 08.10.2021
- 37.RKI (2021) Wöchentlicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 vom 19.08.2021. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/Wochenbericht/Wochenbericht_2021-08-19.pdf?__blob=publicationFile. Zugegriffen: 08.10.2021
- 38.Deutsche Gesellschaft für pädiatrische Infektiologie (DGPI) (2021) Aktuelle Ergebnisse der DGPI-Datensammlung von stationären COVID‑19 Fällen bei Kindern und Jugendlichen in Deutschland. https://dgpi.de/covid-19-survey-update/. Zugegriffen: 1. Sept. 2021
- 39.Twohig KA, Nyberg T, Zaidi A, Thelwall S, et al. Hospital admission and emergency care attendance risk for SARS-CoV‑2 delta (B.1.617.2) compared with alpha (B.1.1.7) variants of concern: a cohort study. Lancet. 2021 doi: 10.1016/S1473-3099(21)00475-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Frenck RW, Klein NP, Kitchin N, Gurtman A, Absalon J, Lockhart S, et al. Safety, immunogenicity, and efficacy of the BNT162b2 Covid‑19 vaccine in adolescents. N Engl J Med. 2021;385(3):239–250. doi: 10.1056/NEJMoa2107456. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Ali K, Berman G, Zhou H, Deng W, Faughnan V, Coronado-Voges M, et al. Evaluation of mRNA-1273 SARS-CoV‑2 vaccine in adolescents. N Engl J Med. 2021 doi: 10.1056/NEJMoa2109522. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Norwegian Medicines Agency (2021) Reports of suspected adverse reactions to COVID‑19 vaccines as of 27 april 2021. https://legemiddelverket.no/nyheter/reports-of-suspected-adverse-reactions-to-covid-19-vaccines-as-of-27-april-2021. Zugegriffen: 28. Mai 2021
- 43.Larson KF, Ammirati E, Adler ED, Cooper LT, Hong KN, Saponara G, et al. Myocarditis after BNT162b2 and mRNA-1273 vaccination. Circulation. 2021;144(6):506–508. doi: 10.1161/CIRCULATIONAHA.121.055913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Mouch SA, Roguin A, Hellou E, Ishai A, Shoshan U, Mahamid L, et al. Myocarditis following COVID‑19 mRNA vaccination. Vaccine. 2021;39(29):3790–3793. doi: 10.1016/j.vaccine.2021.05.087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Rosner CM, Genovese L, Tehrani BN, Atkins M, Bakhshi H, Chaudhri S, et al. Myocarditis temporally associated with COVID‑19 vaccination. Circulation. 2021;144(6):502–505. doi: 10.1161/CIRCULATIONAHA.121.055891. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.European Medicines Agency (EMA) (2021) Comirnaty and Spikevax: possible link to very rare cases of myocarditis and pericarditis. https://www.ema.europa.eu/en/news/comirnaty-spikevax-possible-link-very-rare-cases-myocarditis-pericarditis. Zugegriffen: 22. Juli 2021
- 47.Shimabukuro T (2021) Advisory committee on immunization practices (ACIP). COVID‑19 vaccine safety updates. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-06/03-COVID-Shimabukuro-508.pdf. Zugegriffen: 08.10.2021
- 48.Hause AM, Gee J, Baggs J, et al. COVID‑19 vaccine safety in adolescents aged 12–17 years—United States, december 14, 2020–july 16, 2021. Mmwr Morb Mortal Wkly Rep. 2021;70:1053–1058. doi: 10.15585/mmwr.mm7031e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Centers for Disease Control and Prevention (2021) Estimated COVID‑19 infections, symptomatic illnesses, and hospitalizations—United States. https://www.cdc.gov/coronavirus/2019-ncov/cases-updates/burden.html. Zugegriffen: 1. Sept. 2021
- 50.Gargano JW, Wallace M, Hadler SC, et al. Use of mRNA COVID‑19 vaccine after reports of myocarditis among vaccine recipients: update from the advisory committee on immunization practices—United States, June 2021. Mmwr Morb Mortal Wkly Rep. 2021;70:977–982. doi: 10.15585/mmwr.mm7027e2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.PEI (2021) Sicherheitsbericht. Verdachtsfälle von Nebenwirkungen und Impfkomplikationen nach Impfung zum Schutz vor COVID‑19 seit Beginn der Impfkampagne am 27.12.2020 bis zum 31.07.2021. https://www.pei.de/SharedDocs/Downloads/DE/newsroom/dossiers/sicherheitsberichte/sicherheitsbericht-27-12-bis-31-07-21.pdf?__blob=publicationFile&v=5. Zugegriffen: 08.10.2021
- 52.Jain SS, Steele JM, Fonseca B, Huang S, Shah S, Maskatia SA, et al. COVID‑19 vaccination-associated myocarditis in adolescents. Pediatrics. 2021 doi: 10.1542/peds.2021-053427. [DOI] [PubMed] [Google Scholar]
- 53.Vygen-Bonnet SKJ, Berner R, Bogdan C, Harder T, Heininger U, Hummers E, Littmann M, Meerpohl J, Mertens T, Meyer H, Neufeind J, Schmid-Küpke N, Scholz S, Terhardt M, Überla K, van der Sande M, Waize M, Wichmann O, Wicker S, Widders G, Wiedermann U, Wild V, Zepp F, von Kries R. Beschluss der STIKO zur 6. Aktualisierung der COVID‑19-Impfempfehlung und die dazugehörige wissenschaftliche Begründung. Epidemiol Bull. 2021;23:3–32. [Google Scholar]
- 54.Oliver S et al (2021) EtR framework: Pfizer-bioNtech COVID‑19 vaccine in adolescents aged 12-15 years. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-05-12/04-COVID-Oliver-508.pdf. Zugegriffen: 08.10.2021
- 55.CDC (2021) Provisional COVID‑19 death counts by age in years. https://data.cdc.gov/NCHS/Provisional-COVID-19-Deaths-Counts-by-Age-in-Years/3apk-4u4f/data. Zugegriffen: 08.10.2021
- 56.RKI (2021) Anhang 1 zur wissenschaftlichen Begründung der STIKO-Empfehlung zur COVID‑19-Impfung. Mathematische Modellierung. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2021/Ausgaben/33_21_Anhang_1.pdf?__blob=publicationFile. Zugegriffen: 08.10.2021