Abstract
骨稳态的维持对于骨骼健康极为重要,如果骨形成与骨吸收的平衡被打破,容易造成骨量丢失、骨质疏松等多种骨骼疾病。近期越来越多的研究表明,能量代谢失调,例如葡萄糖代谢异常、氨基酸代谢受阻以及脂代谢缺陷等等,都会对骨稳态的平衡造成破坏,从而引起或是加剧导致骨量减少和骨质疏松性骨折等疾病。本文将对能量代谢在成骨细胞以及破骨细胞中的研究进展进行总结分析,深入了解能量代谢,特别是葡萄糖代谢在骨稳态维持中对成骨、破骨细胞分化和功能的关键调控作用,为了解、治疗骨质疏松等骨相关疾病提供指导。
Keywords: 能量代谢, 葡萄糖代谢, 成骨细胞, 破骨细胞, 骨质疏松
Abstract
The maintenance of bone homeostasis is critical for bone health. It is vulnerable to cause bone loss, even severely osteoporosis when the balance between bone formation and absorption is interrupted. Growing evidence has shown that energy metabolism disorders, such as abnormal glucose metabolism, irregular amino acid metabolism, and aberrant lipid metabolism, can damage bone homeostasis, causing or exacerbating bone mass loss and osteoporosis-related fractures. Here, we summarize the studies of energy metabolism in osteoblasts and osteoclasts and provide a better appreciation of how energy metabolism, especially glucose metabolism maintains bone homeostasis. With this knowledge, new avenues will be unraveled to understand and cue bone-related diseases such as osteoporosis.
Keywords: energy metabolism, glucose metabolism, osteoblast, osteoclast, osteoporosis
骨量丢失与骨质疏松导致的骨折一直是威胁人类健康尤其是中老年人健康的主要疾病,根据国家卫生健康委员会调查的结果显示,骨质疏松症已经成为中国50岁以上人群的重要健康问题,中老年女性骨质疏松问题尤为严重。随着中国人口老龄化的进程,患有骨质疏松症的患者人数将迅速增加。更为严重的是,调查还发现,中国低骨量人群庞大,是骨质疏松症的高危人群,但是因为早期骨量丢失病症不明显,并没有引起人们的足够重视,耽误了病症的治疗[1]。尽管近些年来,越来越多的科研工作结合临床治疗开发了多种药物,例如针对RANKL的药物地舒单抗(Denosumab),二磷酸盐类药物以及美国食品药品监督管理局(food and drug administration,FDA)批准的新药TYMLOS(abaloparatide)注射液等等,在一定程度上对治疗骨质疏松起到有效作用。但是,随着用药疗程的延长,药效减弱、药物安全性以及药物对机体的不良反应渐渐引起人们的关注[2]–[3]。因此,寻找更为有效的治疗方案成为本领域的研究重点和热点。成骨细胞以及破骨细胞是骨骼系统中重要的细胞类型,直接参与并影响成年个体的骨骼重建。由成骨细胞介导的骨形成以及由破骨细胞介导的骨吸收共同调控着骨稳态;如果骨形成与骨吸收的平衡被打破,极易造成骨量丢失,进而导致骨质疏松的发生。因此,研究对成骨细胞和破骨细胞的分化、活性和功能的调控机制对于更好地了解骨质疏松的发病原理以及发现新的治疗方案至关重要。在研究细胞分化过程中,以往的研究大多集中于研究内分泌、旁分泌信号或者转录因子如何调控成骨、破骨细胞的特异基因表达水平,从而促进或是抑制其分化[4]–[7]。但是细胞分化过程中的另外一个重要特征往往被忽略,那就是细胞如何获得特定的生物学功能,比如成骨细胞沉积胶原、破骨细胞分泌蛋白酶等,这一过程涉及到大量的能量代谢调控;目前,对于这方面的研究还处于起步阶段[8]。这篇综述将总结目前能量代谢主要是葡萄糖代谢是如何调控成骨、破骨分化这一重要生物学过程的。
1. 葡萄糖代谢和成骨细胞
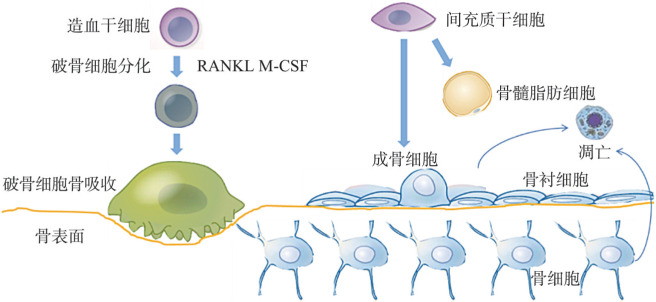
间充质干细胞经过一系列的分化过程最终分化成为成骨细胞,同时在不同阶段表达特异的分子标记物[4]。成骨细胞成熟后附着在骨表面,一些最终被包被在骨基质中成为骨细胞或者成为骨衬细胞,还有一部分发生凋亡,被机体代谢掉(图1)。目前,对于间充质干细胞以及前体细胞分化成为成骨细胞的调控机制研究,已经有了明显的进展,但是对于细胞水平上能量代谢如何影响成骨细胞生物学功能的研究还处于起步阶段。
图 1. 成骨细胞以及破骨细胞.
Fig 1 Osteoblasts and osteoclasts
众所周知,氧化磷酸化与糖酵解相比,可以产生更多的三磷酸腺苷(adenosine triphosphate,ATP)。但是研究表明,成骨细胞在氧气充足的情况下更倾向于使用有氧糖酵解方式将葡萄糖转化为乳酸[9],而不是使用三羧酸循环代谢葡萄糖。此现象最早在骨片培养和离体骨细胞培养中被检测到[10]–[12];后续研究[13]–[14]发现,颅盖骨前体细胞在β-甘油磷酸钠以及抗坏血酸联合促进成骨分化过程中,有氧糖酵解明显增强。有意思的是,在成熟的成骨细胞中存在更多的线粒体,但是这并没有改变细胞倾向于使用有氧糖酵解的频率[15]–[16]。近期研究[17]还发现,在成骨细胞中葡萄糖的有氧糖酵解反应产生能量占到80%左右,并且随着成骨细胞的成熟,线粒体呼吸反应逐渐减弱,有氧糖酵解成为主要的能量获取方式。这些数据证明,葡萄糖的代谢方式会发生明显的改变以适应细胞在分化过程中对能量的需求。但是目前,对于成骨细胞为何倾向于使用有氧糖酵解途径代谢葡萄糖仍然不清楚。很可能,有氧糖酵解途径产生更多的用于成骨细胞分化的中间代谢产物,这些产物有利于成骨细胞内活跃的合成反应。此外,糖酵解被证明可以有效降低氧化磷酸化中活性氧自由基(reactive oxygen species,ROS)的产生,有效地阻止了干细胞向脂肪细胞的分化过程[18]–[19]。另外一种可能是,有氧糖酵解过程直接改变了表观遗传修饰过程中的酶或是底物的水平[20]–[21],从而在干细胞定向分化中起到关键作用;例如,Wnt信号降低了细胞核内的柠檬酸以及乙酰辅酶A的水平,这也解释了为何Wnt可以大规模抑制组蛋白乙酰化水平,从而抑制间充质干细胞向脂肪、软骨方向的分化能力[22]。
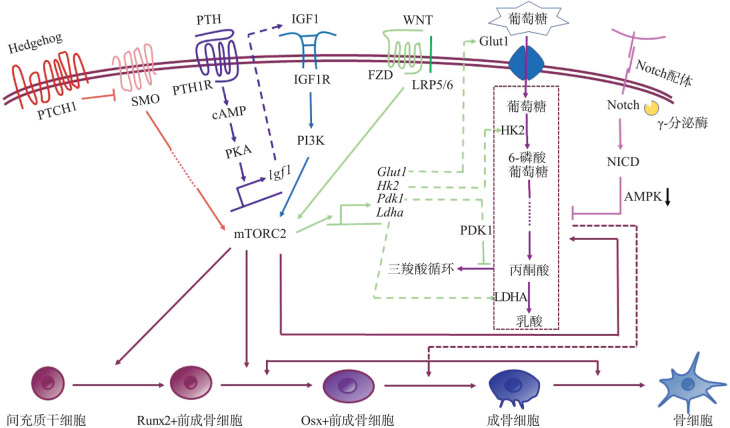
近期有越来越多的文章证明,有氧糖酵解在成骨向细胞中直接被多种关键的分子通路所调控。目前有文献指出,在治疗骨质疏松症中最为常用的药物——甲状旁腺激素(parathyroid hormone,PTH)类药物,可以促进骨片的葡萄糖吸收以及乳糖的产生[23]–[24]。在机制层面有文章[25]报道,PTH信号通路通过间接调控胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,Igf1r)增强有氧糖酵解,这一过程通过mTORC2介导;通过药物DCA降低有氧糖酵解水平,可以促进丙酮酸更多地进入三羧酸循环,从而抑制PTH对间充质干细胞成骨分化的促进作用以及PTH对骨量的增加效果。为了进一步阐述有氧糖酵解和骨形成之间的关系,科学家在小鼠体内过表达促进有氧糖酵解的低氧诱导因子(hypoxia inducible factor,Hif)1α,结果发现,这一操作明显地促进了骨形成;更为重要的是,注射DCA药物抑制有氧糖酵解的同时,显著的逆转了Hif1α引起的骨量增加,这一部分数据更加有力地证明了有氧糖酵解在体内对骨量增加的促进作用[26]。除了促骨形成的PTH通路之外,Wnt以及Notch等在骨发育中不可或缺的信号通路同样可以通过调控糖酵解,进而引起骨量的改变。Wnt家族蛋白是骨形成过程中研究最为全面的分子之一,Wnt3a-Lrp5信号级联反应,可以迅速地升高糖酵解过程中的转运蛋白以及催化酶,比如葡萄糖转运蛋白(glucose transporter,Glut)1、HK2、乳酸脱氢酶(lactate dehydrogenase,Ldh)a以及Pdk1等的mRNA和蛋白水平,并且这些基因被Wnt3a下游的mTORC2所调控。升高Glut1和HK2的表达水平可以提升有氧糖酵解的效率,同时Ldha以及Pdk1的升高有利于丙酮酸转化为乳糖,最终促进成骨细胞分化[27]。Notch家族被认为是控制细胞命运的重要信号,之前的研究[28]–[29]指出,Notch维持骨髓间充质干细胞群体,同时抑制干细胞的成骨分化。近期文献报道,通过Jagged1或是Notch2胞内部分(NICD)激活Notch通路,可以显著抑制骨髓间充质干细胞的葡萄糖代谢和成骨细胞分化;体内实验证明,特异的在四肢骨间充质干细胞中敲除Notch2可以增加有氧糖酵解以及骨形成。在机制层面,有研究[30]还揭示了Notch通过AMP依赖的蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)通路调控这一表型。另一个骨骼发育重要的调控分子Hedgehog通路被报道通过非经典途径,在肌肉和棕色脂肪组织中,促进了有氧糖酵解[31]。虽然Hedgehog对成骨细胞的糖代谢方式还没有明确研究,但是有工作[32]指出Hedgehog通路可以通过mTORC2促进骨形成;同时mTORC2又被多次报道是糖代谢途径中重要的调控因子。因此,研究Hedgehog在有氧糖酵解和骨形成中的调控机制,以及三者之间的关系,将对深入了解Hedgehog通路十分重要(图2)。
图 2. 成骨分化细胞信号通路与糖代谢.
Fig 2 Signal pathway of osteoblast differentiation cells and glucose metabolism
除了成骨细胞,终末分化的骨细胞生物学功能同样受到糖代谢的调控。骨细胞可以分泌骨钙素和核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL),前者对骨稳态维持至关重要,而后者则调控着破骨细胞的活性。最新研究指出,MLO-Y4-A2骨细胞系表达Glut1基因,并且骨细胞在Glut1抑制剂phloretin作用下,明显减少对葡萄糖的摄取,进而通过AMPK通路降低骨细胞骨钙素和RANKL的分泌量。这些数据提示,降低骨细胞葡萄糖摄取可以通过降低骨钙素表达以及抑制RANKL诱导的骨吸收来维持骨稳态[33]。
2. 葡萄糖代谢和破骨细胞
破骨细胞分化自造血细胞,是一种个体大、多细胞核、在体内负责吸收骨基质的细胞,同时也是维持骨稳态的主要细胞种类。巨噬细胞经过巨噬细胞克隆刺激因子(macrophage-colony stimulating factor,M-CSF)以及RANKL的作用逐渐分化成为破骨细胞[7](图1)。
不同于间充质干细胞的成骨分化,在RANKL刺激巨噬细胞向破骨前体细胞分化的过程中,氧化磷酸化以及有氧糖酵解都有明显增加[34]。此前研究[35]显示,氧化磷酸化被抑制会造成破骨前体细胞向成熟破骨细胞分化的阻滞。体内敲除参与氧化磷酸化的Ndufs4基因,可以有效阻止破骨细胞的分化,最终导致骨硬化病[36]。此外,利用Cathepsin K重组酶小鼠模型,特异性敲除线粒体转录因子A(mitochondrial transcription factor A,Tfam)明显地降低了破骨细胞的胞内ATP水平,同时促进了其凋亡[37]。
另一方面近期研究指出,破骨细胞成熟过程中有氧糖酵解的产物——乳酸也有明显增加;随后的体内实验证明,在破骨前体细胞中特异敲除Glut1基因,导致有氧糖酵解减弱,虽然氧化磷酸化水平无明显缺陷,但是这一敲除实验导致了破骨形成障碍[38]。并且,体内敲除有氧糖酵解重要的催化酶Ldha或者Ldhb,会减弱糖酵解和氧化磷酸化,引起破骨细胞形成障碍[39]。这些结果都说明,线粒体呼吸与糖酵解在破骨细胞分化这一过程中发生偶联反应,共同影响其分化与最终成熟。
到目前为止,葡萄糖不仅被认为是调控破骨细胞分化与形成的主要能量来源,而且对成熟的破骨细胞发挥其生物学功能也是十分重要的。早期研究[40]证明,鸡的破骨细胞需要葡萄糖作为能量来源发挥骨吸收的作用,在骨表面的成熟破骨细胞明显的增强了对葡萄糖的摄取量。随后,该实验室的科学家[41]同样使用鸡的破骨细胞作为研究对象,发现用于反映破骨细胞骨吸收活力的V-ATPase基因的蛋白和mRNA水平都有明显的增加。与成骨细胞类似,在培养基内减少葡萄糖或是在小鼠体内特异的敲除Hif1α都可以有效的降低破骨细胞的骨吸收能力[42]。免疫荧光研究[36]显示,一些糖酵解中重要的酶富集在破骨细胞极化反应后的细胞肌动蛋白环附近。这说明,不同于破骨细胞分化过程需要线粒体的氧化磷酸化、糖酵解以及其他代谢产物提供能量,成熟的破骨细胞更依赖活跃的糖酵解来发挥骨吸收的作用。但值得注意的是,在培养基中降低葡萄糖含量或是敲除Hif1α导致的糖酵解减弱,并不能导致破骨细胞形成异常。这说明,对于破骨细胞形成过程中能量来源,除了葡萄糖外,还有多种替代途径[42]。
3. 其他能量代谢与成骨、破骨细胞形成
3.1. 谷氨酰胺
在人类细胞质中,谷氨酰胺的浓度维持在500~750 µmol·L−1,是人体外周循环中最为丰富的氨基酸[43]。在作为蛋白质合成的主要参与者的同时,谷氨酰胺还作为机体中合成氨基酸、核酸、谷胱甘肽以及己糖胺等重要碳与氮原子的提供者[44]–[46]。尽管谷氨酰胺作为非必需氨基酸,机体可以合成,但是研究[47]证明其在肿瘤细胞中的代谢率远远高于其他的非必需氨基酸。到目前为止,越来越多的研究表明,谷氨酰胺的代谢在成骨细胞形成与功能中十分重要。起初,研究[48]发现,长骨和头盖骨碎片在培养状态中持续吸收谷氨酰胺;在随后的报道[49]中,谷氨酰胺被发现参与了颅骨前体细胞的基质钙化过程。更重要的是,使用同位素标记的谷氨酰胺进行示踪实验[50],发现其通过三羧酸循环转化为柠檬酸,进而促进了成骨前体细胞线粒体中的能量代谢。最新研究[51]显示,在骨骼干细胞向成骨细胞分化过程中,谷氨酰胺代谢后的α-酮戊二酸可以促进骨骼干细胞的氨基酸合成以及增殖;体内实验指出,特异的在骨骼干细胞中阻断谷氨酰胺代谢抑制骨形成并且增加骨髓脂肪含量。
在破骨分化过程中,首先科学家[52]发现低氧状态有利于破骨细胞对谷氨酰胺的吸收。随后有文献[42]报道,升高谷氨酰胺可以增强破骨细胞的形成能力;同时研究指出相比于分化的初期,谷氨酰胺对成熟过程中的破骨细胞更为重要。近期研究通过转录组学分析发现,谷氨酰胺代谢而来的α-酮戊二酸在上调Slc7a11(半胱氨酸/谷氨酸逆向转运蛋白亚基)的同时,降低破骨细胞特异基因的表达。在机制方面,α-酮戊二酸通过去除Slc7a11启动子区上抑制型组蛋白H3K9甲基化修饰,同时增加与Nrf2的结合,从而增加Slc7a11的表达。由于Slc7a11可以通过谷胱甘肽的输入抑制ROS的水平,因此文章中测定了细胞内ROS,发现RANKL诱导ROS的产生可以被α-酮戊二酸—Slc7a11通路所抑制。因此,谷氨酰胺代谢而来的α-酮戊二酸在破骨细胞形成的过程中起到负调控作用[53]。
3.2. 其他常见氨基酸
除了谷氨酰胺以外,其他的氨基酸也被证明参与了成骨细胞的分化。成骨分化的重要调控因子Atf4可以提升对氨基酸的摄取以及胶原的合成,在Atf4突变引起的Coffin-Lowry综合征患者体内,骨量与骨密度都明显降低[54]–[55]。在前体细胞中,精氨酸可以促进成骨分化[56];而亮氨酸、异亮氨酸以及缬氨酸的代谢虽然在成骨分化中没有明确报道,但是在成脂肪分化中起到关键作用[57]。这些结果证明,氨基酸代谢对于前体细胞定向分化不可或缺。
3.3. 脂肪酸
脂肪酸存在于循环系统中,包括骨髓血清中,其浓度依据不同组织会有差别[58]。脂肪酸一般认为是来源于机体储存的甘油三酯以及脂滴发生脂解作用后的产物,随后分泌到循环系统中;也有报道[59],过氧化物酶体可以合成一些长链的脂肪酸,而这些脂肪酸可以在成骨分化过程中促进细胞增殖。最终,脂肪酸在线粒体中发生降解并产生ATP,为成骨分化提供能力。有文献[60]报道,长链饱和脂肪酸,例如棕榈酸脂可以抑制颅骨前成骨细胞的分化;但是非饱和脂肪酸-油酸脂却可以缓解棕榈酸酯在成骨过程中的副作用[61]。体外实验[62]中,Wnt-Lrp5通路增强了脂肪酸的氧化反应,有利于成骨细胞的分化;体内实验[63]证明,给模式动物喂食长链非饱和脂肪酸有利于骨骼发育。在破骨形成方面,体外诱导模型中,非饱和脂肪酸通过FFAR4/β-arr2途径抑制破骨细胞分化[64]。在牙龈卟啉单胞菌诱导的小鼠牙周炎模型中,骨吸收加剧,破骨细胞活性增强,omega-3非饱和脂肪酸的摄取可以明显的降低破骨细胞的数目;omega-3非饱和脂肪酸的衍生物RvE1可以抑制破骨细胞体外分化[65]。去卵巢大鼠因为雌激素水平降低,表现为骨量下降,是常用的研究破骨细胞活性以及骨吸收能力的动物模型;在去卵巢大鼠体内抑制脂肪酸合成酶,可以有效降低破骨细胞的活性,减少骨量丢失[66]。这些结果阐述了脂肪酸在骨稳态维持中的重要性。
3.4. 丙酮酸
丙酮酸被认为是葡萄糖代谢中重要的中间产物,它通过线粒体丙酮酸转运体进入线粒体中,定向于线粒体内膜上,通过三羧酸循环产生烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)和还原型黄素二核苷酸(flavine adenine dinucleotide, reduced,FADH2)。在颅骨成骨前体细胞中,外源性地加入丙酮酸可以显著提升氧耗量,同时通过氧化磷酸化过程增加ATP的产量[17],[49]。这一过程不仅对成骨细胞分化与功能十分重要,并且也将有效提升破骨细胞的形成。在培养基中补充丙酮酸,在提高线粒体呼吸的同时,通过细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和RANKL通路协同促进破骨细胞形成[35];这一发现也被后续的体内研究[67]所证明,为小鼠连续注射丙酮酸,可以增加胫骨中破骨细胞数目以及活力。因此,丙酮酸代谢对破骨细胞介导的骨吸收以及成骨细胞介导的骨形成都是有利的。
4. 糖代谢异常与骨骼疾病的相关性
糖尿病常常伴随着复杂的骨骼疾病,比如骨密度降低、容易骨折以及骨折后修复迟缓等[68]。之前的报道大多关注糖尿病引起的成骨细胞异常以及骨形成缺陷,近期的研究[69]–[72]证明,骨吸收在糖尿病患者中也被发现有明显的改变。在糖尿病模式动物中,破骨细胞的增多以及骨吸收的增强很可能不是全身性的升糖反应直接导致,更可能是因为骨髓中的低氧诱导酸中毒所致[73]。除此之外,脂质以及蛋白质代谢产物会导致高血糖的发生,随后通过膜上糖基化终产物受体(receptor for advanced glycation endproducts,RAGE)蛋白加强骨吸收[74],而RAGE的激活会使得ROS积累,进而通过RANKL对破骨细胞的形成发挥正反馈的功能[75];同时ROS的增加反作用于成骨细胞,导致其分化受阻以及凋亡加剧[76]–[77]。
机体利用能量维持组织内稳态以及合成代谢活动,因此营养不良会导致全身代谢的显著变化。神经性食欲缺乏症的特征为机体能量供给不足,导致全身性的能量代谢紊乱、骨形成异常、易骨折等,但奇怪的是,破骨细胞介导的骨吸收作用却在这种症状中被发现有明显的增强,患有此类疾病的患者骨量减少,血糖降低,同时伴随有骨髓脂肪增多的现象[78]。激素的水平变化被认为是原因之一,在绝经的女性体内,雌激素的缺失不仅可以增加骨髓脂肪细胞的形成,还可以降低骨量。目前,对于在严重营养贫乏的情况下,前成骨细胞的能量代谢调控机制仍然不明;并且这种在营养缺失严重情况下的脂肪增多现象是否由于能量代谢异常导致前体细胞从成骨向分化转为成脂肪向分化,也有待研究。
5. 总结
恰当的能量代谢方式和调控程序对于骨骼发育以及稳态维持中的各种细胞都是不可或缺的;同时代谢中涉及到的各种产生能量的底物在细胞分化的不同阶段使用效率也各不相同。据报道,成骨细胞形成过程中的葡萄糖代谢是能量供给最主要的来源,并且Wnt、胰岛素样生长因子、Notch以及PTH等通路都被报道可以调控这一过程。破骨细胞形成与发挥功能同样受到糖代谢的调控,并且不同阶段使用糖代谢方式亦不相同。除此之外,尽管关于氨基酸、脂肪酸以及柠檬酸等营养分子对成骨、破骨细胞形成有初步探讨,但是仍有很多细节有待研究。
阻碍骨骼系统中能量代谢方面研究进程的原因很多,其中最为重要的是科学家很难在体外模拟骨髓中的微环境。体外人为模拟的分化条件虽然已为本领域的研究做出重大贡献,但是营养物质之间的代偿作用以及细胞在不同的分化阶段利用的营养物质比例并不相同等因素都无法在体外模拟出来。在研究例如糖尿病等代谢疾病的过程中,科学家发现,糖尿病模型中的成骨细胞使用能量以及利用营养物质的方式发生明显改变;报道也指出在使用药物治疗糖尿病的同时,成骨细胞使用能量的方式也随即发生变化。这些结果都提示,成骨细胞以及破骨细胞在能量代谢过程中都可以十分巧妙的依据微环境中当时存在的营养物质进行代谢过程,以确保其正常的生理功能。今后,对于其他骨相关细胞,比如骨细胞、骨衬细胞以及骨髓脂肪细胞等在能量代谢方面的深入探讨,将丰富对骨骼系统的认识,也将成为今后本领域的重点之一。除此之外,更为先进的科学仪器以及更加精准的测量方式将为科研工作提供更为准确的数据,也是推动领域进步的重要环节。依靠这些技术以及基础知识,希望今后可以将骨骼系统细胞的能量代谢研究应用于骨相关疾病的临床治疗和药物开发中。
专家简介
石玉,研究员,2011年毕业于中国科学院上海生命科学研究院并获得博士学位,2011—2018年在美国圣路易斯华盛顿大学骨外科从事研究工作,2018—2019年在美国宾夕法尼亚大学费城儿童医院骨外科从事研究工作,2019年10月至今在四川大学华西口腔医院口腔疾病研究国家重点实验室从事研究工作。入选国家“海外高层次人才引进计划”(第十六批);第十四批四川省卫生健康委员会学术技术带头人后备人选。主要研究方向包括:1)骨骼发育生物学,主要研究Indian Hedgehog分子通路与骨骼发育的关系,以及Indian Hedgehog分子通路对间充质干细胞分化的影响;2)通过单细胞测序与谱系追踪技术鉴定骨骼间充质干细胞。先后以第一作者或通信作者身份在Nature Communications、Proceedings of the National Academy of Sciences of the United States of America、Cell Reports、eLife等杂志上发表SCI论文。

Funding Statement
[基金项目] 国家自然科学基金面上项目(82071091);四川省科技厅中央引导地方科技发展专项资金(2020ZYD001);四川大学华西口腔医院引进人才科研启动经费(QDJF2019-2)
Supported by: The National Natural Science Foundation of China (82071091); Sichuan Science and Technology Program (2020ZYD001); The Scientific Research Foundation for Recruited Talents-West China Hospital of Stomatology, Sichuan University (QDJF2019-2).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Zeng Q, Li N, Wang QQ, et al. The prevalence of osteoporosis in China, a nationwide, multicenter DXA survey[J] J Bone Miner Res. 2019;34(10):1789–1797. doi: 10.1002/jbmr.3757. [DOI] [PubMed] [Google Scholar]
- 2.Davis S, Martyn-St James M, Sanderson J, et al. A systematic review and economic evaluation of bisphosphonates for the prevention of fragility fractures[J] Health Technol Assess. 2016;20(78):1–406. doi: 10.3310/hta20780. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Lv F, Cai XL, Yang WJ, et al. Denosumab or romosozumab therapy and risk of cardiovascular events in patients with primary osteoporosis: systematic review and Meta-analysis[J] Bone. 2020;130:115121. doi: 10.1016/j.bone.2019.115121. [DOI] [PubMed] [Google Scholar]
- 4.Long FX. Building strong bones: molecular regulation of the osteoblast lineage[J] Nat Rev Mol Cell Biol. 2011;13(1):27–38. doi: 10.1038/nrm3254. [DOI] [PubMed] [Google Scholar]
- 5.Karsenty G, Kronenberg HM, Settembre C. Genetic control of bone formation[J] Annu Rev Cell Dev Biol. 2009;25:629–648. doi: 10.1146/annurev.cellbio.042308.113308. [DOI] [PubMed] [Google Scholar]
- 6.Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation[J] Nature. 2003;423(6937):337–342. doi: 10.1038/nature01658. [DOI] [PubMed] [Google Scholar]
- 7.Teitelbaum SL. Bone resorption by osteoclasts[J] Science. 2000;289(5484):1504–1508. doi: 10.1126/science.289.5484.1504. [DOI] [PubMed] [Google Scholar]
- 8.Lee WC, Guntur AR, Long FX, et al. Energy metabolism of the osteoblast: implications for osteoporosis[J] Endocr Rev. 2017;38(3):255–266. doi: 10.1210/er.2017-00064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Esen E, Long FX. Aerobic glycolysis in osteoblasts[J] Curr Osteoporos Rep. 2014;12(4):433–438. doi: 10.1007/s11914-014-0235-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Felix R, Neuman WF, Fleisch H. Aerobic glycolysis in bone: lactic acid production by rat calvaria cells in culture[J] Am J Physiol. 1978;234(1):C51–C55. doi: 10.1152/ajpcell.1978.234.1.C51. [DOI] [PubMed] [Google Scholar]
- 11.Neuman WF, Neuman MW, Brommage R. Aerobic glycolysis in bone: lactate production and gradients in calvaria[J] Am J Physiol. 1978;234(1):C41–C50. doi: 10.1152/ajpcell.1978.234.1.C41. [DOI] [PubMed] [Google Scholar]
- 12.Borle AB, Nichols N, Nichols G., Jr Metabolic studies of bone in vitro. I. Normal bone[J] J Biol Chem. 1960;235:1206–1210. [PubMed] [Google Scholar]
- 13.Guntur AR, Le PT, Farber CR, et al. Bioenergetics during calvarial osteoblast differentiation reflect strain differences in bone mass[J] Endocrinology. 2014;155(5):1589–1595. doi: 10.1210/en.2013-1974. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Komarova SV, Ataullakhanov FI, Globus RK. Bioenergetics and mitochondrial transmembrane potential during differentiation of cultured osteoblasts[J] Am J Physiol Cell Physiol. 2000;279(4):C1220–C1229. doi: 10.1152/ajpcell.2000.279.4.C1220. [DOI] [PubMed] [Google Scholar]
- 15.Klein BY, Gal I, Hartshtark Z, et al. Induction of osteoprogenitor cell differentiation in rat marrow stroma increases mitochondrial retention of rhodamine 123 in stromal cells[J] J Cell Biochem. 1993;53(3):190–197. doi: 10.1002/jcb.240530303. [DOI] [PubMed] [Google Scholar]
- 16.Passi-Even L, Gazit D, Bab I. Ontogenesis of ultrastructural features during osteogenic differentiation in diffusion chamber cultures of marrow cells[J] J Bone Miner Res. 1993;8(5):589–595. doi: 10.1002/jbmr.5650080510. [DOI] [PubMed] [Google Scholar]
- 17.Lee WC, Ji X, Nissim I, et al. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts[J] Cell Rep. 2020;32(10):108108. doi: 10.1016/j.celrep.2020.108108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Tormos KV, Anso E, Hamanaka RB, et al. Mitochondrial complex Ⅲ ROS regulate adipocyte differentiation[J] Cell Metab. 2011;14(4):537–544. doi: 10.1016/j.cmet.2011.08.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Wang WM, Zhang Y, Lu WY, et al. Mitochondrial reactive oxygen species regulate adipocyte differentiation of mesenchymal stem cells in hematopoietic stress induced by arabinosylcytosine[J] PLoS One. 2015;10(3):e0120629. doi: 10.1371/journal.pone.0120629. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Carey BW, Finley LW, Cross JR, et al. Intracellular α-ketoglutarate maintains the pluripotency of embryonic stem cells[J] Nature. 2015;518(7539):413–416. doi: 10.1038/nature13981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Wellen KE, Hatzivassiliou G, Sachdeva UM, et al. ATP-citrate lyase links cellular metabolism to histone acetylation[J] Science. 2009;324(5930):1076–1080. doi: 10.1126/science.1164097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Karner CM, Esen E, Chen JK, et al. Wnt protein signaling reduces nuclear acetyl-CoA levels to suppress gene expression during osteoblast differentiation[J] J Biol Chem. 2016;291(25):13028–13039. doi: 10.1074/jbc.M115.708578. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Rodan GA, Rodan SB, Marks SC., Jr Parathyroid hormone stimulation of adenylate cyclase activity and lactic acid accumulation in Calvaria of osteopetrotic (ia) rats[J] Endocrinology. 1978;102(5):1501–1505. doi: 10.1210/endo-102-5-1501. [DOI] [PubMed] [Google Scholar]
- 24.Nichols FC, Neuman WF. Lactic acid production in mouse calvaria in vitro with and without parathyroid hormone stimulation: lack of acetazolamide effects[J] Bone. 1987;8(2):105–109. doi: 10.1016/8756-3282(87)90078-0. [DOI] [PubMed] [Google Scholar]
- 25.Esen E, Lee SY, Wice BM, et al. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling[J] J Bone Miner Res. 2015;30(11):2137. doi: 10.1002/jbmr.2714. [DOI] [PubMed] [Google Scholar]
- 26.Regan JN, Lim J, Shi Y, et al. Up-regulation of glycolytic metabolism is required for HIF1α-driven bone formation[J] Proc Natl Acad Sci U S A. 2014;111(23):8673–8678. doi: 10.1073/pnas.1324290111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Esen E, Chen JQ, Karner CM, et al. WNT-LRP5 signaling induces Warburg effect through mTORC2 activation during osteoblast differentiation[J] Cell Metab. 2013;17(5):745–755. doi: 10.1016/j.cmet.2013.03.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Tu XL, Chen JQ, Lim J, et al. Physiological notch signaling maintains bone homeostasis via RBPjk and Hey upstream of NFATc1[J] PLoS Genet. 2012;8(3):e1002577. doi: 10.1371/journal.pgen.1002577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Hilton MJ, Tu XL, Wu XM, et al. Notch signaling maintains bone marrow mesenchymal progenitors by suppressing osteoblast differentiation[J] Nat Med. 2008;14(3):306–314. doi: 10.1038/nm1716. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Lee SY, Long FX. Notch signaling suppresses glucose metabolism in mesenchymal progenitors to restrict osteoblast differentiation[J] J Clin Invest. 2018;128(12):5573–5586. doi: 10.1172/JCI96221. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Teperino R, Amann S, Bayer M, et al. Hedgehog partial agonism drives Warburg-like metabolism in muscle and brown fat[J] Cell. 2012;151(2):414–426. doi: 10.1016/j.cell.2012.09.021. [DOI] [PubMed] [Google Scholar]
- 32.Shi Y, Chen JQ, Karner CM, et al. Hedgehog signaling activates a positive feedback mechanism involving insulin-like growth factors to induce osteoblast differentiation[J] Proc Natl Acad Sci U S A. 2015;112(15):4678–4683. doi: 10.1073/pnas.1502301112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Takeno A, Kanazawa I, Notsu M, et al. Glucose uptake inhibition decreases expressions of receptor activator of nuclear factor-kappa B ligand (RANKL) and osteocalcin in osteocytic MLO-Y4-A2 cells[J] Am J Physiol Endocrinol Metab. 2018;314(2):E115–E123. doi: 10.1152/ajpendo.00159.2017. [DOI] [PubMed] [Google Scholar]
- 34.Lemma S, Sboarina M, Porporato PE, et al. Energy metabolism in osteoclast formation and activity[J] Int J Biochem Cell Biol. 2016;79:168–180. doi: 10.1016/j.biocel.2016.08.034. [DOI] [PubMed] [Google Scholar]
- 35.Kim JM, Jeong D, Kang HK, et al. Osteoclast precursors display dynamic metabolic shifts toward accelerated glucose metabolism at an early stage of RANKL-stimulated osteoclast differentiation[J] Cell Physiol Biochem. 2007;20(6):935–946. doi: 10.1159/000110454. [DOI] [PubMed] [Google Scholar]
- 36.Jin ZX, Wei W, Yang M, et al. Mitochondrial complex Ⅰ activity suppresses inflammation and enhances bone resorption by shifting macrophage-osteoclast polarization[J] Cell Metab. 2014;20(3):483–498. doi: 10.1016/j.cmet.2014.07.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Miyazaki T, Iwasawa M, Nakashima T, et al. Intracellular and extracellular ATP coordinately regulate the inverse correlation between osteoclast survival and bone resorption[J] J Biol Chem. 2012;287(45):37808–37823. doi: 10.1074/jbc.M112.385369. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Li BE, Lee WC, Song C, et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation[J] FASEB J. 2020;34(8):11058–11067. doi: 10.1096/fj.202000771R. [DOI] [PubMed] [Google Scholar]
- 39.Ahn H, Lee K, Kim JM, et al. Accelerated lactate dehydrogenase activity potentiates osteoclastogenesis via NFATc1 signaling[J] PLoS One. 2016;11(4):e0153886. doi: 10.1371/journal.pone.0153886. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Williams JP, Blair HC, McDonald JM, et al. Regulation of osteoclastic bone resorption by glucose[J] Biochem Biophys Res Commun. 1997;235(3):646–651. doi: 10.1006/bbrc.1997.6795. [DOI] [PubMed] [Google Scholar]
- 41.Larsen KI, Falany ML, Ponomareva LV, et al. Glucose-dependent regulation of osteoclast H(+)-ATPase expression: potential role of p38 MAP-kinase[J] J Cell Biochem. 2002;87(1):75–84. doi: 10.1002/jcb.10252. [DOI] [PubMed] [Google Scholar]
- 42.Indo Y, Takeshita S, Ishii KA, et al. Metabolic regulation of osteoclast differentiation and function[J] J Bone Miner Res. 2013;28(11):2392–2399. doi: 10.1002/jbmr.1976. [DOI] [PubMed] [Google Scholar]
- 43.Walsh NP, Blannin AK, Robson PJ, et al. Glutamine, exercise and immune function. Links and possible mechanisms[J] Sports Med. 1998;26(3):177–191. doi: 10.2165/00007256-199826030-00004. [DOI] [PubMed] [Google Scholar]
- 44.Stegen S, van Gastel N, Eelen G, et al. HIF-1α promotes glutamine-mediated redox homeostasis and glycogen-dependent bioenergetics to support postimplantation bone cell survival[J] Cell Metab. 2016;23(2):265–279. doi: 10.1016/j.cmet.2016.01.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Wise DR, Thompson CB. Glutamine addiction: a new therapeutic target in cancer[J] Trends Biochem Sci. 2010;35(8):427–433. doi: 10.1016/j.tibs.2010.05.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Slawson C, Copeland RJ, Hart GW. O-GlcNAc signaling: a metabolic link between diabetes and cancer[J] Trends Biochem Sci. 2010;35(10):547–555. doi: 10.1016/j.tibs.2010.04.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Reitzer LJ, Wice BM, Kennell D. Evidence that glutamine, not sugar, is the major energy source for cultured HeLa cells[J] J Biol Chem. 1979;254(8):2669–2676. [PubMed] [Google Scholar]
- 48.Biltz RM, Letteri JM, Pellegrino ED, et al. Glutamine metabolism in bone[J] Miner Electrolyte Metab. 1983;9(3):125–131. [PubMed] [Google Scholar]
- 49.Brown PM, Hutchison JD, Crockett JC. Absence of glutamine supplementation prevents differentiation of murine calvarial osteoblasts to a mineralizing phenotype[J] Calcif Tissue Int. 2011;89(6):472–482. doi: 10.1007/s00223-011-9537-6. [DOI] [PubMed] [Google Scholar]
- 50.Karner CM, Esen E, Okunade AL, et al. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling[J] J Clin Invest. 2015;125(2):551–562. doi: 10.1172/JCI78470. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Yu YL, Newman H, Shen LY, et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells[J] Cell Metab. 2019;29(4):966–978.e4. doi: 10.1016/j.cmet.2019.01.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Morten KJ, Badder L, Knowles HJ. Differential regulation of HIF-mediated pathways increases mitochondrial metabolism and ATP production in hypoxic osteoclasts[J] J Pathol. 2013;229(5):755–764. doi: 10.1002/path.4159. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Lee S, Kim HS, Kim MJ, et al. Glutamine metabolite α-ketoglutarate acts as an epigenetic co-factor to interfere with osteoclast differentiation[J] Bone. 2021;145:115836. doi: 10.1016/j.bone.2020.115836. [DOI] [PubMed] [Google Scholar]
- 54.Yang XL, Matsuda K, Bialek P, et al. ATF4 is a substrate of RSK2 and an essential regulator of osteoblast biology; implication for Coffin-Lowry Syndrome[J] Cell. 2004;117(3):387–398. doi: 10.1016/s0092-8674(04)00344-7. [DOI] [PubMed] [Google Scholar]
- 55.Elefteriou F, Benson MD, Sowa H, et al. ATF4 mediation of NF1 functions in osteoblast reveals a nutritional basis for congenital skeletal dysplasiae[J] Cell Metab. 2006;4(6):441–451. doi: 10.1016/j.cmet.2006.10.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Chevalley T, Rizzoli R, Manen D, et al. Arginine increases insulin-like growth factor-I production and collagen synthesis in osteoblast-like cells[J] Bone. 1998;23(2):103–109. doi: 10.1016/s8756-3282(98)00081-7. [DOI] [PubMed] [Google Scholar]
- 57.Green CR, Wallace M, Divakaruni AS, et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis[J] Nat Chem Biol. 2016;12(1):15–21. doi: 10.1038/nchembio.1961. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Pino AM, Miranda M, Figueroa C, et al. Qualitative aspects of bone marrow adiposity in osteoporosis[J] Front Endocrinol (Lausanne) 2016;7:139. doi: 10.3389/fendo.2016.00139. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Qian GF, Fan W, Ahlemeyer B, et al. Peroxisomes in different skeletal cell types during intramembranous and endochondral ossification and their regulation during osteoblast differentiation by distinct peroxisome proliferator-activated receptors[J] PLoS One. 2015;10(12):e01–43439. doi: 10.1371/journal.pone.0143439. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Yeh LC, Ford JJ, Lee JC, et al. Palmitate attenuates osteoblast differentiation of fetal rat calvarial cells[J] Biochem Biophys Res Commun. 2014;450(1):777–781. doi: 10.1016/j.bbrc.2014.06.063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Gunaratnam K, Vidal C, Boadle R, et al. Mechanisms of palmitate-induced cell death in human osteoblasts[J] Biol Open. 2013;2(12):1382–1389. doi: 10.1242/bio.20136700. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Frey JL, Li Z, Ellis JM, et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast[J] Mol Cell Biol. 2015;35(11):1979–1991. doi: 10.1128/MCB.01343-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Lau BY, Cohen DJ, Ward WE, et al. Investigating the role of polyunsaturated fatty acids in bone development using animal models[J] Molecules. 2013;18(11):14203–14227. doi: 10.3390/molecules181114203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Kasonga AE, Kruger MC, Coetzee M. Free fatty acid receptor 4-β-arrestin 2 pathway mediates the effects of different classes of unsaturated fatty acids in osteoclasts and osteoblasts[J] Biochim Biophys Acta Mol Cell Biol Lipids. 2019;1864(3):281–289. doi: 10.1016/j.bbalip.2018.12.009. [DOI] [PubMed] [Google Scholar]
- 65.Ozaki Y, Morozumi T, Watanabe K, et al. Inhibitory effect of omega-3 fatty acids on alveolar bone resorption and osteoclast differentiation[J] J Oral Sci. 2020;62(3):298–302. doi: 10.2334/josnusd.19-0267. [DOI] [PubMed] [Google Scholar]
- 66.Bermeo S, Al Saedi A, Vidal C, et al. Treatment with an inhibitor of fatty acid synthase attenuates bone loss in ovariectomized mice[J] Bone. 2019;122:114–122. doi: 10.1016/j.bone.2019.02.017. [DOI] [PubMed] [Google Scholar]
- 67.Fong JE, Le Nihouannen D, Tiedemann K, et al. Moderate excess of pyruvate augments osteoclastogenesis[J] Biol Open. 2013;2(4):387–395. doi: 10.1242/bio.20133269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Lecka-Czernik B, Rosen CJ. Energy excess, glucose utilization, and skeletal remodeling: new insights[J] J Bone Miner Res. 2015;30(8):1356–1361. doi: 10.1002/jbmr.2574. [DOI] [PubMed] [Google Scholar]
- 69.Verhaeghe J, Visser WJ, Einhorn TA, et al. Osteoporosis and diabetes: lessons from the diabetic BB rat[J] Horm Res. 1990;34(5-6):245–248. doi: 10.1159/000181834. [DOI] [PubMed] [Google Scholar]
- 70.Verhaeghe J, Suiker AM, Visser WJ, et al. The effects of systemic insulin, insulin-like growth factor-I and growth hormone on bone growth and turnover in spontaneously diabetic BB rats[J] J Endocrinol. 1992;134(3):485–492. doi: 10.1677/joe.0.1340485. [DOI] [PubMed] [Google Scholar]
- 71.Shires R, Teitelbaum SL, Bergfeld MA, et al. The effect of streptozotocin-induced chronic diabetes mellitus on bone and mineral homeostasis in the rat[J] J Lab Clin Med. 1981;97(2):231–240. [PubMed] [Google Scholar]
- 72.Goodman WG, Hori MT. Diminished bone formation in experimental diabetes. Relationship to osteoid maturation and mineralization[J] Diabetes. 1984;33(9):825–831. doi: 10.2337/diab.33.9.825. [DOI] [PubMed] [Google Scholar]
- 73.Reni C, Mangialardi G, Meloni M, et al. Diabetes stimulates osteoclastogenesis by acidosis-induced activation of transient receptor potential cation channels[J] Sci Rep. 2016;6:30639. doi: 10.1038/srep30639. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Zhou Z, Immel D, Xi CX, et al. Regulation of osteoclast function and bone mass by RAGE[J] J Exp Med. 2006;203(4):1067–1080. doi: 10.1084/jem.20051947. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Goettsch C, Babelova A, Trummer O, et al. NADPH oxidase 4 limits bone mass by promoting osteoclastogenesis[J] J Clin Invest. 2013;123(11):4731–4738. doi: 10.1172/JCI67603. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Chen CT, Shih YR, Kuo TK, et al. Coordinated changes of mitochondrial biogenesis and antioxidant enzymes during osteogenic differentiation of human mesenchymal stem cells[J] Stem Cells. 2008;26(4):960–968. doi: 10.1634/stemcells.2007-0509. [DOI] [PubMed] [Google Scholar]
- 77.Almeida M, Han L, Martin-Millan M, et al. Oxidative stress antagonizes Wnt signaling in osteoblast precursors by diverting β-catenin from T cell factor- to forkhead box O-mediated transcription[J] J Biol Chem. 2007;282(37):27298–27305. doi: 10.1074/jbc.M702811200. [DOI] [PubMed] [Google Scholar]
- 78.Rosen CJ, Klibanski A. Bone, fat, and compositionbody: evolving concepts in the pathogenesis of osteoporosis[J] Am J Med. 2009;122(5):409–414. doi: 10.1016/j.amjmed.2008.11.027. [DOI] [PubMed] [Google Scholar]