Abstract
目的
探讨广谱抗生素疗程对极低出生体重儿粪便肠道菌群和短链脂肪酸的影响。
方法
前瞻性选取2020年6~12月重庆医科大学附属儿童医院新生儿诊治中心收治的29例极低出生体重儿为研究对象,根据抗生素疗程分为≤7 d组(n=9)和>7 d组(n=20)。采集患儿住院第14天和第28天的粪便标本,运用16S rDNA高通量测序法和气相色谱-质谱法分别分析粪便样本的菌群和短链脂肪酸。
结果
≤7 d组和>7 d组早产儿第4周和第2周相比,肠道菌群的Chao指数均显著下降(P<0.05)。≤7 d组第4周菌群与第2周相比,厚壁菌门和狭窄梭菌属1的比例均显著升高,而变形菌门显著降低(P<0.05)。第4周时,>7 d组厚壁菌门和狭窄梭菌属1的比例较≤7 d组显著降低而变形菌门显著升高(P<0.05);>7 d组异丁酸和戊酸含量较≤7 d组显著下降(P<0.05)。
结论
广谱抗生素疗程可影响极低出生体重儿肠道菌群的丰富度、定植和演化,以及其代谢产物短链脂肪酸的含量。临床上应该严格把握广谱抗生素适应证及疗程。
Keywords: 广谱抗生素, 肠道菌群, 短链脂肪酸, 极低出生体重儿
Abstract
Objective
To study the effect of the course of treatment with broad-spectrum antibiotics on intestinal flora and short-chain fatty acids (SCFAs) in feces of very low birth weight (VLBW) infants.
Methods
A total of 29 VLBW infants who were admitted to the Neonatal Diagnosis and Treatment Center of Children's Hospital Affiliated to Chongqing Medical University from June to December 2020 were enrolled as subjects for this prospective study. According to the course of treatment with broad-spectrum antibiotics, they were divided into two groups: ≤7 days (n=9) and >7 days (n=20). Fecal samples were collected on days 14 and 28 of hospitalization, and 16S rDNA high-throughput sequencing and gas chromatography-mass spectrometry were used to analyze the flora and SCFAs in fecal samples.
Results
There was a significant reduction in Chao index of the intestinal flora in the ≤7 days group and the >7 days group from week 2 to week 4 (P<0.05). In the ≤7 days group, there were significant increases in the proportions of Firmicutes and Clostridium_sensu_stricto_1 and a significant reduction in the proportion of Proteobacteria from week 2 to week 4 (P<0.05). At week 4, compared with the ≤7 days group, the >7 days group had significant reductions in the proportions of Firmicutes and Clostridium_sensu_stricto_1 and a significant increase in the proportion of Proteobacteria (P<0.05), as well as significant reductions in the content of isobutyric acid and valeric acid (P<0.05).
Conclusions
The course of treatment with broad-spectrum antibiotics can affect the abundance, colonization, and evolution of intestinal flora and the content of their metabolites SCFAs in VLBW infants. The indication and treatment course for broad-spectrum antibiotics should be strictly controlled in clinical practice.
Keywords: Broad-spectrum antibiotics, Intestinal flora, Short-chain fatty acid, Very low birth weight infant
人类肠道与共生微生物之间的相互作用可能是人体中最多样化的,其中细菌占较大比例。不同种类的细菌在宿主免疫系统成熟、肠道屏障功能和人类疾病中起着关键作用[1-2]。相较于正常出生体重儿,低出生体重儿肠道菌群的组成丰富度和多样性降低[3]。研究表明经验性使用抗生素会增加早产儿视网膜病变、坏死性小肠结肠炎[4]、晚发型败血症的发病率;同时影响远期预后,如生长障碍、肥胖、过敏和自身免疫性疾病的风险增加[5]。
一方面,抗生素的使用会导致肠道菌群失衡和多样性减少,缺乏有益的双歧杆菌属和狭窄梭菌属1[6],同时机会致病菌肠杆菌科、肠球菌和葡萄球菌增加[7]。另一方面,抗生素的使用会影响肠道菌群代谢产物短链脂肪酸(short-chain fatty acids,SCFAs)含量。SCFAs与多种疾病状态的发生发展密切相关,如炎症性肠病、1型糖尿病和非酒精性脂肪肝等[8]。
目前针对极低出生体重儿(very low birth weight infant,VLBWI)的相关研究,大多着眼于抗生素干预对肠道菌群的影响,研究结果显示抗生素治疗会降低肠道菌群的多样性并且增加有害菌[9]。Arboleya等[10]探讨了抗生素疗程后菌群及3种SCFAs含量的改变,本研究拟进一步探讨广谱抗生素疗程对VLBWI肠道细菌群落及大部分SCFAs的影响,并分析菌群与SCFAs之间的关联。为合理使用广谱抗生素提供科学依据,为进一步研究提供切入点。
1. 资料与方法
1.1. 研究对象
前瞻性选取2020年6~12月重庆医科大学附属儿童医院新生儿诊治中心收治的29例VLBWI为研究对象。纳入标准:(1)患儿出生24 h内直接入住我科者;(2)胎龄<30周且出生体重<1 500 g者;(3)入院后因伴有感染、早产、母孕期高危因素并入住新生儿重症监护室,使用广谱抗生素治疗者。所有纳入对象根据血培养结果决定是否停用抗生素。排除标准:(1)住院期间死亡和放弃治疗者;(2)合并先天性消化道畸形(如先天性肠闭锁、先天性巨结肠、肠旋转不良等);(3)未完成肠道菌群、SCFAs测定者;(4)不愿参加本研究者。
本研究已经获得重庆医科大学附属儿童医院伦理委员会批准(No.2021-18)。参与这项试验新生儿的父母已经签署知情同意书。
1.2. 分组
按抗生素疗程分为≤7 d组[出生后经验性使用了青霉素+头孢菌素类药物(总使用时间≤7 d)]和>7 d组[根据病情所需要,联用了青霉素+头孢菌素,或糖肽/碳青霉烯类药物(总使用时间>7 d但≤28 d)]。本研究两组使用的抗生素均为广谱抗生素,均为杀菌剂。
1.3. 标本采集
采用专用一次性粪便收集管收集两组患儿住院后第14天和第28天粪便标本;立刻分装,-80℃保存,备检。早产儿肠道菌群具有多样性低和稳定性差的特点,抗生素的治疗及疗程持续时间对肠道菌群有影响[9]。为给予抗生素反应时间以获得较稳定的菌群及代谢结果,本研究仅在VLBWI第2周龄和第4周龄检测了粪便菌群和SCFAs。
1.4. 粪便样本微生物群分析
使用QIAamp快速DNA粪便试剂盒(Qiagen,德国),按照制造商的说明书提取储存的粪便标本的微生物基因组DNA。用1%琼脂糖凝胶检测DNA提取液。16S rDNA基因的V3+V4区域用指定引物放大。扩增过程:变性(95°C下3 min,95°C下30 s)、退火(55°C下30 s)、延伸(72°C下45 s)持续27个循环和额外延伸(72°C下10 min)。扩增产物经2%琼脂糖凝胶电泳分离,使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences)进行回收,并使用Quantus™ 荧光仪(Promega,USA)进行定量。在Illumina MiSeq相关平台上建立数据库并进行测序。将质量分数<20的碱基和长度为>10 bp的重叠序列删除。在拼接序列的重叠区域,删除超过最大错配率0.2的读数。利用Uparse(7.1版)将处理后的序列划分为操作分类单元(operational taxonomic units,OTU),以97%的相似性阈值与OTU进行生物信息学聚类分析,对菌群数据进行Alpha多样性分析(肠道菌群中物种的丰富度、多样性分别用Chao指数值和Shannon指数值来体现,其中Chao指数值与菌群丰富度成正比,Shannon指数值与菌群多样性成正比[11])和群落组成分析。
1.5. 粪便样本短链脂肪酸分析
取100 mg粪便样本至2 mL研磨管中,加入研磨珠,加入900 μL甲醇和100 μL的内标(甲醇配制的1 000 μg/mL的2-乙基丁酸),冷冻研磨仪50 Hz研磨3 min,2次。冰水浴30 min,-20℃静置30 min,13 000 g(4℃)离心15 min。将上清液转移到1.5 mL离心管中。加入50 mg无水硫酸钠,涡旋,13 000 g(4℃)离心15 min。取上清液运用安捷伦公司(Agilent Technologies Inc. CA,USA)的8890B-5977B GC/MSD气质联用仪检测。最后用Masshunter定量软件(美国Agilent公司,版本号:v10.0.707.0)对目标SCFAs(乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、己酸、异己酸)进行自动识别和集成。通过标准曲线计算各样品的SCFAs含量。
1.6. 统计学分析
所有数据采用SPSS 24.0软件进行统计学分析。正态分布的计量资料用均数±标准差(±s)表示,组间比较采用两样本t检验,组内比较采用配对t检验。非正态分布的计量资料用中位数和四分位数间距[M(P 25,P 75)]表示,组间比较采用Mann-Whitney U检验,组内比较采用Wilcoxon符号秩和检验。计数资料采用例数和率(%)表示,组间比较采用Fisher确切概率法。采用Spearman秩相关分析变量之间的相关性。P<0.05差异有统计学意义。
2. 结果
2.1. 临床特征
2020年6~12月本中心共收治60例VLBWI,其中住院期间死亡和放弃治疗者7例,先天性消化道畸形9例,未完成肠道菌群和SCFAs测定者5例,不愿参加本研究者10例,最终共纳入29例VLBWI。抗生素疗程≤7 d组(n=9)和>7 d组(n=20)成功入组,所有入组患儿均母乳喂养。两组VLBWI性别、胎龄、出生体重、入院年龄、住院时间、出生方式、胎膜早破、羊水污染、宫内窘迫、Apgar评分、喂养方式、中心静脉置管持续时间,以及喂养不耐受、坏死性小肠结肠炎、新生儿败血症、化脓性脑膜炎发生率等比较,差异均无统计学意义(P>0.05)。见表1。
表1.
两组不同抗生素疗程VLBWI临床指标对比
| 项目 | ≤7 d组 (n=9) | >7 d组 (n=20) | Z/t值 | P值 |
|---|---|---|---|---|
| 性别 (男/女, 例) | 4/5 | 12/8 | - | 0.688 |
| 胎龄 [M(P 25, P 75), 周] | 29.1(28.7, 29.7) | 28.5(28.0, 29.4) | -1.28 | 0.216 |
| 出生体重 (, g) | 1 134±173 | 1 141±198 | -0.09 | 0.927 |
| 入院年龄 [M(P 25, P 75), h] | 2.0(1.0, 2.0) | 1.9(1.0, 3.0) | -0.52 | 0.627 |
| 住院时间 (, d) | 58±10 | 68±17 | -1.94 | 0.064 |
| 顺产 [n(%)] | 2(22) | 10(50) | - | 0.234 |
| 胎膜早破 [n(%)] | 2(22) | 7(35) | - | 0.675 |
| 羊水污染 [n(%)] | 0(0) | 2(10) | - | 1.000 |
| 宫内窘迫 [n(%)] | 2(22) | 3(15) | - | 0.633 |
| 妊娠高血压 [n(%)] | 3(33) | 3(15) | - | 0.339 |
| 妊娠糖尿病 [n(%)] | 3(33) | 6(30) | - | 1.000 |
| 母亲产前糖皮质激素 [n(%)] | 5(56) | 16(80) | - | 0.209 |
| 母亲产前抗生素 [n(%)] | 4(44) | 8(40) | - | 1.000 |
| 双胎 [n(%)] | 3(33) | 6(30) | - | 1.000 |
| 使用有创呼吸机 [n(%)] | 4(44) | 11(55) | - | 0.700 |
| 1 min Apgar评分 () | 7.2±1.6 | 6.4±2.3 | 1.03 | 0.312 |
| 5 min Apgar评分 [M(P 25, P 75)] | 9.0(8.5, 9.5) | 8.0(7.3, 9.0) | -1.22 | 0.253 |
| 静脉高营养持续时间 [M(P 25, P 75), d] | 27.0(24.5, 28.0) | 28.0(26.0, 28.0) | -1.00 | 0.390 |
| 开奶日龄 [M(P 25, P 75), d] | 0.0(0.0, 1.0) | 0.0(0.0, 1.8) | -0.18 | 0.871 |
| 母乳喂养持续时间 [M(P 25, P 75), d] | 24.0(20.5, 24.0) | 24.0(22.0, 24.0) | -0.20 | 0.871 |
| 禁食 [n(%)] | 5(56) | 12(60) | - | 1.000 |
| PICC持续时间 [M(P 25, P 75), d] | 22(18, 25) | 22(17, 24) | -0.62 | 0.562 |
| 呼吸机使用时间 [M(P 25, P 75), d] | 3.5(2.0, 5.0) | 5.0(4.0, 7.0) | -1.33 | 0.226 |
| 抗生素疗程 (±s, d) | 4.4±1.8 | 12.6±5.7 | -5.79 | <0.001 |
| 喂养不耐受 [n(%)] | 3(33) | 13(65) | - | 0.226 |
| 坏死性小肠结肠炎 [n(%)] | 0(0) | 2(10) | - | 1.000 |
| 新生儿败血症 [n(%)] | 2(22) | 9(45) | - | 0.412 |
| 化脓性脑膜炎 [n(%)] | 0(0) | 2(10) | - | 1.000 |
注:[PICC]经外周静脉穿刺中心静脉置管。
2.2. 菌群单样本Alpha多样性分析
≤7 d组第4周和第2周相比,Chao指数显著降低(P<0.05),Shannon指数差异无统计学意义(P>0.05)。>7 d组第4周和第2周相比,Chao指数显著降低(P<0.05),Shannon指数变化差异无统计学意义(P>0.05)。第2周时,>7 d组和≤7 d组相比,Shannon指数变化差异无统计意义(t=1.12,P=0.285),Chao指数的变化差异无统计学意义(Z=-0.50,P=0.643)。第4周时,>7 d组和≤7 d组相比,Shannon指数差异无统计学意义(t=1.09,P=0.284),Chao指数变化差异无统计学意义(Z=-0.80,P=0.444)。见表2。
表2.
两组不同抗生素疗程VLBWI粪便的菌群Alpha多样性分析
| 指数 | ≤7 d组 (n=9) | >7 d组 (n=20) | ||||||
|---|---|---|---|---|---|---|---|---|
| 第2周 | 第4周 | Z/t值 | P值 | 第2周 | 第4周 | Z/t值 | P值 | |
| Chao指数 [M(P 25, P 75)] | 59.00(49.92, 78.09) | 29.00(20.13, 37.50) | -2.192 | 0.028 | 64.57(51.93, 87.58) | 27.25(22.33, 44.50) | -2.542 | 0.011 |
| Shannon指数 () | 1.0±0.6 | 1.0±0.4 | -0.282 | 0.785 | 0.7±0.3 | 0.9±0.4 | -1.035 | 0.320 |
2.3. 菌群组成分析
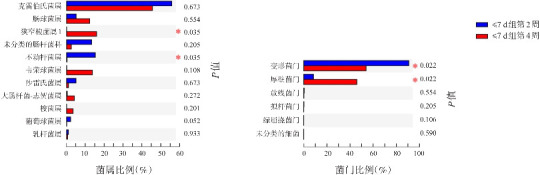
组内比较:≤7 d组第4周与第2周的菌群相比,在属水平上,狭窄梭菌属1显著升高(P=0.035),而不动杆菌属显著降低(P=0.035);在门水平上,厚壁菌门显著升高(P=0.022),而变形菌门显著降低(P=0.022)。见图1。
图1. 抗生素疗程≤7 d组生后第2周和第4周菌群差异分析 左图示菌属水平;右图示菌门水平。.
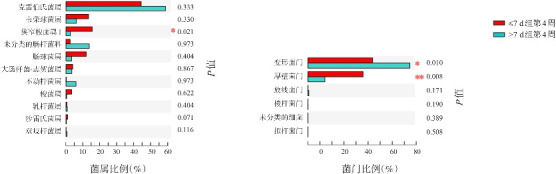
组间比较:第4周时,在属水平上,>7 d组的狭窄梭菌属1较≤7 d组显著降低(P=0.021);在门水平上,>7 d组的厚壁菌门较≤7 d组显著降低(P=0.008),而变形菌门显著升高(P=0.010)。见图2。
图2. 抗生素疗程≤7 d组和>7 d组生后第4周的菌群差异分析 左图示菌属水平;右图示菌门水平。.
2.4. SCFAs测定
≤7 d组第4周与第2周相比,总SCFAs、丙酸、丁酸、戊酸含量显著升高(P<0.05)。>7 d组第4周与第2周相比,总SCFAs、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸含量显著升高(P<0.05)。见表3。
表3.
两组不同抗生素疗程VLBWI粪便的SCFAs含量分析 [M(P 25, P 75),μg/g]
| SCFAs | ≤7 d组 (n=9) | >7 d组 (n=20) | ||||||
|---|---|---|---|---|---|---|---|---|
| 第2周 | 第4周 | Z值 | P值 | 第2周 | 第4周 | Z值 | P值 | |
| 总SCFAs | 227.25(169.13, 303.04) | 528.14(357.29, 814.89) | -2.547 | 0.011 | 219.7(153.35, 389.46) | 526.26(208.13, 889.51) | -2.763 | 0.006 |
| 乙酸 | 201.96(160.29, 244.65) | 237.53(190.08, 361.21) | -1.125 | 0.260 | 215.17(148.91, 312.33) | 266.50(182.81, 333.80) | -1.157 | 0.247 |
| 丙酸 | 5.66(2.44, 12.66) | 136.26(30.64, 214.25) | -2.666 | 0.008 | 2.63(0.67, 12.87) | 89.81(7.42, 270.49) | -3.285 | 0.001 |
| 异丁酸 | 0.34(0.23, 1.08) | 6.92(2.13, 8.48) | -1.481 | 0.139 | 0.33(0.23, 0.48) | 0.43(0.33, 1.01)a | -2.688 | 0.007 |
| 丁酸 | 0.92(0.58, 3.84) | 104.64(2.54, 557.19) | -2.666 | 0.008 | 0.55(0.34, 1.06) | 3.38(1.37, 42.85) | -3.360 | 0.001 |
| 异戊酸 | 0.40(0.17, 1.92) | 2.30(0.29, 3.56) | -0.770 | 0.441 | 0.22(0.10, 0.61) | 0.63(0.33, 1.17) | -2.987 | 0.003 |
| 戊酸 | 0.41(0.17, 0.47) | 3.22(0.65, 4.65) | -2.666 | 0.008 | 0.18(0.11, 0.35) | 0.47(0.21, 1.83)a | -3.472 | 0.001 |
| 异己酸 | 0.26(0.21, 2.18) | 0.27(0.22, 12.54) | -0.533 | 0.594 | 0.20(0.11, 0.29) | 0.30(0.16, 0.63) | -1.829 | 0.067 |
| 己酸 | 1.65(1.49, 2.88) | 1.83(1.22, 3.54) | -1.007 | 0.314 | 1.36(0.69, 1.91) | 1.47(0.89, 4.03) | -1.979 | 0.048 |
注:a示与抗生素疗程≤7 d组第4周比较,P<0.05。[SCFAs]短链脂肪酸。
第4周时,>7 d组异丁酸(Z=-2.357,P=0.018)和戊酸(Z=-2.121,P=0.034)含量较≤7 d组显著下降;>7 d组丙酸(Z=-0.707,P=0.501)、丁酸(Z=-1.839,P=0.069)、异戊酸(Z=-1.084,P=0.295)、己酸(Z=-0.990,P=0.340)和异己酸(Z=-0.283,P=0.799)含量与≤7 d组比较差异无统计学意义。见表3。
2.5. 菌群与粪便样本SCFAs相关性分析
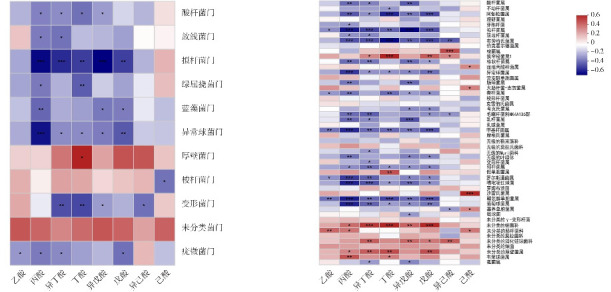
根据Spearman相关性热图分析,方法与Su等[12]和Tsukuda等[13]一致。在门水平上,厚壁菌门与丁酸含量呈显著正相关(rs=0.36,P=0.012),变形菌门与丁酸(rs=-0.44,P=0.0017)和异丁酸(rs=-0.42,P=0.0025)含量呈显著负相关;在属水平上,狭窄梭菌属1与异丁酸(rs=0.29,P=0.045)、丁酸(rs=0.57,P=0.00002)和戊酸(rs=0.41,P=0.0037)含量均呈显著正相关。这提示SCFAs含量与肠道中某些类别菌的比例相关。见图3。
图3. 肠道菌群与SCFAs的相关性 左图示菌门水平;右图示菌属水平;X轴和Y轴分别为SCFAs含量和菌群物种,通过计算获得相关性rs值和P值。rs值大小在图中以不同颜色深浅表示,右侧图例是不同rs值的颜色区间。红色代表正相关,蓝色代表负相关。P<0.05表示显著相关,*0.01<P≤0.05,**0.001<P≤0.01,*** P≤0.001。.
3. 讨论
抗生素的经验性使用在VLBWI中较常见,抗生素的使用对肠道菌群有显著影响[10]。本研究进一步发现广谱抗生素疗程可能会对VLBWI肠道细菌群落的丰富度、定植和演化,以及其代谢产物SCFAs的含量产生较大影响。
本研究发现抗生素疗程≤7 d组第4周和第2周比较,Chao指数显著降低;>7 d组,第4周和第2周比较,Chao指数也显著降低。这提示抗生素疗程治疗后均可导致VLBWI的菌群丰富度显著降低。抗生素疗程>7 d组较≤7 d组Chao指数降低更明显,进一步提示抗生素疗程越长,菌群丰富度越显著降低。有研究发现抗生素治疗后会降低早产儿肠道菌群多样性[9,14]。本研究中,抗生素疗程≤7 d组第4周和第2周相比,Shannon指数差异无统计学意义;同时>7 d组,第4周和第2周相比,Shannon指数差异也无统计学意义。这提示抗生素疗程治疗后对VLBWI的菌群多样性无明显影响。本研究与其他研究结论存在差异的原因可能与本研究样本量小有关。
通常随着日龄的增长,早产儿厚壁菌门的比例增加而变形菌门的比例降低[9]。在本研究中,抗生素疗程≤7 d组第4周与第2周的菌群相比,厚壁菌门显著增加而变形菌门显著降低。这提示≤7 d抗生素疗程治疗对肠道菌群的构成和演化影响较轻微和暂时,随着抗生素停用和日龄增长有一定恢复的趋势,与之前研究结果一致[10,14]。本研究中,抗生素疗程>7 d组第4周与第2周的菌群相比,门水平和属水平上均无显著变化。这提示>7 d抗生素治疗疗程对菌群的构成和演化影响可能较严重,无显著恢复趋势。与其他研究结果显示长期抗生素治疗显著改变了肠道菌群的组成一致[15]。第4周时,在门水平上,抗生素疗程>7 d组较≤7 d组的厚壁菌门显著降低而变形菌门显著升高;在属水平上,>7 d组较≤7 d组的狭窄梭菌属1显著降低。这提示>7 d的抗生素疗程治疗会导致有害菌或机会致病菌如变形菌门的比例显著增加,有益菌属如厚壁菌门及狭窄梭菌属1的比例显著降低,与对早产儿的肠道菌群的其他研究结果一致[16]。这可能是由于广谱抗生素的较长时间应用,较强的抗菌活性导致有益菌一直处于受抑制状态[15]。
SCFAs大多是未经小肠吸收利用的膳食纤维被大肠的肠道菌群发酵而生成的,且与菌群的种类和数量密切相关[17]。有研究表明,新生儿的肠道在出生时是有氧环境,然后逐渐变为厌氧环境,从而使厌氧菌(如梭菌和拟杆菌)得以定植[18]。异丁酸和戊酸大多是由厌氧菌发酵产生,其含量应随着厌氧菌的定植增多而显著升高[19]。本研究在第4周时,抗生素疗程>7 d组的异丁酸和戊酸含量较≤7 d组显著降低。这提示>7 d的抗生素疗程治疗会显著减少VLBWI异丁酸和戊酸含量,与之前结果显示抗生素疗程会降低SCFAs含量及破坏肠道代谢的稳态一致[10,15]。异丁酸有助于降低代谢紊乱个体对胰岛素的抵抗[20],戊酸对神经系统有保护作用[21],为功能性SCFAs。影响功能性SCFAs的含量可能对健康有影响。
为寻找精准干预靶点,本研究进一步探求特定菌群与SCFAs之间的关系。有研究显示厚壁菌门和梭状芽孢杆菌属是产生SCFAs的优势类别,主要包括乙酸、丙酸和丁酸,粪便中的丁酸含量与梭状芽胞杆菌相关系数最高[13]。本研究仅讨论了组间SCFAs、菌群的测定结果具有显著性差异且对应一致的菌的相关性,发现狭窄梭菌属1与异丁酸、丁酸和戊酸含量呈正相关,且>7 d组的抗生素疗程治疗会显著减少其丰度。这提示狭窄梭菌属1可能是进一步相关研究的良好切入点。
本研究有一定的局限性。本研究只涉及来自同一家医院的少量患儿样本,未能进一步依据胎龄和体重进行分层分析。同时,本研究处于三级甲等医院,收治的病例病情较为严重,因此未收集到胎龄小于30周且未使用抗生素的VLBWI作为对照组。本院未设有妇产科,本研究中的早产儿一经住院立即使用抗生素,故使用抗生素前的自身对照标本收集困难。
广谱抗生素疗程可能会导致胎龄小于30周的VLBWI肠道菌群的丰富度降低、定植和演化改变,以及其代谢产物功能性SCFAs含量降低。不利于肠道健康,临床上应该严格把握广谱抗生素的适应证及疗程。
基金资助
国家自然科学基金项目(82001602)。
参 考 文 献
- 1. 李瑶, 黄金莉, 黄娟, 等. 肠道菌群与肠道屏障互作在炎症性肠病中的作用研究进展[J].胃肠病学和肝病学杂志, 2021, 30(1): 10-15. DOI: 10.3969/j.issn.1006-5709.2021.01.003. [DOI] [Google Scholar]
- 2. Chen YW, Zhou JH, Wang L. Role and mechanism of gut microbiota in human disease[J].Front Cell Infect Microbiol, 2021, 11: 625913. PMID: . PMCID: . DOI: 10.3389/fcimb.2021.625913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Costello EK, Carlisle EM, Bik EM, et al. Microbiome assembly across multiple body sites in low-birthweight infants[J].mBio, 2013, 4(6): e00782-13. PMID: . PMCID: . DOI: 10.1128/mBio.00782-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. 贾琼, 童笑梅. 早产儿菌群特征及与疾病关系的研究进展[J].中国当代儿科杂志, 2020, 22(11): 1240-1244. PMID: . PMCID: . DOI: 10.7499/j.issn.1008-8830.2005131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Ting JY, Roberts A, Sherlock R, et al. Duration of initial empirical antibiotic therapy and outcomes in very low birth weight infants[J].Pediatrics, 2019, 143(3): e20182286. PMID: . DOI: 10.1542/peds.2018-2286. [DOI] [PubMed] [Google Scholar]
- 6. Chen YX, Xie YN, Zhong RQ, et al. Effects of xylo-oligosaccharides on growth and gut microbiota as potential replacements for antibiotic in weaning piglets[J].Front Microbiol, 2021, 12: 641172. PMID: . PMCID: . DOI: 10.3389/fmicb.2021.641172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Wandro S, Osborne S, Enriquez C, et al. The microbiome and metabolome of preterm infant stool are personalized and not driven by health outcomes, including necrotizing enterocolitis and late-onset sepsis[J].mSphere, 2018, 3(3): e00104-18. PMID: . PMCID: . DOI: 10.1128/mSphere.00104-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Liu WX, Luo XL, Tang J, et al. A bridge for short-chain fatty acids to affect inflammatory bowel disease, type 1 diabetes, and non-alcoholic fatty liver disease positively: by changing gut barrier[J].Eur J Nutr, 2021, 60(5): 2317-2330. PMID: . DOI: 10.1007/s00394-020-02431-w. [DOI] [PubMed] [Google Scholar]
- 9. Zhu DP, Xiao S, Yu JL, et al. Effects of one-week empirical antibiotic therapy on the early development of gut microbiota and metabolites in preterm infants[J].Sci Rep, 2017, 7(1): 8025. PMID: . PMCID: . DOI: 10.1038/s41598-017-08530-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Arboleya S, Sánchez B, Solís G, et al. Impact of prematurity and perinatal antibiotics on the developing intestinal microbiota: a functional inference study[J].Int J Mol Sci, 2016, 17(5): 649. PMID: . PMCID: . DOI: 10.3390/ijms17050649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Risely A, Gillingham MAF, Béchet A, et al. Phylogeny- and abundance-based metrics allow for the consistent comparison of core gut microbiome diversity indices across host species[J].Front Microbiol, 2021, 12: 659918. PMID: . PMCID: . DOI: 10.3389/fmicb.2021.659918. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Su LL, Mao CQ, Wang XC, et al. The anti-colitis effect of schisandra chinensis polysaccharide is associated with the regulation of the composition and metabolism of gut microbiota[J].Front Cell Infect Microbiol, 2020, 10: 519479. PMID: . PMCID: . DOI: 10.3389/fcimb.2020.519479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Tsukuda N, Yahagi K, Hara T, et al. Key bacterial taxa and metabolic pathways affecting gut short-chain fatty acid profiles in early life[J].ISME J, 2021. PMID: . DOI: 10.1038/s41396-021-00937-7. Epub ahead of printDOI: 10.1038/s41396-021-00937-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Greenwood C, Morrow AL, Lagomarcino AJ, et al. Early empiric antibiotic use in preterm infants is associated with lower bacterial diversity and higher relative abundance of Enterobacter [J].J Pediatr, 2014, 165(1): 23-29. PMID: . PMCID: . DOI: 10.1016/j.jpeds.2014.01.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Zhu XH, Fu B, Dong MY, et al. Effects of long-term antibiotic treatment on mice urinary aromatic amino acid profiles[J].Biosci Rep, 2021, 41(1): BSR20203498. PMID: . PMCID: . DOI: 10.1042/BSR20203498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Lu SL, Huang QM, Wei BM, et al. Effects of β-lactam antibiotics on gut microbiota colonization and metabolites in late preterm infants[J].Curr Microbiol, 2020, 77(12): 3888-3896. PMID: . DOI: 10.1007/s00284-020-02198-7. [DOI] [PubMed] [Google Scholar]
- 17. 赵怀宝, 任玉龙. 短链脂肪酸在动物体内的生理特点和功能[J].饲料研究, 2016(3): 29-32. DOI: 10.13557/j.cnki.issn1002-2813.2016.03.007. [DOI] [Google Scholar]
- 18. Arrieta MC, Stiemsma LT, Amenyogbe N, et al. The intestinal microbiome in early life: health and disease[J].Front Immunol, 2014, 5: 427. PMID: . PMCID: . DOI: 10.3389/fimmu.2014.00427. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Liu B, Popp D, Müller N, et al. Three novel Clostridia isolates produce n-Caproate and iso-Butyrate from lactate: comparative genomics of chain-elongating bacteria[J].Microorganisms, 2020, 8(12): 1970. PMID: . PMCID: . DOI: 10.3390/microorganisms8121970. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Heimann E, Nyman M, Pålbrink AK, et al. Branched short-chain fatty acids modulate glucose and lipid metabolism in primary adipocytes[J].Adipocyte, 2016, 5(4): 359-368. PMID: . PMCID: . DOI: 10.1080/21623945.2016.1252011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Jayaraj RL, Beiram R, Azimullah S, et al. Valeric acid protects dopaminergic neurons by suppressing oxidative stress, neuroinflammation and modulating autophagy pathways[J].Int J Mol Sci, 2020, 21(20): 7670. PMID: . PMCID: . DOI: 10.3390/ijms21207670. [DOI] [PMC free article] [PubMed] [Google Scholar]


