Abstract
目的
探讨振幅整合脑电图(amplitude-integrated electroencephalogram,aEEG)、头颅磁共振成像(cranial magnetic resonance imaging,cMRI)的定量指标双顶径(biparietal width,BPW)、两半球间距(interhemispheric distance,IHD)与中晚期早产儿近期神经发育的关系。
方法
前瞻性选择2018年9月至2020年4月入住新生儿重症监护病房的104例中晚期早产儿为研究对象,在生后72 h内采用Naqeeb法及睡眠-觉醒周期(sleep-wake cycling,SWC)进行aEEG评估;在矫正胎龄37周时完成cMRI检查,并在T2冠状位测量BPW和IHD;矫正月龄6月龄时采用0~6岁儿童发育筛查测验(Developmental Screening Test for Child Under Six,DST)随访神经发育,并根据发育商(development quotient,DQ)分为DST正常组(≥85分,78例)和DST异常组(DQ<85分,26例),分析比较两组间各指标差异,以及aEEG和cMRI的关系。
结果
DST异常组aEEG正常率、SWC成熟率低于DST正常组(P<0.05);与DST正常组相比,DST异常组的IHD偏大、BPW偏小(P<0.05)。不成熟的SWC、aEEG异常、较大的IHD是DST异常的危险因素(P<0.05),较大的BPW是DST异常的保护因素(P<0.05)。
结论
中晚期早产儿生后72 h内的aEEG、矫正胎龄37周时cMRI定量指标BPW和IHD可能影响其矫正月龄6月龄时的神经发育结局。
Keywords: 振幅整合脑电图, 磁共振成像, 神经发育结局, 早产儿
Abstract
Objective
To study the association of amplitude-integrated electroencephalogram (aEEG) and the quantitative indices biparietal width (BPW) and interhemispheric distance (IHD) of cranial magnetic resonance imaging (cMRI) with short-term neurodevelopment in moderately and late preterm infants.
Methods
A total of 104 moderately and late preterm infants who were admitted to the neonatal intensive care unit from September 2018 to April 2020 were selected as the subjects for this prospective study. The Naqeeb method and sleep-wake cycling (SWC) were used for aEEG assessment within 72 hours after birth. cMRI was performed at the corrected gestational age of 37 weeks. BPW and IHD were measured at the T2 coronal position. At the corrected age of 6 months, the Developmental Screening Test for Child Under Six (DST) was used to follow up neurodevelopment. According to developmental quotient (DQ), the infants were divided into a normal DST group (78 infants with DQ≥85) and an abnormal DST group (26 infants with DQ<85). Related indices were compared between the two groups. The association between aEEG and cMRI was evaluated.
Results
Compared with the normal DST group, the abnormal DST group had significantly lower aEEG normal rate and SWC maturation rate (P<0.05), as well as a significantly larger IHD and a significantly smaller BPW (P<0.05). Immature SWC, aEEG abnormality, and a relatively large IHD were the risk factors for abnormal DST (P<0.05), and a relatively large BPW was a protective factor against abnormal DST (P<0.05).
Conclusions
For moderately and late preterm infants, aEEG within 72 hours after birth and the quantitative indices BPW and IHD of cMRI at the corrected gestational age of 37 weeks may affect their neurodevelopmental outcome at the corrected age of 6 months.
Keywords: Amplitude-integrated electroencephalogram, Magnetic resonance imaging, Neurodevelopmental outcome, Preterm infant
据统计每年约有1 500万早产儿出生,全球早产儿发生率约11.1%[1-3],我国早产儿发生率约7.8%[4]。随着新生儿科诊疗水平的不断发展,早产儿的存活率显著提高,但其神经系统不良预后如脑性瘫痪、智力障碍、认知缺陷、发育迟缓等的发生率并没有显著下降[5-6]。如何早期评估早产儿脑发育成熟度并识别脑损伤,这对改善早产儿神经发育结局具有重要意义。已有文献显示振幅整合脑电图(amplitude-integrated electroencephalogram,aEEG)可用于预测早产儿的神经发育结局[7-9]。同时随着影像学技术的发展,临床医生不仅关注早产儿头颅磁共振成像(cranial magnetic resonance imaging,cMRI)上宏观的脑损伤与神经发育的关系,还证实了cMRI上微观结构的改变也可影响早产儿的神经发育结局[10-11]。Kidokoro等[12]研究表明较小的双顶径(biparietal width,BPW)与认知发育迟缓有关。Hüning等[13]研究表明两半球间距(interhemispheric distance,IHD)可以预测早产儿2岁时的神经发育结局。但目前无论是aEEG还是cMRI与神经发育预后的研究都主要集中于具有明确脑损伤的早产儿,而对于在颅脑超声、常规cMRI显示无异常,临床又无脑病表现的早产儿神经发育预后的研究相对较少,且Kidokoro等[12]、Hüning等[13]研究对象均为胎龄较小的早期早产儿,故本研究以无颅内出血、脑白质损伤等神经系统高风险的中晚期早产儿为研究对象,探讨生后早期aEEG、IHD和BPW与中晚期早产儿近期神经发育结局的关系。
1. 资料与方法
1.1. 研究对象
前瞻性收集2018年9月至2020年4月我院产科分娩并直接转入新生儿重症监护病房救治的104例中晚期早产儿的临床资料。纳入标准:(1)胎龄(gestational age,GA)为32+0~36+6周;(2)孕期在我院产科进行规律产检;(3)孕母及早产儿临床资料完整;(4)早产儿在生后72 h内完成aEEG检查;(5)早产儿在矫正胎龄37周时完成cMRI检查;(6)早产儿在矫正月龄1、3、6月龄时均在我院儿童保健门诊进行生长发育评估并接受相关指导,且资料保存完整。排除标准:(1)存在先天畸形;(2)患有遗传代谢性疾病;(3)存在窒息、惊厥、缺氧缺血性脑病、胆红素脑病、小于胎龄儿、低血糖等导致脑功能异常的高危因素;(4)颅脑超声或cMRI检查存在颅内出血、脑白质异常等脑损伤;(5)死亡或未达临床出院标准而家长放弃治疗。此研究取得了患儿家长的知情同意,并通过了我院伦理委员会批准(KY20181102001)。
1.2. 资料收集
收集早产儿及其母亲的临床资料:性别、出生方式、GA、出生体重(birth weight,BW)、头围、氧疗时间、受孕方式、产前使用糖皮质激素情况、湿肺、呼吸窘迫综合征(respiratory distress syndrome,RDS)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、肺炎、高胆红素血症、早产儿视网膜病(retinopathy of prematurity,ROP)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、妊娠糖尿病(gestational diabetes mellitus,GDM)、妊娠高血压(gestational hypertension,GH)、胎膜早破、胎盘早剥、前置胎盘。其中当中晚期早产儿的胆红素水平达到光疗标准[14]时即诊断为高胆红素血症,其余诊断标准采用第4版《实用新生儿学》[15]、《实用妇产科学》[16]。
1.3. aEEG监测及评估
早产儿在生后72 h内均使用美国Nicolet Monitor机器完成aEEG检查。采用帽状电极对非镇静状态下的中晚期早产儿进行脑电信号采集,电极安放位置为双侧中央区及颞区,相当于国际10~20电极安放系统电极位置的F3、F4、C3、C4、P3、P4、T3、T4、REF、GND,其中REF为参考电极,GND为接地电极。采用双通道进行aEEG的记录(C3~F3、C4~F4、C3~P3、C4~P4),与此同时记录原始脑电图信号,并对记录过程中的临床及护理事件进行标记,连续监测时间至少240 min。采用Naqeeb分类法[17]对aEEG进行评估:(1)正常:aEEG的上边界(upper margin amplitude,UMA)>10 μV,下边界(lower margin amplitude,LMA)>5 μV;(2)轻度异常:UMA>10 μV,LMA≤5 μV;(3)重度异常:UMA≤10 μV,LMA<5 μV。在本研究中(1)为正常,将(2)(3)归为异常。同时根据Hellström-Westas等[18]所定义的睡眠-觉醒周期(sleep-wake cycling,SWC)的成熟性进行aEEG的评估,即成熟的SWC是指脑电图的宽度和窄带交替出现,呈现正弦样变化,且周期持续时间在20 min以上。
1.4. MRI检查
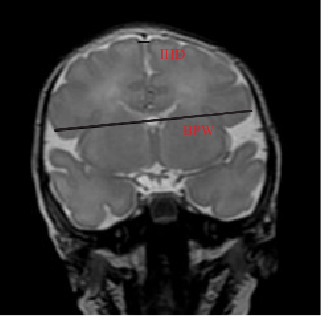
采用美国GE(Signa HDxt)1.5 T仪器在早产儿矫正胎龄37周时进行cMRI检查。MRI扫描参数:T2快速自旋回波(fast spin echo,FSE)序列,脉冲间隔重复时间(repetition time,TR)=3 000 ms,回波时间(echo time,TE)=85 ms;T1加权成像(T1-weighted imaging,T1WI)序列参数:TR=1 750 ms,TE=24 ms,扫描视野(field of view,FOV)=24 cm,层厚5 mm,无间距;T2加权成像(T2-weighted imaging,T2WI)序列参数:TR=8 500 ms,TE=155 ms,FOV=24 cm,层厚5 mm,无间距。选取在T2冠状位以双侧耳蜗基底为标准测量BPW和IHD值(图1)。所有早产儿在cMRI检查前30 min予静脉注射苯巴比妥钠(5 mg/kg),并用棉被将其包裹,待患儿处于睡眠状态时进行检查。
图1. cMRI测量示意图 [IHD]两半球间距,指额上回顶部之间的水平距离;[BPW]双顶径,指额叶的最大水平宽度。.
1.5. 神经发育评估及分组
所有早产儿在矫正月龄6月龄时在我院儿童保健门诊由接受过0~6岁儿童发育筛查测验(Developmental Screening Test for Child Under Six,DST)专业培训的医生进行神经发育评估。DST是上海复旦附属儿童医院参考国内外各种发育评估方法并结合我国国情制定的神经发育筛查量表[19],该量表具有操作简便、耗时短等优势。DST包括三大方面的内容,共120个项目,其中社会适应能区和运动能区各有30个项目,智力能区为60个项目。DST包括29个年龄组,对0~96月龄的生长发育情况进行了定义,但是该方法只适用于0~72月龄的儿童,主要是为了发育水平超过同龄的儿童也能得到合理的评估。DST测试结果以智力指数(mental index,MI)和发育商(development quotient,DQ)表示。MI反映智力能区的发育水平;DQ用于反映三个能区的总体发育水平。3岁以下儿童根据DQ将其分为3个等级[20]:<70分为异常,70~84分为可疑,≥85分为正常。在本研究中将DQ≥85为DST正常组,DQ<85为DST异常组。
1.6. 统计学分析
应用SPSS 25.0软件进行统计学分析。非正态分布计量资料用中位数及四分位数间距[M(P 25,P 75)]表示,组间比较采用Mann-Whitney U检验;正态分布计量资料用均数±标准差(±s)表示,组间比较用两样本t检验。计数资料采用例数和百分率(%)表示,组间比较采用检验、连续性校正检验或Fisher确切概率法。对单因素P<0.05的变量进行二元logistic回归分析。采用Pearson相关探讨IHD、BPW和DQ之间的关系。P<0.05为差异有统计学意义。
2. 结果
2.1. 两组早产儿及其母亲一般资料比较
2018年9月至2020年4月间新生儿重症监护病房共收治中晚期早产儿546例,其中在生后72 h内完成aEEG检查者共137例;矫正胎龄37周时完成cMRI共353例,矫正月龄6月龄完成DST者共179例。最终共纳入104例,其中DST正常组78例(75.0%),异常组26例(25.0%)。两组患儿在GA、BW、头围、氧疗时间、性别、出生方式,以及孕母受孕方式、产前是否使用糖皮质激素、妊娠期并发症方面的比较,差异均无统计学意义(P>0.05)。两组患儿湿肺、RDS、BPD、肺炎、高胆红素血症、ROP、NEC的发生率比较,差异均无统计学意义(P>0.05)。见表1。
表 1.
两组早产儿临床资料及母亲孕期并发症比较
| 项目 | DST正常组(n=78) | DST异常组(n=26) | /Z值 | P值 |
|---|---|---|---|---|
| 早产儿情况 | ||||
| 胎龄 [M(P 25, P 75), 周] | 34.9(33.7, 35.7) | 34.9(32.9, 35.4) | -0.616 | 0.538 |
| 出生体重 [M(P 25, P 75), g] | 2 375.0(1 995.0, 2 612.5) | 2 195.0(1 920.0, 2 672.5) | -0.668 | 0.504 |
| 头围 [M(P 25, P 75), cm] | 32.3(30.3, 33.1) | 32.0(30.0, 33.0) | -0.897 | 0.370 |
| 氧疗时间 [M(P 25, P 75), d] | 1.0(0.0, 3.3) | 1.0(0.0, 4.3) | -0.618 | 0.537 |
| 男性 [例(%)] | 40(51) | 15(58) | 0.322 | 0.571 |
| 剖宫产 [例(%)] | 64(82) | 20(77) | 0.330 | 0.566 |
| 试管婴儿 [例(%)] | 8(10) | 4(15) | 0.126 | 0.723 |
| 湿肺 [例(%)] | 6(8) | 3(12) | 0.041 | 0.840 |
| RDS [例(%)] | 12(15) | 3(12) | 0.026 | 0.872 |
| BPD [例(%)] | 0(0) | 1(4) | - | 0.250 |
| 肺炎 [例(%)] | 19(24) | 9(35) | 1.043 | 0.307 |
| 高胆红素血症 [例(%)] | 57(73) | 18(69) | 0.563 | 0.453 |
| ROP [例(%)] | 2(3) | 1(4) | - | 1.000 |
| NEC [例(%)] | 4(5) | 1(4) | 0.000 | 1.000 |
| 母亲情况 | ||||
| 产前使用糖皮质激素 [例(%)] | 52(67) | 13(50) | 2.311 | 0.128 |
| 妊娠糖尿病 [例(%)] | 14(18) | 3(12) | 0.211 | 0.646 |
| 妊娠高血压 [例(%)] | 25(32) | 7(27) | 0.241 | 0.624 |
| 胎膜早破 [例(%)] | 26(33) | 8(31) | 0.079 | 0.779 |
| 胎盘早剥 [例(%)] | 9(12) | 1(4) | 0.590 | 0.442 |
| 前置胎盘 [例(%)] | 7(9) | 4(15) | 0.305 | 0.581 |
注:[RDS]呼吸窘迫综合征;[BPD]支气管肺发育不良;[ROP]早产儿视网膜病变;[NEC]坏死性小肠结肠炎;[DST]0~6岁儿童发育筛查测验。
2.2. aEEG与DST得分的关系
DST异常组aEEG正常率、SWC成熟率低于DST正常组(P<0.05),见表2。
表 2.
两组早产儿aEEG、IHD、BPW比较
| 项目 | DST正常组(n=78) | DST异常组(n=26) | /t值 | P值 |
|---|---|---|---|---|
| 不成熟的SWC [例(%)] | 13(17) | 20(77) | 32.684 | <0.001 |
| aEEG异常 [例(%)] | 21(27) | 18(69) | 14.892 | <0.001 |
| IHD (, mm) | 2.9±0.8 | 3.5±0.7 | -3.386 | 0.001 |
| BPW (, mm) | 70.6±5.2 | 66.5±3.7 | 4.495 | <0.001 |
注:[SWC]睡眠-觉醒周期;[aEEG]振幅整合脑电图;[IHD]两半球间距;[BPW]双顶径;[DST]0~6岁儿童发育筛查测验。
2.3. cMRI定量指标IHD、BPW与DST的关系
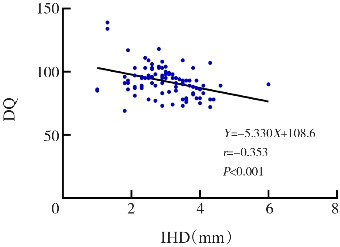
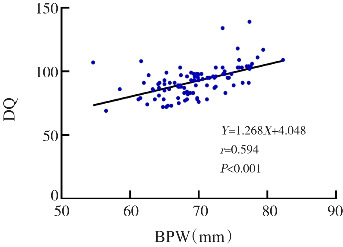
与DST正常组相比,DST异常组IHD较大,BPW较小(P<0.05),见表2。同时对IHD、BPW与DQ值的关系行进一步探讨,发现IHD与DQ值存在负相关(r=-0.353,P<0.001);BPW与DQ值存在正相关(r=0.594,P<0.001),见图2。
图 2. IHD、BPW与DQ的关系 [IHD]两半球间距;[BPW]双顶径;[DQ]发育商。.
2.4. 多因素分析
采用二元logistic回归分析对上述P<0.05的变量进行多因素分析,结果显示较大的IHD、不成熟的SWC、aEEG异常是DST异常的独立危险因素(分别OR=2.394、14.667、4.793,P<0.05);较大的BPW是DST异常的独立保护因素(OR=0.822,P<0.05)。见表3。
表3.
不良神经发育结局的多因素logistic回归分析
| 因素 | β | SE | Wald | P | OR | 95%CI |
|---|---|---|---|---|---|---|
| IHD | 0.873 | 0.392 | 4.967 | 0.026 | 2.394 | 1.111~5.160 |
| BPW | -0.195 | 0.072 | 7.313 | 0.007 | 0.822 | 0.714~0.948 |
| 不成熟SWC | 2.686 | 0.674 | 15.867 | <0.001 | 14.667 | 3.912~54.982 |
| aEEG异常 | 1.567 | 0.649 | 5.831 | 0.016 | 4.793 | 1.343~17.105 |
| 常量 | 7.322 | 4.744 | 2.383 | 0.123 |
注:[IHD]两半球间距;[BPW]双顶径;[SWC]睡眠-觉醒周期;[aEEG]振幅整合脑电图。
3. 讨论
目前针对非神经系统高风险早产儿神经发育结局的研究报道相对较少,尤其是将常规cMRI定量指标IHD、BPW与神经发育测试结合起来去评估早产儿脑发育的研究更少;同时aEEG的研究也主要集中于存在缺氧缺血性脑病、颅内出血、新生儿高胆红素血症、新生儿低血糖、新生儿惊厥的早产儿,针对出生时无高危因素的正常早产儿脑发育与神经发育预后关系的研究较少。因此本研究将两者联合起来评估中晚期早产儿脑发育的成熟度,同时探讨aEEG与IHD、BPW对早产儿近期神经发育结局的预测价值。对早产儿aEEG的评估多采用Burdjalov量表[21],但本研究对象为无神经系统高风险的中晚期早产儿,其aEEG的差异主要体现在UMA、LMA和SWC,故对aEEG的评估采用Naqeeb分类法[17]和Hellström-Westas等[18]所定义的SWC成熟性。同时结合我院儿童保健科的实际情况对神经发育的随访采用的是DST法。
本研究中DST异常组aEEG正常率、SWC成熟率均低于DST正常组,差异有统计学意义。多因素logistic回归分析显示:不成熟的SWC、异常的aEEG均是DST异常的独立危险因素,因此可以说明aEEG可用来预测健康早产儿的神经发育预后,这一结果与文献报道[22-24]相一致。Wikström等[22]对GA<30周且无脑损伤表现的早产儿进行研究发现,生后24 h内aEEG的结果与2岁时采用Bayley评估早产儿神经发育预后的一致性高达75%~80%。El Ters等[23]研究表明缺乏SWC新生儿,其生后可出现运动和认知发育迟缓。El-Dib等[24]研究发现具备成熟SWC的早产儿其生后9月龄和18月龄的Bayley评估神经发育的得分均较高。
本研究中DST异常组IHD大于DST正常组,BPW小于DST正常组,差异均有统计学意义。多因素logistic回归分析发现较大的IHD是DST异常的独立危险因素;较大的BPW是DST异常的独立保护因素。Kidokoro等[12]对早产儿BPW、IHD与神经发育结局的关系进行随访研究发现,较小的BPW与采用Bayley评估的2岁时的认知发育迟缓有关。Hüning等[13]对GA<32周的早产儿研究发现IHD可以预测早产儿2岁时的神经发育结局。研究显示GA<32周、BW≤1 500 g的早产儿BPW与其矫正月龄24月龄时的神经发育预后相关[25-26]。本研究结果与上述既往研究结果相似。BPW主要反映脑白质的体积,也同时反映了脑体积的绝对大小;IHD反映脑灰质的发育情况,代表相对于头围脑生长受限的程度。通过这些定量指标进行大脑生长发育的评估,可以扩大对大脑结构的进一步分析,并进一步明确大脑结构对其功能的影响。但目前尚没有明确的界限表明不同胎龄的早产儿其IHD、BPW的参考值,因此还需要多中心、大样本的研究。
早产儿作为不良神经发育结局的高危人群,对其早期进行神经发育的评估及随访至关重要,临床上通过各种评估手段发现早产儿出现偏离正常水平的情况时,给予正确的指导,进行正规体能训练和智力培训,可以降低不可逆脑损伤的发生率,从而改善神经发育预后,提高生存质量。本研究以临床上无脑损伤表现的健康早产儿为研究对象,探讨其生后72 h内aEEG、矫正胎龄37周时cMRI定量指标IHD、BPW与矫正月龄6月龄时DST的关系,结果显示aEEG、IHD、BPW均可作为早产儿神经发育结局的预测指标。但是目前临床上关于健康早产儿其神经发育结局预测因子的研究较少,且研究IHD、BPW与神经发育预后关系的研究更少,因此还需要大样本、多中心的重复研究来明确IHD、BPW、aEEG与早产儿神经发育的关系,以便最大限度地利用其潜在的预测价值,以达到最大程度改善早产儿神经发育预后的目的。
利益冲突声明
所有作者均声明不存在利益冲突。
参 考 文 献
- 1. Han W, Song JA, Liu AQ, et al. Trends in live births in the past 20 years in Zhengzhou, China[J].Acta Obstet Gynecol Scand, 2011, 90(4): 332-337. PMID: . DOI: 10.1111/j.1600-0412.2010.01065.x. [DOI] [PubMed] [Google Scholar]
- 2. Kinney MV, Lawn JE, Howson CP, et al. 15 million preterm births annually: what has changed this year?[J].Reprod Health, 2012, 9: 28. PMID: . PMCID: . DOI: 10.1186/1742-4755-9-28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Blencowe H, Cousens S, Oestergaard MZ, et al. National, regional, and worldwide estimates of preterm birth rates in the year 2010 with time trends since 1990 for selected countries: a systematic analysis and implications[J].Lancet, 2012, 379(9832): 2162-2172. PMID: . DOI: 10.1016/S0140-6736(12)60820-4. [DOI] [PubMed] [Google Scholar]
- 4. 魏克伦, 杨于嘉, 姚裕家, 等. 中国城市早产儿流行病学初步调查报告[J].中国当代儿科杂志, 2005, 7(1): 25-28. DOI: 10.3969/j.issn.1008-8830.2005.01.006. [DOI] [Google Scholar]
- 5. Johnson S, Waheed G, Manktelow BN, et al. Differentiating the preterm phenotype: distinct profiles of cognitive and behavioral development following late and moderately preterm birth[J].J Pediatr, 2018, 193: 85-92.e1. PMID: . DOI: 10.1016/j.jpeds.2017.10.002. [DOI] [PubMed] [Google Scholar]
- 6. Natarajan G, Shankaran S. Short- and long-term outcomes of moderate and late preterm infants[J].Am J Perinatol, 2016, 33(3): 305-317. PMID: . DOI: 10.1055/s-0035-1571150. [DOI] [PubMed] [Google Scholar]
- 7. Fogtmann EP, Plomgaard AM, Greisen G, et al. Prognostic accuracy of electroencephalograms in preterm infants: a systematic review[J].Pediatrics, 2017, 139(2): e20161951. PMID: . DOI: 10.1542/peds.2016-1951. [DOI] [PubMed] [Google Scholar]
- 8. Ralser E, Neubauer V, Pupp-Peglow U, et al. Amplitude-integrated electroencephalography can predict neurodevelopmental outcome at 12 months of corrected age in very preterm infants[J].Acta Paediatr, 2017, 106(4): 594-600. PMID: . DOI: 10.1111/apa.13748. [DOI] [PubMed] [Google Scholar]
- 9. Burger C, Hammerl M, Neubauer V, et al. Early preterm infants with abnormal psychomotor neurodevelopmental outcome at age two show alterations in amplitude-integrated electroencephalography signals[J].Early Hum Dev, 2020, 141: 104935. PMID: . DOI: 10.1016/j.earlhumdev.2019.104935. [DOI] [PubMed] [Google Scholar]
- 10. Kostović Srzentić M, Raguž M, Ozretić D. Specific cognitive deficits in preschool age correlated with qualitative and quantitative MRI parameters in prematurely born children[J].Pediatr Neonatol, 2020, 61(2): 160-167. PMID: . DOI: 10.1016/j.pedneo.2019.09.003. [DOI] [PubMed] [Google Scholar]
- 11. Kelly CE, Thompson DK, Spittle AJ, et al. Regional brain volumes, microstructure and neurodevelopment in moderate-late preterm children[J].Arch Dis Child Fetal Neonatal Ed, 2020, 105(6): 593-599. PMID: . DOI: 10.1136/archdischild-2019-317941. [DOI] [PubMed] [Google Scholar]
- 12. Kidokoro H, Anderson PJ, Doyle LW, et al. Brain injury and altered brain growth in preterm infants: predictors and prognosis[J].Pediatrics, 2014, 134(2): e444-e453. PMID: . DOI: 10.1542/peds.2013-2336. [DOI] [PubMed] [Google Scholar]
- 13. Hüning B, Storbeck T, Bruns N, et al. Relationship between brain function (aEEG) and brain structure (MRI) and their predictive value for neurodevelopmental outcome of preterm infants[J].Eur J Pediatr, 2018, 177(8): 1181-1189. PMID: . PMCID: . DOI: 10.1007/s00431-018-3166-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. 中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会 . 新生儿高胆红素血症诊断和治疗专家共识[J].中华儿科杂志, 2014, 52(10): 745-748. PMID: . DOI: 10.3760/cma.j.issn.0578-1310.2014.10.006. 25537539 [DOI] [Google Scholar]
- 15. 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 4版. 北京: 人民卫生出版社, 2011. [Google Scholar]
- 16. 徐丛剑, 华克勤. 实用妇产科学[M]. 4版. 北京: 人民卫生出版社, 2018. [Google Scholar]
- 17. al Naqeeb N, Edwards AD, Cowan FM, et al. Assessment of neonatal encephalopathy by amplitude-integrated electroencephalography[J].Pediatrics, 1999, 103(6 Pt 1): 1263-1271. PMID: . DOI: 10.1542/peds.103.6.1263. [DOI] [PubMed] [Google Scholar]
- 18. Hellström-Westas L, Rosén I. Continuous brain-function monitoring: state of the art in clinical practice[J].Semin Fetal Neonatal Med, 2006, 11(6): 503-511. PMID: . DOI: 10.1016/j.siny.2006.07.011. [DOI] [PubMed] [Google Scholar]
- 19. 邹小兵, 静进. 发育行为儿科学[M]. 北京: 人民卫生出版社, 2005. [Google Scholar]
- 20. 苏亭娟, 于伟平, 邓文君, 等. 扬州市5635例婴幼儿智能发育水平调查[J].中国儿童保健杂志, 2012, 20(4): 374-376. [Google Scholar]
- 21. Burdjalov VF, Baumgart S, Spitzer AR. Cerebral function monitoring: a new scoring system for the evaluation of brain maturation in neonates[J].Pediatrics, 2003, 112(4): 855-861. PMID: . DOI: 10.1542/peds.112.4.855. [DOI] [PubMed] [Google Scholar]
- 22. Wikström S, Pupp IH, Rosén I, et al. Early single-channel aEEG/EEG predicts outcome in very preterm infants[J].Acta Paediatr, 2012, 101(7): 719-726. PMID: . PMCID: . DOI: 10.1111/j.1651-2227.2012.02677.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. El Ters NM, Vesoulis ZA, Liao SM, et al. Term-equivalent functional brain maturational measures predict neurodevelopmental outcomes in premature infants[J].Early Hum Dev, 2018, 119: 68-72. PMID: . PMCID: . DOI: 10.1016/j.earlhumdev.2018.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. El-Dib M, Massaro AN, Glass P, et al. Sleep wake cycling and neurodevelopmental outcome in very low birth weight infants[J].J Matern Fetal Neonatal Med, 2014, 27(9): 892-897. PMID: . DOI: 10.3109/14767058.2013.845160. [DOI] [PubMed] [Google Scholar]
- 25. Tich SNT, Anderson PJ, Hunt RW, et al. Neurodevelopmental and perinatal correlates of simple brain metrics in very preterm infants[J].Arch Pediatr Adolesc Med, 2011, 165(3): 216-222. PMID: . DOI: 10.1001/archpediatrics.2011.9. [DOI] [PubMed] [Google Scholar]
- 26. Dewan MV, Herrmann R, Schweiger B, et al. Are simple magnetic resonance imaging biomarkers predictive of neurodevelopmental outcome at two years in very preterm infants?[J].Neonatology, 2019, 116(4): 331-340. PMID: . DOI: 10.1159/000501799. [DOI] [PubMed] [Google Scholar]


