Abstract
目的
探讨益生菌联合应用行为分析法(applied behavior analysis,ABA)治疗儿童孤独症谱系障碍(autism spectrum disorder,ASD)的疗效。
方法
选取2019年5月至2020年12月在江苏大学附属医院就诊的ASD患儿41例,随机分为观察组(n=21)和对照组(n=20)。观察组给予口服益生菌联合ABA干预,对照组仅给予ABA干预,比较两组的疗效。在干预前、干预后3个月分别依据孤独症治疗评估量表(autism treatment evaluation checklist,ATEC)对两组患儿行为症状的严重程度进行评分,并分别留取患儿的粪便标本,基于16s rRNA高通量测序分析两组患儿的肠道菌群差异。
结果
干预前,观察组与对照组ATEC评分差异无统计学意义(P>0.05);干预后3个月,观察组与对照组ATEC评分均较干预前明显下降,且观察组ATEC评分低于对照组(P<0.05)。干预前,观察组与对照组肠道菌群构成情况无明显差异;干预后3个月,观察组与对照组肠道菌群构成情况存在明显差异。观察组双歧杆菌属、乳杆菌属、粪杆菌属、瘤胃菌属、普雷沃菌属、布劳特菌属的相对丰度明显高于对照组(P<0.05),志贺氏菌属、梭状菌属的相对丰度明显低于对照组(P<0.05)。
结论
益生菌可能通过调节肠道菌群微生态进一步改善传统ABA治疗儿童ASD的疗效。
Keywords: 孤独症谱系障碍, 益生菌, 应用行为分析法, 儿童
Abstract
Objective
To study the effect of probiotics combined with applied behavior analysis (ABA) in the treatment of children with autism spectrum disorder (ASD).
Methods
A total of 41 children with ASD who attended the Affiliated Hospital of Jiangsu University from May 2019 to December 2020 were enrolled and randomly divided into an observation group with 21 children and a control group with 20 children. The children in the observation group were given oral probiotics combined with ABA intervention, while those in the control group were given ABA intervention alone. The treatment outcomes were compared between the two groups. Autism Treatment Evaluation Checklist (ATEC) was used to evaluate the severity of behavioral symptoms in both groups before intervention and at 3 months after intervention. The fecal samples were collected to analyze the difference in intestinal flora between the two groups based on 16s rRNA high-throughput sequencing.
Results
Before intervention, there was no significant difference in the ATEC score between the observation and control groups (P>0.05). At 3 months after intervention, both groups had a significant reduction in the ATEC score, and the observation group had a significantly lower ATEC score than the control group (P<0.05). Before intervention, there was no significant difference in the composition of intestinal flora between the observation and control groups. At 3 months after intervention, there was a significant difference in the composition of intestinal flora between the observation and control groups. Compared with the control group, the observation group had significantly higher relative abundances of Bifidobacterium, Lactobacillus, Coprobacillus, Ruminococcus, Prevotella, and Blautia (P<0.05) and significantly lower relative abundances of Shigella and Clostridium (P<0.05).
Conclusions
Probiotics may improve the effect of conventional ABA intervention in children with ASD by regulating intestinal flora.
Keywords: Autism spectrum disorder, Probiotics, Applied behavior analysis, Child
孤独症谱系障碍(autism spectrum disorder,ASD)是一种神经发育广泛障碍性疾病,其主要临床特点包括言语及社交障碍、兴趣狭窄、重复刻板行为等[1]。目前,ASD具体病因仍不十分明确,多认为由遗传和环境两方面因素共同作用引发[2],其较高致残率和较差预后造成了家庭及社会的沉重负担[3]。
ASD患儿多在医院康复训练中心或特殊教育培训机构接受应用行为分析法(applied behavior analysis,ABA)干预,可以在一定程度上改善其行为表现[4]。较多ASD患儿伴有消化道症状,包括腹泻、便秘、腹痛、呕吐等[5]。研究证实,益生菌可通过改善ASD患者肠道微生态失衡减轻消化道症状[6]。作者前期研究已证实ASD患儿消化道症状与行为表现有一定的相关性[7]。作者推测,益生菌联合ABA干预儿童ASD有可能比传统ABA干预更好地改善其行为表现。
为论证以上推测,本研究对2019年5月至2020年12月经江苏大学附属医院儿童康复中心明确诊断为ASD的41例患儿进行随机分组干预,观察疗效,以便为临床治疗儿童ASD提供参考。
1. 资料与方法
1.1. 研究对象
本研究是前瞻性随机对照研究。选取2019年5月至2020年12月在江苏大学附属医院儿童康复中心明确诊断为ASD的患儿作为研究对象。纳入标准:(1)年龄3~6岁;(2)符合《精神疾病诊断及统计手册》第5版中关于ASD的诊断标准[8];(3)监护人文化程度在初中以上。排除标准:(1)伴有其他发育障碍性疾病;(2)患有其他急慢性疾病;(3)监护人不能配合完成相应评估。本研究已通过江苏大学附属医院生物医学研究伦理委员会审查(SWYXLL20200121-19),患儿监护人均签署知情同意书。最终有41例ASD患儿纳入本研究,随机分为观察组(n=21)和对照组(n=20),分组人员不参与ASD患儿的评估和治疗。
1.2. 研究方法
所有纳入本研究的观察组和对照组ASD患儿均在江苏大学附属医院儿童康复中心由专业康复治疗师运用ABA进行训练干预3个月,每周训练28~35 h,包括语言、模仿、社交、自理、认知、大运动和精细动作等7个方面能力的训练。观察组除ABA干预治疗外,同时给予双歧杆菌三联活菌散(上海上药信谊药厂有限公司;国药准字:S10970105;产品批号:08120200712-1;2 g/包,含长型双歧杆菌、嗜酸乳杆菌、粪肠球菌活菌数分别应不低于2.0×107 CFU)口服,每次0.5包,每天3次,连续服药3个月。
在干预前、干预后3个月分别依据孤独症治疗评估量表(Autism Treatment Evaluation Checklist,ATEC)对两组患儿行为症状的严重程度进行评分。ATEC评分旨在对ASD患儿的治疗效果进行动态评估,包括表达/语言沟通(14个项目)、社交能力(20个项目)、感知/认知能力(18个项目)和健康/生理/行为(25个项目)等4个部分总计77个项目评分[9]。在干预前、干预后3个月分别留取患儿的粪便标本,基于16s rRNA高通量测序分析两组患儿的肠道菌群差异。
1.3. 粪便标本采集
在干预前、干预后3个月分别采集观察组和对照组ASD患儿的粪便,立即-80℃保存备用。嘱患儿先排空小便,防止尿液污染,影响检测结果,使用专用无菌粪便采集盒留取粪便。取样前洗手、戴口罩及无菌手套,取便棒深入粪便,取大约2 g粪便保存。同时,标记好标号、姓名、日期,经核对确认无误后建立数据库。
1.4. 肠道菌群检测
肠道菌群检测采用16s rRNA高通量测序技术,流程包括以下步骤:(1)基因组DNA提取:选用德国QIAGEN公司QIAamp® DNA Stool Mini Kit试剂盒对粪便标本的基因组DNA进行提取,之后采用Onedrop仪器和琼脂糖凝胶电泳检测DNA的纯度和浓度。(2)PCR扩增:取2.5 ng稀释后的基因组DNA,以此作为模板,使用带有条形码的16s V4通用引物(515F-806R)和美国Promega公司的GoTaq® Hot Start Colorless Master Mix高效高保真酶进行PCR,确保扩增效率和准确性。(3)PCR产物的均一化和纯化:PCR产物使用Pico Green荧光定量检测DNA浓度;根据PCR产物浓度进行等浓度混样,充分混匀后使用德国Qiagen公司的QIAquick® PCR Purification Kit试剂盒纯化回收产物。(4)文库构建和上机测序:回收产物后进行第二轮扩增,引入美国Illumina公司的桥式PCR兼容引物,扩增产物使用Pico Green荧光定量及Agilent 2200 TapeStation电泳工作平台检测,合格后使用MiSeq台式测序仪进行上机测序。(5)测序结果处理:采用Illumina MiSeq测序平台得到的下机数据存在一定的低质量数据,会干扰分析的结果,因此在进一步分析前,需要对下机数据进行预处理,具体处理步骤如下:①对高通量测序的原始数据首先根据样品条形码的信息,将单个样品数据拆分出来,取出引物序列,进行测序序列质量控制;②通过质量检查的序列,应用Ribo-somal Database Project数据库Classifier 2.3,使用Silva数据库进行序列比对,确定每条序列的分类等级(界、门、纲、目、科、属、种);③应用Mothur软件进行分类操作单元(operational taxo-nomic units,OTUs)划分,以序列相似性97%为标准,将这些序列划分为OTUs,并按照序列数量生成OTUs丰度谱。获取每个粪便标本的OTUs和分类谱系的基本分析结果后,再进行OTUs丰度分析。属水平某菌群相对丰度=某菌群基因拷贝数/总拷贝数。
1.5. 统计学分析
采用SPSS 20.0统计学软件对数据进行统计学分析。正态分布的计量资料以均数±标准差( )表示,两组间比较采用两样本t检验或配对t检验。非正态分布的计量资料以中位数(四分位数间距)[M(P 25,P 75)]表示,两组间比较行Mann-Whitney U检验。两组间肠道菌群构成差异的比较采用主成分分析(principal component analysis,PCA)。P<0.05为差异有统计学意义。
2. 结果
2.1. 两组ASD患儿一般资料的比较
观察组ASD患儿21例,年龄3~6岁,男16例,女5例。对照组ASD患儿20例,年龄3~6岁,男15例,女5例。观察组与对照组性别、年龄、身高/体重/体重指数Z评分的差异均无统计学意义(P>0.05),见表1。
表1.
观察组与对照组一般资料的比较 ( ±s)
| 组别 | 例数 | 性别 (男/女) | 年龄 (岁) | 身高Z评分 | 体重Z评分 | 体重指数Z评分 |
|---|---|---|---|---|---|---|
| 对照组 | 20 | 15/5 | 4.5±1.8 | 0.3±1.3 | -0.2±1.1 | 0.4±1.2 |
| 观察组 | 21 | 16/5 | 4.6±1.7 | 0.3±1.4 | -0.2±1.2 | 0.5±1.1 |
| /t值 | 0.008 | 1.633 | 0.778 | 0.997 | 1.412 | |
| P值 | 0.929 | 0.120 | 0.451 | 0.365 | 0.186 |
2.2. 两组ASD患儿ATEC评分的比较
干预前,观察组与对照组ATEC总评分及各部分评分比较差异均无统计学意义(P>0.05)。干预后3个月,观察组与对照组ATEC总评分及各部分评分均较干预前明显下降(P<0.05),且观察组ATEC总评分及各部分评分均低于对照组(P<0.05)。见表2~5。
表2.
干预前观察组与对照组ATEC评分的比较 ( ±s)
| 组别 | 例数 | 表达/语言沟通 | 社交能力 | 感知/认知能力 | 健康/生理/行为 | 总评分 |
|---|---|---|---|---|---|---|
| 对照组 | 20 | 15±7 | 21±8 | 19±7 | 27±10 | 82±27 |
| 观察组 | 21 | 16±7 | 21±7 | 19±6 | 28±10 | 84±27 |
| t值 | 1.877 | 1.702 | 1.101 | 0.849 | 1.115 | |
| P值 | 0.081 | 0.110 | 0.354 | 0.401 | 0.302 |
表5.
干预前、干预后3个月观察组ATEC评分的比较 ( ±s)
| 组别 | 例数 | 表达/语言沟通 | 社交能力 | 感知/认知能力 | 健康/生理/行为 | 总评分 |
|---|---|---|---|---|---|---|
| 干预前 | 21 | 16±7 | 21±7 | 19±6 | 28±10 | 84±27 |
| 干预后3个月 | 21 | 9±5 | 15±5 | 12±5 | 20±7 | 57±23 |
| t值 | 2.529 | 2.886 | 2.844 | 2.862 | 3.154 | |
| P值 | 0.020 | 0.008 | 0.010 | 0.009 | 0.005 |
表3.
干预后3个月观察组与对照组ATEC评分的比较 ( ±s)
| 组别 | 例数 | 表达/语言沟通 | 社交能力 | 感知/认知能力 | 健康/生理/行为 | 总评分 |
|---|---|---|---|---|---|---|
| 对照组 | 20 | 12±5 | 18±6 | 15±6 | 24±9 | 70±25 |
| 观察组 | 21 | 9±5 | 15±5 | 12±5 | 20±7 | 57±23 |
| t值 | 2.412 | 2.708 | 2.601 | 2.976 | 2.894 | |
| P值 | 0.021 | 0.010 | 0.015 | 0.005 | 0.007 |
表4.
干预前、干预后3个月对照组ATEC评分的比较 ( ±s)
| 组别 | 例数 | 表达/语言沟通 | 社交能力 | 感知/认知能力 | 健康/生理/行为 | 总评分 |
|---|---|---|---|---|---|---|
| 干预前 | 20 | 15±7 | 21±8 | 19±7 | 27±10 | 82±27 |
| 干预后3个月 | 20 | 12±5 | 18±6 | 15±6 | 24±9 | 70±25 |
| t值 | 2.095 | 2.350 | 2.392 | 2.274 | 2.362 | |
| P值 | 0.048 | 0.033 | 0.029 | 0.035 | 0.031 |
2.3. 两组ASD患儿肠道菌群PCA分析
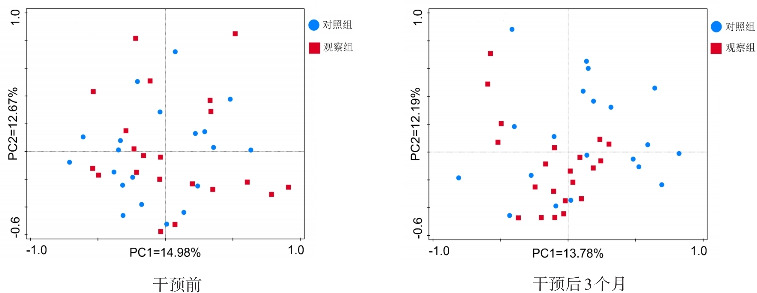
干预前,观察组与对照组肠道菌群构成情况无明显差异,第一主成分对样品差异的贡献值为14.98%;第二主成分对样品差异的贡献值为12.67%。干预后3个月,观察组与对照组肠道菌群构成情况存在明显差异,第一主成分对样品差异的贡献值为13.78%;第二主成分对样品差异的贡献值为12.19%。见图1。
图1. 干预前后观察组和对照组肠道菌群的PCA分析 图中1个点代表1个标本,不同组标本点间离散程度越大,提示肠道菌群构成差异越大,点间离散程度越小,提示肠道菌群构成差异越小。干预前,观察组与对照组肠道菌群构成无明显差异,PC1=14.98%,表示第一主成分对样品差异的贡献值;PC2=12.67%,表示第二主成分对样品差异的贡献值。干预后3个月,观察组与对照组肠道菌群构成存在明显差异;PC1=13.78%,表示第一主成分对样品差异的贡献值;PC2=12.19%,表示第二主成分对样品差异的贡献值。.
2.4. 两组ASD患儿肠道菌群的比较
干预后3个月,在肠道菌群门水平上显示,观察组和对照组肠道菌群均主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门及疣微菌门这5个菌门构成,包含了所有样本丰度98.54%的菌群,两组之间优势菌门的相对丰度比较差异均无统计学意义(P>0.05),见表6。
表6.
干预后3个月观察组与对照组在肠道菌群门水平上相对丰度的比较 ( ±s,%)
| 组别 | 例数 | 厚壁菌门 | 拟杆菌门 | 变形菌门 | 放线菌门 | 疣微菌门 |
|---|---|---|---|---|---|---|
| 对照组 | 20 | 55.29±15.64 | 29.42±6.92 | 4.23±1.31 | 6.09±1.72 | 1.12±0.14 |
| 观察组 | 21 | 56.73±16.32 | 28.48±5.81 | 4.04±1.42 | 6.33±1.62 | 1.16±0.13 |
| t值 | 0.679 | 1.065 | 0.776 | 1.007 | 1.019 | |
| P值 | 0.501 | 0.316 | 0.452 | 0.361 | 0.350 |
干预后3个月,在肠道菌群属水平上显示,观察组双歧杆菌属、乳杆菌属、粪杆菌属、瘤胃菌属、普雷沃菌属、布劳特菌属的相对丰度明显高于对照组(P<0.05),志贺氏菌属、梭状菌属的相对丰度明显低于对照组(P<0.05),见表7。
表7.
干预后3个月观察组与对照组在肠道菌群属水平上相对丰度的比较 [M(P 25,P 75),%]
| 组别 | 例数 | 双歧杆菌属 | 乳杆菌属 | 粪杆菌属 | 瘤胃菌属 | 普雷沃菌属 | 布劳特菌属 | 志贺氏菌属 | 梭状菌属 |
|---|---|---|---|---|---|---|---|---|---|
| 对照组 | 20 | 3.12(1.71, 4.23) | 1.48(0.56, 2.49) | 0.72(0.03, 1.57) | 0.16(0.01, 0.36) | 7.04(3.25, 9.71) | 1.41(0.26, 2.59) | 29.89(2.78, 58.72) | 1.97(0.45, 3.54) |
| 观察组 | 21 | 7.02(3.26, 9.51) | 6.75(2.96, 9.68) | 2.64(0.15, 4.98) | 0.96(0.11, 1.73) | 22.57(10.06, 31.65) | 3.42(1.52, 5.24) | 7.69(0.83, 15.24) | 0.56(0.10, 1.18) |
| U值 | 94 | 50 | 121 | 67 | 47 | 130 | 126 | 54 | |
| P值 | 0.002 | <0.001 | 0.020 | 0.001 | <0.001 | 0.039 | 0.032 | <0.001 |
3. 讨论
ABA主要针对ASD患儿在语言、交流和感知运动等方面的缺陷,进行针对性教育训练,以正强化技术加强其对训练内容的理解和服从,改善语言交流,纠正不当情绪及行为,有效改善其社会功能,提高生存、发展能力[10]。多数学者证实ABA是治疗ASD儿童的一种非常有效的方法[11]。有学者证实ATEC评分具有较高的信度和效度,可以反映ASD患儿症状的严重程度,且对于ASD患儿治疗后的症状变化比较敏感,对治疗效果的评估明显优于孤独症儿童行为检查量表和儿童孤独症评定量表[12-13]。口服益生菌可改善ASD患儿便秘、腹痛、呕吐、腹泻等消化道症状[6],而ASD患儿消化道症状与行为表现有一定的相关性[7-14]。本研究结果显示,观察组口服益生菌联合ABA干预ASD患儿3个月后,ATEC评分明显低于仅采用ABA干预的对照组。这说明联合益生菌治疗可进一步改善传统ABA干预儿童ASD的疗效。
益生菌是可实现工业化生产的活的微生物,适量口服对宿主健康有益,其所含微生物组分本身就是宿主肠道菌群的一部分,较多用于纠正肠道菌群失衡,改善肠道功能[15]。本研究中采用益生菌为双歧杆菌三联活菌散,包含长型双歧杆菌、嗜酸乳杆菌和粪肠球菌。3种活菌定植部位不同,双歧杆菌在结肠,乳杆菌在回盲部,肠球菌范围广泛,对人体肠道起到全面的保护作用[16]。肠道的正常功能维持由中枢神经、肠神经、自主神经及下丘脑-垂体-肾上腺轴共同支配,大脑先将传入信息整合,后通过神经内分泌系统及自主神经将调控信息传出到肠神经丛及肠道平滑肌细胞,产生一系列相关效应[17]。这种双向神经传导通路被称为肠-脑轴,而介导脑、肠发挥双向作用的桥梁被认为是肠道菌群,因此又被称为微生物-肠-脑轴[18]。研究表明,ASD的发生、发展极可能与肠道菌群失衡有关[19],纠正肠道菌群失调则很可能在一定程度上阻止ASD的发生、发展。双歧杆菌和嗜酸乳杆菌可以产生乙酸、丙酸、丁酸及乳酸等有机酸,竞争性抑制人体肠道有害细菌的生长,并促进肠蠕动防止便秘。双歧杆菌还可以部分阻断致病菌和毒素的结合位点,作用机制可能是通过胞外酶降解肠上皮细胞表面的多糖结构[20]。嗜酸乳杆菌还能合成嗜酸乳菌素、嗜酸杆菌素及乳酸菌素,对肠道致病菌有拮抗作用。粪肠球菌可产生细菌素,有效抑制志贺氏菌和沙门氏菌等病原菌过度生长,对维持肠道微环境稳定有重要作用。本研究中,干预前观察组与对照组肠道菌群PCA分析无明显差异,干预后3个月观察组与对照组肠道菌群PCA分析存在明显差异,提示口服益生菌可有效纠正ASD患儿的肠道菌群失调,从而明显改善其相关症状。
本研究中,干预后3个月,观察组和对照组两组ASD患儿肠道菌群在门水平上均主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门及疣微菌门这5个菌门构成,两组之间优势菌门的相对丰度均无显著性差异。既往有研究发现,与正常对照组儿童相比,ASD患儿肠道菌群中拟杆菌门比例升高,厚壁菌门比例降低,差异有统计学意义,其他菌门比例无明显改变[21]。另一项研究表明,ASD患儿粪便中仅厚壁菌门比例显著降低,其他菌门比例变化不明显[22]。但也有研究显示,ASD患儿与健康儿童在拟杆菌门、厚壁菌门、变形菌门等8个主要菌门上的比例差异均无统计学意义[23],甚至有学者发现ASD患儿厚壁菌门比例升高而拟杆菌门比例降低的研究结果[24]。目前,国内外研究主要集中在比较ASD患儿与正常儿童肠道菌群构成的差异,而口服益生菌能否在菌门水平上改变ASD患儿的肠道菌群构成还尚未见公开报道,有待更多的研究去证实。
本研究中,干预后3个月,在菌群属水平上观察组与对照组ASD患儿相比,双歧杆菌属、乳杆菌属、粪杆菌属、瘤胃菌属、普雷沃菌属、布劳特菌属的相对丰度明显升高,而志贺氏菌属、梭状菌属的相对丰度明显降低。
双歧杆菌属、乳杆菌属、粪杆菌属和瘤胃菌属均可产生丁酸。丁酸属短链脂肪酸,是肠道菌群无氧发酵的重要代谢产物,与肠道黏膜通透性、血脑屏障功能维持、大脑功能及行为密切相关[25]。丁酸是组蛋白脱乙酰酶-1抑制剂,可调节pH值高敏感双孔钾离子通道-1,促进肠道上皮黏膜屏障的功能恢复[26]。丁酸还可改善细胞氧化应激反应,增强线粒体功能[27]。ASD动物模型研究发现,丁酸还可以通过调控额叶脑皮质兴奋性/抑制性基因的转录过程从而改善其行为症状[28]。研究发现,丁酸在ASD患儿肠道中的水平较正常儿童明显降低[29]。粪杆菌属主要定植在结肠,既可合成丁酸,又可抑制肠道上皮细胞NF-κB活化及IL-8生成,从而阻止炎症反应,维护结肠黏膜屏障功能,减少有害物质进入血循环和大脑[30]。普雷沃菌属的主要发酵产物是乙酸和琥珀酸,可抑制肠道有害菌过度生长,而布劳特菌属可以帮助清除肠道中的气体,可能与肠易激综合征相关[31]。调节肠道菌群,尤其是可产生丁酸盐的细菌,可能是治疗ASD的一个有效策略。以丁酸为代表的短链脂肪酸可能通过多种机制参与ASD的发生、发展,包括:(1)通过促进Ca2+依赖的5-羟色胺、谷氨酸及多巴胺的释放,促进合成儿茶酚胺;(2)通过抑制γ-氨基丁酸受体活化短链脂肪酸-G蛋白偶联受体,增加谷氨酸受体敏感性;(3)通过细胞内酸化引起缝隙连接关闭及线粒体功能障碍[32]。志贺氏菌属即痢疾杆菌,痢疾志贺氏菌群是导致典型细菌性痢疾的病原菌,在敏感人群中少数的细菌载量就可以发病。梭状菌属和脱硫弧菌是引起ASD患儿胃肠道症状及孤独症行为的常见细菌。有学者发现,ASD患儿粪便中梭状菌属比正常对照组高10倍,且用抗生素治疗梭状菌属所致慢性腹泻后,ASD患儿的行为评分显著改善[33]。3-羟基苯基-3羟基丙酸是梭状菌属的一种代谢产物,可耗竭脑内儿茶酚胺,产生ASD症状,提示梭状菌属与ASD病因具有相关性,梭状菌属还可产生对甲酚和神经毒素,促进合成丙酸,诱发炎症反应[34]。在肠道代谢过程中,肠道菌群产生5-羟色胺、儿茶酚胺、γ-氨基丁酸等神经递质和短链脂肪酸等脂肪及氨基酸代谢产物,可通过肠上皮细胞及肠嗜铬细胞的表面受体激活肠神经系统的传入神经影响中枢神经系统[35-36]。如果肠道菌群发生明显异常,相关神经递质和代谢产物的种类、数量也将发生异常,从而导致中枢神经系统功能异常及行为异常。本研究证实,口服益生菌可通过在属水平上上调有益菌群并抑制有害菌群,纠正ASD患儿菌群失调,改善其临床症状。
综上所述,本研究发现益生菌可能通过调节肠道菌群微生态进一步改善传统ABA干预儿童ASD的疗效,但其具体机制尚需肠道代谢组学等进一步研究证实。另外,本研究为单中心研究,并且样本数较少,研究结论还需多中心大样本研究进一步证实,为以后临床广泛应用益生菌联合ABA干预儿童ASD提供更可靠的理论依据。
基金资助
江苏省人口学会开放基金资助项目(JSPA2019025)。
利益冲突声明
所有作者均声明不存在利益冲突。
参考文献
- 1. 唐婷, 朱江, 郭敏, 等. 孤独症谱系障碍儿童便秘及睡眠问题与情绪行为问题的关系[J].重庆医科大学学报, 2020, 45(1): 85-90. DOI: 10.13406/j.cnki.cyxb.001940. [DOI] [Google Scholar]
- 2. Baio J, Wiggins L, Christensen DL, et al. Prevalence of autism spectrum disorder among children aged 8 years—autism and developmental disabilities monitoring network, 11 sites, United States, 2014[J].MMWR Surveill Summ, 2018, 67(6): 1-23. PMID: . PMCID: . DOI: 10.15585/mmwr.ss6706a1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. 中华医学会儿科学分会发育行为学组, 中国医师协会儿科分会儿童保健专业委员会, 儿童孤独症诊断与防治技术和标准研究项目专家组 . 孤独症谱系障碍患儿常见共患问题的识别与处理原则[J].中华儿科杂志, 2018, 56(3): 174-178. PMID: . DOI: 10.3760/cma.j.issn.0578-1310.2018.03.004. [DOI] [PubMed] [Google Scholar]
- 4. Roane HS, Fisher WW, Carr JE. Applied behavior analysis as treatment for autism spectrum disorder[J].J Pediatr, 2016, 175: 27-32. PMID: . DOI: 10.1016/j.jpeds.2016.04.023. [DOI] [PubMed] [Google Scholar]
- 5. 李珂, 江晓东, 季忆婷, 等. 孤独症谱系障碍儿童胃肠问题检出情况初探[J].上海交通大学学报(医学版), 2017, 37(11): 1506-1511. DOI: 10.3969/j.issn.1674-8115.2017.11.010. [DOI] [Google Scholar]
- 6. Ding HT, Taur Y, Walkup JT. Gut microbiota and autism: key concepts and findings[J].J Autism Dev Disord, 2017, 47(2): 480-489. PMID: . DOI: 10.1007/s10803-016-2960-9. [DOI] [PubMed] [Google Scholar]
- 7. 李玉勤, 孙映红, 梁亚鹏, 等. 孤独谱系障碍患儿消化道症状与行为表现关系分析[J].中国儿童保健杂志, 2020, 28(11): 1259-1262. DOI: 10.11852/zgetbjzz2020-0412. [DOI] [Google Scholar]
- 8. Regier DA, Kuhl EA, Kupfer DJ. The DSM-5: classification and criteria changes[J].World Psychiatry, 2013, 12(2): 92-98. PMID: . PMCID: . DOI: 10.1002/wps.20050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Mahapatra S, Khokhlovich E, Martinez S, et al. Longitudinal epidemiological study of autism subgroups using Autism Treatment Evaluation Checklist (ATEC) score[J].J Autism Dev Disord, 2020, 50(5): 1497-1508. PMID: . PMCID: . DOI: 10.1007/s10803-018-3699-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Stanislaw H, Howard J, Martin C. Helping parents choose treatments for young children with autism: a comparison of applied behavior analysis and eclectic treatments[J].J Am Assoc Nurse Pract, 2020, 32(8): 571-578. PMID: . DOI: 10.1097/JXX.0000000000000290. [DOI] [PubMed] [Google Scholar]
- 11. Yu Q, Li EY, Li LG, et al. Efficacy of interventions based on applied behavior analysis for autism spectrum disorder: a meta-analysis[J].Psychiatry Investig, 2020, 17(5): 432-443. PMID: . PMCID: . DOI: 10.30773/pi.2019.0229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Al Backer NB. Correlation between Autism Treatment Evaluation Checklist (ATEC) and Childhood Autism Rating Scale (CARS) in the evaluation of autism spectrum disorder[J].Sudan J Paediatr, 2016, 16(1): 17-22. PMID: . PMCID: . [PMC free article] [PubMed] [Google Scholar]
- 13. 方慧, 任艳玲, 李春燕, 等. 孤独症治疗评定量表中文版的信度和效度检验[J].四川精神卫生, 2019, 32(6): 518-522. DOI: 10.11886/scjsws20190902002. [DOI] [Google Scholar]
- 14. 朱江, 郭敏, 杨亭, 等. 孤独症谱系障碍患儿胃肠道症状与行为表现关系研究[J].中华儿科杂志, 2017, 55(12): 905-910. PMID: . DOI: 10.3760/cma.j.issn.0578-1310.2017.12.007. [DOI] [PubMed] [Google Scholar]
- 15. Schrenzel J, Lazarevic V. Intestinal microbiota: towards therapeutic applications[J].Rev Med Suisse, 2017, 13(582): 1959-1961. PMID: . [PubMed] [Google Scholar]
- 16. Pulikkan J, Maji A, Dhakan DB, et al. Gut microbial dysbiosis in Indian children with autism spectrum disorders[J].Microb Ecol, 2018, 76(4): 1102-1114. PMID: . DOI: 10.1007/s00248-018-1176-2. [DOI] [PubMed] [Google Scholar]
- 17. Averina OV, Danilenko VN. Human intestinal microbiota: role in development and functioning of the nervous system[J].Mikrobiologiia, 2017, 86(1): 5-24. PMID: . [PubMed] [Google Scholar]
- 18. 赵英欣, 张旭静, 郑毅. 肠道微生物-大脑轴与孤独症谱系障碍[J].中华精神科杂志, 2019, 52(3): 224-227. DOI: 10.3760/cma.j.issn.1006-7884.2019.03.010. [DOI] [Google Scholar]
- 19. Strati F, Cavalieri D, Albanese D, et al. New evidences on the altered gut microbiota in autism spectrum disorders[J].Microbiome, 2017, 5(1): 24. PMID: . PMCID: . DOI: 10.1186/s40168-017-0242-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Grimaldi R, Gibson GR, Vulevic J, et al. A prebiotic intervention study in children with autism spectrum disorders (ASDs)[J].Microbiome, 2018, 6(1): 133. PMID: . PMCID: . DOI: 10.1186/s40168-018-0523-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Ferguson BJ, Marler S, Altstein LL, et al. Psychophysiological associations with gastrointestinal symptomatology in autism spectrum disorder[J].Autism Res, 2017, 10(2): 276-288. PMID: . PMCID: . DOI: 10.1002/aur.1646. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. 赵锐豪, 郑鹏远, 刘思濛, 等. 孤独症谱系障碍儿童肠道菌群与行为症状的相关研究[J].中国当代儿科杂志, 2019, 21(7): 663-669. PMID: . PMCID: . DOI: 10.7499/j.issn.1008-8830.2019.07.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. 吴薇岚, 江蕙芸, 陈雪, 等. 孤独症谱系障碍儿童肠道菌群多样性的研究[J].中国儿童保健杂志, 2020, 28(9): 980-984. DOI: 10.11852/zgetbjzz2019-1045. [DOI] [Google Scholar]
- 24. Adams JB, Borody TJ, Kang DW, et al. Microbiota transplant therapy and autism: lessons for the clinic[J].Expert Rev Gastroenterol Hepatol, 2019, 13(11): 1033-1037. PMID: . DOI: 10.1080/17474124.2019.1687293. [DOI] [PubMed] [Google Scholar]
- 25. Fung TC, Olson CA, Hsiao EY. Interactions between the microbiota, immune and nervous systems in health and disease[J].Nat Neurosci, 2017, 20(2): 145-155. PMID: . PMCID: . DOI: 10.1038/nn.4476. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Sgritta M, Dooling SW, Buffington SA, et al. Mechanisms underlying microbial-mediated changes in social behavior in mouse models of autism spectrum disorder[J].Neuron, 2019, 101(2): 246-259.e6. PMID: . PMCID: . DOI: 10.1016/j.neuron.2018.11.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Maqsood R, Stone TW. The gut-brain axis, BDNF, NMDA and CNS disorders[J].Neurochem Res, 2016, 41(11): 2819-2835. PMID: . DOI: 10.1007/s11064-016-2039-1. [DOI] [PubMed] [Google Scholar]
- 28. Lammert CR, Frost EL, Bolte AC, et al. Cutting edge: critical roles for microbiota-mediated regulation of the immune system in a prenatal immune activation model of autism[J].J Immunol, 2018, 201(3): 845-850. PMID: . PMCID: . DOI: 10.4049/jimmunol.1701755. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Port RG, Gaetz W, Bloy L, et al. Exploring the relationship between cortical GABA concentrations, auditory gamma-band responses and development in ASD: evidence for an altered maturational trajectory in ASD[J].Autism Res, 2017, 10(4): 593-607. PMID: . PMCID: . DOI: 10.1002/aur.1686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Lee E, Kim BJ, Kang MJ, et al. Dynamics of gut microbiota according to the delivery mode in healthy Korean infants[J].Allergy Asthma Immunol Res, 2016, 8(5): 471-477. PMID: . PMCID: . DOI: 10.4168/aair.2016.8.5.471. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. 吴晓丽, 梁姗, 王涛, 等. 肠道微生物与自闭症研究进展[J].科学通报, 2018, 63(18): 1803-1821. DOI: 10.1360/N972017-01186. [DOI] [Google Scholar]
- 32. Robertson CE, Ratai EM, Kanwisher N. Reduced GABAergic action in the autistic brain[J].Curr Biol, 2016, 26(1): 80-85. PMID: . DOI: 10.1016/j.cub.2015.11.019. [DOI] [PubMed] [Google Scholar]
- 33. Pequegnat B, Sagermann M, Valliani M, et al. A vaccine and diagnostic target for Clostridium bolteae, an autism-associated bacterium[J].Vaccine, 2013, 31(26): 2787-2790. PMID: . DOI: 10.1016/j.vaccine.2013.04.018. [DOI] [PubMed] [Google Scholar]
- 34. Lobzhanidze G, Japaridze N, Lordkipanidze T, et al. Behavioural and brain ultrastructural changes following the systemic administration of propionic acid in adolescent male rats. Further development of a rodent model of autism[J].Int J Dev Neurosci, 2020, 80(2): 139-156. PMID: . DOI: 10.1002/jdn.10011. [DOI] [PubMed] [Google Scholar]
- 35. Careaga M, Rogers S, Hansen RL, et al. Immune endophenotypes in children with autism spectrum disorder[J].Biol Psychiatry, 2017, 81(5): 434-441. PMID: . PMCID: . DOI: 10.1016/j.biopsych.2015.08.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Estes ML, McAllister AK. Brain, immunity, gut: "BIG" links between pregnancy and autism[J].Immunity, 2017, 47(5): 816-819. PMID: . DOI: 10.1016/j.immuni.2017.10.019. [DOI] [PMC free article] [PubMed] [Google Scholar]


