Abstract
Die Peritonealdialyse (PD) war früher eine geläufige Behandlung beim akuten dialysepflichtigen Nierenversagen. Zugunsten kontinuierlicher, extrakorporaler Nierenersatzverfahren verschwand sie von der Bildfläche der westlichen Welt, wohingegen sie in strukturarmen Ländern aufgrund ihrer Simplizität und geringen Ressourcenintensität weiter eingesetzt wird. Die Engpässe in der medizinischen Versorgung im Rahmen der COVID-19(„coronavirus disease 2019“)-Pandemie führten kürzlich zu erneuter weltweiter Beachtung der PD als sichere Option beim akuten dialysepflichtigen Nierenversagen. Von der Einführung biokompatibler Lösungen vor 20 Jahren war eine Reduktion von Mortalität oder technischem Versagen erwartet worden. Leider konnten Studien dieses bisher allenfalls andeuten, nicht aber beweisen. Eine innovative Option stellen immunmodulatorische Adjuvanzien dar, die die lokale Immunkompetenz verbessern und den Verlust der Funktion des Peritoneums verhindern sollen. Derzeit rückt die Vision einer tragbaren künstlichen Niere immer näher. Auch eine Intensivierung der Dialysedosis erscheint mit minimaler Dialysatmenge erreichbar. In Zeiten der globalen Erderwärmung könnten durch die Regeneration von Dialysat nicht nur relevante Mengen an Wasser eingespart, sondern auch die CO2-Bilanz günstig beeinflusst werden. Zusammenfassend erlebt die PD derzeit einen zweiten Frühling. Dieser Artikel beschreibt die derzeitigen und zukünftigen Entwicklungen dieses Verfahrens.
Schlüsselwörter: Akutes dialysepflichtiges Nierenversagen, Perkutane Katheteranlage, Immunmodulatorische Adjuvanzien, Alanyl-Glutamin-Supplementation, Tragbare Cycler
Abstract
Peritoneal dialysis used to be a common treatment for acute kidney failure that required dialysis. In favor of continuous, extracorporeal renal replacement procedures, it disappeared from the scene in the western world, whereas it continues to be used in structurally poor countries due to its simplicity and low resource intensity. Recently, the shortages in medical care in the context of the coronavirus disease 2019 (COVID-19) pandemic led to renewed worldwide interest in peritoneal dialysis as a safe option in acute kidney failure requiring dialysis. The introduction of biocompatible solutions 20 years ago was expected to reduce mortality or technical failure. Unfortunately, so far this could only be implied but not confirmed in studies. Immunomodulatory adjuvants are an innovative option which have the potential to improve the local immunocompetence and prevent the loss of peritoneal function. Currently, the vision of a wearable artificial kidney is getting closer. Intensification of dialysis dose also appears achievable with minimal dialysate volumes. In times of global warming, the regeneration of dialysates could not only save relevant amounts of water but also have a favorable impact on the CO2 balance. In summary, peritoneal dialysis is currently enjoying a comeback. This article describes the current and future developments of this procedure.
Keywords: Acute kidney injury requiring dialysis, Percutaneous catheterization, Immunomodulatory adjuvants, Alanyl-glutamine supplementation, Wearable cyclers
Peritonealdialyse im akuten Nierenversagen
Präambel
Obwohl sie in den 1970er-Jahren ein vielgenutztes Verfahren beim akuten Nierenversagen war, wird die Peritonealdialyse (PD) durch die Entwicklung der kontinuierlichen Hämodialyse(HD)-Modalitäten über die letzten Jahrzehnte deutlich seltener angewendet [24, 29]. Während der letzten 10 Jahre erlebte die Akut-PD einen Aufschwung durch das Aufkommen randomisierter, kontrollierter Studien, die Evidenz für ihre sichere Anwendung beim schweren akuten Nierenversagen im Vergleich zu den extrakorporalen Nierenersatzverfahren geschaffen haben.
Während der letzten 10 Jahre erlebte die Akut-PD einen Aufschwung
In den Entwicklungs- und Schwellenländern ist keine flächendeckende HD verfügbar, sodass hier die Akut-PD aufgrund ihres einfachen und ressourcenschonenden Charakters als Routineverfahren eingesetzt wird. Die pflegerische Betreuung ist wesentlich weniger zeit- und ausbildungsintensiv; zudem ist für ihre Anwendung weder das Vorhandensein von Strom noch von fließendem Wasser notwendig [10]. Im Rahmen der COVID-19(„coronavirus disease 2019“)-Pandemie ist es auch in den westlichen Ländern zu Engpässen bei der Versorgung von Patienten mit dialysepflichtigem akuten Nierenversagen gekommen. London und New York waren zeitweise besonders hohen Inzidenzzahlen ausgesetzt und berichteten über die erfolgreiche Etablierung von Notfall-PD-Teams und bettseitigen, nichtchirurgischen Katheteranlagestrategien [6]. Auf den Intensivstationen konnte die PD erfolgreich beim ARDS („acute respiratory distress syndrome“) eingesetzt werden [8]. Spezielle Herausforderungen im Zusammenhang mit der Coronavirusinfektion stellen die Hyperkoagulabilität und die damit verbundenen technischen Probleme an der HD dar, die bei der PD umgangen werden. Es ist davon auszugehen, dass sich diese positiven Erfahrungen auch nach der COVID-19-Pandemie verstetigen.
Präferenz Peritonealdialyse
Die PD bietet gegenüber der HD relevante Vorteile: Mit dem Peritoneum ist eine biokompatible Membran vorhanden und mit dem Wegfall des extrakorporalen Kreislaufs bedarf es keiner Antikoagulation. Bei hämodynamisch instabilen Patienten sowie Patienten, die hohe Volumen- oder Elektrolytschwankungen schlecht tolerieren, ist sie eine attraktive Option.
Dysäquilibrium und schnelle Volumenschwankungen werden bei der HD für den schnellen Verlust der renalen Restfunktion verantwortlich gemacht. Bei der PD werden diese Nachteile vermieden und es kommt deutlich seltener zu Hypotonien. Dementsprechend verkürzte sich in 2 randomisierten, kontrollierten Studien zum akuten Nierenversagen die Zeit bis zur Erholung der Nierenfunktion durch die PD im Vergleich zu extrakorporalen Nierenersatzverfahren [1, 15].
Die Peritonealdialyse bietet gegenüber der Hämodialyse relevante Vorteile
Ein besonders von PD profitierendes Fachgebiet ist die Pädiatrie. Aufgrund der anatomischen Verhältnisse ist das Peritoneum bei Kindern ein effizienterer Dialysator als bei Erwachsenen. Zum einen besteht relativ zum Körpergewicht eine erhöhte Peritonealoberfläche, zum anderen weisen Kinder im Alter unter einem Jahr eine erhöhte peritoneale Kapillardichte auf [33]. So ist es wenig verwunderlich, dass in Europa im Jahr 2019 die PD mit 39,4 % neben den CRRT(„continuous renal replacement therapy“)-Verfahren mit 38,2 % das am häufigsten beim akuten Nierenversagen angewandte Nierenersatzverfahren bei Kindern darstellte [16].
Die extrakorporalen Nierenersatzverfahren sind allerdings in Situationen mit schnellem Handlungsbedarf, wie bei schwerer Hyperkaliämie, Intoxikation, bei fulminanter Sepsis und beim Lungenödem, zu priorisieren. Zudem stellen frische Peritonitiden und Operationen mit Eröffnung der Bauchhöhle sowie pleuroperitoneale Fisteln eine Kontraindikation der Akut-PD dar.
Wahl der Peritonealdialysemodalität
Grundsätzlich wird beim akuten Nierenversagen zur Gewährleistung einer ausreichenden Entgiftung zunächst die automatisierte PD (APD) mit 0,5- bis 2‑stündigen Zyklen empfohlen. Die früher häufig verwendete intermittierende PD spielt aufgrund ihrer geringen Intensität eine untergeordnete Rolle. Einen Überblick über die verschiedenen Modalitäten der Akut-PD gibt Abb. 1.
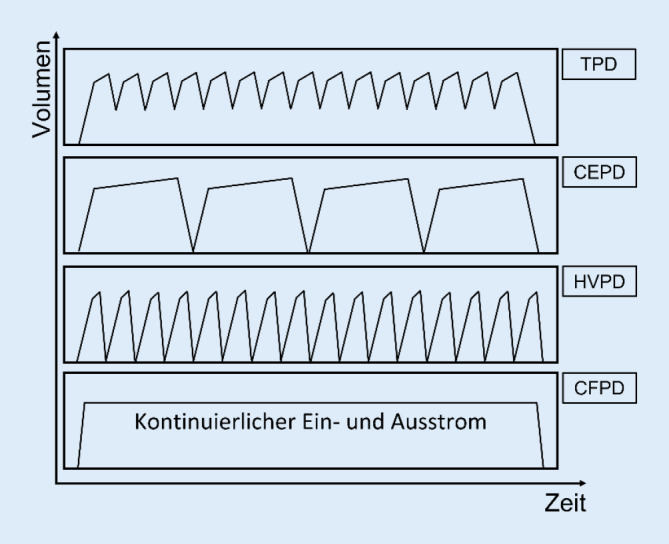
TPD.
Die TPD („tidal PD“) nutzt den Cycler, um lediglich einen gewissen Prozentsatz von etwa 50–75 % des Dialysats mit kurzer Verweilzeit in der Peritonealhöhle auszutauschen. Es wird davon ausgegangen, dass der Stoffaustausch durch den steten Kontakt des Restvolumens mit der Peritonealfläche verbessert wird. Al Hwiesh et al. demonstrierten 2018 in einer randomisierten, kontrollierten Studie eine bessere metabolische Kontrolle und einen besseren Elektrolytausgleich nach 7 Tagen TPD im Vergleich zu kontinuierlicher venovenöser Hämodiafiltration (CVVHDF), wohingegen Letztere hinsichtlich der Ultrafiltration (UF) der TPD innerhalb der ersten 4 Tage überlegen war [1].
CEPD.
Die CEPD („continuous equilibrated PD“) ähnelt der CAPD („continuous ambulatory PD“): Das Dialysat wird mit Verweilzeiten von 2–6 h manuell oder mittels Cycler ausgetauscht. In einer randomisierten, kontrollierten Crossover-Studie war die CEPD der TPD allerdings trotz des gleichen Dialysatvolumens hinsichtlich Entgiftung und UF unterlegen [10]. Die CEPD verfehlte die geforderte mindest-kT/V (Clearance [K] × effektive Dialysezeit in min [t]/60 % der Körpermasse [Gewicht], in der das Blut zirkulieren kann [V]) von 2,1 der Guidelines knapp. Dennoch schlossen die Autoren, dass in leicht hyperkatabolen Patienten beide Verfahren geeignet sind [10].
HVPD.
Die HVPD („high-volume PD“) nutzt ein hohes Behandlungsvolumen von etwa 36–44 l/24 h mit 30- bis 50-minütigen Zyklen. Dieses recht aufwändige Verfahren ist der täglichen HD zumindest hinsichtlich der UF nicht unterlegen [15]. Trotz der signifikant unterschiedlichen Dialysedosis wurde die metabolische Kontrolle nach der gleichen Anzahl von Dialysesitzungen erreicht.
CFPD.
Die CFPD („continuous flow PD“) nutzt einen hohen, kontinuierlichen Dialysatfluss von bis zu 300 ml/min durch die Schaffung zweier intraperitonealer Zugänge oder den Gebrauch von doppellumigen Kathetern. Somit wird der Verlust effektiver Dialysezeit durch Zulauf und Ablauf minimiert und stets der maximale Diffusionsgradient aufrechterhalten. Das verbrauchte Dialysat wird durch eine konventionelle HD-Maschine aufbereitet. Mit diesem Verfahren wird eine 3‑ bis 8‑mal höhere Clearance als bei der APD berichtet, wobei sich die Erfahrung derzeit auf Fallberichte beschränkt [2]. Dieses Verfahren ist aufgrund seiner Komplexität nur in Ausnahmefällen sinnvoll anwendbar.
Angemessenheit von Clearance und Volumenentzug
Die größten Bedenken gegenüber der Akut-PD betreffen ihre Angemessenheit hinsichtlich Clearance und Volumenentzug. Die präzise Wahl der UF und die schnell erzielbare Entgiftung durch die Möglichkeit der Einstellung an der Maschine bei HD stellen einen klaren Vorteil dar. Die früher oft aufgeführte, fehlende metabolische Kontrolle als klassische Limitation der PD konnte jedoch durch den Ersatz der starren PD-Katheter durch flexible Katheter wie auch durch die Verwendung höherer Gesamtbehandlungsvolumina überwunden werden. Durch größere Lumina und seitliche Löcher werden die Fließeigenschaften optimiert [26]. Tab. 1 demonstriert, dass die erreichbare kT/V je nach Intensität der gewählten PD-Modalität zwischen 2,2 und 4,1 variiert, wobei mit den extrakorporalen Nierenersatzverfahren naturgemäß höhere Dialysedosen erzielt werden können. Dabei sind die metabolische Kontrolle und die UF weitestgehend unabhängig von der kT/V [28].
| Studie | |||||
|---|---|---|---|---|---|
| Gabriel (2008) [15] | Ponce (2013) [25] | Al-Hwiesh (2018) [1] | Ponce (2011) [28] | Parapiboon (2017) [23] | |
| Modalität | HVPD vs. „daily HD“ | HVPD vs. „daily EHD“ | TPD vs. CVVHDF | „High intensity PD“ vs. „lower intensity PD“ | „Intensive PD“ vs. „minimal standard PD“ |
| Sepsis | 42 vs. 47 % | 51 vs. 45 % | 62 vs. 69 % | 48 vs. 50 % | 87 vs. 81 % |
| Beatmung | 68 vs. 75 % | 84 vs. 87 % | 62 vs. 69 % | 68 vs. 72 % | 87 vs. 89 % |
| APACHE-II-Score | 26,9 vs. 24,1 | 27,5 vs. 26,7 | 22,1 vs. 21,3 | 26,4 vs. 24,8 | 26,9 vs. 25,7 |
| UF | 2,1 vs. 2,4 l | 0,6 vs. 1,4 l | 0,95 vs. 1,39 l | 2,4 vs. 2,1 l | 2,1 vs. 0,9 l |
| kT/V wöchentlich | 3,6 vs. 4,7 | – | – | 4,13 vs. 3,01 | 2,26 vs. 3,3 |
| kT/V 24 h | – | 0,48 vs. 1,43 | – | – | 0,61 vs. 0,38 |
| Metabolische Kontrolle | n. s. | Tag 3 | Tag 3 | n. s. | n. s. |
| BUN | 48 vs. 25 mg/dl | 40 vs. 61 mg/dl | |||
| Krea | 2,1 vs. 4,3 mg/dl | 3,0 vs. 4,5 mg/dl | |||
| HCO3− | n. s. | 20,2 vs. 18,5 mmol/L | |||
| Katheterassoziierte Infektionen | 18 % vs. 13 % | 16,3 % vs. 19,5 % | 9,5 % vs. 17,7 % | 12,9 % vs. 13,3 % | 15,3 vs. 8,3 % |
| Leckagen | 6,7 % | 15 % | n. a. | 6 % vs. 7 % | 4 % vs. 4 % |
| Mortalität |
58 vs. 53 % n. s. |
63,9 vs. 63,4 % n. s. |
30,2 vs. 53,2 P = 0,002 |
55 vs. 53 % n. s. |
79 vs. 63 % n. s. |
PD Peritonealdialyse, HVPD „high-volume PD“, HD Hämodialyse, TPD „tidal PD“, CVVHDF kontinuierliche venovenöse Hämodiafiltration, kT/V Clearance [K] × effektive Dialysezeit in min [t]/60 % der Körpermasse [Gewicht], in der das Blut zirkulieren kann [V], APACHE II Acute Physiology And Chronic Health Evaluation II, BUN „blood urea nitrogen“, Krea Kreatinin, EHD „extended hemodialysis“, n. s. nicht signifikant, n. a. nicht angegeben
Aktuell existiert kein Konsens über die adäquate Dialysedosis beim akuten Nierenversagen oder die ideale Messmethode zu ihrer Bestimmung [7]. Die KDIGO (Kidney Disease: Improving Global Outcomes) Clinical Practice Guidelines for Acute Kidney Injury 2012 empfehlen für die HD eine Dialysedosis mit einer wöchentlichen kT/V von 3,9. Von der International Society for Peritoneal Dialysis (ISPD) wird für die Akut-PD das Erzielen einer wöchentlichen kT/V von 3,5 für kritisch kranke Patienten empfohlen, um in etwa gleichwertige Verhältnisse zur täglichen HD zu schaffen. Allerdings haben Ponce et al. 2011 gezeigt, dass höhere Dosen weder zu einer Mortalitätsreduktion noch zu einer schnelleren Erholung der Nierenfunktion führen. Dem allgemeinen Konsens zufolge erzielt eine wöchentliche kT/V von mindestens 2,2 für die meisten, insbesondere für die nicht intensivstationären Patienten äquivalente klinische Ergebnisse [12]. Jede dieser Studien wurde im intensivstationären Umfeld durchgeführt; entsprechend ist ein hyperkatabolerer Zustand als bei normalstationären Patienten zu erwarten.
Es existieren 3 systematische Reviews, die die PD beim akuten Nierenversagen mit den extrakorporalen Nierenersatzverfahren vergleichen. Jede dieser Studien stellte den Mangel an ausreichenden, qualitativ hochwertigen Daten fest, kam aber zu dem Schluss, dass die PD hinsichtlich ihrer Mortalität den extrakorporalen Nierenersatzverfahren nicht unterlegen war [9, 21, 38]. Zusammenfassend schlussfolgern die aktuellen ISPD-Guidelines [12], dass die PD beim akuten Nierenversagen als geeignete Behandlungsmethode in allen Situationen erwogen werden sollte.
Klinische Praxis
Die Akut-PD wird direkt im Anschluss an die Katheteranlage begonnen. Innerhalb der ersten 24–48 h wird die Verwendung von niedrigen Füllvolumina (z.B. 20 ml/kg) zur Minimierung des Leckagerisikos und von kurzen Zyklen zur Maximierung von Entgiftung und UF empfohlen [6, 27]. Durch die Verwendung von 4,5 %igen Glukoselösungen und Verkürzung der Verweildauer kann eine UF von bis zu 1 l in 2–4 h erreicht werden [12]. Die Dauer einer Dialysesitzung wird an die Schwere des akuten Nierenversagens angepasst; für normalstationäre Patienten genügen häufig 12h-Sitzungen [6, 10, 27]. Nach Erreichen der metabolischen und der Volumenkontrolle eignen sich zur Optimierung der Elimination von mittel- und großmolekularen Urämietoxinen etwa 4‑ bis 6‑stündige Intervalle.
Die Peritonitis ist die am häufigsten zu technischem Versagen führende Komplikation der Akut-PD. Eine Katheterexplantation ist mit hoher Wahrscheinlichkeit notwendig, denn häufig kommt es trotz testgerechter antibiotischer Therapie nicht zu adäquatem klinischen Ansprechen. Aufgrund des hohen Risikos für ein technisches Versagen erfolgen routinemäßig tägliche Bestimmungen der Zellzahl. Leckagen und mechanische Obstruktion des Katheters gehören zu den häufigsten Frühkomplikationen in den ersten 24–48 h, führen allerdings nur sehr selten zu technischem Versagen.
Katheteranlage
Die Gewährleistung einer schnellen Katheteranlage stellt aufgrund der Abhängigkeit von anderen Fachdisziplinen sowie der Verfügbarkeit von Operationssaalkapazitäten eine relevante Limitation der Akut-PD dar. In Akut-PD-erprobten Zentren wird die Katheteranlage perkutan in Lokalanästhesie und unter Analgosedierung durch den interventionellen Nephrologen durchgeführt. Die perkutane PD-Katheter-Anlage bedient sich dabei einer ultraschallgesteuerten oder blinden Seldinger-Technik [17]. Nach infraumbilikaler Querinzision und stumpfer Präparation bis auf die Linea alba wird mit einer Hohlnadel in die Peritonealhöhle vorgegangen und ein weicher Seldinger-Draht eingeführt. Anschließend erfolgen das Auffädeln eines Dilatators mit Spalthülse über den Führungsdraht und nach Dilatation das Einbringen des flexiblen Katheters, wobei die tiefe Muffe des Katheters in der Linea alba versenkt wird. Das distale Ende des Katheters wird an einen Trokar fixiert und durch retrogrades Ausstechen getunnelt ausgeleitet. Als Verzögerung bleibt die notwendige Darmreinigung am Vorabend. Die minimal-invasive Technik ist der offen-chirurgischen Anlage und der laparoskopisch gesteuerten Anlage nicht unterlegen und minimiert bei der Akut-PD das Leckagerisiko im Vergleich mit der offen-chirurgischen Anlage. Die chirurgischen Verfahren sollten jedoch im Falle des Vorliegens von größeren abdominellen Voroperationen oder bei Verdacht auf Adhäsionen bevorzugt werden [5, 19].
Biokompatibilität der Dialysatlösungen
Bekanntermaßen kommt es im Rahmen der PD zu Veränderungen am Peritoneum, die mit der Zeit dessen Verlust als Dialysemembran bedingen. Die submesotheliale Gewebeschicht proliferiert und es kommt zu einem Verlust der Mesothelzellen und zu einer Hyalinose der Arteriolen. Es findet eine Neovaskularisation statt, die in einer Zunahme der Clearance kleiner Moleküle resultiert [37]. Die Glukosedegradationsprodukte (GDP), die während des Sterilisationsprozesses entstehen und Laktat als Puffer der Standardlösungen werden hierfür verantwortlich gemacht [34]. Um diesen Faktoren zu begegnen, wurden vor etwa 2 Dekaden die Low-GDP-Lösungen eingeführt. Indem die Glukose in einem separaten Teil des Zweikammerbeutels bei niedrigem pH-Wert sterilisiert wird, entstehen weniger GDP. Unmittelbar vor der Infusion findet eine Vermischung mit dem zweiten Teil der Lösung mit hohem pH-Wert statt, sodass eine Lösung mit physiologischem pH-Wert vorliegt.
Metaanalysen konnten hinsichtlich Mortalität und technischem Überleben keinen Vorteil für Low-GDP-Lösungen belegen
Metaanalysen konnten jedoch hinsichtlich Mortalität und technischem Überleben keinen Vorteil der neuen Lösungen zeigen [20]. Das am stärksten für die Verwendung der Low-GDP-Lösungen sprechende Argument ist der wiederholt berichtete längere Erhalt der renalen Restfunktion [11]. Eine simultane Beobachtung ist die zu Beginn der PD schnellere Zunahme der peritonealen Transportrate von Kreatinin (D/P[„dialysate to plasma“]-Kreatinin) bzw. der kleinen Moleküle [39]. Da durch den schnelleren osmotischen Ausgleich zwischen Blut und Dialysat eine geringere UF resultiert, schlussfolgern Kritiker der Low-GDP-Lösungen, dass die höhere Restausscheidung lediglich auf den vermeintlich hypervolämeren Hydratationszustand der Patienten zurückzuführen ist [4]. Die Annahme einer tatsächlich länger erhaltenen renalen Restfunktion ließe auch eine verbesserte Mortalität erwarten, die bis jetzt nicht gezeigt werden konnte. Allerdings existiert bis heute keine Studie, die genügend Patienten eingeschlossen hat, um dies wissenschaftlich zu belegen. Auch das häufig zu kurze Follow-up mag ein Grund für das Fehlen dieser Daten sein.
Schäfer et al. konnten 2018 an Peritonealbiopsien pädiatrischer Patienten zeigen, dass es bei der Verwendung von Low-GDP-Lösungen ebenfalls zu den oben beschriebenen Veränderungen kommt [32]. Die Neovaskularisation scheint das morphologische Korrelat der ebenfalls schnell zunehmenden D/P-Kreatinin zu sein. In Anbetracht dieser Ergebnisse kann deshalb nicht von einer Biokompatibilität der neueren Lösungen gesprochen werden. Es muss davon ausgegangen werden, dass die Glukose selbst für einen Großteil der peritonealen Veränderungen verantwortlich ist. Als einzige Alternative zur Glukose steht Icodextrin als längerkettiges Zuckermolekül zur Verfügung, wobei es beim Menschen nur indirekte Untersuchungen zur Biokompatibilität bzw. zu den morphologischen Einflüssen auf das Peritoneum gibt. Da Icodextrin vergleichsweise wenig resorbiert wird, erzielt es insbesondere bei langer Verweildauer eine viel höhere UF, wobei bei einmal täglicher Verwendung kein negativer Einfluss auf die Restausscheidung resultiert [22].
Einen tatsächlich innovativen Ansatz, die Biokompatibilität der Dialysatlösungen zu verbessern, stellt die Strategie zugesetzter Adjuvanzien mit immunmodulatorischen Eigenschaften dar. Das Dipeptid Alanylglutamin wird üblicherweise als Zusatz für i.v.-Ernährung verwendet. An einem Modell urämischer Ratten konnte gezeigt werden, dass es nach Zusatz des Dipeptids zu einer geringeren Zunahme des peritonealen Durchmessers kam [13]. Der Zusatz reduzierte ebenfalls die Expression von „α-smooth muscle actin“ und die Angiogenese. 2018 wurde die erste randomisierte, kontrollierte Studie mit Crossover-Design durchgeführt [36]. Als Marker der Integrität der Peritonealmembran wurde eine höhere Konzentration von CA-125 im Dialysat nachgewiesen. Die ebenfalls während der Exposition zu Alanylglutamin höhere Konzentration von Interleukin(IL)-6 gilt als Surrogatmarker für eine erhöhte lokale Immunkompetenz. Gleichzeitig wiesen die Patienten geringere Konzentrationen von hoch sensitivem C‑reaktiven Protein (hsCRP) und IL‑8 im Serum auf. Letztlich gilt es nun, Ergebnisse hinsichtlich klarer klinischer Endpunkte zu produzieren. Sollten diese aber erfolgreich sein, ist ein neuer Standard in der PD denkbar.
Tragbare Cycler – die Zukunft?
Die Grundvoraussetzung für ein tragbares Dialysegerät besteht in der Reduktion des täglichen Bedarfs von etwa 8–15 l Dialysat auf ein Minimum. Essenziell für die Implementierung eines solchen Systems ist also das Vorhandensein wirksamer Strategien zur Entfernung der Urämietoxine, ohne große Mengen an Dialysat zu verbrauchen. Bereits vor 40 Jahren wurden erste Methoden zur Wiederaufbereitung von Dialysat durch Sorptionsverfahren entwickelt [3]. Sorbentien sind Stoffe, die andere Stoffe durch Ad- oder Absorption binden. Während durch aktivierte Kohle ein Großteil der organischen Urämietoxine wie Kreatinin oder Harnsäure mit hoher Affinität adsorbiert wird, stellt die Harnstoffelimination aufgrund der geringen Affinität für aktivierte Kohle eine Limitation für die Verwendung ausschließlich sorptiver Verfahren dar. Verschiedene Verfahren wurden mit der Sorptionstechnik kombiniert, um eine adäquate Harnstoff-Clearance zu erzeugen. Durch Integration einer Ureasesäule in die Filtereinheit wird Harnstoff enzymatisch in Ammoniak und CO2 gespalten. Durch die Hydrierung entstehen Ammoniumionen und HCO3−, welche durch ihre Ladungen an nachgeschaltete Kationen- und Anionenaustauscher binden und somit aus dem Dialysat eliminiert werden. Das Dialysat wird anschließend mit Kalzium, Magnesium und Glukose angereichert und rezirkuliert in die Peritonealhöhle. Dieses Verfahren birgt einige Risiken: Eine Übersättigung der Kationenaustauschsäule kann zum Übertritt von toxischem Ammoniak in das frische Dialysat führen. Des Weiteren besteht die Gefahr einer Gasbildung durch die Freisetzung von CO2 im Rahmen der Hydrolyse von Harnstoff [30]. Andere Verfahren verwenden zusätzlich Austauscherharze oder versuchen, durch Dilution eine Harnstoffelimination zu erreichen [35]. Darüber hinaus werden photo- und elektrooxidative Verfahren für die Lösung des „Harnstoffproblems“ getestet [14]. Weitere Herausforderungen für die tragbaren Systeme sind das Erzielen der optimalen UF über die Glukosetitration sowie die Aufrechterhaltung einer konstanten Glukosekonzentration.
Aktuell in klinischen Studien erprobt werden die AWAK („automated wearable artificial kidney“) und das CarryLife®-System. Beide bedienen sich dabei in verschiedener Weise der oben geschilderten Sorptionsverfahren. Die AWAK ist ein 1,5 kg schweres Gerät im Handtaschenformat mit Schultergurt, welches mit einem Tidalverfahren funktioniert. Nach üblicher morgendlicher manueller Füllung wird in einer Dialysesitzung mit einer Dauer von 6–8 h ein Dialysatvolumen von 12–16 l aufbereitet. Das Ultrafiltrat wird in einen Ablaufbeutel drainiert. Die Filterkartusche muss alle 7 h erneuert werden. In einer ersten klinischen Studie an 15 Patienten ergab sich ein günstigeres Profil von Kreatinin, Harnstoff- und Phosphat-Clearance im Vergleich zu den zuvor angewandten konventionellen PD-Verfahren [18].
Das CarryLife®-System benötigt als CFPD-Verfahren 2 einliegende PD-Katheter. Nach initialer Füllung der Peritonealhöhle mit 2 l Dialysat kommt es zu einer kontinuierlichen Dialysatzirkulation, wobei eine Filtereinheit die Regeneration der Dialysatflüssigkeit gewährleistet. Durch die stetige Auffrischung des Dialysats bleibt ein konstant hoher Diffusionsgradient bestehen. Zudem wird eine Vergrößerung der effektiven Membranoberfläche durch die Erneuerung stagnierender Flüssigkeitsschichten an der Peritonealmembran erreicht. Eine klinische Studie an einer kleinen Patientenanzahl hat gezeigt, dass auf diese Art die Plasmadialysatkonzentration von Urämietoxinen aufrechterhalten werden kann [31].
Die Idee der tragbaren Dialysegeräte ist nicht nur hinsichtlich der Lebensqualität der Patienten vielversprechend
Zusammenfassend ist die Idee der tragbaren Dialysegeräte nicht nur im Hinblick auf die Lebensqualität unserer Patienten vielversprechend. Die Regeneration des Dialysats ermöglicht eine Steigerung der Dialysedosis mit nur minimalem Flüssigkeitsbedarf. In Bezug auf die globale Erderwärmung werden Wasserverbrauch und CO2-Bilanz der PD bedeutend reduziert. Die oben erwähnten Geräte befinden sich dabei in fortgeschrittenen Entwicklungsstadien und dürften bald für den Einsatz in größeren klinischen Studien in Frage kommen.
Fazit für die Praxis
Die Akut-PD (Peritonealdialyse) sollte beim dialysepflichtigen Nierenversagen als sichere Alternative zu der Hämodialyse geprüft werden.
Kontraindikationen beinhalten frische abdominelle Operationen und Akutpathologien sowie akut lebensbedrohliche Komplikationen des Nierenversagens.
Die Intensität der Dialyse sollte sich am klinischen Gesamteindruck des Patienten orientieren.
Die perkutane PD-Katheter-Anlage durch den interventionellen Nephrologen gewährleistet den rechtzeitigen Behandlungsbeginn.
Immunmodulatorische Adjuvanzien könnten zukünftig die durch die Glukoselösungen induzierten chronischen Veränderungen des Peritoneums reduzieren.
Einhaltung ethischer Richtlinien
Interessenkonflikt
R. Hausinger, C. Schmaderer, U. Heemann und Q. Bachmann geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Contributor Information
R. Hausinger, Email: renateilona.hausinger@mri.tum.de
Q. Bachmann, Email: quirin.bachmann@mri.tum.de
Literatur
- 1.Al-Hwiesh A, Abdul-Rahman I, Finkelstein F, et al. Acute kidney injury in critically ill patients: a prospective randomized study of tidal peritoneal dialysis versus continuous renal replacement therapy. Ther Apher Dial. 2018;22:371–379. doi: 10.1111/1744-9987.12660. [DOI] [PubMed] [Google Scholar]
- 2.Amerling R, Winchester JF, Ronco C. Continuous flow peritoneal dialysis: update 2012. Contrib Nephrol. 2012;178:205–215. doi: 10.1159/000337854. [DOI] [PubMed] [Google Scholar]
- 3.Ash SR. Sorbents in treatment of uremia: a short history and a great future. Semin Dial. 2009;22:615–622. doi: 10.1111/j.1525-139X.2009.00657.x. [DOI] [PubMed] [Google Scholar]
- 4.Blake PG. Is the peritoneal dialysis biocompatibility hypothesis dead? Kidney Int. 2018;94:246–248. doi: 10.1016/j.kint.2018.04.014. [DOI] [PubMed] [Google Scholar]
- 5.Boujelbane L, Fu N, Chapla K, et al. Percutaneous versus surgical insertion of PD catheters in dialysis patients: a meta-analysis. J Vasc Access. 2015;16:498–505. doi: 10.5301/jva.5000439. [DOI] [PubMed] [Google Scholar]
- 6.Bowes E, Joslin J, Braide-Azikiwe DCB, et al. Acute peritoneal dialysis with percutaneous catheter insertion for COVID-19-associated acute kidney injury in intensive care: experience from a UK tertiary center. Kidney Int Rep. 2021;6:265–271. doi: 10.1016/j.ekir.2020.11.038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Burdmann EA, Chakravarthi R. Peritoneal dialysis in acute kidney injury: lessons learned and applied. Semin Dial. 2011;24:149–156. doi: 10.1111/j.1525-139X.2011.00868.x. [DOI] [PubMed] [Google Scholar]
- 8.Chen W, Caplin N, El Shamy O, et al. Use of peritoneal dialysis for acute kidney injury during the COVID-19 pandemic in New York City: a multicenter observational study. Kidney Int. 2021;100:2–5. doi: 10.1016/j.kint.2021.04.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chionh CY, Soni SS, Finkelstein FO, et al. Use of peritoneal dialysis in AKI: a systematic review. Clin J Am Soc Nephrol. 2013;8:1649–1660. doi: 10.2215/CJN.01540213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chitalia VC, Almeida AF, Rai H, et al. Is peritoneal dialysis adequate for hypercatabolic acute renal failure in developing countries? Kidney Int. 2002;61:747–757. doi: 10.1046/j.1523-1755.2002.00177.x. [DOI] [PubMed] [Google Scholar]
- 11.Cho Y, Johnson DW, Badve SV, et al. The impact of neutral-pH peritoneal dialysates with reduced glucose degradation products on clinical outcomes in peritoneal dialysis patients. Kidney Int. 2013;84:969–979. doi: 10.1038/ki.2013.190. [DOI] [PubMed] [Google Scholar]
- 12.Cullis B, Al-Hwiesh A, Kilonzo K, et al. ISPD guidelines for peritoneal dialysis in acute kidney injury: 2020 update (adults) Perit Dial Int. 2021;41:15–31. doi: 10.1177/0896860820970834. [DOI] [PubMed] [Google Scholar]
- 13.Ferrantelli E, Liappas G, Vila Cuenca M, et al. The dipeptide alanyl-glutamine ameliorates peritoneal fibrosis and attenuates IL-17 dependent pathways during peritoneal dialysis. Kidney Int. 2016;89:625–635. doi: 10.1016/j.kint.2015.12.005. [DOI] [PubMed] [Google Scholar]
- 14.Foo MWY, Htay H. Innovations in peritoneal dialysis. Nat Rev Nephrol. 2020;16:548–549. doi: 10.1038/s41581-020-0283-8. [DOI] [PubMed] [Google Scholar]
- 15.Gabriel DP, Caramori JT, Martim LC et al (2008) High volume peritoneal dialysis vs daily hemodialysis: a randomized, controlled trial in patients with acute kidney injury. Kidney Int Suppl: S87–S93. 10.1038/sj.ki.5002608 [DOI] [PubMed]
- 16.Guzzo I, De Galasso L, Mir S, et al. Acute dialysis in children: results of a European survey. J Nephrol. 2019;32:445–451. doi: 10.1007/s40620-019-00606-1. [DOI] [PubMed] [Google Scholar]
- 17.Henderson S, Brown E, Levy J. Safety and efficacy of percutaneous insertion of peritoneal dialysis catheters under sedation and local anaesthetic. Nephrol Dial Transplant. 2009;24:3499–3504. doi: 10.1093/ndt/gfp312. [DOI] [PubMed] [Google Scholar]
- 18.Htay H, Gow SK, Jayaballa M et al (2021) Preliminary safety study of the automated wearable artificial kidney (AWAK) in peritoneal dialysis patients. Perit Dial Int. 10.1177/08968608211019232 [DOI] [PubMed]
- 19.Htay H, Johnson DW, Craig JC, et al. Catheter type, placement and insertion techniques for preventing catheter-related infections in chronic peritoneal dialysis patients. Cochrane Database Syst Rev. 2019 doi: 10.1002/14651858.CD004680.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Htay H, Johnson DW, Wiggins KJ, et al. Biocompatible dialysis fluids for peritoneal dialysis. Cochrane Database Syst Rev. 2018 doi: 10.1002/14651858.CD007554.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Liu L, Zhang L, Liu GJ, et al. Peritoneal dialysis for acute kidney injury. Cochrane Database Syst Rev. 2017 doi: 10.1002/14651858.CD011457.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Moberly JB, Mujais S, Gehr T et al (2002) Pharmacokinetics of icodextrin in peritoneal dialysis patients. Kidney Int Suppl: S23–S33. 10.1046/j.1523-1755.62.s81.5.x [DOI] [PubMed]
- 23.Parapiboon W, Jamratpan T. Intensive Versus Minimal Standard Dosage for Peritoneal Dialysis in Acute Kidney Injury: A Randomized Pilot Study. Perit Dial Int. 2017;37:523–528. doi: 10.3747/pdi.2016.00260. [DOI] [PubMed] [Google Scholar]
- 24.Passadakis P, Oreopoulos D. Peritoneal dialysis in acute renal failure. Int J Artif Organs. 2003;26:265–277. doi: 10.1177/039139880302600401. [DOI] [PubMed] [Google Scholar]
- 25.Ponce D, Berbel MN, Abrão JM, et al. A randomized clinical trial of high volume peritoneal dialysis versus extended daily hemodialysis for acute kidney injury patients. Int Urol Nephrol. 2013;45:869–878. doi: 10.1007/s11255-012-0301-2. [DOI] [PubMed] [Google Scholar]
- 26.Ponce D, Balbi A, Cullis B. Acute PD: evidence, guidelines, and controversies() Semin Nephrol. 2017;37:103–112. doi: 10.1016/j.semnephrol.2016.10.011. [DOI] [PubMed] [Google Scholar]
- 27.Ponce D, Balbi AL, Durand JB, et al. Acute peritoneal dialysis in the treatment of COVID-19-related acute kidney injury. Clin Kidney J. 2020;13:269–273. doi: 10.1093/ckj/sfaa102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Ponce D, Brito GA, Abrao JG, et al. Different prescribed doses of high-volume peritoneal dialysis and outcome of patients with acute kidney injury. Adv Perit Dial. 2011;27:118–124. [PubMed] [Google Scholar]
- 29.Ronco C. Continuous renal replacement therapy: forty-year anniversary. Int J Artif Organs. 2017;40:257–264. doi: 10.5301/ijao.5000610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Salani M, Roy S, Fissell WHT. Innovations in wearable and Implantable artificial kidneys. Am J Kidney Dis. 2018;72:745–751. doi: 10.1053/j.ajkd.2018.06.005. [DOI] [PubMed] [Google Scholar]
- 31.Samuelsson O, Heijdenberg L, De Leon C, et al. SuO014peritoneal dialysis with the new portable carry life® system. Nephrol Dial Transplant. 2018;33:i621. doi: 10.1093/ndt/gfy104.SuO014. [DOI] [Google Scholar]
- 32.Schaefer B, Bartosova M, Macher-Goeppinger S, et al. Neutral pH and low-glucose degradation product dialysis fluids induce major early alterations of the peritoneal membrane in children on peritoneal dialysis. Kidney Int. 2018;94:419–429. doi: 10.1016/j.kint.2018.02.022. [DOI] [PubMed] [Google Scholar]
- 33.Schaefer B, Bartosova M, Macher-Goeppinger S, et al. Quantitative histomorphometry of the healthy peritoneum. Sci Rep. 2016;6:21344. doi: 10.1038/srep21344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Schilte MN, Celie JW, Wee PM, et al. Factors contributing to peritoneal tissue remodeling in peritoneal dialysis. Perit Dial Int. 2009;29:605–617. doi: 10.1177/089686080902900604. [DOI] [PubMed] [Google Scholar]
- 35.Van Gelder MK, Ligabue G, Giovanella S, et al. In vitro efficacy and safety of a system for sorbent-assisted peritoneal dialysis. Am J Physiol Renal Physiol. 2020;319:F162–F170. doi: 10.1152/ajprenal.00079.2020. [DOI] [PubMed] [Google Scholar]
- 36.Vychytil A, Herzog R, Probst P, et al. A randomized controlled trial of alanyl-glutamine supplementation in peritoneal dialysis fluid to assess impact on biomarkers of peritoneal health. Kidney Int. 2018;94:1227–1237. doi: 10.1016/j.kint.2018.08.031. [DOI] [PubMed] [Google Scholar]
- 37.Williams JD, Craig KJ, Topley N, et al. Morphologic changes in the peritoneal membrane of patients with renal disease. J Am Soc Nephrol. 2002;13:470–479. doi: 10.1681/ASN.V132470. [DOI] [PubMed] [Google Scholar]
- 38.Ye Z, Wang Y, Ge L, et al. Comparing renal replacement therapy modalities in critically ill patients with acute kidney injury: a systematic review and network meta-analysis. Crit Care Explor. 2021;3:e0399. doi: 10.1097/CCE.0000000000000399. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Yohanna S, Alkatheeri AM, Brimble SK, et al. Effect of neutral-pH, low-glucose degradation product peritoneal dialysis solutions on residual renal function, urine volume, and ultrafiltration: a systematic review and meta-analysis. Clin J Am Soc Nephrol. 2015;10:1380–1388. doi: 10.2215/CJN.05410514. [DOI] [PMC free article] [PubMed] [Google Scholar]


