Abstract
Hintergrund
Etwa 10 % der Patienten weisen nach einer milden COVID-19-Erkrankung anhaltende Symptome auf. Wir hatten zuvor Autoantikörper (ANA/ENA) bei Patienten mit schweren COVID-19-Verläufen erstbeschrieben.
Fragestellung
Ziel dieser Pilotstudie war die Charakterisierung der Long‑/Post-COVID-Erkrankung und der Vergleich mit einer Lungenbeteiligung bei Erkrankungen aus dem rheumatischen Formenkreis (CTD-ILD).
Methoden
Wir rekrutierten prospektiv 33 Patienten mit anhaltender pulmonaler Symptomatik nach einer mild/moderat verlaufenen COVID-19-Erkrankung (Altersmedian 39 Jahre). Wir führten Lungenfunktionstests, Computertomografien (CT) und einen serologischen Autoantikörpernachweis durch und entnahmen bei 29 von 33 Patienten transbronchiale Lungenbiopsien.
Ergebnisse
Die meisten Patienten wiesen gestörten Sauerstoffpuls in der Spiroergometrie und eine leichte Lymphozytose in der bronchoalveolären Lavage auf. In der CT zeigten sich verdickte Atemwege und ein erhöhtes Low-attenuation-Volumen. Autoantikörper konnten bei 13 von 33 Patienten nachgewiesen werden (39,4 %). Histopathologisch zeigte sich interstitielle Lymphozytose mit alveolärer Fibrinausfällung und organisierender Pneumonie. Ultrastrukturelle Analysen zeigten interstitielle Kollagenablagerung.
Diskussion
Während die histopathologischen Befunde der Long‑/Post-COVID-Erkrankung für sich alleine unspezifisch sind, würde die Kombination mit klinischen und radiologischen Eigenschaften die Diagnosekriterien einer „interstitiellen Pneumonie mit autoimmunen Merkmalen“ (IPAF) erfüllen. Da sich interstitielle Kollagenablagerung zeigte und die IPAF/CTD-ILD einen fibrosierenden Verlauf nehmen kann, sollte eine mögliche Persistenz von Autoantikörpern und die Entwicklung fibrotischer Lungenveränderungen bei Long‑/Post-COVID-Patienten engmaschig kontrolliert werden.
Schlüsselwörter: SARS-CoV‑2, COVID-19, Long-COVID, ILD, Fibrose
Abstract
Background
About 10% of patients develop persistent symptoms after mild/moderate COVID-19. We have previously reported detection of antinuclear autoantibodies/extractable nuclear antigens (ANA/ENA) in patients with severe COVID-19.
Objectives
The aim of this small pilot study was to characterize long-/post-COVID and to evaluate possible similarities between lung involvement in long-/post-COVID and connective tissue disease (CTD).
Methods
We prospectively enrolled 33 previously healthy patients with persistent pulmonal symptoms after mild/moderate COVID-19 without hospitalization (median age, 39 years). We performed clinical evaluation including pulmonary function tests, computed tomography (CT), and serology for ANA/ENA. In 29 of 33 patients, transbronchial biopsies (TBBs) were taken for histopathological assessment.
Results
Most patients presented with disturbed oxygen pulse in spiroergometry and slight lymphocytosis in bronchoalveolar lavage (BAL) fluid. The CT pattern showed bronchial wall thickening and increased low-attenuation volume. Autoantibodies were detected in 13 of 33 patients (39.4%). Histopathological assessment showed interstitial lymphocytosis with alveolar fibrin and organizing pneumonia. Ultrastructural analyses revealed interstitial collagen deposition.
Conclusion
While histopathology of pulmonary long-/post-COVID alone is unspecific, the combination with clinical and radiological features together with detection of autoantibodies would allow for a diagnosis of interstitial pneumonia with autoimmune features (IPAF). Since we observe interstitial collagen deposition and since IPAF/CTD-ILD might progress to fibrosis, the persistence of autoantibodies and possible fibrotic change should be closely monitored in autoantibody-positive long-/post-COVID patients.
Keywords: SARS-CoV‑2, COVID-19, Long-COVID, ILD, Fibrosis
Bislang besteht kein Konsens über den zugrunde liegenden Pathomechanismus sowie die Diagnosekriterien des pulmonalen Long- bzw. Post-COVID-Syndroms. Bei einem Teil der überwiegend jungen und sportlichen Patienten der Long-COVID-Ambulanz am Bundeswehrkrankenhaus Ulm fielen uns mögliche Parallelen zu einer Lungenbeteiligung bei Erkrankungen aus dem rheumatologischen Formenkreis auf. Wir vermuten, dass eine Infektion mit SARS-CoV‑2 bei prädisponierten Patienten zumindest vorübergehend zu einem Autoimmunprozess mit interstitieller Entzündung des Lungengewebes und resultierender Einschränkung der Lungenfunktion führen kann.
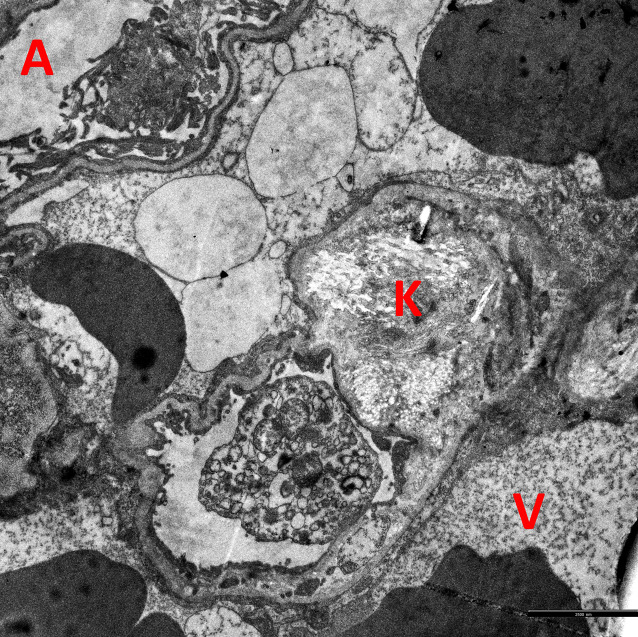
Bei einigen Patienten sind ultrastrukturell interstitielle Kollagenfaserablagerungen nachweisbar. Ein besseres Verständnis der dem Long- bzw. Post-COVID-Syndrom zugrunde liegenden Pathomechanismen würde eine gezielte therapeutische Intervention erleichtern und einer anhaltenden Beeinträchtigung der pulmonalen Leistungsfähigkeit entgegenwirken.
Long-COVID-/Post-COVID-Syndrom
Die Coronavirus-Krankheit 2019 (COVID-19) nach Infektion mit dem neuartigen Coronavirus SARS-CoV‑2 hat sich zu einer weltweiten Pandemie entwickelt. Trotz großer Kraftanstrengung der weltweiten Forschergemeinde sind zahlreiche Facetten der Erkrankung noch unzureichend verstanden. Während die Pathologie der akuten lebensbedrohliche COVID-19-Erkrankung auch aufgrund zahlreicher (Obduktions-)studien aus dem deutschsprachigen Raum mittlerweile gut charakterisiert ist [1–3], besteht nach wie vor eine große Unsicherheit über mögliche Langzeit- und Spätfolgen einer leicht- bis mittelschweren Erkrankung. Nach den NICE-Kriterien werden anhaltende Beschwerden 4–12 Wochen nach Beginn der akuten Symptomatik als Long-COVID-, über 12 Wochen hinaus gehende Beschwerden als Post-COVID-Syndrom klassifiziert [4]. Ein großer Teil der hospitalisierten, nicht beatmeten Patienten berichtet 8 Wochen nach der Infektion von anhaltender Müdigkeit, Muskelschwäche oder Atemnot bei Belastung [5]. Neben den subjektiven Symptomen konnten Einschränkungen der Lungenfunktion (FEV1, VC und TLCO) sowie Auffälligkeiten in der HRCT-Bildgebung (Konsolidierung, Milchglaszeichnung) nachgewiesen werden; einige Patienten zeigten Besserung auf Steroidgabe [6, 7]. Während die Lungenveränderungen bei schweren akuten Verläufen von COVID-19 gut dokumentiert sind, existieren bislang keine Erkenntnisse über das histopathologische Erscheinungsbild des pulmonalen Long‑/Post-COVID-Syndroms. Da unsere Arbeitsgruppe erstmals das Auftreten von Autoantikörpern aus dem Formenkreis der Kollagenosen bei schweren COVID-19-Verläufen beschrieben hatte [1] und dieser Befund mittlerweile von mehreren internationalen Forschergruppen bestätigt wurde [8–10], gehen wir in dem hier vorgestellten Projekt der Frage nach, inwiefern es sich auch beim pulmonalen Long‑/Post-COVID-Syndrom um eine Form der autoimmunvermittelten Lungenerkrankung handeln könnte.
Einschlusskriterien und Diagnostik
Wir rekrutierten prospektiv 33 zuvor gesunde Patienten ohne Anamnese für eine rheumatische Grunderkrankung, welche sich nach einer leicht oder mittelschwer verlaufenden SARS-CoV-2-Infektion (ohne Krankenhausaufenthalt oder Sauerstoffgabe) in der Long-COVID-Ambulanz des Bundeswehrkrankenhauses Ulm vorstellten. Der Großteil der Patienten waren Polizeibeamte und Soldaten, das mediane Alter betrug 39 (21–61) Jahre. Die meisten Patienten hatten stets aktiv Sport betrieben und klagten nun über eine eingeschränkte Belastbarkeit mit unterschiedlich ausgeprägter Belastungsdyspnoe. Neben einer vollständigen ILD-Anamnese (interstitielle Lungenerkrankung, ILD) führten wir Lungenfunktionstests einschließlich einer Spiroergometrie, eine Computertomographie (CT) einschließlich digitaler Bildauswertung (Pulmo 3D syngo.via, Siemens Healthcare AG, Zürich, Schweiz) sowie eine serologische Analytik für antinukleäre Antikörper (ANA, indirekte Immunfluoreszenz) bzw. extrahierbare nukleäre Antigene (ENA, Immunoblot) durch. Die klinischen Daten sowie die Ergebnisse der Lungenfunktionsuntersuchungen fasst Tab. 1 zusammen. Bei 29 Patienten wurden neben einer bronchoalveolären Lavage (BAL) einschließlich Immunzytologie auch transbronchiale Biopsien (TBB) zur histopathologischen Beurteilung einer möglichen interstitiellen Lungenerkrankung entnommen. Eine zustimmende Bewertung der Ethikkommission der Universität Ulm (Nr. 129/20 bzw. 331/20) liegt vor.
| Geschlecht (m:w) | 20:13 |
| Alter (Median; von–bis) | 39 (21–61) |
| Wochen seit pos. SARS-CoV‑2 RT-PCR (Median; von–bis) | 28 (16–44) |
| Nachweis von Autoantikörperna | 13 (39,4 %) |
| % FVC | 95 ± 2,4 |
| % RV | 111 ± 28,4 |
| % DLCO | 94 ± 17,5 |
| % Lymphozyten (BAL) | 12,5 ± 12,61 |
m männlich, w weiblich, FVC forcierte Vitalkapazität, RV Residualvolumen, DLCO „diffusion capacity of the lungs for carbon monoxide“, BAL bronchoalveoläre Lavage
aANA-Titer ≥ 1:320 und/oder positiver Immunoblot (Scl 70, PCNA, PM Scl, dsDNA, SS B, Histone) oder Rheumafaktoren > 20 U/ml
Vorläufige Ergebnisse
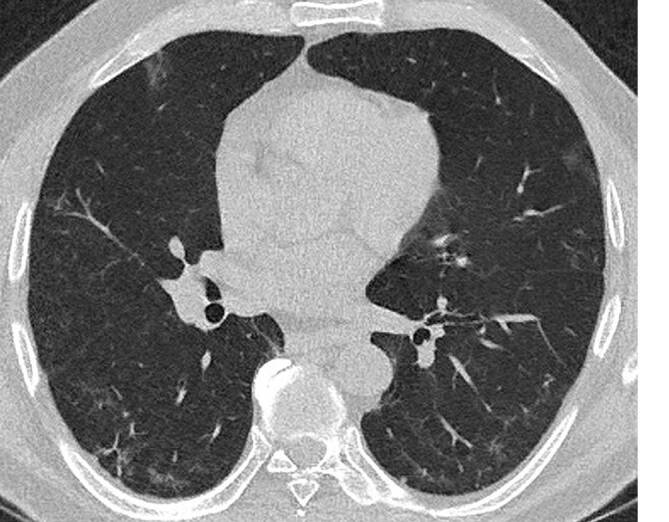
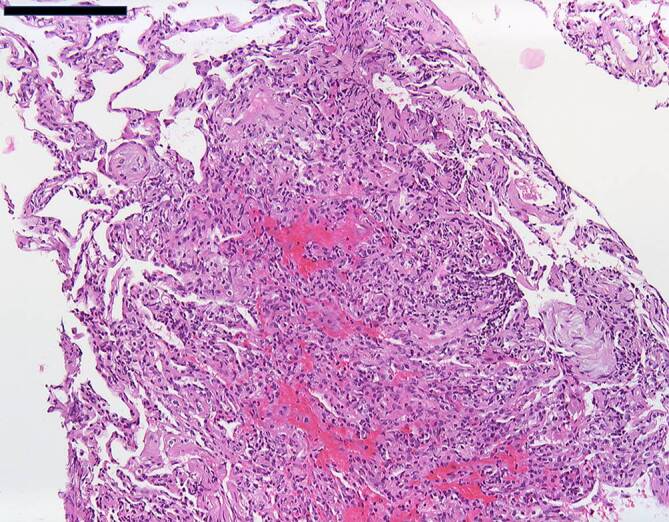
Bei den meisten Patienten präsentierten sich die klassischen Lungenfunktionsparameter als unauffällig. Einzig das Residualvolumen bewegte sich im Vergleich zu einem gesunden Normkollektiv etwas erhöht und wird als Ausdruck einer terminalen Bronchiolitis diskutiert. In der CT wurde kein klassisches ILD-Muster registriert (Abb. 1). Hier zeigten sich allerdings – passend zum tendenziell höheren Residualvolumen – neben peripheren Bronchialwandverdickungen leichtgradige Lungendichteabnahmen im Vergleich zu gesunden Lungen. Zusätzlich fielen bei fast allen Patienten im Vergleich zu den begleitenden Bronchien v. a. im mittleren bis subpleuralen Abschnitt pathologisch erweiterte Pulmonalgefäße auf, passend zu dem beobachteten gestörten O2-Puls in der Spiroergometrie. Bei 13 von 33 Patienten (39,4 %) waren ANA-Titer ≥ 1:320 oder spezifische ENA (a-Scl-70, a‑PM-Scl, a‑dsDNA, a‑SS‑B und a‑Histone) nachweisbar. Die BAL zeigte bei fast einem Teil der Patienten eine leichtgradige, bei einigen Patienten eine mittel- bis schwergradige Lymphozytose mit jeweils ausgeglichener CD4/CD8-Ratio. Histopathologisch waren in den meisten Fällen alveoläre Fibrinausschwitzungen sowie eine Vermehrung des interstitiellen Entzündungsinfiltrats erkennbar. Bei 4 Patienten zeigte sich eine organisierende Pneumonie (OP) mit alveolären Fibroblastenplugs (Abb. 2). Eine ultrastrukturelle Analyse, die bislang nur bei einem Teil der Patienten angefertigt werden konnte, ließ eine diskrete interstitielle Kollagenablagerung erkennen (Abb. 3).
Schlussfolgerung
Die isolierte Betrachtung von lungenfunktionellen, radiologischen oder histopathologischen Merkmalen von pulmonalem Long‑/Post-COVID ist als eher unspezifisch zu bewerten. Insgesamt weisen die Befunde auf eine Entzündung der kleinen Atemwege mit konsekutiver Erhöhung des Residualvolumens hin („small airway disease“), wie sie auch von anderen Autoren im Kontext von Long‑/Post-COVID diskutiert wird [11], ohne dass jedoch bislang histopathologische Befunde hierzu vorlagen. Die Pathophysiologie hinter dieser Entzündung ist noch unzureichend verstanden, es gibt allerdings deutliche Hinweise darauf, dass es auch nach milde verlaufender COVID-19-Erkrankung zu einer anhaltenden Bildung von Autoantikörpern kommen kann [12]. Die Heranziehung der klinischen, serologischen und radiologischen Befunde würde bei Patienten mit Nachweis von Autoantikörpern die Diagnose einer „interstitiellen Pneumonie mit autoimmunen Merkmalen“ (IPAF) ermöglichen, wie sie 2015 von der ETS/ATS vorgeschlagen wurde (Tab. 2; [13]). Einschränkend ist jedoch anzumerken, dass diese Klassifikation eine histopathologische Diagnostik an chirurgischen Lungenbiopsien voraussetzt, für die vorliegende Auswertung aber ausschließlich transbronchiale Biopsien untersucht wurden.
| 1 | Nachweis einer interstitiellen Pneumonie (mittels HRCT oder chir. Lungenbiopsie) und | |
| 2 | Ausschluss einer anderweitigen Ätiologie und | |
| 3 | Nichterfüllung der Diagnosekriterien einer definierten Kollagenose und | |
| 4 | Erfüllung mindestens eines Merkmals aus mindestens 2 der folgenden Domänen: | |
| a | Klinische Domäne (z. B. digitale Fissuren/Ulcera, Morgensteifigkeit, Raynaud-Phänomen) | |
| b | Serologische Domäne (z. B. ANA-Titer ≥ 1:320, ENA-Nachweis, RF ≥ 2fach erhöht) | |
| c | Morphologische Domäne (z. B. NSIP ± OP in Bildgebung oder Histopathologie) | |
HRCT hochauflösende Computertomografie, ANA antinukleäre Antikörper, ENA extrahierbare nukleäre Antigene, RF Rheumafaktoren, NSIP nichtspezifische interstitielle Pneumonie, OP organisierende Pneumonie
Management von Long‑/Post-COVID-Patienten
Als optimale Screening- und Verlaufsdiagnostik von Long‑/Post-COVID-Patienten hat sich aus unserer Sicht die Spiroergometrie erwiesen, da hierüber – anders als bei klassischen Lungenfunktionstests, wo fast immer unauffällige Werte erzielt werden – eine frühzeitige und objektivierbare pulmonale Leistungseinschränkung entlarvt werden kann. Da die IPAF oder andere kollagenoseassoziierte interstitielle Lungenerkrankungen (CTD-ILD) einen Progress zur Fibrose zeigen können, sollte die Persistenz von Autoantikörpern sowie eine pulmonale Rekrutierungsstörung engmaschig überwacht werden. Darüber hinaus sollte bei einem Progress der initial detektierten Auffälligkeiten eine auf das rheumatologische Patientenprofil zugeschnittene Therapiestrategie angewendet werden, um möglichst die Entstehung bzw. das Fortschreiten einer interstitiellen Fibrose zu verhindern.
Fazit für die Praxis
Auch nach mild verlaufender COVID-19-Erkrankung kann es zu einer persistierenden Einschränkung der Lungenfunktion mit Belastungsdyspnoe kommen.
Ein Teil der Patienten zeigt gestörten Sauerstoffpuls und eine lymphozytäre Entzündung der kleinen Atemwege mit Erhöhung des Residualvolumens („small airway disease“).
Bei Nachweis von Autoantikörpern erfüllt ein Teil der Patienten Diagnosekriterien einer „interstitiellen Pneumonie mit autoimmunen Merkmalen“ (IPAF).
Diese Patienten sollten entsprechend überwacht und therapiert werden, um eine anhaltende Entzündung des Lungengewebes mit möglicher Fibrosierung zu verhindern.
Einhaltung ethischer Richtlinien
Interessenkonflikt
K. Steinestel, A. Czech, C. Hackenbroch, W. Bloch und D. Gagiannis geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
The supplement containing this article is not sponsored by industry.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Gagiannis D, Steinestel J, Hackenbroch C, Schreiner B, Hannemann M, Bloch W, Umathum VG, Gebauer N, Rother C, Stahl M. Clinical, serological, and histopathological similarities between severe COVID-19 and acute exacerbation of connective tissue disease-associated interstitial lung disease (CTD-ILD) Front Immunol. 2020;11:2600. doi: 10.3389/fimmu.2020.587517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F, Moch H. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Venkatesan P. NICE guideline on long COVID. Lancet Respir Med. 2021;9(2):129. doi: 10.1016/S2213-2600(21)00031-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Carfì A, Bernabei R, Landi F. Persistent symptoms in patients after acute COVID-19. JAMA. 2020;324(6):603–605. doi: 10.1001/jama.2020.12603. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Trinkmann F, Müller M, Reif A, Kahn N, Kreuter M, Trudzinski F, Eichinger M, Heussel C‑P, Herth FJ. Residual symptoms and lower lung function in patients recovering from SARS-CoV‑2 infection. Eur Respir. J. 2021 doi: 10.1183/13993003.03002-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Myall KJ, Mukherjee B, Castanheira AM, Lam JL, Benedetti G, Mak SM, Preston R, Thillai M, Dewar A, Molyneaux PL. Persistent post-COVID-19 interstitial lung disease. An observational study of corticosteroid treatment. Annals ATS. 2021;18(5):799–806. doi: 10.1513/AnnalsATS.202008-1002OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Vlachoyiannopoulos PG, Magira E, Alexopoulos H, Jahaj E, Theophilopoulou K, Kotanidou A, Tzioufas AG. Autoantibodies related to systemic autoimmune rheumatic diseases in severely ill patients with COVID-19. Ann Rheum Dis. 2020;79(12):1661–1663. doi: 10.1136/annrheumdis-2020-218009. [DOI] [PubMed] [Google Scholar]
- 9.Fujii H, Tsuji T, Yuba T, Tanaka S, Suga Y, Matsuyama A, Omura A, Shiotsu S, Takumi C, Ono S. High levels of anti-SSA/Ro antibodies in COVID-19 patients with severe respiratory failure: a case-based review. Baillieres Clin Rheumatol. 2020 doi: 10.1007/s10067-020-05359-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Woodruff MC, Ramonell RP, Nguyen DC, Cashman KS, Saini AS, Haddad NS, Ley AM, Kyu S, Howell JC, Ozturk T. Extrafollicular B cell responses correlate with neutralizing antibodies and morbidity in COVID-19. Nat Immunol. 2020 doi: 10.1038/s41590-020-00814-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Cho JL, Villacreses R, Nagpal P, Guo J, Pezzulo AA, Thurman AL, Hamzeh NY, Blount RJ, Fortis S, Hoffman EA, Zabner J, Comellas AP. Small airways disease is a post-acute sequelae of SARS-CoV-2 infection. 2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bhadelia N, Belkina AC, Olson A, Winters T, Urick P, Lin N, Rifkin I, Kataria Y, Yuen RR, Sagar M, Snyder-Cappione JE. Distinct autoimmune antibody signatures between hospitalized acute COVID-19 patients, SARS-CoV-2 convalescent individuals, and unexposed pre-pandemic controls. 2021. [Google Scholar]
- 13.Fischer A, Antoniou KM, Brown KK, Cadranel J, Corte TJ, Du Bois RM, Lee JS, Leslie KO, Lynch DA, Matteson EL. An official European Respiratory Society/American Thoracic Society research statement: interstitial pneumonia with autoimmune features. Eur Respir J. 2015;46(4):976–987. doi: 10.1183/13993003.00150-2015. [DOI] [PubMed] [Google Scholar]


