Abstract
Existe una clara relación entre la infección por gripe y las enfermedades cardiorrespiratorias. La gripe se ha descrito como un factor capaz tanto de descompensar a pacientes con patologías crónicas como de desencadenar la aparición de nuevos eventos respiratorios y cardiovasculares. Como consecuencia, la infección por gripe y su comorbilidad asociada tienen un importante impacto en el sistema sanitario. En este documento, se ha revisado extensamente la literatura actual para describir los datos más relevantes sobre la relación entre la infección por gripe y las enfermedades cardiorrespiratorias. Asimismo, se exponen los posibles mecanismos fisiopatológicos que explicarían la asociación entre la infección por gripe y los eventos cardíacos y respiratorios. Finalmente, se han puesto los datos en perspectiva para resaltar la importancia de la vacunación frente a la gripe, una medida efectiva en la prevención de enfermedades cardiovasculares, especialmente en la población con enfermedades crónicas subyacentes.
Palabras clave: Gripe, eventos cardiovasculares, enfermedades respiratorias, vacuna antigripal
Abstract
There is accumulating evidence showing that influenza infection and cardiorespiratory diseases are closely associated. Influenza has been described as a triggering factor capable of both exacerbate underlying chronic diseases as well as inducing the appearance of new respiratory and cardiovascular events. Consequently, influenza infection and its associated comorbidity have a significant impact on the health system. In this document, we extensively reviewed the current literature to describe the most relevant data on the relationship between influenza infection and cardiorespiratory diseases. Likewise, we analyzed the possible pathophysiological mechanisms explaining the connection between influenza infection and cardiac and respiratory events. Finally, reviewed data has been put into perspective to highlight the importance of influenza vaccination as an effective measure in the prevention of cardiorespiratory diseases, especially in the population with underlying chronic diseases..
Keywords: Influenza, cardiovascular events, respiratory disease, influenza vaccine
INTRODUCCIÓN
En los últimos años, la esperanza de vida ha aumentado de forma significativa en todo el mundo. En España, según datos del Instituto Nacional de Estadística (INE), entre 1998 y 2018 ha pasado de 75,4 a 80,5 años en los hombres, y de 82,3 a 85,9 años en las mujeres [1]. Esto supone un aumento de la población de edad avanzada y, consecuentemente, un incremento de las comorbilidades asociadas a la edad. Enfermedades crónicas como el asma, la enfermedad coronaria, la bronquitis o la enfermedad cerebrovascular son muy prevalentes entre la población mayor de 65 años en nuestro país [2], lo que contribuye a un aumento de la complejidad en este grupo poblacional y un mayor riesgo de eventos adversos para la salud.
La gripe es uno de los factores que puede exacerbar estas comorbilidades, requiriendo hospitalización e incluso llegando a provocar la muerte [3]. Se trata de una enfermedad que afecta a más de mil millones de personas en todo el mundo cada año. Se ha demostrado que la infección por gripe no solo puede descompensar a pacientes con patologías crónicas previas sino que, además, puede desencadenar la aparición de novo de eventos respiratorios y cardiovasculares.
Existen suficientes datos que avalan una asociación clínicamente significativa entre la gripe y los acontecimientos cardiorrespiratorios. Respecto a los cardiovasculares, el riesgo de un infarto de miocardio o de un accidente cerebrovascular aumenta significativamente en temporada de gripe, incrementándose el número de hospitalizaciones por causas cardiovasculares [4-7]. Así, estudios recientes han demostrado que la infección por el virus de la gripe aumenta entre 6 y 10 veces el riesgo de sufrir un infarto de miocardio, y entre 3 y 8 veces el riesgo de accidentes cerebrovasculares [5,6,8]. En cuanto a acontecimientos respiratorios, según la Organización Mundial de la Salud (OMS), hasta 650.000 personas murieron debido a enfermedades respiratorias asociadas a la gripe, como la neumonía y la bronquitis, en 2017 [9]. La infección por gripe es también una causa importante del exceso de mortalidad y morbilidad en personas con enfermedad pulmonar obstructiva crónica (EPOC) o asma, llegando incluso a afectar la progresión de la enfermedad y la frecuencia de exacerbaciones [10-12]. Además, las personas con EPOC tienen un aumento del riesgo de hospitalización relacionada con enfermedades respiratorias durante los brotes de gripe, independientemente de la edad y el grado de morbilidad [13]. Por lo tanto, la infección por gripe y su comorbilidad asociada representa un problema de salud pública con un enorme coste social y económico.
La evidente relación entre la infección por gripe y las enfermedades cardiorrespiratorias refuerzan la necesidad de medidas que mitiguen la incidencia de la infección por el virus de la gripe, especialmente en aquellos pacientes con un elevado riesgo cardiovascular, o con enfermedades cardiovasculares o respiratorias subyacentes. Las medidas preventivas adoptadas frente a la reciente pandemia por COVID-19 parecen haber mediado una reducción de la actividad gripal en 2020 en comparación con temporadas previas [14]. Sin embargo, la manera más efectiva de prevenirla es mediante la vacunación anual [15-18]. La efectividad global de la vacuna frente a la gripe se sitúa alrededor del 65 %, dependiendo de múltiples factores, como el grado de concordancia entre las cepas presentes en la vacuna y las cepas circulantes ese año, el tipo de vacuna, o la vía de administración, entre otras características [19-22]. Además, las vacunas antigripales inactivadas presentan excelentes perfiles de seguridad y los acontecimientos adversos, cuando aparecen, suelen ser locales o sistémicos leves [18]. Es desta-cable que, a pesar de su disponibilidad y de que los 28 países de la Unión Europea actualmente recomiendan la vacunación frente a la gripe en personas con enfermedades crónicas, las tasas de vacunación en los grupos de riesgo son muy variables, oscilando entre el 15,7 % y el 57,1 % en la temporada 2016-17, con una mediana del 44,9 % [23]. En España, los datos del Ministerio de Sanidad recogen que, en la campaña 2018-19, la cobertura en mayores de 65 años varió entre el 49 % y el 65 % según CC.AA.; fue del 17 %- 30 % entre los 60-64 años en las CC. AA. que la administraban a este rango de edad y osciló entre el 22 % y el 55 % en las embarazadas [24]. En estos informes no se recogen datos de cobertura de vacunación antigripal en enfermos crónicos menores de 65 años.
En este contexto, este documento pretende resumir la evidencia actual sobre la relación entre la infección por gripe y las enfermedades cardiorrespiratorias. Se muestran los datos más relevantes para determinar el impacto real de los eventos cardiorrespiratorios en el sistema sanitario. Asimismo, se exponen los posibles mecanismos fisiopatológicos que explicarían la asociación entre la infección por gripe y los eventos cardíacos y respiratorios. Finalmente, todos estos datos se pondrán en perspectiva para resaltar la importancia de la vacunación frente a la gripe, especialmente en esta población con enfermedades crónicas subyacentes.
GRIPE Y ENFERMEDADES CARDIOPULMONARES: UNA RELACIÓN DEMOSTRADA
Gripe y eventos cardiovasculares. Las enfermedades cardiovasculares (ECV) son un conjunto de patologías que se deben a trastornos del corazón o de los vasos sanguíneos y que tienen un origen multifactorial. Aunque existen muchos tipos de ECV, las que se han visto más relacionadas con la infección por gripe son la cardiopatía isquémica, la insuficiencia cardíaca, la fibrilación auricular y los accidentes cerebrovasculares.
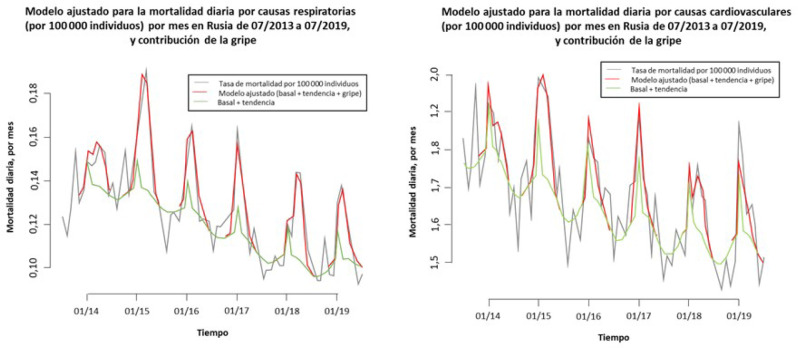
La asociación entre la gripe y las complicaciones cardiovasculares se conoce desde hace más de 80 años. En un estudio en el que se analizaron los datos históricos del exceso de mortalidad en los EE. UU. entre 1915-1929, se encontró que el exceso de mortalidad por cualquier causa durante las epidemias de gripe fue sensiblemente mayor [25]. Entre las causas de muerte se incluían las cardiopatías orgánicas que, en el periodo estudiado, alcanzaron sus máximos niveles de forma simultánea a los picos de gripe en prácticamente todas las epidemias [25]. De forma similar, una reciente investigación en Rusia entre las temporadas 2013-2014 y 2018-2019 ha demostrado que existe una asociación entre la presencia de gripe y el aumento de la mortalidad por causas cardiovasculares (Figura 1) [26].
Figura 1.
Modelo ajustado para las tasas de mortalidad por causas respiratorias (gráfico izquierdo) o cardiovasculares (gráfico derecho) por 100 000 individuos por mes en Rusia durante las temporadas entre julio de 2013 y julio de 2019. Figura adapta de Goldstein E. (2019) [26]. Los picos muestran el exceso de mortalidad coincidentes además con la época invernal.
Otros estudios observacionales han demostrado una sólida relación entre la gripe o la enfermedad de tipo gripal (ILI, de sus siglas del inglés) y la muerte u hospitalización por causas cardiovasculares. En uno de ellos se analizaron series temporales de mortalidad por ECV e informes de ILI en Nueva York entre 2006 a 2012, y se observó que las temporadas con más ILI tenían un mayor exceso de mortalidad por ECV. La mayoría de muertes fueron por cardiopatía isquémica (72 %) e infarto de miocardio (12 %) [27]. Un estudio realizado en Escocia con el objetivo de analizar el efecto de la gripe como desencadenante de infarto de miocardio o accidente cerebrovascular en una cohorte de pacientes mostró un aumento del riesgo de infarto de miocardio de 9 veces a los 1-3 días después de la infección, y de 8 veces el riesgo de accidente cerebrovascular tras el mismo tiempo postinfección [28]. Estos datos se han corroborado en otras investigaciones independientes. En Canadá, un estudio en el que se evaluaba la asociación entre la infección por gripe confirmada en laboratorio y la hospitalización por infarto de miocardio en adultos mayores de 35 años demostró que el riesgo de ingreso por infarto de miocardio agudo era de entre 5 (para la gripe A) y 10 (para la gripe B) veces mayor durante los 7 días siguientes a la infección por gripe [8]. Además, en 2018 un estudio estadounidense confirmó también que la ILI aumentaba el riesgo de ictus isquémico unas 3 veces en los primeros quince días postinfección [6].
Por otro lado, la infección por gripe también se ha asociado a un aumento de la morbilidad y mortalidad hospitalaria en los pacientes con insuficiencia cardíaca [29]. Un estudio reciente ha comparado la actividad de ILI en cuatro regiones de los EE. UU. con la tasa de ingresos por insuficiencia cardíaca o infarto de miocardio en una muestra de más de 451.000 personas entre octubre de 2010 y septiembre de 2014. Los investigadores encontraron que, de media, un aumento del 5 % en la actividad mensual de ILI se asociaba a un incremento del 24 % en las tasas de hospitalización por insuficiencia cardíaca en el mismo mes. Además, la ILI se asoció temporalmente a un aumento en las hospitalizaciones por insuficiencia cardíaca en las cuatro temporadas de gripe [7].
También se ha demostrado que la infección por gripe aumenta el riesgo de eventos cardíacos en pacientes con enfermedad cardiovascular establecida. En un estudio de casos y controles en individuos con historia previa de infarto de miocardio, se comparó un grupo de pacientes que padecieron un infarto recurrente con respecto a un grupo control en el que no hubo empeoramiento de la enfermedad [30]. La vacuna frente a la gripe se asoció con una reducción del 67 % en el riesgo de infarto durante la siguiente temporada de gripe [30]. Asimismo, múltiples ensayos clínicos y metaanálisis han mostrado los beneficios de la vacuna antigripal en la prevención secundaria de muerte cardiovascular, eventos cardiovasculares y hospitalización [31-37]. Por otra parte, muchos pacientes no vacunados desarrollan gripe o ILI que tratan sintomáticamente con antiinflamatorios no esteroideos (AINE) como el ibuprofeno [38]. Sin embargo, el uso continuado de AINE puede producir efectos secundarios especialmente graves en pacientes con patologías cardiovasculares subyacentes. Estudios recientes han demostrado que el uso de AINE puede aumentar entre 3 y 4 veces el riesgo de un infarto agudo de miocardio, e incrementar en un 19 % el riesgo de ingreso hospitalario por insuficiencia cardíaca [39, 40].
En conclusión, la relación entre la gripe y los desenlaces cardiovasculares ha sido evidente durante muchos años e independientemente del planteamiento de los estudios, parece que existe una asociación clínicamente significativa.
Gripe y eventos respiratorios. A lo largo de la historia, la gripe se ha visto asociada a diversas enfermedades respiratorias, tanto crónicas como agudas. En esta revisión nos vamos a centrar en el asma, la EPOC y la neumonía.
El asma es una enfermedad crónica caracterizada por la inflamación de las vías respiratorias, producción excesiva de secreciones, hiperreactividad bronquial y una obstrucción reversible del flujo de aire que conduce a episodios recurrentes de sibilancias, disnea y tos [41]. Es común que curse con exacerbaciones que empeoren la situación basal del paciente e incluso puedan requerir su hospitalización. Se trata de la enfermedad subyacente más frecuente en pacientes hospitalizados por gripe, tanto en adultos (7,6 %-46 %) como en niños (8,3 %-42 %)[42-44]. Asimismo, el asma representa un factor de riesgo de hospitalización durante las temporadas de gripe en la población general [43]. Lo mismo aplica en niños, en los que se ha determinado que el asma confiere un riesgo de hospitalización de 4 a 21 veces mayor [45-47]. Por otro lado, los pacientes con asma parecen tener un mayor riesgo de ser ingresados en la unidad de cuidados intensivos (UCI) y una peor evolución cuando están hospitalizados por gripe [43]. La infección gripal puede, además, conducir a exacerbaciones asmáticas. En dos estudios con pacientes ambulatorios adultos se encontró que la gripe estaba presente en el 32 % y el 9,8 % de los casos con exacerbaciones agudas. Entre los adultos hospitalizados con asma, se detectaron tasas de exacerbaciones inducidas por gripe entre un 10 % y un 37,9 % [48-51].
La EPOC se caracteriza por una limitación progresiva del flujo aéreo. Esta obstrucción del flujo aéreo está asociada con un proceso inflamatorio en la mucosa bronquial. La mayoría de los pacientes con EPOC son fumadores o ex fumadores. Existe un grupo de pacientes con EPOC que se caracteriza por presentar una o más exacerbaciones por año, que están asociadas con una disminución acelerada de la función pulmonar y una reducción de la calidad de vida. En pacientes con EPOC, la infección por virus respiratorios se ha asociado con una disminución acelerada de la función pulmonar, independientemente del tabaquismo, la frecuencia de exacerbaciones y la carga bacteriana de las vías respiratorias inferiores [52]. Así, se ha visto que la infección por gripe es causa de un exceso de morbilidad y mortalidad en la EPOC y puede afectar a la progresión de la enfermedad independientemente de la edad [53] Asimismo, entre un 15 % y un 64 % de las exacerbaciones de la EPOC están asociadas con infecciones respiratorias de origen vírico [54-56]. En estudios en poblaciones que no recibieron la vacuna antigripal, las tasas de hospitalización por exacerbaciones agudas de EPOC fueron sustancialmente más altas en la temporada de gripe que en la temporada sin gripe [57].
La neumonía es una infección aguda de los pulmones que produce la inflamación de los espacios alveolares, lo que provoca tos productiva, fiebre y dificultad para respirar. Se trata de la principal causa de muerte en niños menores de cinco años en todo el mundo, con alrededor de 1,6 millones de muertes al año en este grupo de edad [58]; más del 99% de todas las muertes por neumonía ocurren en países con baja renta. En Europa, las tasas de mortalidad por neumonía son sustancialmente más altas en niños de hasta cuatro años y en adultos mayores de 75 años que en otros grupos de edad [58]. En un metaanálisis reciente se determinó que la tasa de coinfección entre gripe y neumonía fluctúa entre un 2 % y un 65 % en función del país de origen y del estado de gravedad de los pacientes [59]. Además, la coinfección supone un factor de riesgo independiente de mortalidad en pacientes con gripe en la UCI [60].
Por otro lado, múltiples investigaciones clínicas y epidemiológicas han demostrado que la infección bacteriana secundaria a la infección por gripe puede aumentar significativamente la morbilidad y mortalidad en comparación con la infección solo por el virus de la gripe, especialmente en pacientes con neumonía grave [61,62]. La infección por el virus de la gripe puede provocar síntomas en el tracto respiratorio inferior, pero las infecciones bacterianas secundarias durante y después de la gripe son una causa mucho más común de neumonía. La incidencia de la enfermedad neumocócica invasiva se correlaciona estrechamente con la temporada de gripe y la vacunación antineumocócica no solo resulta en una reducción del número de casos de neumonía, sino que también conduce a una disminución de los casos de neumonía asociada a la gripe [63,64]. Aunque la neumonía bacteriana secundaria también se ha descrito para otros virus respiratorios, la morbilidad y la mortalidad son mucho más bajas que las observadas cuando existe coinfección por el virus de la gripe [65, 66]. Así pues, el virus gripal se presenta como un facilitador para la sobreinfección bacteriana, principalmente por el neumococo como se explica y desarrolla en la punto 3.1
ETIOPATOGENIA DE LOS EVENTOS CARDIORRESPIRATORIOS ASOCIADOS A LA GRIPE
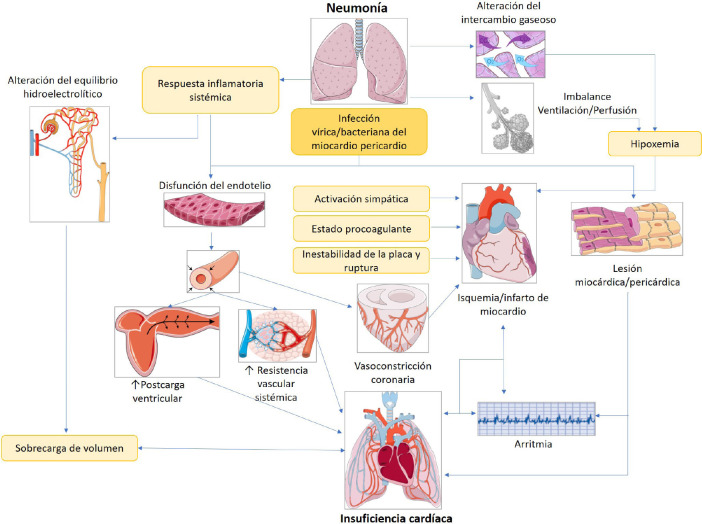
Mecanismos fisiopatológicos de los eventos cardiovasculares relacionados con la gripe. Ante el proceso infeccioso originado en el pulmón se producen diversas alteraciones fisiopatológicas que tendrán consecuencias sobre el sistema cardiovascular, tanto por sus implicaciones locales, como hipoxemia e hipoxia tisular, como por las derivadas de la inflamación sistémica (Figura 2).
Figura 2.
Resumen de los principales mecanismos implicados en las complicaciones cardiacas durante las infecciones respiratorias, especialmente la neumonía [111].
Esquema creado usando imágenes de Servier Medical Art (smart.servier.com)
La hipoxemia puede provocar daño miocárdico de origen no isquémico además de ser también potencial desencadenante de arritmias. Por otra parte, la inflamación sistémica puede afectar directamente a las placas de ateroma, generar un estado procoagulante y producir disfunción endotelial, que conduce a vasoconstricción coronaria e isquemia miocárdica.
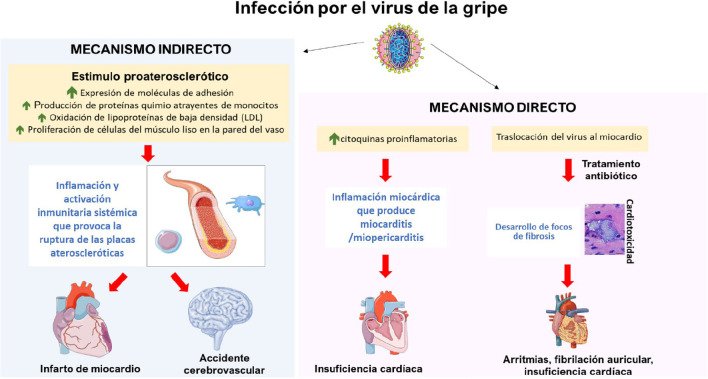
La relación entre la infección por el virus de la gripe y el desarrollo de patologías del corazón, o el empeoramiento de éstas en pacientes con antecedentes cardiovasculares previos tiene varios mecanismos [67, 68]. Por un lado, se ha descrito un mecanismo indirecto por el cual la infección gripal provocaría la ruptura de las placas ateroscleróticas que culminan en eventos clínicos como infarto agudo de miocardio agudo o un accidente cerebrovascular (Figura 2) [69]. La infección actuaría como un estímulo inflamatorio y activaría el sistema inmunitario, cuya respuesta acelera el crecimiento causando la génesis, progresión e inestabilidad de las placas ateroscleróticas [70]. Múltiples agentes infecciosos, incluido el virus de la gripe, inducen mecanismos proateroescleróticos locales, como con la expresión de moléculas de adhesión, la producción de proteínas quimioatrayentes de monocitos o la oxidación de lipoproteínas de baja densidad (LDL) que activan el endotelio, promueven la migración de leucocitos y eventualmente la formación del “core” lipídico de placas de ateroma de lípidos [70-73]. Además, las infecciones también se han asociado con una mayor proliferación de células del músculo liso en la pared del vaso del endotelio, lo que contribuye a la progresión de dichas placas [70].
Por otro lado, como se resume en la Figura 3 , también se especula con un posible efecto directo de la infección vírica. La infección por el virus de la gripe produciría un aumento de las citoquinas proinflamatorias, que pueden dar lugar a pericarditis o miocarditis y, en última instancia, generar insuficiencia cardíaca [74,75]. Otro mecanismo propuesto más recientemente implica la cardiotoxicidad, descrita inicialmente en neumonías neumocócicas donde se ha observado una traslocación bacteriana al miocardio sin una expresión inflamatoria celular identificable, pero sí con la capacidad de que se produzcan focos de microfibrosis en relación con la destrucción de la bacteria por los antibióticos y que pudiera dar lugar a patologías como arritmias, fibrilación auricular o insuficiencia cardíaca [76,77]. En este contexto, el virus de la gripe podría actuar en el miocardio de manera similar al neumococo. La gripe tiene una fuerte asociación con desarrollo de neumonía neumocócica que, por sí misma, ha demostrado aumentar el riesgo de eventos cardiovasculares tanto durante el episodio inicial como en el seguimiento a largo plazo [78].
Figura 3.
Etiopatogenia de los eventos cardiovasculares asociados a gripe [8, 67, 68, 74].
Esquema creado usando imágenes de Servier Medical Art (smart.servier.com)
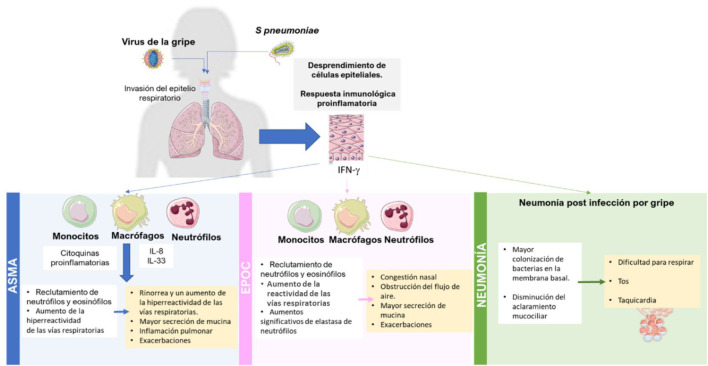
Mecanismos fisiopatológicos de los eventos respiratorios asociados a la gripe. Los pacientes con asma presentan, en primer lugar, un mayor riesgo de desarrollar gripe y, en segundo lugar, complicaciones más graves asociadas con esta enfermedad [3,49]. Los síntomas respiratorios asociados a la gripe son básicamente el resultado de dos factores: i) destrucción del tejido que compone la vía aérea normal como consecuencia de los efectos directos del virus, y ii) la respuesta inflamatoria desencadenada por la infección. En el mecanismo propuesto, resumido en la Figura 4, la infección por gripe se inicia con la invasión del epitelio respiratorio, en el que se dan la replicación vírica y la respuesta inmunológica del huésped [79]. La replicación viral desencadena respuesta inmune innata y adaptativa predominantemente en la vía aérea que incluye la activación celular (macrófagos y monocitos) y la liberación de citoquinas proinflamatorias. La respuesta del huésped causa muchos de los síntomas propios de cualquier infección respiratoria viral y aquellos asociados con las exacerbaciones asmáticas. Por otra parte, la activación de neutrófilos aumenta la producción de elastasa y mucina por las células caliciformes de las vías respiratorias. Asimismo, las partículas virales también contribuyen a los síntomas al aumentar la hiperreactividad de las vías respiratorias, aunque se desconoce el mecanismo. El daño viral inducido en el epitelio respiratorio provoca también el desprendimiento de estas células hacia la luz de las vías respiratorias, lo que agrava el grado de la obstrucción y la manifestación en forma de sibilancias [80]. Además, una investigación reciente ha demostrado la implicación de la interleucina 33 (IL-33) en la aparición de exacerbaciones asmáticas inducidas por infecciones virales [81].
Figura 4.
Etiopatogenia de los eventos respiratorios asociados a gripe [79, 80, 112]
Esquema creado usando imágenes de Servier Medical Art (smart.servier.com)
Los mecanismos de exacerbación de la EPOC inducida por virus respiratorios siguen sin estar claros. Sin embargo, parece que serían similares a los descritos para el asma [82]. La infección vírica conduciría al desprendimiento de células epiteliales, dilatación microvascular, edema e infiltración de células inmunes. Se promovería una respuesta inmune, con la participación del receptor TLR-3 y con la producción de la citoquina IL-8, provocando congestión nasal [82]. Además, se han detectado aumentos significativos de elastasa de neutrófilos en el esputo de pacientes con EPOC tras sufrir una infección vírica, que se han relacionado con una mayor gravedad de los síntomas y con la obstrucción del flujo de aire en sujetos con EPOC [12,83].
La mayoría de los estudios sobre el mecanismo subyacente del desarrollo de neumonía bacteriana tras la infección gripal se han centrado en el deterioro de las defensas del huésped frente a una infección producida por un patógeno no relacionado. El daño inducido por el virus de la gripe en el epitelio de las vías respiratorias conduce a una mayor colonización de las bacterias en la membrana basal mediante el favorecimiento de la adhesión bacteriana e invasión [84]. Además, se ha demostrado que la gripe perjudica la función de los neutrófilos en múltiples niveles. Por otro lado, también provoca reducción del aclaramiento mucociliar, lo cual aumenta la producción de moco y supone una mayor cantidad de sustrato disponible para Streptococcus pneumoniae [85]. Todos estos datos corroboran que la infección viral facilita la invasión de S. pneumoniae y el desarrollo de la enfermedad en personas de todas las edades [85].
IMPACTO DE LOS EVENTOS CARDIORRESPIRATORIOS ASOCIADOS A LA GRIPE
Enfermedades cardiovasculares. Según datos de la OMS, entre 2013 y 2016 la prevalencia de ECV en adultos mayores de 20 años fue del 48,0 %, con un total de 121,5 millones de personas en 2016. Esta prevalencia aumenta con la edad, tanto en hombres como en mujeres. Las ECV siguen siendo la primera causa de muerte a nivel mundial, con 17,9 millones de muertes anuales en 2016, que representan el 31 % de todas las muertes globales [86]. Además, se espera que esta cifra incremente hasta más de 23,6 millones en 2030 [86].
Las ECV representan el 29 % del total de muertes en España, afectando más a mujeres (54 %) que a hombres (46 %) según datos del INE para 2018 [87]. Específicamente, los infartos de miocardio agudos tienen una incidencia anual en España del 0,69 %, provocando casi 15.000 muertes en 2018. El número de ingresos por esta causa fue de 57.903 [87] (Tabla 1). Los valores son aún más elevados para los pacientes con insuficiencia cardíaca o accidentes cerebrovasculares, con 19.142 y 26.420 muertes anuales respectivamente [87].
Tabla 1.
Impacto epidemiológico de eventos cardiorrespiratorios que se han asociado con la gripe en España [87]
| Evento | Códigos CIE-10 | INE. Defunciones según la Causa de Muerte 2018 | Mortalidad (x 100.000 hab) 2018 |
|---|---|---|---|
| Asma | J45 | 1.111 | 2,05 |
| EPOC | J44 | 3.169 | 6,95 |
| Neumonía | J13 | 10.415 | 22,29 |
| Infarto agudo de miocardio | I21 | 14.521 | 32,14 |
| Insuficiencia cardíaca | I50 | 19.142 | 41,19 |
| Enfermedades cerebrovasculares | I60-I69 | 26.420 | 57,89 |
| Fibrilación auricular | I48 | 6.926 | 14,38 |
Enfermedades respiratorias. En España, el asma es un problema de salud pública cada vez más frecuente. Tal y como se muestra en la Tabla 1, en 2017, la incidencia de asma en España fue de 4,7 %, con más de 22 600 ingresos hospitalarios. Por otro lado, en 2018, más de 1000 personas fallecieron a causa de esta patología en nuestro país [88].
Respecto a la EPOC, se estima una prevalencia a nivel mundial del 11,7 %, siendo la causante de alrededor de 3 millones de muertes anuales [89,90]. Además, teniendo en cuenta el mayor envejecimiento en la población y el aumento del tabaquismo, se espera que la prevalencia de EPOC aumente en los próximos 40 años y sea la causa de unos 5,4 millones de muertes anuales [91,92].
La EPOC representa el 6,95 % de las defunciones en España con 15.421 muertes anuales, por detrás de la cardiopatía isquémica (14,5 %) o el Alzheimer y otras demencias (13,6 %). Sin embargo, es más mortal que patologías muy prevalentes como el cáncer de pulmón, que figura como la quinta causa de muerte [93]. A nivel de morbilidad, se calcula que la EPOC supone unos 100 000 ingresos hospitalarios al año en nuestro país [94].
Los datos de un estudio en España sitúan la tasa de hospitalización por neumonía en 3,54 personas hospitalizadas por cada 1.000 habitantes, con un promedio de estancia en el hospital por año de 16,63 días [95]. Además, la tasa de incidencia anual media de neumonía adquirida en la comunidad (NAC) es 4,63 por 100.000 habitantes en adultos y alcanza los 1400 casos por cada 100 000 habitantes en > 65 años [96,97]. La letalidad debida a esta patología respiratoria fue del 19,56 % entre 2009-2014 [95]. Según datos del INE para el 2018, la neumonía causó más de 10 000 muertes y provocó unos 120.000 ingresos [87].
LA VACUNA FRENTE A LA GRIPE: UNA MEDIDA EFICAZ PARA EL CONTROL DE LOS EVENTOS CARDIORRESPIRATORIOS ASOCIADOS
Diversas investigaciones han analizado el posible efecto de la vacuna antigripal en la prevención primaria o secundaria de enfermedades cardiopulmonares asociadas. Un estudio retrospectivo en el que se agruparon los datos de 18 cohortes, con un total de 713. 872 pacientes de edad avanzada por temporada, durante 10 temporadas de vacunación, demostró que la vacunación antigripal se asocia con reducciones significativas en el riesgo de hospitalización por neumonía o gripe (con un promedio de un 27 %) y una disminución del 48 % en el riesgo de muerte en pacientes vacunados [98]. Asimismo, un estudio prospectivo en el que se analizó el efecto de la vacunación antigripal en pacientes con EPOC mostró una reducción del 38 % en las hospitalizaciones relacionadas con el virus de la gripe en individuos vacunados frente a los no vacunados [99]. Por otro lado, los resultados de un estudio con 2.217 pacientes con ILI durante la temporada 2013-2014 indicaron que las tasas ajustadas de efectividad de la vacuna antigripal en la prevención del desarrollo de neumonía y la hospitalización fueron del 64 % (IC 95 % = 29 % -81 %) y del 35 % (IC 95 % = 12 % a 52 %), respectivamente [100].
Respecto a los eventos cardiovasculares, en un estudio de casos y controles, tras ajustar por factores de riesgo demográficos, clínicos y de comportamiento, la vacunación contra la gripe se asoció con una reducción del riesgo de paro cardíaco primario fuera del hospital [101]. Otro estudio, aleatorizó 301 pacientes ingresados por infarto de miocardio o intervención coronaria percutánea programada, a recibir la vacuna contra la gripe o no recibirla. La mortalidad por causas cardiovasculares fue menor en el grupo de pacientes vacunados (2 % frente a 8 %), y este efecto fue significativamente evidente tras 1 año de seguimiento (6 % vs. 17 %) [102]. También se redujo la variable secundaria compuesta, que incluía eventos cardiovasculares mayores (MACE), definidos como muerte cardiovascular, infarto de miocardio no fatal u hospitalización por isquemia (11 % frente 23 %) tras un seguimiento de 6 meses [102]. Otro metaanálisis en el que se incluyeron 12 ensayos clínicos aleatorizados siguió a 6.735 pacientes de alto riesgo cardiovascular durante una media de 7,9 meses [35]. En el subgrupo de pacientes con síndrome coronario agudo reciente (≤1 año) (n = 815), la vacuna contra la gripe redujo significativamente los MACE [35].
En conjunto, se calcula que la vacuna para la gripe reduce el riesgo relativo de infarto de miocardio entre un 15 % y un 45 % [103]. Este efecto protector es comparable con la eliminación de otros factores clásicos de riesgo cardiovascular, como el tabaquismo cuyo cese se estima tiene una reducción del riesgo cardiovascular de entre un 32 % y un 43 %; o con el uso de fármacos antihipertensivos y de fármacos hipocolesterolemiantes, asociados a una de reducción de riesgo cardiovascular del 17-25 % y del 19-30 % respectivamente (Tabla 2) [103].
Tabla 2.
Medidas de prevención secundaria para el infarto de miocardio [103]
| Factores | Reducción del riesgo relativo (%) |
|---|---|
| Vacunación antigripal | 15-45 % |
| Dejar de fumar | 32-43% |
| Tratamiento con estatinas | 19-30% |
| Terapia antihipertensiva | 17-25% |
El mecanismo del efecto protector de la vacunación antigripal está relacionado con la prevención de las infecciones respiratorias y la reducción del estrés asociado [74,104]. Sin embargo, específicamente en su papel cardioprotector, la vacuna antigripal se ha relacionado con la modificación del modelo inmunoinflamatorio de la aterosclerosis. Existen estudios en los que se muestra una protección de la vacunación más allá de la temporada de gripe. Se ha propuesto un mecanismo de “imitación de antígeno” entre los agentes infecciosos y los antígenos de la placa aterosclerótica [75,104]; de tal forma que con la vacunación antigripal, se impediría el efecto del virus de la gripe sobre la alteración de la homeostasis de las placas de ateroma en pacientes vulnerables. Un estudio reciente ha propuesto un posible mecanismo molecular en el que algunos de los anticuerpos generados por las vacunas antigripales actuarían como agonistas del receptor de la bradiquinina-2, activando una vía de señalización (con activación del óxido nítrico y facilitación de la vasodilatación y de la natriuresis) que contribuiría a la protección contra las ECV [105].
La vacunación frente a la gripe no sólo supone beneficios clínicos para los pacientes con patologías cardiopulmonares subyacentes, sino que también implica beneficios a nivel económico. Estudios de coste-efectividad en los EE.UU. han demostrado que, un aumento de la tasa de vacunación hasta un 80 % entre los pacientes hospitalizados con síndrome coronario agudo, tiene un perfil económico favorable y supone un ahorro de los costes [106]. Otra investigación en Corea en la que se incluyeron 682.258 pacientes con síndrome coronario agudo mostró que la vacuna contra la gripe evitaría 16.514 hospitalizaciones relacionadas con eventos cardiovasculares mayores y 2.764 muertes prematuras en el país por año, lo que supondría una reducción global de los costes de 86,2 millones de dólares [107]. Asimismo, en Australia se determinó que la ampliación del programa de vacunación a todos los adultos de 50 a 64 años para prevenir las hospitalizaciones relacionadas con la gripe sería rentable económicamente. Con ello, se evitarían 314 hospitalizaciones anuales por gripe/neumonía, 388 hospitalizaciones debidas a otras enfermedades respiratorias y 1.482 infartos agudos de miocardio en un año, lo que supondría un ahorro de alrededor de 8 millones de dólares [108]. En España, un estudio realizado entre las temporadas de gripe 2013-2014 y 2014–15, en el que se registraron un total de 728 casos confirmados de gripe en mayores de 65 años, determinó que los costes medios por hospitalización relacionados con gripe fueron un 2,75 % más bajos en los pacientes vacunados. La vacuna antigripal mostró además una protección significativa frente al ingreso en la UCI y la infección por neumonía bacteriana secundaria, entre otros factores [109].
Existen pues, evidencias que demuestran que la vacunación antigripal puede prevenir los eventos cardiorrespiratorios y, como consecuencia, suponer un beneficio económico [10,11]. En relación con esto, hay una nueva vacuna antigripal disponible que ha demostrado una efectividad relativa del 20,9 % frente a la incidencia de ingresos hospitalarios por patologías en las vías respiratorias, siendo un 12,7 % mayor que la vacuna de dosis estándar tradicional [110]. Esto tiene una considerable importancia clínica y sanitaria, dada la infrautilización de la vacunación entre la población, a pesar de que actualmente tanto las autoridades sanitarias como las sociedades médicas y los organismos asesores recomiendan la vacuna frente a la gripe en los pacientes con enfermedades crónicas [12-14], las tasas de vacunación en esta población de riesgo clínico son muy variables y siguen siendo subóptimas. Según datos del Ministerio de Sanidad, Consumo y Bienestar Social, en España la cobertura de la vacuna antigripal fue tan solo del 54,2 % en las personas mayores de 65 años y del 22,8 % en la población de entre 60 y 64 en la temporada 2018-2019 [15].
Esta revisión pone de manifiesto el gran impacto que tienen las complicaciones cardiorrespiratorias asociadas a la gripe, aumentando de forma significativa la morbimortalidad de los pacientes, y un incremento de los gastos sanitarios asociados. Incrementar la tasa de vacunación antigripal en estas poblaciones es una medida de eficacia probada para mejorar el control de los eventos cardiovasculares y respiratorios en relación con la infección gripal. En esta línea, la llegada de nuevas vacunas antigripales, con una previsible mayor efectividad frente a gripe y sus complicaciones cardiorrespiratorias, deberá suponer un nuevo avance en la prevención de la enfermedad gripal.
AGRADECIMIENTOS
Los autores agradecen la ayuda de Vanessa Marfil, PhD (Medical Statistics Consulting, Valencia, España) en la redacción y edición de este manuscrito.
CONFLICTOS DE INTERESES
AGR ha recibido remuneración por actividades docentes y formativas para Sanofi Pasteur, GlaxoSmithKline y MSD. JAA ha colaborado en actividades docentes subvencionadas por GlaxoS-mithKline, MSD, Pfizer y Sanofi Pasteur, como investigador en ensayos clínicos de GlaxoSmithKline, Novartis y Sanofi y como consultor en Advisory Board de GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur. ERM ha recibido honorarios como consultor/ asesor y/o ponente, así como becada para asistir a conferencias o cursos por GlaxoSmithKline, Sanofi Pasteur, MSD, Pfizer y Novartis. MTVA ha recibido remuneración por actividades docentes y formativas para Daiichy-Sankyo, Sanofi Pasteur, FreseniusKabi, Novartis. PS ha colaborado como consultor en Advisory board para Sanofi-Aventis. IJ ha recibido ayudas de viajes y/o honorarios por conferencias y/o el patrocinio de proyectos y/o consultorías de Sanofi Pasteur, Menarini, Seqirus y Pfizer. MGC y AC declaran no tener conflictos de intereses.
FINANCIACIÓN
Sanofi ha promovido el desarrollo de este trabajo financiando los servicios de medical writing y facilitando las reuniones del panel de expertos. Los autores han desarrollado y consensuado el contenido con independencia de la fuente de financiación.
References
- 1.Instituto Nacional de Estadística . Esperanza de vida 2018 [cited 2020 February 11th]. Disponible en: https://www.ine.es/ss/Satellite?L=es_ES&c=INESeccion_C&cid=1259926380048&p=1254735110672&pagename=ProductosYServicios/PYSLayout.
- 2.Abizanda Soler P, Paterna Mellinas G, Martinez Sanchez E, Lopez Jimenez E. [Comorbidity in the elderly: utility and validity of assessment tools]. Rev Esp Geriatr Gerontol. 2010;45(4):219-28. DOI: 10.1016/j.regg.2009.10.009 [DOI] [PubMed] [Google Scholar]
- 3.Walker TA, Waite B, Thompson MG, McArthur C, Wong C, Baker MG, et al. Risk of Severe Influenza Among Adults With Chronic Medical Conditions. J Infect Dis. 2020;221(2):183-90. DOI: 10.1093/infdis/jiz570 [DOI] [PubMed] [Google Scholar]
- 4.Kwok CS, Aslam S, Kontopantelis E, Myint PK, Zaman MJS, Buchan I, et al. Influenza, influenza-like symptoms and their association with cardiovascular risks: a systematic review and meta-analysis of observational studies. International Journal of Clinical Practice. 2015;69(9):928-37. DOI: 10.1111/ijcp.12646 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Warren-Gash C, Smeeth L, Hayward AC. Influenza as a trigger for acute myocardial infarction or death from cardiovascular disease: a systematic review. Lancet Infect Dis. 2009;9(10):601-10. DOI: 10.1016/s1473-3099(09)70233-6 [DOI] [PubMed] [Google Scholar]
- 6.Boehme AK, Luna J, Kulick ER, Kamel H, Elkind MSV. Influenza-like illness as a trigger for ischemic stroke. Annals of Clinical and Translational Neurology. 2018;5(4):456-63. DOI: 10.1002/acn3.545 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kytomaa S, Hegde S, Claggett B, Udell JA, Rosamond W, Temte J, et al. Association of Influenza-like Illness Activity With Hospitalizations for Heart Failure: The Atherosclerosis Risk in Communities Study. JAMA Cardiol. 2019;4(4):363-9. DOI: 10.1001/jamacardio.2019.0549 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kwong JC, Schwartz KL, Campitelli MA, Chung H, Crowcroft NS, Karnauchow T, et al. Acute Myocardial Infarction after Laboratory-Confirmed Influenza Infection. N Engl J Med. 2018;378(4):345-53. DOI: 10.1056/NEJMoa1702090 [DOI] [PubMed] [Google Scholar]
- 9.(WHO) WHO . Up to 650 000 people die of respiratory diseases linked to seasonal flu each year 2017 [Disponible en: https://www.who.int/news-room/detail/14-12-2017-up-to-650-000-people-die-of-respiratory-diseases-linked-to-seasonal-flu-each-year.
- 10.Rothbarth PH, Kempen BM, Sprenger MJ. Sense and nonsense of influenza vaccination in asthma and chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1995;151(5):1682-5; discussion 5-6. DOI: 10.1164/ajrccm/151.5_Pt_1.1682 [DOI] [PubMed] [Google Scholar]
- 11.Centanni S, Pregliasco F, Bonfatti C, Mensi C, Tarsia P, Guarnieri R, et al. Clinical efficacy of a vaccine-immunostimulant combination in the prevention of influenza in patients with chronic obstructive pulmonary disease and chronic asthma. J Chemother. 1997;9(4):273-8. DOI: 10.1179/joc.1997.9.4.273 [DOI] [PubMed] [Google Scholar]
- 12.Mallia P, Johnston SL. Influenza infection and COPD. Int J Chron Obstruct Pulmon Dis. 2007;2(1):55-64. DOI: 10.2147/copd.2007.2.1.55 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Monto AS. Influenza: quantifying morbidity and mortality. Am J Med. 1987;82(6A):20-5. DOI: 10.1016/0002-9343(87)90556-0 [DOI] [PubMed] [Google Scholar]
- 14.Sakamoto H, Ishikane M, Ueda P. Seasonal Influenza Activity During the SARS-CoV-2 Outbreak in Japan. JAMA. 2020. DOI: 10.1001/jama.2020.6173 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Grohskopf LA, Sokolow LZ, Broder KR, Walter EB, Bresee JS, Fry AM, et al. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices-United States, 2017-18 Influenza Season. MMWR Recomm Rep. 2017;66(2):1-20. DOI: 10.15585/mmwr.rr6602a1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Garcia A, Ortiz de Lejarazu R, Reina J, Callejo D, Cuervo J, Morano Larragueta R. Cost-effectiveness analysis of quadrivalent influenza vaccine in Spain. Hum Vaccin Immunother. 2016;12(9):2269-77. DOI: 10.1080/21645515.2016.1182275 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Cox NJ, Subbarao K. Influenza. Lancet. 1999;354(9186):1277-82. DOI: 10.1016/s0140-6736(99)01241-6 [DOI] [PubMed] [Google Scholar]
- 18.World Health Organization . Vaccines against influenza WHO position paper-November 2012. Wkly Epidemiol Rec. 2012;87(47):461-76. [PubMed] [Google Scholar]
- 19.Organización Mundial de la Salud . Evaluation of influenza vaccine effectiveness. A guide to the design and interpretation of observational studies. Ginebra: OMS; 2017. Disponible en: http://apps.who.int/iris/bitstream/10665/255203/1/9789241512121-eng.pdf.
- 20.Nichol KL. Challenges in evaluating influenza vaccine effectiveness and the mortality benefits controversy. Vaccine. 2009;27(45):6305-11. DOI: 10.1016/j.vaccine.2009.07.006 [DOI] [PubMed] [Google Scholar]
- 21.Diaz-Granados CA, Denis M, Plotkin S. Seasonal influenza vaccine efficacy and its determinants in children and non-elderly adults: a systematic review with meta-analyses of controlled trials. Vaccine. 2012;31(1):49-57. DOI: 10.1016/j.vaccine.2012.10.084 [DOI] [PubMed] [Google Scholar]
- 22.Ortiz de Lejarazu R, Tamames S. [Influenza vaccination. Effectiveness of current vaccines and future challenges]. Enferm Infecc Microbiol Clin. 2015;33(7):480-90. DOI: 10.1016/j.eimc.2015.06.011 [DOI] [PubMed] [Google Scholar]
- 23.European center for disease prevention and control (ECDC) . Seasonal influenza vaccination and antiviral use in EU/EEA Member States2018. Disponible en: https://www.ecdc.europa.eu/sites/portal/files/documents/Seasonal-influenza-antiviral-use-EU-EEA-Member-States-December-2018_0.pdf.
- 24.Ministerio de Sanidad CyBS . Coberturas de vacunación frente a gripe en ≥65 años, personas de 60-64 años, embarazadas y personal sanitario. Campaña 2018-2019 2020. [Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacuna-ciones/docs/CoberturasVacunacion/Tabla13.pdf. [Google Scholar]
- 25.Collins SD. Excess Mortality from Causes Other than Influenza and Pneumonia during Influenza Epidemics. Public Health Reports (1896-1970). 1932;47(46):2159. DOI: 10.2307/4580606 [DOI] [Google Scholar]
- 26.Edward G. Influenza-associated mortality for circulatory and respiratory causes during the 2013-2014 through the 2018-2019 influenza seasons in Russia. 2019.
- 27.Nguyen JL, Yang W, Ito K, Matte TD, Shaman J, Kinney PL. Seasonal Influenza Infections and Cardiovascular Disease Mortality. JAMA Cardiology. 2016;1(3):274. DOI: 10.1001/jamacardio.2016.0433 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Warren-Gash C, Blackburn R, Whitaker H, McMenamin J, Hayward AC. Laboratory-confirmed respiratory infections as triggers for acute myocardial infarction and stroke: a self-controlled case series analysis of national linked datasets from Scotland. European Respiratory Journal. 2018;51(3):1701794. DOI: 10.1183/13993003.01794-2017 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Panhwar MS, Kalra A, Gupta T, Kolte D, Khera S, Bhatt DL, et al. Effect of Influenza on Outcomes in Patients With Heart Failure. JACC: Heart Failure. 2019;7(2):112-7. DOI: 10.1016/j.jchf.2018.10.011 [DOI] [PubMed] [Google Scholar]
- 30.Naghavi M, Barlas Z, Siadaty S, Naguib S, Madjid M, Casscells W. Association of influenza vaccination and reduced risk of recurrent myocardial infarction. Circulation. 2000;102(25):3039-45. DOI: 10.1161/01.cir.102.25.3039 [DOI] [PubMed] [Google Scholar]
- 31.Gurfinkel EP, Leon de la Fuente R, Mendiz O, Mautner B. Flu vacci-nation in acute coronary syndromes and planned percutaneous coronary interventions (FLUVACS) Study. Eur Heart J. 2004;25(1):25-31. DOI: 10.1016/j.ehj.2003.10.018 [DOI] [PubMed] [Google Scholar]
- 32.Wu HH, Chang YY, Kuo SC, Chen YT. Influenza vaccination and secondary prevention of cardiovascular disease among Taiwanese elders-A propensity score-matched follow-up study. PLoS One. 2019;14(7):e0219172. DOI: 10.1371/journal.pone.0219172 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Phrommintikul A, Kuanprasert S, Wongcharoen W, Kanjanavanit R, Chaiwarith R, Sukonthasarn A. Influenza vaccination reduces cardiovascular events in patients with acute coronary syndrome. European Heart Journal. 2011;32(14):1730-5. DOI: 10.1093/eurheartj/ehr004 [DOI] [PubMed] [Google Scholar]
- 34.Clar C, Oseni Z, Flowers N, Keshtkar-Jahromi M, Rees K. Influenza vaccines for preventing cardiovascular disease. Cochrane Database of Systematic Reviews. 2015. DOI: 10.1002/14651858.CD005050.pub3 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Udell JA, Zawi R, Bhatt DL, Keshtkar-Jahromi M, Gaughran F, Phrommintikul A, et al. Association Between Influenza Vaccination and Cardiovascular Outcomes in High-Risk Patients: A Meta-analysis. JAMA. 2013;310(16):1711. DOI: 10.1001/jama.2013.279206 [DOI] [PubMed] [Google Scholar]
- 36.Vardeny O, Claggett B, Udell JA, Packer M, Zile M, Rouleau J, et al. Influenza Vaccination in Patients With Chronic Heart Failure: The PARADIGM-HF Trial. JACC Heart Fail. 2016;4(2):152-8. DOI: 10.1016/j.jchf.2015.10.012 [DOI] [PubMed] [Google Scholar]
- 37.Tsivgoulis G, Katsanos AH, Zand R, Ishfaq MF, Malik MT, Karapanayiotides T, et al. The association of adult vaccination with the risk of cerebrovascular ischemia: A systematic review and meta-analysis. J Neurol Sci. 2018;386:12-8. DOI: 10.1016/j.jns.2018.01.007 [DOI] [PubMed] [Google Scholar]
- 38.Kim SY, Chang YJ, Cho HM, Hwang YW, Moon YS. Non-steroidal anti-inflammatory drugs for the common cold. Cochrane Database Syst Rev. 2013(6):CD006362. DOI: 10.1002/14651858.CD006362.pub3 [DOI] [PubMed] [Google Scholar]
- 39.Arfe A, Scotti L, Varas-Lorenzo C, Nicotra F, Zambon A, Kollhorst B, et al. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ. 2016;354:i4857. DOI: 10.1136/bmj.i4857 [DOI] [PubMed] [Google Scholar]
- 40.Wen YC, Hsiao FY, Chan KA, Lin ZF, Shen LJ, Fang CC. Acute Respiratory Infection and Use of Nonsteroidal Anti-Inflammatory Drugs on Risk of Acute Myocardial Infarction: A Nationwide Case-Crossover Study. J Infect Dis. 2017;215(4):503-9. DOI: 10.1093/infdis/jiw603 [DOI] [PubMed] [Google Scholar]
- 41.Lai CK, Beasley R, Crane J, Foliaki S, Shah J, Weiland S, et al. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax. 2009;64(6):476-83. DOI: 10.1136/thx.2008.106609 [DOI] [PubMed] [Google Scholar]
- 42.Silvennoinen H, Peltola V, Vainionpaa R, Ruuskanen O, Heikkinen T. Admission diagnoses of children 0-16 years of age hospitalized with influenza. Eur J Clin Microbiol Infect Dis. 2012;31(3):225-31. DOI: 10.1007/s10096-011-1297-8 [DOI] [PubMed] [Google Scholar]
- 43.Schwarze J, Openshaw P, Jha A, Del Giacco SR, Firinu D, Tsilochristou O, et al. Influenza burden, prevention, and treatment in asthma-A scoping review by the EAACI Influenza in asthma task force. Allergy. 2018;73(6):1151-81. DOI: 10.1111/all.13333 [DOI] [PubMed] [Google Scholar]
- 44.Centers for Disease C, Prevention . Patients hospitalized with 2009 pandemic influenza A (H1N1)-New York City, May 2009. MMWR Morb Mortal Wkly Rep. 2010;58(51):1436-40. [PubMed] [Google Scholar]
- 45.Leckerman KH, Sherman E, Knorr J, Zaoutis TE, Coffin SE. Risk factors for healthcare-associated, laboratory-confirmed influenza in hospitalized pediatric patients: a case-control study. Infect Control Hosp Epidemiol. 2010;31(4):421-4. DOI: 10.1086/651311 [DOI] [PubMed] [Google Scholar]
- 46.Libster R, Coviello S, Cavalieri ML, Morosi A, Alabart N, Alvarez L, et al. Pediatric hospitalizations due to influenza in 2010 in Argentina. N Engl J Med. 2010;363(25):2472-3. DOI: 10.1056/NEJMc1008806 [DOI] [PubMed] [Google Scholar]
- 47.Lee MC, Kim HY, Kong SG, Kim YM, Park SE, Im YT, et al. Clinical Characteristics of Pandemic Influenza A (H1N1) 2009 Pediatric Infection in Busan and Gyeongsangnam-do: One Institution. Tuberc Respir Dis (Seoul). 2012;72(6):493-500. DOI: 10.4046/trd.2012.72.6.493 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Iikura M, Hojo M, Koketsu R, Watanabe S, Sato A, Chino H, et al. The importance of bacterial and viral infections associated with adult asthma exacerbations in clinical practice. PLoS One. 2015;10(4):e0123584. DOI: 10.1371/journal.pone.0123584 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Teichtahl H, Buckmaster N, Pertnikovs E. The incidence of respiratory tract infection in adults requiring hospitalization for asthma. Chest. 1997;112(3):591-6. DOI: 10.1378/chest.112.3.591 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Tan WC, Xiang X, Qiu D, Ng TP, Lam SF, Hegele RG. Epidemiology of respiratory viruses in patients hospitalized with near-fatal asthma, acute exacerbations of asthma, or chronic obstructive pulmonary disease. Am J Med. 2003;115(4):272-7. DOI: 10.1016/s0002-9343(03)00353-x [DOI] [PubMed] [Google Scholar]
- 51.Atmar RL, Guy E, Guntupalli KK, Zimmerman JL, Bandi VD, Baxter BD, et al. Respiratory tract viral infections in inner-city asthmatic adults. Arch Intern Med. 1998;158(22):2453-9. DOI: 10.1001/archinte.158.22.2453 [DOI] [PubMed] [Google Scholar]
- 52.Mallia P, Johnston SL. How viral infections cause exacerbation of airway diseases. Chest. 2006;130(4):1203-10. DOI: 10.1378/chest.130.4.1203 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Gorse GJ, O’Connor T Z, Young SL, Habib MP, Wittes J, Neuzil KM, et al. Impact of a winter respiratory virus season on patients with COPD and association with influenza vaccination. Chest. 2006;130(4):1109-16. DOI: 10.1378/chest.130.4.1109 [DOI] [PubMed] [Google Scholar]
- 54.Wedzicha JA. Role of viruses in exacerbations of chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2004;1(2):115-20. DOI: 10.1513/pats.2306030 [DOI] [PubMed] [Google Scholar]
- 55.Seemungal T, Harper-Owen R, Bhowmik A, Moric I, Sanderson G, Message S, et al. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2001;164(9):1618-23. DOI: 10.1164/ajrccm.164.9.2105011 [DOI] [PubMed] [Google Scholar]
- 56.Rohde G, Wiethege A, Borg I, Kauth M, Bauer TT, Gillissen A, et al. Respiratory viruses in exacerbations of chronic obstructive pulmonary disease requiring hospitalisation: a case-control study. Thorax. 2003;58(1):37-42. DOI: 10.1136/thorax.58.1.37 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Simonsen L, Fukuda K, Schonberger LB, Cox NJ. The impact of influenza epidemics on hospitalizations. J Infect Dis. 2000;181(3):831-7. DOI: 10.1086/315320 [DOI] [PubMed] [Google Scholar]
- 58.World Health Organization (WHO) . Pneumonia Fact Sheet2019. Disponible en: https://www.who.int/en/news-room/fact-sheets/detail/pneumonia.
- 59.Klein EY, Monteforte B, Gupta A, Jiang W, May L, Hsieh YH, et al. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. Influenza Other Respir Viruses. 2016;10(5):394-403. DOI: 10.1111/irv.12398 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Martin-Loeches I, M JS, Vincent JL, Alvarez-Lerma F, Bos LD, Sole-Violan J, et al. Increased incidence of co-infection in critically ill patients with influenza. Intensive Care Med. 2017;43(1):48-58. DOI: 10.1007/s00134-016-4578-y [DOI] [PubMed] [Google Scholar]
- 61.Morens DM, Taubenberger JK, Fauci AS. Predominant role of bacterial pneumonia as a cause of death in pandemic influenza: implications for pandemic influenza preparedness. J Infect Dis. 2008;198(7):962-70. DOI: 10.1086/591708 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Gupta RK, George R, Nguyen-Van-Tam JS. Bacterial pneumonia and pandemic influenza planning. Emerg Infect Dis. 2008;14(8):1187-92. DOI: 10.3201/eid1408.070751 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Khater F, Moorman JP. Complications of influenza. South Med J. 2003;96(8):740-3. DOI: 10.1097/01.SMJ.0000084984.13843.C0 [DOI] [PubMed] [Google Scholar]
- 64.Oliveira EC, Marik PE, Colice G. Influenza pneumonia: a descriptive study. Chest. 2001;119(6):1717-23. DOI: 10.1378/chest.119.6.1717 [DOI] [PubMed] [Google Scholar]
- 65.Talbot TR, Poehling KA, Hartert TV, Arbogast PG, Halasa NB, Edwards KM, et al. Seasonality of invasive pneumococcal disease: temporal relation to documented influenza and respiratory syncytial viral circulation. Am J Med. 2005;118(3):285-91. DOI: 10.1016/j.amjmed.2004.09.016 [DOI] [PubMed] [Google Scholar]
- 66.Patel J, Faden H, Sharma S, Ogra PL. Effect of respiratory syncytial virus on adherence, colonization and immunity of non-typable Haemophilus influenzae: implications for otitis media. Int J Pediatr Otorhinolaryngol. 1992;23(1):15-23. DOI: 10.1016/0165-5876(92)90075-z [DOI] [PubMed] [Google Scholar]
- 67.Musher DM, Abers MS, Corrales-Medina VF. Acute Infection and Myocardial Infarction. N Engl J Med. 2019;380(2):171-6. DOI: 10.1056/NEJMra1808137 [DOI] [PubMed] [Google Scholar]
- 68.Udell JA, Farkouh ME, Solomon SD, Vardeny O. Does influenza vaccination influence cardiovascular complications? Expert Review of Cardiovascular Therapy. 2015;13(6):593-6. DOI: 10.1586/14779072.2015.1044439 [DOI] [PubMed] [Google Scholar]
- 69.Lee KR, Bae JH, Hwang IC, Kim KK, Suh HS, Ko KD. Effect of Influenza Vaccination on Risk of Stroke: A Systematic Review and Meta-Analysis. Neuroepidemiology. 2017;48(3-4):103-10. DOI: 10.1159/000478017 [DOI] [PubMed] [Google Scholar]
- 70.Pothineni NVK, Subramany S, Kuriakose K, Shirazi LF, Romeo F, Shah PK, et al. Infections, atherosclerosis, and coronary heart disease. Eur Heart J. 2017;38(43):3195-201. DOI: 10.1093/eurheartj/ehx362 [DOI] [PubMed] [Google Scholar]
- 71.Haidari M, Wyde PR, Litovsky S, Vela D, Ali M, Casscells SW, et al. Influenza virus directly infects, inflames, and resides in the arteries of atherosclerotic and normal mice. Atherosclerosis. 2010;208(1):90-6. DOI: 10.1016/j.atherosclerosis.2009.07.028 [DOI] [PubMed] [Google Scholar]
- 72.Park I-W, Wang J-F, Groopman JE. HIV-1 Tat promotes monocyte chemoattractant protein-1 secretion followed by transmigration of monocytes. Blood. 2001;97(2):352-8. DOI: 10.1182/blood.V97.2.352 [DOI] [PubMed] [Google Scholar]
- 73.Li D, Mehta JL. Antisense to LOX-1 Inhibits Oxidized LDL–Mediated Upregulation of Monocyte Chemoattractant Protein-1 and Monocyte Adhesion to Human Coronary Artery Endothelial Cells. Circulation. 2000;101(25):2889-95. DOI: 10.1161/01.CIR.101.25.2889 [DOI] [PubMed] [Google Scholar]
- 74.Vardeny O, Solomon SD. Influenza vaccination: a one-shot deal to reduce cardiovascular events. Eur Heart J. 2017;38(5):334-7. DOI: 10.1093/eurheartj/ehw560 [DOI] [PubMed] [Google Scholar]
- 75.Madjid M, Naghavi M, Litovsky S, Casscells SW. Influenza and cardiovascular disease: a new opportunity for prevention and the need for further studies. Circulation. 2003;108(22):2730-6. DOI: 10.1161/01.CIR.0000102380.47012.92 [DOI] [PubMed] [Google Scholar]
- 76.Aykac K, Ozsurekci Y, Kahyaoglu P, Basaranoglu ST, Ertugrul I, Alp A, et al. Myocarditis associated with influenza infection in five children. J Infect Public Health. 2018;11(5):698-701. DOI: 10.1016/j.jiph.2018.05.003 [DOI] [PubMed] [Google Scholar]
- 77.Hekimian G, Jovanovic T, Brechot N, Lebreton G, Leprince P, Trouillet JL, et al. When the heart gets the flu: Fulminant influenza B myocarditis: A case-series report and review of the literature. J Crit Care. 2018;47:61-4. DOI: 10.1016/j.jcrc.2018.06.001 [DOI] [PubMed] [Google Scholar]
- 78.Corrales-Medina VF, Alvarez KN, Weissfeld LA, Angus DC, Chirinos JA, Chang CC, et al. Association between hospitalization for pneumonia and subsequent risk of cardiovascular disease. JAMA. 2015;313(3):264-74. DOI: 10.1001/jama.2014.18229 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Gern JE. Viral Respiratory Infection and the Link to Asthma. The Pediatric Infectious Disease Journal. 2008;27(Supplement):S97-S103. DOI: 10.1097/INF.0b013e318168b718 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Guilbert TW, Denlinger LC. Role of infection in the development and exacerbation of asthma. Expert Review of Respiratory Medicine. 2010;4(1):71-83. DOI: 10.1586/ers.09.60 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Ravanetti L, Dijkhuis A, Dekker T, Sabogal Pineros YS, Ravi A, Dierdorp BS, et al. IL-33 drives influenza-induced asthma exacerbations by halting innate and adaptive antiviral immunity. J Allergy Clin Immunol. 2019;143(4):1355-70 e16. DOI: 10.1016/j.jaci.2018.08.051 [DOI] [PubMed] [Google Scholar]
- 82.Linden D, Guo-Parke H, Coyle PV, Fairley D, McAuley DF, Taggart CC, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD. Eur Respir Rev. 2019;28(151). DOI: 10.1183/16000617.0063-2018 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Mallia P, Message SD, Gielen V, Contoli M, Gray K, Kebadze T, et al. Experimental rhinovirus infection as a human model of chronic obstructive pulmonary disease exacerbation. Am J Respir Crit Care Med. 2011;183(6):734-42. DOI: 10.1164/rccm.201006-0833OC [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Plotkowski MC, Puchelle E, Beck G, Jacquot J, Hannoun C. Adherence of type I Streptococcus pneumoniae to tracheal epithelium of mice infected with influenza A/PR8 virus. Am Rev Respir Dis. 1986;134(5):1040-4. DOI: 10.1164/arrd.1986.134.5.1040 [DOI] [PubMed] [Google Scholar]
- 85.Morris DE, Cleary DW, Clarke SC. Secondary Bacterial Infections Associated with Influenza Pandemics. Front Microbiol. 2017;8:1041. DOI: 10.3389/fmicb.2017.01041 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.World Health Organization (WHO) . Fact Sheet Cardiovascular diseases (CVDs) [Disponible en: https://www.who.int/en/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds).
- 87.Instituto Nacional de Estadística (INE) . Defunciones según la causa de muerte 2018. Defunciones por causas (lista detallada) sexo y edad. Disponible en: https://www.ine.es/jaxiT3/Tabla.htm?t=7947&L=0.
- 88.Corduras Martinez A DLSJ. La sanidad española en cifras 2018-2019.
- 89.Adeloye D, Chua S, Lee C, Basquill C, Papana A, Theodoratou E, et al. Global and regional estimates of COPD prevalence: Systematic review and meta-analysis. J Glob Health. 2015;5(2):20415. DOI: 10.7189/jogh.05-020415 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.GBD 2013 Mortality and Causes of Death Collaborators . Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;385(9963):117-71. DOI: 10.1016/S0140-6736(14)61682-2 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Lopez AD, Shibuya K, Rao C, Mathers CD, Hansell AL, Held LS, et al. Chronic obstructive pulmonary disease: current burden and future projections. Eur Respir J. 2006;27(2):397-412. DOI: 10.1183/09031936.06.00025805 [DOI] [PubMed] [Google Scholar]
- 92.World Health Organization (WHO) . Projections of mortality and causes of death, 2016 to 2060 [Disponible en: https://www.who.int/healthinfo/global_burden_disease/projections/en/.
- 93.Sociedad Española de Neumología y Cirugía Torácica (SEPAR) . Las cifras de la EPOC siguen creciendo en España2018. Disponible en: https://www.separ.es/sites/default/files/SEPAR_EPOC_Espa%C3%B1a.pdf.
- 94.Instituto Nacional de Estadística . Altas hospitalarias según el sexo, el motivo del alta y el diagnóstico principal 2017. [Disponible en: https://www.ine.es/jaxi/Datos.htm?path=/t15/p414/a2017/l0/&file=01006.px.
- 95.Lopez-Gobernado M, Perez-Rubio A, Lopez-Garcia E, Mayo-Iscar A, Eiros JM. [Burden of hospitalization for pneumonia in a Spanish tertiary hospital. Period 2009-2014]. Rev Med Inst Mex Seguro Soc. 2017;55(2):170-5. [PubMed] [Google Scholar]
- 96.Rivero-Calle I, Pardo-Seco J, Aldaz P, Vargas DA, Mascaros E, Redondo E, et al. Incidence and risk factor prevalence of community-acquired pneumonia in adults in primary care in Spain (NEUMOES-RISK project). BMC Infect Dis. 2016;16(1):645. DOI: 10.1186/s12879-016-1974-4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Vila-Corcoles A, Ochoa-Gondar O, Rodriguez-Blanco T, Raga-Luria X, Gomez-Bertomeu F, Group ES. Epidemiology of community-acquired pneumonia in older adults: a population-based study. Respir Med. 2009;103(2):309-16. DOI: 10.1016/j.rmed.2008.08.006 [DOI] [PubMed] [Google Scholar]
- 98.Nichol KL, Nordin JD, Nelson DB, Mullooly JP, Hak E. Effectiveness of influenza vaccine in the community-dwelling elderly. N Engl J Med. 2007;357(14):1373-81. DOI: 10.1056/NEJMoa070844 [DOI] [PubMed] [Google Scholar]
- 99.Mulpuru S, Li L, Ye L, Hatchette T, Andrew MK, Ambrose A, et al. Effectiveness of Influenza Vaccination on Hospitalizations and Risk Factors for Severe Outcomes in Hospitalized Patients With COPD. Chest. 2019;155(1):69-78. DOI: 10.1016/j.chest.2018.10.044 [DOI] [PubMed] [Google Scholar]
- 100.Song JY, Lee JS, Wie SH, Kim HY, Lee J, Seo YB, et al. Prospective cohort study on the effectiveness of influenza and pneumococcal vaccines in preventing pneumonia development and hospitalization. Clin Vaccine Immunol. 2015;22(2):229-34. DOI: 10.1128/CVI.00673-14 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Siscovick DS, Raghunathan TE, Lin D, Weinmann S, Arbogast P, Lemaitre RN, et al. Influenza vaccination and the risk of primary cardiac arrest. Am J Epidemiol. 2000;152(7):674-7. DOI: 10.1093/aje/152.7.674 [DOI] [PubMed] [Google Scholar]
- 102.Gurfinkel EP, de la Fuente RL, Mendiz O, Mautner B. Influenza vaccine pilot study in acute coronary syndromes and planned percutaneous coronary interventions: the FLU Vaccination Acute Coronary Syndromes (FLUVACS) Study. Circulation. 2002;105(18):2143-7. DOI: 10.1161/01.cir.0000016182.85461.f4 [DOI] [PubMed] [Google Scholar]
- 103.MacIntyre CR, Mahimbo A, Moa AM, Barnes M. Influenza vaccine as a coronary intervention for prevention of myocardial infarction. Heart. 2016;102(24):1953-6. DOI: 10.1136/heartjnl-2016-309983 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Ciszewski A. Cardioprotective effect of influenza and pneumococcal vaccination in patients with cardiovascular diseases. Vaccine. 2018;36(2):202-6. DOI: 10.1016/j.vaccine.2017.11.078 [DOI] [PubMed] [Google Scholar]
- 105.Veljkovic V, Glisic S, Veljkovic N, Bojic T, Dietrich U, Perovic VR, et al. Influenza vaccine as prevention for cardiovascular diseases: Possible molecular mechanism. Vaccine. 2014;32(48):6569-75. DOI: 10.1016/j.vaccine.2014.07.007 [DOI] [PubMed] [Google Scholar]
- 106.Peasah SK, Meltzer MI, Vu M, Moulia DL, Bridges CB. Cost-effectiveness of increased influenza vaccination uptake against re-admissions of major adverse cardiac events in the US. PLoS One. 2019;14(4):e0213499. DOI: 10.1371/journal.pone.0213499 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Suh J, Kim B, Yang Y, Suh D-C, Kim E. Cost effectiveness of influenza vaccination in patients with acute coronary syndrome in Korea. Vaccine. 2017;35(21):2811-7. DOI: 10.1016/j.vaccine.2017.04.016 [DOI] [PubMed] [Google Scholar]
- 108.Raj SM, Chughtai AA, Sharma A, Tan TC, MacIntyre CR. Cost-benefit analysis of a national influenza vaccination program in preventing hospitalisation costs in Australian adults aged 50-64years old. Vaccine. 2019;37(40):5979-85. DOI: 10.1016/j.vaccine.2019.08.028 [DOI] [PubMed] [Google Scholar]
- 109.Torner N, Navas E, Soldevila N, Toledo D, Navarro G, Morillo A, et al. Costs associated with influenza-related hospitalization in the elderly. Hum Vaccin Immunother. 2017;13(2):412-6. DOI: 10.1080/21645515.2017.1264829 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 110.Gravenstein S, Davidson HE, Taljaard M, Ogarek J, Gozalo P, Han L, et al. Comparative effectiveness of high-dose versus standard-dose influenza vaccination on numbers of US nursing home residents admitted to hospital: a cluster-randomised trial. Lancet Respir Med. 2017;5(9):738-46. DOI: 10.1016/S2213-2600(17)30235-7 [DOI] [PubMed] [Google Scholar]
- 111.Corrales-Medina VF, Musher DM, Shachkina S, Chirinos JA. Acute pneumonia and the cardiovascular system. Lancet. 2013;381(9865):496-505. DOI: 10.1016/S0140-6736(12)61266-5 [DOI] [PubMed] [Google Scholar]
- 112.van der Sluijs KF, van der Poll T, Lutter R, Juffermans NP, Schultz MJ. Bench-to-bedside review: bacterial pneumonia with influenza-pathogenesis and clinical implications. Crit Care. 2010;14(2):219. DOI: 10.1186/cc8893 [DOI] [PMC free article] [PubMed] [Google Scholar]